医第五章立体化学PPT课件
合集下载
医学有机化学--第五章立体异构

Br Cl
Cl
CC
Cl
H
Br
(E)-1,2-二氯-1-溴乙烯 顺-1,2-二氯-1-溴乙烯
2020/3/2
9
H C
H3C
CH3 C CH3 CH
CH3
H3C C
H
CH3 C CH3 CH
CH3
(E)-3, 4-二甲基-2-戊烯 顺-3, 4-二甲基-2-戊烯
(Z)-3, 4-二甲基-2-戊烯 反-3, 4-二甲基-2-戊烯
1、确定C*abcd分子,优先顺序a>b>c>d;
2、若最小基d在垂直方向,ab c顺时针时为R 构型;
反之,为S构型。
3、若最小基d在水平方向,ab c顺时针时为 S构型;
反之,为R构型。
a
Rc
b
a dc
d
b
2020/3/2
S
a
a
bc
cd
32
d
b
乳酸
OH COOH CH3 H
COOH
(一)命名法法则: 针对 C*abcd分子
1、根据次序规则,排列成序:a>b>c>d; 2、把最小的d基团放在最远,其它三个朝向自己;
3、观察abc顺序,若呈顺时针为R-构型;呈逆时针
为S-构型。
a
a
2020/3/2
d
b
c
d
c b
a b c顺时针 a b c逆时针
R-构型
S-构型
31
(二)由费歇尔投影式确定R/S构型的方法
CH3
2020/3/2
6
③当取代基为不饱和基团时,则把双键、三键原子 看成是它以两个或三个单键与相同的原子相连。
有机化学课件立体化学ppt课件

量子化学计算
基于量子力学原理计算分子的电子结构和性质,可深入揭示有机 物的立体化学本质和反应机理。
人工智能与机器学习
结合大数据和机器学习算法,可加速新有机物的设计和合成,为 立体化学研究提供新的思路和方法。
06
总结与展望:立体化学发展趋势和挑 战
当前存在问题和挑战
01
立体化学合成方法有限
目前立体化学合成方法仍然相对有限,对于复杂分子的合成仍面临较大
05
立体化学分析方法与技术进展
传统分析方法回顾(如:极谱法、色谱法等)
极谱法
利用物质在电解过程中的电极电位与浓度之间的关系进行分析,主要用于无机物和有机物的定性和定量分析。
色谱法
基于物质在固定相和流动相之间的分配平衡,通过流动相的洗脱将不同物质分离,常用于复杂样品的分离和纯化。
现代波谱技术在立体化学中应用(如
立体选择性合成是获得具有特定立体构型药物分子的关键步骤,对于提高药物疗效和降低副 作用具有重要意义。
面临的挑战
立体选择性合成面临着反应条件苛刻、合成步骤繁琐、产物纯度难以控制等挑战。
机遇与发展
随着有机合成化学、计算化学等学科的不断发展,立体选择性合成的方法和技术也在不断改 进和完善,为药物研发提供了更多的机遇和可能性。例如,利用不对称催化、新型手性配体 等策略,可以实现高效、高选择性的立体选择性合成。
对称性与手性判断
对称性判断
通过观察分子是否具有对称轴、对称 面等对称因素来判断。
手性判断
通过判断分子是否具有手性碳原子或其 他不对称因素来判断。具有手性碳原子 的分子一定是手性分子,但手性分子不 一定具有手性碳原子。
立体化学原理ห้องสมุดไป่ตู้应用
立体化学原理
基于量子力学原理计算分子的电子结构和性质,可深入揭示有机 物的立体化学本质和反应机理。
人工智能与机器学习
结合大数据和机器学习算法,可加速新有机物的设计和合成,为 立体化学研究提供新的思路和方法。
06
总结与展望:立体化学发展趋势和挑 战
当前存在问题和挑战
01
立体化学合成方法有限
目前立体化学合成方法仍然相对有限,对于复杂分子的合成仍面临较大
05
立体化学分析方法与技术进展
传统分析方法回顾(如:极谱法、色谱法等)
极谱法
利用物质在电解过程中的电极电位与浓度之间的关系进行分析,主要用于无机物和有机物的定性和定量分析。
色谱法
基于物质在固定相和流动相之间的分配平衡,通过流动相的洗脱将不同物质分离,常用于复杂样品的分离和纯化。
现代波谱技术在立体化学中应用(如
立体选择性合成是获得具有特定立体构型药物分子的关键步骤,对于提高药物疗效和降低副 作用具有重要意义。
面临的挑战
立体选择性合成面临着反应条件苛刻、合成步骤繁琐、产物纯度难以控制等挑战。
机遇与发展
随着有机合成化学、计算化学等学科的不断发展,立体选择性合成的方法和技术也在不断改 进和完善,为药物研发提供了更多的机遇和可能性。例如,利用不对称催化、新型手性配体 等策略,可以实现高效、高选择性的立体选择性合成。
对称性与手性判断
对称性判断
通过观察分子是否具有对称轴、对称 面等对称因素来判断。
手性判断
通过判断分子是否具有手性碳原子或其 他不对称因素来判断。具有手性碳原子 的分子一定是手性分子,但手性分子不 一定具有手性碳原子。
立体化学原理ห้องสมุดไป่ตู้应用
立体化学原理
立体化学基础-药本课件

Cl 观察
C CH3
Cl CH2OH CH3 为逆时针方向
CH2OH
S-型
R/S标记法也可直接应用于Fischer投影式:
CO2H
H
OH 1#
3# CH3 R-(-)-乳酸
CH2Cl 2#
HOCH2
Cl
3# H 1#
S-2,3-二氯丙醇
CO2H
HO
H
CH3 S-(+)-乳酸
H
HOCH2
Cl
CH2Cl
D/L 和 R/S 两种标记方法,都不能通过其标记的构型来 判断旋光方向。因为旋光方向是化合物的固有性质。而对 化合物的构型标记只是人为的规定。
含有两个手性碳原子的化合物
(一) 含两个不同手性碳原子的化合物
2-羟基-3-氯丁二酸总共有四种旋光异构体:
COOH HO H Cl H
COOH
COOH H OH H Cl
D、L与 “+、-” 没有必然的联系
COOH H OH
CH2OH D£ ¸Ê ÓÍ Ëá
COOH H OH
CH3 D£ Èé Ëá
CHO H OH
CH2OH
D-(+)-甘油醛
COOH H2N H
CH3 L£ ± û ° ±Ëá
COOH H2N H
CH2OH L£ Ë¿ ° ±Ëá
-
CHO
HO H
(IV ) (I)与 (III)或(IV)、 (2S,3R()II)与(III)或
2R,3R (IV) 、 (III)与(I) 或(II) 、(IV)与(I) 或(II) 分别构成非 对映体;
对含有n个*C的化合物:
光学异构体数目=2n
立体化学 第5章 环烷烃
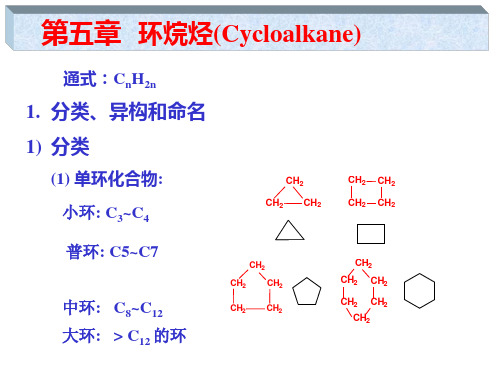
1,2,4-三甲基环己烷
C. 必要时须注明立体构型;
D. 复杂化合物也可将环的部分当作取代基。
顺-1,2-二甲基环丙烷 反-1,3-二甲基环丁烷
4-环戊基庚烷
(2) 多环化合物的命名:
(命名较为复杂, 以二环化合物为例). A. 参加成环的总碳原子数作为母体烃; 如有8个碳原子,则称为辛烷 B. 简单桥环可用“二环”、“三环”等作词头; C. 二环“连接”处的碳原子为桥头碳原子; D. 从桥头碳原子处,由大环开始编号;将各“桥”所含的碳原子 数写入方括号中(注意:桥头C原子都不可计入)。
2) 环戊烷的构象
环戊烷的结构是以拆叠的形式存在,四个C原子基本在一 平面上,另一个C则在平面之外,这种构象称为信封式构象。 环戊烷由于以“信封式”构象存在,使分子张力较小,化学性 质较稳定。
3) 环己烷的构象及构象分析
i) 椅式和船式构象
椅式
船式
船式构象相对能量较高, 不稳定,通过C-C键扭曲, 使其成为扭曲式(或称为扭 船型)。这种构象相对于船 式能量低。
角张力---由于键角偏离正常键角 而产生的张力。
环丙烷的三个C在同一平而上,相邻两个C上的C-H键都是重叠式构象, 相互拥挤,产生排斥,也具有较高的能量。
扭转张力---由于重叠式构象而产生的张力。
4. 环烷烃的构象和构象分析
1) 环丁烷的构象
环丁烷的四个C不在同一平面上,形如蝴蝶。即通过C-C键的扭转而以 一个拆叠的碳环存在。 环丁烷的三个C原子分布在同一平面,另一个C取于平面之外。 环丁烷的这种存在形式可使环的张力降低,但仍然是一个不稳定分子。
(1)分子中有两个平行的平面,C1、C3、C5和C2、C4、C6;
(2)12个氢原子分成两类:一类与分子对称轴平行,即垂直于环平面,称为
第五章 立体化学

四、判断对映体的方法
有三种方法可以用来判断一个分子是否 存在对映体: 1.建造一个分子和它的镜像的模型,如果 两者不能重合,就存在对映体。 2. 如果分子有对称面,那么它和其镜像 就能重合,就不存在对映体。 3.如果一个分子有一个手性碳原子,它就 具有对映异构现象,有一对对映体。
第二节 费歇尔(Fischer)投影式
D-(-)-甘油酸
D-(-)-乳酸
D.L命名法的使用有一定的局限性,它只适用与甘油醛结构 类似的化合物.目前,仍用于糖类和氨基酸的构型命名
二、 R.S构型命名法
R/S 构型标记法分为两步:
(1) 按次序规则确定与手性碳相连的四个原子 或基团的优先次序(或称为“大小” 次序)
3
CH3 C H4 Br1
对称面
内消旋酒石酸分子
问题:内消旋体是否显旋光性?为什么? 答案:不显旋光性。因为内消旋体有一对 称面,互为对称的两部分对偏振光的影响 相互抵消,使整个分子不表现旋光性。
第六节 构型命名
一、D.L命名法 规则:以甘油醛为标准,Fischer投影式中C* 上羟基处于右侧的为D-构型;反之为L-构型
CH3 H C6H5
S构型
CH3
Br
HO H
S构型
C6H5
COOH HO H
R构型
COOH H3C Cl C6H5
R构型
CH2OH
问题:判断下列手性碳的R、S构型。
R
HO COOH C H
R
H H
CO2H OH OH CH3
CH3
R
R-乳酸
2R,3R-2,3-二羟基丁酸
实物与镜像不重合
不含 对称中心 对称面
CO2H H HO C C OH H HO H
有机化学立体化学PPT课件

官能团对分子极性和溶解性的影响
03
官能团的电性和极性会影响分子的极性和溶解性,从而影响分
子在溶液中的行为。
官能团间相互作用和转化规律
官能团间的相互作用
不同官能团之间可能存在相互作用,如共轭效应、诱导效应 等,这些相互作用会影响分子的性质和反应。
官能团的转化规律
在一定条件下,官能团可以发生转化,如醇氧化成醛、醛还 原成醇等,这些转化规律是有机化学中的重要内容。
不对称烷基化反应
通过手性辅剂或催化剂的作用,实现烷基化反应的不对称诱导, 生成具有手性中心的产物。
不对称氧化反应
利用手性氧化剂或催化剂对底物进行不对称氧化,生成具有手性 中心的产物。
立体选择性反应在药物合成中应用
手性药物合成
手性药物具有特定的生理活性和药效,其合成过程中常涉及立体选择性反应。例如,通过 不对称催化氢化合成治疗心血管疾病的L-多巴等手性药物。
异构体间相互转化机理
包括化学键的断裂和形成、原子或基团的迁移等过程。
异构体间相互转化实例
如顺反异构体之间可以通过光照或加热等条件进行相互转 化;对映异构体之间可以通过手性试剂进行拆分或外消旋 化等过程进行相互转化。
05 立体选择性反应 原理及应用
立体选择性反应概念及分类
立体选择性反应定义
指在一定条件下,反应物分子中某一特定立体构型的原子或基团优先发生反应,生成具有特定立体构型的产物的 化学反应。
碳-碳单键旋转自由度受限情况
碳-碳单键 旋转自由度受限,导致有机分子具有特定构象。
环状化合物中碳原子构型判断
环状化合物中碳原子构型判断方法
通过比较环上相邻碳原子的相对构型,可以确定整个环状化合物的立体构型。
环状化合物中碳原子构型与性质关系
《立体化学教学》课件

手性来源
手性主要来源于碳原子的四个单键,使得碳 原子在形成有机分子时,可能形成两种不同 的空间排列方式,从而产生手性。
手性判断
判断一个分子是否具有手性,可以通过查看 其是否具有手性碳原子,即连接四个不同基 团的碳原子。
对映体
01
02
03
对映体定义
对映体是指通过镜面对称 的方式无法重合的两个立 体异构体。
02
它涉及到有机化学、无机化学、 物理化学等多个学科领域,是化 学学科的一个重要分支。
立体化学的重要性
立体化学对于理解分子性质、化学反 应机制以及药物设计等方面具有重要 意义。
通过了解分子的三维结构,可以更好 地理解其物理性质和化学性质,预测 其反应行为,为新材料的开发和药物 的设计提供理论支持。
动态立体化学的应用
动态立体化学在药物设计和合成、催 化剂设计等领域有广泛应用,了解分 子构型的变化有助于优化化学反应过 程和开发新的化学技术。
04
立体化学的教学策略与技巧
利用模型进行立体展示
总结词
通过实物模型展示分子结构,帮助学生理解立体化学的概念。
详细描述
利用分子模型展示分子的三维结构,让学生直观地观察分子中原子在空间中的排列方式。通过对比不同结构的分 子模型,解释立体化学中的概念,如顺反异构、手性等。
旋光性测定的教学案例
总结词
演示旋光性测定的实验操作和数据分析
详细描述
介绍旋光性测定的基本原理和实验操作,包 括旋光仪的构造和工作原理、样品的制备和 测量步骤等。通过具体的旋光性测定实验, 演示实验操作过程和数据分析方法,包括旋 光度的测量、图谱解析和误差分析等。同时 ,强调旋光性测定在化学、生物和医学等领 域的重要应用。
第五章立体化学基础:手性分子

(二)、比旋光度 )、比旋光度
规定用一分米长的旋光管, 规定用一分米长的旋光管,待测物质 的浓度为1g.ml-1时所测得的旋光度,称 时所测得的旋光度, 的浓度为 为比旋光度, α 表示。 为比旋光度,用[α]Dt表示。
α l:旋光管的长度(分米) 旋光管的长度(分米) 旋光管的长度 C:溶液的浓度(g.ml-1) 溶液的浓度( 溶液的浓度 l×C × ɑ:实验观察旋光值(度数 实验观察旋光值 度数) t: 测定时温度(℃) 测定时温度( 公式:[α]Dt== 公式: α
有一个手性碳原子时,则有一对( 有一个手性碳原子时,则有一对(二个 立体异构体)对映体; 立体异构体)对映体;有二个手性碳原 子时,则有二对(四个立体异构体) 子时,则有二对(四个立体异构体)对映 有三个手性碳原子时,则有四对( 体;有三个手性碳原子时,则有四对(八 个立体异构体) 个立体异构体)对映体 …… 可见:含有 个手性碳原子时,有2n个 可见 含有n个手性碳原子时 有 含有 个手性碳原子时 立体异构体. 立体异构体
存在对称面就不存在对映体 ⑵、寻找对称面:存在对称面就不存在对映体 寻找对称面 存在对称面就不存在
⑶、寻找手性碳原子:有一个手性碳原 寻找手性碳原子: 就具有一对对映体。 子,就具有一对对映体。有二个或 二个以上手性碳原子时, 二个以上手性碳原子时,有例外情 。(有对称面则没有对映体 有对称面则没有对映体)。 况。(有对称面则没有对映体)。
CHO OH CH2OH HO
CHO H CH2OH
D-(+)-甘油醛 ( ) 甘油醛
L-(-)-甘油醛 ( ) 甘油醛
(+);(-)只表示旋光方向 和构型没有一定 ) ( )只表示旋光方向,和构型没有一定 的关系。 的关系。
第五章:立体化学

O H C H2 C H2 C H2 C H
3
【TM】 】
O H O H C H2 C H2 C H2 C H
3
O H
O
3
【逆推】 逆推】
C H2 C H2 C H2 C H
3
C H2 C H2 C H2 C H
3
C H2 C H2 C H2 C H
O H O M g B r 1 . + 2 . H3 O H3 P O
4
1 . B H
2 2 6
_ 2 . H O2 / H O
T M 1 1 0
【合成】 合成】
5. 烯烃与卤素加成 烯烃与卤素加成 烯烃与卤素加成是反式加成 烯烃与卤素加成是反式加成
B r B r
2
B r
比较: 比较: 6. 卤代烷的E2消除 卤代烷的 消除 卤代烷的E2消除是反式消除 卤代烷的 消除是反式消除 查依采夫规则 消除是
2
C O
2
E t
E t C O
2
E t
O O
+
C O E t
2
【逆推】 逆推】
H
C O
2
E t H H C O
2
F G A
E t O C O H
2
C O
2
E t
O
+
C O
2
E t E t
H H C O 2 E t C O 2 E t O
H / P d +
O C O 2 E t H C O 2 E t H
有机合成中立体化学 立体化学的控制 第五章 有机合成中立体化学的控制
1. 炔烃的还原 炔烃的催化氢化是顺式加氢,而在液氨中用金属钠还原则为反式加氢 炔烃的催化氢化是顺式加氢,而在液氨中用金属钠还原则为反式加氢 顺式加氢 液氨中用金属钠 OH
《有机化学》第五章 立体化学基础 - 副本
表示含两个或两个以上手性碳原子的化合物时, Fischer投影式显示的立体结构全是重叠式构象!
COOH H C OH
COOH H C OH
HO C H
HO C H
COOH
COOH
Pers酒pec石tiv酸e projection Fischer projection
Tartaric acid (carboxyl group at top)
CHO
H OH [O]
CH2OH D-(+)-甘油醛
COOH
H OH [H]
CH2OH
D-(-)-甘油酸
COOH H OH
CH3 D-(-)-乳酸
1951年,J.M.Bijvoet 用X-衍射技术测定了(+)-酒石酸铷钾 盐的绝对构型之后,确定了原来人为规定的D-(+)-甘油醛的构型 (相对构型)刚巧就是它的真实构型(绝对构型)。
第五章 立体化学基础 第四节 构型标记法 (R/S构型标记法)
R/S 构型命名法举例:
CH3
H
OH
CH2CH3
S-2-丁醇
CHO HO H
H OH CH2OH
CH3
H
H
OH 转动使H
HO
远离视线
CH3
C2H5
C2H5
CHO
S 构型
HO SC H RC
H
2S,3R-2,3-二羟基丁醛
OH
CH2OH
人民卫生电子音像出版社
第五章 立体化学基础:手性分子
碳架异构
同分异构
构造异构
(分子中原子间的排 列顺序、结合方式)
位置异构 官能团异构
立体异构
顺反异构
对映异构 构型异构
COOH H C OH
COOH H C OH
HO C H
HO C H
COOH
COOH
Pers酒pec石tiv酸e projection Fischer projection
Tartaric acid (carboxyl group at top)
CHO
H OH [O]
CH2OH D-(+)-甘油醛
COOH
H OH [H]
CH2OH
D-(-)-甘油酸
COOH H OH
CH3 D-(-)-乳酸
1951年,J.M.Bijvoet 用X-衍射技术测定了(+)-酒石酸铷钾 盐的绝对构型之后,确定了原来人为规定的D-(+)-甘油醛的构型 (相对构型)刚巧就是它的真实构型(绝对构型)。
第五章 立体化学基础 第四节 构型标记法 (R/S构型标记法)
R/S 构型命名法举例:
CH3
H
OH
CH2CH3
S-2-丁醇
CHO HO H
H OH CH2OH
CH3
H
H
OH 转动使H
HO
远离视线
CH3
C2H5
C2H5
CHO
S 构型
HO SC H RC
H
2S,3R-2,3-二羟基丁醛
OH
CH2OH
人民卫生电子音像出版社
第五章 立体化学基础:手性分子
碳架异构
同分异构
构造异构
(分子中原子间的排 列顺序、结合方式)
位置异构 官能团异构
立体异构
顺反异构
对映异构 构型异构
《立体化学》课件

2023 WORK SUMMARY
《立体化学》课件
REPORTING
目录
• 立体化学简介 • 立体化学基本概念 • 立体化学中的反应 • 立体选择性反应 • 立体化学的应用 • 立体化学的未来发展与挑战
PART 01
立体化学简介
定义与特点
定义
立体化学是研究分子在三维空间中结 构的科学,主要关注分子的几何构型 、构象和旋转轴对称性等。
方式的分子。
顺反异构体的性质
顺反异构体在化学性质上存在差异 ,但在物理性质方面相似。
顺反异构体的合成
顺反异构体的合成是立体化学研究 的重要内容之一,通常采用烯烃的 加成反应进行合成。
PART 03
立体化学中的反应
亲核反应
总结词
亲核反应是试剂向反应物的负电性中心进攻 的反应,通常是由具有孤对电子的中性分子 或负离子进攻正电性较弱的碳原子。
对映异构体
对映异构体的定义
对映异构体是指具有相同 化学组成但旋光方向不同 的分子。
对映异构体的性质
对映异构体在物理性质上 几乎相同,但在旋光性和 生物活性方面存在差异。
对映异构体的分离
对映异构体的分离是立体 化学研究的重要内容之一 ,通常采用化学或物理方 法进行分离。
非对映异构体
非对映异构体的定义
生物学中的立体化学对 于理解生物大分子的结 构和功能至关重要。例 如,蛋白质的结构和折 叠方式决定了其生物活 性,而核酸的结构则与 其遗传信息的传递和表 达密切相关。
生物学中的立体化学有 助于深入了解生物大分 子的相互作用和调控机 制。
通过研究生物大分子的 立体结构和相互作用, 可以揭示其复杂的调控 机制,为疾病诊断和治 疗提供新的思路和方法 。
《立体化学》课件
REPORTING
目录
• 立体化学简介 • 立体化学基本概念 • 立体化学中的反应 • 立体选择性反应 • 立体化学的应用 • 立体化学的未来发展与挑战
PART 01
立体化学简介
定义与特点
定义
立体化学是研究分子在三维空间中结 构的科学,主要关注分子的几何构型 、构象和旋转轴对称性等。
方式的分子。
顺反异构体的性质
顺反异构体在化学性质上存在差异 ,但在物理性质方面相似。
顺反异构体的合成
顺反异构体的合成是立体化学研究 的重要内容之一,通常采用烯烃的 加成反应进行合成。
PART 03
立体化学中的反应
亲核反应
总结词
亲核反应是试剂向反应物的负电性中心进攻 的反应,通常是由具有孤对电子的中性分子 或负离子进攻正电性较弱的碳原子。
对映异构体
对映异构体的定义
对映异构体是指具有相同 化学组成但旋光方向不同 的分子。
对映异构体的性质
对映异构体在物理性质上 几乎相同,但在旋光性和 生物活性方面存在差异。
对映异构体的分离
对映异构体的分离是立体 化学研究的重要内容之一 ,通常采用化学或物理方 法进行分离。
非对映异构体
非对映异构体的定义
生物学中的立体化学对 于理解生物大分子的结 构和功能至关重要。例 如,蛋白质的结构和折 叠方式决定了其生物活 性,而核酸的结构则与 其遗传信息的传递和表 达密切相关。
生物学中的立体化学有 助于深入了解生物大分 子的相互作用和调控机 制。
通过研究生物大分子的 立体结构和相互作用, 可以揭示其复杂的调控 机制,为疾病诊断和治 疗提供新的思路和方法 。
第5章立体化学基础

CH3
CH3
H
OH
异丙醇
H
OH
H CH3
OH
2,32,3-丁二醇
CH3
H
CH3
H
CH3
CH3
H
1,11,1-二氯乙烷
H
顺-1,2-二甲基环丙烷 二甲基环丙烷
四、判断对映体的方法
1. 最直接的方法是建造一个分子及其镜像的模型。 最直接的方法是建造一个分子及其镜像的模型。 如果两者能重合,说明分子无手性, 如果两者能重合,说明分子无手性,没有对映异构现 象;如果两者不能重合,则为手性分子,有对映异构 如果两者不能重合,则为手性分子, 现象,存在对映体。 现象,存在对映体。 2. 考察分子有无对称面。如果分子有对称面, 考察分子有无对称面 如果分子有对称面, 对称面。 则该分子与其镜像就能重合,没有对映异构现象。 则该分子与其镜像就能重合,没有对映异构现象。 3. 大多数情况下,可根据分子中是否存在手性碳 大多数情况下,可根据分子中是否存在手性碳 原子(或手性中心 来判断分子是否有手性。 原子 或手性中心) 来判断分子是否有手性。 或手性中心
COOH COO H
CO OH H HO C CH 3
H OH CH 3 CH 3 OH H
COO H C H3 C H OH
-
二者的关系:互为镜象(实物与镜象关系, 二者的关系:互为镜象(实物与镜象关系,或 者说左、右手关系)。二者无论如何也不能完全重 者说左、右手关系)。二者无论如何也不能完全重 )。 叠。这种呈物体与镜像关系,彼此又不能重叠的性 这种呈物体与镜像关系, 呈物体与镜像关系 质称为手性。 质称为手性。
COOH COOH
H OH CH3 CH3 OH
H
有机化学《立体化学》课件

Van’t Hoff 认为含有不对称碳的分子具有旋光性。
Stereocenter
优点:使用方便 缺点:很多例外
有些分子中存在不对称碳,但却无手性:
H
H
H
H3C Cl
CH3 Cl
H3C Cl
有些分子中没有不对称碳,但却有手性:
A A
Pc
a
b
5.1.3 Symmetric element
C2
C3
C3
H
4
H
H
H3 2H
H
1H
H
H H
H H
H
H H
H
C2
C3
8
C
对称面
:假如有一个平面可以将分子分割成两部分,而其中一部分正好 是另一部分的镜象,这个平面就是分子的对称面。
H
HCH
H
σ
Four planes of symmetric in the molecule
Br H Br H
5.3.1 Molecule with two same asymmetric carbons
5.3.2 Optical activity and conformation 5.3.3 Molecule with two different
充分且必要
1874 Newzealand Van’t Hoff
The carbon atom linking four different groups or atoms is called an “asymmetric carbon”.
不对称碳原子:与四个互不相同 的一价基团相连接的碳原子。
加“ * ”表示
CO OH
Br Cl H
Stereocenter
优点:使用方便 缺点:很多例外
有些分子中存在不对称碳,但却无手性:
H
H
H
H3C Cl
CH3 Cl
H3C Cl
有些分子中没有不对称碳,但却有手性:
A A
Pc
a
b
5.1.3 Symmetric element
C2
C3
C3
H
4
H
H
H3 2H
H
1H
H
H H
H H
H
H H
H
C2
C3
8
C
对称面
:假如有一个平面可以将分子分割成两部分,而其中一部分正好 是另一部分的镜象,这个平面就是分子的对称面。
H
HCH
H
σ
Four planes of symmetric in the molecule
Br H Br H
5.3.1 Molecule with two same asymmetric carbons
5.3.2 Optical activity and conformation 5.3.3 Molecule with two different
充分且必要
1874 Newzealand Van’t Hoff
The carbon atom linking four different groups or atoms is called an “asymmetric carbon”.
不对称碳原子:与四个互不相同 的一价基团相连接的碳原子。
加“ * ”表示
CO OH
Br Cl H
有机化学PPT第五章 立体化学基础课件

凡是连有4个不同的原子或基团的碳原子称为手 性碳原子, 也可称为手性中心。
南京医科大学康达学院化学教研室 有机化学
南京医科大学康达学院 博学至精 明德至善
含有一个手性碳原子的化合物,在空间有2种不同构
型, 它们彼此构成一对对映体。
CH3C* HCOOH
COOH
OH
乳酸
HO C H
CH3
COOH H C OH
CH3
有一个手性碳的化合物必定 是手性化合物,只有一对对映体。
南京医科大学康达学院化学教研室 有机化学
南京医科大学康达学院 博学至精 明德至善
问题:下列化合物哪些含手性碳原子?
1. CH2Cl2
2. CHCl3 3.CH3CHClCH2CH3
4. CH3-CH-CH2CH3 CH2CH3
H
6.
CH3 7.
南京医科大学康达学院化学教研室 有机化学
南京医科大学康达学院 博学至精 明德至善
第一节 手性分子和对映体
一、手 性
观察自己的双手, 左手与右手有什么联系和区别?
南京医科大学康达学院化学教研室 有机化学
南京医科大学康达学院 博学至精 明德至善
左右手互为镜像与实物关系(称为对映关 系),彼此又不能重合的现象称为手性。
H
2 COOH
H3C3 1Cl
H 1OH
2 CH2CH3
3CH3
竖,顺,R南-京型医科大学康达学院化学教横研室,有逆机化,学 R-型
南京医科大学康达学院 博学至精 明德至善
课堂练习:根据Fischer投影式命名。
2
CO2H
H
OH 1
3 CH3 R-(-)-乳酸
HOCH2 3
南京医科大学康达学院化学教研室 有机化学
南京医科大学康达学院 博学至精 明德至善
含有一个手性碳原子的化合物,在空间有2种不同构
型, 它们彼此构成一对对映体。
CH3C* HCOOH
COOH
OH
乳酸
HO C H
CH3
COOH H C OH
CH3
有一个手性碳的化合物必定 是手性化合物,只有一对对映体。
南京医科大学康达学院化学教研室 有机化学
南京医科大学康达学院 博学至精 明德至善
问题:下列化合物哪些含手性碳原子?
1. CH2Cl2
2. CHCl3 3.CH3CHClCH2CH3
4. CH3-CH-CH2CH3 CH2CH3
H
6.
CH3 7.
南京医科大学康达学院化学教研室 有机化学
南京医科大学康达学院 博学至精 明德至善
第一节 手性分子和对映体
一、手 性
观察自己的双手, 左手与右手有什么联系和区别?
南京医科大学康达学院化学教研室 有机化学
南京医科大学康达学院 博学至精 明德至善
左右手互为镜像与实物关系(称为对映关 系),彼此又不能重合的现象称为手性。
H
2 COOH
H3C3 1Cl
H 1OH
2 CH2CH3
3CH3
竖,顺,R南-京型医科大学康达学院化学教横研室,有逆机化,学 R-型
南京医科大学康达学院 博学至精 明德至善
课堂练习:根据Fischer投影式命名。
2
CO2H
H
OH 1
3 CH3 R-(-)-乳酸
HOCH2 3
第五章 立体化学原理3

Cl
分子中所有的原子都在同一平面上,这个面就是分子的对成面。
有对称面的分子能和它的镜像重合, 没有手性。
(2) 对称中心: 从分子中任何一个原子或基团向中心引
一条直线, 再延长到对面等距的地方, 总有一个相同的原 子或基团。
对称中心
翻转180度
有对称中心的分子能和它的镜像重合, 没有手性。
(3)对称轴(旋转轴):分子中有一条直线,当分子以
五、手性化合物的获得与产生
1.从天然资源中分离;
2.外消旋体的拆分 3.酶及微生物合成
4.手性合成
外消旋体的拆分
将外消旋体拆分成左旋体和右旋体的过程,称为 外消旋体的拆分。
(+)
(±)
( -)
a、 结晶机械分离法
1848年Pasteur在研究酒石酸钠铵晶体的时候,发现酒
石酸钠铵有两种不同的晶体,这两种晶体互为镜像。
有些不含手性碳原子的化合物,由于分子结构中
不存在对称因素,也属于手性分子。
(环状化合物,轴手性、面手性和螺手性化合物)
三、对映、非对映异构体的理化性质比较 对映异构体:
② 化学性质:非手性条件下相同;手性条件下不相同。 ③ 对映异构体的生理活性不同 。
① 物理性质: 除比旋光度值相同, 方向相反外,其它相同。
则分子有对称面,没有对映异构。
O2 N
COOH
O2N
C(CH3)3
联苯和联萘
H Br F
F
F F
H Br
HO HO
H H
镜面
面手性化合物:
平面手性的立体模型
面手征性:分子就一个平面来区别手征性,该面即为 手性面.
手柄类化合物
环蕃类化合物
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
问题:脚, 耳朵, 鼻子, 螺丝钉是否具有手性?
答案:脚、耳朵、螺丝钉有手性
.
上页 下页 首页 5
第五章 立体化学基础 第一节 手性分子和对映体(二、手性分子和对映体)
二、手性分子和对映体
任何物体都有它的镜像,一个有机分子也会有它的镜像。
COOH
C
H
H
CH3
COOH
C
H
H
CH3
CCOOOOHH
所有基团 都重合
CH3 CH3
H 3C
8.
CH3 C H 3O
.
上页 下页 首页 11
第五章 立体化学基础 第一节 手性分子和对映体(三、对称面和非手性分子)
三、对称面和非手性分子
对称面(planes of symmetry)是指能将分子 结构剖成互为镜像的两半的面。如通过圆球心的 面;将长方形盒子分成各一半的面都是对称面。
CC
HH
HH
丙酸分子 没有手性
CCHH3 3
若实物与其镜像能够完全重合,则实物
与镜像所代表的两个分子为同一个分子。
.
上页 下页 首页 6
第五章 立体化学基础 第一节 手性分子和对映体(二、手性分子和对映体)
但有些分子如乳酸, 两个互为实物与镜像关系的分子不能重合。
COOH
H C CH3 OH
HOOC
.
上页 下页 首页 10
第五章 立体化学基础 第一节 手性分子和对映体(二、手性分子和对映体)
问题:下列化合物哪些含手性碳原子?
1. CH2Cl2
2. CHCl3 3.CH3CHClCH2CH3
4. CH3-CH-CH2CH3 CH2CH3
H
6.
C H 3 7.
5. CH3-CH-CH-CH2CH3 OHOH
碳架异构 位置异构 官能团异构
立体异构
顺反异构
对映异构 构型异构(构造相同,原子在 Nhomakorabea构象异构
空间排布方式不同)
对映异构又叫光学异构或旋光异构。它 是一类与物质的旋光性质有关的立体异构。
.
上页 下页 首页 2
第五章 立体化学基础:手性分子 第一节 手性分子和对映体(一、手性)
第一节 手性分子和对映体
一、手 性
观察自己的双手, 左手与右手有什么联系和区别?
.
上页 下页 首页 3
第五章 立体化学基础:手性分子 第一节 手性分子和对映体(一、手性)
左手的镜像是右手
右手的镜像是左手
.
上页 下页 首页 4
第五章 立体化学基础:手性分子 第一节 手性分子和对映体(一、手性)
左右手互为镜像与实物关系(称为对映关 系),彼此又不能重合的现象称为手性。
(二) 立体结构式
透视式是书写立体结构式常见的方法之一。 应注意它的书写方法,通常实线 “” 代表位 于纸平面上的键;虚线 “ ” (或“ ”) 代表 伸向纸平面后方的键,楔形线 “ ” 代表伸 向纸平面前方的键。
CH3
1 有一个手性碳的化合物必定
是手性化合物,只有一对. 对映体。上页 下页 首页 9
第五章 立体化学基础 第一节 手性分子和对映体(二、手性分子和对映体)
一对对映体有相同的物理性质 除了与手性试剂反应外,对映体的化学性质也相同 两者还有十分重要的不同性质:
对偏振光的作用不同; 生理作用上有着显著的不同
.
上页 下页 首页 14
第五章 立体化学基础 第一节 手性分子和对映体(四、判断对映体的方法)
问题:下列化合物是否存在对映异构体?
CC HH 33
CH3 C
H
HH HH
CH3 C
H
CC HH 33
Cl
F
H
Cl
H
H
F
H
3
C HC3C l l
Br
Br
HH CC HH 33 CC HH 33 HH
55
66
.
上页 下页 首页 8
第五章 立体化学基础 第一节 手性分子和对映体(二、手性分子和对映体)
一个手性碳原子所连的4个不同原子或基团位 于四面体的四个顶角,在空间具有2种不同的排列 方式(也称两种构型), 它们彼此构成一对对映体。
CH3C* HCOOH
COOH
OH
乳酸
HO C H
CH3
COOH H C OH
有对称面的分子 与它的镜像能重合, 因此没有对映异构现 象,称为非手性分子 (achiral molecule)。
对称面
.
上页 下页 首页 12
第五章 立体化学基础 第一节 手性分子和对映体(三、对称面和非手性分子)
CH3
H
CH3
H
CH3
H
H
存在对称面的分子
.
上页 下页 首页 13
第五章 立体化学基础 第一节 手性分子和对映体(四、判断对映体的方法)
.
CC HH 33
CC HH 33 C C HC 3l l
上页 下7页7 首页 15
第五章 立体化学基础 第二节 费歇尔投影式
第二节 费歇尔投影式
对映异构体的结构可以用模型、透视式 (立体结构式) 或费歇尔(Fischer)投影式表示。
(一) 三维模型
.
上页 下页 首页 16
第五章 立体化学基础 第二节 费歇尔投影式
第五章 立体化学基础
第一节 手性分子和对映体 第二节 费歇尔投影式 第三节 旋光性 第四节 构型标记法 第五节 外消旋体 第六节 非对映体和内消旋化合物 第七节 无手性碳原子的对映体 第八节 外消旋体的拆分
1
.
第五章 立体化学基础:手性分子 第一节 手性分子和对映体(一、手性)
同分异构
构造异构
(分子中原子间的排 列顺序、结合方式)
四、判断对映体的方法
1. 最直接的方法是建造一个分子及其镜像的模型。 如果两者能重合,说明分子无手性,没有对映异构现 象;如果两者不能重合,则为手性分子,有对映异构 现象,存在对映体。
2. 考察分子有无对称面。如果分子有对称面,则 该分子与其镜像就能重合,没有对映异构现象。
3. 大多数情况下,可根据分子中是否存在手性碳 原子(或手性中心) 来判断分子是否有手性。
H3C C HO
不能与其镜像重 合的分子称为手性分 H子(chiral molecule)。
它们是彼此成镜 像关系,又不能重合 的一对立体异构体, 互称为对映异构体 (enantiomer) 。 镜 像 的不重合性是产生对 映异构现象的充分必 要条件。
.
上页 下页 首页 7
第五章 立体化学基础 第一节 手性分子和对映体(二、手性分子和对映体)
仔细考察没有手性的丙酸分子和有 手性的乳酸分子,它们的差别在哪里?
丙酸 H
C O 2H
C
H
CH3
C O 2H
*C
乳酸 OH
H
CH3
乳酸分子中有一个碳原子(C2)所连的四个基团 (COOH,OH,CH3,H) 均不相同。凡是连有4个不同的 原子或基团的碳原子称为手性碳原子(chiral carbon atom), 也可称为手性中心(chiral center)。
答案:脚、耳朵、螺丝钉有手性
.
上页 下页 首页 5
第五章 立体化学基础 第一节 手性分子和对映体(二、手性分子和对映体)
二、手性分子和对映体
任何物体都有它的镜像,一个有机分子也会有它的镜像。
COOH
C
H
H
CH3
COOH
C
H
H
CH3
CCOOOOHH
所有基团 都重合
CH3 CH3
H 3C
8.
CH3 C H 3O
.
上页 下页 首页 11
第五章 立体化学基础 第一节 手性分子和对映体(三、对称面和非手性分子)
三、对称面和非手性分子
对称面(planes of symmetry)是指能将分子 结构剖成互为镜像的两半的面。如通过圆球心的 面;将长方形盒子分成各一半的面都是对称面。
CC
HH
HH
丙酸分子 没有手性
CCHH3 3
若实物与其镜像能够完全重合,则实物
与镜像所代表的两个分子为同一个分子。
.
上页 下页 首页 6
第五章 立体化学基础 第一节 手性分子和对映体(二、手性分子和对映体)
但有些分子如乳酸, 两个互为实物与镜像关系的分子不能重合。
COOH
H C CH3 OH
HOOC
.
上页 下页 首页 10
第五章 立体化学基础 第一节 手性分子和对映体(二、手性分子和对映体)
问题:下列化合物哪些含手性碳原子?
1. CH2Cl2
2. CHCl3 3.CH3CHClCH2CH3
4. CH3-CH-CH2CH3 CH2CH3
H
6.
C H 3 7.
5. CH3-CH-CH-CH2CH3 OHOH
碳架异构 位置异构 官能团异构
立体异构
顺反异构
对映异构 构型异构(构造相同,原子在 Nhomakorabea构象异构
空间排布方式不同)
对映异构又叫光学异构或旋光异构。它 是一类与物质的旋光性质有关的立体异构。
.
上页 下页 首页 2
第五章 立体化学基础:手性分子 第一节 手性分子和对映体(一、手性)
第一节 手性分子和对映体
一、手 性
观察自己的双手, 左手与右手有什么联系和区别?
.
上页 下页 首页 3
第五章 立体化学基础:手性分子 第一节 手性分子和对映体(一、手性)
左手的镜像是右手
右手的镜像是左手
.
上页 下页 首页 4
第五章 立体化学基础:手性分子 第一节 手性分子和对映体(一、手性)
左右手互为镜像与实物关系(称为对映关 系),彼此又不能重合的现象称为手性。
(二) 立体结构式
透视式是书写立体结构式常见的方法之一。 应注意它的书写方法,通常实线 “” 代表位 于纸平面上的键;虚线 “ ” (或“ ”) 代表 伸向纸平面后方的键,楔形线 “ ” 代表伸 向纸平面前方的键。
CH3
1 有一个手性碳的化合物必定
是手性化合物,只有一对. 对映体。上页 下页 首页 9
第五章 立体化学基础 第一节 手性分子和对映体(二、手性分子和对映体)
一对对映体有相同的物理性质 除了与手性试剂反应外,对映体的化学性质也相同 两者还有十分重要的不同性质:
对偏振光的作用不同; 生理作用上有着显著的不同
.
上页 下页 首页 14
第五章 立体化学基础 第一节 手性分子和对映体(四、判断对映体的方法)
问题:下列化合物是否存在对映异构体?
CC HH 33
CH3 C
H
HH HH
CH3 C
H
CC HH 33
Cl
F
H
Cl
H
H
F
H
3
C HC3C l l
Br
Br
HH CC HH 33 CC HH 33 HH
55
66
.
上页 下页 首页 8
第五章 立体化学基础 第一节 手性分子和对映体(二、手性分子和对映体)
一个手性碳原子所连的4个不同原子或基团位 于四面体的四个顶角,在空间具有2种不同的排列 方式(也称两种构型), 它们彼此构成一对对映体。
CH3C* HCOOH
COOH
OH
乳酸
HO C H
CH3
COOH H C OH
有对称面的分子 与它的镜像能重合, 因此没有对映异构现 象,称为非手性分子 (achiral molecule)。
对称面
.
上页 下页 首页 12
第五章 立体化学基础 第一节 手性分子和对映体(三、对称面和非手性分子)
CH3
H
CH3
H
CH3
H
H
存在对称面的分子
.
上页 下页 首页 13
第五章 立体化学基础 第一节 手性分子和对映体(四、判断对映体的方法)
.
CC HH 33
CC HH 33 C C HC 3l l
上页 下7页7 首页 15
第五章 立体化学基础 第二节 费歇尔投影式
第二节 费歇尔投影式
对映异构体的结构可以用模型、透视式 (立体结构式) 或费歇尔(Fischer)投影式表示。
(一) 三维模型
.
上页 下页 首页 16
第五章 立体化学基础 第二节 费歇尔投影式
第五章 立体化学基础
第一节 手性分子和对映体 第二节 费歇尔投影式 第三节 旋光性 第四节 构型标记法 第五节 外消旋体 第六节 非对映体和内消旋化合物 第七节 无手性碳原子的对映体 第八节 外消旋体的拆分
1
.
第五章 立体化学基础:手性分子 第一节 手性分子和对映体(一、手性)
同分异构
构造异构
(分子中原子间的排 列顺序、结合方式)
四、判断对映体的方法
1. 最直接的方法是建造一个分子及其镜像的模型。 如果两者能重合,说明分子无手性,没有对映异构现 象;如果两者不能重合,则为手性分子,有对映异构 现象,存在对映体。
2. 考察分子有无对称面。如果分子有对称面,则 该分子与其镜像就能重合,没有对映异构现象。
3. 大多数情况下,可根据分子中是否存在手性碳 原子(或手性中心) 来判断分子是否有手性。
H3C C HO
不能与其镜像重 合的分子称为手性分 H子(chiral molecule)。
它们是彼此成镜 像关系,又不能重合 的一对立体异构体, 互称为对映异构体 (enantiomer) 。 镜 像 的不重合性是产生对 映异构现象的充分必 要条件。
.
上页 下页 首页 7
第五章 立体化学基础 第一节 手性分子和对映体(二、手性分子和对映体)
仔细考察没有手性的丙酸分子和有 手性的乳酸分子,它们的差别在哪里?
丙酸 H
C O 2H
C
H
CH3
C O 2H
*C
乳酸 OH
H
CH3
乳酸分子中有一个碳原子(C2)所连的四个基团 (COOH,OH,CH3,H) 均不相同。凡是连有4个不同的 原子或基团的碳原子称为手性碳原子(chiral carbon atom), 也可称为手性中心(chiral center)。
