第九章 醛酮醌
有机化学 第9章 醛、酮、醌

O CH3-C-CH3
酮式
OH CH3-C=CH2
烯醇式
碱和酸都可以促使烯醇化,原因如下: 碱促进烯醇化的理由:碱可以夺取α-H,而产生碳负离子
O B: + H-CH2-C-CH3
O 碳负离子 -CH2-C-CH3
3、氧化
醛和酮最主要的区别是对氧化剂的敏感性。因为醛中羰 基的碳上连有氢,所以醛很容易被氧化为相应的羧酸。而酮 则不易被氧化。因此用此性质可区别醛酮,常用弱的氧化剂 如托伦试剂(硝酸银的氨溶液),Ag+即可将醛氧化为羧酸, 本身被还原为金属银Ag。P:164页
OH-
RCHO + Ag+ 托伦试剂
Ag + RCOO- 银镜反应
由于生成复杂的氧化产物,酮氧化一般没有合成意义。 但环己酮氧化是工业上生产己二酸的方法。
O KCrO4 + H2SO4 HOOCCH2CH2CH2CH2COOH
环己酮
己二酸
4、烃基上的反应
(1)α-H的活性 与羰基相邻的碳(α-C)上的氢叫α-H,由于羰基中氧
原子的电负性较强,使得α-C上电子密度有所降低,从而 使α-H与分子中其它碳原子上的氢相比,酸性有所增强, 即具有一定的活性。
6、酮还有一种命名法:根据羰基所连的两个烃基而命名, 简单在前,复杂在后,最后加一酮字。如:
O C-CH3
苯乙酮 甲基苯基酮
O CH3-C-CH2CH3
丁酮 甲基乙基酮
物理性质
醛、酮分子间不能形成氢键,没有缔 合作用,但由于极性较强, 因此沸点比相 应(或分子量相近的)醇低,比相应的烷 烃和醚高。
09有机化学第四版课件编(第9章_醛酮醌)课件

含3个α-H的醛、酮在碱性条件下卤代时, 3个α-H全被 卤素取代。生成的三卤代醛、酮,在碱性溶液中分解成 CHX3和羧酸盐。称为卤仿反应。
用次碘酸钠(I2+NaOH)作试剂,产生具有特殊气味的黄 色结晶的碘仿,称为碘仿反应(iodoform reaction)。
O CH3C -R
I2/NaOH
O I3CC-R
C=N Y
CO +
H2N OH H2N NH2
H2N NH
NO2
H2N NH
NO2
O
H2N NHCNH2
C N OH
肟
C N NH2
腙
C N NH
苯腙
NO2 2,4-二硝
C N NH
NO2 基苯腙
O
C N NHCNH2
缩氨脲
羰基化合物与羟氨、2,4-二硝基苯肼及氨基脲的加成缩 合产物,都是结晶,具有固定熔点,可用来鉴别醛、酮。 加成缩合产物,在稀酸作用下能水解为原来的醛和酮,可 用这些反应分离、提纯醛、酮。
第九章 醛 酮 醌
Ⅰ 醛(aldehydes)和酮(ketones)
第一节 醛和酮的化学性质
4、还原反应
RCH H
Oδ 1、亲核加成反应 Cδ+ H 3、氧化反应
R
2、α-H的反应
1、羰基上的亲核加成反应(nucleophilic addition)
(1)与 HCN 加成反应 反应是可逆的
δC+=δO- +
砖红色
注意 Fehling试剂不氧化芳醛 Benedict试剂不氧化甲醛
酮类一般不易被氧化。在强氧化剂条件下,被氧化成 碎片,无实际意义。
O RCH2-a C-b CH2R' [O]
第九章醛酮醌

(CH3)2C N OH 丙酮肟 (CH3)2C N NH2 丙酮腙 (CH3)2C (CH3)2C N NH 丙酮苯腙 N NH NO2
+ H 2O
NO2 丙酮-2,4-二硝基苯腙
实验 醛、酮与2,4-二硝基苯肼的反应
均加入2,4-二硝基苯肼
试管①—乙醛
试管②—丙酮
① ② ③
试管③—苯甲醛
振摇
均出现黄
CH CH CH2 2CH3 3
常用于合成(C成倍增加)
无α-H
CHO
-
稀 OH
-
CH3CHCH2CHO OH
H2O
+
CH3CHO
OH CHCH2CHO
稀 OH 50℃
CH CHCHO
3-苯丙烯醛
(三)氧化与还原 1. 氧化反应 醛易氧化,酮较难
RCHO + 2 [Ag(NH3)2]OH
RCOONH4 + 2 Ag
O O CH3 C C CH2CH3
2,3-戊二酮 (α-戊二酮)
O
O
CH3 C CH2 C CH3
2,4-戊二酮 (β-戊二酮)
一、醛和酮的命名
CH3 CH3
γ
CH CH CH2 CH2CH3
β
α
CHO
4-甲基-3-乙基戊醛 (γ-甲基-β-乙基戊醛)
CH3 O O
2-甲基-1,4-环己二酮
CH CHCHO
试管③—苯甲醛
试管④—异丙醇
常用于: 合成少一个C的羧酸
鉴别乙醛、甲基酮及
CH3 CH R(H) OH
2-戊醇
CHI3 (黄)
I2 + NaOH
H2N NH O2N
有机化学课件第五版汪小兰第9章醛、酮、醌

醛、酮、醌
• 醛、酮、醌的结构、分类和命名
• 醛、酮、醌的物理性质
• 醛、酮、醌的化学性质
9-1 醛和酮的结构、分类及命名
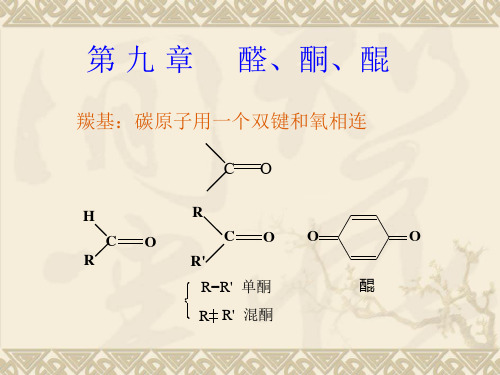
一、结构 • 醛、酮:分子中含有羰基,故称为羰基化合物。
• 官能团: 羰基
C O
O R C H 醛
O C H 醛基
O R C R1
O C 酮基
酮
• C、O:sp2 杂化;
3-戊酮
O CH3CH2C CH CH3
5 4 3 2 1
CH2=CHCHO 丙烯醛
CH3
2-甲基-3-戊酮
O CH3C CH CH CH3
1 2 3 4 5
5 4 3 2 1 CH3CH CHCHCH3
OH
3-戊烯-2-醇
3-戊烯-2-酮
CHO
苯甲醛 苯乙醛
CH2CHO
COCH 3
苯乙酮
O CH2C CH3
CH
CH
CH R
CH3
4 CH
3 CH
H 2 C 1 O
H
+ RMgX 1,4-加
H CH C OH
成 CH 3
CH R
CH
C
OMgX
H+, H2O
CH3
CH R
CH3CHCH2CHO R
CH3CH=CH-CHO
1,2加成
+
CH3CH2MgX
CH3CH=CH-C
OH
CH2CH3
1,4加成
CH3CH
• 酮较难与一元醇反应,与1 ,2-或1,3-二员醇比较容易 进行,产物为环状缩酮。
O
O
O
+ HOCH2CH2OH
汪版有机第九章醛酮醌

CH3CHCH2CHO OH
Δ
CH3CH CHCHO + H2O
除乙醛的羟醛缩合得到直链化合物外,其他醛的羟醛 缩合产物都是带有支链的。
产物特点:羟基在β-碳上,支链在α-碳上。 使用两种带有α-氢的不同的醛进行羟醛缩合,则产物 较复杂,至少有四种,不适于在合成上应用。
用一种无α-氢的醛和另一种有α-氢的醛,进行交叉羟醛 缩合,则有合成价值。
CH3CHCH2CHO OH
CH3CH CHCHO + H2O
羟醛缩和反应的历程,同时体现了羰基化合物的两大特 性:α-氢的酸性,和羰基的亲核加成。
-
CH3CHO + OH CH3 C O
-
[CH2CHO
-
CH2
CH] + H2O
O-
H + CH2CHO
CH3CHCH2CHO
O-
H2O
CH3CHCH2CHO OH
制备少一个碳的羧酸盐
这一反应称为卤仿反应。
若使用的卤素是碘,就称为碘仿反应。 碘仿是不溶于水的黄色固体,有特殊气味,因此常用 碘仿反应来检验乙醛或甲基酮的存在。 羟基在2-位上的醇,可被次卤酸钠氧化成甲基酮结构, 也能起碘仿反应。
I2 + 2NaOH
NaIO + NaI + H2O
OH
NaIO
1)给电子性基团增多 2)空间位阻增大
R > H
R C=O > 甲基酮 C=O R'
反应活性降低
α-羟基腈分子中的氰基可以水解为羧基,也可以还原为 氨基,进而转化为许多有用的化合物。
H2O,H+
CHCN OH
CHCOOH OH
第9章 醛酮醌
说明:
Ⅰ用途:鉴别醛类 制不饱和酸
Ⅱ只氧化醛基,不影响双键。
幻灯片48
练习:
步骤:
羟醛缩合,加热脱水,本尼迪特试剂作用.
幻灯片49
5.还原反应 (适应 醛酮)
1)羰基还原为羟基
Ⅰ催化氢化
幻灯片50
幻灯片51
Ⅱ金属氢化物NaBH4 (硼氢化钠)
优点:选择性强,只还原醛、酮、酰卤中的羰基,不还原其它基团。
异丁醛
丙烯醛
幻灯片6
B.酮酮的命名与醚相似,按照羰基所连烃基来命名。
二甲(基)酮
苯乙酮
幻灯片7
系统命名法
选主链:含羰基和重键,Ar–取代基
编 号:近羰基端,指明羰基位置和数目
3-甲基丁醛
βα
β-甲基丁醛
3-苯基-2-丙烯醛
幻灯片8
4-苯基-2-丁酮
4-羰基戊醛
或:4-ቤተ መጻሕፍቲ ባይዱ酮醛
幻灯片9
练习
Z-13-二十碳烯-10-酮
幻灯片52
幻灯片53
2)羰基还原为亚甲基的反应
Ⅰ沃尔夫—凯惜纳—黄鸣龙反应
幻灯片54
练习:
步骤: 酰基化, 黄鸣龙反应.
幻灯片55
Ⅱ克莱门森还原法Zn—Hg / HCl
对碱敏感时可用克莱门森还原法(锌汞齐)
幻灯片56
幻灯片57
6.歧化反应——坎尼扎罗(Cannizzaro)反应
条件: 无α-H 的醛
反应活性
亲核试剂一定,不同类型醛酮反应活性大小
结论:醛>酮,R小的> R大的
幻灯片20
④分析
相同点:都有双键,都能加成.
不同点:
亲核加成
有机化学 第九章醛酮醌

C
.. O + HN Y 2
δ
_
C NH2 Y _ O
+
H
+
C OH
N H
Y
醇胺
H2O
C
N
Y
27
第九章 醛、酮、
17:38
胺的主要衍生物
NH2
R 伯胺
NH2
OH 羟胺
O
NH2
NH2 肼
NH2
NH
Hale Waihona Puke C氨基脲NH2
NH2
NH O2 N
NO2
2,4-二硝基苯肼
第九章 醛、酮、
17:38
28
具体反应:(加成后脱水)
O
甲 甲 Fo Fo
乙酰基 酰基 Acetyl Acyl
O
第九章 醛、酮、 C
17:38
乙酰基 甲酰基 酰基 苯甲酰胺 苯甲酰基 苯甲酰氯
甲酰基 乙酰基 酰基 Formyl Acetyl Acyl
乙酰基 甲酰基 Formyl Acetyl
13
O
苯甲酰基 Benzoyl 苯甲酰基 Benzoyl
醛、酮的物理性质: 状态
C
OMgX
H2O
R
C
OH
RMgX
+
C
O
R
CH
OMgX
H2O
RCH2OH
第九章 醛、酮、
17:38
24
H R3 R1MgX + R 2 R1MgX + R 2 C C O O
R2 R3 R1
H2O R 1 C OMgX OMgX H2O R 1 R CH 1
R R 23 C CH R2 OH OH
第九章醛、酮和醌

CH3 CH CH CH2
2-甲基-3-丁烯醛
2-甲基-4-戊烯-2-酮
碳原子的位置也可用希腊字母表示,与羰基相连的第 一个碳原子称为α碳,第二个碳原子称为β,其他与此类 推。例如:
H3C
CH
CH
CH2
CHO
β -丁烯醛
二、 醛、酮的性质
分子结构与化学性质分析: 醛、酮分子中都含有羰基,所以它们具有相似的化学 性质,主要表现加成反应、氧化还原反应。 但是它们的分子结构并不完全形同,所以它们的化学 性质又有所不同。
α
O CH
H O R α C CH H
α
H R C H
O C
H C H
α '
H H R αC H
O C
H
' Cα R1
C H
H
• 受相邻羰基极化等作用的影响,α-氢原子性质活泼,容 易发生许多反应。
(1)卤代反应 在碱性条件下,醛、酮的α -氢容易与卤 素(Cl2、Br2、I2)发生取代反应,生成一、二、三卤代物
(一)甲醛
俗名蚁醛。无色、刺激性气味的气体。 福尔马林:质量分数(ω B)为0.35~0.40的甲醛水 溶液。沸点为19 ℃。质量分数(ω B)0.02的甲醛溶液用于 外科器械消毒,体积分数为0.10的甲醛溶液用于保存动物 标本和尸体。 甲醛溶液与氨水共同蒸发时,生成环六亚甲基四胺,药 名乌洛托品。 甲醛易发生聚合反应,生成多聚甲醛固体。多聚甲醛, 加热到160~200 ℃时,能解聚重新生成甲醛。若在甲醛中 加入少量甲醇可防止甲醛聚合。
2,4-二硝基苯肼
2.还原反应 醛加氢还原为伯醇,酮加氢还原为仲醇。 铂、钯或镍等金属催化剂
O CH3CH + H2
第九章醛酮醌(选择、鉴别和推断)

醛酮醍(选择、鉴别和推断)一、单选题(共20题,20分)1、下列哪个化合物不能起卤仿反应A、CH3CH (OH)CH2CH2CH3B、C6H5COCH3C、CH3CH2CH2OHD、CH3CH2OH正确答案:C解析:2、下列化合物能发生歧化反应的是:A、CH3CH2CHOB、CH3COCH2CH3C、C6H5CH0D、(CH3)2CHCHO正确答案:c 解析:.3、下列彼基化合物中最易与HCN加成的是A、B、C、D、正确答案:D 解析:.4、下列化合物与NaHSO3加成反应的最快的是(A、B、C、D、正确答案:D 解析:5、下述反应通常称为()A、Wolf-Kisher 反应B、Clemensen 反应C、Cannizzaro 反应D、Wurts反应正确答案:C解析:6、下述反应通常称为()A、Wolf-Kisher 反应B、Clemensen 反应C、Cannizzaro 反应D、Wurts反应正确答案:B 解析:7、保护醛基常用的反应是()A、氧化反应B、羟醛缩合C、缩醛的生成D、还原反应正确答案:C 解析:8、下列洗基化合物发生亲核加成反应的速度次序是i.HCHO;ii・ CH3COCH3; iii. CH3CHO; iv. C6H5C0C6H5 ()1 > 11> 111? IVIV > 111 > 11 > 1c、IV > 11 > 111 > 1D、1 > 111> 11> IV正确答案:D解析:9、能够将洗基还原为亚甲基的试剂为( )A、Al(i-Pr0)3 , i-PrOHH2NNH2, NaOH, (H0CH2CH2) 20, AC、⑴ HSCH2CH2SH, (2) H2/NiD、NaBH4正确答案:B 解析:10、下列化合物在浓碱中,不能发生歧化反应的是()A、CH3CH0B、(CH3)3CCHOC、LPhCHO正确答案:A解析"11、下列试剂能与PhCHO发生加成反应的是()A、饱和NaHS03溶液B、斐林试剂C、乙酰氯D、3%FeCl3溶液正确答案:B解析"12、下列化合物能发生碘仿反应的是( )A、(CH3) 3C-OHB、PhC0CH2CH3C、CH3CH (OH) PhD、CH3CH2CH2OH正确答案:C 解析:A、CH3CH2CH0B、CH3COCH2CH3C、C6H5CHOD、(CH3) 2CHCHO正确答案:C解析:.14、CMCOgCH (OC2H5) 2还原为GH5CH2CH2CH (OC2H5) 2 的试剂为( )A、LiAlH4B、Zn-Hg, HC1c、Fe / 浓HC1D、NaBH4正确答案:B解析:.15、将CH3CH=CHCHO氧化成CILCH二CHCOOH选择下列哪种试剂较好?( )A、酸性KMnO4B、KzCmO? + H2SO4C、土伦试剂D、HNO3正确答案:c解析:16、下列化合物中,哪个可发生Cannizzaro反应()。
有机化学ppt-醛酮醌

a.α-C上含有三个活泼氢的醛,酮与碘的氢氧化钠溶液作用, 生成碘仿(黄色沉淀,有特殊气味)和羧酸钠,称碘仿反应。
b.常用此反应鉴别乙醛和甲基酮以及有( 醇。
)结构的
(2)羟醛缩合反应
O
H
OH
稀OH-
CH3 C H + CH2 CHO
CH3 CH CH2 CHO
乙醛
乙醛
β- 羟基丁醛
是增长碳链的一种方法。
O
O
O
O
O
O
1,4-苯醌 (对苯醌)
1,2-苯醌 (邻苯醌)
O
1,4-萘醌 (α-萘醌)
1,2-萘醌 (β-萘醌)
二、重要的醌及性质 (一) α-萘醌和维生素K
许多天然的植物色素含有α-萘醌的结 构,如维生素K类,它们存在于绿叶蔬菜 中,具有促进凝血作用,故在医学上常用 作止血剂,亦可用于预防长期口服广谱抗 生素药物引起的K族维生素缺乏症。
3-甲基丁醛 β -甲基丁醛
O CH3CHCCH2CH3
CH3 2-甲基-3-戊酮
CH3CH=CHCHO
2-丁烯醛
(CH3)2CHCH2COCH3 4-甲基-2-戊酮
CH3COCH2COCH2CH3 2,4-己二酮
O
CH3CH=CHCCH2CH3
4-己烯-3-酮
OHCCH2CHO 丙二醛
三、醛酮的物理性质
目录
Contents
第一节 醛和酮 第二节 醌
第二节 醌
一、醌的结构和命名 醌是一类具有环状共轭体系的环己二烯二酮类化合物
O
O
O
O 对位
邻位
一、醌的结构和命名
命名:以相应的芳烃衍生物来命名,苯醌、萘醌、蒽醌等,两
有机化学-第九章醛酮醌

3、低级醛酮的沸点比相对分子量相近的醇低。 (分子间无氢键)。
4、低级醛酮易溶于水,醛酮都能溶于水。丙酮能 溶解很多有机化合物,是很好的有机溶剂。
二、 醛酮的化学性质
1、 加成反应
• 烯烃的加成一般为亲电加成; • 醛酮的加成为亲核加成,易于HCN、NaHSO3、ROH、 RMgX等发生亲核加成反应。
(1)一般过酸 + 无机强酸(H2SO4) (2)强酸的过酸 :CF3COOOH (3)一般酸 + 一定浓度的过氧化氢(产生的过酸立即反应)。
反应机理
O
H+ +OH
R-C-R'
R-C-R'
OH
R-C-R'
+
-H+ O R"COO-H
OH R-C-R'
O-OCR" O
R
O
R' C
O O
H
O
C R"
R’重排 O-O键断裂 -R”COO- , -H+
(1)碳碳双键加成
2,3,5,6-四溴环己二酮
注意:两种方法的适用范围
• 克莱门森还原——适用对酸不敏感的化合物; 如:NH2-CH2-CH2-CO-CH3,就不能用此方法,
含有-NO2也被同时还原。 • 武尔夫-克日聂尔-黄鸣龙反应——适用对碱不敏感的
化合物; 如:含有羧基等就不行。
补充:
-CO,-NO2均 还原!
用HCl,可使 之变为酚!
• 由于醛基直接连在芳环上的芳醛都没有氢原子, 所以可以用坎尼扎罗反应来制备芳香族醇:
二、烃基的反应
1、α-氢原子的卤代反应
有机化学 第9章 醛酮醌
HCN(bp26.5℃),常把无机酸加入醛(酮)和 NaCN水溶液,加酸时注意pH=8为好
增长碳链的一种方法 产物羟基腈是一类活泼化合物,便于转化为其 它化合物。 OH
H3O +
CH3 – C – COOH
CH3
O OH
HCN
OH
H
CH3CCH3
CH3 – C – CN
CH3
- H2O
CH3 – C – CH2NH2 CH3 CH3 CH2 = C—CN
C 6H 5 >
C H C H2 >
R
H
O
H
C H 2C H O H
C H 2C O C H 3 H
HC
CH
H
CH3
C H 2C H 3 H
pK a
1 5 .7 4
17
20
25
49
50
d
_
O
α-H活泼原因:-I,σ- π
R
C
H
C
d+
互变异构 在溶液中有α-H的醛、酮是以酮式和烯醇式互变 平衡而存在的
O 2N CHO > CHO > CH3 CHO
空间效应 羰基碳原子上连有较大的基团,不利于反应进 行,R或R’基团愈小,加成反应愈容易(羰基C 由SP2变成SP3立体障碍小)
H H C CH3 O > ph C CH3 O > CH3 C O > C 2H 5 O > C 2H 5 同碳数环酮比开链酮 活泼,因加成时羰基 碳 由 SP
C = N—NHCONH2 (缩氨脲)
(二)α-H原子的反应
第九章 醛 酮 醌

O
121pm 122o
C
116.6o
平面分子 H
C
H
CH3 116o
CH3
sp2 R C R' O
羰基 >C=O: 一个键、 一个键 羰基碳:sp2杂化;羰基为平面型。
羰基是极性基团:
C O
C+
O-
2)醛和酮的物理性质 状态:除甲醛为气体外,12个C以下为液体,其他 多为固体。
CH3CH2CH2CH3 CH3CH2CHO CH3COCH3 CH3CH2CH2OH
4-甲基-3-丙基- 4-戊烯-2-酮
O
5-甲基-1,3-环己二酮
CH3—
—C—CH3 O
O
对-甲基苯乙酮
CH3CH2CCH2CHO
O CH3CH2-C-CH2-CH-CH2CH3 HO-CH-CH3
5-乙基-6-羟基- 3-庚酮
3-氧代戊醛 或 3-戊酮醛
二、结构与物理性质
1)醛和酮的结构 O
121.7o
RCH=CH(CH2)nCR' O H2 Ni RCH2CH2(CH2)nCHR' OH
选择氢化:只还原羰基,而对其它不饱和官能团都不发 生作用。例:NaBH4、LiAlH4。
b. 还原成烃:
C O
H CH 2
酰基化
COCH2CH3
Zn-Hg 浓 HCl
CH2CH2CH3
3、氧化反应(可区别醛、酮)
CH2=CH-CHO + 2CH3CH2OH
H+
CH2=CH CH
OC2H5 OC2H5
KMnO4 冷
CH2 CH CH OH OH
OC2H5 OC2H5
有机化学第五版汪小兰第9章醛、酮、醌课件

例:
B r C H 2 C H = C H C H O H 2 / /P N .i a .C H 3 C H 2 C H 2 C H 2 O H
有机化学第五版汪小兰第9章醛、酮、醌
(b) 用金属氢化物还原
R 2
H 2ORR C 1O H R 2
有机化学第五版汪小兰第9章醛、酮、醌
3.与氨的衍生物加成
• 氨的衍生物: H2N Y
H2N-H 氨
C NH 亚胺
H2N-R(Ar) 伯胺 H2N-OH 羟胺
C N R(Ar) 取代亚胺 西佛碱
(Schiff base)
C N OH 肟
有机化学第五版汪小兰第9章醛、酮、醌
甲醛(HCHO)的结构
C
O
有机化学第五版汪小兰第9章醛、酮、醌
δ+
C
δ-
O
二、分类
• 脂肪族醛、酮,芳香族醛、酮。 CH3CHO CH3COCH3
• 饱和醛、酮,不饱和醛、酮。 • 一元醛、酮,二元醛、酮等。
单酮、混酮、环酮。
CHO COCH3
O O
OO
CH3CCH CHCH3
CH3CCH2CCH3
O C C H 2 C H 2 O C O H Z n 苯 H 或 g 甲 /H 苯 C /l( 浓 )
O C H 2 C H 2 C H 2 C O H
△ 只能还原醛、酮羰基为CH3、CH2 ,不能
还原:
OO
C O O H 、 C O O R 、 CO C、 C O X
△ 这反应只能适用于还原对酸稳定的化合物
hcn与格氏试剂反应无水乙醚rmgx无水乙醚nh亚胺nrarschiffbase24二硝基苯肼24二硝基苯腙产物多数为晶体有固定的熔点与稀酸作用可水解成原来的醛或酮常用来鉴定分离和提纯醛或酮
有机化学理论课 第九章 醛、酮、醌

第九章 醛、酮、醌一、教学目的和要求1、掌握醛、酮的结构特点及主要化学性质,以及如何运用这些性质上的异同点进行鉴别。
2、熟练掌握醛、酮的系统命名法,了解醌的系统命名法。
3、熟练掌握醛、酮的结构、理化性质及用途。
4、掌握亲核加成机制、醛酮氧化特性、羧醛缩合、Canizzaro 反应、碘仿反应特征。
5、了解典型醛、酮、醌的性能、用途。
二、教学重点与难点重点是醛、酮亲核加成机制、羧醛缩合、Canizzaro 反应、碘仿反应特征。
难点是醛、酮亲核加成机制、羧醛缩合。
三、教学方法和教学学时(1)教学方法:以课堂讲授为主,结合必要的课堂讨论。
教学手段以板书和多媒体相结合,配合适量的课外作业。
(2)教学学时:4学时。
四、教学内容 1、醛和酮(1)醛、酮的概述 (2)醛、酮物理性质 (3)醛、酮化学性质 (4)个别化合物 2、醌3、合成例题五、总结、布置作业9.1 醛和酮(Aldehyde and Ketone )醛、酮、醌统称羰基化合物。
醛:羰基至少连有一个H 原子,官能团:醛基 酮:羰基与两个烃基相连,官能团:羰基或酮羰基 醌:一种特殊的不饱和环状二酮一、醛、酮的分类和命名:4-甲基戊醛 6-甲基-2-庚酮3H 33CH 34-甲基-2,6-庚二酮 4-甲基环己酮CHO苯甲醛 苯乙酮1-苯基-1-丙酮4-甲基-2-戊烯醛5-苯基-4-戊烯-2-酮α –氯丁醛二、醛、酮的化学性质回顾烯烃亲电加成的特征:亲电试剂、π-络合物及正碳离子的形成羰基进行加成反应时,其历程与C =C 加成相同吗? 碳-碳双键及碳-氧双键的比较C C羰基碳显正电性,易受亲核试剂的进攻羰基碳氧双键与烯烃碳碳双键相似,也是由一个σ键和一个π键构成,但氧原子电负性比碳大,使成键电子云偏向O ,O 原子上电子云密度较大而C 原子上电子云密度较小。
醛、酮有许多相似的化学性质,但醛比酮更活泼。
醛、酮分子中比较容易发生反应的部位是羰基、醛基上的H 和烃基上的α-H 等。
第九章-醛酮醌

9.5.2. 醌的制备 苯醌:
萘醌 蒽醌
9.5.3. 醌的化学性质
碳碳双键的性质 羰基的性质 共轭双键的性质
(1)加卤素(碳碳双键的性质)
双烯合成-----Diles-Alder反应
(2)共轭加成(共轭双键的性质)
(3)羰基加成 互变异构体
(4)还原反应 (醌氢醌)
C H 2 = C H -C H O + 2 C H 3 C H 2 O HH +
O C 2 H 5 C H 2 = C HC H
O C 2 H 5
K M n O 4 C H 2C HC H O C 2 H 5 H + C H 2 C H C H O 冷 O HO H O C 2 H 5 H 2 OO HO H
有机玻璃的单体
—CN作为亲核试剂,负电荷在碳原子上,与之相似的 是炔基负离子也可与醛、酮发生亲核加成.用于制备炔 醇,且反应不可逆:
增链反应
(2)与亚硫酸氢鈉加成
反应历程:
饱和(40%)
鉴别
白色结晶
适用范围:醛、脂肪族甲基酮、少于八个碳的环酮
可逆性:
分离
间接法制备-羟基腈:
(3)与醇加成
(无水) (无水)
亲核加成
亲核加成反应——由亲核试剂进攻而引起的加成反应
亲核加成反应历程:
决定反应速度
sp2
比较——亲电加成反应
决定反应速度
sp3 X–
影响亲核加成反应因素: 电子因素:凡是增加羰基碳原子的正性有利于亲核加成 空间因素:空间障碍大不利于亲核加成
故:醛比酮易于反应
反应易难顺序:
试比较下列化合物发生亲核加成反应的活性大小:
有机化学-第九章 醛 酮 醌

丁烯醛
CH3CH2CHO
丙醛
CH2=CHCHO
丙烯醛
BrCH2CH2CH2CHO
γ-溴丁醛
酮:看作甲酮的衍生物,烃基+烃基+(甲)酮。
O C H3C O C H2C H3 (C H 3 )2 C H C C H3 O C Cl O C H 3 C HC C H 2 C H 2 C l
2.系统命名法:选择含有羰基的最长碳链作为主链,碳原子编号应 从靠近羰基的一端开始。醛基在碳链的一端,编号总是1,酮分子 羰基的位次。 对于脂环族酮,羰基在环内,称为环某酮,在环外则把环作为取 代基。
乙醇合成丙酮
PPC
C H 3C H 2 O H
CrO 3 吡啶
CH3
C O
H
C H 3M gB r
H 2O H
+
C H 3C H C H 3
OH
KMnO
C H 3C C H 3
4
O
(3) 和氨的衍生物加成 :
醛或酮和氨的衍生物加成时,所得到的产物往往不稳定, 常进一步脱水生成含有碳氮双键的化合物。
2 CH 3
CH 3 -C-CH 2 ,4
O 3 甲基环戊酮
戊二酮
醛、酮分子中连有苯环时,常把苯环作为取代基。
CHO
O C C H 2C H 3
苯甲醛
1-苯基-1-丙酮
不饱和醛、酮命名,碳原子编号时应使羰基的位次最
小,并标出不饱和键和羰基的O
CH
CHCHO
C H 3C C H
脂肪族亚胺一般不稳定,容易分解;芳香族亚胺则较稳 定。甲醛法测定氨基酸中羧基的含量。
H+
C 6H 5C H O + H 2N C 6H 5
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不断 除去
半缩醛(酮) 一般不稳定
H+:HCl(干), H2SO4 ,TsOH, 例:
缩醛(酮) 碱性和中性中稳定
(4) 与醇加成——缩醛形成机理
半缩醛(酮)
H OR
缩醛(酮) H OH 缩醛的形成机理与水合的机理有部分相似。
9.3.2 α-氢原子的反应
(1) α–氢的酸性
(2) 卤化反应 (3) 羟醛缩合 (aldol 缩合反应)
9.5 α,β-不饱和醛、酮的特性
(1) 酸催化的亲核加成 (2) 碱催化的亲核加成
9.6 醌
4
醛和酮
羰基 carbonyl
脂肪族
醛(aldehyde) 酮(Ketone)
芳香族 醛
酮
a, b–不饱和醛、酮5
其它含羰基化合物
羧酸
羧酸衍生物
酯 酰卤 酸酐 酰氨(胺)
6
9.1 醛和酮的命名
9.1.1 普通命名法
50
11.6.1 1, 2–加成与1, 4–加成反应
强碱的1,2–加成反应
11.8 醌(简单了解)
芳烃+醌 羰基在环中的位置 取代基的位次及名称
1, 4-苯醌
1, 2-苯醌
(对位苯醌) (邻位苯醌)
1, 4-萘醌
1, 2-萘醌
9, 10-蒽醌
9, 10-菲醌
52
11.8.2 醌的化学性质
a, b-不饱和醛(酮)
(a) 羟醛缩合——机理
b-羟基醛(酮)
ห้องสมุดไป่ตู้
a, b-不饱和醛(酮)
(b) 羟醛缩合——自身羟醛缩合
Ba(OH)2
由于羰基的活性较低,所以平衡常数较小,需要索氏提取器。
丙酮
(c) 羟醛缩合——交叉羟醛缩合
dil OH-
RCH2CHO + R'CH2CHO
四种产物,不易分离,无意义
24
9.3.2 α-氢原子的反应
(1) α –氢的酸性
σ,π-超共轭效应使α-氢原子的酸性增强。
pKa
17
20 48 51
醛酮羰基 α - H 的弱酸性和烯醇负离子
烯醇 (enol)
烯醇负离子 (enolate)
(较稳定的共振式)
碳负离子
26
(2) 卤化反应
醛、酮分子中的α-氢原子,在碱或酸的催化下,容易被卤 素取代,生成α-卤代醛、酮。例如:
NaBH4 还原反应 LiAlH4 还原反应
2. C=O还原成CH2
(c) Clemmensen 还原
适用于对酸 稳定的体系
烷基苯
(d) Wolff-Kishner-黄鸣龙还原法
Wolff-Kishner (1912)
适用于对碱 稳定的体系
使用无水肼
强碱
黄鸣龙改进 使用水合肼(安全);弱碱
醛:“烃基” + 醛
正丁醛
异戊醛
酮:以甲酮作母体,“甲”字可省略
苯甲醛 (benzaldehyde)
甲基乙基(甲)酮 甲乙酮
甲基乙烯基(甲)酮 (又称丁烯酮)
二苯甲酮 (benzophenone)
7
9.1.2 系统命名法
选择含有羰基碳原子的最长的碳链作为主链。 从靠近羰基一端编号,酮羰基位次要标明。
9.3.3 氧化和还原反应
• (1) 氧化反应
– (a)
与Tollens 试剂的反应
– (b)
Fehling 试剂
– (c)
与强氧化剂的作用
• (2) 还原反应
– (a)
催化加氢
– (b)
用金属氢化物还原
– (c)
Clemmensen 还原法
– (d)
Wolff–Kishner 反应
• (3) Cannizzaro 反应(歧化反应)
3–甲基–4–己烯–2–酮
苯甲醛
1–苯基–1–丙酮 1–Phenyl–1–propanone
9
9.1.2 系统命名法
•脂环族醛和酮的命名:
羰基在环内的——环某酮;羰基在环外的——环为取代基。
4–甲基环己酮
1– (3–甲基环己基)乙酮
3–(3–甲基环己基)–2–丁酮
10
9.2 醛和酮的结构
VS.
(1) 与HCN加成 机理:
慢
a-羟基腈
亦称α-氰醇
快
(1) 与HCN加成——反应活性
(a)
醛
芳香族醛
酮 芳香族酮
反应活依次性降低 (b)
吸电子基, 增加活性
供电子基, 降低活性
(1) 与HCN加成——合成上的应用
甲基丙烯酸甲酯 有机玻璃
聚甲基丙烯酸甲酯
(2) 与Grignard试剂的加成
结构的化合物。
鉴别:
CH2CHO
O
NaOI
C-CH3
ÎÎÎÎÎ í CHIÎ ¨ 3 Î Î
CH3CH2OH
NaOI CHIÎ ¨ 3 Î Î
CH3CH2CH2CH2OH
ÎÎÎÎÎ í
(3) 羟醛缩合 (Aldol condensation reaction)
b-羟基醛(酮)
醇(alcohol) 醛(aldehyde) aldol condensation 羟醛缩合、醇醛缩合
9.3 醛和酮的化学性质
反应概述 9.3.1 羰基的亲核加成反应 9.3.2 α–氢原子的反应 9.3.3 氧化和还原反应
13
• 一些常见的与羰基加成的亲核试剂
分子型
亲核试剂
相应试剂
负离子型
亲核能力 弱 较强 强
很强
9.3.1 羰基的亲核加成反应
本节反应:
(1) 与氢氰酸的加成 (2) 与Grignard试剂加成 (3) 与氨及其衍生物的加成缩合反应 (4) 与醇加成
27
酸催化卤化反应机理
28
碱催化卤化反应机理
反应: 机理:
卤代前后a-H活性 同一分子不同a-H
碘仿反应:次碘酸钠(NaOI)的碱溶液与醛或酮作用生成三碘甲烷的反应
碘仿反应: 试剂:I2 + NaOH 现象:HCI3 黄色沉淀
适用对象: 具有 应用: 有机分析:鉴定甲基酮(碘仿试验) 有机合成:通过甲基酮合成少一碳的羧酸
甲醛分子的结构
羰基的碳原子是sp2杂化 σ 键的形成 羰基的几何构型 π 键的形成 羰基的极性
11
9.3 醛和酮的化学性质
反应活性位点
孤对电子,弱碱性 可与酸结合
氢易被氧化或 羰基被还原
可与弱亲核试剂结合
羰基碳有亲电性 可与亲核试剂结合
a碳连有吸电子基 a氢有弱酸性
可形成烯醇负离子
结构和性质分析:
C=C, C=O双键, 可加氢,有氧化性
C=C, C=O双键共 轭;可1, 2–加成与 1, 4–加成反应
C=C与两个C=O双键相连, 易与二烯发生Diels –Alder反应
53
11.8.2 醌的化学性质
还原反应:
醌
氢醌
萘氢醌易 被氧化
现代生产双氧水方法54
11.8.2 醌的化学性质
9.1.1 普通命名法
9.1.2 系统命名法
9.2 醛和酮的结构
9.3 醛和酮的物理性质及波谱性质
9.4 醛和酮的化学性质
9.4.1 羰基的亲核加成
(1) 与醇加成 (3) 与金属有机试剂的加成
9.4.2 α-氢的反应
(2) 与氢氰酸的加成 (4) 与氨及其衍生物的加成缩合反应
(1) α-氢的酸性 (2) 卤化反应 (3) 羟醛缩合反应
产物复杂,没 有合成意义 合成尼龙-66 的原料
(2) 还原反应
羰基的两种主要还原形式
•催化氢化还原:
H2, 加压 / Pt (or Pd, or Ni) / 加热
•氢化金属还原(第III主族元素)
LiAlH4, NaBH4, B2H6
• Clemmensen还原
Zn(Hg) / HCl
• Wolff-Kishner还原
9.4.3 氧化和还原
(1) 氧化反应
(a) 与Tollens 试剂反应 (b) Fehling 试剂 (c)与强氧化剂作用
(2) 还原反应
(a) 催化加氢
(b) 用金属氢化物还原
(c) Clemmensen 还原 (d) Wolff – Kishner 还原
(3) Cannizzaro 反应(歧化反应)
Organic Chemistry 有机化学
第九章 醛、酮和醌
1
第九章 醛、酮和醌
醛和酮 ——醛和酮都是含有羰基(
因此又统称为羰基化合物。
)官能团的化合物,
醛、酮的分类、命名、制法和物理性质 醛和酮的亲核加成反应、α–H的反应、氧化及还原反应 不饱和醛、酮及醌的反应
2
9.1 醛和酮的命名
例:
O CH3CCH3 CH3CHO C6H5CHO
Tollen's
x
Ag Fehling's × ÎÎ ì
Ag
x
②合成:
R-CH=CH-CHO
Ag(NH3)2NO3
° ÎÎÎ
H+ R-CH=CH-COOH
° ÎÎÎ á
ÎÎKMnO4ÎÎÎÎ ò C=C ÎÎ!
例:
(1) 氧化反应
强氧化剂: 醛被H2O2、RCO3H、KMnO4、CrO3氧化为羧酸,酮被 强氧化剂如硝酸、酸性高锰酸钾氧化发生C-C键断裂
11.5.4 氧化和还原反应
(3) Cannizzaro反应(歧化反应)
例:
机理:
11.5.4 氧化和还原反应
