《中国药典》2020版—通则 3407 外源性 DNA 残留量测定法第三法公示稿
外源性DNA残留量测定法

溶 解 ,室 温 放 置 2 4 小 时 ,裂 解 物 加 水 1 80 4 ,再 冷 冻 干
燥 。冻 干 的 裂 解 物 用 水 复 溶 至 适 当 浓 度 。照 SDS- 聚丙烯
酰 胺 凝 胶 电 泳 法 (通 则 0541第 五 法) (胶 浓 度 20% ) 进行
电 泳 ,用 银 染 法 染 色 。
将待提取的细胞基质悬液的细胞浓度调整为每lml约 含 107 个 细 胞 ,如 果 为 细 菌 ,则 将 其 浓 度 调 整 为 每 l m l 约 含 108 个 细 菌 。量 取 悬 液 lml,离 心 ,在 沉 淀 中 加 裂 解 液 400^1混 匀 ,37°C作 用 12〜2 4 小 时 后 ,加人饱和苯酚溶液 450^1,剧 烈 振 摇 混 匀 ,以 每 分 钟 10 0 0 0 转 离 心 1 0 分 钟 , 转 移 上 层 液 体 ,以 饱 和 苯 酚 溶 液 450M1 重 复 抽 提 1 次 ;转 移 上 层 液 体 ,加 人 三 氯 甲 烷 450^1,剧 烈 振 摇 混 匀 ,以每
中 国 药 典 2015年版
以 每 分 钟 15 0 0 0 转 离 心 1 5 分 钟 ;用 适 量 一20eC 7 0 % 乙醇 溶 液 洗 涤 沉 淀 1 次 ,以 每 分 钟 15 0 0 0 转 离 心 1 5 分 钟 ,弃 上 清 液 ,保 留 沉 淀 ,吹 至 干 燥 后 ,加 适 量 灭 菌 T E 缓冲液 溶 解 ,R N a s e 酶 切 ,苯 酚 -三 氯 甲 烷 抽 提 ,分 子 筛 纯 化 D N A , 即得。
(12) D N A 稀 释 液 取 1 % 鱼 精 D N A 溶 液 50^1,加 T E 缓 冲 液 至 10ml。
用于探针标记和阳性对照的D N A 制 备 用于探针标 记 和 阳 性 对 照 的 D N A ,由生 产供 试 品 用 的 传 代 细 胞 、工
2020版中国药典采用气相色谱法鉴定药物中残留的甲醇

2020版中国药典采用气相色谱法鉴定药物中残留的甲醇
2020版中国药典的改革宣告着全民医疗治理体系的又一次改进。
其中,最重要的一个重点是药物中残留的甲醇的鉴定。
在药物制剂中残留甲醇,对于患者和药物制剂使用有直接影响,因此有必要确定残留甲醇的大小。
2020版中国药典要求应采用气相色谱法进行鉴定。
气相色谱法是一种广泛应用于分析鉴定残留甲醇的快速有效分析方法。
它将检测样品中的化学物质进行分离以后,再充分延时,通过检测器检测样品的图谱来判断残留甲醇的真实含量。
实验操作过程中,首先将样品放入分析仪,用压缩空气进行气相色谱,并将检测结果与预设的甲醇浓度值进行比较,如果满足要求,则表明样品还原无毒符合要求,若不符合要求,则样品有残留甲醇,必须采取适当措施进行处理,以确保产品质量标准及患者安全。
气相色谱法具有灵敏度高、重现性好等优点,可用于现代药物检测中残留甲醇的分析鉴定,逐步取代传统检测方法。
根据2020版中国药典的规定,采用气相色谱法鉴定药物中残留甲醇,将有效帮助企业完成残留甲醇的检测,以确保产品的质量和安全性。
【收藏】《中国药典》2020版有特殊检验项目的品种统计

【收藏】《中国药典》2020版有特殊检验项目的品种统计1、其他有机氯类农药残留量:(5个)人参、甘草、西洋参、红参、黄芪 2、重金属及有害元素:(28个)人参、三七、山茱萸、山楂、丹参、水蛭、甘草、白芍、白芷、冬虫夏草、西洋参、当归、牡蛎、阿胶、昆布、金银花、珍珠、栀子、枸杞子、桃仁、海螵蛸、海藻、黄芪、黄精、葛根、蛤壳、蜂胶、酸枣仁。
3、黄曲霉毒素:(24个)九香虫、土鳖虫、大枣、马钱子、水蛭、地龙、肉豆蔻、延胡索、全蝎、决明子、麦芽、远志、陈皮、使君子、柏子仁、胖大海、莲子、桃仁、蜈蚣、蜂房、槟榔、酸枣仁、僵蚕、薏苡仁。
4、玉米赤霉烯酮:(1个)薏苡仁 5、【含量测定】(气相色谱法):(19个)丁香、八角茴香、土木香、千年健、广藿香、小茴香、天然冰片(右旋龙脑)、艾片(左旋龙脑)、艾叶、石斛(金钗石斛)、亚麻子、冰片(合成龙脑)、豆蔻、油松节、砂仁、鸦胆子、香薷、薄荷、麝香。
6、【鉴别】(气相色谱法):(1个)乳香 7、二氧化硫残留量:(10个)山药、天冬、天花粉、天麻、牛膝、白及、白术、白芍、党参、粉葛。
8、聚合酶链式反应-限制性内切酶长度多态性方法(PCR法):(5个)川贝母、乌梢蛇、石斛(霍山石斛)、金钱白花蛇、蕲蛇。
9、高效液相色谱-质谱法:(6个)千里光、川楝子、龟甲胶、阿胶、苦楝皮、鹿角胶。
10、特征图谱:(6个)天麻、石斛(霍山石斛)、羌活、沉香、金银花、蟾酥。
11、砷盐:(7个)石膏、玄明粉、芒硝、西瓜霜、冰片(合成龙脑)、鹿角胶、滑石粉 12、红外分光光度法:(1个)石膏 13、高效液相色谱法(蒸发光散射检测器):(20个)山银花、马鞭草、巴戟天、四季青、瓜子金、地肤子、伊贝母、知母、急性子、桔梗、益母草、浙贝母、通关藤、黄芪、银杏叶、商陆、湖北贝母、路路通、酸枣仁、薏苡仁 14、高效液相色谱法(示差折光检测器):(1个)蜂蜜 15、高效液相色谱法使用特殊色谱柱的(非C18色谱柱):15.1苯基硅烷键合硅胶为填充剂忍冬藤、金银花、莱菔子15.2辛烷基硅烷键合硅胶为填充剂土荆皮、知母、京大戟、罂粟壳15.3辛基硅烷键合硅胶为填充剂甘遂15.4辛基键合硅胶为填充剂辛夷15.5氨基键合硅胶为填充剂山豆根、使君子、枸杞子15.6强阳离子交换(SCX)色谱柱茺蔚子15.7强阳离子交换键合硅胶为填充剂(SCX-强阳离子交换树脂柱)槟榔15.8 Prevail Carbohyrate ES为色谱柱蜂蜜15.9 极性乙醚连接苯基键合硅胶为填充剂麻黄 16、薄层色谱扫描法(1个)牛黄。
外源性dna残留量测定法

外源性DNA残留量测定法第一法 DNA探针杂交法供试品中的外源性DNA经变性为单链后吸附于固相膜上,在一定温度下可与相匹配的单链DNA复性而重新结合成为双链DNA,称为杂交。
将特异性单链DNA探针标记后,与吸附在固相膜上的供试品单链DNA杂交,并使用与标记物相应的显示系统显示杂交结果,与已知含量的阳性DNA对照比对后,可测定供试品中外源性DNA的含量。
试剂(1)DNA标记和检测试剂盒(2)DNA杂交膜尼龙膜或硝酸纤维素膜。
(3)2%蛋白酶K溶液称取蛋白酶K 0.20g,溶于灭菌水10ml中,分装后储藏于-20℃备用。
(4)3%牛血清白蛋白溶液称取牛血清白蛋白0.30g,溶于灭菌水10ml中。
(5)1mol/L三羟甲基氨基甲烷(Tris)溶液(pH8.0)用盐酸调pH值至8.0。
(6)5.0mol/L氯化钠溶液(7)0.5mol/L乙二胺四乙酸二钠溶液(pH8.0)用10mol/L 氢氧化钠溶液调节pH 至8.0。
(8)20%十二烷基硫酸钠(SDS)溶液用盐酸调pH至7.2。
(9)蛋白酶缓冲液(pH8.0)量取1mol/L Tris溶液1.0ml(pH8.0),5mol/L 氯化钠溶液2.0ml,0.5mol/L乙二胺四乙酸二钠溶液(pH8.0)2.0ml,20%SDS溶液2.5 ml,加灭菌水至10ml。
(10)TE缓冲液(pH8.0)量取1mol/L Tris溶液(pH8.0)10ml,0.5mol/L乙二胺四乙酸二钠溶液(pH8.0)2ml,加灭菌水至1000ml。
(11)1%鱼精DNA溶液精密称取鱼精DNA 0.10g,置10ml量瓶中,用TE缓冲液溶解并稀释至刻度,摇匀,用7号针头反复抽打以剪切DNA成为小分子,分装后贮藏于-20℃备用。
(12)DNA稀释液取1%鱼精DNA溶液50μl,加TE缓冲液至10ml。
用于探针标记和阳性对照的DNA制备用于探针标记和阳性对照的DNA,由生产供试品用的传代细胞、工程菌或杂交瘤细胞提取纯化获得,其提纯和鉴定可参考下述推荐方案进行,具体方法可参考《分子克隆实验指南》([美]J.萨姆布鲁克等著,黄培堂等译,科学出版社,2002)或《精编分子生物学实验指南》([美]F.奥斯伯等著,颜子颖、王海林译,科学出版社,1998)。
药典三部(2015版)-通则-3407外源性DNA残留量测定法

3407 外源性DNA残留量测定法在进行外源性DNA残留量测定时,可根据供试品具体情况选择下列任何一种方法进行测定。
第一法 DNA探针杂交发供试品中的外源性DNA经变性为单链后吸附于固相膜上,在一定条件下可与相匹配的单链DNA复性而重新结合成为双链DNA,称为杂交。
将特异性单链DNA探针标记后,与吸附在固相膜上的供试品单链DNA杂交,并使用与标记物相应的显示系统显示杂交结果,与已知含量的阳性DNA对照比对后,可测定供试品中外源性DNA残留量。
试剂⑴ DNA标记和检测试剂盒⑵ DNA杂交膜尼龙膜或硝酸纤维素膜。
⑶ 2% 蛋白酶K溶液称取蛋白酶K 0.20g,溶于灭菌水(电阻率大于18.2MΩ·cm)10ml中,分装后贮藏于﹣20℃ 备用。
⑷ 3% 牛血清白蛋白溶液称取牛血清白蛋白0.30g,溶于灭菌水(电阻率大于18.2MΩ·cm)10ml中。
⑸ 1 mol/L 三羟甲基氨基甲烷(Tris)溶液(pH8.0)用适宜浓度盐酸溶液调pH值至8.0。
⑹ 5.0 mol/L氯化钠溶液。
⑺ 0.5 mol/L乙二胺四乙酸二钠溶液(pH8.0)用10mol/L氢氧化钠溶液调pH值至8.0。
⑻ 20% 十二烷基硫酸钠(SDS)溶液用盐酸调pH值至7.2。
⑼ 蛋白酶缓冲液(pH8.0)量取1 mol/L Tris溶液1.0ml(pH8.0)、5.0 mol/L氯化钠溶液2.0ml、0.5 mol/L乙二胺四乙酸二钠溶液(pH8.0)2.0ml、20% SDS溶液2.5ml、加灭菌水(电阻率大于18.2MΩ·cm)至10ml。
如供试品遇氯化钠溶液发生沉淀反应,可免加氯化钠。
⑽ TE缓冲液(pH8.0)量取1 mol/L Tris溶液(pH8.0)10ml、0.5 mol/L乙二胺四乙酸二钠溶液(pH8.0)2ml,加灭菌水(电阻率大于18.2MΩ·cm)至1000ml。
⑾ 1% 鱼精DNA溶液精密称取鱼精DNA 0.10g,置10ml量瓶中,用TE缓冲液溶解并稀释至刻度,摇晃,用7号针头反复抽打,以剪切DNA成为小分子,分装后贮藏于﹣20℃ 备用。
《中国药典》2020版—重组人胰岛素国家药品标准公示稿

重组人胰岛素
Chongzu Ren Yidaosu
Recombinant Human Insulin
本品系由含有可高效表达人胰岛素基因的工程化细胞,经发酵、分离、高度纯化、结晶和干燥制成。
重组人胰岛素为51 个氨基酸残基组成的蛋白质。
按干燥品计算,含重组人胰岛素(包括A21 脱氨人胰岛素)应为95.0%~105.0%。
每 1 单位重组人胰岛素相当于0.0347mg。
1基本要求
生产和检定用设施、原材料及辅料、水、器具等应符合“凡例”的有关要求。
2制造
2.1工程菌
本品为重组DNA技术生产的由51个氨基酸残基组成的蛋白质,工程菌菌种名称、来源及种子批检定应符合批准的要求。
2.2原料
2.2.1种子液制备
将检定合格的工作种子批细胞接种于适宜的培养基(可含适量抗生素)中培养。
2.2.2发酵用培养基
采用适宜的不含抗生素的培养基
1。
外源性DNA残留量测定法(qPCR法)
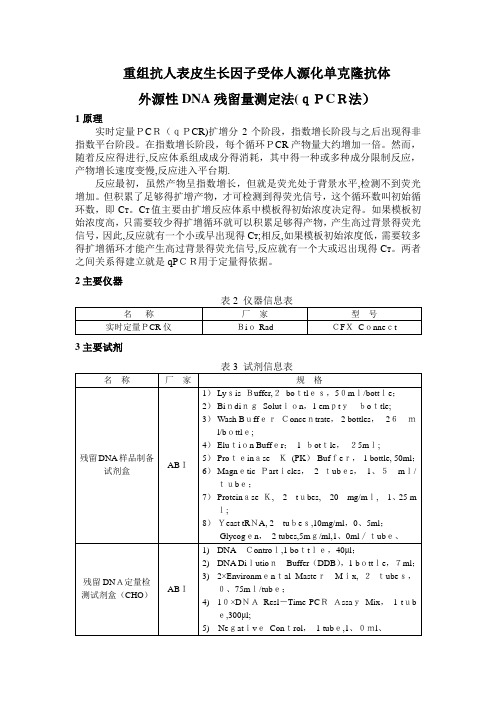
重组抗人表皮生长因子受体人源化单克隆抗体外源性DNA残留量测定法(qPCR法)1原理实时定量PCR(qPCR)扩增分2个阶段,指数增长阶段与之后出现得非指数平台阶段。
在指数增长阶段,每个循环PCR产物量大约增加一倍。
然而,随着反应得进行,反应体系组成成分得消耗,其中得一种或多种成分限制反应,产物增长速度变慢,反应进入平台期.反应最初,虽然产物呈指数增长,但就是荧光处于背景水平,检测不到荧光增加。
但积累了足够得扩增产物,才可检测到得荧光信号,这个循环数叫初始循环数,即C T。
C T值主要由扩增反应体系中模板得初始浓度决定得。
如果模板初始浓度高,只需要较少得扩增循环就可以积累足够得产物,产生高过背景得荧光信号,因此,反应就有一个小或早出现得C T;相反,如果模板初始浓度低,需要较多得扩增循环才能产生高过背景得荧光信号,反应就有一个大或迟出现得C T。
两者之间关系得建立就是qPCR用于定量得依据。
2主要仪器3主要试剂4溶液配制4、1 蛋白酶K混合液(新配)裂解混合液(新配)4、2注:DNA标准品溶液4℃放置保存1天,—20℃放置保存1周.5测定方法5、1样品处理5.1.1除蛋白1)在2ml离心管中加入100μl样品;2)每100μl得样品中加入70μl得蛋白酶K混合液,混合均匀,56℃水浴30min;3)每100μl得样品中加入360μl得裂解液,室温裂解2小时以上。
5.1.2 DNA得纯化1)磁珠使用前于37℃温浴10min,高速涡旋,彻底悬浮磁珠;2)每100μl得样品加入30μl得磁珠悬浮液;3)每100μl得样品加入300μl得BindingSolution,涡旋混合5min;4)12000r/min离心30sec,将离心管放置于磁力架上,静置5min直至溶液清澈,弃上清;5)从磁力架上取下离心管,加入300μl 得Wash Bu ffer ,涡旋混合5 sec ;6)12000r/min 离心30sec ,将离心管放置于磁力架上,静置2min,弃上清; 7)重复步骤6)1次,打开离心管得盖子,室温下风干;8)加入50μl 得Elution Bu ffer ,高速涡旋10 sec,70℃处理10min ,在温浴过程中,涡旋2~3次; 9)12000r/mi n离心30sec,将离心管放置于磁力架上,静置2min,将含有洗脱DNA 得液体转移到新得1、5ml 得离心管中,用于进行qP CR反应。
2020版药典变化全汇总

2020版药典变化全汇总一部中药收载2711种,其中新增117种、修订452种。
新增了药材:裸花紫珠。
新增制剂:116个,具体清单如下:二部化学药收载2712种,其中新增117种、修订2387种。
在药品安全性控制方面,要求进一步完善杂质和有关物质的分析方法,推广先进检测技术的应用,重点强化了对有毒有害杂质(特别是基因毒性杂质)的控制,加强了对药品安全性相关控制项目和限度标准的研究制定。
在药品有效性控制方面,要求将药品质量和疗效一致性评价的成果体现在相关制剂的质量标准提高中,进一步完善了常规固体制剂溶出及释放度检测方法,且在整体质量控制方面进一步借鉴国际要求。
2020年版药典二部新增品种(117个),与一部新增品种居然一样!未收载品种(8个),名称变化的品种(5个)。
具体清单如下:未收载品种(8个)本版药典(二部)未收载2015年版药典(二部)中的品种名单:•鱼肝油••重组人生长激素••注射用重组人生长激素••重组人胰岛素••重组人胰岛素注射液••精蛋白重组人胰岛素注射液••盐酸吡硫醇注射液••注射用盐酸吡硫醇•新增品种(117个)本版药典(二部)新增品种名单:1.注射用门冬氨酸鸟氨酸2.马来酸氟伏沙明3.马来酸氟伏沙明片4.扎来普隆5.乌苯美司片6.丙戊酸钠缓释片(I)7.丙泊酚乳状注射液(曾用名:丙泊酚注射液)8.丙酸氟替卡松9.左卡尼汀10.左甲状腺素钠11.左甲状腺素钠片12.右佐匹克隆13.右佐匹克隆片14.卡培他滨15.卡培他滨片16.甲钴胺片17.甲钴胺注射液18.甲磺酸多沙唑嗪19.甲磺酸多沙唑嗪片20.甲磺酸多沙唑嗪胶囊21.甲磺酸瑞波西汀22.甲磺酸瑞波西汀片23.甲磺酸瑞波西汀胶囊24.兰索拉唑肠溶胶囊25.矛头蝮蛇血凝酶(曾用名:蛇毒血凝酶、血凝酶)26.注射用矛头蝮蛇血凝酶(曾用名:注射用蛇毒血凝酶、注射用血凝酶)27.地红霉素肠溶片28.地红霉素肠溶胶囊29.西尼地平胶囊30.西吡氯铵31.西吡氯铵含漱液32.西咪替丁注射液33.西洛他唑片34.托拉塞米35.托拉塞米片36.托拉塞米胶囊37.注射用托拉塞米38.吗替麦考酚酯分散片39.伏格列波糖40.伏格列波糖片41.伏格列波糖胶囊42.米氮平43.米氮平片44.那他霉素45.那他霉素滴眼液46.坎地沙坦酯片47.克霉唑阴道膨胀栓[曾用名:克霉唑栓(指含膨胀棉条的克霉唑栓)]48.更昔洛韦胶囊49.来曲唑50.来曲唑片51.吲哚美辛片52.佐米曲普坦分散片53.阿托伐他汀钙54.阿利沙坦酯55.阿利沙坦酯片56.阿那曲唑片57.苯磺酸左氨氯地平58.苯磺酸左氨氯地平片59.拉西地平60.拉西地平片61.依巴斯汀62.依巴斯汀片63.草酸艾司西酞普兰64.草酸艾司西酞普兰片65.枸橼酸坦度螺酮66.枸橼酸坦度螺酮胶囊67.抗凝血用枸橼酸钠溶液[曾用名:(1)输血用枸橼酸钠注射液(适应症为仅用于单采原料血浆的体外抗凝血)K2)枸橼酸钠抗凝剂]68.枸橡酸钾颗粒69.氟尿苷(曾用名:氟脲苷)70.复方氨基酸(15)双肽(2)注射液71.美司钠72.美司钠注射液73.盐酸乙哌立松74.盐酸乙哌立松片75.盐酸左布比卡因76.盐酸左布比卡因注射液77.盐酸托烷司琼片78.盐酸托烷司琼胶囊79.盐酸曲普利啶80.盐酸伊达比星81.注射用盐酸伊达比星82.盐酸奈福泮胶囊83.盐酸度洛西汀84.盐酸度洛西汀肠溶片85.盐酸度洛西汀肠溶胶囊86.盐酸羟甲唑啉87.盐酸羟甲唑啉喷雾剂88.盐酸羟甲唑啉喷鼻液89.盐酸羟苄唑90.盐酸羟苄唑滴眼液(曾用名:羟苄唑滴眼液)91.盐酸奥布卡因92.盐酸奥布卡因滴眼液93.氨糖美辛肠溶片94.氨糖美辛肠溶胶囊95.脂肪乳注射液(C14~24)(曾用名:脂肪乳注射液)96.酒石酸溴莫尼定97.酒石酸溴莫尼定滴眼液98.酚磺乙胺99.注射用酚磺乙胺100.铝碳酸镁101.铝碳酸镁咀嚼片102.葡萄糖酸钙氯化钠注射液103.硝酸益康唑阴道膨胀栓[曾用名:硝酸益康唑栓(指含膨胀棉条的硝酸益康唑栓)]104.氯沙坦钾105.氯沙坦钾片106.氯沙坦钾胶囊107.酮咯酸氨丁三醇108.酮咯酸氨丁三醇注射液109.腺苷110.腺苷注射液[曾用名:腺苷注射液(供诊断用)]111.去氨加压素片(曾用名:醋酸去氨加压素片)112.注射用去氨加压素(曾用名:注射用醋酸去氨加压素)113.磷酸氟达拉滨114.注射用磷酸氟达拉滨115.磷酸腺嘌呤(曾用名:维生素b4)116.磷酸腺嘌呤片(曾用名:维生B4片)117.碘帕醇注射液三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。
2020版《中国药典》三部通则3204收载的戊二醛残留量测定法(高效液相色谱法)

戊二醛残留量测定法(高效液相色谱法)《中国药典》(2020版)的三部通则3204中收载了戊二醛残留量测定法,采用了高效液相色谱法(HPLC)进行检测。
本文将对该测定法进行详细介绍。
戊二醛是一种常用的消毒剂,也被广泛应用于医疗、制药和食品工业等领域。
然而,由于其具有一定的毒性和致癌性,对其残留量进行监测和控制非常重要。
《中国药典》(2020版)的三部通则3204中收录的戊二醛残留量测定法就是用于这一目的。
该测定法采用高效液相色谱法((HPLC)进行分析。
HPLC是一种广泛应用于药物分析和质量控制的分析技术,其特点是分离效果好,灵敏度高。
在戊二醛残留量的测定中,HPLC 技术可以准确、快速地分离和测定药物样品中的戊二醛。
以下是该测定法的主要步骤和操作流程:1.(样品准备:将待测样品进行合适的前处理,例如提取、固相萃取等,以获得戊二醛的纯化样品。
2.(色谱条件设置:根据具体仪器和柱的性能,优化色谱条件,包括流动相、柱温、检测波长等参数的选择与调整。
3.(样品注射:将纯化的样品注入到色谱仪中,一般采用自动进样器进行精确控制。
4.(色谱分离:在设定的色谱条件下,样品中的戊二醛与色谱柱发生相互作用,分离出各组分。
5.(检测和定量:利用紫外可见光检测器检测样品中戊二醛的吸收峰,并根据标准曲线或外标法进行定量分析。
6.(结果分析:计算出样品中戊二醛的浓度,并与相应的规定限度进行比较,判断样品是否符合要求。
通过上述步骤,该测定法能够准确、可靠地测定样品中的戊二醛残留量,为药物生产等领域的质量控制提供重要参考。
需要注意的是,该测定法的操作人员应具备一定的理论知识和实验技能,确保操作的准确性和可重复性。
同时,还需要严格控制实验条件和各项参数,以确保测试结果的准确性和可信度。
综上所述,《中国药典》(2020版)部通则3204中收载的戊二醛残留量测定法采用了高效液相色谱法((HPLC),该方法具有准确、灵敏的特点,对戊二醛残留量进行测定具有重要意义。
外源性DNA残留量检测

外源性DNA残留量检测1.目的描述外源性DNA残余量检定(地高辛法)的操作过程和注意事项。
2.材料及设备2.1试剂试液无水乙醇。
Tris饱和酚。
三氯甲烷。
异戊醇。
吐温20。
20%十二烷基硫酸钠(SDS)溶液,用盐酸调pH至7.2。
0.2mol/L乙二胺四乙酸二钠溶液(pH8.0)。
3mol/L醋酸钠溶液。
20×SSC溶液:0.3mol/L柠檬酸钠,3mol/L NaCl,调pH至7.0。
Buffer I (0. lmol/L Tris-HCl,0.15mol/L NaCI,用固体NaOH调pH7. 5)。
Buffer Ⅲ (100mmo1/L Tris-HCl 100mmo1/L NaCI, 50mmo1/LMgCl2,pH9. 5)。
TE缓冲液(pH8.0):量取1mol/L Tris溶液(pH8.0)10ml,0.5mol/L EDTA溶液(pH8.0)2ml, 加灭菌水至1000ml。
ECORI内切酶(宝生物工程(大连)有限公司)BamHI内切酶(宝生物工程(大连)有限公司)2.2材料和用具细菌基因组DNA提取试剂盒(天根生物)批号H6611琼脂糖凝胶DNA回收试剂盒(天根生物)批号I7908外源DNA残留量检测试剂盒(Roche)货号:11745832910和1109365791尼龙膜(PALL 0.45微米)点样器(Bio-RAD;Model No:Bio-Dot SF Cell;Serial No:160BR07680)、移液器、tip 头、恒温水浴锅、超净工作台、冰盒、离心机、三维旋混仪、电磁炉3.操作原理用随机启动法,将地高辛甙元标记的脱氧尿苷三磷酸掺入未标记DNA,通过一个手臂将dUTP与载体半抗原地高辛甙元连接起来(dig-dUTP)。
与目的DNA杂交后,杂交分子用酶联免疫法检测;应用抗体-酶联接物(抗地高辛甙元-碱性磷酸酶复合物)和随后用酶促颜色反应使5-溴-4-氯-3-吲哚磷酸(BCIP)和氮蓝四唑(NBT)显色。
《中国药典》2020版—单抗分子大小变异

3127 单抗分子大小变异体测定法(CE-SDS 法)本法系采用十二烷基硫酸钠毛细管电泳(CE-S D S)紫外检测方法,在还原和非还原条件下,依据分子量大小,按毛细管电泳法(通则0542),定量测定重组单克隆抗体产品的纯度。
毛细管电泳系统(1)检测器紫外或二极管阵列检测器。
波长:214 nm(紫外检测器)或 220 nm(二极管阵列检测器)。
(2)毛细管非涂层-熔融石英毛细管(内径50μm),选择合适长度以满足系统适应性要求。
试剂(1)S D S样品缓冲液:含1%S D S的0.04m o l/L磷酸盐溶液(p H6.5)或等效缓冲液。
(2)SDS 凝胶分离缓冲液:含0.2% SDS 缓冲液(pH8.0)含有适当的亲水性聚合物作为分子筛或等效缓冲液。
(3)0.1m ol/L盐酸溶液或其他适宜浓度。
(4)0.1m ol/L氢氧化钠溶液或其他适宜浓度。
(5)2-巯基乙醇。
(6)烷基化溶液0.8m ol/L的碘乙酰胺水溶液,可称取约74mg 碘乙酰胺,加入500μL超纯水溶解,新鲜制备,避免光照。
(7)系统适用性对照品溶液终浓度 1mg/mL。
供试品制备(1)供试品溶液制备用 SDS 样品缓冲液将供试品稀释至 1mg/mL。
样品缓冲液以相同稀释倍数稀释,为空白对照。
(2)非还原供试品溶液制备取供试品溶液(1m g/m L)95μL,加入0.8m ol/L碘乙酰胺水溶液5μL,涡旋混匀。
取空白对照95μL,加入 0.8 m ol/L碘乙酰胺水溶液5μL,涡旋混匀,为非还原空白对照。
(3)还原供试品溶液制备取供试品溶液(1 mg/mL)95μL,加入 2-巯基乙醇5μL,涡旋混匀。
取空白对照95μL,加入2-巯基乙醇5μL,涡旋混匀,为还原空白对照。
将供试品溶液和空白对照在68~72℃孵育,非还原供试品溶液孵育 5 分钟,还原供试品溶液孵育 15 分钟。
冷却至室温后每分钟 6000 转离心 1 分钟。
从样品管中分别取出75μL至样品瓶中,立即进行分析。
二氧化硫残留量测定法操作规程(2020版药典)

二氧化硫残留量测定法标准操作规程目的:建立二氧化硫残留量测定法标准操作规程范围:适用于二氧化硫残留量测定法操作职责:QC检验人员对本操作规程实施负责依据:《中国药典》2020年版四部238页通则2331规程:1简述二氧化硫残留量测定法系用蒸馏法测定经硫黄熏蒸处理过的药材或饮片中二氧化硫的残留量。
除另有规定外,按下列方法测定。
2仪器和用具2.1仪器磁力搅拌器、电热套。
2.2用具 1000ml两颈圆底烧瓶、竖式回流冷凝管、(带刻度)分液漏斗。
2.3试剂和试液 6mol/L盐酸溶液、淀粉指示液、碘滴定液(0.01mol/L)、氮气。
3操作方法取药材或饮片细粉约10g(如二氧化硫残留量较髙,超过1000mg/kg,可适当减少取样量,应不少于5g) ,精密称定,置两颈圆底烧瓶中,加水300~400ml。
打开回流冷凝管开关给水,将冷凝管的上端口处连接一橡胶导气管置于100ml锥形瓶底部。
锥形瓶内加入3%过氧氢溶液50ml作为吸收液(橡胶导气管的末端应在吸收液液面以下)。
使用前,在吸收液中加人3滴甲基红乙醇溶液指示剂(2.5mg /ml) ,并用0.01mol/L氢氧化钠滴定液滴定至黄色(即终点;如果超过终点,则应舍弃该吸收溶液)。
开通氮气,使用流量计调节气体流量至约0.2L/min;打开分液漏斗的活塞,使盐酸溶液(6mol/L)10ml流入蒸馏瓶,立即加热两颈烧瓶内的溶液至沸,并保持微沸;烧瓶内的水沸腾1.5小时后,停止加热。
吸收液放冷后,置于磁力搅拌器上不断搅拌,用氢氧化钠滴定液(0.01mol/L) 滴定,至黄色持续时间20秒不褪,并将滴定的结果用空白实验校正。
照下式计算:(A-B)×C×0.032×106供试品中二氧化硫残留量(µg/g)=WA为供试品溶液消耗氢氧化钠滴定液的体积,ml;B 为空白消耗氢氧化钠滴定液的体积,ml;C为氢氧化钠滴定液摩尔浓度,mol/L;0.032为lml氢氧化钠滴定液(l mol/L )相当的二氧化硫的质量,g;W 为供试品的重量,g。
2020药典三部,收载品种变化情况

本版药典(三部)新增品种名单预防类•23价肺炎球菌多糖疫苗•无细胞百白破b型流感嗜血杆菌联合疫苗•黄热减毒活疫苗•冻干人用狂犬病疫苗(人二倍体细胞)•S a b i n株脊髓灰质炎灭活疫苗(V e r o细胞)•口服I型I I I型脊髓灰质炎减毒活疫苗(人二倍体细胞)治疗类•马破伤风免疫球蛋白F(a b')2•人凝血酶•人干扰素α2b阴道泡腾片•外用人粒细胞巨噬细胞刺激因子凝胶•康柏西普眼用注射液•精蛋白人胰岛素混合注射液(30R)•精蛋白人胰岛素混合注射液(50R)•甘精胰岛素•甘精胰岛素注射液•赖脯胰岛素•赖脯胰岛素注射液•治疗用卡介苗体外诊断类•人类免疫缺陷病毒抗原抗体诊断试剂盒(酶联免疫法)•乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒1型核酸检测试剂盒二部转三部品种•人胰岛素•人胰岛素注射液•精蛋白人胰岛素注射液•注射用人生长激素本版药典(三部)采用生物制品通用名称与原通用名称对照本版药典(三部)新增的生物制品通则/总论/通则和指导原则名单一、新增的生物制品通则•生物制品通用名称命名原则二、新增的总论•人用聚乙二醇化重组蛋白及多肽制品总论•人用基因治疗制品总论•生物制品病毒安全性控制•螨变应原制品总论人用马免疫血清制品总论三、新增的通则和指导原则•3128抗毒素/抗血清制品分子大小分布测定法•3129单抗电荷变异体测定法•3130单抗N糖谱测定法•3208人血白蛋白铝残留量测定法(第二法)•3303鼠源性病毒检査法(第二法)•3307黄热减毒活疫苗猴体试验•3308禽源性病毒荧光定量P C R(Q-P C R)检查法•3407外源性D N A残留量测定法(第三法)•3428人免疫球蛋白类制品I g A残留量测定法•3429免疫化学法•3503人用狂犬病疫苗效价测定法(第二法)•3534S a b i n株脊髓灰质炎灭活疫苗效力试验•3535康柏西普生物学活性测定法•3601生物制品生产及检定用实验动物质量控制•3603重组胰蛋白酶•3650氢氧化铝佐剂•9401生物制品生物活性/效价测定方法验证指导原则•9402生物制品稳定性试验指导原则生物制品术语本版药典(三部)未收载2015年版药典(三部)及增补本中的品种名单治疗类•注射用重组链激酶体外诊断类•梅毒快速血桨反应素诊断试剂•梅毒甲苯胺红不加热血清试验诊断试剂。
《中国药典》2020版—通则3407外源性DNA残留量测定法第三法公示稿

《中国药典》2020版—通则3407外源性DNA残留量测定法第三法公示稿通则3407 外源性DNA 残留量测定法第三法公示稿定量PCR 法PCR 反应过程中可通过荧光标记的特异性探针或荧光染料掺入而检测PCR产物量,通过连续监测反应体系中荧光数值的变化,可即时反映特异性扩增产物量的变化。
在反应过程中所释放的荧光强度达到预设的阈值时,体系的PCR 循环数(Ct 值)与该体系所含的起始DNA 模板量的对数值呈线性关系。
采用已知浓度的DNA 标准品,依据以上关系,构建标准曲线,对特定模板进行定量分析,测定供试品中的外源DNA 残留量。
试剂(1)PCR 反应预混液(2×) 含MgCl2、扩增酶、dNTPs 等,按试剂使用说明书要求配制,或符合条件的其它配方预混液。
(2)TE 缓冲液(pH 8.0)同方法一。
(3)荧光标记探针用TE 缓冲液稀释至100μmol/L,-20℃保存。
(4)正向和反向序列检测引物用TE 缓冲液稀释至100μmol/L,-20℃保存。
(5)碘化钠溶液(6mol/L 碘化钠,15 mmol/L EDTA,0.5%月桂酰肌氨酸钠,25mmol/L Tris-HCl pH 8.0 以及35μg/ml 糖原):配制100ml 碘化钠溶液,先取干净的烧杯置于磁力搅拌器上,依次加入以下成分,同时用搅拌子不断搅拌混匀:50ml 的无核酸酶水,3.0 ml 的0.5 mol/L EDTA 溶液,2.5ml 的1 mol/L Tris-HCl pH 8.0,缓慢加入89.93g 的碘化钠,加入适量的无核酸酶水至100 ml(可根据需要等比增加或减少)。
用0.2 微米孔径的尼龙膜过滤溶液。
避光4℃(6)2%蛋白酶K 溶液同方法一。
(7)蛋白酶K 缓冲液(10×),同方法一但不加氯化钠,或按蛋白酶K 试剂说明书要求配制。
(8)推荐的检测探针及引物CHO 细胞探针: 5ˊFAM-ACTCGCTCTGGAGACCAGGCTGGC-TAMRA3ˊ正向引物: 5ˊ-TGTGTAGCTTTGGAGCCTATCCT-3ˊ反向引物: 5ˊ-CAGCACTCGGGAGGCAGA-3ˊ大肠杆菌探针: 5ˊ FAM-CGGTGCTGCGACGGCGGAGT-TAMRA3ˊ正向引物: 5ˊ-GAAAGTAACACCAGCGTGCG-3ˊ反向引物: 5ˊ-CCAATGCATTAACGCTGGCA-3ˊ毕赤酵母探针: 5ˊ FAM-TAACTACGGTTGATCGGACGGGAAA-TAMRA3ˊ正向引物: 5ˊ-ACACTACTCGGTCAGGCTCT-3ˊ反向引物: 5ˊ-TTTCGGTTGCGGCCATATCT-3ˊNS0 细胞探针: 5ˊ FAM-AGGGCCCCCAATGGAGGAGCT-T AMRA3ˊ正向引物: 5ˊ-CCCCTTCAGCTCCTTGGGTA-3ˊ反向引物: 5ˊ-GCCTGGCAAATACAGAAGTGG-3ˊVero 细胞探针: 5ˊ FAM-CCTTCAAGAAGCCTTTCGCTAAG-TAMRA3ˊ正向引物: 5ˊ-GCTTTCTGAGAAACTGCTCTGTGT-3ˊ反向引物: 5ˊ-GGAAGATATTTCCTTTTTCACCATAGC-3’(9)DNA 共沉淀染色剂(10)清洗液A 按试剂(5)方法配制,含碘化钠37.5g,1 mol/L Tris 缓冲液(pH8.4)) 2.0ml,0.5M EDTA 溶液(pH8.4) 2.0ml,异丙醇50ml,N-月桂酰肌氨酸钠0.5% (w/v),加去离子水至总体积(11)清洗液B 含有35 μg/ml 糖原的乙醇(70%)水溶液。
【2020版中国药典】通则-非无菌微生物限度检查

【2020版中国药典】通则-非无菌微生物限度检查1105非无菌产品微生物限度检查:微生物计数法微生物计数法系用于能在有氧条件下生长的嗜温细菌和真菌的计数。
当本法用于检查非无菌制剂及其原、辅料等是否符合规定的微生物限度标准时,应按下述规定进行检验,包括样品的取样量和结果的判断等。
除另有规定外,本法不适用于活菌制剂的检查。
学习:将旧版的“相应”更换为“规定”,更便于按照1107进行判定执行。
微生物计数试验环境应符合微生物限度检查的要求。
检验全过程必须严格遵守无菌操作,防止再污染,防止污染的措施不得影响供试品中微生物的检出。
洁净空气区域、工作台面及环境应定期进行监测。
学习:将旧版的“单向流空气区域”更换为“洁净空气区域”。
计数方法……供试品检查时,应根据供试品理化特性和微生物限度标准等因素选择计数方法,检测的样品量应能保证所获得的试验结果能够判断供试品是否符合规定。
所选方法的适用性须经确认。
……提示:后文增加了对于“贵重药品、微量包装药品”的检验量的更全面的表述,因注意结合此处的要求。
计数培养基适用性检查和供试品计数方法适用性试验……菌液制备……取黑曲霉的新鲜培养物加人适量含0.05%(ml/ml)聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液或……学习:此处改动同无菌检查法,将“3~5ml”的具体量调整为“适量”,便于根据孢子的量灵活掌握菌液制备方法。
培养基适用性检查微生物计数用的商品化的预制培养基、由脱水培养基或按处方配制的培养基均应进行培养基适用性检查。
学习:类似于无菌检查法,此处将“成品培养基”修改为“商品化的预制培养基”,表述更准确,下文还有,不再赘述。
……计数方法适用性试验1.供试液制备根据供试品的理化特性与生物学特性,采取适宜的方法制备供试液。
供试液制备若需加温时,应均匀加热,且温度不应超过45°C。
供试液从制备至加人检验用培养基,不得超过1小时。
……学习:此处应注意同时进行数个品种计数方法适用性试验时的时效问题。
2020版药典植物类33种禁用农药残留

2020版药典植物类33种禁用农药残留检测方法2020年6月,《中国药典》2020年版正式出版。
33种禁用农药正式列入2020版《中国药典》四部通则《0212药材和饮片检定通则》。
2020版药典在四部通则《2341 农药残留量测定法》中新增第五法“药材及饮片(植物类)中禁用农药多残留测定法”。
第五法要求采用气相色谱-串联质谱法和液相色谱-串联质谱法,对药材及饮片(植物类)33种禁用农药及其代谢物,异构体共54个残留物进行测定。
1.气相色谱-串联质谱法色谱条件用(50%苯基)-甲基聚硅氧烷为固定液的弹性石英毛细管柱(柱长为30m,柱内径为0.25mm,膜厚度为0.25um)。
进样口温度250℃,不分流进样。
载气为高纯氦气(He)。
进样口为恒压模式,柱前压力为146kPa。
程序升温:初始温度60℃,保持1分钟,以30℃/min升至120℃,再以每分钟10℃的速率升温至160℃,再以每分钟2℃的速率升温至230℃,最后以每分钟15℃的速率升温至300℃,保持6分钟。
质谱条件以三重四极杆串联质谱仪检测;离子源为电子轰击源(EI),离子源温度250℃。
碰撞气为氮气或氩气。
质谱传输接口温度250℃。
质谱监测模式为多反应监测(MRM),各化合物参考保留时间、监测离子对、碰撞电压(CE)见表6。
为提高检测灵敏度,可根据保留时间分段监测各农药。
2.高效液相色谱-串联质谱法色谱条件以十八烷基硅烷键合硅胶为填充剂(柱长10cm,内径为2.1mm,粒径为2.6um);以0.1%甲酸溶液(含5mmol/L甲酸铵)为流动相A,以乙-0.1%甲酸溶液(含5mmol/L甲酸铵)(95:5)为流动相B,按下表5进行梯度洗脱;流速为每分钟0.3ml,柱温为40℃。
质谱条件以三重四极杆串联质谱仪检测;离子源为电喷雾(ESI)离子源,正离子扫描模式。
监测模式为多反应监测(MRVD,各化合物参考保留时间、监测离子对、碰撞电压(CE)见表7。
外源DNA残留量测定(荧光定量PCR法)标准操作规程SOP

外源性DNA残留量测定法(荧光定量PCR法)标准操作规程文件编码:XXXXXX目录1.目的 (1)2.范围 (1)3.职责 (1)4.依据 (1)5.定义 (1)6.内容 (1)6.1.原理 (1)6.2.实验材料 (1)6.3.操作步骤 (3)6.4.结果计算 (6)6.5.判定标准 (7)6.6.注意事项 (7)7.相关文件 (7)8.附件 (7)9.变更历史 (7)1.目的1.1.规范外源性DNA残留量测定法(荧光定量PCR法)的操作过程。
2.范围2.1.本规程适用于采用荧光定量PCR法对CHO细胞表达产品进行外源性DNA残留量的测定。
3.职责3.1.方法学研究员负责严格执行本规程规定;3.2.质量研究室负责人负责本规程的培训并监督本规程的执行。
4.依据4.1.DNA残留量检测样品处理试剂盒(PrepSEQ TM Residual DNA Sample Preparationkit,Applied Biosysterms)使用说明书。
5.定义5.1.LTR:long tandem repeat,长串联重复序列5.2.PCR:Polymerase Chain Reaction,聚合酶链式反应5.3.Ct:阈值循环,即荧光信号强度超过设置的阈值强度时所经历的循环数6.内容6.1.原理CHO工程细胞所表达的蛋白质产品,其外源性DNA残留量的测定采用荧光定量PCR法。
该方法是以荧光定量PCR仪为设备平台基础,选择CHO细胞中含量较丰富的一段LTR(long tandem repeat,长串联重复序列)为靶标序列设计扩增引物,建立基于Taqman探针的定量检测实验。
用已知量的CHO细胞基因组DNA做标准曲线,通过对Ct值进行线性回归计算样品中DNA的含量。
6.2.实验材料6.2.1.试药与试液灭菌水使用电阻率不低于18.2MΩ·cm的超纯水,121℃灭菌20分钟以上。
本方法所有试液均用灭菌水配制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
通则3407 外源性DNA 残留量测定法第三法公示稿
定量PCR 法
PCR 反应过程中可通过荧光标记的特异性探针或荧光染料掺入而检测PCR
产物量,通过连续监测反应体系中荧光数值的变化,可即时反映特异性扩增产物量
的变化。
在反应过程中所释放的荧光强度达到预设的阈值时,体系的PCR 循环数(Ct 值)与该体系所含的起始DNA 模板量的对数值呈线性关系。
采用已知浓度的DNA 标准品,依据以上关系,构建标准曲线,对特定模板进行定量分析,测
定供试品中的外源DNA 残留量。
试剂(1)PCR 反应预混液(2×) 含MgCl2、扩增酶、dNTPs 等,按试剂使
用说明书要求配制,或符合条件的其它配方预混液。
(2)TE 缓冲液(pH 8.0)同方法一。
(3)荧光标记探针用TE 缓冲液稀释至100μmol/L,-20℃保存。
(4)正向和反向序列检测引物用TE 缓冲液稀释至100μmol/L,-20℃保存。
(5)碘化钠溶液(6mol/L 碘化钠,15 mmol/L EDTA,0.5%月桂酰肌氨酸钠,25mmol/L Tris-HCl pH 8.0 以及35µg/ml 糖原):配制100ml 碘化钠溶液,先取干
净的烧杯置于磁力搅拌器上,依次加入以下成分,同时用搅拌子不断搅拌混匀:
50ml 的无核酸酶水,3.0 ml 的0.5 mol/L EDTA 溶液,2.5ml 的1 mol/L Tris-HCl pH 8.0,缓慢加入89.93g 的碘化钠,加入适量的无核酸酶水至100 ml(可根据需要
等比增加或减少)。
用0.2 微米孔径的尼龙膜过滤溶液。
避光4℃储藏。
(6)2%蛋白酶K 溶液同方法一。
(7)蛋白酶K 缓冲液(10×),同方法一但不加氯化钠,或按蛋白酶K 试
剂说明书要求配制。
(8)推荐的检测探针及引物
CHO 细胞
探针: 5ˊFAM-ACTCGCTCTGGAGACCAGGCTGGC-TAMRA3ˊ
正向引物: 5ˊ-TGTGTAGCTTTGGAGCCTATCCT-3ˊ
反向引物: 5ˊ-CAGCACTCGGGAGGCAGA-3ˊ
大肠杆菌。
