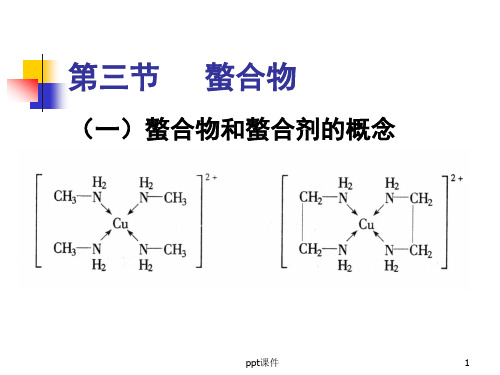
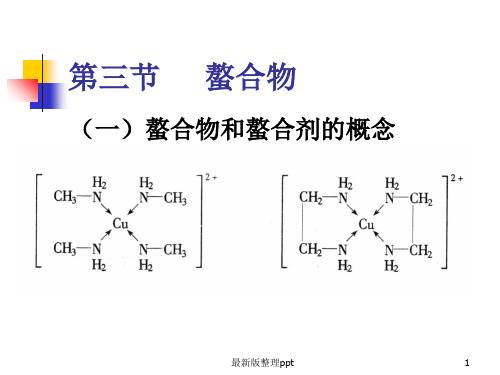
一螯合物和螯合剂的概念
螯合物的定义

螯合物的定义螯合物是一种具有一定稳定性的化合物,能将可溶或不可溶性金属离子、络合阴离子、络合阳离子等包括在分子内部而形成复杂的分子螯合体。
螯合物是目前发展最快、应用范围较广泛的络合剂之一,它被誉为“绿色”、“天然”、“安全”的稀土元素络合剂,在国防、航空航天、医疗卫生等领域均得到了极其重要的应用。
因此对其进行研究就显得尤为必要了。
在众多对镧系元素络合物的研究中,螯合剂的应用占据了相当大的比例。
因此螯合剂在镧系金属络合物的研究与开发上扮演着举足轻重的角色。
随着螯合理论研究和应用水平的不断提高,我们发现镧系元素络合物在络合物结构、电子结构、配位数及电荷数量等方面存在着较大差异,从而导致了镧系元素络合物的多样性,这也给研究者带来了新的挑战。
对于镧系元素络合物,已经做过许多研究工作。
然而由于对镧系元素的认识还只停留在实验阶段,故而没有任何关于镧系元素络合物的计算机模拟程序。
近年来有些学者运用各种数值计算软件进行了镧系元素络合物的数值计算。
这些研究使得大家认识到科学技术飞速发展所带来的巨大影响力,但是它们都是通过经验公式建立起来的,缺乏对实际计算结果的检验,同时又难免会受到实验条件的限制。
螯合剂的出现使得镧系金属络合物的结构和性质逐渐清晰明朗起来,并且随着镧系金属络合物的分析测试手段的不断完善和精密,研究者能够直接获取实验数据进行分析,从而为相关研究打开一扇大门。
近年来研究者在镧系元素络合物的研究上取得了许多突破,如控制加热温度可以增强络合反应的速率;控制反应时间则可以减小络合物中间态浓度;而控制螯合剂的摩尔组成和螯合物中所含阴离子则可以调整络合物的分解温度等。
在最近的研究中人们意外地发现铕- EDTA 络合物的稳定性超越了大多数 EDTA 络合物,不仅能长期稳定存在,而且在其后可以再次与镧系元素发生络合反应。
而且还发现在与钙、镁、铝三种镧系元素络合物的实验研究中,发现与钙络合物的稳定性更好。
此外,镧系金属络合物在液体中的保存期限也比传统的络合剂长。
螯合物知识点

螯合物知识点螯合物是指含有一个或多个配位基与中心金属离子形成稳定配位键的化合物。
螯合物在化学、环境科学和生物学等领域中具有重要应用。
本文将从基础概念、螯合物的形成与性质、应用以及未来发展等方面介绍螯合物的知识点。
1. 基础概念螯合物的概念最早由法国化学家阿尔弗雷德·文伯(Werner)于19世纪末提出。
螯合物由一个或多个配位基(通常是有机物分子或离子)与中心金属离子形成稳定的配位键,形成一个整体稳定的结构。
2. 螯合物的形成与性质螯合物的形成是通过配位键的形成而实现的。
配位基通常通过提供自由电子对与金属离子形成配位键。
螯合物具有以下几个特点:•稳定性:螯合物能够通过配位键的形成增加化合物的稳定性,使其在不同条件下保持稳定结构。
•水溶性:由于螯合物通常具有较大的极性,因此在水溶液中具有良好的溶解性。
•选择性:螯合物的形成可以导致与金属离子的高度选择性结合,从而实现对特定金属离子的识别和分离。
3. 螯合物的应用螯合物在许多领域中具有广泛的应用。
以下是几个重要的应用领域:3.1 化学分析螯合物可以用于分析化学中的金属离子的检测与定量。
通过选择合适的螯合剂,可以实现对特定金属离子的高度选择性识别和分离,从而实现对复杂样品中金属离子的分析。
3.2 医药领域螯合物在医药领域中有广泛应用。
例如,铁离子螯合物可以用作治疗贫血的药物,钙离子螯合物可以用于治疗骨质疏松症等。
3.3 环境科学螯合物在环境科学领域中也具有重要应用。
例如,螯合物可以用于处理废水中的金属离子,使其形成不溶性沉淀物,从而实现对金属离子的去除和废水的净化。
4. 螯合物的未来发展螯合物的研究和应用仍在不断发展。
随着对环境污染和资源稀缺的关注加大,对绿色和可持续发展的需求增加,螯合物的设计和合成也向着更高效、可再生和环境友好的方向发展。
总之,螯合物作为一种特殊的化合物,在化学、环境科学和生物学等领域中具有广泛的应用。
通过了解螯合物的基础概念、形成与性质、应用和未来发展,我们可以更好地理解和应用螯合物,为解决相关问题提供有效的解决方案。
螯合剂种类总结及其在不同pH下的对金属离子的螯合能力比较

螯合剂的种类及其在不同pH值条件下螯合剂的螯合常数一、螯合剂与螯合物具有可供配位孤电子对的分子、原子或离子的化合物能够与具有空轨道的金属离子形成配位键,该化合物称为络合物,如能与配位金属离子形成环状结构的化合物称为螯合剂,形成的络合物称为螯合物。
螯合剂中至少含有一对孤电子对,而金属离子必须有空的价电子轨道,孤电子对填充入金属离子空轨道,电子对属2个原子共享,形成配位键,中心金属离子空轨道杂化。
不同的提供孤电子对的配位体分别与不同金属离子形成正四面体、正六面体、正八面体的螯合物。
1.类型1.1无机类螯合剂聚磷酸盐螯合剂:主要是三聚磷酸钠(STPP)、六偏磷酸钠、焦磷酸钠为主,含磷酸基空间配位基团。
特点:高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,一般只适合在碱性条件下作螯合剂。
1.2有机类螯合剂形态分析表明螯合剂提取的重金属主要来源于可交换态或酸溶态、还原态和氧化态。
1.21羧酸型(1)氨基羧酸类:含羧基和胺(氨基)配位基团,如乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸(DTPA)及其盐等。
如:EDTA的4个酸和2个胺(—NRR′)的部分都可作为配体的齿,两个氮原子和四个氧原子可提供形成配位键的电子对。
特点:络合能力强,络合稳定常数大,耐碱性好,但分散力弱且不易被生物降解。
(2)羟基羧酸类含羟基、羧基配位基团这类羧酸主要是柠檬酸(CA)、酒石酸(TA)和葡萄糖酸(GA)。
特点:可生物降解,在酸性条件下羟基与羧基不会离解为氧负离子,因而络合能力很弱,不适宜在酸性介质中应用。
(3)羟氨基羧酸类这类酸用作螯合剂的典型代表是羟乙基乙二胺三乙酸(HEDTA)和二羟乙基甘氨酸(DEG)。
特点:大多易于生物降解,在pH=9的弱碱性条件下可螯合铁离子,但对其他离子螯合能力较差。
1.22有机多元膦酸羟基亚乙基-1,1-二膦酸(HEDP)、氨基三亚甲基膦酸(A TMP)、二乙烯三胺五亚甲基膦酸(HTPMP)、三乙烯四胺六亚甲(TETHMP)、双(1,6-亚己基)三胺五亚甲基膦酸(BNHMTPMP)、多氨基多醚基四亚甲基膦酸(PAPEMP)。
螯合剂知识

螯合剂知识一、螯合剂的概念由一个简单正离子(称为中心离子)和几个中性分子或离子(称为配位体)结合而成的复杂离子叫配离子(又称络离子),含有配离子的化合物叫配位化合物。
在配合物中中心离子与配位体通过配位键结合。
配位键是一种特殊的共价键,通常的共价键是由两个成键·原子绷出一个电子形成共同电子对的,而在配位键中是由一个原子提供电子对,另一原手提供攀删道形成的。
为了区别把共价键用“一”表示,如H·+·H =H:H(H—H),配位键奶删“←”表示,箭头指向提供空轨道的原子,如Cu+NH3=CuNH3(Cu←NH3)。
如果配位体中只有一个配位原子,则中心离子与配位体之间只能形成一个配位键。
而有些配位体分瑚中含有两个以上的配位原子而且这两个原子间相隔着两至三个其他非配位原子时,:这个硼体就可以与中心离子(或原子)同时形成两个以上的配位键,并形成一个包括两个配位剿五元或六元环的特殊结构,把这种配合物称为螯合物。
螯合物比一般配合物更稳定。
把能形成螯合物的配位体叫整合剂。
螯合剂包括无机和有机两类。
它们在清洗过程中蕉着重要用途。
二、无机金属离子螯合剂聚磷酸盐螯合剂的缺点是它们在高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,兰般只适合在碱性条件下作螯合剂。
一般说来这些无机螯合剂对重金属离子特别是铁离子的螯合能力较差。
由于以上缺点,使无机螯合剂的用途受到限制,通常只用于对钙、镁离子螯合,所以常作为硬水软化剂。
三、有机金属离子螯合剂能与重金属离子起螯合作用的有机化合物很多,如羧酸型、有机多元膦酸等。
1.羧酸型在清洗剂中使用的羧酸型螯合剂主要有氨基羧酸类和羟基羧酸类等。
(1)氨基羧酸类氨基羧酸用作螯合剂的有乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸及其盐等。
它们对钙、镁离子均有较强的螯合作用。
从单位质量的三种酸螯合钙离子的数量看,以NTA螯合最多,ZDTA其次,DTPA再次。
EDTA与螯合剂 ppt课件
ppt课件
10
溶液中螯合物的稳定性除决定于螯 合物稳定常数的大小外,还与溶液 的pH值有关。不同的金属离子与 EDTA生成的螯合物的稳定性不同, 滴定时所需溶液的pH值也不同。因 此,在两种以上金属离子的混合溶 液中,常可以通过调节溶液的pH值, 用EDTA进行选择滴定。
ppt课件
11
例如,在Mg2+离子和Zn2+离子的混合
测定水的总硬度时加NH3-NH4Cl缓 冲溶液调节pH ≈ 10,以铬黑T为指 示剂,用EDTA标准溶液滴定。溶液 中有关配合物的稳定性有如下顺序:
CaY2- > MgY2- >MgIn - > CaIn-
ppt课件
20
反应式如下:
加指示剂时:
Mg2+ + HIn2- ⇌ MgIn - + H+
蓝 紫红
ppt课件
18
可加入某种掩蔽剂(此试剂能与干 扰离子结合成更稳定的配合物,而 对被测离子无影响),把干扰离子 掩蔽起来,再滴定被测离子。例如 EDTA滴定Ca2+ Mg2+时,少量Fe3+, Al3+有干扰,可加入三乙醇胺消除 干扰。
ppt课件
19
(三)EDTA螯合滴定
示例-水的总硬度测定
水的总硬度是指水中Ca2 + , Mg2+ 的总硬度(以为mmol ·L-1单位)
12
(二)EDTA螯合滴定的基本原理
EDTA螯合滴定就是基于EDTA与
金属离子螯合反应的一种重要的滴定分 析方法,常用于测定溶液中金属离子的 含量。
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。 它们是一类能与金属离子形成有色配合 物的水溶性有机染料。
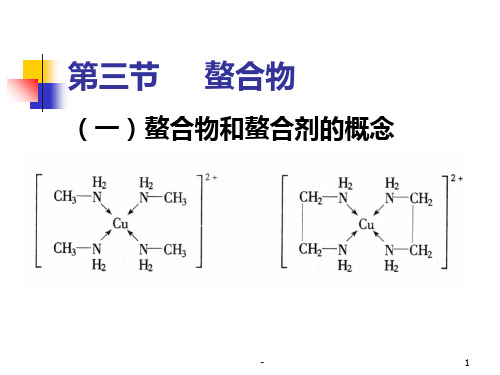
(一)螯合物和螯合剂的概念PPT课件
-
6
CaY2-的结构
-
7
EDTA与金属离子的配合有以下特点:
1.螯合能力强 除碱金属以外,能与 几乎所有的金属离子形成稳定的螯 合物。
2.与金属离子形成的螯合物大多带 有电荷,因此易溶于水。
-
8
3.简单的螯合比 不论几价的金属离子, 它们与EDTA总是1:1螯合。例如:
M2++H2Y2--MY2 - +2H + M3++H2Y2--MY - +2H + M4++H2Y2--MY +2H +
-
12
(二)EDTA螯合滴定的基本原理
EDTA螯合滴定就是基于EDTA与
金属离子螯合反应的一种重要的滴定分 析方法,常用于测定溶液中金属离子的 含量。
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。 它们是一类能与金属离子形成有色配合 物的水溶性有机染料。
-
13
作为金属指示剂必须具备以下条件: 1.与金属离子形成的配合物的颜色 与其本身(即未配合时)的颜色有 明显不同;
Ca2++H2Y2- ⇌ CaY2- +2H+ Mg2+ + H2Y2- ⇌MgY2- +2H+
滴定终点时:
MgIn-+ H2Y2- ⇌MgY2- +HIn- +H+
紫红
蓝
-
21பைடு நூலகம்
水的总硬度按下式计算:
总硬度= 式中:
CEDTVAEDTA V水样 1000
CEDTA: EDTA 标准溶液的浓度( mol ·L-1 ) VEDTA : 消耗EDTA标准溶液的体积(L) V: 滴定时水样的体积(L)
螯合剂

螯合剂又名络合剂,是一种能和重金属离子发生螯合作用形成稳定的水溶性络合物,而使重金属离子钝化的有机或无机化合物。
这种化合物的分子中含有能与重金属离子发生配位结合的电子给予体,故有软化、去垢、防锈、稳定、增效等一系列特殊作用。
印染工艺中常见的螯合剂有以下几种:(1)磷酸盐类:主要有三聚磷酸钠、多聚磷酸钠、六偏磷酸钠、焦磷酸钠等。
此类螯合剂因有离子交换能力,是最早用于印染工业的水质软化剂,焦磷酸钠可与三价铁离子形成络合离子,故可用于双氧水稳定剂中。
但无机磷酸盐在一些地区已被禁用。
(2)氨基羧酸类:主要有乙二胺四乙酸’(ED—TA),即软水剂B;氮川三乙酸(NTA),即软水剂A。
此外还有二乙撑三胺五乙酸(DTPA)、N一羟乙基乙胺三乙酸(HEDTA)、乙二醇一双一(B一氨基乙醚)一N,N一四乙酸(EGTA)等。
氨基羧酸型螯合剂的配位体是氮原子和带负电荷的羧酸根离子(COO—)。
其配位体数目越多,与金属离子的络合作用越强。
其中DTPA和大多数金属离子络合作用最强,其次是EDTA和HEDTA,NTA最差。
其中DTPA 作为双氧水稳定剂效果最好。
但NTA、EDTA、DTPA等因螯合金属后生物降解性极差,近年来欧洲一些国家已严禁使用。
(3)有机膦酸型类:主要有氨基三亚甲基膦酸(ATMP)、1一羟乙叉一1,1一二膦酸(HEDP)、乙二胺四甲叉膦酸(EDTMP)、二乙烯三胺五甲叉膦酸(DTPMP)、氨基三甲叉膦酸(ATP)等。
此类螯合剂具有使污垢分散、悬浮的能力,在高温下不易水解,对防止产生锅垢效果优良,亦可作锅炉清洗剂。
DTPMP是一种比DTPA效果更好的双氧水稳定剂,DTPA 只是在有硅酸钠存在下,对Ca、Mg盐有较好稳定作用,而DTPMP在不加硅酸钠条件下,也能对双氧水起稳定作用。
这类螯合剂既有较好的螯合、除垢作用,又易于被生物降解,目前使用较多。
(4)羟基羧酸类:主要有葡萄糖酸、聚丙烯酸(PAA)、马来酸(MAO)等。
[总论]螯合剂常识
![[总论]螯合剂常识](https://img.taocdn.com/s3/m/36e9ed7959fafab069dc5022aaea998fcd22405f.png)
螯合剂知识一、螯合剂的概念由一个简单正离子(称为中心离子)和几个中性分子或离子(称为配位体)结合而成的复杂离子叫配离子(又称络离子),含有配离子的化合物叫配位化合物。
在配合物中中心离子与配位体通过配位键结合。
配位键是一种特殊的共价键,通常的共价键是由两个成键·原子绷出一个电子形成共同电子对的,而在配位键中是由一个原子提供电子对,另一原手提供攀删道形成的。
为了区别把共价键用“一”表示,如H·+·H=H:H(H—H),配位键奶删“←”表示,箭头指向提供空轨道的原子,如Cu+NH3=CuNH3(Cu←NH3)。
如果配位体中只有一个配位原子,则中心离子与配位体之间只能形成一个配位键。
而有些配位体分瑚中含有两个以上的配位原子而且这两个原子间相隔着两至三个其他非配位原子时,:这个硼体就可以与中心离子(或原子)同时形成两个以上的配位键,并形成一个包括两个配位剿五元或六元环的特殊结构,把这种配合物称为螯合物。
螯合物比一般配合物更稳定。
把能形成螯合物的配位体叫整合剂。
螯合剂包括无机和有机两类。
它们在清洗过程中蕉着重要用途。
二、无机金属离子螯合剂聚磷酸盐螯合剂的缺点是它们在高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,兰般只适合在碱性条件下作螯合剂。
一般说来这些无机螯合剂对重金属离子特别是铁离子的螯合能力较差。
由于以上缺点,使无机螯合剂的用途受到限制,通常只用于对钙、镁离子螯合,所以常作为硬水软化剂。
三、有机金属离子螯合剂能与重金属离子起螯合作用的有机化合物很多,如羧酸型、有机多元膦酸等。
1.羧酸型在清洗剂中使用的羧酸型螯合剂主要有氨基羧酸类和羟基羧酸类等。
(1)氨基羧酸类氨基羧酸用作螯合剂的有乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸及其盐等。
它们对钙、镁离子均有较强的螯合作用。
从单位质量的三种酸螯合钙离子的数量看,以NTA螯合最多,ZDTA其次,DTPA再次。
螯合剂的概念

螯合剂的概念双功能螯合剂(bifunctionalchelator,bfc)既有很强的金属螯合基团,又能与生物分子以共价键的形式连接。
生物分子接通bfc后,既能够与金属稳固融合,又可以确保导入的金属元素远离生物分子以保证其生物活性不受损失[1-3]。
bfc包含3部分:螯合单元,融合基团和配体构架。
理想的bfc应当该能够在bfc-生物分子低浓度条件下,与放射性核素牢固结再分,并且存有很高的标记速度[2]。
类bfc由于其结构、性质的特殊性(骨架结构体积大;不易构成平衡络合物;与生物分子相连接时,较好地维持了其原有的生化性质),成为bfc领域研究的重点[4-21]。
其中,单胺单酰胺二硫醇(monoamino-monoamidedithiol,mama)等类联接剂近年来备受关注,并已经被广泛应用于联接受体配基为、多肽、蛋白质、单克隆抗体等[13-21];但在制备路线以及提升其稳定性方面,有待进一步积极探索[12-16],以合乎现今环境及绿色化学发展的要求。
本文以半胱胺盐酸盐为初始原料,将其巯基用对甲氧苄基保护后与溴乙酰溴经“one-potreaction”合成mama联接剂前体,n-(2"-对甲氧苄巯乙基)-2-[(2'-对甲氧苄巯乙基)氨基]乙酰胺,并将其做成更平衡且不易留存的盐酸盐。
螯合剂,是一类能与金属离子形成多配位络合物的交联功能有机材料,其组成是由一个简单正离子和几个中性分子或离子结合而成的复杂离子,称为配离子(又称络离子),含有配离子的化合物叫配位化合物[18]。
它能与重金属离子强力螯合,形成絮凝,达到去除各种重金属目的。
与传统去除水中重金属污染的方法相比,螯合剂具有可处理低重金属离子浓度废水、可同时去除多种重金属离子、可去除胶质重金属、不受共存盐类的影响、可在较宽ph范围内反应等许多优点[19]。
螯合剂大致可以分成无机和有机两类,以磷酸酯磷酸盐为代表的无机螯合剂,例如三聚磷酸钠等,其缺点就是高温下易水解,并使螯合能力减少甚至消失,而且只适用于于碱性介质,就可以用作硬水的软化。
螯合剂作用原理

螯合剂的作用原理1. 螯合剂的定义和分类螯合剂是一类具有多个配位位点的化合物,能够与金属离子形成稳定的配合物。
螯合剂通常具有较高的亲和力,可以选择性地与特定金属离子结合。
根据其配位原子数目,螯合剂可以分为双齿螯合剂、多齿螯合剂和多环螯合剂等。
2. 配位键的形成螯合剂与金属离子之间的结合是通过配位键形成的。
配位键是由一个或多个配体中的一个或多个非共价电子对与金属离子中未被占据的轨道相互作用而形成的。
这种相互作用可以通过共价键、离子键或范德华力来实现。
3. 配位数和络合度一个金属离子与一个或多个配体形成络合物时,金属离子周围所存在的配位位置数目称为其配位数。
具有不同配位数的金属离子对应不同类型的络合物。
而一个金属离子与一个或多个薄弱结构化学键相连时,所形成的络合物称为其络合度。
4. 螯合剂的作用机制螯合剂通过与金属离子形成稳定的络合物,改变了金属离子的化学性质和生物活性。
下面将从以下几个方面详细解释螯合剂的作用机制。
4.1 形成稳定络合物螯合剂与金属离子形成稳定的络合物,可以通过多个配位位点与金属离子形成多个配位键,从而增强配位键的稳定性。
这种稳定性使得金属离子能够在更宽的pH范围内存在,并且不易被其他分子或离子取代。
4.2 改变金属离子的溶解度螯合剂可以与难溶于水的金属离子结合,形成溶解度较高的络合物。
这种络合物具有较好的水溶性,使得原本不易溶解于水中的金属离子能够更容易地被水分散和溶解。
4.3 提高药物活性和选择性螯合剂可以与药物分子结合,形成能够更有效地传递药物到目标组织或细胞的络合物。
螯合剂还可以通过与金属离子结合,改变药物分子的结构和性质,从而提高药物的活性和选择性。
4.4 促进催化反应螯合剂与金属离子形成络合物后,可以改变金属离子的电子结构和配位环境,从而影响催化反应的速率和选择性。
螯合剂可以作为辅助基团参与反应机理中的中间步骤,加速反应速率。
4.5 降低毒性某些金属离子在生物体内具有毒性,而螯合剂能够与这些金属离子形成稳定的络合物,降低其毒性。
螯合剂种类

螯合剂种类什么是螯合剂?螯合剂是一类能够与金属离子形成稳定配合物的化合物。
它们通过形成共价键或离子键与金属离子结合,从而阻止金属离子发生化学反应或沉淀。
螯合剂可以被广泛应用于许多领域,包括医药、环境保护、工业加工等。
不同种类的螯合剂具有不同的特性,因此在实际应用中需要根据具体情况选择合适的螯合剂。
有机螯合剂有机螯合剂是一类主要由有机化合物构成的螯合剂。
由于有机螯合剂具有良好的溶解性和可选择性,它们在药物设计和水处理领域得到了广泛应用。
α-胎盘素α-胎盘素是一种最常用的有机螯合剂之一。
它具有与许多金属离子结合的能力,包括铁、铝、钙等。
α-胎盘素可以在医药领域用于治疗铁缺乏性贫血,同时也被用作工业废水处理剂。
β-环糊精β-环糊精是另一种常用的有机螯合剂。
它是一种大环多糖,可以与一些金属离子如氢氧化铁结合形成稳定的配合物。
β-环糊精在环境污染治理中起到了重要的作用,可以用来去除废水中的重金属离子。
EDTAEDTA,即乙二胺四乙酸,是一种广泛使用的有机螯合剂。
它可以与多种金属离子形成稳定的配合物,并用于许多不同的应用领域,如医药、食品工业、水处理等。
EDTA在医药领域被广泛用于螯合金离子,从而增强药物的稳定性和生物利用度。
无机螯合剂无机螯合剂主要由无机化合物构成,它们具有较高的化学稳定性和选择性,因此在某些特定的应用中表现出较好的性能。
氨四乙酸氨四乙酸是一种常见的无机螯合剂,也称为乙二胺四乙酸。
它可以与多种金属离子形成稳定的四个配位键,并且具有较好的溶解性。
氨四乙酸广泛应用于工业生产过程中,可以用于除垢、阻垢剂以及金属离子的稳定剂。
硫酸钠硫酸钠是一种无机螯合剂,常用于纸浆和纸张工业中的漂白过程。
它可以与一些金属离子形成络合物,从而降低金属离子对纸张的影响。
硫酸钠在漂白工艺中具有较好的稳定性和选择性。
酒石酸酒石酸是一种天然无机螯合剂,广泛存在于葡萄酒和葡萄酒渣中。
酒石酸可以与一些金属离子结合形成络合物,从而影响葡萄酒的质量和稳定性。
(一)螯合物和螯合剂的概念
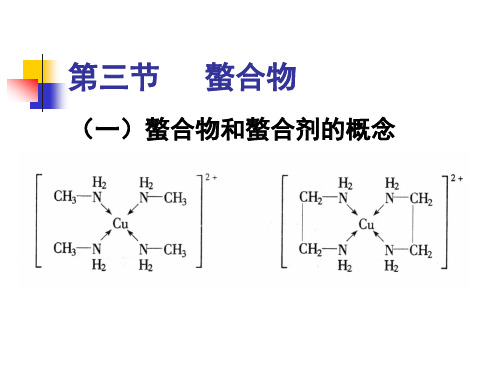
铬黑T能与许多金属离子如Ca2+ 铬黑 能与许多金属离子如 Mg2+ Zn2+Cd2+ 等形成红色的配合物。 形成红色的配合物。 显兰色, 在pH为7~11时,铬黑 显兰色,与 为 时 铬黑T显兰色 形成配合物的红色有明显区别, 形成配合物的红色有明显区别,则 终点时颜色变化明显。因此, 终点时颜色变化明显。因此,用铬 黑T作指示剂时最适宜的pH值为 作指示剂时最适宜的 值为
C
EDTAV EDTA V水样
×1000
9~10.5,一般用NH3-NH4Cl缓冲溶液 ,一般用 缓冲溶液 控制溶液pH值在 左右进行滴定。 值在10左右进行滴定 控制溶液 值在 左右进行滴定。
对于含有两种或两种以上金属离子 的混合溶液, 的混合溶液,可以通过调节溶液的
pH值,选择性地滴定其中某一离子。例 值 选择性地滴定其中某一离子。 离子和Zn 如,在Mg2+离子和 2+离子的混合溶液 可首先调节溶液pH ≈ 6.8,用铬黑 中,可首先调节溶液 , 离子, T作指示剂,用EDTA滴定Zn2+离子, 作指示剂, 作指示剂 此时Mg2+离子不干扰。然后再调节溶液 离子不干扰。 此时 pH ≈ 10,用EDTA滴定Mg2+离子。 离子。 ,
例如, 离子和Zn 例如,在Mg2+离子和 2+离子的混合 溶液中,调节溶液的pH ≈ 6.8, 这时 溶液中,调节溶液的 , EDTA仍可与 Zn2+离子完全螯合,而与 离子完全螯合, 仍可与 Mg2+离子则完全不螯合,即Mg2+离子 离子则完全不螯合, 的存在不会干扰EDTA 对Zn2+离子的螯 的存在不会干扰 合滴定。 合滴定。 由于滴定时不断有离子的生成, 由于滴定时不断有离子的生成,为了 保持合适的pH值 使反应进行完全, 保持合适的 值,使反应进行完全,滴 定前必须加入合适的缓冲溶液控制溶液 的pH值。 值
(一)螯合物和螯合剂的概念
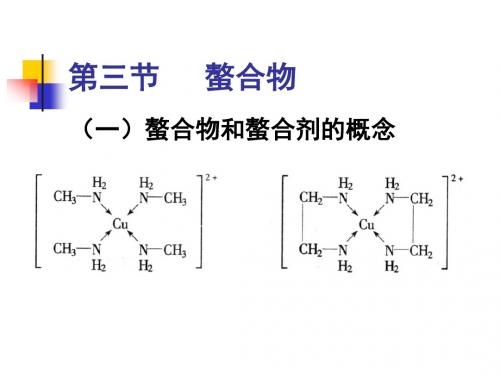
对于含有两种或两种以上金属离子 的混合溶液,可以通过调节溶液的
pH值,选择性地滴定其中某一离子。例 如,在Mg2+离子和Zn2+离子的混合溶液 中,可首先调节溶液pH ≈ 6.8,用铬黑
T作指示剂,用EDTA滴定Zn2+离子,
(二)EDTA螯合滴定的基本原理 EDTA螯合滴定就是基于EDTA与
金属离子螯合反应的一种重要的滴定分 析方法,常用于测定溶液中金属离子的 含量。
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。 它们是一类能与金属离子形成有色配合 物的水溶性有机染料。
作为金属指示剂必须具备以下条件: 1.与金属离子形成的配合物的颜色 与其本身(即未配合时)的颜色有 明显不同; 2.与金属离子形成的有色配合物具 有足够的稳定性; 3.与金属离子形成配合物的稳定性 必须小于EDTA与金属离子形成螯合 物的稳定性。
反应式如下: 加指示剂时: Mg2+ + HIn2- ⇌ MgIn - + H+
蓝 滴定终点前: Ca2++H2Y2紫红
⇌ CaY2- +2H+ Mg2+ + H2Y2- ⇌MgY2- +2H+
⇌MgY2- +HIn- +H+
蓝
滴定终点时: MgIn-+ H2Y2紫红
水的总硬度按下式计算: 总硬度= 式中: CEDTA: EDTA 标准溶液的浓度( mol ·L-1 ) VEDTA : 消耗EDTA标准溶液的体积(L) V: 滴定时水样的体积(L)
此时Mg2+离子不干扰。然后再调节溶液 pH ≈ 10,用EDTA滴定Mg2+离子。
螯合物定义

螯合物定义全文共四篇示例,供读者参考第一篇示例:螯合物是一种由金属离子与配体通过配位键形成的化合物。
金属离子通常是过渡金属离子,配体则是一个或多个能够提供一个或多个孤对电子给金属离子的有机或无机化合物。
螯合物在化学领域中具有广泛的应用,包括生物化学、药物化学、环境化学等领域。
螯合物的形成通常是通过参与配位键的配体和金属离子之间的相互作用而实现的。
配位键是一种共价键,是指配体中的一个原子将其孤对电子提供给金属离子形成的化学键。
金属离子通常是具有一个或多个未成对电子的过渡金属元素,而配体可以是有机或无机分子,具有提供电子对的原子。
螯合物的形成可以改变金属离子的性质,使得金属离子与配体形成的螯合物具有不同的化学性质和物理性质。
螯合物一般比金属离子本身更加稳定,同时也具有更强的化学活性和生物活性。
螯合物在生物活性分子的设计和制备中具有重要的应用,可以用于设计和合成具有特定功能的生物活性分子。
螯合物还具有广泛的环境应用。
螯合物可以用于水污染治理中的重金属去除,可以通过配位键与金属离子形成的螯合物将金属离子从水中去除。
螯合物还可以用于工业废水处理中的金属去除、环境监测中的金属检测等领域。
螯合物在药物化学中也具有重要的应用。
许多药物分子本身就是螯合物,通过配位到金属离子实现其生物活性。
铁离子与血红蛋白结合形成的血红素就是一种重要的螯合物,它可以有效地将氧气输送到身体的各个组织和细胞中。
一些抗癌药物中也含有螯合物结构,通过与金属离子形成稳定的化合物来实现对癌细胞的攻击。
螯合物是一种重要的化学结构,具有广泛的应用领域和重要的科学意义。
通过研究螯合物的结构和性质,人们可以更好地理解金属离子与配体之间的相互作用,为生物化学、药物化学、环境化学等领域的研究提供新的思路和方法。
希望未来能够进一步深入研究螯合物的性质和应用,为人类社会的发展做出更大的贡献。
第二篇示例:螯合物是指由一个或多个配体与一个中心金属离子结合而形成的化合物。
螯合物的定义

螯合物的定义螯合物是指那些在分子结构上能与金属离子形成稳定络合物的化合物。
这种络合物在溶液中可以作为一种特殊的离子载体而起到传递信息的作用,即“传递信息”。
螯合物主要有两大类型,即金属螯合物和非金属螯合物。
非金属螯合物如 EDTA、 CMA、 EDTMP 等。
金属螯合物包括氨基酸及蛋白质的衍生物,如谷氨酸、天冬酰胺、二肽、三肽、四肽等,均具有很好的络合性能,对钙、镁、锌、铜等金属离子都有良好的螯合作用。
另外还有某些含氮杂环化合物,如吡啶、喹啉、噻唑、嘧啶、吲哚等也具有较强的螯合性能。
螯合物通过螯合作用将金属离子连接在一起形成螯合物。
这样既保证了金属离子的生理功能,又增加了分子的稳定性。
从某种意义上讲,螯合物比一般配位剂更安全。
因此,利用螯合物来解决生产实际问题时,不仅考虑到所需螯合物的稳定性,同时也必须考虑螯合物本身的毒性。
当然,由于存在络合物的空间位阻效应,因此在进行螯合反应时,必须严格控制螯合条件,使得络合物尽量小,才能提高螯合物的选择性。
金属螯合物与其他无机或有机配位剂相比,具有以下优点:1.对人体健康危害少,且容易被生物降解。
2.具有明显的抗肿瘤活性。
3.具有生物活性,易被生物体内酶系统水解。
4.具有特异性,不会引入新的杂质。
5.对细胞膜通透性影响极小。
6.与蛋白质或多糖形成的螯合物,有助于药物吸收。
7.具有缓释性,不会出现快速排泄。
8.无毒,对环境友好。
9.价廉,容易获取。
10.具有独特的生物相容性。
11.适宜 pH 范围宽。
12.可通过重组 DNA 技术修饰,改变其结构,增强其功能。
13.易于获得。
螯合物的缺点:1.螯合物的稳定性差,不耐光、热和碱。
2.在低温下,螯合物容易失去活性。
3.对金属离子敏感,特别是铜离子。
4.螯合物的分子结构复杂,不便于进行纯化处理。
螯合物广泛应用于日常生活中的各个方面:工业上制造螯合铁、铬等金属和其它金属的氢氧化物;农业上制造多种微量元素肥料;医学上用于临床治疗肝炎、肾病综合征、癌症、心血管疾病、老年痴呆症、糖尿病等;食品添加剂、饲料添加剂等方面也有广阔前景。
螯合剂种类总结及其在不同pH下的对金属离子的螯合能力比较

螯合剂的种类及其在不同pH值条件下螯合剂的螯合常数一、螯合剂与螯合物具有可供配位孤电子对的分子、原子或离子的化合物能够与具有空轨道的金属离子形成配位键,该化合物称为络合物,如能与配位金属离子形成环状结构的化合物称为螯合剂,形成的络合物称为螯合物。
螯合剂中至少含有一对孤电子对,而金属离子必须有空的价电子轨道,孤电子对填充入金属离子空轨道,电子对属2个原子共享,形成配位键,中心金属离子空轨道杂化。
不同的提供孤电子对的配位体分别与不同金属离子形成正四面体、正六面体、正八面体的螯合物。
1.类型1.1无机类螯合剂聚磷酸盐螯合剂:主要是三聚磷酸钠(STPP)、六偏磷酸钠、焦磷酸钠为主,含磷酸基空间配位基团。
特点:高温下会发生水解而分解,使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大,一般只适合在碱性条件下作螯合剂。
1.2有机类螯合剂形态分析表明螯合剂提取的重金属主要来源于可交换态或酸溶态、还原态和氧化态。
1.21羧酸型(1)氨基羧酸类:含羧基和胺(氨基)配位基团,如乙二胺四乙酸(EDTA),氨基三乙酸(又称次氮基三乙酸NTA),二亚乙基三胺五乙酸(DTPA)及其盐等。
如:EDTA的4个酸和2个胺(—NRR′)的部分都可作为配体的齿,两个氮原子和四个氧原子可提供形成配位键的电子对。
特点:络合能力强,络合稳定常数大,耐碱性好,但分散力弱且不易被生物降解。
(2)羟基羧酸类含羟基、羧基配位基团这类羧酸主要是柠檬酸(CA)、酒石酸(TA)和葡萄糖酸(GA)。
特点:可生物降解,在酸性条件下羟基与羧基不会离解为氧负离子,因而络合能力很弱,不适宜在酸性介质中应用。
(3)羟氨基羧酸类这类酸用作螯合剂的典型代表是羟乙基乙二胺三乙酸(HEDTA)和二羟乙基甘氨酸(DEG)。
特点:大多易于生物降解,在pH=9的弱碱性条件下可螯合铁离子,但对其他离子螯合能力较差。
1.22有机多元膦酸羟基亚乙基-1,1-二膦酸(HEDP)、氨基三亚甲基膦酸(A TMP)、二乙烯三胺五亚甲基膦酸(HTPMP)、三乙烯四胺六亚甲(TETHMP)、双(1,6-亚己基)三胺五亚甲基膦酸(BNHMTPMP)、多氨基多醚基四亚甲基膦酸(PAPEMP)。
EDTA与螯合剂ppt课件
20
反应式如下:
加指示剂时:
Mg2+ + HIn2- ⇌ MgIn - + H+
蓝 紫红
滴定终点前:
Ca2++H2Y2- ⇌ CaY2- +2H+ Mg2+ + H2Y2- ⇌MgY2- +2H+
滴定终点时:
MgIn-+ H2Y2- ⇌MgY2- +HIn- +H+
紫红
蓝
最新版整理ppt
21
水的总硬度按下式计算:
最新版整理ppt
3
二、氨羧螯合剂及氨羧 螯合滴定
(一)氨羧螯合剂的结构和特点
氨羧螯合剂中最重要同时应用最 广的是乙二氨四乙酸(EDTA)及其 二钠盐 (EDTA-2Na),统称为 EDTA。结构如下:
最新版整理ppt
4
最新版整理ppt
5
EDTA在水中溶解度小,故配制 标准溶液时,常用它的二钠盐。 EDTA的分子或离子中含有2个氨基 氮和4个羧基氧可与金属离子配合, 生成具有5个五元环的稳定性很高的 螯合物。如下图:
M2++H2Y2--MY2 - +2H + M3++H2Y2--MY - +2H + M4++H2Y2--MY +2H +
最新版整理ppt
9
4.由于EDTA与金属离子螯合可形成5个五 元环,故生成的螯合物十分稳定。常见 金属离子的EDTA螯合物的lgKs 见表5-2。 表5-2 EDTA与部分金属离子螯合物的稳 定常数对数值
总硬度= 式中:
CEDTVEADTA V水样 1000
§3.螯合物08.5.15

2021/4/9
1
例:[Cu(en)2]2+的螯合比为1:2 ; [Ca-EDTA]2-的螯合比为1:1
=
1.0×109
[Ni(en)3]2+ + 6 H2O
K
θ f
=
1.0×1017
2
(2)、稳定原因: 螯合剂与中心离子配位形成五员环或六员环稳 定结构。
螯合效应中混乱度增加得更大, 因而熵效 应更有利。
3.2 *螯合物的应用
1、在分析化学上的应用 2、螯合物在农业上的应用
2021/4/9
3
补充: 配位化合物的异构现象
5、螯合效应与螯合物的稳定性 (1)、螯合效应:
指中心离子与螯合剂形成具有环状结构的螯合物, 从而使螯合物比配位数相同的一般配合物具有特殊
的稳定性的现象。
例如: [Ni(H2O)6]2+ + 6 NH3
2021/4/9
[Ni(H2O)6]2+ + 3 en
[Ni(NH3)6]2+ + 6 H2O
K
θ f
③ ④
[CoCl (NH3)5]Cl2 [Co(NH3)6]Cl3
③[CoCl (NH3)5]Cl ④[Co(NH3)6]Cl 3
2•
3NH3
问题:除给出的四个答案外,还有其它答案吗?
2021/4/9
6
感谢您的阅读收藏,谢谢!
2021/4/9
7
组成相同而结构不同的分子或复杂离子叫 做异构现象。
