高中化学竞赛题--成键理论
2020高中化学竞赛(入门篇)-基础有机化学-第01、02章 绪论、有机化合物命名(共66张PPT)

7
CH3
CH3
CH3 CH3
2,6,8-三甲基癸烷
如处于对称位置,优先考虑较简单的取代基。 1 2 34 C5H3CH62CHC7H2CHCH2CH3 3-甲基-5-乙基庚烷
CH3 CH2CH3
1 23 456 6 54 321
CH3CHCH2CHCHCH3
CH3 H3C CH3
CH3
甲苯
CH(CH3)2
CH3 CH3
异丙苯
邻二甲苯 o-二甲苯 1,2-二甲苯
CH3
CH3
CH3
间二甲苯 m-二甲苯 1,3-二甲苯
CH3
对二甲苯 p-二甲苯 1,4-二甲苯
CH3 CH3
CH3
1,2,3-三甲苯 连三甲苯
CH3 CH3
CH3
CH3
1,2,4-三甲苯 偏三甲苯
H3C
CH3
1,3,5-三甲苯 均三甲苯
命名规则:
(1)选主链:选择最长的碳链作主链,按主链的碳 原子数命名为“某烷”。
(2)编号:从靠近支链(取代基)的一端对主链进行 编号,根据支链所连碳原子的编号表示支链的位次。
65 4 3 2
CH3CH2CH2CHCH2CH3 CH3
1
3-甲基己烷
(3)命名:将支链的位次、个数、名称写在主体 名称的前面,中间用短线隔开。
654
CH3
CH3CH2CHCH2CHCH3
3 21
2-甲基-4-环己基己烷
H CH3
C2H5 H
反-1-甲基-4-乙基环己烷
C2H5 CH3 CH3
r-1,反-1,2-二甲基-反-4-乙基环己烷
桥环:共用两个或两个以上碳原子的多环烷烃
2015年第29届全国高中学生化学竞赛决赛理论试题

第29届中国化学奥林匹克(决赛)试题2015年11月28日 合肥注意事项1. 考试时间4小时。
迟到超过30分钟者不能进考场。
开始考试后30分钟内不得离场。
2. 考试“开始铃声”响起后方可拆开资料袋答题。
考试“结束铃声”响起后,立即停止答题,把试卷和答题纸放于桌面,由监考人员检查并将答题纸装订后一并放入资料袋。
听到可以离开指令后方可离开考场。
3. 发出停止答题指令后仍继续答题者,正在解答的试题(大题)以零分计。
4. 本试卷含9道大题,共5页。
试卷已装订成册,不得拆散。
所有解答必须写在答卷上指定的框格内,写于其他地方无效。
若有改动,需将新内容写于答卷的附页,并标明题号。
5. 凡要求计算的问题,只有计算结果而无计算过程,即使结果正确也不得分。
6. 用黑色墨水笔或黑色圆珠笔答题,不得携带任何其他纸张进入考场。
若需要草稿纸,可举手向监考人员索取。
7. 将营员号写在试卷首页和每页答卷指定位置,否则无效。
8. 允许使用非编程计算器以及直尺等文具,。
不得携带铅笔盒、书籍、通讯工具入场。
不得将草稿纸带出考场。
9. 欲上卫生间,举手示意,经监考人员允许方可离开座位出考场,考场外由志愿者全程引领。
第1题 (7分)1-1 CH 3SiCl 3和金属钠在液氨中反应,得到组成为Si 6C 6N 9H 27的分子,此分子有一条三重旋转轴,所有Si 原子不可区分,画出该分子结构图(必须标明原子各类,H 原子可不标),并写出化学反应方程式。
1-2 金属钠和(C 6H 5)3CNH 2在液氨中反应,生成物中有一种红色钠盐,写出化学反应方程式,解释红色产生的原因。
1-3 最新研究发现,高压下金属Cs 可以形成单中心的CsF 5分子,试根据价层电子对互斥理论画出CsF 5的中心原子价电子对分布,并说明分子形状。
第2题(11分)将银电极插入298 K 的1.000×10-1 mol/L NH 4NO 3和1.000×10-3 mol/L AgNO 3混合溶液中,测得其电极电势Ag Ag /+ϕ随溶液pH 的变化如下图所示,已知氨水的解离常数(K b )为1.780×10-5,理想气体常数R = 8.314 J •mol -1•K -1,法拉第常数F = 96500 C •mol -1。
高中化学竞赛题--成键理论

中学化学竞赛试题资源库——成键理论A组 B组1.下列各结构式中,最有可能的N2O Lewis结构式为A N=N=OB N≡N-OC N-N≡OD N=O=N 2.下列各Lewis结构式中,能正确表示出NO3离子的Lewis结构式是-AO2-BOCODO3.S2O3合理的共振结构式总数为 A 3 B 6 C 11 D 12 4.BF3的合理的共振结构式总数有A 2B 3C 4D 65.下列有关HOCN分子的共振结构中,最稳定的是 A H-O=C=N B H-O-C≡N C H -O≡C-N D H=O-C=N6.假定CH3是平面结构,并且在外磁场中处于平衡,不成对电子处在什么原子轨道上?A 2sB 2pxC 2pyD 2pz 7.下列各组物质中,都含有两个π3的是 A N2O,CO2,N3- B N2O,NO2,N3- C N2O,CO2,NO2 D NO2,CO2,N3- 8.N2O4中存在着A 一个π3B 两个π3C 一个π6D 两个π6 9.2001年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰泡林(Linus Pauling)教授诞辰100周年(1901~1994)。
1994年这位世纪老人谢世,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如图所示。
老人为什么画这个结构式?它是生命前物质?它能合成吗?它有什么性质?不得而知。
这是泡林留给世人的一个谜。
也许这是永远无法解开的谜;也许你有朝一日能解开它。
不管结果如何,让我们先对这个结构作一番考察:(1)它的分子式是什么?(2)它的所有原子是否处于同一个平面上?(3)它是否带有电荷?(4)该分子中sp杂化的N原子有个;sp2杂化个;sp3杂化个。
(5)为什么人们猜它是炸药?10.硫有许多同素异形体,在低温下用浓盐酸分解硫代硫酸钠时,在甲苯中结晶,得中学综合学科网第 1 页共 36 页44884。
化学竞赛题库化学键与分子几何构型答案

B
. . . . C C N. . . . . .
(2) BC2N 分子是直线型的,所以(BC2N)n 理应属于一维晶体。 (3) 既然(BC2N)n 可以制成单壁纳米管材料,这说明(BC2N)n 首先应聚合成二维平面, 然后受外力而卷曲成单壁纳管材料,所以每个原子都应象石墨中的 C 原子那样, 采取 sp2 杂化,然后聚合成下面的单层结构:
船式
八、1.K︰C =
0.289 0.711 ︰ =7.39 ´ 10-3︰0.05925 = 1︰8 该化合物的分子式为 KC8。 39.10 12.00
2.2KC8 + 2C2H5OH KC8 + C2H5OH
2C2H5OK + H2 + 16C(graphite) C2H5OK + C8H
3.存在离子键。金属 K 失去价电子(4s1) ,成为 K+离子层,插入石墨层之间,石墨层获
23 ´ 14.01 = 0.9124 23 ´ 14.01 + M X
解得 MX = 30.9
0.9124MX = 28.227
-
∴该元素为 P,故(D)的离子式为[N5+][P(N3)6 ] 4[N5+][P(N3)6 ] + 5O2
-
P4O10 + 46N2
二、1.类硼为 Sc,类铝为 Ga,类硅为 Ge。要预言元素,只能预言一周期中的中间元素, 通过前、后两元素的性质比较,才能确定是否存在有中间元素。但稀有气体是一周期中
Cl P N Cl
Cl N P Cl
Cl P N Cl
Cl N
2. N
Cl
这两种结构式都有 N2PCl2 四面体最小重复单元。
高中化学竞赛总训练4化学键理论与分子几何构型

中学化学竞赛总训练四、化学键理论与分子几何构型1.NO的生物活性已引起科学家高度重视,它与O2-反应,生成A。
在生理pH条件下,A的t1/2= 1~2秒。
⑴写出A的可能的Lewis结构式,标出形式电荷。
推断它们的稳定性。
⑵A与水中的CO2快速一对一地结合,试写出此物种可能的路易斯结构式,表示出形式电荷,推断其稳定性。
⑶含Cu+的酶可把NO2-转化为NO,写出此反应方程式。
⑷在固定器皿中,把NO压缩到100atm,发觉气体压强快速降至略小于原压强的2/3,写出反应方程式,并说明为什么最终的气体总压略小于原压的2/3。
2.试画出N5+离子的Lewis全部可能结构式,标出形式电荷,探讨各自稳定性,写出各氮原子之间的键级。
你认为N5+的性质如何?它应在什么溶剂中制得。
3.在地球的电离层中,可能存在下列离子:ArCl+、OF+、NO+、PS+、SCl+。
请你预料哪一种离子最稳定?哪一种离子最不稳定?说明理由。
4.硼与氮形成类似苯的化合物,俗称无机苯。
它是无色液体,具有芳香性。
⑴写出其分子式,画出其结构式并标出形式电荷。
⑵写出无机苯与HCl发生加成反应的方程式⑶无机苯的三甲基取代物遇水会发生水解反应,试推断各种取代物的水解方程式,并以此推断取代物可能的结构式。
⑷硼氮化合物可形成二元固体聚合物,指出这种聚合物的可能结构,并说明是否具有导电性。
⑸画出Ca2(B5O9)Cl·2H2O中聚硼阴离子单元的结构示意图,指明阴离子单元的电荷与硼的哪种结构式有关。
5.用VSEPR理论推断下列物种的中心原子实行何种杂化类型,指出可能的几何构型。
(1)IF3(2)ClO3-(3)AsCl3(CF3)2(4)SnCl2(5)TeCl4(6)GaF63-170℃ 6.试从结构及化学键角度回答下列问题:一氧化碳、二氧化碳、甲醛、甲酸等分子(1)画出各分子的立体构型,并标明各原子间成键状况(σ、π、Πmn ) (2)估计分子中碳—氧键的键长改变规律7.近期报导了用二聚三甲基铝[Al(CH 3)3]2 (A)和2, 6 —二异丙基苯胺(B)为原料,通过两步反应,得到一种环铝氮烷的衍生物(D): 第一步:A + 2B === C + 2CH 4其次步:□C □D + □CH 4 (□中填入适当系数)请回答下列问题:(1)分别写出两步反应配平的化学方程式(A 、B 、C 、D 要用结构简式表示 (2)写出D 的结构式(3)设在第一步反应中,A 与过量B 完全反应,产物中的甲烷又全部挥发,对反应后的混合物进行元素分析,得到其质量分数如下:C (碳):73.71%,N (氮):6.34% 试求混合物中B 和C 的质量分数(%)(已知相对原子量:Al :26.98、C :12.01、N :14.01、H :1.01)8.四氨合铜(II)离子在微酸性条件下,与二氧化硫反应生成一种沉淀物(A),该沉淀物中Cu:N:S (原子个数比)=1:1:1,结构分析证明:存在一种正四面体和一种三角锥型的分子或离子,呈逆磁性。
全国高中学生化学竞赛(决赛)理论试题
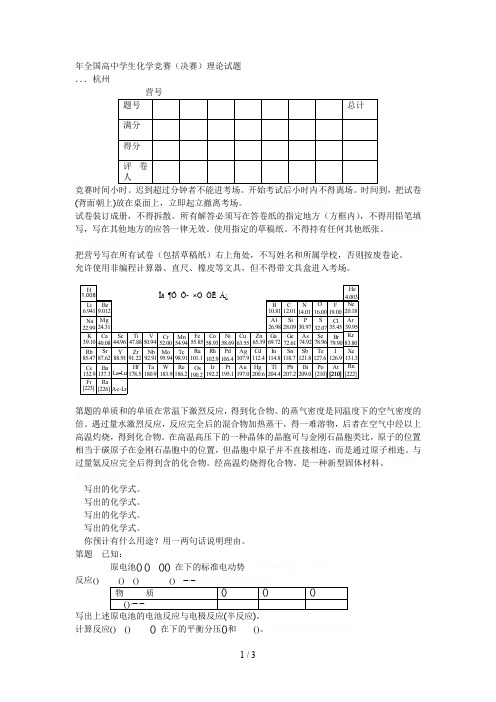
年全国高中学生化学竞赛(决赛)理论试题 ...杭州(背面朝上)放在桌面上,立即起立撤离考场。
试卷装订成册,不得拆散。
所有解答必须写在答卷纸的指定地方(方框内),不得用铅笔填写,写在其他地方的应答一律无效。
使用指定的草稿纸。
不得持有任何其他纸张。
把营号写在所有试卷(包括草稿纸)右上角处,不写姓名和所属学校,否则按废卷论。
允许使用非编程计算器、直尺、橡皮等文具,但不得带文具盒进入考场。
1.008Zr NbMo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re OsIr Pt Au Hg Tl Pb Bi Po At Ac-LrHLi Be B C N O FNa Mg Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn G a G e As Se BrRb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn Ïà ¶Ô Ô- ×Ó ÖÊ Á¿第题的单质和的单质在常温下激烈反应,得到化合物。
全国高中化学竞赛真题库

全国高中化学竞赛真题库
全国高中化学竞赛真题库:
中国全国高中化学竞赛自1989年开始组织到今天已有30年历史,考
试覆盖程度更是遍及着全国各地使中国高中学生竞争意识逐渐被引发。
根据历年考题,收集整理出如下全国高中化学竞赛真题库:
一、物质的性质及变化
1. 电解质的定义及特点
2. 溶液的滴定
3. 酸碱和盐的性质和变化
4. 气体的特性
5. 化学平衡
二、物质的组成、结构和用途
1. 分子的构造
2. 化学反应的机理及分子式
3. 结构式的构建和称呼
4. 无机化合物的构建
5. 有机物的结构特征
三、化学实验技术
1. 实验准备及安全操作
2. 助剂作用及试剂配制
3. 分析技术
4. 实验误差
四、认识自然界
1. 气候变化
2. 光合作用
3. 地球能量资源
4. 环境污染
5. 生物多样性
五、史前世界
1. 古典元素论的形成
2. 史前化学之父
3. 古代化学实验
4. 早期碳氢键的发现
5. 古代加工技术
六、现代思维
1. 实现资源循环
2. 全球视野
3. 智能材料
4. 现代工业技术
5. 绿色化学
经整理,上方便是全国高中化学竞赛真题库,旨在丰富学生理论知识以及扩充对愿实际操作的认知,最终为学生找到最符合能力的学习路径。
全国高中学生化学竞赛(冬令营)理论试题及解答1

全国高中学生化学竞赛(冬令营)理论试题2002年1月22日山东·济南注意事项:.竞赛时间4小时。
迟到超过30 分钟者不能进考场。
开始考试后1小时内不得离场。
考试时间一到,把试卷和答卷还放在桌面上(背面朝上),持监考老师收完卷子后起立离开考场。
.把营号写在所有答卷统的客封线外和草稿纸的右上角处,不写姓名和所属学校,否则按废卷处理。
.试卷装订成册,不得拆散。
所有答案必须写在答卷纸的指定地方(方框内),用钻笔答卷或写在其他地方的答案一律无效。
使用指定的草稿纸。
不得特有任何其他纸张。
.允许使用非编程计算器、直尺、橡皮等文具,但不得带文具盒进人考场。
第1题1-1.用容量法测定磷肥含磷量的主要步骤如下:准确称取磷肥0.385g,用硫酸和高氯酸在高温下使之分解,磷转化为磷酸。
过滤,洗涤,弃去残渣。
以硫酸-硝酸为介质,加入过量钼酸铵溶液生成铝磷酸铵沉淀(NH4)3H4PMo12O42•H2O。
过滤,洗涤,沉淀溶于40.00cm3 1.026 mol· dm-3NaOH标准溶液中,以酚酞为指示剂,用0.1022 mol·dM-3盐酸标准溶液滴定至终点(MoO42-),耗去15.20cm3。
计算磷肥中磷的百分含量(以P2O5计)。
1-2.测定土壤中SO42-含量的主要步骤如下:称取50g风干土样,用水浸取,过滤,滤液移入250cm3容量瓶中,定容。
用移液管移取25.00 cm3浸取液,加入1:4盐酸8滴,加热至沸,用吸量管缓慢地加入过量钡镁混合液(浓度各为0.0200mol•dm-3)V1(cm3)。
继续微沸5分钟,冷却后,加入氨缓冲溶液(pH=10)2 cm3,以铬黑T为指示剂,用0.0200 mol·dm-3EDTA标准溶液滴定至溶液由红色变蓝色即为终点,消耗V2(cm3)。
另取25.00 cm3蒸馏水,加入1:4盐酸8滴,加热至佛,用吸量管缓慢地加入钡镁混合液V1(cm3),同前述步骤处理,滴定消耗EDTA V3(cm3)。
全国高中生化学竞赛试题3 配位化合物

配位化合物(全国初赛)第1题(13分)六配位(八面体)单核配合物MA 2(NO 2)2呈电中性;组成分析显示:M 21.68%,N 31.04%,C 17.74%;配体A 含氮不含氧;配体(NO 2)x 的两个氮氧键不等长。
1-1该配合物中心原子M 是什么元素?氧化态多大?给出推论过程。
(2002年第5题)1-2画出该配合物的结构示意图,给出推理过程。
13指出配体(NO 2)x 在“自由”状态下的几何构型和氮原子的杂化轨道类型。
1-4除本例外,上述无机配体还可能以什么方式和中心原子配位?画出三种。
第2题(7分)研究发现,钒与吡啶-2-甲酸根形成的单核配合物可增强胰岛素降糖作用,它是电中性分子,实验测得其氧的质量分数为25.7%,画出它的立体结构,指出中心原子的氧化态。
要给出推理过程。
(2004年第5题)第3题(8分)今有化学式为Co(NH 3)4BrCO 3的配合物。
(2004年第8题)3-1画出全部异构体的立体结构。
3-2指出区分它们的实验方法。
第4题(6分)本题涉及3种组成不同的铂配合物,它们都是八面体的单核配合物,配体为OH -和/或Cl -。
(2005年第4题)4-1PtCl 4·5H 2O 的水溶液与等摩尔NH 3反应,生成两种铂配合物,反应式为:。
4-2BaCl 2·PtCl 4和Ba(OH)2反应(摩尔比2:5),生成两种产物,其中一种为配合物,该反应的化学方程式为:。
第5题(11分)化合物A 是近十年开始采用的锅炉水添加剂。
A 的相对分子质量90.10,可形成无色晶体,能除去锅炉水中溶解氧,并可使锅炉壁钝化。
(2006年第7题)5-1A 是用碳酸二甲酯和一水合肼在70℃下合成,收率80%。
画出A 的结构式。
5-2写出合成A 的反应方程式。
5-3低于135℃时,A 直接与溶解氧反应,生成三种产物。
写出化学方程式。
5-4高于135℃时,A 先发生水解,水解产物再与氧反应。
全国高中生化学竞赛试题1 共价键、共价分子几何构型(答案)

共价键、共价分子几何构型答案第1题(6分)1-1C 5H 4(2分)1-2C CCCCH H HH(只有一种可能结构,重键位置必须正确,而键角和立体结构则不要求)(4分)第2题(5分)2-1NCOHN CHOOO HH n(3分)2-2PHA 高分子键的共轭较差,加热容易发生键的旋转,是柔性骨架,所以PHA 具有热塑性,而PBO 高分子键的共轭程度高,加热不容易发生键的旋转,所以PBO 是热固性的。
(2分)(注:只要能对高分子骨架的键的性质能作正确的描述,均可得分)第3题(10分)3-1C 6F 5XeF 2+BF 4-(1分)3-2分子中有C -Xe 键(2分)(答:“分子中存在氙和有机基团”得1分)3-3XeF 4+C 6F 5BF 2C 6F 5XeF 2+BF 4-(1分)(注:用“→”代替“=”不扣分;离子加方括号得分相同;画出五氟代苯基结构不加分)。
3-45C 6F 5XeF 2+BF 4-+2I 24IF 5+5Xe +5C 6F 5BF 2(2分)(注:不配平不得分)3-5(4分)(注:4-5的答案需应用初赛基本要求规定的VSEPR 模型才能得出。
只要正确表述出四方锥体都得满分,表述形式不限。
)第4题(5分)4-1NH 3+HCl NH 4Cl (2分)(注:答其他非质子转移的任何“化合反应”得1分)。
4-2B CCl H(3分)参考图形:(注:硼上氢氯互换如参考图形仍按正确论,但上下的C 、B 分别连接H 和Cl ,不允许互换。
)第5题(15分)5-1NF 3(1分)4NH 3+3F 2NF 3+3NH 4F (1分)(共2分)5-2N -F 键的偶极方向与氮原子孤对电子的偶极方向相反,导致分子偶极矩很小,因此质子化能力远比氨质子化能力小。
画图说明也可,如:(1分)5-32NF3+2Hg N2F2+2HgF2(1分)trans cis(14+19)⨯2=66(每式1分,共3分)5-4D:[N N-F]+E:F:(每式1分)2N2F2+SnF4[N2F+]2[SnF6]2-(1分)[N2F+]2[SnF6]2-[N2F]+[SnF5]-+N2F2(1分)(共5分)5-5阳离子的化学式为NF4+(1分)NF3+F2+BF3NF4+BF4-(1分)NF4+水解反应首先得到HOF(否则写不出配平的NF4+水解反应):NF4++H2O NF3+HOF+H+定量生成NF3(1分)而反应2HOF2HF+O2和反应HOF+H2O HF+H2O2哪一反应为主与反应条件有关,但无论哪一反应为主却总是定量生成HF。
2019年全国高中学生化学竞赛(江苏省赛区)选拔赛试题含详细答案及指导

在化竞的学习过程中,掌握国初核心知识点、明确一条合理的学习路径至关重要。
化竞知识庞杂,不少学化竞的同学对于自己应该学什么,或先学什么后学什么摸不清头脑,甚至有些同学临近考前了,还在问这个知识点国初考不考,要不要学。
因为对国初核心知识点不够了解,并且没有一条清晰合理的学习路径,走了不少冤枉路。
温馨提醒:在开始学习国初知识之前,同学们需先研读全国高中学生化学(奥林匹克)竞赛基本要求(2008年4月版大纲),了解国初考试对知识点的要求。
以下为分模块需掌握的知识点:化学基本原理1.现代化学入门:宏观手段对物质的分类,原子的发现,测量,有效数字,化学计量,化学反应的质量关系2.原子结构:原子结构模型,原子轨道,电子排布,元素周期表,元素周期律3.成键&离子键:化学键,电负性,键的极性,离子,离子晶体结构4.共价键理论&分子结构:共价键,键能,Lewis结构,八隅体规则,价键理论,VSEPR理论,杂化轨道,分子轨道理论5.气体:气体的温度和压强,理想气体定律,Dalton分压定律,Henry定律6.液体和固体:分子间作用力,液态,金属和金属键,晶体结构初步7.溶液的性质:溶液的组成,溶解度,相似相溶,蒸气压,熔沸点,胶体8.化学热力学:焓,Hess定律,标准生成热,键能,熵,热力学第二定律,自发过程,自由能,自由能和平衡,Gibbs-Helmholtz方程及应用9.化学平衡:平衡条件,平衡常数,化学平衡的移动10.溶液中的平衡:酸碱平衡,沉淀溶解平衡,氧化还原平衡&电化学,配位平衡&配位结构初步11.化学动力学初步&核化学:反应速率,速率方程,反应机理,催化剂,放射性衰变,放射性的应用与防护,同位素,核裂变和核聚变有机化学1.有机结构基础:基本概念,成键和结构,有机酸碱理论2.烷烃、环烷烃、构象:烷烃、环烷烃、构象3.立体化学:对映异构、非对映异构、顺反异构、构象异构4.烷烃、自由基取代反应:自由基、自由基反应、烷烃的自由基反应5.卤代烃、亲核取代反应:卤代烃、碳正离子,SN1,SN26.消除反应:E1, E2, Substitution Vs Elimination7.醇、醚:醇、硫醇、醚、环氧8.烯、炔的加成反应:构对比;亲电、自由基、亲核加成9.烯、炔:氧化、还原、聚合反应10.醛、酮:羰基、亲核加成、α,β-不饱和醛酮的加成、氧化、还原、wittig反应11.羧酸、羧酸衍生物、胺:羧酸、羧酸衍生物、胺、卡宾12.缩合反应:烯醇、烷基化反应、与羰基反应13.共轭、芳香性:共轭体系、分子轨道理论、芳香性14.共振、芳环的取代反应:共振论、芳环亲电取代、芳环亲核取代15.周环反应:前线轨道、经典周环反应机理举例16.重排反应:经典重排反应机理举例17.有机波谱分析:IR、MS、NMR在有机产物和中间体结构表征中的综合应用。
2007年全国高中学生化学竞赛(初赛)试题及答案

2007年全国高中学生化学竞赛(省级赛区)试题答案及评分第1 题(12分)1-1 Si + 4OH− = SiO44 − + 2 H2(1 分) SiO44 − + 4H2O = Si(OH)4 + 4OH−(1 分)若写成Si + 2OH− + H2O = SiO32− + 2 H2 SiO32− + 3H2O = Si(OH)4 + 2OH−,也得同样的分。
但写成Si + 4H2O = Si(OH)4 + 2H2不得分。
写不写↓(沉淀)和↑(气体)不影响得分。
1-2 不能。
(1 分)经典共价键理论认为原子之间通过共享电子对而成键。
C 为第二周期元素,只有4 个价层轨道,最多形成4 个共价键。
(1 分)理由部分:答“C 原子无2d 轨道,不能形成sp3d 杂化轨道”,得1 分;只答“C 原子没有2d 轨道”,得0.5分;只答“C 原子有4 个价电子”,得0.5 分;答CH5+中有一个三中心二电子键,不得分(因按三中心二电子键模型,CH5+离子的C-H 键不等长)。
1-3 A 或质子酸(多选或错选均不得分。
) (2 分)1-4 C26H30(分子式不全对不得分) (2 分)1-5 有(1 分)1-6 3 种(答错不得分)(1 分)1-7 有(1 分)1-8 无(1 分)第2 题(6 分)(每式3 分)对每一式,只写对原子之间的连接顺序,但未标对价电子分布,只得1 分;未给出立体结构特征不扣分;未标出同位素符号不扣分,但B 中将星号标错位置扣0.5 分。
第3 题(10 分)w.w.w.k.s.5.u.c.o.m3-1 ··· AcB CbA BaC A ···(5 分)大写字母要体现出Cl-层作立方最密堆积的次序,镁离子与空层的交替排列必须正确,镁离子层与氯离子层之间的相对位置关系(大写字母与小写字母的相对关系)不要求。
必须表示出层型结构的完整周期,即至少写出包含 6 个大写字母、3 个小写字母、3 个空层的排列。
高中化学竞赛试题(答案)

第 1 页 共 34 页 高中化学竞赛试题一参考答案:1-1 n =1,L =0,M =0n =2,L =0,M =0n =2,L =1,M =0,+1,-1,+2,-2第一周期:H 、He (2分)第二周期:Li 、Be 、B 、C 、N 、O 、F 、Ne 、Na 、Mg 、Al 、Si (2分)1-2 氢在两种情况下都一样,但是哪一个X 元素可以作氧的替代物?至少有三种元素与“我们的氧”具有相同的性质:Mg (其核外层少2个电子),Ne (只有一个充满p 轨道),还有Na ,因为它位于上述二者之间,其性质一定与二者有相同之处。
因此,有三个明显的“侯选者”去作为“X —水”(3分);H 2Mg 、H 3Na 、H 4Ne (1分)。
目前,至少在Cute 教授的进一步研究之前,我们还不能确定哪一个是最好的选择。
1-3 现在,我们必须去寻找与生命相关的元素X -碳,选择是唯一的。
因为我们需要当外层所有电子均为未成对电子对而形成杂化态时具有最大成键可能的元素,只有O 能满足这样的条件,它以sp 5杂化形成X -甲烷(1分);化学式为OH 6(1分)。
所以Mg 代替X -氧为例,可得如下的反应:X -甲烷在镁中燃烧:OH 6+3Mg 2=OMg 3+3H 2Mg (2分)2-1 (1)碳酸二乙酯(1分)(2)COCl 2+4NH 3 → NH 2CONH 2+2NH 4Cl (1分)(3)-CO -(1分) (4)-NHCOCl-N =C =O (2分)2-2 CCl 4+H 2SO 4·SO 3 →COCl 2+2ClSO 3H (或HCl +SO 3)(2分)2-3 (1)Cl 3C -O --O -CCl 3(1分)(2)BTC 常温下为极稳定的固体物质,便于贮运(1分),使用安全,无污染。
2-4COCl 2(g )CO (g )+Cl 2(g )起始 1mol 0 0平衡 1-x x x平衡时总的物质的量n (总)=1+x (1分)222111)1(x x p p x x p p x x p p K p -=+-⋅+⋅=θθθ(1分)第 2 页 共 34 页x =0.121mol (1分)88 r M (1分)3-1 20CsB 3H 82Cs 2B 9H 9+2Cs 2B 10H 10+Cs 2B 12H 12+10CsBH 4+35H 2(2分);3820(1分)最小系数分别为:16、2、1、1、8、28;电子转移数为56e 。
第23届全国高中学生化学竞赛理论试题(全)

第23届全国高中学生化学竞赛理论试题第1题用传统的工艺方法从矿物中提取锰和锌存在能耗高、三废排放量大和工艺流程长等缺点。
2009年报道,采用1:1硫酸溶液同槽浸出锰结核矿[质量分数20.0)(2=MnO ϖ]和锌精矿[质量分数70.0)(=ZnS ϖ]的工艺方法提取锰和锌获得成功,对资源综合利用、节能减排和清洁生产生有重要的实际意义。
已知44.0)/(,77.0)/(223-==+++Fe Fe E V Fe Fe E θθ V ZnS S E V Mn MnO E V 265.0)/(,23.1)/(.22==+θθ。
1-1 锰结核矿和锌精矿单独酸浸结果很不理想。
请通过热力学计算,说明锰结核矿和锌精矿同槽酸浸时发生化学反应的可行性。
1-2 模拟实验发现,二氧化锰和硫化锌同槽酸浸时反应速率很慢,若在酸溶液中加入少量的铁屑则能明显使反应速率加快。
写出铁进入溶液后分别与二氧化锰和硫化锌发生化学反应的离子方程式,并简述反应速率加快的原因。
1-3 研究发现,2种矿物同槽酸浸4小时后,锰和锌的浸出率只有~80%,为了提高浸出率,在实际工艺中,须将过滤后的滤渣用四氯乙烷处理后再做二次酸浸,请简要说明四氯乙烷的作用。
1-4 锌精矿中常有部分铅共生,同槽酸浸工艺回收铅的方法之一是在浸渣中加入足量的食盐水使铅溶出,写出溶出铅的化学方程式。
第2题我国的稀土资源约占世界总量的80%,居世界第一位。
稀土元素的化学性质极其相似,分离十分困难,仅从1794年发现钇到1945年从铀裂变产物中得到钷就花了150年。
稀土萃取化学的研究为大规模分离和提纯稀土元素带来了新飞跃。
2008年国家最高科学技术奖授予化学家徐光宪,以表彰他在创立稀土 串级萃取理论及其工艺方面的杰出贡献,该项成就使我国高纯稀土产品成本下降3/4,单一高纯稀土产品占世界产量的90%以上。
2-1 目前在稀土分离工业中广泛应用国产萃取剂P 507,它的化学名称为(2 乙基己基)膦酸(2 乙基己基)酯,画出其化学结构简式,写出萃取三价稀土离子的化学反应方程式(萃取剂用HA 表示,稀土离子用RE3+表示)。
第32届全国高中学生化学竞赛(初赛含参考答案解析)

第32届中国化学奥林匹克(初赛)试题第1题(8分)根据所给的条件按照要求书写化学方程式(要求系数为最简整数比)。
1-1氮化硅可用作LED的基质材料,它可通过等离子体法由SiH4与氨气反应制得。
1-2将擦亮的铜片投入装有足量的浓硫酸的大试管中,微热片刻,有固体析出但无气体产生,固体为Cu2S和另一种白色物质的混合物。
1-3在50℃水溶液中,单质碲与过量NaBH4反应制备碲氢化钠,反应过程中析出硼砂[Na2B4O5(OH)4.8H2O]。
1-4天然气的无机成因说十分诱人。
据称,地幔主成分之一的橄榄石与水和二氧化碳反应,可生成甲烷。
橄榄石以Mg2SiO4和Fe2SiO4表示,反应后变为蛇纹石[Mg3Si2O5(OH)4]和磁铁矿。
第2题(8分)2-1195K,三氧化二磷在二氯甲烷中与臭氧反应得到P4O18。
画出P4O18分子的结构示意图。
2-2CH2SF4是一种极性溶剂,其分子几何构型符合阶点子对互斥(VSEPR)模型。
画出CH2SF4的分子结构示意图(体现合理的成键及角度关系)。
2-32018年足球世界杯比赛用球使用了生物基三元乙丙橡胶(EPDM)产品Keltan Eco。
EPDM 属三元共聚物,由乙烯、丙烯及第三单体经溶液共聚而成2-3-1EPDM具有优良的耐紫外光、耐臭氧、耐腐蚀等性能。
写出下列分子中不可用于制备EPDM的第三单体(可能多选,答案中含错误选项不得分)。
2-3-2合成高分子主要分为塑料、纤维和橡胶三大类,下列高分子中与EPDM同为橡胶的是:F 聚乙烯 G聚丙烯腈 H 反式聚异戊二烯 I 聚异丁烯第3题(12分)为纪念门捷列夫发现元素周期律150周年,国际纯粹和应用化学联合会将2019年设为“国际化学元素周期表年”。
门捷列夫预言了多种当时未知的元素,A即为其中之一。
将含元素A的硫化物矿在N2气氛中800℃处理,分解产物中右A的硫化物B;随后升温至825℃并向体系中通入氨气,得到红色化合物C,C溶于发烟硝酸得到白色沉淀D。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中学化学竞赛试题资源库——成键理论
A组 B组
1.下列各结构式中,最有可能的N2O Lewis结构式为
A N=N=O
B N≡N-O
C N-N≡O
D N=O=N 2.下列各Lewis结构式中,能正确表示出NO3离子的Lewis结构式是
-
A
O
2-
B
O
C
O
D
O
3.S2O3合理的共振结构式总数为 A 3 B 6 C 11 D 12 4.BF3的合理的共振结构式总数有
A 2
B 3
C 4
D 6
5.下列有关HOCN分子的共振结构中,最稳定的是 A H-O=C=N B H-O-C≡N C H -O≡C-N D H=O-C=N
6.假定CH3是平面结构,并且在外磁场中处于平衡,不成对电子处在什么原子轨道上?
A 2s
B 2px
C 2py
D 2pz 7.下列各组物质中,都含有两个π3的是 A N2O,CO2,N3- B N2O,NO2,N3- C N2O,CO2,NO2 D NO2,CO2,N3- 8.N2O4中
存在着
A 一个π3
B 两个π3
C 一个π6
D 两个π6 9.2001年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰泡林(Linus Pauling)教授诞辰100周年(1901~1994)。
1994年这位世纪老人谢世,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如图所示。
老人为什么画这个结构式?它是生命前物质?它能合成吗?它有什么性质?不得而知。
这是泡林留给世人的一个谜。
也许这是永远无法解开的谜;也许你有朝一日能解开它。
不管结果如何,让我们先对这个结构作一番考察:
(1)它的分子式是什么?
(2)它的所有原子是否处于同一个平面上?
(3)它是否带有电荷?
(4)该分子中sp杂化的N原子有个;sp2杂化个;sp3杂化个。
(5)为什么人们猜它是炸药?
10
.硫有许多同素异形体,在低温下用浓盐酸分解硫代硫酸钠时,在甲苯中结晶,得
中学综合学科网
第 1 页共 36 页
4
4
8
8
4。
