2016年高考化学大一轮复习讲义专题9化学实验(第1讲)苏教版
2016《创新设计》高考化学大一轮复习(江苏专用)配套课件 1-1化学实验常用仪器及基本操作-3

防腐蚀
防黏结
碱性溶液用橡胶塞盖
溶液等
知识串讲 考点精练
要点提取 试剂瓶选用的四个要素
1.瓶口:固体药品存放于广口瓶中;液体药品存放于细口
瓶中。 2.瓶质:与玻璃强烈反应的试剂(如氢氟酸)不能用玻璃试剂 瓶盛装。 3.瓶塞:强碱性溶液不可用带玻璃塞的玻璃试剂瓶来盛装。
4.瓶色:见光易分解的试剂应保存在棕色试剂瓶中。
[跟进题组] 1.下列保存物质的方法正确的是 ( )。
A.新制氯水保存在棕色广口瓶中,并放在阴凉处
B.波尔多液盛放在铁制容器中 C.氨水易挥发,应密封且在低温处保存 D.金属钠应保存在煤油中,防止被氧化 解析 新制氯水是见光易分解的液体试剂,应保存在棕
色细口试剂瓶中,A错;波尔多液中的CuSO4能与Fe发生
知识串讲
考点精练
解析
C2H5OH 既不是氧化剂,也不是腐蚀品, A 项错误;
HNO3是强氧化剂,具有强烈的腐蚀性,B项正确;NaOH是 强碱,具有强烈的腐蚀性,但不是氧化剂, C 项错误; HCl
是强酸,具有腐蚀性,但通常不作氧化剂,D项错误。
答案 B
知识串讲
考点精练
2.(高考题汇编)下列关于药品的保存方法不正确的是( A.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 B.硅酸钠溶液应保存在带橡胶塞的试剂瓶中 C.液溴易挥发,在存放溴的试剂瓶中应加水封 D.浓硝酸存放在带有玻璃塞的棕色试剂瓶中 解析
考点精练
防燃烧 防分解 防水解
置于阴凉处,不与氧化剂 混合贮存,严禁火种
苯、汽油、酒精等
保存在棕色瓶中,置于阴
凉处 加入酸(碱)抑制水解 能腐蚀橡胶的物质用玻璃 塞盖
浓硝酸、KMnO4、AgNO3
高考化学(苏教版)一轮复习配套课件:9-3常见物质的制备PPT优质课件

东 金 太
解析:大理石与稀硫酸反应生成的CaSO4微溶于水,附着在大理
阳 书
石上使硫酸不能与大理石接触,不能持续生成CO2,A选项错误;制取 业
Cl2应用浓盐酸且检验Cl2应该用湿润的淀粉碘化钾试纸,B选项错误;
业 有
制备时一般用可溶性铝盐与氨水反应。
限 公
司
菜 单 隐藏
课前 基础 探究
课堂 优化 探究
实验 思维 探究
课时 演练 探究
3.氢氧化铁胶体的制备
高考总复习 SJ 化学
山
(1)原理
东 金
化学方程式:FeCl3+3H2O==△===Fe(OH)3(胶体)+3HCl
太 阳
(2)操作步骤
书 业
加热蒸馏水至沸腾,逐滴滴加饱和氯化铁溶液,加热至液体呈 有
高考总复习 SJ 化学
山
(1)原理
东
金
CH3COOH+CH3CH2OH浓硫 △酸CH3COOCH2CH3+H2O
太 阳
书
(2)收集:饱和碳酸钠溶液
业 有
现象:碳酸钠溶液上层有 特殊香味的无色油状液体 。
限
公
司
菜 单 隐藏
高考总复习 SJ 化学
课前
基础
探究
(3)注意事项
课堂
优化 探究
①试剂的混合方法:先取无水乙醇,再沿器壁慢慢加入浓硫酸,
AlO- 2 +CO2+2H2O===Al(OH)3↓+HCO-3 。
山 东
(3)书写 Fe(OH)3 胶体制备的化学方程式时,切勿忘记“△”,错写
金 太
“ ”,多写“↓”和“↑”。
阳
书
业
有
限
公
司
2016《创新设计》高考化学大一轮复习(江苏专用)配套课件 1-1化学实验常用仪器及基本操作-2

化学实验基本操作
知识串讲
考点精练
1.药品的使用 取用 药品 固体药品 液体药品
粉末
块状
一定量
用 托盘
少量
多量
一定量 用 量筒、
使用
仪器
药匙 (或 纸槽 )
镊子
天平 称量
胶头 用试剂 滴定管(或 滴管 瓶倾倒 移液管) 量取
知识串讲 考点精练
知识串讲
考点精练
2.物质的溶解
(1)固体物质的溶解: ① 振荡 、 加热 、 搅拌 等可加快溶解速率;
试管底部,引起炸裂,B项错误;洗气时应该长导管进气,
短导管出气,C项错误。 答案 D
知识串讲
考点精练
3.检查装置的气密性是化学实验中的重要操作之一。按要
求回答下列问题:
(1)对于下列装置,不添加其他仪器无法检查气密性的是 ________。
知识串讲
考点精练
(2)下列关于不进行气密性检查可能导致的后果的叙述正确的 是________。 A.收集不到气体 B.造成环境污染
可分段检查,方法多是常用方法的组 合。如图装置,可分别关闭K1、K2, 分段检查。
知识串讲 考点精练
知识串讲
考点精练
5.仪器的安装与连接
(1)安装顺序:一般从热源开始,按 先下后上 、
从左到右
的顺序。
(2)连接顺序:洗气时,“ 长 进 短 出”,如a;量气时 “ 短 进 长 出”,如b;干燥管除杂时“大进小出”,如 c。
知识串讲
考点精练
6.实验装置气密性的检查方法
(1)常用方法 方法 原理 微热法 液差法
知识串讲 考点精练
3.玻璃仪器的洗涤
(1) 洗涤干净的标准:内壁附着的水膜均匀,既不聚成水
2016高考化学大一轮复习(江苏专用)配套课件 专题九 有机化学基础-3-2

正确;1 mol Y发生类似酯化的反应,最多消耗3 mol X,B错误;
X与足量HBr反应,分子中的三个醇羟基均要被溴原子取代,所
得有机物的分子式为 C24H37O2Br3 , C 正确;由于 Y 分子中含有 两个—NH2和一个—NH—,极性比癸烷强,D正确。 答案 B
知识串讲 考点精练
【考向揭示】 由以上题组训练,可得出本考点的基本命题方向如下: 1.考查醇的性质(消去反应、氧化反应等)
知识串讲
考点精练
乙烯的制备 A CH3CH2Br与NaOH乙醇溶液
试剂X H2O
试剂Y KMnO4酸性溶液
共热
CH3CH2Br与NaOH乙醇溶液 共热 C2H5OH与浓H2SO4加热至 170 ℃ C2H5OH与浓H2SO4加热至 170 ℃
B
H2O
Br2的CCl4溶液
C
NaOH溶液 KMnO4酸性溶液
考点二
醇的结构与性质
知识串讲
考点精练
1.概念:醇是烃分子中饱和碳原子上的一个或几个氢原子被羟
基取代的产物,饱和一元醇的分子通式为CnH2n+2O(n≥1)。 2.分类
知识串讲
考点精练
3.物理性质
知识串讲
考点精练
4.化学性质 分子发生反应的部位及反应类型如下:
知识串讲
考点精练
条件
断键位置
反应 类型 置换
②④
消去
浓硫酸 CH3CH2OH― ― ― ― → 170 ℃ CH2===CH2↑+H2O
①或②
浓硫酸 2CH3CH2OH― ― ― ― → 140 ℃ 取代 C2H5—O—C2H5+H2O
①
取代 CH3CH2OH+CH3COOH (酯化) CH3COOC2H5+H2O
高考化学第一轮复习苏教版

(4)过氧化氢(H2O2)分解成氧气和水的反应。
第一单元丰富多彩的化学世界
物质的聚集状态
重点:
1、气体摩尔体积的概念,单位L·mol-1
2、物质的聚集状态(气、液、固),三种聚集状态是由于在微观结构上存在差异,才导致了物质性质的不同
3、1 mol任何物质的质量,我们都可以用摩尔质量做桥梁把它计算出来若想要通过质量求体积,还须怎样才能达到目的呢?
习题:
1、溶液中可能有下列阴离子中的一种或几种:SO 、S0 、CO 、Cl-。
(1)当溶液中有大量H+存在时,则不可能有______存在。
(2)当溶液中有大量Ba2+存在时,溶液中不可能有______存在。
(3)当溶液中有______和______的阳离子存在时,上述所有阴离子都不可能存在。
2、要除去CO2气体中所含的少量HCl气体,最好的方法是将混合气通过( )
总结:
1、物质体积的大小取决于物质粒子数的多少、粒子本身的大小和粒子之间的距离三个因素。
2、当粒子数一定时,固、液态的体积主要决定于粒子本身的大小,而气态物质的体积主要决定于粒子间的距离。
3、在固态和液态中,粒子本身的大小不同决定了其体积的不同,而不同气体在一定的温度和压强下,分子之间的距离可以看作是相同的,所以,粒子数相同的气体有着近似相同的体积。
5、丁达尔现象
6、电离方程式
第二单元研究物质的实验方法
单元目标:
1.初步学会物质的检验、分离、提纯和溶液配制等实验技能。
2.树立安全意识,能识别化学品安全使用标识,初步形成良好的实验习惯。
3.能独立或与同学合作完成实验,记录实验现象和数据,完成实验报告,并能主动进行交流。
高三化学第一轮复习专题一化学实验苏教版知识精讲

高三化学第一轮复习:专题一:化学实验苏教版【本讲教育信息】一. 教学内容:专题一:化学实验二. 教学目标1、知道化学实验是科学探究过程中的一种重要方法,了解实验探究的一般过程。
2、了解控制实验条件的方法,能设计、评价和改进简单的实验方案。
3、能绘制和识别简单的实验仪器装置图,能对实验数据进行初步分析或处理,并得出合理结论。
4、能对探究方案、探究结论等进行分析和评价,能准确地表述探究结果,并应用探究结果解决相关问题。
三. 教学重点、难点探究实验的方法及解题技巧四. 教学过程(一)化学实验方案设计的原则①科学性的原则。
所设计的实验应该符合科学道理,不能凭空捏造②对照性的原则。
要设计一个对照性的实验,要想这个实验更能够说明问题,一定要有正反两个方面的实验。
③等量性的原则。
所设计的实验中的平衡反应,试剂的取用应该是等量的④单因子变量原则。
对某个实验的影响,会有很多的因素,实验正是要人为控制条件,使众多变量中,只能有一个因素是变量,其余几个是一样的。
(二)化学实验方案设计的基本思路(1)明确目的原理:首先必须认真审题,明确实验的目的要求,弄清题目有哪些新的信息,综合已学过的知识,通过类比、迁移、分析,从而明确实验原理。
(2)选择仪器药品:根据实验的目的和原理以及反应物和生成物的性质、反应条件,如反应物和生成物的状态、能否腐蚀仪器和橡皮、反应是否加热及温度是否控制在一定范围内等,从而选择合理的化学仪器和药品。
(3)设计装置步骤:根据上述实验目的和原理,以及所选用的实验仪器和药品,设计出合理的实验装置和实验操作步骤,学生应具备识别和绘制典型的实验仪器装置图的能力,实验步骤应完整而又简明。
(4)记录现象、数据:根据观察,全面准确地记录实验过程中的现象和数据。
(5)分析得出结论:根据实验观察的现象和记录的数据,通过分析、计算、图表、推理,得出正确的结论。
及到气体的制取和处理,对这类实验的操作程序及装置的连接顺序大体可概括为:发生→除杂质→干燥→主体实验→尾气处理。
2016高考化学大一轮复习(江苏专用)配套课件专题(精)

知识康讲]考点桶练考点二 物质氧化性.还原性强弱的比较知识康讲I 考点桶练STEP1.氧化性、还原性的判断(1) 氧化性是指物质得电子的性质(或能力h 还原性是指物 质失电子的性质(或能力)。
(2) 氧化性、还原性的强弱取决于物质得、失电子的难易程度,与得、失电子数目的多少无关。
如:Na-e ==Na\Al-3e"==Al 3+,但根据金属活动性顺序表,Na 比A1活泼,更易失去电子,所以Na 比A1的还原性强。
知识串讲学 有所H 2SO 4. KMnO 4等;最低价 一只有还原性,如金属单质、Cl-、S2-等;中间价态一既有氧化性又有还原性,如 Fe2+、s 、Cl?等。
知识串讲I 考点於练2・氧化性、还原性的强弱判断方法方法一:依据反应原理判断失电子,化合价升高,被氧化II原剂+氧化剂=_氧化产物+还原产物It得电子,化合价降低,被还原(还原性强)(氧化性强)(氧化性较弱)(还原性较弱) 氧化性:氧化剂厶氧化产物 还原性:还原剂上还原产物(3)从元素的价态考虑:【高价态如 F2+、可总结为:比什么性,找什么剂,产物之性小于剂。
知识串讲;考点梢练知识康讲!考点常练方法二:据“三表”判断(1)根据元素周期表判断。
知识崇讲I 考点於练(2)根据金属活动性顺序表判断oK Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag失电子能力逐渐减弱,单质的还原性逐渐减弱K+ C/+ Nf Mg2+ AP+ Z I ?+ Fe?+ 厲+) C I ?+ Hg2+ Ag+得电子能力逐渐增强,阳离子的氧化性逐渐增强(3) 根据非金属活动性顺序表判断oF2 C12 02 Br2(Fe”)【2 s P C Si 比得电子能力逐渐减弱,单质的氧化性逐渐减弱F- C1 一 BQ (Fe“)I 一 S?一P 3-失电子能力逐渐增强,阴离子的还原性逐渐增强金属单质的还原性逐渐增强, 对应阳离子氧化性逐渐减弱知识康讲!考点梢练方法三:根据"两池"判断(1)根据原电池原理判断:一般情况下■两种不同的金属构成 原电池的两极,其还原性:负极〉正极。
2016届高考化学大一轮复习 第一章 第1节 化学实验基本方法课件

【解析】 (1)A 项,碘元素是人体必需的微量元素,摄 入过多或过少都会对身体健康造成危害。过多摄入会引起高 碘甲状腺肿、甲亢、甲状腺组织硬化等不良后果,故不能多 吃富含高碘酸的食物;B 项,强氧化剂是易燃试剂的助燃剂, 二者应分开放置;C 项,金属钠着火用细沙灭火,不能用水 灭火;D 项,应用大量水冲洗,再用 NaHCO3 溶液冲洗;E 项,不能再用稀盐酸冲洗。
考向 1 化学品安全标志 1.(2010·北京高考)下列物质与常用危险化学品的类别 不对应的是( ) A.H2SO4、NaOH——腐蚀品 B.CH4、C2H4——易燃液体 C.K、Na——遇湿易燃物品 D.KMnO4、K2Cr2O7——氧化剂 【解析】 CH4、C2H4 为易燃气体。 【答案】 B
(4)氯水和浓 HNO3 应放在带有橡皮塞的棕色试剂瓶中, 并存放于阴冷处( )
(5)分离纯水和汽油可以用萃取法( ) (6)从食盐水中提取 NaCl 固体可用蒸发法( ) (7)从碘水中提取 I2,可用酒精作萃取剂( ) (8)分离汽油和煤油可用蒸馏法( ) 【答案】 (1)√ (2)× (3)√ (4)× (5)× (6)√ (7)× (8)√
【 答 案 】 (1)③④ (2)⑥⑧ (3)①② (4)②⑤⑦ (5)④⑦⑧
3.填写下列混合物的分离方法。 (1)除去粗盐水中的泥沙________。 (2)分离植物油和水的混合物________。 (3)提取溴水中的溴__________,分离溴的 CCl4 混合液 ________。
【答案】 (1)过滤 (2)分液 (3)萃取分液 蒸馏
【答案】 BD
考向 1 常见试剂的保存方法 3.下列物质的保存方法中正确的是( ) ①少量金属钠保存在四氯化碳中 ②浓硝酸盛放在无色试剂瓶中 ③少量金属钾保存在煤油中 ④硅酸钠溶液盛放在带有橡胶塞的试剂瓶中 ⑤氯水存放在带橡胶塞的棕色细口瓶中 ⑥碳酸钠固体保存在带橡胶塞的细口瓶中
高考化学大一轮复习讲义专题9化学实验(第1讲)苏教版

第1讲 化学实验基础知识和技能[考纲要求] 1.了解化学实验室常用仪器的主要用途和使用方法。
2.掌握化学实验的基本操作,能识别药品安全使用标志。
3.了解实验室一般事故的预防和处理方法。
考点一 常用化学仪器的识别与使用1.可加热的仪器(1)仪器①的名称为试管,加热液体时,液体体积不能超过其容积的13,加热固体时,试管口应略向下倾斜。
(2)仪器②的名称为蒸发皿。
使用方法:蒸发浓缩时要用玻璃棒搅拌。
(3)仪器③的名称为坩埚。
使用方法:用于固体物质灼烧,把坩埚放在三脚架上的泥三角上加热,取放坩埚必须使用坩埚钳,加热完的坩埚应放在石棉网上冷却。
(4)仪器④的名称为圆底烧瓶。
使用方法:a.常用于组装有液体参与反应的反应器;b.加热液体时,不能超过其容积的12。
(5)仪器⑤的名称为锥形瓶。
使用方法:a.可用于组装气体发生器;b.用于滴定操作;c.作蒸馏装置的接收器。
(6)仪器⑥的名称为烧杯。
使用方法:a.可用于物质的溶解与稀释;b.用于称量具有腐蚀性的固体药品;c.组装水浴加热装置。
2.常用的计量仪器 完成下列空白(1)仪器A 的名称:量筒;用途:量取一定体积的液体;精确度:0.1 mL 。
特别提醒 (1)无“0”刻度;(2)不可加热,不可作反应容器,不可用于溶液的稀释;(3)选取量筒的规则是“大而近”,例如量取5.6 mL NaOH 溶液应选取10 mL 量筒,而不能选 5 mL 或 50 mL 量筒。
(2)仪器B 的名称:容量瓶;用途:配制一定物质的量浓度的溶液;该仪器能长时间贮存溶液吗?不能。
(3)仪器C 的名称:酸式滴定管。
①使用前需“查漏”;②“0”刻度在上方;③不可盛装碱性溶液;④精确度:0.01 mL 。
(4)仪器D 的名称:碱式滴定管。
用于盛装碱性溶液,不可盛装酸性和强氧化性液体(如KMnO4溶液)。
(5)仪器E的名称:托盘天平。
①称量前先调零点;②腐蚀性药品应放于烧杯内称量;③左盘放被称物,右盘放砝码,即“左物右码”;④精确度:0.1 g。
2016届高考化学一轮复习题库专题9第一单元化学实验基础(苏教版)

专题九化学实验第一单元化学实验基础一、选择题1.化学实验设计和操作中必须十分重视安全问题和环境保护问题。
下列实验问题处理方法不正确的是()。
①制氧气时排水法收集氧气过程中出现倒吸现象,应立即松开试管上的橡胶塞。
②在气体发生装置上直接点燃一氧化碳气体时,必须要先检验一氧化碳气体的纯度。
最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声。
③实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室。
④给试管中的液体加热时应不时移动试管或加入碎瓷片,以免暴沸伤人。
⑤不慎将酸溅到眼中,应立即用大量水冲洗,边洗边眨眼睛。
⑥配制稀硫酸时,可先在烧杯中加一定体积的水,再一边搅拌一边沿烧杯内壁加入浓硫酸。
A.①②B.②③C.③⑤D.②⑥解析②应用排水集气法收集一氧化碳气体,不可用排空气的方法收集,因其密度与空气接近,难以排净空气;③实验结束后不可将实验的废液倒入下水道,应交实验员回收集中处理,否则会腐蚀管道、引发事故、造成污染等。
①④⑤⑥均正确。
答案 B2.下列实验操作中,正确的是()①用托盘天平称取5.2 g NaCl;②用50 mL量筒量取5.2 mL盐酸;③用蒸发皿加热NaCl溶液可以得到NaCl晶体;④用100 mL容量瓶配制50 mL 0.1 mol·L -1H2SO4溶液;⑤用带玻璃塞的棕色试剂瓶存放浓HNO3;⑥中和热测定的实验中使用的玻璃仪器只有2种A.①③⑤B.②④⑥C.①③④D.③⑤⑥答案:A3.下列物质与常用危险化学品的类别不对应的是()A.H2SO4、NaOH——腐蚀品B.CH4、C2H4——易燃液体C.CaC2、Na——遇湿易燃物品D.KMnO4、K2Cr2O7——氧化剂解析A项,H2SO4、NaOH都具有腐蚀性;B项,CH4、C2H4为易燃气体;C 项,CaC2、Na遇湿生成C2H2、H2易燃气体;D项,KMnO4、K2Cr2O7是常见的强氧化剂。
答案 B4.下列有关实验装置的说法中正确的是()。
高考化学大一轮复习讲义 专题9 化学实验(第4讲)苏教版-苏教版高三全册化学试题

第4讲 物质制备与工艺流程分析型实验题热点一 物质制备实验题物质制备是中学化学实验的重要组成部分,以新物质制备为背景的实验题,涉及知识面广、题型多变、思维发散空间大,能很好的考查学生综合运用化学实验基础知识解决实际问题的能力,因而倍受高考命题者的青睐。
解答此类试题的一般程序是第一,认真阅读题干,抽取有用信息;第二,仔细观察装置图(或框图),联想熟悉的实验,观察装置图(或框图),找出每件仪器(或步骤)与熟悉的某一实验相似的地方,分析每件仪器中所装药品的作用;第三,通读问题,整合信息作出答案,把所有的问题进行综合分析,运用题给信息和化学基础知识作出正确答案。
[典例] (2013·山东理综,30)审题指导 TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+CCl4(g)=====△TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:有关物质性质如下表:物质熔点/℃ 沸点/℃ 其他 CCl4-23 76 与TiCl4互溶 TiCl4 -25 136 遇潮湿空气产生白雾 仪器A 的名称是________。
装置E 中的试剂是________。
反应开始前依次进行如下操作: 组装仪器、________、加装药品、通N2一段时间后题干信息:反应条件是无水无氧,因而要先排空气,且要保持反应装置内干燥。
装置图信息:A 的作用是干燥氮气,B 处产生CCl4(g),C 为核心反应装置,D 为冷凝装置,E 为干燥装置,防止空气中的水蒸气进入。
表格信息:根据CCl4和TiCl4的沸点可知在冰水中都会液化,分离可用蒸馏。
问题信息:回答操作顺序,联系题干信息和装置特点知,N2必须进行干燥处理(干燥管);然后通过N2排除系统内的空点燃酒精灯。
反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。
正确的顺序为________(填序号)。
高考化学大一轮复习讲义 专题9 化学实验(第2讲)苏教版-苏教版高三全册化学试题
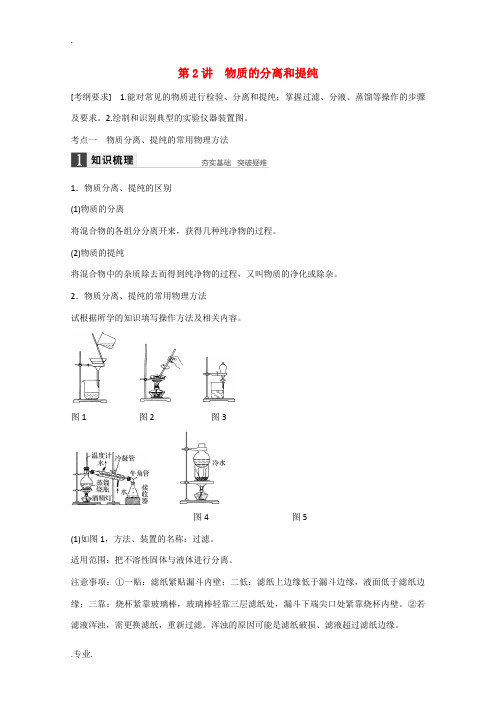
第2讲物质的分离和提纯[考纲要求] 1.能对常见的物质进行检验、分离和提纯;掌握过滤、分液、蒸馏等操作的步骤及要求。
2.绘制和识别典型的实验仪器装置图。
考点一物质分离、提纯的常用物理方法1.物质分离、提纯的区别(1)物质的分离将混合物的各组分分离开来,获得几种纯净物的过程。
(2)物质的提纯将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂。
2.物质分离、提纯的常用物理方法试根据所学的知识填写操作方法及相关内容。
图1图2图3图4图5(1)如图1,方法、装置的名称:过滤。
适用范围:把不溶性固体与液体进行分离。
注意事项:①一贴:滤纸紧贴漏斗内壁;二低:滤纸上边缘低于漏斗边缘,液面低于滤纸边缘;三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸处,漏斗下端尖口处紧靠烧杯内壁。
②若滤液浑浊,需更换滤纸,重新过滤。
浑浊的原因可能是滤纸破损、滤液超过滤纸边缘。
(2)结晶是晶体从饱和溶液中析出的过程,对溶解度受温度变化影响不大的固态溶质,采用蒸发溶剂的方法,而对溶解度受温度变化影响相当大的固态溶质,采用冷却饱和溶液的方法。
如图2,方法、装置的名称:蒸发结晶。
适用范围:溶解度随温度变化较小的物质。
注意事项:①玻璃棒的作用:搅拌,防止液体局部过热而飞溅;②当有大量晶体析出时,停止加热,利用余热蒸干而不能直接蒸干。
(3)如图3,方法、装置的名称:分液。
适用范围:①萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来;②分液:两种液体互不相溶且易分层。
注意事项:①溶质在萃取剂中的溶解度比在原溶剂中的大;②萃取剂与原溶剂不反应、不相溶;③萃取剂与溶质不反应。
(4)如图4,方法、装置的名称:蒸馏。
适用范围:沸点相差较大的液体混合物。
注意事项:①温度计的水银球放在蒸馏烧瓶的支管口处;②蒸馏烧瓶内要加沸石;③冷凝管水流方向应为“逆流”。
(5)如图5,方法、装置的名称:升华。
适用范围:某种组分易升华的混合物,利用物质升华的性质在加热条件下分离的方法。
高考化学大一轮复习讲义 专题9 化学实验(第3讲)苏教版-苏教版高三全册化学试题

第3讲探究型实验题热点一未知产物及物质性质的探究1.对未知产物的探究通过化学反应原理猜测可能生成哪些物质,对这些物质逐一进行检验来确定究竟含有哪些物质。
正确解答此类试题的关键:(1)猜测要全面;(2)熟记常见物质的检验方法。
[典例] 审题指导某研究性学习小组用下列装置(铁架台等夹持仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
联想:乙醇的催化氧化。
(1)用2%的CuSO4溶液和10%的NaOH溶液配制Cu(OH)2悬浊液的注意事项是________________________。
新制Cu(OH)2悬浊液与醛基的反应需要碱性条件。
(2)为快速得到乙醇气体,可采用的方法是______________________________________________。
若实验时小试管中的溶液已经开始发生倒吸,可采取的措施是________(填字母)。
a.取下小试管b.移去酒精灯c.将导管从乳胶管中取下d.以上都可以①升高温度可加速乙醇的挥发。
②若液体倒吸入加热的反应管,可能会造成反应管炸裂,取下小试管已无济于事,因“溶液已经开始发生倒吸”。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体M,充分反应后停止加热。
取下小试管,加热,有砖红色沉淀生成。
为了检验M的组成,进行下列实验。
①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;②经检验溶液中有铁离子和亚铁离子,检验铁离子的方法是____________________________;证明溶液含有亚铁离子的破题关键分析黑色固体(M)可能的成分,铁的氧化物Fe3O4、FeO和铁粉均为黑色,Fe3O4中既有+3价铁又有+2价铁,且具有磁性,Fe3+能溶解单质铁。
易错警示已知溶液中有Fe3+,检验Fe2+不能用KSCN溶液。
方法是___________________________________________________ _____________________。
高考化学大一轮复习 真题汇编 J单元 化学实验 苏教版

高考题分类目录J单元化学实验J1 化学实验常见仪器与基本方法9.J1 J2[2016·全国卷Ⅲ] 下列有关实验的操作正确的是( )9.D [解析] 配制稀硫酸时,应将浓硫酸沿着烧杯内壁慢慢注入水中,并用玻璃棒不断搅拌,A项错误;排水法收集KMnO4分解产生的O2,应先移出导管,再熄灭酒精灯,否则可能会发生倒吸现象使试管炸裂,B项错误;浓盐酸与MnO2反应制备纯净Cl2,气体产物应先通过饱和食盐水,后通过浓硫酸,否则不能除去水蒸气,C项错误;用CCl4萃取碘水中的I2时,振荡后分层,上层为水溶液,下层为I2的CCl4溶液,分液时先从分液漏斗下口放出有机层,后从上口倒出水层,D项正确。
7.J1 J2[2016·北京卷] 下列中草药煎制步骤中,属于过滤操作的是( )使草药的成分浸出, B项错误;把药渣去除,保留液体,是过滤的操作,C项正确;罐装保存,只是把草药转移到容器中保存, D项错误。
6.J1 J2[2016·江苏卷] 根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤。
下列图示装置和原理能达到实验目的的是( )A.制取氨气B.制取NaHCO3C.分离NaHCO3D.干燥NaHCO3图0-06.C [解析] 制取NH3需要NH4Cl与Ca(OH)2反应,若只加热NH4Cl生成NH3和HCl,在试管口遇冷又生成固体NH4Cl,可能堵塞导管,A项错误;制取NaHCO3时,向NH3和食盐的饱和溶液中通入CO2的导气管应长进短出,B项错误; NaHCO3在水中的溶解度小,可用过滤法分离,C项正确;加热NaHCO3会分解,无法得到干燥的NaHCO3,D项错误。
5.J1、J2、J3[2016·天津卷] 下列选用的仪器和药品能达到实验目的的是( )5.C [解析] 水与电石反应非常剧烈,应该用分液漏斗加水,既能控制水的滴入又能防止乙炔气体溢出,故A项错误;锥形瓶作蒸馏时的接收装置时不能用橡胶塞,用橡胶塞后,蒸馏的液体不能顺利流下,故B项错误;HCl与饱和的亚硫酸氢钠溶液反应生成SO2,从而除去HCl又不引入新杂质,故C项正确;K2Cr2O7溶液具有强氧化性,会腐蚀橡胶管,所以不能用碱式滴定管量取,应用酸式滴定管,故D项错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1讲 化学实验基础知识和技能[考纲要求] 1.了解化学实验室常用仪器的主要用途和使用方法。
2.掌握化学实验的基本操作,能识别药品安全使用标志。
3.了解实验室一般事故的预防和处理方法。
考点一 常用化学仪器的识别与使用1.可加热的仪器(1)仪器①的名称为试管,加热液体时,液体体积不能超过其容积的13,加热固体时,试管口应略向下倾斜。
(2)仪器②的名称为蒸发皿。
使用方法:蒸发浓缩时要用玻璃棒搅拌。
(3)仪器③的名称为坩埚。
使用方法:用于固体物质灼烧,把坩埚放在三脚架上的泥三角上加热,取放坩埚必须使用坩埚钳,加热完的坩埚应放在石棉网上冷却。
(4)仪器④的名称为圆底烧瓶。
使用方法:a.常用于组装有液体参与反应的反应器;b.加热液体时,不能超过其容积的12。
(5)仪器⑤的名称为锥形瓶。
使用方法:a.可用于组装气体发生器;b.用于滴定操作;c.作蒸馏装置的接收器。
(6)仪器⑥的名称为烧杯。
使用方法:a.可用于物质的溶解与稀释;b.用于称量具有腐蚀性的固体药品;c.组装水浴加热装置。
2.常用的计量仪器 完成下列空白(1)仪器A 的名称:量筒;用途:量取一定体积的液体;精确度:0.1 mL 。
特别提醒 (1)无“0”刻度;(2)不可加热,不可作反应容器,不可用于溶液的稀释;(3)选取量筒的规则是“大而近”,例如量取5.6 mL NaOH 溶液应选取10 mL 量筒,而不能选 5 mL 或 50 mL 量筒。
(2)仪器B 的名称:容量瓶;用途:配制一定物质的量浓度的溶液;该仪器能长时间贮存溶液吗?不能。
(3)仪器C 的名称:酸式滴定管。
①使用前需“查漏”;②“0”刻度在上方;③不可盛装碱性溶液;④精确度:0.01 mL 。
(4)仪器D 的名称:碱式滴定管。
用于盛装碱性溶液,不可盛装酸性和强氧化性液体(如KMnO4溶液)。
(5)仪器E的名称:托盘天平。
①称量前先调零点;②腐蚀性药品应放于烧杯内称量;③左盘放被称物,右盘放砝码,即“左物右码”;④精确度:0.1 g。
(6)仪器F的名称:温度计。
①测反应混合液的温度时,温度计的水银球应插入混合液中但不能接触容器内壁;②测蒸汽的温度时,水银球应在液面以上;测馏分温度时,水银球应放在蒸馏烧瓶支管口处。
3.常用的分离、提纯仪器仪器图形与名称主要用途使用方法和注意事项漏斗①用于过滤②向小口容器中转移液体③倒扣在液面上,用作易溶于水或溶液的气体的防倒吸装置①滤纸与漏斗内壁应严密吻合,用水润湿后,中间不得有气泡②过滤时,要做到“一贴、二低、三接触”分液漏斗①用于随时添加液体②萃取、分液①注意活塞不得渗漏②分离液体时,下层液体由下口放出,上层液体由上口倒出蒸发皿蒸发或浓缩溶液可直接加热,加热时液体体积不超过其容积的2/3,快蒸干时停止加热蒸馏烧瓶蒸馏或分馏①加热时要垫石棉网②加热时液体的体积不超过其容积的1/2,加沸石,防暴沸冷凝管①用于蒸馏或分馏时冷凝易液化的气体②有利于液体回流①直形冷凝管一般用于蒸馏或分馏时冷凝②球形冷凝管通常用于回流③冷却水下口进上口出深度思考1.判断正误,正确的划“√”,错误的划“×”(1)烧瓶、锥形瓶、量筒加热时均需要垫石棉网()(2)加热试管时先均匀加热,后局部加热()(3)用10 mL的量筒准确量取8.80 mL的稀硫酸()(4)坩埚加热时直接放在铁圈或三脚架上加热()答案(1)×(2)√(3)×(4)×2.有下列几种常见仪器:①分液漏斗②漏斗③酸式滴定管④容量瓶⑤碱式滴定管⑥球形冷凝管思考回答下列几个问题:(1)使用前必须检查是否漏水的是________(填序号)。
(2)酸式滴定管不能盛放烧碱溶液的原因是____________________________。
(3)球形冷凝管不能用于组装蒸馏装置的原因是:________________________________________________________________________________________________________________________________________________。
答案(1)①③④⑤(2)酸式滴定管玻璃活塞处是磨砂的,玻璃中的SiO2与烧碱溶液反应生成Na2SiO3,容易使活塞处粘合(3)冷凝后的液体容易残留在球形区域内3.如图所示,读数时同样是仰视,引起的读数误差相同吗?________;若不同,请指出读数误差情况________。
答案不同A图读数偏大,B图读数偏小4.下列仪器中,在灼烧固体物质时必须用到的仪器是________________________(填名称)。
答案坩埚、泥三角题组一常用仪器的识别及使用1.玻璃棒是化学实验中常用的仪器之一,其主要用于搅拌、过滤或转移液体时的引流。
下列有关实验过程中,通常不需要使用玻璃棒的是()①用pH试纸测定Na2CO3溶液的pH②从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl③用饱和FeCl3溶液和沸水制取Fe(OH)3胶体④配制一定物质的量浓度的氯化钠溶液⑤取某溶液做焰色反应实验,检验该溶液中是否含有钠元素⑥用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验⑦探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的的能量变化A.①②④⑤B.③④⑤⑦C.⑤⑥⑦D.③⑤答案 D解析③中制取Fe(OH)3胶体时,不能搅拌;⑤中取某溶液做焰色反应实验,检验该溶液中是否含有钠元素,需要铂丝和酒精灯,无需玻璃棒;⑦中要使反应及时充分进行,需用玻璃棒搅拌。
2.某学生的实验报告中有如下数据:①用托盘天平称取11.7 g食盐;②用量筒量取21.48 mL 盐酸;③用容量瓶配制210 mL 1 mol·L-1的硫酸溶液;④用标准NaOH溶液滴定未知浓度的盐酸,用去18.20 mL NaOH溶液,其中数据合理的是()A.①④B.②④C.①③D.②③答案 A解析解此题的关键在于依据所用仪器的精确度,如实记录可测得的可靠数值。
托盘天平的精确度为0.1 g,①正确;量筒精确度为0.1 mL,②错误;容量瓶的规格中有100 mL、250 mL、500 mL、1 000 mL等,没有210 mL的,③错误;中和滴定要用滴定管,滴定管的精确度为0.01 mL,题中18.20 mL的数值合理,④正确。
3.有如图所示A、B、C、D、E五种仪器:(1)请选择下列仪器名称的序号,填入相应的横线上:①蒸馏烧瓶②碱式滴定管③圆底烧瓶④长颈漏斗⑤分液漏斗⑥酸式滴定管⑦容量瓶A:________B:________C:________D:________E:_______________________。
(2)上述A~E五种仪器中,使用前必须检漏的有______,组装气体发生器必须液封的是________。
答案(1)①⑤④⑥⑦(2)BDE C规避计量仪器使用时的4个易失分点1.托盘天平的精确度为0.1 g。
2.量筒的精确度为0.1 mL,无“0”刻度,小刻度在下方。
3.滴定管的精确度为0.01 mL,“0”刻度在接近上口处。
4.容量瓶只有一条刻度线,只能读取一个值,该数值为容量瓶的容量值。
题组二仪器的组合与创新4.用下图所示装置进行如下实验,能达到实验目的的是()A.瓶中盛满水,从B口进气,用排水法收集NO2B.瓶中盛适量浓硫酸,从A口进气来干燥NH3C.从B口进气,用排空气法收集CO2D.瓶中盛满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积答案 D解析NO2可与水反应生成HNO3和NO,用排水法收集NO2得到的是NO;氨气可被浓H2SO4吸收;CO2的密度比空气的大,应用向上排空气法收集,即应从A管进气。
5.下图是几种常见的加热装置。
(1)A、B、C、D四装置都是用酒精灯直接加热,E、F装置加热时需垫________________。
其中F装置中对试管的加热方式是________________,采用这种加热方式的目的是____________________。
(2)H2还原CuO可选用________装置。
(3)NH4Cl与Ca(OH)2混合加热制NH3可选用______装置。
(4)胆矾中结晶水含量的测定可选用________装置。
(5)乙酸乙酯的制备可选用________装置。
(6)MnO2与浓盐酸混合制氯气可选用________装置。
若该装置只加热液体时,容器内必须放________________。
答案(1)石棉网水浴加热使仪器受热均匀,便于控制溶液的温度(2)A(3)C(4)D(5)B(6)E碎瓷片或沸石6.下图为常用玻璃仪器组成的六种实验装置,均可根据不同的实验需要在其中加入不同的液体或固体试剂。
请用适宜装置的序号完成下列填空:(1)能用于干燥CO2气流的装置是________________。
(2)在实验室制取Cl2并检验Cl2部分性质的实验中,用于除去Cl2中HCl杂质的最佳装置是______________。
(3)用于尾气吸收并能防止液体倒吸到反应装置中的是________________。
(4)接在气体制备的连续实验装置中间,用于控制气流平稳的装置是________________。
答案(1)AEF(2)A(3)CE(4)D广口瓶的“一材多用”要注意在广口瓶的不同用途中,导气管长短的不同。
1.装置A可作集气瓶和洗气瓶(1)作洗气瓶:装入适当的试剂除去气体中的杂质,气体“长进短出”。
(2)作集气瓶:①不装任何试剂,收集密度比空气大且不与空气反应的气体,气体“长进短出”。
②不装任何试剂,收集密度比空气小且不与空气反应的气体,气体“短进长出”。
③装水,可收集难溶于水的气体,装饱和食盐水,可收集Cl2,气体“短进长出”。
2.装置B用于测量气体的体积长导管与另一弯管连接伸入量筒底部,广口瓶中盛满水,气体“短进长出”。
将广口瓶中的水排到量筒中来测量难溶于水的气体的体积。
3.装置C和D作安全瓶(1)装置C用作防倒吸。
(2)装置D用作缓冲和防堵塞。
考点二常见的实验基本操作1.药品的取用(1)取用粉末状或小颗粒状固体用药匙(或纸槽),要把药品送入试管底部,而不能沾在管口和管壁上;块状和大颗粒固体用镊子夹取。
(2)取少量液体可用胶头滴管。
取用较多的液体用倾倒法,注意试剂瓶上的标签面向手心;向容量瓶、漏斗中倾倒液体时,要用玻璃棒引流。
2.试纸的使用(1)类型及作用石蕊试纸——定性检验酸碱性pH试纸——定量(粗测)检测酸碱性强弱品红试纸——检验SO2等有漂白性的物质淀粉-KI试纸——检验Cl2等有氧化性的物质(2)使用方法①检验溶液:取一小块试纸放在玻璃片或表面皿上,用玻璃棒蘸取液体,点在试纸中部,观察试纸的颜色变化,等pH试纸变色后,与标准比色卡对照。
