脑红蛋白
脑红蛋白在实验大鼠局灶性脑缺血组织中的表达及其对谷氨酸表达的作用

失; 5分 : 亡 。 死
脑 红 蛋 白 ( e rgo i, GB 为 含 有 铁 卟 啉 环 的 携 氧 n uo lbn N )
A — B外 , 操 作 同 干 预组 。 bNG 余
入 组标 准 : 血 组 5mi、. 、 缺 n 0 5h 1h亚 组 及 干 预 组 0 5 . h 1h亚 组 由 于麻 醉 尚未 清 醒 , 择 模 型 制 作后 对侧 前爪 屈 、 选
虫垦垄垒鱼堕芏塑塑垒 堂苤查
堡
卷箜
h N uo m nl LN uo 21 , o.8 N . i J eri u o 8 erl 0l g 11 , o6 n m
・
451 ・
疗。 综上所述 , 于男性 儿童 , 对 出现 渐 进 性 智 能 减 退 、 语 言
p a ma o o ia t e t nt t a e i s n l k d d e o e — h r c l g c l r a me s r t g e i x i e a r n l u n
k d srp y J. ri ah l2 1 ,0 4 :4 —5. o yto h [ ] BanP to ,O 0 2 ( )8 58 6
球 蛋 白 , 够 特 异 性 地 向 脑 组 织 供 氧 , 脑 组 织 具 有 保 护 作 能 对
用 。 谷 氨 酸 ( ltmi ai, U) 为 兴 奋 性 神 经 递 质 参 与 gua c c GL 作 d
脑红蛋白在脑梗死大鼠脑组织中的表达及其神经保护作用机制

[文章编号] 1671-587Ⅹ(2012)06-1114-05[收稿日期] 2012-07-26[基金项目] 陕西省自然科学基金资助课题(2010JM4054);陕西省教育厅科研基金资助课题(09JK713)[作者简介] 张 蓓(1980-),女,山东省济宁市人,主治医师,讲师,在读医学博士,主要从事脑血管病发病机制的研究。
[通信作者] 李亚军(Tel:029-84277893,E-mail:liyajun9@hotmail.com)脑红蛋白在脑梗死大鼠脑组织中的表达及其神经保护作用机制张 蓓,李亚军,张世俊,任会云,王敏娟,郭长江(西安医学院附属医院神经内科,陕西西安710077)[摘 要] 目的:观察脑梗死大鼠脑组织中脑红蛋白(Ngb)的表达及其对PI3K/Akt信号通路的影响,探讨二者在缺血性脑损伤中的作用及Ngb神经保护作用的可能机制。
方法:60只SD大鼠随机分为假手术组、缺血组、Hemin(Ngb诱导剂)组、LY(PI3-K/Akt抑制剂LY294002)组和Hemin+LY组,每组12只。
应用大脑中动脉线栓法制备脑梗死动物模型,术后24h观察各组大鼠神经功能评分和脑组织梗死体积;应用RT-PCR法检测各组大鼠脑组织Ngb mRNA表达水平及PI3-K/Akt活性。
结果:假手术组未见TTC不着色区,未检出神经功能缺损。
与缺血组比较,Hemin组大鼠脑组织中Ngb和Akt mRNA表达水平升高(P<0.01),神经功能评分降低(P<0.05),脑梗死体积减小(P<0.01);与缺血组比较,LY组大鼠脑梗死体积增加(P<0.01),神经功能评分升高(P<0.05),Akt mRNA表达水平降低(P<0.01),Ngb无明显变化。
与Hemin组比较,Hemin+LY组大鼠脑组织损伤加重,Akt mRNA表达水平明显降低(P<0.01),Ngb未被抑制。
结论:Ngb可以减小局灶性脑缺血大鼠脑梗死体积,改善神经功能,并且可能通过PI3K/Akt信号通路发挥神经保护作用。
急性一氧化碳中毒大鼠脑红蛋白表达变化的研究

脑与神经疾病杂志 2 0 年第 l 卷第 4 08 6 期
3 9 7
急性 一 氧化 川 刘和亮 李世 英 冯 云
摘 要 目的 : 究 急 性 一 氧 化 碳 中 毒 大 鼠 迟 发性 脑 病 模 型 中 脑 红 蛋 白 ( B 在 额 叶 皮 质 和 海 马 区 的 表 达 变 化 情 研 NG )
况 。方 法 : 腔 注射 纯 C 制备 急性 一 氧 化 碳 中毒 与 一 氧 化 碳 中 毒 迟 发 性 脑 病 的 大 鼠 模 型 。检 测 大 鼠大 脑 皮 质 及 海 马 腹 O 区细 胞 的脑 红 蛋 白的 表 达情 况 。 结果 : 急性 一 氧化 碳 中毒 后 大 鼠 额 叶 皮 质 的 N GB蛋 白 表 达 于 损 伤 后 第 1 上 调 , 天 以后 逐 渐 降 低 至 染 毒 后 2 d 而 海 马 区 NG 1; B表 达 降 低 并 呈 持 续 减 少 的趋 势 , 至染 毒 后 2d最 低 ; 对 照 组 相 比差 异 均 有 统 计 1 与 学意义(<00) p . 1 。病 理 学 检 测 显示 海 马 区神 经 细 胞 损 伤 程 度 较 额 叶皮 质 严 重 。 结 论 :1 脑 不 同 部 位 对 一 氧 化 碳 中 毒 () 的耐 受 性 差 异 可 能 与 N GB的 表达 有 关 。( ) B 的表 达 下 调 可 能 与 一 氧 化碳 中 毒 迟 发性 脑 病 的发 生 与 发 展 有 关 。 2 NG
关 键 词 一 氧 化碳 中毒 急 性 一 氧 化 碳 中毒 迟 发 性 脑 病 中 图分 类 号 : 7 7 8 R 4 . 文献 标 识 码 : A 脑红蛋 白
文 章 编 号 :1 0 —3 1 2 0 ) 4 3 9 0 0 6 5 X( 0 8 0 —0 7 — 4
脑出血大鼠脑红蛋白表达与脑含水量变化

703 ; eat n N uo re , eea H s t Sey n 胁  ̄g n Sey n 106 C i 102 Dp r t o er ugr Gnr o i l hnag胁 e m f s y l pao f i , hnag 1 1 , h a o 0 n A src O jc v T t y te ep s o fnuol i ( g ) i ba i u n rt wt bt t bet e a i o s d h xr s n o er o n N u ei gb h n ri tse i a i n s s h i r e ba hm r ae(C n a r ri e o hg IH)adterl os pbtenteepe i g n r nee aflwn tc e r n e t nh e e h xr s no N adba dm li g h a i i w so f h i oo
n au ecagso a a r ot t adWet nb t e sdt dt t eepes no N ri l sr t ne f ri w t n n. n s r l r ue e c t xr i g i ba e eh h b n ec e e ow e o e h so f h n n i e eut o pr h nr l t l r po hm o a g p t xr i f h i p i t u.R sl C m a dwt o a cn o g u rsa -pr e ru , eepes no g r s s e i m r o o e t d o h so N ne ・
【国家自然科学基金】_脑红蛋白_基金支持热词逐年推荐_【万方软件创新助手】_20140729
2011年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
2011年 科研热词 推荐指数 脑红蛋白 2 重组人源脑红蛋白 1 酶联免疫吸附检测 1 近红外光谱 1 转基因株系 1 贫血 1 记忆 1 脑部血氧参数 1 聚合酶链反应 1 红细胞生成素受体(epor) 1 红细胞生成素(epo) 1 突变 1 秀丽隐杆线虫 1 神经保护 1 汽车振动 1 氨基酸类 1 引物突变法 1 寿命 1 大肠杆菌 1 基因表达 1 地黄水提物 1 双抗夹心 1 原核表达 1 产卵率 1
推荐指数 6 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2013年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26
科研热词 推荐指数 脑红蛋白 6 免疫组织化学 2 鸡胚尿囊膜 1 转染 1 谷胱甘肽还原酶 1 血管新生 1 蛛网膜下腔出血 1 蛋白质印迹法 1 蕨麻 1 腺病毒载体 1 细胞红蛋白 1 细胞损伤 1 神经胶质瘤 1 神经保护剂 1 病毒包装 1 生肌玉红胶原 1 慢病毒属 1 实时荧光定量逆转录聚合酶链反应1 学习 1 大鼠 1 创伤性脑损伤 1 低压缺氧 1 β -淀粉样蛋白片段 1 sh-sy5y细胞 1 dha 1 1-溴丙烷 1
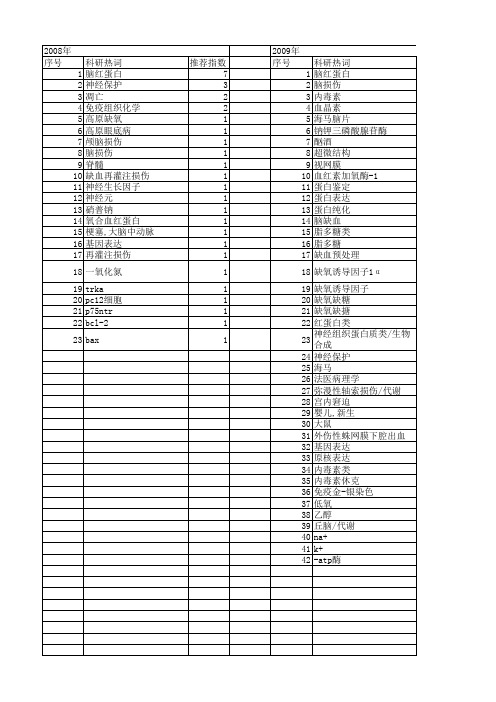
2008年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23
科研热词 脑红蛋白 神经保护 凋亡 免疫组织化学 高原缺氧 高原眼底病 颅脑损伤 脑损伤 脊髓 缺血再灌注损伤 神经生长因子 神经元 硝普钠 氧合血红蛋白 梗塞,大脑中动脉 基因表达 再灌注损伤 一氧化氮 trka pc12细胞 p75ntr bcl-2 bax
脑红蛋白的最新研究进展

脑红蛋白的最新研究进展黄飚,王德林重庆医科大学附属第一医院泌尿外科(重庆400016) 长期以来,血红蛋白和肌红蛋白被认为是脊椎动物仅有的2种携氧球蛋白。
但是,在2000年,德国科学家Burmester 在《Nature》上首次报道,在人和小鼠脑内存在一类新的球蛋白,基于它最先在神经系统表达,我们叫它神经球蛋白(neu⁃roglobin,NGB),又叫脑红蛋白[1]。
在过去的9年里,各国科学家掀起了一股研究脑红蛋白的热潮,尽管提出了大量各种假设,然而它的功能还是不能确定。
目前研究主要集中在脑红蛋白作为一种新型的携氧载体实现血氧向组织的运输,缺血缺氧性损伤中对神经元的保护作用,去除活性氧和一氧化氮(NO),抑制细胞凋亡等方面。
毫无疑问,脑红蛋白是一种新型、非常重要、功能多样的球蛋白。
1 脑红蛋白的结构和分布BURMESTER等[2]发现第3种球蛋白存在于人和小鼠的神经系统,从那以后我们逐渐发现直系同源的NGB存在于各种哺乳动物、鸟类、爬虫类、两栖类、鱼类等。
NGB的结构非常类似于另外一种我们非常熟悉的球蛋白-肌红蛋白(myoglobin,MGB),它由151个氨基酸组成,相对分子质量为1.7×107。
ZHANG等[3]率先克隆了大鼠NGB基因,hNGB基因长约8041bp,放射原位标记发现hNGB位于14q24染色体上。
NGB具有独特的外显子和内含子结构,其中3个内含子分别位于B12-2、E11-0和G7-0。
与血红蛋白(Hb)、肌红蛋白比较,E11-0为其独有的内含子。
NGB 具有经典螺旋三折叠结构特性,基本结构是1个血红蛋白结构和蛋白质肽链。
对大鼠NGB晶体研究发现NGB立体结构中存在1个大的中心凹陷包含了血红蛋白,人蛋白质内部活性部位、结合解离的途径[4]。
NGB最先被发现分布于中枢神经系统及外周神经系统,ZHANG等[3]利用免疫组化分析发现,NGB蛋白免疫反应阳性物质广泛存在于大鼠脑中,在脑中特异的分布于大脑皮质、海马、丘脑、下丘脑、嗅球和小脑[5]。
神经球蛋白简介

脑红蛋白在脑缺血的研究进展songxue 2000年Burmester等1在《Nature》上发表了名为《A vertebrate globin expressed in thebrain》的文章。
其中写到脑红蛋白(neuroglobin,Ngb)是继血红蛋白这种携氧的球蛋白发现以来的第三种蛋白质,主要表达在人和小鼠脑内。
自此关于脑红蛋白的研究便展开了,近十余年来,脑红蛋白成了很多神经科学学者研究的热门,诸多的学者将他们的方向定位在探讨脑红蛋白在大脑局灶性缺血缺氧的保护作用问题上2`3。
本文旨在其分布结构及脑保护的作用进行综述。
1脑红蛋白的分布1.1脑红蛋白mRNA在脑内定位Burmester错误!未定义书签。
初步检测了Ngb mRNA在脑中的分布:通过斑点杂交研究发现在大脑的前叶、下丘脑核和丘脑有较强的Ngb mRNA阳性信号的分布,形态学方面,原位杂交结果显示在海马的锥体细胞层有Ngb mRNA阳性物质存在。
邓美玉等4用地高辛标记的cRNA探针原位杂交组织化学技术观察了Ngb mRNA在成年大鼠脑中的正常分布:大脑皮质中Ngb mRNA阳性神经元分布广泛,尤以颞叶听区、扣带皮质、梨状皮质中的阳性细胞较为密集,在新皮质的第Ⅱ~V层均有阳性神经元分布,细胞形态以中型居多,阳性产物多集中于胞质。
海马的各区(CA1—4)均有NgbmRNA阳性神经元分布,阳性细胞主要是锥体细胞。
在锥体细胞层外的其他海马区域内有稀疏的阳性细胞。
前脑核团中,杏仁中央核、杏仁内侧核、杏仁皮质前核、杏仁皮质后核、梨状内核等均见Ngb mRNA阳性神经元的分布,数量中等,染色较强。
丘脑、下丘脑中Ngb mRNA阳性神经元散在分布,数量不多。
嗅球的僧帽细胞层染色阳性,胞体大,染色强度较弱。
小脑中Ngb mRNA阳性产物染色强,主要分布于蒲肯野细胞。
在脑干,脑桥网状结构及脑桥核中也观察到了Ngb mRNA阳性细胞的分布,数量较少。
脑红蛋白与脑保护

编码 区为 4 6b , ’ 5 p 3 端非编码 区为 10 8 b 。N b基因组为 7 p g
8 0 1 b , 含 四个 外 显 子 和 三 个 内 含 子 , 只 有 三 个 外 显 4 p 包 与 子 和两 个 内 含 子 的 M 和 n b 在 结 构 上 的 不 同 。外 显 子 g存
织 的氧供应圆 。另外 , g 还表达于 内分泌腺体 。本文仅就脑 Nb 红蛋 白的结构 、 分布 、 调控机 制及 其与脑保 护的关系综述 如
下。
胞 ; 脑干 , 在 脑桥 网状 结构及脑桥 核中也可观察 到阳性细胞
的 分 布 , 数 量 较少 。 但
1 Ng b的结构
N 主要 以单体形 式存在 , 次为二 聚体 , 其 极少量 为 四 聚体 , 其二聚体 以二硫键相 连。单体形式 的 N b由含有 11 g 5
以还原 ( 亚铁 ) 状态 即脱 氧形 式存在 , 其结构 为六 配体 ; 然而 在缺氧状态 时 N b主要 以五配体形式存在 。N b的三级结构 g g
可能为 E 一螺旋结构。N b末端有多个配体结合位点 , g 配体可
在各结合位点间移动 , 可能是 N b g 作为氧载体的结构基础 。
和视网膜 , 在分子水平 调节脑组织氧供应 状态 , 与脑 的氧供
应密切相关 ; 脑缺氧后 , 脑红蛋 白表达上调 , 参与维持对脑 组
核、 杏仁皮质前核 、 杏仁皮质后核 、 梨状 内核 等有 中等量 N b s
m N R A阳性神经元分布 ,其染色较强 ; g R A阳性神经 Nb m N 元 散在分 布于丘脑 、 下丘脑 , 数量 不多 ; 嗅球 的僧帽细胞层染 色强度较弱 ; 小脑 中阳性细胞染 色强 , 主要分布 于浦肯野细
脑红蛋白在脊髓缺血再灌注损伤中的表达及其意义

2,1 2,2 ,4 n 2h g o p r 0 2 - 0 0 ) 0 2 ± 0 0 ) O 3 ± 0 0 ) 0 4 ± 0 0 )a d ( . 2 0 0 ) r— 4 8h a d 7 r u swe e( . 6- . 5 ,( . 8 + - . 4 ,( . 0 . 5 ,( . 1 . 8 n 0 3 ± . 6 e
李红 岩 孙善 全△ 汪克建 黄柏 南 刘 超
40 1 ) 0 0 6
( 庆 医 科 大 学 基 础 医 学 院 神经 生 物 学 研 究 室 , 庆 重 重
摘要 目的 : 观察大 鼠脊髓 缺血再灌 注损 伤( C ) S I过程 中脑红蛋 白( g ) N b 的表达 变化及其 意义 。方法 : 康成年 Witr 健 s 大 a 鼠随机分为脊髓压迫缺血再灌注组和假手术对照组 。运用原 位杂交组 织化 学和免疫 印迹法 , 检测 压迫段 脊髓组 织中 Ng b 的表达变化。结果 : 再灌注 2h后 , g N b在压迫段脊髓开始表达上调 ,4h较为 明显 , 8h达峰值 , 2h表 达减少 , 2 4 7 与假手术 组相 比较 , 具有显著性差异 。免疫 印迹法 的结果 和上述 结果一致 。结论 : 在脊髓缺血再灌 注损 伤中 N b的表达变化与再灌 g 注时间相关 , 其表达上调是机体 内源性神 经保 护之一 。
( CI n r t. M e h d Fi y sx a u tW it r r t r a d ml i i e n o 6 g o p ,i c u i g s a o e a in g o p S )i a s to s f - i d l t s a a s we e r n o y dv d d i t r u s n l d n h m p r t r u o ( 一 6 n i e o e a in gr u s( )a d fv p r t o p 一 1 ) o 0 .Th p n l o d S o e se t b ih d wi e ̄ma e d v c n t e o e a e s i a r CI c m dl wa s a l e t as l s h d e ie i h p r — t n g o p . e e p e s n fNg i r u s Th x r s i s o b mRNA n r t i e es we e d t c e y u i g i iu h b i ia i n h s o h mit y o o a d p o en lv l r e e t d b sn n s t y r z t it c e s r d o a d W e t r l t n n t es i a o d t s er s e t ey n s e n b o t g i h p n l r i u e p c i l .Re u t Th x r s in o b mRNA s i c e s d a fe i c s v s ls e e p e so fNg wa n r a e t h a t r 2 S ,a d p a e t4 。 u p e r d t e u esg i c n l fe e e f so o 2 h Th b mRNA p ia e st sa CI n e k d a 8 h b ta p a e o r d c i n f a t a t rr p r u i n f r 7 . i y e Ng o tc ld n ii t e
脑红蛋白在人脑水肿时的表达研究

4 1 0 , ia) 7 0 3 Ch n
[ src Abtat Obet e Toe po etee p es no e rgo i N )i u n bane e n ] jci v x lr h x rsi f uo lbn( GB nh ma ri d maa d o n
( u o lbn NGB , Ne rgo i, ) 它有 较 高 的 氧 亲 和力 , 可逆 能
1 2 方 法 .
选取 四川 大学 华 西 法 医 病 理 学 教研 室尸 体 解 剖 的脑 组织 标本 , 正常 对照 组 和脑水 肿 组 , 分 每组 5例 。 其 中创伤 性脑 水肿 3 , 例 中毒 引起脑 水 肿 2例 。各例
b an e e r u h n t a ft en r l o to r u ( r i d mag o p t a h to h o ma n r l o p P ̄ 0 0 ) c g . 5 .Co cu in Th p' g ltd n lso eu 一e u a e r
e p e so fNGB i u a r i d ma i l d t a h x r sin o h m n b an e e n mp i h tt eNGB m a a e n u o r t c i e e f c n e y h v e r p o e tv fe ta d b g i s r i d ma e a an t b a n e e .
免疫组织化学方法检测脑红蛋白在大鼠中枢神经系统的分布

( src] Ab ta t
Obet e I r e o e po e te lc l a in o e r go i ( jci n o d rt x lr h o ai t fn u o lbn NGB) p o e si h v s e a i e y a s n ii e i m u o it c e ia e h d Re u t N G B p o en i m u o e c ie c l a swa x m n d b e stv m n hso h m c l t o . m s l r t i m n r a tv el s we e wi ey d s rb t dt r u h u h d l a r i r d l it i u e h o g o tt ea u tr tb an,i cu ig c r b a o t x n l d n e e r l re ,h p o a p s h lm u , c i p c m u ,t aa s h p t a a u .p n n e e e l m . NGB- m u o e ci e m a t r wa o a e n t e p a m fn u o s y o h lm s o sa d c r b lu i m n r a tv te s lc t d i h ls o e r n . Co cu in T h s aa s g e t d t a n l so e ed t u g s e h tNG B g n g tp a n i p ra tr l n t ec n r ln r o s s s e e mi h ly a m o t n o e i h e ta e v u y —
脑红蛋白对活性氧的清除作用及其在神经系统疾病中的功能意义

脑 红 蛋 白对 活 性 氧 的 清 除 作 用 及 其 在 神 经 系统 疾病 中的 功 能 意义 术
李 伟光 任 长虹 张成岗
( 军事 医学科学 院放射 与辐射 医学研究 所 , 白质组学 国家重点实验室 , 蛋 北京 10 5 ) 0 80
电 子 的 氧 原 子 或 原 子 团 , 常 包 括 超 氧 阴 离 子 通
( )过 氧化 氢 ( 等 多种形 式 , 机体 内具有 0 、 HO) 在
很强 的氧 化反应 能 力 , 与 各种 生 物 大 分 子 发 生反 易 应而 导致 细胞 和组 织 氧 化 损 伤 。通 常 , 入 机 体 的 进
国家 重 点 基 础研 究 发 展 规 划 项R S O O 。R S是 机体 正 常代 谢 的 中
间产 物 , 理状态 下人 体 内 R S处 于产 生与 清 除 的 生 O
动态平衡 中 , 而此 平 衡 主要 依靠 机 体 内的抗 氧化 系
统进行 维持 。机 体 内过 多 的 R S是 产 生 氧 化 应 O 激 的重要 因素 , 是致 病 的重要 原 因 , 也 如神 经系 统退
行性 疾 病 、 中 风 、 瘤 等 , 此 清 除 体 内过 多 的 脑 肿 因
R S或 防止过 多 R S的产 生 已成 为预 防神 经 系统 O O
一
、
( )N B在 神经 系统 中 的作 用 一 G
N B是新 发 G
现 的存 在 于 人 和 小 鼠 脑 部 的 第 三 类 携 氧 珠 蛋 白
( umet 等.20 ) 与 氧 的亲 和力 较高 ( 5 2 Br sr e 00 , P0
脑红蛋白及其在神经系统疾病中的研究进展

脂 质筏 , , 蛋 白一 可能通过 类似 方式募 集 N b 因此 筏 1 g 到脂 质
筏, 防止神经元死亡 。 3 3 N b与 N . .T . g a K A P酶 1亚基 3 徐文琳等利用酵母 双
家族中第一个具 有 6个配体的单体蛋 白, 1 1 氨基酸组 由 5个 成, 相对分子质量约为 1 D。P se等研究表 明 , 7K ec 缺少 外源 性 配体 时, g N b呈 HsF ”一 i对称 螺旋结构 , i F 离解 i e Hs — Hs e . 速度及结合 氧速度较慢 ( 1s , 约 ) 其原 因是 O 、 O与亚 铁血 C
1 N b的 分 布 g
脑 内 N b主要分 布于大脑皮 层第 1~Ⅵ层 、 马各 区 , g 海 定位于锥体 细胞 、 丘脑和下丘脑 的部分核 团及小脑蒲 肯野 细 胞 。正 常大 鼠脑 内 N b位 于脑 神经元 的胞质 ; g 脊髓 内 N b定 g 位 于脊髓神经元 的胞质 , 主要 分布于 颈 、 腰 段灰 质 中 , 胸、 以 前 角神经元含 量最丰富 。正常大 鼠视 网膜节细胞层 、 内核层 及视锥视杆层 细胞 N b表达阳性 ; g 消化道大多数肌 间神经丛 及 黏膜 下、 脊神经根 、 马尾及 坐骨神 经 中的有髓 神经纤 维轴 突、 视神经均有 N b阳性细胞分布 。在神经系统外 器官组织 g 中, 如睾丸间质细胞 、 肾上腺皮质球状带的多数细胞 , 以及脑 垂体、 腺垂体 的内分泌 细胞 N b均呈 阳性 。 g
N b可能通过 与 N 一 . T g a K A P酶 亚基 作用 , 增加神经元 膜
稳定性 。
3 4 N b与低 氧诱导 因子 1 H F 1 H F1是 转录 因子 , . g ( I 一 ) I.
脑红蛋白内源性神经保护因子

等[5]观察发现,慢性长期低氧条件下小鼠脑内 NGB 的 表达无增加。Hundahl 等 通 [6] 过对小鼠研究,发现短期 低氧并 不能改变 NGB 在脑中及 视网膜中的表 达水 平,结合 Mammen 等 的 [5] 研究得出结论为纯低氧因素 对活体内 NGB 的表达并无调节作用。 1.2 缺血对 NGB 表达的影响 在脑缺血情况下,脑 组织中 NGB mRNA 水 平增加[2,7- 8],神经元细胞 质中 NGB 的免疫反应增强[2]。但 Hundahl 等[9] 通过研究自 发性高血压大鼠,发现缺血并不能使脑中 NGB 的表 达发生明显变化。Schmidt- kastner 等 对 [4] 短暂大鼠脑 缺血研究认为:缺血不能增加哺乳动物大脑 NGB 的 表达。
的清道夫,清除缺氧性脑病体内的氧化产物,如 NO、
H
2O
2、NO
2
等。Fordel
等 进 [12] 一步证实了这一点,认为
NGB 在抵御氧化损伤中起重要作用。
3 对缺血的保护
纯缺氧性损伤并不常见,但缺氧常伴缺血表现。 为研究 NGB 在缺血性脑损伤中的功能,Sun 等[13]通过 脑室注入 NGB 反义寡 (脱氧)核苷酸,大鼠中动脉闭 塞后脑梗死面积增加;给予表达 NGB 的腺病毒载体后 与对照组比较,梗死灶体积减小 50 %。Khan 等[14]研究 显示过分表达 NGB 的转基因小鼠,可以降低脑梗死 体积,同时发现,心脏中过分表达 NGB 可以降低冠脉 闭塞后的心梗面积,提示 NGB 在缺血时的保护效应 可以同样出现于非神经细胞。
脑红蛋白与脑损伤研究现状

实用 医学杂 志 20 0 7年第 2 3卷第 5期
75 6
脑 红蛋 白与脑 损 伤研 究 现 状
高贵 山 于晓军 徐 小虎
脑红 蛋 白( erg bn g ) n uol i,N b 由德 国 慢性炎症 、 o 小脑 、 胎胸腺 、 膀胱癌 、 乳腺癌 、 中具 有重要作 用 。脑组 织具 有十分 复杂
n g s - 视 网膜 神 经 所 有 神 经 元 中均 有 N b表 等 []研 究 表 明 生 理 状 态 下 N b的 Hi 渐增 高。通过 反义寡核 苷酸技 术转 染培 g g e. s : O有 养 细胞后 ,发 现 N b表达较 正常 明显下 达 。其浓度 为脑 内浓度 的 5 - 0 0 10倍 , 且 F “Hi脱 氧 6配位 形 态对 O 和 C N b表达下降 很高 的亲 和力 。一旦 有 O 和 C : O就 会快 降 。细胞更 易受缺氧影响 , g 其 分布与亚 细胞 线粒 体 的分 布相 关[ 。 ]
名为脑红 蛋白。
g 织 中均存在 高度表达 的 N b基因 ,在外 与血 红素铁结合 。在高铁 和亚 铁状 态下 2 N b与 脑 损 伤 g Y nnB等 [] 察 了培 养 的小 鼠皮 u ja :观 - N b均呈 6配 位低 自旋构 象 ,在 p ~ g H5 发现 剥夺 氧气时 , s 表 达逐 Nb 0范 H值变化不 敏感 [] ec “。P se 织 . 肾上腺和垂 体也有表 达[ 如 。在小 鼠 1 围 内对 p
B r et 等 [于 2 0 um s r e ] 00年 首先报 道 。 究 H l.3细胞 、 研 eaS 肝癌 、 胎心 , 提示 N b除在 的神 经功能 。能量供应 几乎 全部靠 有氧 g
脑红蛋白与高原低氧性脑保护

生 理 科 学 进展 20 0 8年 第 3 9卷 第 2期
・
l5・蛋 白与 高原 低 氧性 脑 保 护 水
韩 淑芬 格 日力
( 青海大学医学院高原 医学研究 中心 , 西宁 800 ) 10 1
摘要 脑红蛋 白( erg b ,G ) nu l i N B 是新近发现的一种在脊椎 动物神经系统和少量 内分泌腺体 中 oon 大 量特异 性表达 的携氧球 蛋 白, 与氧有 很高 的 亲和力 , 维持 着 神经 元 的 氧平 衡调 节作 用 , 它的发 现 在 脑缺氧 研 究方面 引起 了广 泛关注 。 高原 的核 心是 缺 氧 , 氧 能够 诱 导 N B的 高表 达 , 而提 高 缺 G 从
源性 , 这些 都 暗示 N B在神 经 系统方 面有 一个 重要 G
细胞代谢的需求 ; 在高耗氧的肌 肉组织中, 肌红蛋 白 ( yg bn G 以单体 形 式 携 氧 , 速 氧 向线 粒 m ol i,M B) o 加
体扩 散 和传递 , 为肌 肉组 织储存 和转 运 氧 ; 红蛋 白 胞 (y g bn,C B) 泛 分 布 于 多 种 组 织 和 器 官 ct l i oo G 广
( um s r B r et 等.2 0 , 能 与 胶 原 的形 成 有 关 ; e 0 2) 可 脑 红蛋 白( er l i,N B 主要 分布在 神经元… , nuo o n G ) gb
而保守的功能 。
_ _ ● ● ● ●
●
扫
逮存清
储氧
能
~
9 % 。人 N B为 单 拷 贝 基 因 , 位 于 1q4 全 长 4 G 定 42 ,
图 1 四种携氧球蛋白的组织分布 、 结构和功能
心肺脑复苏患者血液中脑红蛋白及N端脑钠肽前体的表达意义

临森医学工 5 5 ・
论著・
( 临床研 究 )
心肺脑复苏患者血液中脑红蛋 白及 N端脑钠肽前体的表达意义
阳生光 ,张欣 洲 2 7林 少珍 ,向华 国 ,颜石 新
( 深圳 市宝 安 区福永人 民医 院 急诊科 ,。 中心 实验 室 ,广东 深 圳 5 1 8 1 0 3 ; 深圳 市人 民医院 肾内科 ,广东 深 圳 5 1 8 1 0 3 )
NP )在 心 肺 脑 复 苏 中 的 变化 与 意 义 。方 法 1 2 6例 心 搏 骤 停 ( c a r d i a c a r r e s t ,C A) 患 者按 抢 救 结 果 分 为 A 组 :心 肺 脑 复 苏 3 O m i n
无 自主循环 ,或 有 自主循环但 <4 8 h :B组 : 自主循 环恢复 ≥4 8 h ,未能存活 出院;C组 :抢救成功 ,存活 出院。于心肺脑复 苏 0 h( 即刻 ) 、3 h 、1 2 h 、2 4 h 、4 8 h留取 静脉血 ,测定血 清 中 NGB和 血浆 中 NT— p r o B NP的含 量。结果 在 0 h ,NT - p r o B NP
0 E m e r g e n c y D e p a r t m e n t , 3 C e n t r a l L o b o r a t o r y , F u y o n g P e o p l e s Ho s p i t l 《B a a o a n D i s t r i c t S h e n z h e n 5 1 8 1 0 3 , C h i n a ;
脑红蛋白在绵羊视网膜中的分布

脑红蛋白在绵羊视网膜中的分布杨阳;刘霞;高雪晋;梁春花;陈斌;杜晓华【期刊名称】《解剖学杂志》【年(卷),期】2015(000)003【摘要】目的::探讨脑红蛋白在绵羊视网膜的分布特征。
方法:利用免疫组织化学显色 SP 法,观察脑红蛋白在健康成年绵羊视网膜中的分布情况。
结果:脑红蛋白在绵羊视网膜的视神经纤维层、内网状层、外网状层和光感受器内节段中有强阳性表达,在视网膜的内核层和节细胞层有弱阳性表达,在视网膜外核层、光感受器外节段和色素上皮层中未见有阳性表达,内界膜、外界膜和视神经中亦有脑红蛋白阳性表达。
绵羊视网膜脑红蛋白阳性表达的细胞类型主要有节细胞、双极细胞和光感受器细胞,其中节细胞的阳性表达定位于细胞质,胞核中未见表达。
结论:除外核层、光感受器外节段和色素上皮层外,脑红蛋白在绵羊视网膜其他各层中均有表达,提示脑红蛋白在维持视网膜中氧平衡状态时发挥重要作用。
【总页数】4页(P275-278)【作者】杨阳;刘霞;高雪晋;梁春花;陈斌;杜晓华【作者单位】甘肃省农业大学动物医学院,兰州 730070;甘肃省农业大学生命科学技术学院,兰州 730070;甘肃省农业大学生命科学技术学院,兰州 730070;甘肃省农业大学动物医学院,兰州 730070;甘肃省农业大学生命科学技术学院,兰州 730070;甘肃省农业大学动物医学院,兰州 730070【正文语种】中文【相关文献】1.视网膜氧分布与脑红蛋白作用模型解的存在唯一性 [J], 陈美癸;卫雪梅2.脑红蛋白在糖尿病大鼠视网膜中的表达 [J], 许星照;华飞;冯建国;谈炎;刘瑶3.成年大鼠视网膜中脑红蛋白表达的亚细胞分布 [J], 徐琼;黄晓峰;魏小燕;武明媚;丁国鹏;李耀宇4.脑红蛋白在家兔视网膜中的分布 [J], 杨阳;刘霞;曾国敏;高雪晋;梁春花;杜晓华5.脑红蛋白在糖尿病大鼠视网膜病变发展中的表达变化 [J], 刘琼;于健;陈林江因版权原因,仅展示原文概要,查看原文内容请购买。
携氧血红蛋白、肌红蛋白、脑红蛋白

携氧血红蛋白、肌红蛋白、脑红蛋白
刘连生
【期刊名称】《《医学信息》》
【年(卷),期】2011(024)008
【摘要】脑红蛋白是继血红蛋白、肌红蛋白之后发现的第三类具有运输与储存氧
的球蛋白。
血红蛋白能够将氧从肺泡经血管输送到全身组织以满足细胞代谢的需求。
肌红蛋白能够加速氧向线粒体的扩散和传递,并储备氧以满足应激状态下氧的需求。
脑红蛋白能够可逆地结合氧,且与氧有很高的亲和力,能够特异性地向脑组织供氧。
【总页数】1页(P5411)
【作者】刘连生
【作者单位】长江大学医学院湖北荆州 434023
【正文语种】中文
【相关文献】
1.血红蛋白交联条件优化及其携氧性能 [J], 张玉;庄海燕;陈浩然;谷劲松
2.携氧血红蛋白、肌红蛋白、脑红蛋白 [J], 刘连生
3.血红蛋白携氧-释氧动力学研究 [J], 江川;王翔;高玮;彭雁;谢家馨;李遥金
4.脑红蛋白和细胞红蛋白:携氧蛋白质家族2个新成员 [J], 杨立涛;刘爽;于常海
5.一类新携氧球蛋白——脑红蛋白 [J], 任雪平;刘双喜
因版权原因,仅展示原文概要,查看原文内容请购买。
脑血红蛋白浓度指数在体外循环中的应用

脑血红蛋白浓度指数在体外循环中的应用贾在申;腾轶超;李岳;谢海秀;刘媛;侯晓彤【摘要】Objective Using continuous-wave near infrared spectroscopy (NIRS ),human cerebral tissue hemoglobin concentration index (tHI)is detected non-invasively and in real time,so that the change percentage of cerebral total hemoglobin concentration can be indicated and cerebral hemodynamics as well as oxygenation can be evaluated.Methods Based on the propagation of near-infrared light in human brain,the near-infrared oximeter was developed,and the cerebral tHI as well as cerebral oxygen saturation of 8 infants suffered from congenital heart disease were monitored non-invasively and in real time under cardiopulmonary bypass.Results During modified ultrapurification in the end of cardiopulmonary bypass,the cerebral tHI of all the infants increased significantly at the average speed of (0.0304 ±0.0136)mM/(cm?min),P<0.001 . Comparing the end to the beginning of modified ultrapurification,the cerebral tHI increased for (18.8±7.5)%,because the hematocrit was increase d by filtering out the redundant water in the blood.The cerebral oxygen n<br> saturation increased for (5.3 ±4.1 )% (P <0.05 ), which was not so obvious as the increase trend of cerebral tHI.Conclusions During modified ultrapurification in the end of cardiopulmonary bypass,the changes of cerebral hemodynamics and oxygenation may be indicated effectively by cerebral tHI.%基于稳态的近红外光谱技术,可无创、实时监测脑组织血红蛋白浓度指数,以反映人体脑组织中血红蛋白总浓度变化的百分比,从而有利于评价脑血流动力学及脑氧合。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
416Mol.Biol.Evol.19(4):416–421.2002᭧2002by the Society for Molecular Biology and Evolution.ISSN:0737-4038Cytoglobin :A Novel Globin Type Ubiquitously Expressed in Vertebrate TissuesThorsten Burmester,*Bettina Ebner,†Bettina Weich,†and Thomas Hankeln †*Institute of Zoology;and †Institute of Molecular Genetics,Biosafety Research and Consulting,Johannes Gutenberg UniversityVertebrates possess multiple respiratory globins that differ in terms of structure,function,and tissue distribution.Three types of globins have been described so far:hemoglobin facilitates the transport of oxygen in the blood,myoglobin serves oxygen transport and storage in the muscle,and neuroglobin has a yet unidentified function in nerve cells.Here we report the identification of a fourth and novel type of globin in mouse,man,and zebrafish.It is expressed in apparently all types of human tissue and therefore has been called cytoglobin (CYGB).Mouse and human CYGBs comprise 190amino acids;the zebrafish CYGB,174amino acids.The human CYGB gene is located on chromosome 17q25.The mammalian genes display a unique exon-intron pattern with an additional exon resulting in a C-terminal extension of the protein,which is absent in the fish CYGB.Phylogenetic analyses suggest that the CYGBs had a common ancestor with vertebrate myoglobins.This indicates that the vertebrate myoglobins are in fact a specialized intracellular globin that evolved in adaptation to the special needs of muscle cells.IntroductionGlobins are respiratory proteins that usually bind an oxygen molecule between the iron ion of the por-phyrin ring and a histidine of the polypeptide chain (Dickerson and Geis 1983).Globins have been found in bacteria,plants,fungi,and animals and play an impor-tant role in the respiratory system (Hardison 1996).In the jawed vertebrates (Gnathostomata),three types of globins have been described.The heterotetrameric he-moglobin in the red blood cells serves to transport ox-ygen in the circulatory system (Dickerson and Geis 1983).The monomeric myoglobin in the muscle acts as an oxygen buffer and may facilitate oxygen diffusion (Wittenberg and Wittenberg 1989;Wittenberg 1992),and it was recently shown to be involved in the detox-ification of NO (Flo ¨gel et al.2001).Because of their high concentrations in the blood and muscles,respec-tively,the vertebrate hemoglobins and myoglobins are among the best-studied proteins in terms of structure,function,and evolution (Dickerson and Geis 1983;Har-dison 1996,2001).Neuroglobin,expressed in mouse and human brain,has just recently been added to the vertebrate globin family (Burmester et al.2000).Neu-roglobins are phylogenetically ancient,and it has been suggested that they enhance the oxygen supply of nerve tissues.These data suggested that the oxygen metabo-lism of vertebrates is more complex than previously thought and that other globins of yet unknown function remained to be discovered.Here we report the discoveryAbbreviations:CYGB,cytoglobin;RT-PCR,reverse transcrip-tion–polymerase chain reaction;SSC,standard saline citrate.Key words:globin,myoglobin,cytoglobin,evolution,gene duplication.Address for correspondence and reprints:Dr.Thomas Hankeln,Johannes Gutenberg University Mainz,Institut fu ¨r Molekulargenetik,Becherweg 32,D-55099Mainz,Germany.E-mail:hankeln@molgen.biologie.uni-mainz.de.Correspondence and requests for material should be addressed to T .B.(burmeste@mail.uni-mainz.de)or T .H.(hankeln@molgen.biologie.uni-mainz.de).and molecular evolutionary analyses of a novel verte-brate globin type,named cytoglobin (CYGB).Materials and MethodsCloning and Sequencing of Mouse,Human,and Zebrafish CYGBsHuman and mouse EST databases were searched using the TBLASTN algorithm (Altschul et al.1990)with the amino acid sequence of the Drosophila globin (Burmester and Hankeln 1999)as query.Several partial EST matches for Human (accession numbers R87866,AI093531,AL514650,AL516826,AL514972,and BE313504)and mouse (AA469788,AA469798,BE648697,and BF159503)were extracted from the da-tabases and aligned.Specific oligonucleotide primers were designed according to these aligned EST sequences (Human—HsCYGB-N 5Ј-ATGGAGAAAGTGCCAGG CGAGATG-3Јand HsCYGB-B 5Ј-TTACGGCCCCGA AGAGGGCAGT-3Ј;mouse—MmCYGB-N 5Ј-ATGG AGAAAGTGCCGGGCGACATG-3Јand MmCYGB-B 5Ј-TTACGGCCCTGAAGAGGGCAGA-3Ј)and used to amplify CYGB cDNAs making up the complete coding regions from mouse and human brain total RNA by re-verse transcription–polymerase chain reaction (RT-PCR;using SuperScript TM reverse transcriptase,Life Technol-ogies).The PCR products were cloned into the pGEM-Teasy vector (Promega)and sequenced on both strands using DyeTerminator TM chemistry (Applied Biosystems)on ABI377sequencers by GENterprise GmbH,Mainz,Germany.Sequences were deposited under the accession numbers AJ315162(human CYGB cDNA)and AJ315163(mouse CYGB cDNA).A zebrafish (Danio rerio )CYGB cDNA clone was identified by EST da-tabase searching and obtained from the Resource Center,Berlin,Germany (http://www.rzpd.de),and sequenced by a primer walking strategy (accession number AJ320232).Expression Analysis of Human CYGBAn RNA Master Blot TM (Clontech)containing nor-malized amounts of polyA ϩRNA from 50human tis-at Gansu Agricultural University on August 4, 2014/Downloaded fromCytoglobin417F IG.1.—Comparison of human,mouse,and zebrafish CYGBs(HsaCYGB,accession number AJ315162;MmuCygb,AJ315163;DreCygb, AJ320232)with human myoglobin(HsaMB,M14603)and hemoglobins␣and(HsaHBA,J00153;HsaHBB,M36640)and a lamprey globin (LzaHbA,Z24746).The globin consensus numbering is given below the sequences;the secondary structure of the sperm whale(Physeter catodon)myoglobin is superimposed in the upper row.Alpha-helices are designated A through H,and amino acids strictly conserved between the CYGBs and the myo-or hemoglobins are shaded.The intron positions in the human CYGB gene(at B12.2,E11-0,and HC11-2)are indicated by arrows.sues was hybridized to a32P-labelled(Feinberg and Vo-gelstein1983)subcloned CYGB cDNA probe containing the complete coding sequence(accession number AJ315162).Washing was performed at68ЊC in0.1ϫstandard saline citrate(SSC)solution.Signals were quantified on a Fuji BAS-1800phosphorimager.No nonspecific binding of the probe was observed to yeast total RNA and tRNA,E.coli rRNA,poly rA,and human C o t1repetitive DNA.Sequence and Phylogenetic AnalysesSequence analyses were carried out with the pro-grams provided by the Software Package9.0from the Genetics Computer Group(GCG),Wisconsin,and the ExPASy web server(http://www.expasy.ch).The geno-mic organization of the human CYGB gene was depicted using the PIPMAKER program(/ pipmaker/;Schwartz et al.2000).Amino acid sequences of selected vertebrate globins were aligned with ClustalX(Thompson et al.1997)and corrected using published alignments(Burmester and Hankeln1999; Burmester et al.2000)and globin structural data.The software packages PHYLIP3.6(Felsenstein2000)and TREE-PUZZLE5.0(Strimmer and von Haeseler1996) were applied for phylogenetic inference.Gamma-cor-rected distances were calculated using the PAM250 model with eight rate categories(Dayhoff,Schwartz, and Orcutt1978).Tree constructions were performed using the neighbor-joining method.The reliability of the trees was tested by bootstrap analysis(Felsenstein1985) with100replications using PUZZLEBOOT(shell script by M.Holder and A.Roger).Synonymous and nonsy-nonymous nucleotide substitution rates were calculated using the method of Nei and Gojobori(1986). ResultsIdentification,Cloning,and Expression Analysis of CYGBA systematic search of the expressed sequence tag (EST;Boguski,Lowe,and Tolstoshev1993)databases using the Drosophila globin(Burmester and Hankeln 1999)as query resulted in several partial globin-like cDNA sequences from Human,mouse,and zebrafishthat did not correspond to the vertebrate hemoglobins, myoglobins or neuroglobins.Specific primers(see Ma-terials and Methods)were used to amplify the mouseand human globin cDNAs via RT-PCR from brain mRNA.They each code for a novel globin of190amino acids(20.9kDa;fig.1).A homologous cDNA clonefrom the zebrafish D.rerio was also obtained by EST database searching,and was sequenced completely.It covers5,188bp with an open reading frame of522bp, giving rise to a174–amino acid protein(fig.1).The cDNAs from all three vertebrates encode proteins thatfit well into a globin alignment based on the conserved alpha-helices A to H of the globin fold.The protein sequences of the novel globin type are clearly longerthan those of the typical vertebrate myo-and hemoglo-bin chains,which comprise about150amino acids.The difference is because of unusually long N-and C-ter-mini,whereas no sequence insertions interrupt the glo-bin fold(fig.1).Computer predictions using the PSORTII program(Nakai and Horton1999)indicate that the novel globins do not contain any signal peptide and aremost likely localized in the cytoplasm.The expression of the newly identified globin genewas analyzed by Northern hybridization to afilter con-taining mRNA from different human tissues and devel-opmental stages(fig.2).We observed a ubiquitous ex-pression of the globin mRNA,with the strongest signalsseen in heart,stomach,bladder,and small intestine.Be-cause of its apparently widespread expression,the novel globin was designated as cytoglobin.The Human and Mouse CYGB GenesThe genomic sequence of the human CYGB genewas derived from contigs of the human genome project (accession number AC015802;International Human Ge-nome Sequencing Consortium2001).By using our cDNA sequence information,it was possible to revealthe complete gene structure which comprises four exons(fig.3),whereas in the gene prediction by the EN-at Gansu Agricultural University on August 4, 2014/Downloaded from418Burmester etal.F IG .2.—Northern dot blot analysis of human mRNA with CYGB cDNA as hybridization probe.All human tissues and developmental stages show the presence of CYGB mRNA.A1,whole brain;A2,amygdala;A3,caudate nucleus;A4,cerebellum;A5,cerebral cortex;A6,frontal lobe;A7,hippocampus;A8,medulla oblongata;B1,oc-cipital pole;B2,putamen;B3,substantia nigra;B4,temporal lobe;B5,thalamus;B6,subthalamic nucleus;B7,spinal cord;C1,heart;C2,aorta;C3,skeletal muscle;C4,colon;C5,bladder;C6,uterus;C7,prostate;C8,stomach;D1,testes;D2,ovary;D3,pancreas;D4,pitu-itary gland;D5,adrenal gland;D6,thyroid gland;D7,salivary gland;D8,mammary gland;E1,kidney;E2,liver;E3,small intestine;E4,spleen;E5,thymus;E6,peripheral leukocyte;E7,lymph node;E8,bone marrow;F1,appendix;F2,lung;F3,trachea;F4,placenta;G1,fetal brain;G2,fetal heart;G3,fetal kidney;G4,fetal liver;G5,fetal spleen;G6,fetal thymus;G7,fetal lung.Blot positions indicated by dashes contain no RNAsample.F IG .4.—Phylogenetic analysis of the vertebrate globins using amino acid sequence data.Bootstrap (upper number)and quartet sup-port (lower number)values are given at the branches;the bar equals 0.1PAM distance.The CYGBs are shaded.In addition to the proteins used in figure 1,the tree includes Myxine glutinosa hemoglobins 1and 3(MglHb1,AF156936;MglHb2,AF157494;MglHb3,AF184239),Lampetra zanandreai hemoglobin B (LzaHbB,Z24748),Petromyzon marinus hemoglobin III (PmaHbIII,P09968),Heterodontus portus-jacksoni myoglobin (HpoMb,P02206)and hemoglobins ␣and (HpoHba,P02021;HpoHbb,P02143),Mustelus antarcticus myoglobin (ManMb,P14399),Squalus acanthias hemoglobins ␣and (SacHba,A24653;SacHbb,B24653),and Mus musculus myoglobin (MmuMb,P04247)and hemoglobins ␣and (MmuHba,A45964;MmuHbb,P02088).F IG .3.—Genomic organization of the human CYGB gene.Exons 1to 4are boxed.Various types of repetitive sequences present and GC-rich regions are also indicated.SEMBL annotation project the small,last coding exon is missing (http://www.ensembl.de).The human CYGB gene is located on chromosome 17q25.It reveals the presence of three introns (figs.1and 3),at position B12-2(i.e.,between codon positions 2and 3of the 12th amino acid of globin helix B),at position G7-0,and at position HC11-2downstream of the H helix,close to the C-terminus of the protein sequence.This genomic organization is confirmed by the comparative sequenc-ing of the murine Cygb gene (to be published elsewhere).Phylogenetic AnalysesThe cDNA-derived amino acid sequences of the CYGBs were aligned with selected vertebrate hemoglo-bins and myoglobins.Molecular phylogenetic analyses using the neighbor-joining,maximum parsimony,or maximum likelihood method result in four well-sup-ported clades,representing ␣-and -hemoglobins,myo-globins,agnathan globins,and the CYGBs,respectively (fig.4).Because of the high degree of divergence in theat Gansu Agricultural University on August 4, 2014/Downloaded fromCytoglobin419globin superfamily,the interrelationship between these clades cannot be resolved with the help of either inver-tebrate globins or neuroglobins as an outgroup.How-ever,because it is known that distinct myoglobins and hemoglobins most likely differentiated after the split of the Agnatha and the Gnathostomata(jawless and jawed vertebrates;Goodman1981),the hemoglobins of lam-prey and hagfish,agnathan species,may be used as the outgroup(fig.4).When placing the root at the agnathan globins,there is consistent support for a close phylo-genetical relationship of the CYGBs with the vertebrate myoglobins,although the bootstrap support values are only moderate(50%to70%).DiscussionWe report the identification of a fourth and novel type of globin present in the vertebrates.This molecule, dubbed cytoglobin,is ubiquitously expressed in human tissue and fulfils a yet undefined role.Taking into ac-count the recentfindings of a specialized globin in nerve cells(Burmester et al.2000)and a novel orphaned-hemoglobin(-globin)from the Marsupialia(Wheeler et al.2001),this in fact indicates that the evolution of globins in higher organisms may be more complex than hitherto thought.Protein Structure and Genomic Organization of CYGBsWithin the conserved globin fold,which covers the standard alpha helices A through H,the key residues important for the function of CYGB as a typical oxygen-binding protein are strictly conserved.The proximal and distal histidines in the positions E7and F8as well as the phenylalanine at the CD1corner are present in the CYGBs(fig.1).The lengths of the mammalian(190 amino acids)andfish(174amino acids)CYGBs exceed those of vertebrate myo-and hemoglobins.The length differences are exclusively because of N-and C-terminal protein extensions,which occasionally have been ob-served previously in invertebrate globins(e.g.,in Cae-norhabditis elegans;Neuwald et al.1997)but whose functional relevance is unclear.Whereas the C-terminal extension of CYGBs may be caused by the recruitment of an additional exon(see subsequent discussion),the N-terminal extension of murine and human CYGBs seems to have partly resulted from a direct duplication of21nucleotides(with7/21mismatches)at the5Јend of the coding region(data not shown).The antiquity of introns within globin genes and their positional stability during evolution have been a matter of intense debate(e.g.,Hankeln et al.1997;Logs-don,Stoltzfus,and Doolittle1998).The human CYGB gene displays the B12-2and G7-0introns which are typically found in many globins,including the vertebrate hemo-,myo-and neuroglobins,and which must there-fore be considered phylogenetically ancient(Dixon and Pohajdak1992;Burmester et al.2000).However,the additional intron in the3Ј-most region of the murine and human CYGB coding sequences(corresponding to the C-terminal position HC11-2)is unprecedented.The or-igin of the small exon4sequence,which only encodesthe10most–C-terminal amino acid residues,is unclear.The C-terminus of zebrafish CYGB is shorter and lacksthe additional exon4sequence(fig.1).In the murineand human CYGB s,the HC11-2intron occurs just downstream of the C-terminal end of other globin se-quences,and we therefore consider that exon4mighthave been acquired only during the evolution of the tet-rapod CYGBs.Molecular Evolution of CYGBsMouse and human CYGB share92.8%of the nu-cleotides and95.3%of the amino acids in the coding region.The zebrafish CYGB shows49%amino acid identity to the mammalian proteins.CYGBs display the highest degree of amino acid sequence similarity to the hemoglobins of the Agnatha(26%to33%identity). Somewhat lower scores were observed when the CYGBs were compared with the myoglobins and he-moglobins(ϳ30%identity).Assuming that mice and humans diverged about80MYA(Kimura1987),an amino acid substitution rate of about0.3ϫ10Ϫ9replace-ments per site per year was inferred for the mammalian CYGBs.This is much lower than calculated for the or-thologous mammalian hemoglobins(0.9ϫ10Ϫ9to1.2ϫ10Ϫ9)and myoglobins(0.8ϫ10Ϫ9to1.2ϫ10Ϫ9)butlies in the range of the neuroglobins(0.4ϫ10Ϫ9).These values are in agreement with our calculations of verylow nonsynonymous nucleotide substitution rates in hu-man and mouse cyto-and neuroglobin(dnϭ0.02and0.03nonsynonymous substitutions per site,respective-ly),compared with human and mouse hemoglobins(dnϭ0.09for␣globin,0.21forglobin)and myoglobin(dnϭ0.09).In the case of CYGB,the low nonsynon-ymous substitution rate is correlated to an unusually low substitution rate at synonymous codon positions(dsϭ0.28synonymous substitutions per site),the reason for which is unclear.The ds:dn ratio(Nei and Gojobori 1986)of k1,however,clearly demonstrates that mam-malian CYGBs evolve under strong purifying selection.A Model of Globin Evolution in VertebratesPhylogenetic analyses suggest that the CYGBs share a common clade with the vertebrate myoglobins(fig.4).An independent confirmation of the common ancestry of cyto-and myoglobins may come from data suggesting that the chromosomal regions encompassing CYGB(17q25)and myoglobin(22q12)represent long, paralogous stretches of genomic DNA,which are thought to have originated by an ancient duplication event(A.McLysaght,K.Hokamp,and K.H.Wolfe, personal communication).Taking into account the antiquity of the neuroglo-bins,the last common ancestor of all vertebrates mostlikely possessed two different types of globins(fig.5). Neuroglobin maintained its function in the nervous sys-tem,which it had acquired early in the evolution of the Bilateria(Burmester et al.2000).The other globin likely differentiated into a cellular globin,which later gave riseto the myoglobins and CYGBs on the one hand and toat Gansu Agricultural University on August 4, 2014/Downloaded from420Burmester etal.F IG .5.—Model of vertebrate globin evolution (see Discussion for detailed explanation).hemoglobin on the other.The hemoglobins obtained their function in the circulatory system of the gnathos-tomian vertebrates after their divergence from the line-age leading to the myoglobins and CYGBs,probably as early as 500to 600MYA (Goodman et al.1987).This event was probably correlated with an increase in body size and the evolution of an efficient circulatory system.Myoglobin and CYGB separated later,but before the divergence of the Chondrichthyes and the other gna-thostomes more than 450MYA (Benton 1990,p.44).It is conceivable that myoglobin,which is present in high concentrations in skeletal and smooth muscle (Wit-tenberg and Wittenberg 1989;Qiu,Sutton,and Riggs 1998),and which supplies the cells with high amounts of oxygen,is in fact an offspring of a more general tissue-globin of similar or other function.Functional Implications of CYGBThe physiological function of CYGBs still has to be investigated.During the preparation of this manu-script,Kawada et al.(2001)reported the finding of a protein that we believe represents the rat ortholog of CYGB.The protein was identified in a proteomics ap-proach by virtue of its heavily upregulated expression in stellate cells of rat liver (and it was therefore dubbed stellate cell activation–associated protein,STAP).The authors could demonstrate that STAP possesses perox-idase activity,and they speculate upon its role as a scav-enger of peroxides in fibrotic liver.In fact,it has been reported before that the dehaloperoxidase enzyme of the marine worm Amphritite is phylogenetically related to globins (Lebioda et al.1999;LaCount et al.2000)and has retained its ability to bind oxygen (Roach et al.1997).However,without additional data the possible spectrum of physiological role(s)of CYGB within the broad variety of vertebrate tissues can only be hypoth-esized.CYGB may be involved in intracellular oxygen storage or transfer,have an enzymatic (peroxidase)func-tion,play a role in O 2sensing (Goldberg,Dunning,and Bunn 1988),or may bind and detoxify NO (Flo ¨gel etal.2001).Finally,a combination of several of thesefunctions also seems conceivable.AcknowledgmentsWe wish to thank E.R.Schmidt,J.Markl,and H.Decker for excellent working facilities,continuous sup-port,and valuable suggestions.This work is supported by the Deutsche Forschungsgemeinschaft (DFG Ha 2103-3and Bu 956-3)and the Naturwissenschaftlich-Medizinisches Forschungszentrum (NMFZ)Mainz.LITERATURE CITEDA LTSCHUL ,S.F .,W .G ISH ,W .M ILLER ,E.W .M YERS ,and D.J.L IPMAN .1990.Basic local alignment search tool.J.Mol.Biol.215:403–410.B ENTON ,M.J.1990.Vertebrate paleontology.Unwin Hyman Ltd.,London.B OGUSKI ,M.S.,T .M.L OWE ,and C.M.T OLSTOSHEV .1993.dbEST—database for ‘‘expressed sequence tags.’’Nat.Genet.4:332–333.B URMESTER ,T .,and T .H ANKELN .1999.A globin gene of Dro-sophila melanogaster .Mol.Biol.Evol.16:1809–1811.B URMESTER ,T .,B.W EICH ,S.R EINHARDT ,and T .H ANKELN .2000.A vertebrate globin expressed in the brain.Nature 407:520–523.D AYHOFF ,M.O.,R.M.S CHWARTZ ,and B.C.O RCUTT .1978.A model of evolutionary change in proteins.Pp.345–352in M.O.D AYHOFF ,ed.Atlas of protein sequence structure,Vol.5,Suppl.3.National Biomedical Research Foundation,Washington,DC.D ICKERSON ,R.E.,and I.G EIS .1983.Hemoglobin:structure,function,evolution,and pathology.Benjamin/Cummings Publ.Co.,Menlo Park,Calif.D IXON ,B.,and B.P OHAJDAK .1992.Did the ancestral globin gene of plants and animals contain only two introns?TIBS 17:486–488.F EINBERG ,A.,and B.V OGELSTEIN .1983.A technique for ra-diolabeling DNA restriction endonuclease fragments to high specific activity.Anal.Biochem.132:6–13.F ELSENSTEIN ,J.1985.Confidence limits on phylogenies:an approach using the bootstrap.Evolution 39:783–791.at Gansu Agricultural University on August 4, 2014/Downloaded fromCytoglobin421———.2000.PHYLIP(phylogeny inference package).Ver-sion3.6.Distributed by the author,Department of Genetics, University of Washington,Seattle.F LO¨GEL,U.,M.W.M ERX,A.G OEDECKE,U.D ECKING,and J.S CHRADER.2001.Myoglobin:a scavenger of bioactive NO.A98:735–740.G OLDBERG,M.A.,S.P.D UNNING,and H.F.B UNN.1988.Reg-ulation of the erythropoietin gene:evidence that the oxygen sensor is a heme protein.Science242:1412–1415.G OODMAN,M.1981.Globin evolution was apparently veryrapid in early vertebrates:a reasonable case against the rate-constancy hypothesis.J.Mol.Evol.17:114–120.G OODMAN,M.,J.C ZELUSNIAK,B.F.K OOP,D.A.T AGLE,andJ.L.S LIGHTOM.1987.Globins:a case study in molecular phylogeny.Cold Spring Harbor Symp.Quant.Biol.52:875–890.H ANKELN,T.,H.F RIEDL,I.E BERSBERGER,J.M ARTIN,and E.R.S CHMIDT.1997.A variable intron distribution in globin genes of Chironomus:evidence for recent intron gain.Gene 205:151–160.H ARDISON,R.C.1996.A brief history of hemoglobins:plant,animal,protist,and A 93:5675–5679.———.2001.New views of evolution and regulation of ver-tebrate beta-like globin gene clusters from an orphaned gene in A98:1327–1329.K AWADA,N.,D.B.K RISTENSEN,K.A SAHINA,K.N AKATANI, Y.M INAMIYAMA,S.S EKI,and K.Y OSHIZATO.2001.Char-acterization of a stellate cell activation-associated protein (STAP)with peroxidase activity found in rat hepatic stellate cells.J.Biol.Chem.276:25318–25323.K IMURA,M.1987.Molecular evolutionary clock and the neu-tral theory.J.Mol.Evol.26:24–33.L A C OUNT,M.W.,E.Z HANG,Y.P.C HEN,K.H AN,M.W.W HITTON,D.E.L INCOLN,S.A.W OODIN,and L.L EBIODA.2000.The crystal structure and amino acid sequence of de-haloperoxidase from Amphritite ornata indicate common ancestry with globins.J.Biol.Chem.275:18712–18716. L EBIODA,L.,M.W.L A C OUNT,E.Z HANG,Y.P.C HEN,K.H AN, M.W.W HITTON,D.E.L INCOLN,and S.A.W OODIN.1999.An enzymatic globin from a marine worm.Nature401:445. L OGSDON,J.M.,A.S TOLTZFUS,and W.F.D OOLITTLE.1998.Molecular evolution:recent cases of spliceosomal intron gain?Curr.Biol.8:R560–R563.N AKAI,K.,and P.H ORTON.1999.PSORT:a program for de-tecting sorting signals in proteins and predicting their sub-cellular localization.Trends Biochem.Sci.24:34–36.N EI,M.,and T.G OJOBORI.1986.Simple methods for estimat-ing the number of synonymous and nonsynonymous nucle-otide substitutions.Mol.Biol.Evol.3:418–426.N EUWALD,A.F.,J.S.L IU,D.J.L IPMAN,and C.E.L AWRENCE.1997.Extracting protein alignment models from the se-quence database.Nucleic Acids Res.25:1665–1677.Q IU,Y.,L.S UTTON,and A.F.R IGGS.1998.Identification of myoglobin in human smooth muscle.J.Biol.Chem.273:23426–23432.R OACH,M.P.,Y.P.C HEN,S.A.W OODIN,D.E.L INCOLN,C.R.L OVELL,and J.H.D AWSON.1997.Notomastus lobatuschloroperoxidase and Amphitrite ornata dehaloperoxidaseboth contain histidine as their proximal heme iron ligand.Biochemistry36:2197–2202.S CHWARTZ,S.,Z.Z HANG,K.A.F RASER,A.S MIT,C.R IEMER, J.B OUCK,R.A.G IBBS,R.H ARDISON,and W.M ILLER.2000.PIPMAKER—a web server for aligning two genomicDNAs.Genome Res.10:577–586.S TRIMMER,K.,and A.VON H AESELER.1996.Quartet puzzling:a quartet maximum likelihood method for reconstructingtree topologies.Mol.Biol.Evol.13:964–969.T HOMPSON,J.D.,T.J.G IBSON,F.P LEWNIAK,F.J EANMOUGIN, and D.G.H IGGINS.1997.The ClustalX Windows interface:flexible strategies for multiple sequence alignment aided byquality analysis tools.Nucleic Acids Res.25:4876–4882.W HEELER,D.,R.H OPE,S.J.B.C OOPER,G.D OLMAN,G.C.W EBB,C.D.K.B OTTEMA,A.A.G OOLEY,M.G OODMAN,and R.A.B.H OLLAND.2001.An orphaned mammalianglobin gene of ancient evolutionary origin.Proc.Natl.A98:1101–1106.W ITTENBERG,J.B.1992.Functions of cytoplasmatic hemoglo-bins and p.Environ.Physiol.13:60–85.W ITTENBERG,J.B.,and B.A.W ITTENBERG.1989.Mechanisms of cytoplasmic hemoglobin and myoglobin function.Annu.Rev.Biophys.Biophys.Chem.19:217–241.K ENNETH W OLFE,reviewing editor Accepted October12,2001 at Gansu Agricultural University on August 4, 2014/Downloaded from。
