第六章 旋光异构
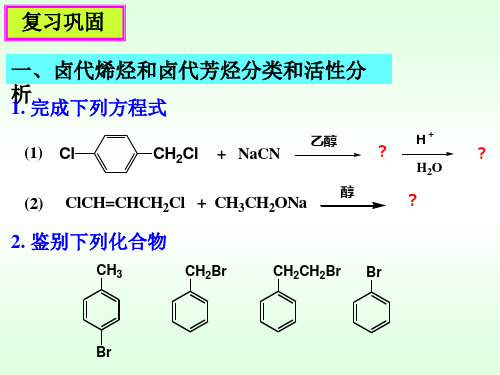
分子的手性与旋光异构课件

产物选择性
在某些化学反应中,一种旋光异构体可能比另一种更倾向于 形成,导致产物选择性。
旋光异构体的生物活性
药理活性
许多药物具有手性,其中一种旋光异构体可能具有治疗作用,而另一种可能具 有副作用。了解和控制药物的旋光异构体对于药物设计和开发至关重要。
代谢和排泄
旋光异构体在生物体内的代谢和排泄速度可能不同,这影响了药物的疗效和副 作用。
非天然旋光异构体的合成
非天然旋光异构体的合成通常采用化学合成的方法,通过手性源、手性辅助剂或手性催化剂来控制反 应的立体化学。
在非天然旋光异构体的合成中,化学合成方法是最常用的手段。通过在手性源、手性辅助剂或手性催 化剂的作用下,可以控制反应的立体化学,从而得到所需的手性产物。这些手性源、手性辅助剂或手 性催化剂可以是天然产物,也可以是人工合成的物质。
泄较少。
手性药物的合成与质量控制
合成方法
通过化学合成、生物合成 等方法制备手性药物。
质量控制
对手性药物的纯度、含量 、稳定性等指标进行严格 控制,确保药物的安全性 和有效性。
法规求
遵循相关法规和标准,确 保手性药物的研发、生产 和销售合法合规。
THANKS
感谢观看
其镜像重合。
手性分子的分类
根据手性中心数目,手性分子 可分为单手性分子和双手性分 子。
根据手性轴数目,手性分子可 分为具有一个手性轴的分子和 具有多个手性轴的分子。
根据手性面的数目,手性分子 可分为具有一个手性面的分子 和具有多个手性面的分子。
02
旋光异构
旋光现象的发现
19世纪中叶
法国科学家Pasteur在研究酒石酸 的旋光性时,发现了旋光现象。
分子的手性与旋光异构课件
06 第六章 对映体

CH2OH
(Ⅱ)
CH2OH
H F F H
H
有对称中心
镜象和实物能重叠,无手性
结论:有对称中心的分子,实物和镜象能重叠,无手
性,无对映异构体,无旋光性。
20
21
3. 对称轴 定义: 穿过分子画一直线,以它为轴旋转一定角度后,可 以获得于原来分子相同的构型,这一直线叫对称 轴.
H H H H
Cn
H H H
C4
( 360 ) 90
29
COOH H C
CH 3
COOH
OH
对映异构体:
HO
H3 C
C H
S–(+)–乳酸
(R)
注意: R、S与右旋、左旋没有一定关系。
CH3 C H OH CH2CH3 CH3CH2 OH CH3 C H
(S)–2–丁醇
(R)–2–丁醇
30
H H3C C OH CH CH2
H
OH COOH C
(S)–3–丁烯–2–醇 (S)–2–羟基苯乙酸 2. 对映异构体的表示方法 常有两种表示方法
18
2. 对称中心( i ) 定义:分子中有一点 P ,以分子任何一点与其连线,
都能在延长线上找到自己的镜象,则 P 点为
该分子的对称中心。
19
例:环丁烷
H H H H H
H H H H H H H H
P
H H
H
有对称中心
镜象和实物能重叠,无手性。
Cl
Cl H F H H F H Cl
例:
H Cl
O C OH CH3 H H H
28
O C CH3 O O C
第二较优
O C H O O H
旋光异构
。
纸面上转动90
。
=
对映体
(3)固定一个基团,另外三个基团按顺时针或逆时 针方向依次调换位置,构型保持不变。
COOH
固定羧基
COOH
其它依次调换位置
H CH3
OH
CH3 OH
H
(4)任意两个基团对调奇数次,构型变为其对映体。 任意两个基团对调偶数次,构型不变。
对映体间的区别
旋光方向相反,生理功能不一样。 例如: 1. 右旋葡萄糖具有营养价值,而左旋葡萄糖无营养。 2. 左旋氯霉素为抗菌消炎药,右旋氯霉素为无药效等。 3. 芬必得中的有效成分布洛芬,只是S-异构体有镇痛 作用。
CH3 (CH3)2CHCH2
* CHCOOH
布洛芬
4. 许多香料,对映异构体的气味很不相同。R-香芹酮 有清凉的留兰香气味,而S-香芹酮则有药草的气息。
IV
内消旋体:含有手性碳原子,但分子具有对称面而不 具有旋光性的化合物,用meso表示。
乳酸:一个手性碳原子----2个旋光异构体
氯代苹果酸:二个不相同手性碳原子---4个旋光异构体
酒石酸:二个相同手性碳原子----3个旋光异构体
旋光异构体数目跟手性碳原子数目有关。若含n个 不同的手性碳原子,则该化合物最多可以有2n个旋光 异构体,且有2n-1个外消旋体。
表6-2 氯代苹果酸的物理性质
二、含两个相同手性碳原子化合物的旋光异构
* * 例:酒石酸 HOOC-CH-CH-COOH的立体异构 OH OH
I
II
III
IV
(2R,3R)
(2S,3S)
(2R,3S)
(2S,3R)
旋光异构
镜子 H H3C C Cl CH3 H3C H C Cl CH3
如果实物和它的镜像能够重合,则实物和镜像为同一物质, 并且没有对映异构体。为非手性分子。
手性和对映异构的关系
对映异构体的每一个都具有手性 手性分子肯定有对映异构体 手性(镜像的不重合性) 手性(镜像的不重合性)是产生对映异构现 象的充分必要条件! 象的充分必要条件!
镜子 COOH H C CH3 OH HO COOH C H
CH3
用费歇尔投影式表示为:
COOH H OH CH3
COOH HO H CH3
在费歇尔投影式中,规定横向的两个原子团在纸平面的前 面,竖向的两个原子团在纸平面的后面,横线和竖线的交 点代表手性碳原子。
朝纸面外
朝纸面内
根据费歇尔投影式判断手性碳原子的构型时,需要记住它的立 根据费歇尔投影式判断手性碳原子的构型时, 体形象。 体形象。 当最小的基团在竖线上,即在纸平面的后面时,直接根据另外 三个基团判断; 如果最小的基团在横线上,即在纸平面的前面,观察者应从纸 平面的后面往前看。若从纸平面的前面观察,根据另外三个基 团判断,观察到的构型与实际构型相反。 如果观察到为R,应改为S;如果观察到为S, 应改为R。
O H N O * O N O O H H N * O H N O O
R-型(不致畸)
S-型(致畸)
原因:生物体是手性环境
反应停” 被“反应停”夺去胳膊的孩子们
香芹酮 (香料)
O
O
S-Carvone caraway
R-Carvone spearmint
Dopa (药物)
HO H HO
COOH NH2
Cl F H H
H
.HF
Cl
第五章 旋 光 异 构

外消旋体 m.p 157℃
非对映体
含n个不同手性碳原子的化合物,对映体的数目有2 n个,外消旋体的数目2 n-1个
2、非对映体
不呈物体与镜象关系的立体异构体叫做非对映体。分子中 有两个以上手性中心时,就有非对映异构现象 。
I和II, III和IV分别互为对映体,I和III, I和IV, II和III, II和IV分别互为非对映体
内消旋体与外消旋体的异同
相同点:都不旋光 不同点:内消旋体是一种纯物质,外消旋体是 两个对映体的等量混合物,可拆分开来。 从内消旋酒石酸可以看出,含个手性碳原子的 化合物,分子不一定是手性的。故不能说含手 性碳原子的分子一定有手性。
第五节 构型的标记——R、S命名规则
R、S命名规则: 1、按次序规则将手性碳原子上的四个基团排序。
(3)、对称轴
Cl Cl Cl Cl
不具有手性 (模型同反-二丁烯)
H
H H Cl
Cl C2
H
H
H
H
H
Cl
Cl
H
H
Cl
H
H
Cl
具有手性 (分子和镜像不能重合)
有无对称轴不能作为判断分子有无手性的依据!
第三节 含一个手性碳原子化合物的对映 异构
一、对映体(enantiomers) 1.对映体——互为物体与镜象关系的立体异构体。 含有一个手性碳原子的化合物一定是手性分子, 含有两种不同的构型,是互为物体与镜象关系 的立体异构体,称为对映异构体(简称为对映 体)。 对映异构体都有旋光性,其中一个是左旋的, 一个是右旋的。所以对映异构体又称为旋光异 构体
透视式
(2)、Fischer投影式
第六章--配合物的结构和性质

• VBT的基本要点: 的基本要点: 的基本要点
和配体L之间 (A)配合物的中心离子 和配体 之间,是由中心离子提供 )配合物的中心离子M和配体 之间, 与配位数相图的空轨道来接受配体提供的孤对电子, 与配位数相图的空轨道来接受配体提供的孤对电子,形成配 位键。 位键。 有空轨道,: 3有孤对电 ,:NH 如:在[Cu(NH3)4]2+中,Cu2+有空轨道,: ( 故可以形成配位键: 子,故可以形成配位键:见P69。 。 (B)为了形成稳定的配合物,中心离子采取杂化轨道与配位 )为了形成稳定的配合物, 原子形成σ配键, 原子形成σ配键,杂化轨道的类型与配位个体的配位键型和 空间构型相对应。 P71表 空间构型相对应。见P71表。
●单核配位化合物:一个配位化合物分子(或离子)中只含有一 单核配位化合物:一个配位化合物分子(或离子) 单核配位化合物 个中心原子。 个中心原子。 ●多核配位化合物:含两个或两个以上中心原子。 多核配位化合物:含两个或两个以上中心原子。 ●金属原子簇化合物:在多核配位化合物中,若M—M之间有键 金属原子簇化合物:在多核配位化合物中, 之间有键 合称为金属原子簇化合物 金属原子簇化合物。 合称为金属原子簇化合物。 ●配位化合物是金属离子最普遍的一种存在形式。 配位化合物是金属离子最普遍的一种存在形式。 ●金属离子和不同的配位体结合后,性质不相同,可以进行溶解、 金属离子和不同的配位体结合后,性质不相同,可以进行溶解、 沉淀、萃取,以达到合成制备、分离提纯、分析化验等目的。 沉淀、萃取,以达到合成制备、分离提纯、分析化验等目的。
内轨型配合物: 内轨型配合物: 为外轨型配合物, 如[FeCN6]3- 为外轨型配合物,见P69。 。 特点: 轨道参与杂化; 特点:(n-1)d轨道参与杂化;配体的孤对电子部分 轨道参与杂化 进入中心离子的( ) 轨道中 轨道中; 进入中心离子的(n-1)d轨道中;配体一般为电负 性小的原子, 性小的原子,如C,P,因电负性小,易给出电子, ,因电负性小,易给出电子, 对中心离子的价层电子结构有强烈的影响。 对中心离子的价层电子结构有强烈的影响。因此内 轨型配位键形成时打乱了中心离子的外层电子排布。 轨型配位键形成时打乱了中心离子的外层电子排布。
大学有机化学 第06章 立体化学

但原子或基团在空间排列的顺序不同,在
有手性条件下化学反应活性不相同,旋光
方向相反。比旋光度不一样。
27
对映异构体的异同点: 相同点 1、分子式、构造式都相同。 2、物理性质相同。 3、非手性环境中化学性质相同。 4、旋光度数相同。 不同点 • 构型不同。(原子或基团在空间排列的顺序不 同) • 化学活性不相同。 • 比旋光度不相同。 • 旋光方向不相同。 • 生理活性不相同。
D
(–)–2–丁醇 CH3
HO H CH2CH3
(+)–2–丁醇 CH3 OH H
CH2CH3
[α]D = +13.25° [α]D = –13.25° 手性分子的两个对映体的比旋光度数值相同,而 方向相反。
21
6.4 具有一个手性中心的对映体
6.4.1 对映体和外消旋体的性质 手性中心:不对称中心 与四个不同原子或基团相连的碳原子
图6.14 Fischer 投影式旋转180°的分子模型
35
将投影式中与手性碳相连的任意两个基团对调 ,
对调一次或奇数次)则转变成它的对映体;对调
二次则为原化合物。
COOH COOH HO H 再对调一次 HO H OH 对调一次 CH3 CH3
R S
CH3
H 在纸平面上 COOH
R
旋转180o
12
图6.4 2–丁醇对映异构体的比例模型
13
6.2.2 对称因素 (1) 对称面 (σ)
有两种对称面:(a)一个平面把分子分成两部分,而 一部分恰好是另一部分的镜像。 例如:2–氯丙烷
图6.5 分子中的对称面的示意图 (I)
14
(b) 组成分子的所有原子都在一个平面上 例如: (E)–1,2–二氯乙烯
旋光异构

6.1 物质的旋光性 Optical Activities of Substances 6.1.1 偏振光 Polarized Light
偏振光
尼科尔棱镜 普通光线的 振动平面 普通光
图 6.1 普通光通过尼科尔棱镜产生偏振光的示意图
6
6.1.2 旋光度 Optical Rotation
旋光仪的工作原理
纸面上旋转
旋 转 90° COOH H CH3 (Ⅰ ) OH 旋 转 180° HO H 3C
H COOH OH (Ⅱ )
CH3 H COOH (Ⅲ )
28
基团调换之一
若将一个投影式中与手性碳原子相连的任何原子或基 任何原子或基 对调奇数次转变为它的对映体; 团进行对调,对调奇数次转变为它的对映体;对调偶数次 对调奇数次转变为它的对映体 则仍是原化合物. 则仍是原化合物.
H3C C H C H H CH3 H3C C C H CH3
????
构象异构: 构象异构:如丁烷的反式交叉式及顺叠重叠式构象
CH 3 H H CH 3 H H H H
3
H 3 C CH 3 H H
旋光异构 Optical Isomerism
如 D-(+)-乳酸和L-(-)-乳酸:
肌肉运动时生成的右旋乳酸, 表示为(+)-乳酸或d-乳酸 糖经过发酵生成的是左旋乳酸, 则表示为 (-)-乳酸或l-乳酸.
COOH 对调一次 COOH H CHபைடு நூலகம்3 OH 对调两次 HO HO CH 3 对映体 CH 3 旋转180° H COOH 原化合物 H CH 3
29
H
COOH OH
基团对调之二
如投影式中一个基团位置保持固定不变,而另外 三个基团按顺时针或逆时针地调换位置,则仍为原化 合物.
《有机化学》06 旋光异构

I(2S,3S)
II(2R,3R) III (2R,3S) IV (2S,3R)
含两个不同手性碳原子的化合物,有四种(2n个) 不同的平面构型。
对映关系: Ⅰ与Ⅱ; III与Ⅳ 非对映关系: Ⅰ与III、Ⅰ与Ⅳ、Ⅱ与III、Ⅱ与Ⅳ
2. 含两个相同手性碳原子的化合物 以酒石酸为 例
∴含手性碳原子的化合物不一定都有旋光性,但是
为主要因素。
* 含一个手性碳原子的化合物一定具有旋光性。
而有些化合物的分子内不存在手性碳原子,却 是手性分子。
§5 环状化合物的旋光异构
1,2-环丁烷二甲酸 1,3-环丁烷二甲酸
§6 不含手性碳原子化合物 的旋光异构
1. 丙二烯型
H2C=C=CH2
丙二烯型分子的空间构型
重叠。 • 投影式中任两个基团不能对调,否则构型改变。
如转动180o:
4. 对映异构体的命名: (1) D-L标记法
规定(人为):以甘油醛的构型为标准(相对构
型标准),指定-OH在碳链右侧为D型;在左侧为 L型。
L-甘油醛
D-甘油醛
旋光方向(+),(-)与相对构型之间没有任何必然
的联系。
(2) R, S标记法
对映异构体:两个立体异构体若满足互为镜像, 且不能重叠的关系,则两者都是手性分子且互为 对映异构体。
2.手性与对称因素的关系
对称面:可以把分子分成实物和镜象两半的面。
手性与对称性的关系: 绝大多数情况下,分子中
既没有对称面,又没有对称中心,则该分子与其镜 像不能互相叠合,分子就有手性。
手性碳原子*对映异构体的性质
物理性质:熔点、沸点、相对密度、比旋光度、在非 手性溶剂中的溶解度等完全相同。旋光方向相反。
大学有机化学旋光异构

[目的要求]:
旋 光 异 构 (对映异构)
1.了解平面偏振光的产生及旋光仪的构造; 2.掌握对映异构与分子结构的关系; 3.掌握对映体、非对映体、外消旋体、手性、对称 因素等立体化学中的基本概念; 4.掌握构型的表示及标定; 5.了解环状化合物及不含手性碳原子化合物的对映 异构; 6.了解外消旋体的拆分原理及方法。
若样品管中无旋光性物 质,B和D晶轴平行时, 则F视场最明亮。B和D 互相垂直时,则F视场 最黑暗。 D与刻度转盘E相连
零点----起偏棱晶B 和检偏棱晶D晶轴 相互平行时作为零 点。(即刻度盘指 在0位置)
(2)比旋光度
影响旋光 度的因素
溶液浓度 样品管长度
光的波长
测定温度(通常20℃)
溶剂(通常用水) 为了能比较物质的旋光性能,通常规定: 测量时的温度为t ,测定时光的波长为λ,一般 采用钠光(波长为589 nm,用D表示)。
这两种构型的关系如同实物和镜象(或左手和 右手)的关系一样,外形相似,但不能重合,这种 现象称为对映异构现象。
两种构型互为对映异构体,又叫旋光异构体,其 中一个是左旋的,一个是右旋的。 对映异构(或旋光异构)现象产生的根本原因是: 由于原子在空间的不同排列所引起的。
2.对映异构体 两个乳酸的分子式相同,分子构造也相同, 但分子中原子和基团在空间排列不同,形成实物
H
i H H F H 有对称中心 i H
H
Cl
H i F
H
Cl
H
H
结论:具有对称中心的化合物,是非手性的,它没 有对映异构体和旋光性。
(3)对称轴-------当分子沿轴旋转360°/n,得到 的构型与原来的分子相重合,这个轴即为该分子 的n重对称轴,用Cn表示。* 例1 (E)-1,2-二氯乙烯C2
旋光异构

旋光异构两个或多个分子由于构型上的差异而表现出不同旋光性能的现象。
这些分子互为旋光异构体,也称对映异构体。
导致旋光异构现象的原因有两种:①分子中含有一个或多个手性原子(见手征性)。
含有一个手性碳原子时,有两个旋光异构体,它们具有互为实物和镜像的关系,故也称对映体。
对映异构体具有相等的旋光能力,但旋转方向相反,其物理和化学性质极为相似,如甘油醛(如对图片说明中“菲舍尔投影式”有疑问,见菲舍尔投影式):甘油醛菲舍尔投影式含有两个相同手性碳原子的分子,有3个旋光异构体,如酒石酸:酒石酸菲舍尔投影式其中a和b为对映异构体,c与d也好像是对映体。
但实际上c与d是同一种分子,因为它们可以互相叠合。
只要把c以通过C(2)-C(3)键中点,与读者的显示器荧屏(设荧屏竖直)垂直的线为轴旋转180°,就可以看出来它是可以与d叠合的。
也就是说,c和d是相同的。
c的旋光能力由于分子内的两个结构相同但构型(见分子构型)相反的手性原子的存在而互相抵消,称为内消旋体。
它与a或b在分子中既有构型相同的部分,又有构型相互对映的部分,这种关系称为非对映异构。
非对映异构体不仅旋光性不同,物理和化学性质也不尽相同。
环状化合物中含有手性原子时,也可出现以上旋光异构现象。
分子中当含有几个不同的手性原子时,其旋光异构体的数目为2n,n为不同手性原子的个数。
旋光异构体可用D-、L-法标记其构型(见单糖),也可用R-、S-法标记其分子中每个原子的构型(见顺序规则)。
②某些分子虽然不含手性原子,但由于分子中的内旋转受阻碍,也可以引起旋光异构现象,例如丙二烯型或联苯型旋光化合物是通过分子中的一个轴来区别左右手征性;又如旋光性提篮型化合物分子是就一个平面来区别手征性的等。
等量互为对映异构体的旋光性物质均匀混合,所得混合物没有旋光性。
这种混合物叫做外消旋体。
高分子链的旋光异构及几何异构单元电子教材(精)

《塑料成型加工基础》单元教学内容任务5:高分子链的旋光异构及几何异构微观世界的高分子链当其分子链上的取代基在空间的排列位置不同时,会呈现不同的空间构型高分子链的构型是高分子本身所固有的,要改变其构型必须经过化学键的断裂和重组。
高分子链的构型通常有旋光异构和几何异构两种。
1、旋光异构饱和碳氢化合物分子中的碳,以共价键与4个原子或基团相连,形成一个四面体,4个基团位于四面体的顶点,碳原子位于四面体的中心。
当4个基团都不相同时,该碳原子称为不对称碳原子,以C*表示。
分子中具有不对称C*原子时,具有手性,故又称之为手性碳原子。
这种碳原子能构成象左右手一样的互为镜影的两种异构体,表现出不同的旋光性,称为旋光异构体。
图1-3旋光异构体的互为影镜关系高分子结构单元—CH2—C*HR—中有一个C*原子,由于C*两端的链节不完全相同,因此C*是一个不对称碳原子。
这样,每一个链节就有两种旋光异构体,这种高分子链有三种键接方式:全部由一种旋光异构单元键接而成,则称为全同立构。
全同立构链中的取代基R都位于主链平面的同一侧由两种旋光异构单元交替键接,称为间同立构。
间同立构链中的取代基R交替排列在平面的两侧。
两种旋光异构单元完全无规键接时,则称为无规立构。
无规立构链中的取代基R则任意排列在平面的两侧。
全同立构和间同立构高聚物统称为“等规高聚物”,如全同或间同的聚丙烯,称为等规高聚丙烯。
对于高分子来说不同的旋光构型其性能有较大差异。
如全同或间同的聚丙烯,结构比较规整,容易结晶,是塑料和纤维的良好原料,而无规聚丙烯却是一种橡胶伏的弹性体。
全同立构的聚苯乙烯结构比较规整,能结晶,熔点为240℃,而无规立构的聚苯乙烯结构不规整不能结晶。
通常自由基聚合的高聚物大都是无规的,只有用特殊的催化剂才能制得有规立构的高聚物,这种聚合方法称为定向聚合。
要注意的是高分子中由于有内消旋或外消旋的相互抵消,会使得一些含有不对称碳原子的高分子没有旋光性2、几何异构1,4-加成的双烯类聚合物,由于双键上的基团在双键两侧排列的方式不同而有顺式构型与反式构型之分,它们称为几何异构体。
旋光异构

对映体的等量混合物叫做外消旋体,用(±)表示。
外消旋体中对映体对偏振光的作用互相抵消,因此没有 旋光性。 外消旋体和左旋体、右旋体相比,物理性质有所改变。
(+)-乳酸 [α]20 D mp./℃ +3.8º 53 (-)-乳酸 -3.8º 53 (±)-乳酸 0 18
化学性质基本相同,对映体各自保持自己的生理活性。
子或基团在纸面后方。
COOH H OH CH3
COOH HO CH3 H
1 对映体和外消旋体
互为镜像的异构体称为旋光异构体或对映异构体,简 称对映体。 含有一个手性碳的化合物没有对称面和对称中心,是手 性分子,存在两个旋光的对映异构体。 * CH3CH2CHCH2OH
CH3
2-甲基-1-丁醇
对映体的性质,在非手性环境中完全相同,在手性条件
下可能不同。 对映体的熔点、沸点、在非手性溶剂中的溶解度、和非
手性试剂的反应速度等都相同。
原因:对映体之间是镜像关系,分子中任何两个原子之 间的距离是相同的,因此内能也是相同的。
对映体的旋光性、在手性溶剂中的溶解度、与手性试剂 或在手性催化剂作用下的反应速度等是不同的。 氯霉素的左旋体有疗效,它的对映体则无抗菌作用。 左旋香芹酮与右旋香芹酮的香气不同。 左旋尼古丁的毒性比右旋尼古丁大得多。
向(+)/(-),最后再写出名称。
1 含有两个不同的手性碳的分子
当化合物分子中含有两个不同的手性碳时,应有22 = 4 种构型,若有n个不同的手性碳时,应有2n种构型。 两个不同的手性碳:是指两个手性碳上所连的四个基团 不完全相同。 2-羟基-3-氯丁二酸有两个不同的手性碳原子,应有4种不 同的构型。
接由平面结构式分析考察环状化合物的对映异构。
有机化学 第6章 旋光异构

COOH C H CH3 OH H3C HO
COOH C H
③ Fescher投影式
COOH H CH3 OH HO
COOH H CH3
费歇尔投影式投影原则:把与手性碳原子结合
的左右横向的两个键伸向手性碳原子的前面 ,
即伸向观察者;把上下竖立的两个键伸向手性
碳原子的后面。 常称为“横前竖后”,即横
R
4、三基团轮换操作,不改变其构型。
CO2H NH2 CH3 H CH3 H CO2H NH2 H NH2 CO2H CH3 H CH3 NH2 CO2H
(3)构型的标记法
① D、L命名法(相对构型) 1951年前人们用甘油醛提出了D、L命名法:
CHO H OH CH2OH I D-(+)-甘油醛 HO
第六章 旋光异构
以三维空间研究分子结构和性质的科学 分子中原子或基团在空间的排列状况
不同的排列对分子性质的影响
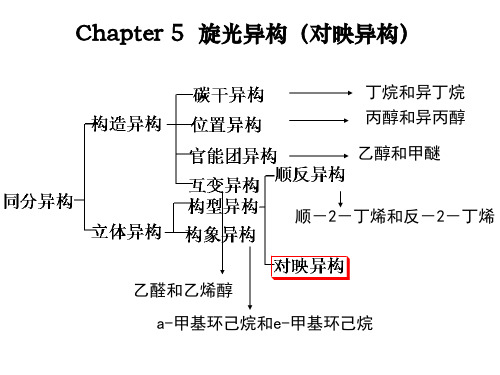
具有相同分子式,但结构不同的化合物称为同分异构体 有机化合物的异构情况:
碳链异构
CH3
CH3CH2CH2CH3与CH3CHCH 3
OH
构造异构
位置异构CH3CH2CH2OH与 CH3CHCH 3
设想分子中有一个点,从分子中任何一个原子出 发,向这个点作直线,再从这个点将直线延长出 去,则在该点前一线段等距离处,可以遇到一个 同样的原子,这个点就是对称中心
Cl H H H F H Cl F
H
Cl F
H
P
H
H Cl
F
③ 手性分子的对称要素
一个分子在结构上具有对称面或对称中心,就无 手性,没有旋光性。 一个分子在结构上即无对称面,也无对称中心, 就具有手性,有旋光性。
旋光异构

第6章 旋光异构 有机化学2012
CHO
CHO
H C OH
HO C H
CH2OH
CH2OH
D-(+)-甘油醛
L-(-)-甘油醛
CHO
COOH
H C OH
[O]
[H] H C OH
CH2OH D-(+)-甘油醛
CH2OH D-(-)-甘油酸
COOH
H C OH
CH3 D-(-)-乳酸
D构型不一定是右旋,也不一定是左旋。
第6章 旋光异构 有机化学2012
H
a Hb
※
※
H
H
有顺反异构; 有旋光异构体;
H
H
H
a Hb
*
*
HH
bHa
*
*
H
H
a HH
*
*
H
b
(Ⅲ)
(Ⅴ)
(Ⅳ)
(Ⅲ)与(Ⅴ)对映体;(Ⅳ)与(Ⅵ) 对映体;
H
HHa
*
*
b
H
(Ⅵ)
(Ⅲ)与(Ⅳ);(Ⅴ)与(Ⅵ) 顺反异构体
应用化学系
第6章 旋光异构 有机化学2012
CH
H
H3C
OH
CH3
OH
-
【外消旋体】
等量的光学对映体混合时,左旋体所具有的旋光度,恰好被 其右旋体抵销,因此失去了旋光性。这种特殊的混合物,称为外 消旋体。
(±)表示外消旋体。
应用化学系
第6章 旋光异构 有机化学2012
二、费歇尔(Fischer)投影式
书写方便,用平面来表示立体结构; 投影原则: “横前竖后”。
第二节 旋光性和分子结构的关系
有机化学傅建熙 第三版 课本答案

第二章有机化合物的结构本质与构性关系1.(1) sp3(2) sp (3) sp2(4) sp (5) sp3(6)sp22. (1)醇类(2)酚类(3)环烷烃(4)醛类(5)醚类(6)胺类3.π键的成键方式:成键两原子的p轨道沿着与连接两个原子的轴垂直的方向“肩并肩”重叠而形成。
π键特点:①电子云平面对称;②与σ键相比,其轨道重叠程度小,对外暴露的态势大,因而π键的可极化度大,在化学反应中易受到亲电试剂的进攻而发生共价键的异裂;③由于总是与σ键一起形成双键或叁键,所以其成键方式必然限制σ键单键的相对旋转。
第四章开链烃1.(1) 2-甲基-4,5-二乙基庚烷(2) 3-甲基戊烷(3) 2,4-二甲基-3-乙基戊烷(4)顺-3-甲基-3-己烯or (Z)-3-甲基-3-己烯(5) 2,2,4-三甲基-3-乙基戊烷(6) 3,5-二甲基-3-庚烯(7) 2,3-己二烯(8) 3-甲基-2-乙基-1-丁烯(9) 2,5,6-三甲基-3-庚炔(10)1-丁炔银(11)3-甲基-1,4-戊二炔(12) 3-甲基-1-庚烯-5-炔2.3.4.(Z)-2-戊烯(E)-2-戊烯C C CH(CH3)2H5C2C C CH(CH3)2 HHH5C2(2)(Z)-2-甲基-3-己烯(E)-2-甲基-3-己烯(Z)-3-甲基-3-己烯(E)-3-甲基-3-己烯(Z)-3-甲基-4-乙基-3-庚烯(E)-3-甲基-4-乙基-3-庚烯(Z)-5-甲基-3-乙基-2-己烯(E)-5-甲基-3-乙基-2-己烯(Z)3-甲基-1,3-戊二烯(E)3-甲基-1,3-戊二烯5.2,3,3-三甲基戊烷2,3-二甲基-3-乙基戊烷2,3-二甲基-1-戊烯6-甲基-5-乙基-2-庚炔二乙基-1-己烯-4-炔6. (1)和(3) (2)和(4) (5)和(6)7.8.1-庚烯2-庚烯3-庚烯2-甲基-1-己烯3-甲基-1-己烯4-甲基-1-己烯5-甲基-1-己烯2-甲基-2-己烯3-甲基-3-己烯2,3-二甲基-1-戊烯2,4-二甲基-1-戊烯3,5-二甲基-1-戊烯戊烯2-乙基-1-戊烯3-乙基-1-戊烯2,3-二甲基-2-戊烯3,3-二甲基-1-(1) 官能团位置异构(2) 顺反异构(3) 碳链异构(4) 官能团异构(5) 碳链异构(6) 碳链异构10.该化合物的分子式为C14H3011.13. (CH 3)2C H CH 2CH 3 > CH 3C H 2CH 3 > C(CH 3)4 > CH 4烷烃的卤代反应机理为自由基取代反应。
旋光异构的基础知识

旋光异构之我见至学习有机化学以来,化学殿堂的多彩缤纷让我深深为之所吸引。
近期对探讨旋光异构体又有产生了强烈的兴趣,下面我想就学习了旋光异构之后谈谈自己对它的分析和看法。
最早在1849年,西方化学家路易·巴斯德(Louis Pasteur)发现从酿酒的容器中取得的酒石酸盐可以使平面偏振光旋转,但是使用其他来源的酒石酸盐却无法测定出此性质。
然而,是什么原因让这两者之间有这样的差别呢?原来这二者互为光学异构物,巴斯德的发现为我们敲开了旋光异构的大门。
酒石酸的结构表达式为HOOC—CH—CH—COOH,但是对于巴斯德的发现,我们又如何去解释同样是酒石酸却表现出不同的偏振光现象,这种导致偏振光现象产生的原因是什么?在进行认真的探讨和分析之后终于找到了满意的答案。
当普通光通过一个偏振的透镜或者尼科尔棱镜时,一部分光就被挡住了,只有振动方向与棱镜晶轴平行的光才能通过,这种只有在一个平面上振动的光称为平面偏振光,简称偏振光。
然而,偏振光所在的振动面化学上习惯性的称为偏振面。
当偏振光通过从酿酒的容器中取得的酒石酸后,偏振面的方向就被旋转了。
这就是西方化学家路易·巴斯德在做实验过程中看到的现象。
随着有机化学在化学领域不断研究和发展,我们对这一现象在原有的基础上又有了新的认识。
我们发现偏振光在通过酒石酸的时候偏振面的方向被旋转了一个角度,在现代化学领域我们把这个角度称为旋光度,用“a ”表示。
把使偏振光的偏振面向右旋转的称为右旋体,把使偏振光的偏振面向左旋转的称为左旋体。
左旋体和右旋体的旋光度相同,旋光方向相反,所以等量的左旋体和右旋体组成的体系没有旋光活性,我们把物体内部同时具有左、右旋光的分子而不表现出旋光性称为外消旋性,这种体系叫外消旋体。
它可以被拆分为左旋和右旋两个异构体。
与此对应的内消旋体是指分子本身结构具有相同碳原子,分子的两个半部分互为实物与镜像的体系不表现旋光性。
那么内消旋体与外消旋体有什么异同呢?资料显示两者都不具有旋光性能,内消旋体是一种纯物质,导致其本身不具旋光性的原因在于其分子结构,它不能像外消旋体还可以分离出具有旋光性的两种物质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
旋光仪
比旋光度:旋光性物质的一个物理常数
在一定温度下,1mL含1g旋光物质的溶液,在 1dm的盛液管中,光源波长(λ)为589nm( 钠光)时,测得的旋光度即为比旋光度。可用 下列公式计算:
•式中:α── 被测溶液的旋光度;
•L ── 是盛液管的长度(dm);
•d ── 溶液的浓度(g/mL到),如果所测 的物质为纯液体,d为该物质的密度;
三、手性碳原子
手性碳原子:与4个不相同的原子或 基团相连的碳原子叫做手性碳原子( 不对称碳原子),用*标记。
手性碳原子
*
分子如果只含有一个
手性碳原子,它一定
是手性分子。
• 第三节 含有一个手性碳原子化合物的旋 光异构
一、对映体和外消旋体
1.对映异构体:互为实物与镜像关系,但不能 重叠的异构体,称为对映异构体(enantiomers ),简称为对映体,这种异构现象,称为对映 异构现象(enantiomerism)。
4COOH II
(2S,3S)
1COOH
1COOH
H 2 OH H 3 OH
σ HO 2 H
HO 3 H
4COOH
III
(2R,3S)
4COOH IV
对映体
非对映体
同一物质,内消旋体
•内消旋体:分子中含有多个手性碳原子,而分子 内部有一对称面,将偏振光的影响相互抵消而无 光学活性的化合物为内消旋体(mesomer),以 meso表示。内消旋体为纯净物。
二、费歇尔投影式
1.旋光异构体的平面表示方法
对映体可用模型、透视式和Fischer投影 式表示。一般多采用Fischer投影式。 Fischer投影式的投影规则为:把含手性 碳原子的主链直立,编号小的碳原子放在 上端,用十字交叉点代表手性碳原子,使 竖键上所连接的原子或基团伸向纸平面的 后方,横键上所连接的原子或基团伸向纸 平面的前方(横前竖后)。
具有旋光性的物质称为旋光性物质或光 学活性物质。
左旋体:迎着光传播的方向观察,使偏振光的 偏振面向左(逆时针方向) 旋转的分子为左旋 体,用“-”或“l”表示。
右旋体:使偏振光的偏振面向右旋转(顺时针 方向)的分子,称为右旋体,用“ +”或“ d”表示。
二、旋光度与比旋光度
旋光度:旋光性物质使偏振光的 振动面旋转的角度称为旋光度, 用符号“α”表示。
i
3.对称轴
分子中有一条假想的 直线,当分子以此直
C2
线为轴旋转360o/n后 (n为整数),所得
CH3
到的分子形象与原来 CH3
的分子相同,那么这
条直线就称为n重对
称轴(符合为Cn)。
注意: 一个分子若存在对称因素,这样的分子 往往能与其镜像重叠,具有对称性,为非手性分 子;反之,若不存在对称因素,则是手性分子。 可通过考察其是否存在对称因素,判断分子是否 具有手性。整个分子具有手性是存在旋光异构体 的必要和充分的条件。
第一节 物质的旋光性
一、偏振光与旋光性
平面偏振光:只在一个平面上振动 的光叫做平面偏振光(planepolarized light),又称为偏振光或 偏光,偏振光前进的方向与光振动的 方向所构成的平面称为偏振面。
普通光通过尼科尔棱镜变为偏振光示意图
旋光性 :能使偏振光偏振面旋转的性质 叫做旋光性 。
内消旋体
作业
1.(2)(4)(6)(7)(8)(10) 2.(5)除外 3.(3)除外 4. 5.(1)(3)(4) 6. 7. 8.(1)(5)
COOH
含两个手性碳原子的分子费歇尔投影式
注意模型、透视式和Fischer投影 式之间可进行下列转换:
a e
bd
a
b
e
d
a
e
b
d
模型式
透视式
Fischer 投影式
三、旋光异构体构型的命名
1. D/L构型命名法
D/L命名法是以甘油醛的两种构型为标准,人 为规定(+)-甘油醛为D构型(Dextro,右,手性 碳原子上的OH处于Fischer投影式的右侧),()-甘油醛为L构型(Levo,左,手性碳原子上 的OH处于Fischer投影式的左侧)。
•t ── 测定时的温度(℃)
•D── 钠光的波长(589nm)
偏振光通过旋光性物质时,偏振面发生旋转。
偏振光通过非旋光性物质时,偏振面不发生旋转。
第二节 旋光性与分子结构的关系
一、手性和手性分子
旋光异构:构造 相同,旋光度数 大小相等,旋光 方向相反的异构 体。
乳酸的旋光异构
手性分子:互为实物与镜像关系,但不 能重叠的性质称为分子的手征性或手性 ,具有手性的分子称为手性分子。与其 镜像重叠的分子称为非手性分子。
取代基互换位置奇数次,构型转变。
3. 将Fischer投影式脱离纸面翻转180°,
则构型发生变化
4.含多个手性碳原子的分子的费歇尔投 影式体现的是重叠式构象,不是其优势构 象,这也是费歇尔投影式的不足之处。
观察者方向
COOH HC
HO HC
HO COOH
COOH H
OH H
OH COOH
COOH H OH H OH
第六章 旋光异构
有机化合物的异构现象
同分异构 isomerism
构造异构 constitutional isomerism
立体异构 stereo isomerism
碳链异构 chain isomerism
位置异构 positional isomerism
官能团异构
functional group isomerism
CHO
CHO
H
OH
HO
H
CH2OH
D-(+)-甘油醛
CH2OH
L-(-)-甘油醛
2. R/S构型命名法
R/S标记法规则如下:
1. 将手性碳原子上相连的四个不同原子或基团 (a,b,c,d)按次序规则从大到小排列成序 (假定a>b>c>d) 2. 将最低次序的原子或基团(d)远离观察者, 其余三个原子或基团面向观察者,观察三个原 子或基团由大到小的顺序,若由 a→b→c为顺 时针方向旋转的为R构型(R为拉丁文Rectus的 缩写,表示右),若是逆时针方向旋转的为S构 型(S为拉丁文Sinister的缩写,表示左)。
乳酸对映体的Fischer投影式
注意:
Fischer投影式是用平面式表示三 维空间的立体结构。在书写时,必 须按照其规定表示分子构型的立体 结构。
1. Fischer投影式在纸面旋转180°或其 偶数倍,构型保持
Fischer投影式在纸面旋转90°、270°, 则构型发生变化
2.取代基互换位置偶数次,构型不变
4COOH 4COOH (2R,II3S) (2SI,II 3S)
1 COOH
HO 2 H Cl 3 H
4 COOH (2R,I3VR)
对映体
非对映体
对映体
非对映体:不呈实物与镜像关系的异构体,被称为 非对映体。
•含有一个手性碳原子的化合物,存在2个旋 光异构体,可组成一对对映体
•含两个不相同手性碳原子的化合物,存在4 个旋光异构体,可组成两对对映体
•含有n个不相同手性碳原子的化合物,其旋 光异构体的数目为2n个,可组成2 n-1对对映 体。由等量对映体组成的外消旋体的数目为2 n-1个
二、含两个相同手性碳原子的化合物 酒石酸(2,3-二羟基丁二酸)
COOH
ห้องสมุดไป่ตู้H 2 OH HO 3 H
4COOH I
(2R,3R)
1COOH
HO 2 H H 3 OH
优先顺序:a>b>c>d
a
c
d
b
观察方向
a>b>c,顺时针,其构型为R-型
直接确认Fischer投影式的R、S构型,规则 为:
当最低次序的原子或基团(d)处于竖键 的上下端时, a→b→c顺时针方向排列的 为R-构型,逆时针方向排列的为S-构型。
当最低次序的原子或基团(d)处于横键 的左右端时, a→b→c顺时针方向排列的 为S-构型,逆时针方向排列的为R-构型。
构型异构 configurational
顺反异构
cis-trans isomerism
isomerism
对映异构
构象异构
enantiomerism
conformation
isomerism
本章要求:
掌握分子对称因素与旋光性的关系。由 结构特征判断分子是否具有旋光性。 掌握以下基本概念:手性、手性分子、对 映体、非对映体、内消旋体、外消旋体 等 掌握Fischer投影式的写法及构型的标记 法(R/S,D/L法)。
CHO
H
OH
CH2OH
R-甘油醛
CHO
HO
H
CH2OH
S- 甘油醛
第四节 含有两个手性碳原子的化合物的 旋光异构
一、含两个不同手性碳原子的化合物
(2-羟基-3-氯丁二酸)
1 COOH
H 2 OH Cl 3 H
4 COOH
(2SI,3R)
1COOH 1COOH HO 2 H H 2 OH
H 3 Cl H 3 Cl
二、分子中常见对称因素
1. 对称面(σ): 假设在分子中有一个平面,它能够
把分子分割成互为实物与镜像关系的两部分,这个平 面就叫做这个分子的对称面(symmetrical plane)。
分子的对称面
2. 对称中心(i) 设想分子中有一点,从分
子的任一原子或基团出发,向该点引一直线并 延长出去,在距该点等距离处,总会遇到相同 的原子或基团,这个点就叫做分子的对称中心 (symmetrical center)。
