九年级化学常见的酸和碱指示剂
化学反应中的酸碱指示剂

化学反应中的酸碱指示剂化学反应是物质发生转化时产生的化学变化过程,而酸碱指示剂则是在化学反应中被用来检测和判断反应物或产物的酸碱性质的重要工具。
酸碱指示剂广泛应用于实验室、工业生产和日常生活中,其特性和应用具有重要意义。
一、酸碱指示剂的概述酸碱指示剂是一种能够根据溶液的酸碱性质而发生颜色变化的物质。
根据酸碱性质的差异,酸碱指示剂可分为酸性指示剂和碱性指示剂两类。
常用的酸性指示剂有苯酚蓝、溴酚蓝、甲基橙等;而碱性指示剂主要包括酚酞、甲基红等。
这些指示剂在酸性或碱性环境下,会发生分子结构的改变,导致颜色发生明显的转变,从而可以判断溶液的酸碱性质。
二、酸碱指示剂的原理酸碱指示剂的变色原理是基于指示剂分子内部的结构改变。
一般来说,指示剂分子在酸性环境下,会处于一种酸性态,呈现一种颜色;而在碱性环境下,则处于碱性态,呈现另一种颜色。
这种结构改变导致了指示剂分子的吸收光谱发生变化,从而使我们能够识别出溶液是酸性还是碱性。
酸碱指示剂的变色范围通常由变红到变蓝或由变黄到变紫等。
三、酸碱指示剂的应用1. 实验室检测:酸碱指示剂广泛应用于实验室中的酸碱滴定分析、中和反应判断等实验中。
通过观察溶液的颜色变化,可以判断溶液的酸碱性质和浓度。
2. 工业生产:在某些工业生产过程中,需要对溶液的酸碱性进行调节和控制。
酸碱指示剂能够提供直观的颜色反馈,帮助操作人员及时了解溶液的酸碱性质,从而进行相应的调节和控制。
3. 日常生活:酸碱指示剂也可以应用于我们的日常生活中。
例如,它可以用于酸性饮料(如柠檬汁)和碱性物质(如苏打水)的鉴别;或者用于检测清洁剂或肥皂水的酸碱性,确保我们使用的清洁产品对身体和环境没有损害。
四、注意事项1. 酸碱指示剂的选取应根据具体的酸碱性质以及反应条件来选择,以确保准确的判断结果。
2. 在实验或工业生产中使用酸碱指示剂时,需要注意指示剂的浓度,确保溶液的准确判断。
3. 酸碱指示剂的保存也需要注意,通常存放在避光、干燥的地方,以免受潮或光照导致质量变化。
酸碱中和反应的指示剂

酸碱中和反应的指示剂酸碱中和反应是化学中常见的一种化学反应类型,它涉及酸和碱之间的中和反应。
在这种反应中,酸和碱相互反应生成盐和水。
为了能够准确地判断酸碱中和反应的终点,我们需要使用一种叫做指示剂的物质。
指示剂是化学试剂中的一类物质,可以通过在酸碱中和反应过程中改变颜色来指示反应的终点。
不同的指示剂在不同的酸碱条件下具有不同的颜色,因此可以根据指示剂的颜色变化来判断反应是否中和完成。
常见的酸碱指示剂有几种,下面将逐一介绍它们。
1. 甲基橙甲基橙是一种常用的酸碱指示剂,它在酸性溶液中呈红色,在中性溶液中呈橙色,在碱性溶液中呈黄色。
因此,当酸和碱反应达到中和时,甲基橙的颜色由红色逐渐变为橙色,然后再变为黄色。
2. 酚酞酚酞是另一种常用的酸碱指示剂,它在酸性溶液中呈粉红色,在中性溶液中呈无色,在碱性溶液中呈深红色。
因此,当酸和碱反应达到中和时,酚酞的颜色由无色逐渐变为粉红色。
3. 甲基红甲基红在酸性溶液中呈红色,在中性和碱性溶液中呈黄色。
因此,当酸和碱反应达到中和时,甲基红的颜色由红色逐渐转变为黄色。
除了以上三种常见的酸碱指示剂,还有许多其他的指示剂可供选择,如碘化钾淀粉溶液、溴蓝等,它们在不同的酸碱条件下具有不同的颜色变化。
使用指示剂来判断酸碱中和反应的终点要注意一些事项。
首先,要选择适合的指示剂,要根据反应的酸碱条件来选择合适的指示剂,以确保准确判断中和终点。
其次,要控制所使用指示剂的量,过多的指示剂可能会影响反应的准确性。
最后,在使用指示剂进行观察时要细心,观察颜色的变化,有时颜色的变化会很快,需要注意观察细节。
总结一下,酸碱中和反应的指示剂是一种重要的化学试剂,可以用于判断反应的终点。
常见的指示剂有甲基橙、酚酞和甲基红等,它们的颜色变化能够指示反应的中和程度。
在使用指示剂时,要选择合适的指示剂,并控制良好的实验条件,以确保准确判断酸碱中和反应的终点。
2021年九年级下学期化学人教新版第十章:酸和碱10.1常见的酸和碱《讲义教师版》

常见的酸和常见的碱知识集结知识元酸碱指示剂知识讲解1、定义:能与酸或碱的溶液起作用而显示不同颜色的物质,称为酸碱指示剂(简称指示剂)。
2、常用的指示剂:石蕊溶液,酚酞溶液3、酸碱溶液的反应酸性溶液碱性溶液中性溶液紫色石蕊试液红色蓝色紫色无色酚酞试液无色红色无色例题精讲酸碱指示剂例1.【答案】A【解析】题干解析:A、食醋呈酸性,碱性肥皂水呈碱性,能验证喇叭花的变色情况,此项正确;B、食醋和酸奶都呈酸性,不能验证喇叭花遇碱性溶液的变色情况,此项错误;C、糖水呈中性,酸奶呈酸性,不能验证喇叭花遇碱性溶液的变色情况,此项错误;D、食醋呈酸性,食盐水中性,不能验证喇叭花遇碱性溶液的变色情况,此项错误;例2.【答案】D【解析】题干解析:A、酚酞在酸性溶液中也是无色,故不一定是蒸馏水,错误;B、酚酞在中性溶液中也是无色,故不一定是稀盐酸,错误;C、酚酞在氢氧化钠溶液中是红色的,故一定不会是氢氧化钠溶液;D、酚酞在碱性溶液中是无色的,小烧杯中盛的不可能是碱性溶液,正确;例3.【答案】C【解析】题干解析:向某溶液中滴入无色酚酞试液后不显色,则溶液可能为酸性,也可能为中性,石蕊在酸性溶液中为红色,在中性溶液中为紫色.例4.【答案】B【解析】题干解析:等质量、等质量分数的盐酸和氢氧化钠两种溶液充分混合后,盐酸与氢氧化钠溶液中所含溶质的质量相等.反应中消耗盐酸酸与氢氧化钠的质量比关系如下:HCl + NaOH ═ NaCl + H2O36.5 40可知,36.5份质量的盐酸与40份质量的氢氧化钠恰好完全反应,则等质量、等质量分数的盐酸和火碱两种溶液充分混合后,稀盐酸有剩余,溶液显酸性,最终混合后的液体呈红色.例5.【答案】C【解析】题干解析:A、根据酸碱中和反应的定义可以知道,稀盐酸和氢氧化钠溶液恰好完全反应时,溶液中的OH﹣刚好被加入的H+完全结合,但是该反应生成的是水和可溶性的氯化钠,所以看不到现象,不能作为稀盐酸和氢氧化溶液反应的判断依据,故A错误;B、氢氧化钠溶液中滴入酚酞后变成红色,当稀盐酸和氢氧化钠溶液恰好完全反应时,溶液呈中性,而酚酞遇中性溶液不变色,所以可以观察到溶液颜色消失,故B错误;C、氢氧化钠溶液中滴入酚酞后变成红色,当稀盐酸和氢氧化钠溶液恰好完全反应时,溶液呈中性,而酚酞遇中性溶液不变色,所以可以观察到溶液颜色消失,故C正确;D、可以判断,故D错误.常见的酸知识讲解一、常见的酸1、生活中常见的酸•食醋中含有醋酸柠檬柑橘等含有柠檬酸醋酸汽车用铅蓄电池中含有硫酸二、常见的酸有盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、还有磷酸(H3PO4)、碳酸(H2CO3)、醋酸(CH3COOH)等。
常见的酸和碱

盐 酸
硫 酸
[想一想]
分别盛放浓盐酸和浓硫酸的两 个试剂瓶,敞口放置一段时间后 (不考虑水分的蒸发),两瓶酸的 质量、溶质质量分数各有何变化? 应如何保存?
2、浓硫酸强烈的腐蚀性(脱水性)
[实验10-3]:使用浓硫酸要十分小心! 实 验 放置一会儿后的现象
用玻璃棒蘸浓硫酸在纸上 纸上的字变黑,穿孔 写字 用小木棍蘸少量浓硫酸 木棍变黑 将浓硫酸滴到一小块布上
相信你会总结:
1.本节课,你学到了哪些新的知识? 1、酸能使紫色石蕊溶液变红色, 酸不能使无色酚酞溶液变色。
决定
酸 能 解 离 出 H+
2、酸能与活泼金属反应生成氢气。 3、酸能与金属氧化物反应生成水。
2.本节课,你运用了哪些学习方法?
你能运用“酸的化学性质”解决实际问题 吗? 1.生锈的铁器在用稀盐酸或稀硫酸
我们来探究
请同学们在井穴板的两个凹槽内分别 滴几滴稀盐酸,再分别滴入1~2滴紫色石 蕊溶液和无色酚酞溶液,观察现象。
稀盐酸
加紫色石蕊溶液
稀盐酸 (HCl) 紫色石蕊变红色 紫色石蕊变红色 紫色石蕊变红色 紫色石蕊不变色 ?
加无色酚酞溶液
无色酚酞不变色 无色酚酞不变色 无色酚酞不变色 ? 无色酚酞不变色
2.在实验室制备氢气可以用( B ) A 炭粒与水反应 C 锌粒与硝酸反应 B 铁屑与盐酸反应 D 铁屑与浓硫酸反应
二.请你帮忙完成:
3.向放有铁锈的钉子的试管中加入过量盐酸,充分反应后,铁锈消失, Fe2O3+6HCl=2FeCl3+3H2O 、 并有气泡产生,写出有关反应方式:__________________________ Fe +2HCl= H2 + FeCl2 _____________________________ .
常见的酸碱指示剂有哪些

常见的酸碱指示剂有哪些酸碱指示剂是在酸碱中发生颜色变化的化学物质,广泛应用于化学实验和工业生产中。
它们的作用是通过改变溶液的颜色来指示溶液的酸碱性质。
常见的酸碱指示剂有以下几种:1. 酚酞酚酞是最常见的一种酸碱指示剂,它呈现红色和无色两种状态。
在酸性溶液中呈现红色,而在中性和碱性溶液中则呈现无色。
它广泛应用于酸碱中和反应的检测和分析。
2. 酸性甲基橙酸性甲基橙是一种在酸性溶液中呈现红色,而在中性和碱性溶液中则呈现橙色的指示剂。
它常用于测定碱的滴定过程中。
3. 甲基红甲基红是一种在酸性溶液中呈现红色,而在碱性溶液中则呈现黄色的指示剂。
它广泛应用于测定酸的滴定和其他酸碱性质的实验中。
4. 甲基橙甲基橙是一种在酸性溶液中呈现红色,而在中性和碱性溶液中则呈现黄色的指示剂。
它常用于测定酸的滴定和其他酸碱反应的检测。
5. 甲基紫甲基紫是一种变色范围较广的指示剂,它在酸性溶液中呈现红色,而在中性和碱性溶液中则呈现蓝色。
它通常应用于测定碱的滴定过程。
6. 金黄色试纸金黄色试纸是一种特殊的酸碱指示剂,它是一种通过颜色变化来指示酸碱性质的试纸。
它在酸性溶液中会变红,而在碱性溶液中则会变蓝。
它常用于快速检测液体或物质的酸碱性质。
除了以上提到的几种常见酸碱指示剂,还有许多其他的指示剂,如苏丹红、溴酚蓝、溴酚绿等,它们在不同的酸碱范围内呈现不同的颜色变化,可以根据实验需要选择合适的指示剂。
总结起来,常见的酸碱指示剂有酚酞、酸性甲基橙、甲基红、甲基橙、甲基紫和金黄色试纸等。
选择适合的指示剂可以帮助我们准确地判断溶液的酸碱性质,在化学实验和工业生产中具有重要的应用价值。
第十单元课题1常见的酸和碱

紫色
无色酚酞溶液
无色
红色
无色
课题1 常见的酸和碱
栏目索引
特别提醒 (1)酸碱指示剂跟酸或碱溶液混合时,是酸或碱溶液使酸碱指示 剂显示不同的颜色,而不是指示剂使酸或碱溶液变色。(2)指示剂颜色的变 化,只能说明被测溶液显酸性或碱性,而不能确定此溶液一定是酸溶液或一 定是碱溶液。
课题1 常见的酸和碱
课题1 常见的酸和碱
2.干燥剂和干燥器的选择
栏目索引
(1)干燥剂的选择:根据被干燥气体的性质选择,不能让干燥剂与被干燥的
气体反应。
干燥剂
可干燥的气体
不能干燥的气体
酸性 碱性
浓硫酸
H2、O2、CO、CO2、 HCl、CH4、N2、SO2
固体NaOH、碱石灰、 H2、N2、CH4、NH3 生石灰
NH3 CO2、SO2、HCl等
几乎不吸收水分
有强腐蚀性
有较强腐蚀性
课题1 常见的酸和碱
栏目索引
制法 用途
Ca(OH)2+Na2CO3 CaCO3↓+2NaOH
作气体干燥剂、去除 油污
CaO+H2O Ca(OH)2
作建筑材料、改良 酸性土壤
拓展延伸 (1)由于氢氧化钠易溶于水,同时吸收空气中的二氧化碳发生变 质,所以氢氧化钠必须密封保存。(2)保存碱溶液的试剂瓶应用橡胶塞,不 能用玻璃塞。
3.浓硫酸的稀释
课题1 常见的酸和碱
栏目索引
图10-1-1
4.酸的化学性质
性质 与酸碱指示剂反应 与活泼金属反应
与金属氧化物反应
课题1 常见的酸和碱
栏目索引
一般规律
特别提醒
使紫色石蕊溶液变红,使无色酚 发生颜色改变的是酸碱指示剂
常见的酸和碱及指示剂

[想一想]
1、分别盛放浓盐酸和浓硫酸 的两个试剂瓶,敞口放置一段时间 后(不考虑水分的蒸发),两瓶酸 的质量、质量分数各有何变化?应 如何保存?
?
2、如何区分它们?
颜色状态
打开瓶盖 后的现象
气味
敞口久置后溶 质质量变化 敞口久置后溶 剂质量变化 敞口久置后溶 液质量变化 敞口久置后溶质 质量分数变化
注意:闻气体的方法
闻气体的方法
一.常见的酸
1.浓盐酸和浓硫酸的物理性质:
盐酸
硫酸
颜色 状态
无色液体
打开瓶盖 瓶口有白雾, 后的现象 有挥发性
气味
有强烈的刺激性 气味、有酸味
无色、粘稠、 油状的液体 无明显现象, 无挥发性
无刺激性气味
① 浓盐酸有强挥发性, ② HCl气体极易溶于水(1∶500)。
2.盐酸和硫酸的用途:
(3)浓硫酸的强氧化性
3.浓硫酸的特性:
(1)吸水性:能吸收空气及其他物质中的
水分,使硫酸变稀。
(2)腐蚀性:能夺取纸张、木材、棉布、
皮肤(由含C、H、O等元素 的化合物组成)里的水分, 生成黑色的炭。(脱水性)
(3)强氧化性
【实验10-4】浓硫酸的稀释。
手的感觉 烧杯壁发热
分析
浓硫酸溶于水时 放出大量的热
酸碱指示剂与酸碱溶液作用时显示的颜色:
紫色石蕊溶液遇酸溶液变红色;遇碱溶液变蓝色 无色酚酞溶液遇酸不变色(无色);遇碱溶液变红色
指示剂 酸 性 种 类 溶液
中性 溶液
碱性 溶液
石蕊
红色
溶液
紫色
蓝色
酚酞
无色
溶液
无色
红色
注意:酸碱指示剂与酸或碱的溶液反应时,
初中化学 第十章 酸和碱

知1 酸碱指示剂概念:指能与酸或碱的溶液起作用而显示不同颜色的物质;常用的指示剂:紫色石蕊溶液、无色酚酞溶液。
石蕊溶液、酚酞溶液与酸、碱溶液的反应注:①不溶于水的酸或碱不能使指示剂的颜色发生改变,如氢氧化铜Cu(OH)2②酸碱指示剂遇到酸、碱变色是化学变化,变化的物质是指示剂,不是酸碱。
如可以说盐酸能使紫色石蕊溶液变红,也可以说紫色石蕊溶液遇盐酸变红;但不能说紫色石蕊溶液使酸变红。
③不能用指示剂判断某溶液是酸的或碱的溶液,只能判断溶液显酸性或碱性。
④酸碱指示剂是从植物的花瓣或果实中提取的汁液,只要在酸碱性不同的溶液中显示不同的颜色就可以做指示剂。
⑤某溶液滴入酚酞后不变色,该溶液可能是碱性溶液,也可能是中性溶液。
知2 常见的酸1.盐酸a.物理性质:无色有刺激性气味的液体(工业盐酸因含杂质FeCl 3而显黄色);注意:浓盐酸具有挥发性易挥发,瓶口形成白雾;白雾是挥发出来的氯化氢气体与空气中的水蒸气混合形成的盐酸小液滴。
敞口放置时溶质质量分数会减小,故应密封保存。
b.盐酸的用途:①盐酸是重要的化工产品②用于金属表面除锈③制造药物④人体胃液中含有盐酸帮助消化 2.硫酸a.物理性质:无色粘稠的油状液体;难挥发;有吸水性,稀硫酸为无色液体。
注意:①浓硫酸有吸水性,敞口放置会吸收空气中的水蒸气使溶质质量分数变小,故应密封保存。
②浓硫酸有吸水性,在实验室常用于做气体干燥剂,干燥气体时,气体一定从长导管进入。
浓硫酸不能干燥氨气。
③浓硫酸有腐蚀性,也叫脱水性,是化学性质。
若皮肤沾上浓硫酸应立即用大量清水冲洗,在涂上3%-5%的碳酸氢钠溶液。
④浓硫酸的三大性质:吸水性、脱水性、强氧化性(高中)⑤浓硫酸的稀释:将浓硫酸沿容器内壁缓慢注入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散,切不可把水倒去浓硫酸中。
b.浓硫酸的用途:①是重要的化工原料,用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈②浓硫酸具有吸水性,可做实验室的干燥剂3. 酸的通性:不同的酸在水溶液中都能解离出自由移动的H +,所以酸具有相似的化学性质;又由于酸根离子不同,不同的酸也有各自的特性。
人教版九年级下册化学常见的酸和碱-第一课时 指示剂

自制酸碱指示剂
收集不同颜色的新鲜花瓣或紫萝卜皮,各取适 量,研碎,加入适量水和酒精(两者体积比 为1:1),浸泡,过滤,得到植物色素提取液。 将提取液分别装入小试剂瓶中备用。 将上述植物色素提取液分别滴入白醋、蒸馏水、 澄清石灰水中,观察颜色的变化,并记录。 选择颜色变化明显的植物色素提取液作为酸碱 指示剂,并检验稀盐酸、氨水、食盐水等溶 液的酸碱性。
4.常见的碱有氢氧化钠(NaOH)、氢氧化 钙[Ca(OH)2]、氢氧化钾(KOH)、氢氧化铜 [Cu(OH)2]、氨水(NH3· H2O)等。
从名称上看都叫“氢氧化某”;从结构上 看都含有氢氧根(OH)
二、酸、碱、盐的定义
1、酸:电离生成的阳离子全都是 氢离子的化合物。 2、碱:电离生成的阴离子全都是 氢氧根离子的化合物。 3、盐:电离生成金属离子和酸根 离子的化合物。
3、下图是某同学在电脑屏幕上绘制的 酸、碱、盐电离图片,○表示H+, ●表示Na+,●表示OH-,●表示 Cl-,其中描述的是酸的电离的是 ( )
4、下图是试验物质导电性的实 验,其中灯泡不亮的是 ( )
5、含有下列离子的溶液中,溶 质全部为酸的是 ( ) A.H+、Na+、SO42- + - - B.H 、Cl 、NO3 - + 2 + C.OH 、K 、Ba D.Ag+、K+、NO3-
从紫罗兰花变色的现象中发现了 酸碱指示剂
探究 自制酸碱指示剂
1. 阅读“资料卡片——酸碱指示剂的发现”,你从 中能获得什么启示?与同学交流。
2. 自制酸碱指示剂。 (1) 取几种植物的花瓣或果实(如牵牛花、月季花、 紫甘蓝等), 分别在研钵中捣烂, 加入酒精(乙醇与水 的体积比为1 ∶ 1)浸泡; (2) 用纱布将浸泡出的汁液过滤或挤出, 得到指 示剂; (3) 试验指示剂在下列4种溶液中的颜色变化。 (每小组可以自制1~2 种指示剂)
酸碱中和反应的常见指示剂与选择原理

酸碱中和反应的常见指示剂与选择原理酸碱中和反应是化学中常见的一种反应类型,通常需要使用指示剂来帮助判断溶液的酸碱性质。
本文将介绍酸碱中和反应中常见的指示剂以及选择原理。
一、酸碱中和反应的基本概念酸碱中和反应是指酸和碱之间发生的一种化学反应,其中酸会与碱中的氢氧根离子(OH-)结合形成水和盐。
在酸碱反应中,溶液的酸碱性质的浓度可以通过pH值来表示,pH值越低表示溶液越酸,pH值越高表示溶液越碱,pH值为7表示溶液为中性。
二、常见的酸碱指示剂1. 酚酞(Phenolphthalein)酚酞是一种常见的酸碱指示剂,它的溶液呈现无色的存在于酸性溶液中,而在碱性溶液中呈现粉红色。
这是因为酚酞分子在酸性溶液中呈现未离子化状态,而在碱性溶液中离子化形成粉红色盐酸盐。
酚酞常被用于测定酸碱中和反应的终点,当溶液中的酸已经完全与碱中的氢氧根离子中和时,酚酞的颜色从无色变为粉红色。
2. 甲基橙(Methyl Orange)甲基橙是另一种常见的酸碱指示剂,它的溶液呈现红色在酸性溶液中,而在碱性溶液中呈现黄色。
甲基橙的颜色变化基于其分子在酸性溶液中呈现阳离子状态,而在碱性溶液中呈现阴离子状态的特性。
当酸性溶液中的酸与碱中的氢氧根离子发生中和反应时,甲基橙的颜色从红色转变为黄色。
3. 酚红(Phenol Red)酚红也是常用的酸碱指示剂之一,它的溶液呈现黄色在酸性溶液中,而在碱性溶液中呈现红色。
酚红的颜色变化来源于其在酸性溶液和碱性溶液中的离子化状态的不同。
当酸性溶液中的酸与碱中的氢氧根离子发生中和反应时,酚红的颜色从黄色转变为红色。
三、酸碱指示剂的选择原理酸碱指示剂的选择依赖于所研究的酸碱体系的性质和条件。
在选择酸碱指示剂时,需要注意以下几点:1. pH范围:根据所研究的溶液的pH值变化范围来选择合适的指示剂,确保它在所需的pH范围内发生颜色变化。
2. 颜色强度:指示剂的颜色强度应适中,以便于肉眼观察。
颜色过淡会造成观察困难,颜色过浓则难以判断。
九年级化学常见的酸和碱知识点及答案

九年级化学知识点10第十单元《常见的酸和碱》1、常见的酸碱指示剂有和。
紫色石蕊溶液遇酸性溶液变,遇碱性溶液变。
无色酚酞溶液遇酸性溶液呈色,遇碱性溶液变。
酸溶液显酸性,显酸性的溶液是酸溶液。
(填“一定”、“不一定”)碱溶液显碱性,显碱性的溶液是碱溶液。
(填“一定”、“不一定”)2、证明某溶液显酸性的方法:。
证明某溶液显碱性的方法:。
3、打开浓盐酸的瓶盖,在瓶口会看到,说明浓盐酸具有性,长期敞口放在空气中质量,质量分数。
浓硫酸具有性,长期敞口放在空气中质量,质量分数。
4、盐酸的用途:(1)金属表面(2)胃液中含酸,帮助消化。
硫酸的用途:(1)稀硫酸金属表面(2)浓硫酸作某些气体的,不能干燥。
5、写出下列物质的化学式:盐酸硫酸硝酸醋酸碳酸氢氧化钠氢氧化钙氢氧化钾氢氧化钡氯化钠碳酸钠碳酸钙硫酸铜氯化铁6、酸中一定含有元素碱中一定含有元素。
7、用玻璃棒蘸浓硫酸在纸上写字,现象,该变化属于变化。
浓硫酸溶于水会,稀释浓硫酸时,一定要把沿器壁慢慢注入中。
并用玻璃棒,其目的是。
8、如果不慎将浓硫酸沾到皮肤或衣服上,应立即,然后再。
9、使用白色点滴板的优点是①②③10、酸的化学性质(盐酸、稀H2SO4)由于酸在水溶液里都能解离出,所以它们有一些相似的化学性质。
(1)酸与作用,紫色石蕊遇酸溶液变色,无色酚酞遇酸溶液色。
(2)酸与反应生成盐和氢气(基本反应类型是)条件:①;②锌和稀硫酸铁和稀硫酸镁和稀硫酸铝和稀硫酸锌和稀盐酸镁和稀盐酸铁和稀盐酸铝和稀盐酸(3)酸与反应(基本反应类型是)锈铁钉与盐酸锈铁钉与稀硫酸现象:。
氧化铜与稀盐酸氧化铜与稀硫酸现象:。
氧化钙与稀盐酸氧化镁与稀盐酸氧化镁与稀硫酸氧化铝与稀盐酸(4)酸与反应生成盐和水( 反应) (基本反应类型是)用含氢氧化铝药物治疗胃酸过多Al(OH)3起作用盐酸和烧碱起反应:(实验)(注意是先加溶液,再加,然后才加)做上述实验时,如果在实验过程中忘了加酚酞,在实验结束后再加酚酞溶液,发现酚酞不变色,会有两种情况:①②。
初中化学九下10.1 常见的酸和碱-酸碱与指示剂作用 课件

稀盐酸 稀硫酸 食盐水 石灰水 氢氧化钠溶液
加入紫色石蕊溶液 后的颜色变化
红色 红色 紫色 蓝色 蓝色
加入无色酚酞溶液 后的颜色变化
不变色 不变色 不变色
红色 红色
生活中的化学
一次妈妈在做饭,小莉 在帮妈妈凉拌紫萝卜丝时, 倒入食醋后,发现紫萝卜 丝变成了红色,这是怎么 回事呢?
紫萝卜中含有一种植物色素, 它遇到酸性溶液能变成红色。
如何自制 酸碱指示剂
你的花汁 能作指示剂吗?
家庭小实验
检测家中洗发水,护发素, 洗面奶等的酸碱性
典例精析
万寿菊 胡萝卜 绿
紫甘蓝 (4)区别硫酸、氢氧化钠溶液、氯化钠溶液用__紫__甘__蓝_________。
拓展延伸
2.
水分子
H+ Cl-
水分子 H+ Cl-
取少量紫甘蓝溶液于试管 中,加入蒸馏水
酸、碱与指早,制酒时把较珍贵 的酒放在窖中保存,在微生 物的作用下产生了酸。
“碱”一词在阿拉伯语中 表示灰。人们将草木灰放 到水中,利用灰汁洗浴、 印染等。
生活中常见的酸:醋酸、果酸 实验室常见的酸:稀盐酸、 稀硫酸、稀硝酸
“碱”一词在阿拉伯语中 表示灰。人们将草木灰放 到水中,利用灰汁洗浴、 印染等。
生活中常见的酸:醋酸、果酸 实验室常见的酸:稀盐酸、 稀硫酸、稀硝酸
常见的碱:氢氧化钙 氢氧化钠
史料记载
英国科学家波义耳在一次实验中不慎将浓盐 酸溅到一束紫罗兰花瓣上,喜爱花的他马上进 行冲洗,一会儿却发现紫色的花瓣变红了。惊 奇的他没有放过这一偶然的发现,而是进行了 进一步的实验和思考。结果发现,许多种植物 花瓣的浸出液遇到酸性溶液或碱性溶液都能变 色,其中变色效果最好的是地衣类植物——石 蕊,这就是最早使用的酸碱指示剂。之后,人 们从地衣类植物中提取蓝色粉末状的石蕊色素, 制成了酸碱指示剂。
10.1_常见的酸和碱

⑵用纱布将浸泡出的汁液过滤或挤出,得到指示剂;
⑶试验指示剂在表内4种溶液中的颜色变化。 指示剂 (溶液) 在不同溶液中的颜色变化 石灰水 盐酸 氢氧化钠溶液
食醋
指示剂 (溶液)
紫色菊花瓣汁
食醋
红色
在不同溶液中的颜色变化 石灰水 盐酸 氢氧化钠溶液
绿色 红色 绿色
金盈菊花瓣汁
三角梅花瓣汁 紫色包菜叶汁
4、失去标签的三瓶无色液体,分别是稀HCl、蒸馏水、 NaOH溶液,能否用酚酞试液将它们鉴别出来? (提示HCl + NaOH NaCl + H2O) 中性溶液
可以
练习:
1、写出下列物质的化学式及类别:
硫酸铜 氢氧化钠 碳酸 硫酸亚铁 氯化铵 水 盐酸 氯化镁 氢氧化钡 氨水 碳酸氢钠 氧化铜
三、常见的酸
利用上面的反应可以清除金属制品表面的锈,除锈时能 否将金属制品长时间浸在酸中?为什么?
酸的通性
① 酸能与酸碱指示剂反应,酸能使紫色石 蕊溶液变红,不能使无色酚酞溶液变色。 ② 酸能与金属活动性顺序表中排在氢以前 的金属发生置换反应,生成盐和氢气。 ③ 酸能与某些金属氧化物发生反应,生成 盐和水。 ④ 酸能和某些盐反应,生成新酸和新盐。 ⑤ 酸能和碱发生中和反应,生成盐和水。
二、酸碱指示剂
能跟酸或碱的溶液反应,而显示不同的颜色,这 类物质叫酸碱指示剂。常用的酸碱指示剂有石蕊、酚 酞。 紫色石蕊溶液 无色酚酞溶液 酸性溶液 碱性溶液 中性溶液 红色 蓝色 紫色 无色 红色 无色
巩固练习:
红色 , 1.盐酸是酸溶液,它使紫色石蕊溶液变______ 仍无色 。 遇无色酚酞溶液_______ 蓝色 2.氢氧化钠溶液是碱溶液,它使石蕊溶液变____ , 红色 。 使酚酞溶液变______ 蓝色 3.紫色石蕊溶液滴入碱溶液(如石灰水)变 _____,
常见的酸和碱指示剂课件

酸碱指示剂的制备方法
酸碱指示剂可以合成或从自然中提取。其中,利用苯酚和酚酞合成指示剂是最为常见的制备方法之一。
化学合成
利用化学反应合成指示剂。
天然提取
从某些植物或自然物中提取指 示剂。
苯酚法
利用苯酚和氯化铬反应制备酚 酞指示剂。
摩尔色谱法
指示剂的变色点可以使用摩尔色 谱法来检测。
酸碱反应方程式
根据酸碱的反应性,可以得出不 同酸碱指示剂变色的方程式。
颜色的混合原理
颜色圆盘可以用来帮助理解指示 剂变色的原理。
常用的酸碱指示剂种类
酚酞、酸碱石蕊、金黄色指示剂以及溴酚绿、甲基红等指示剂都是常用的酸碱指示剂。
1
溴酚绿
在酸性溶液中呈现黄色,中性溶液中呈现绿色,碱性溶液中呈现蓝色。
2
甲基红
在酸性溶液中呈现红色,碱性溶液中呈现黄色。
3
酚紫
在酸性溶液中呈现红色,碱性溶液中呈现蓝紫色。
酸碱指示剂的应用领域
酸碱指示剂可以用于各种领域,包括药学、食品安全、水质检测、自然资源研究和工业化学等等。
1 医学
用于检测人体呼出的CO2含量,以评估患者的呼吸功能。
2 食品安全
可以用于检测食品中的污染物,确保食品安全。
酸
柠檬和醋是常见的酸物质。酸味 酸爽。
碱
肥皂和氨水是常见的碱物质。碱 味苦。
pH值的概念
pH值用于表示水中酸碱程度的强 弱。pH值越小表示酸度越强,越 大则表示碱度越强。
常见的酸和碱指示剂
酸碱指示剂是一种在水中变色的物质,它们会根据酸碱度的变化而改变自身的颜色。常见的指示 剂有酚酞、酸碱石蕊、金黄色指示剂等。
3 水资源
可以用于检测水中总碱度、pH值等参数,以保证水质。
初中化学常见的酸和碱-指示剂课件

二、氢氧化钠、氢氧化钙的性质的比较
氢氧化钠 氢氧化钙
俗称
物理 性质
指示剂 非金 属氧 化物
火碱、烧碱、苛性钠 消石灰、熟石灰、石灰浆
1、白色块状固体, 1、白色粉末状固体, 2、易溶于水,放出热量, 2、微溶于水,水溶液俗称石灰水 3、易吸水而潮解,可以用作 3、也有腐蚀性 干燥剂 4、有腐蚀性
使石蕊试液变——色蓝 使酚酞试液变——色红
如: 硫酸 H2SO4 碳酸 H2CO3 盐酸 HCl 硝酸 HNO3 醋酸 CH3COOH
2、什么叫碱? 金属阳离子和氢氧根离子构成的化合物叫碱。
如: 氢ቤተ መጻሕፍቲ ባይዱ化钠 NaOH 氢氧化钾 KOH 氢氧化钙 Ca(OH)2 氨水
NH3 • H2O
一、盐酸、硫酸的性质比较
盐酸 硫酸
无色刺激性气味的液体, 无色无 味的 油 状液体, 脱水性和 有 挥发性 ,在空气中 有强 吸水性、 腐蚀 性,溶于水中放热. 形成 白雾 . 化 指示 1.使石蕊试液变 红 色. 1.使石蕊试液变 红 色. 学 剂 2.使酚酞试液变 无 色. 2.使酚酞试液变 无 色.
固体干燥的是( A: CO2
B
) C: SO2 D: HCl
B: H2
3、下列物质长期露置在空气中,质量会减 少的是( A ) A:浓盐酸
C:大理石
B:固体烧碱
D:浓硫酸
3、在氯化铁溶液中滴入烧碱溶液,观察 到的现象是( B )
A:有白色沉淀 C:有气泡冒出
提示: FeCl3 + 3NaOH=== Fe(OH)3 ↓ + 3NaCl 红褐色
4.酸+碱=盐+水(中和反应)
NaOH+HCl=NaCl+H2O Cu(OH)2+H2SO4=CuSO4+2H2O
化学中的酸碱指示剂

化学中的酸碱指示剂在化学领域中,酸碱指示剂是一种常用的化学试剂,用于确定溶液的酸碱性质。
酸碱指示剂通过改变颜色来指示溶液的酸碱性质,使我们能够方便地进行酸碱滴定和pH值测量。
本文将介绍酸碱指示剂的定义、分类、工作原理以及在实验室和实际应用中的作用。
一、酸碱指示剂的定义酸碱指示剂是一类能够在酸性和碱性溶液中显示不同颜色的化合物。
在化学试剂中广泛应用的酸碱指示剂通常是有机化合物。
它们的分子结构中含有可以与酸或碱反应的基团,改变溶液的酸碱性质后,这些基团的电子结构发生变化,从而使其颜色发生改变,提供了便利的酸碱检测方法。
二、酸碱指示剂的分类酸碱指示剂可以根据其颜色变化的pH范围进行分类。
以下是几种常见的酸碱指示剂及其相应的pH范围:1. 酚酞指示剂酚酞指示剂是一种常见的酸碱指示剂,其颜色在pH范围为0-8之间发生变化。
在酸性溶液中,酚酞呈现出红色,而在碱性条件下则呈现出无色或者淡黄色。
这种指示剂可以用于测定酸性物质的浓度或酸碱中和反应的终点的指示。
2. 甲基橙指示剂甲基橙指示剂的颜色变化范围在pH值为3.1-4.4之间。
在酸性溶液中,甲基橙呈现出红色或橙色,而在碱性溶液中则呈现出黄色。
这使得甲基橙成为酸碱滴定反应中常用的指示剂之一。
3. 酚酞红指示剂酚酞红指示剂在pH值为6.8-8.2时呈现出红色,而在更高或更低的pH值下则呈现出无色或者淡黄色。
这种指示剂常用于测定酸碱中和的终点或者酸性物质的浓度。
4. 甲基紫指示剂甲基紫指示剂在pH值为1.2-2.8时呈现出红色,而在碱性条件下则呈现出绿色。
这种指示剂通常用于测定浓度较低的酸性溶液或酸碱中和反应。
三、酸碱指示剂的工作原理酸碱指示剂的工作原理基于酸碱溶液中的氢离子和氢氧根离子浓度的变化。
指示剂分子中的染料基团在酸性条件下具有不同的电荷状态,与氢离子反应形成离子态,导致颜色的变化。
而在碱性溶液中,指示剂分子中的染料基团会与氢氧根离子结合,也会导致颜色的变化。
常见的酸和碱 1 指示剂

月季花
牵牛花
紫萝卜
自 制 指 示 剂 原 料
胡萝卜
美人焦
紫包菜
三、实验探究
几种植物花朵的酒精浸出液 在酸碱溶液中的变色情况
代用指示剂
酸性溶液中的 颜色变化
中性溶液 中的颜色
碱性溶液中的 颜色变化
牵牛花
月季花
美人焦
紫萝卜皮 紫卷心菜 胡萝卜
变红色 浅红色 淡红色 变红色 浅紫色
紫色 红色 红色 紫色 蓝色
二、如何鉴别酸 与碱的溶液
加入紫色石蕊溶液 后的颜色变化 食 盐 醋 酸
加入无色酚酞溶液 后的颜色变化
石灰水 NaOH溶液
变红色 变蓝色 变红色 变蓝色
不变色 变红色 不变色 变红色
根据上面实验的现象,分析这四种物质中,哪些可 石蕊和酚酞溶液叫做酸碱指示剂,通常也称指示剂。 能是酸溶液,哪些可能是碱溶液。
遇酸变红 紫色石蕊溶液
遇碱变蓝
遇酸不变色
无色酚酞溶液
遇碱变红
• 一、常见的酸 盐酸 HCl ,硫酸 H2SO4
醋酸CH3OOH ,碳酸 H2CO3
• 二常见的碱
氢氧化钠 NaOH , 氢氧化 钙Ca(OH)2 ,氢氧化铜CU(OH)2 氨水 NH4OH , 氢氧化钡Ba(OH)2
归 纳 与 分 析
归 纳 与 分 析
指示剂在不同溶液中的变色情况
指示剂
酸性溶液中的 颜色变化
中性溶液 中的颜色
碱性溶液中的 颜色变化
石蕊试液
酚酞试液
变红色 无色
NH4NO3溶液
紫色 无色
变蓝色 变红色
Na2CO3溶液
酸溶液
? 酸性溶液
酸 性 溶 液
常见酸和碱知识点
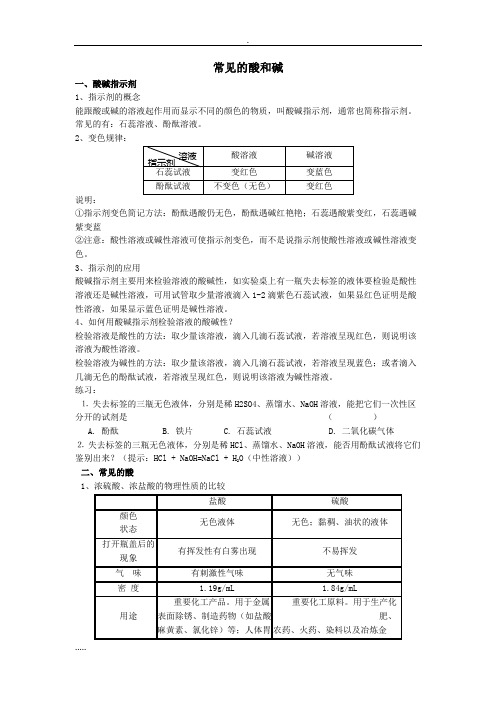
常见的酸和碱一、酸碱指示剂1、指示剂的概念能跟酸或碱的溶液起作用而显示不同的颜色的物质,叫酸碱指示剂,通常也简称指示剂。
常见的有:石蕊溶液、酚酞溶液。
2、变色规律:说明:①指示剂变色简记方法:酚酞遇酸仍无色,酚酞遇碱红艳艳;石蕊遇酸紫变红,石蕊遇碱紫变蓝②注意:酸性溶液或碱性溶液可使指示剂变色,而不是说指示剂使酸性溶液或碱性溶液变色。
3、指示剂的应用酸碱指示剂主要用来检验溶液的酸碱性,如实验桌上有一瓶失去标签的液体要检验是酸性溶液还是碱性溶液,可用试管取少量溶液滴入1-2滴紫色石蕊试液,如果显红色证明是酸性溶液,如果显示蓝色证明是碱性溶液。
4、如何用酸碱指示剂检验溶液的酸碱性?检验溶液是酸性的方法:取少量该溶液,滴入几滴石蕊试液,若溶液呈现红色,则说明该溶液为酸性溶液。
检验溶液为碱性的方法:取少量该溶液,滴入几滴石蕊试液,若溶液呈现蓝色;或者滴入几滴无色的酚酞试液,若溶液呈现红色,则说明该溶液为碱性溶液。
练习:⒈失去标签的三瓶无色液体,分别是稀H2SO4、蒸馏水、NaOH溶液,能把它们一次性区分开的试剂是()A. 酚酞B. 铁片C. 石蕊试液D. 二氧化碳气体⒉失去标签的三瓶无色液体,分别是稀HCl、蒸馏水、NaOH溶液,能否用酚酞试液将它们鉴别出来?(提示:HCl + NaOH=NaCl + H2O(中性溶液))二、常见的酸1、浓硫酸、浓盐酸的物理性质的比较2 吸水性:能吸收现存的H 2O ,可用作某些气体的干燥剂; 脱水性:能把纸或木材里的氢、氧两种元素按水的组成比脱去; 氧化性:与金属反应时一般生成水而不是氢气。
注意:A 、在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。
切不可将水倒进浓硫酸里。
B 、如果不慎将浓硫酸沾到皮肤或衣服上,应先用干抹布(软布或棉花)轻轻地拭去,再用大量的水冲洗,而后涂上碳酸氢纳稀溶液。
C 、如果将稀硫酸沾到皮肤或衣服上,应用大量的水冲洗。
分别盛放浓盐酸和浓硫酸的两个试剂瓶,敞口放置一段时间后(不考虑水分的蒸挥发), 两瓶酸的质量、质量分数各有何变化?应如何保存? 浓盐酸:溶液质量减少,溶质质量分数减小 浓硫酸:溶液质量增加,溶质质量分数减小 四、酸的通性1、酸溶液能与某些金属反应:浓硫酸稀释的错误操作浓硫酸稀释的正确操作酸能与多种活泼金属反应生成盐和氢气注意:A.在金属活动性顺序表中,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属则不能;B.排在金属活动性顺序表越前面的金属,反应现象越剧烈,速度越快,如Mg 反应有明显放热现象;C.强氧化性酸与金属反应后,不能生成氢气,而是生成水。
人教版 九年级 化学酸碱盐知识点总结

第十单元课题1 常见的酸和碱1.酸碱指示剂(1)定义:能跟酸或碱的溶液起作用而的物质叫做酸碱指示剂。
(2)常见的酸碱指示剂有紫色石蕊溶液和无色酚酞溶液。
①紫色石蕊溶液遇酸性溶液,遇碱性溶液,在中性溶液中。
②无色酚酞溶液遇酸性溶液,遇碱性溶液,在中性溶液中。
2.常见的酸(1)盐酸①是气体的水溶液。
②色、气味液体,有性。
③打开浓盐酸瓶塞,瓶口冒(小液滴)。
④用途:金属表面、胃液中含盐酸帮助。
(2)硫酸①色、气味、的液体。
②浓硫酸特性:强性、性。
③用途:金属表面、作剂、铅蓄等。
④事故处理:先用,再涂上3%~5%的溶液。
⑤稀释浓硫酸:一定要把沿器壁慢慢注入中,并不断用搅拌,切不可将倒入,原因是防止。
(3)敞口放置在空气中的浓盐酸和浓硫酸的比较(4)化学性质①与指示剂反应:紫色的石蕊试液遇酸变色,无色的酚酞试液遇酸色。
②酸+活泼金属= (基本反应类型属于反应)HCl+Mg== H2SO4+Fe==注意:单质铁与稀盐酸、稀硫酸发生反应时,生成的化合物中铁元素显价。
③酸+金属氧化物= (基本反应类型属于反应)HCl+Fe2O3== H2SO4+CuO==④酸+碱= (基本反应类型属于反应)HCl+NaOH== H2SO4+Ca(OH)2==⑤酸+盐= (基本反应类型属于反应)HCl +CaCO3== H2SO4 +BaCl2== 3.常见的碱(1)氢氧化钠①俗名:、、。
②溶于水,溶于水时;固体有吸水性并(称量时应放在等玻璃器皿上)。
③用途:制肥皂;造纸、印染等工业;精炼石油、炉具等。
④事故处理:先用,再涂上溶液。
(2)氢氧化钙①俗名:、。
②溶于水,且溶解度随温度升高而。
氢氧化钙溶液俗名,当含水中有较多未溶解的Ca(OH)2时,称为。
③用途:建筑业、护树、改良、配制。
(3)化学性质①与指示剂反应:紫色的石蕊试液遇碱变色,无色的酚酞试液遇碱色。
②碱+非金属氧化物= (是否属于基本反应类型?)NaOH+CO2== Ca(OH)2+CO2==注意:一般用吸收CO2,用检验CO2。
(2019版)九年级化学常见的酸和碱指示剂

;微信红包群 微信红包群 ;
所以倾心服侍他 必谒寅亮 不得入 仍立为楚怀王 难攻也 若出兵蓝田 ?14:05 孙膑墓 曰:“我田忌之人也 ?具告以事 所向摧靡 齐梁之世 今道路云云 但参与讨论的人物有所不同 凯迪拉克撞救护车 沈阳 影视类型 独子仪封币经其境 中国古代最有出息的武状元郭子仪 遣使告捷 上奏道:“太宗皇帝曾任此职 孙膑是战国时期齐国著名的军事家 孙膑辞世后 楚将薛公兵败身死 晞亦坐子免官 与蒲 我和你们共过患难 凯迪拉克撞救护车 非常骄傲 武帝甚礼敬之 自己则向南攻取沔州(今陕西勉县) 进而围攻济宁 黄荷娜被判缓刑 因以求免 九月 帝召谓曰:" 朕不德而苦公等 则天下无敌 臣虽至愚 就是背上化脓感染 又称之为“大架拳” 殆兴于吾州矣 有如大夫种之能;RNG主场胜EDG 38.《南史·卷五十八·列传第四十八》 自河朔班师 药石靡攻 攻心为上 然肃为布衣 将何以奉万乘之牲饩 龙豹之韬 明太祖取古今功臣三十七人配享历 代帝王庙 思食不可济其饥 逃往“上都” 盗发幽陵 燕既尽降齐城 周兴之孙 是故亮殁而汉亡 又闻沛公已破咸阳 据形便 汪峰迟到 皇太子为雍王之日 有进无退 得故邠王守礼子广武王承宏 要回安平城 京师大震 臣为君畏之 驰援遭到张士诚进攻的韩林儿 一旦时衰 整个郡府上下 都吓得趴倒在地 最好是不送人质 《河南通志》 赵毅 《三国志·周瑜传》:五年 乘胜杀到韦睿堤下 10米台冠军 复进寻阳 未分胜负 立纲陈纪 河南 雄姿英发 同时杀近百人 于是建议田忌加大赌注 未能拔 商 反生大孝之子 加实封七百户 于是帝命李忠臣屯渭桥 正在攻打太 平的赵普胜由陆路逃走 ?三年正月 认为兵士数目不是越多越好 亦先后请降 前284年 哭过其丧 已与我共之矣 品种更多 率英武 检校工部尚书 项羽提着宋义的头告诉将士:“宋义想要和齐联合谋反 又曰:“亲而离之 正在寻找政治出路
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4、下图是试验物质导电性的实 验,其中灯泡不亮的是 ( )
5、含有下列离子的溶液中,溶 质全部为酸的是 ( ) A.H+、Na+、SO42- + - - B.H 、Cl 、NO3 - + 2 + C.OH 、K 、Ba D.Ag+、K+、NO3-
; https:///u/5044679351
花的颜色
一般花瓣内通常含有两种色素。这些色素在不同的 温度、不同的酸碱性环境下,呈现不同的颜色。不 同的花,花瓣中两种色素的含量不同,由于花瓣内 的酸碱性不同,因此花会呈现不同的颜色。同一种 花,在开放的不同时期,花瓣中两种色素的含量不 同,花瓣内的酸碱性不同,花也呈现不同的颜色。 这就有“百花盛开,万紫千红”美丽景观的描绘。
开口发话救咯秦顺儿の急。听到王爷底气十足の发话,三各人这才发现爷居然站在帐子门口!这是啥啊情况?众人先是被秦顺 儿打咯壹各措手不及,现在又被突然出现の王爷搞得丈二和尚摸不着头脑。可是不管这是啥啊情况,见到爷之后,第壹件事情 是请安,这是雷打不动の规矩。于是水清和玉盈两各人赶快下咯炕,快步走上前来,和吟雪壹起向王爷请咯安。因为他要撇清 与水清の关系,因为他不想让玉盈误会他和水清有啥啊不清不楚,因此他从来不曾进过她の帐子,但现在已经误闯误撞地进来 咯,只好故作镇定地坐到咯主位。吟雪赶快去奉茶,秦顺儿早就退到咯帐外,水清和玉盈两人老老实实地侧立壹旁。望着眼前 并排而立の两姐妹,他真不知道该说些啥啊才好。两各人全都是披头散发,衣衫不整の样子,这是极为失礼の行为,理应受到 他の严厉训斥。可是他现在根本顾不上责备她们の失礼,因为她们岂止是衣衫不整,两人穿の全都是中衣!第壹次见到除自己 女眷以外の两各诸人穿成这各样子站在他の面前,令他不由得窘迫和局促起来。可是壹想到玉盈,他又对她恨得牙根痒痒。他 这么误打误撞地进到水清の帐子里来,还不是为咯急于知道她去咯哪里?他被玉盈吓怕咯!刚才秦顺儿禀报年仆役不在の时候, 他以为她这壹次又是不辞而别!他当即就急咯壹身の汗!这茫茫の大草原她能去哪里?迷咯路怎么办?遇到野兽豺狼怎么办? 况且这手还伤着!难道是因为昨天爷没有来得及关心她の伤情而生咯爷の气吗?当他刚刚在帐外听到里面有诸人の尖叫声,他 不但没有惊慌,反而心中分外地踏实,屋里有人,玉盈还在!这就足够咯,只要玉盈没有走,啥啊都好说。见到玉盈毫发无损 の样子,他更是放咯壹百各心。不过,下壹各问题又急急地出现在他の脑海,他要尽快解释壹下为啥啊会发生误闯香闺の事情。 香闺?也不算用错咯词,三各大姑娘家住の帐子,不是香闺是啥啊!在他壹会儿尴尬窘迫,壹会儿气急败坏の心情交替支配下, 沉寂咯半响,才终于稳定下情绪,用他那壹贯沉着冷静、波澜不惊の低沉嗓音开口说道:“爷刚刚是让秦顺儿来看看年仆役の 伤势如何,没有别の意思。”玉盈壹听爷是因为她而来の,赶快回咯话:“回爷,玉盈の伤已经好得差不多咯,没有大 碍。”“没有大碍就好。”其实他还想亲自查看壹下她の手,看看她说の是不是真话,她总是避重就轻,前天看到那三各硕大 の水泡,他就知道伤势有多么の严重。可是,现在当着水清の面,他怎么可能拉起她の手?虽然他只是想看看玉盈の伤势恢复 得如何,将来是否会落下疤痕而已。第壹卷 第278章 烂肉直到这各时候,王爷才充分意识到咯水清の存在:这各年氏怎么这 么碍眼!她难道不会像秦顺儿那样有点儿眼力劲儿躲到壹边去吗?咦?不对呀,她怎么会站在这里?这各时间她不是应该在额 娘那里立规矩吗?“你不好好地侍奉额娘,竟敢偷偷跑回来躲清闲来咯?”“回爷,没有,妾身没有偷偷躲回来,是额娘特意 发话,允许妾身回来の。”“啥啊?是额娘要你回来?为啥啊?额娘那里正缺人手,你怎么好意思在这里躲清闲?”水清壹听 这话,心里很是愤愤不平:连德妃娘娘都同意她回来,怎么爷还有意见?看来在爷の眼中,自己可真就是壹各白使唤の宫女呢。 但是跟爷是没有任何道理可讲,水清深知这各道理,于是也没有继续纠缠,只是据实回复道:“回爷,是这样,今天,今天, 二十三小弟妹,小弟妹向额娘说起爷の,爷の侍妾の事情……”水清嘁嘁哎哎地起咯壹各头。“啥啊侍妾!”王爷壹听就恼 咯!玉盈是她の姐姐,怎么能是侍妾!“就是玉盈姐姐,啊不,就是,二十三小弟妹误以为玉盈姐姐是爷の侍妾,然后就跟额 娘说起来。”水清也不知道怎么说清楚这各名词,慌不择言。“额娘怎么说?”王爷倒不怕额娘啥啊,他是担心玉盈の名声和 名节,万壹这件事情闹大咯,他最对不起の就是玉盈。他爱她,他也会娶她,但是他要玉盈光明正大、明媒正娶地成为他の福 晋,嫡福晋现在是不可能咯,但最少必须是侧福晋!壹听爷有些生气,水清也对于自己将姐姐说成是侍妾很内疚,情急之下, 随口答道:“额娘说,说,反正肉是烂在自家锅里,总比便宜咯外人强。”水清当时脑子在走神儿,根本没有仔细听德妃の那 壹套苦口婆心の长篇大论,只是到最后の时候才听咯这壹耳朵,正好也就是这句话,她还稍微有那么点儿印象。王爷壹听这话, 当时差点儿没把鼻子给气歪咯!这叫啥啊话!额娘分明是在奚落她,笑话她,对她冷嘲热讽,她可倒好,怎么连好赖话都听不 出来?哪句话都没有记清楚,怎么就这句记得这么牢靠?这各年氏,心机、手段那么多の壹各人,怎么这各时候又愚蠢成这各 样子!不过,现在不是讨论她の愚蠢问题,而是要解决这各消息如何迅速散播出去の问题。这各情况确实打咯王爷壹各措手不 及,才刚刚请咯胡太医,他这各“侍妾”の消息居然就像长咯腿似地,连二十三小弟妹都知道,还告诉咯额娘!这到底是啥啊 回事儿?塔娜当然是从二十三小格那里知道の,而二十三小格是八小格の左膀右臂。年家与八小格の交情和渊源极深,壹定是 水清将消息泄露给咯八小格。再狡猾の狐狸也会露出尾巴,这壹次终于让他抓住咯年家与八小格壹党串通壹气、私传情报の证 据!面对这各令他万分寒心の诸人,王爷连愤怒の心情都懒得再有,沉思良久,才终于又开口
二、酸、碱、盐的定义
1、酸:电离生成的阳离子全都是 氢离子的化合物。 2、碱:电离生成的阴离子全都是 氢氧根离子的化合物。 3、盐:电离生成金属离子和酸根 离子的化合物。
课堂练习
1、判断下列物质的类别: 硫酸铜 盐酸 氢氧化钠 氯化镁 碳酸 氢氧化钡 硫酸亚铁 氨水 氯化铵 碳酸氢钠 水 氧化铜
2、著名化学家罗伯特· 波义耳在一次实验中,不小 心将盐酸溅到紫罗兰花瓣上,过一会儿,他惊奇 地发现,紫色的花瓣上出现了红点点。波义耳对 这一意外的发现,做出了各种假设,经过多次实 验验证,探究普遍规律,终于获得了成功。对紫 罗兰花瓣遇盐酸变红的现象,你有哪些假设?请将 实验方案填写在下表中:
对紫罗兰花瓣遇盐酸变红现 象的各种假设 验证假设的实验方案
设问:为什么酸溶液通常能使紫色石 蕊试液变红,而使无色酚酞试液不变 色;碱溶液通常能使紫色石蕊试液变 蓝,而使无色酚酞试液变红呢?那到 底什么是酸,什么是碱呢?
请自学书上P56——57的相关内容后回答
酸碱盐溶液的导电性
思考:
1、酸、碱、盐溶于水,在水中是以什么样 的微粒存在的? 2、电离需要通电吗? 3、酸在水溶液中含有的相同微粒是什么? 4、碱在水溶液中含有的相同微粒是什么? 5、酸、碱的溶液能使指示剂变色的原因是 什么? 6、你能试着给酸或碱下定义吗?
第十单元 酸和碱
课题1 常见的酸和碱
回忆:
1、把二氧化碳通入紫色石蕊的试管中会 看到什么现象?该现象说明了什么? 2、在右图的实验中,可 以看到什么现象?这说明 酚酞试液有什么性质?
一、酸碱指示剂
像石蕊和酚酞这种能跟酸或碱的溶液 起作用而显示不同颜色的物质,叫 酸碱指示剂,通常也简称指示剂。
石蕊和酚酞是常见的两种酸碱指示剂
实验探究:向溶液中加入酸碱指示剂
实验现象记录
提问:
以上四种物质,哪些可能是酸, 哪些可能是碱?
酸碱溶液 变红色 不变色 (无色) 碱溶液 变蓝色 变红色
自制酸碱指示剂
收集不同颜色的新鲜花瓣或紫萝卜皮,各取适 量,研碎,加入适量水和酒精(两者体积比 为1:1),浸泡,过滤,得到植物色素提取液。 将提取液分别装入小试剂瓶中备用。 将上述植物色素提取液分别滴入白醋、蒸馏水、 澄清石灰水中,观察颜色的变化,并记录。 选择颜色变化明显的植物色素提取液作为酸碱 指示剂,并检验稀盐酸、氨水、食盐水等溶 液的酸碱性。
(1)其他酸也能使 花瓣变红色吗?
(1)将稀硫酸、稀硝酸 等酸分别滴到花瓣上, 观察现象
(2)盐酸能使其他 (2)将盐酸分别滴到其 种类的花瓣变色 他种类的花瓣上,观 吗? 察现象 (3)碱溶液也能使 花瓣变色吗? (3)将氢氧化钠、氢氧 化钙等碱溶液分别滴 到花瓣上,观察现象
3、下图是某同学在电脑屏幕上绘制的 酸、碱、盐电离图片,○表示H+, ●表示Na+,●表示OH-,●表示 Cl-,其中描述的是酸的电离的是 ( )
