全国高中化学竞赛决赛(冬令营)理论试题及解答3
2000全国高中化学竞赛决赛(冬令营)理论试题及解答

2000年全国高中学生化学竞赛(决赛)理论试题2000.1.11.杭州● 竞赛时间4小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在答卷纸的指定地方(方框内),不得用铅笔填写,写在其他地方的应答一律无效。
使用指定的草稿纸。
不得持有任何其他纸张。
● 把营号写在所有试卷(包括草稿纸)右上角处,不写姓名和所属学校,否则按废卷论。
● 允许使用非编程计算器、直尺、橡皮等文具,但不得带文具盒进入考场。
1.008Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re OsIr Pt Au Hg Tl Pb Bi Po At Ac-LrHLi Be B C N O FNa Mg Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co NiCu Zn G a G e As Se BrRb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn Ïà ¶Ô Ô- ×Ó ÖÊ Á¿第1题 A 的单质和B 的单质在常温下激烈反应,得到化合物X 。
高中化学 第20届全国学竞赛决赛(冬令营)理论试题

中国化学会第20届全国高中学生化学竞赛(决赛)理论试题2007年1月17日● 本竞赛试题共8题,总分120分,竞赛时间4小时。
迟到超过30分钟者不得进入考场,考试开始后1小时内不得离开考场。
解答完毕,将试卷和答卷及草稿纸折好,背面朝上放于桌面,撤离考场。
● 试卷和答卷已分别装订成册,不得拆散,所有解答必须写在答卷的指定位置,写于其他 位置无效.● 选手营号写在答卷每页左边指定位置,不得写所属地区,学校名称和姓名,否则按废卷 论。
● 使用黑色墨水钢笔或圆珠笔答题,不得使用铅笔(包括作图)。
使用提供的草稿纸.不得携带任何其他纸张进入考场。
● 允许使用非编程计算器及直尺,橡皮、涂改液等文具,不得将文具盒以及手机、小灵通、BP 机等通讯工具带入考场,一经发现将严肃处理。
原予量: H 1.008 B 10.81 C 2.01 N 14.01 O 16.00第1题 (14分)钛及其合金具有密度小、强度高、耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门。
我国四川省有大型钒钛磁铁矿。
从由钒钛磁铁矿经“选矿”得到的钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:钛铁铁海面钛l-1 钛铁矿的主要成分为FeTiO 3。
控制电炉熔炼温度(<1500K),用碳还原出铁,而钛则进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集。
已知:FeTiO 3C TiO 2TiC Fe CO FeTiO 3FeTiO3+=++++++C C 43==Fe CO 3Ti ++Fe 3CO①②③G m r J .mol-1===G m r J .mol-1G mr J .mol-1190900-161T 750000--500T 913800519T通过计算判断在电炉熔炼中主要发生以上哪个反应? (3分)1-2 写出在1073—1273K 下氯化反应的化学方程式。
(1分)1-3 氯化得到的TiCl 4中含有的VOCl 3必须用高效精馏的方法除去,为什么? 实际生产中常在409 K 下用Cu 还原VOCl 3,反应物的摩尔比为1:l ,生成氯化亚铜和难溶于TiCl 4的还原物,写出还原反应方程式。
高中化学 竞赛决赛(冬令营)理论试题

促敦市安顿阳光实验学校高中学生化学竞赛决赛(冬令营)理论试题H 1.008 相对原子质量He4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95压力pφ=1bar(巴)=100000Pa(帕斯卡) R=8.314 J·K-1·mol-1第1题(8分)1990年代初发现了碳纳米管,它们是管径仅几纳米的微管,其结构相当于石墨结构层卷曲连接而成。
近年,人们合成了化合物E的纳米管,其结构与碳纳米管十分相似。
气体A与气体B相遇立即生成一种白色的晶体C。
已知在同温同压下,气体A的密度约为气体B的密度的4倍;气体B易溶于水,向其浓水溶液通入CO2可生成白色晶体D;晶体D的热稳性不高,在室温下缓慢分解,放出CO2、水蒸气和B;晶体C在高温下分解生成具有润滑性的白色晶体E1;E1在高温高压下可转变为一种硬度很高的晶体E2。
E1和E2是化合物E的两种不同结晶形态,分别与碳的两种常见同素异形体的晶体结构相似,都是型固体材料;E可与单质氟反,主要产物之一是A。
(1)写出A、B、C、D、E的化学式。
(2)写出A与B反的化学反方程式,按酸碱理论的观点,这是一种什么类型的反?A、B、C各属于哪一类物质?(3)分别说明E1和E2的晶体结构特征、化学键特征和它们的可能用途。
(4)化合物A与C6H5NH2在苯中回流,可生成它们的1︰1加合物;将这种加合物加热到280℃,生成一种环状化合物(其中每摩尔加合物失去2摩尔HF);这种环状化合物是一种非极性物质。
写出它的分子式和结构式。
第2题(8分)太阳能发电和阳光分解水制氮,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面。
下图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带(未充填电子的分子轨道构成的能级最低的能带)与价带(已充填价电子的分子轨道构成的能级最高的能带)之间的能量差ΔE(=E c-E v)称为带隙,图中的e-为电子、h+为空穴。
全国高中学生化学竞赛决赛试题及答

全国高中学生化学竞赛决赛理论试题及答案第一题(6分)选取表1中的合适物质的字母代号(A~H)填人相应标题(①一⑧)后的括号中(单选),并按要求填空。
A B C D E F G HNO2+ NO N2O3N2H4NH3 N2O4H2N2O2NH2OH)不是平面分子,其衍生物用作高能燃料。
②()存在两种异构体,其中一种异构体的结构为。
③()具有线型结构,Lewis结构式中每个键的键级为2.0。
④()是无色的,平面分子,它的一种等电子体是。
⑤()既有酸性,又有碱性,可作制冷剂。
⑥()既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做剂。
⑦()是顺磁性分子。
⑧()水溶液会分解生成N20,反应式为。
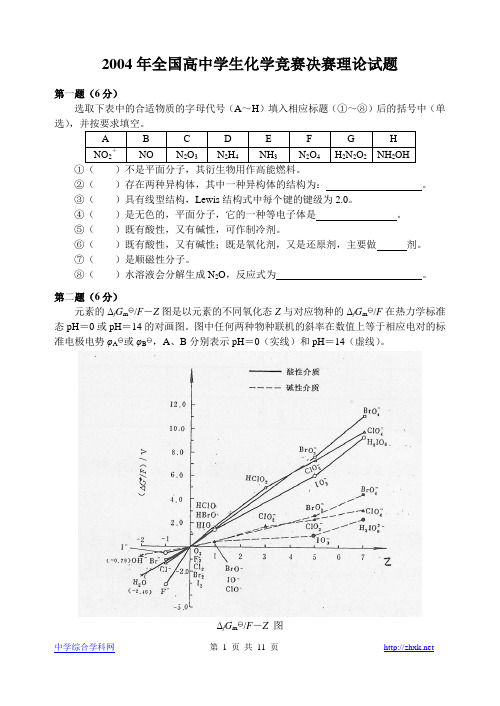
第二题(6分)图1是元素的△f G m/F一Z图,它是以元素的不同氧化态Z与对应物种的△f G m/F 在热力学标准态pH =0或pH == 14的对画图。
图中任何两种物种联线的斜率在数值上等于相应电对的标准电极电势ψA或ψB,A、B分别表示pH=0(实线)和pH=14(虚线)。
上图中各物种的△f G m/F的数值如表2所示。
表2 各物质的△f G m/FA X- X2HXO HXO2 XO3- XO4-F -3.06 0 / / / /Cl -1.36 0 1.61 4.91 7.32 9.79Br -1.06 0 1.60 / 7.60 11.12I -0.54 0 1.45 / 5.97 9.27B X-X2XO- XO2- XO3-XO4-F -3.06 0 / / / /Cl -1.36 0 0.40 1.72 2.38 3.18Br -1.06 0 0.45 / 2.61 4.47I -0.54 0 0.45 / 1.01 2.41⒈用上表提供的数据计算:ψA(IO3-/I-) ψB(IO3-/I-) ψA(ClO4-/HClO2)⒉由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于还是小于其含氧酸盐的氧化性。
2021年全国高中化学竞赛决赛冬令营理论试题及答案

中华人民共和国化学会第20届全国高中学生化学竞赛(决赛)理论试题1月17日● 本竞赛试题共8题,总分120分,竞赛时间4小时。
迟到超过30分钟者不得进入考场,考试开始后1小时内不得离开考场。
解答完毕,将试卷和答卷及草稿纸折好,背面朝上放于桌面,撤离考场。
● 试卷和答卷已分别装订成册,不得拆散,所有解答必要写在答卷指定位置,写于其她位置无效.● 选手营号写在答卷每页左边指定位置,不得写所属地区,学校名称和姓名,否则按废卷论。
● 使用黑色墨水钢笔或圆珠笔答题,不得使用铅笔(涉及作图)。
使用提供草稿纸.不得携带任何其她纸张进入考场。
● 容许使用非编程计算器及直尺,橡皮、涂改液等文具,不得将文具盒以及手机、小灵通、BP机等通讯工具带入考场,一经发现将严肃解决。
原予量:H 1.008 B 10.81 C 2.01 N 14.01 O 16.00第1题(14分)钛及其合金具备密度小、强度高、耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门。
国内四川省有大型钒钛磁铁矿。
从由钒钛磁铁矿经“选矿”得到钛铁矿提取金属钛(海绵钛)重要工艺过程如下:钛铁铁海面钛l-1 钛铁矿重要成分为FeTiO 3。
控制电炉熔炼温度(<1500K),用碳还原出铁,而钛则进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集。
已知:FeTiO 3C TiO 2TiC Fe CO FeTiO 3FeTiO 3+=++++++CC 43==Fe CO 3Ti ++Fe 3CO①②③G m r J .mol -1===G m r J .mol-1G mr J .mol-1190900-161T 750000--500T 913800519T通过计算判断在电炉熔炼中重要发生以上哪个反映? (3分) 1-2 写出在1073—1273K 下氯化反映化学方程式。
(1分) 1-3 氯化得到TiCl 4中具有VOCl 3必要用高效精馏办法除去,为什么?实际生产中常在409 K 下用Cu 还原VOCl 3,反映物摩尔比为1:l ,生成氯化亚铜和难溶于TiCl 4还原物,写出还原反映方程式。
第24届全国高中化学竞赛决赛(冬令营)理论试题及答案(2011.1.7厦门)

w ww .z x x k.c o mw w w .z xx k .c o mw w w .z xx k .c o m2.00 ppm P 0.410w ww .z xx k .co mw ww .z x x k.c o mw w w .z xx k .c o mw ww .z x x k.c o mw w w .z xx k .c o mw ww .z x x k.c o mw w w .z xx k .c o mw ww .z xx k .c o m第24届全国高中学生化学竞赛理论答案更正及评分标准补充2011年1月7日 厦门1-1用共振论写出几个共振式共振的表达形式和用虚线表示不达一个键级的π键的表达形式的画法,只要正确,可以得满分 1-4碱的提供者为NaOH 或Ca(OH)2等强碱的均不得分。
2-1可以将C、H 等元素的个数写在一起表示,但必须将内界与外界分别写出。
若分别写出,可得满分;若没有分别写出,得1分。
4-5-2答出任何简单点阵均可得满分,如四方简单、立方简单等。
注:实际上,这样的晶体为正交简单点阵。
6-3若写成该结构的对映体,不对称碳原子数回答正确,且手性碳的构型均与所写结构对应正确(全为R)该问总共得2分。
6-47a、7b 结构写成其中的羟基氧或羰基氧向BF 3的形式并书写正确(若标出形式电荷则应形式电荷的位置和数量同时表明正确)亦可以得满分。
w ww .z xx k .co mw ww .z x x k.c o mw w w .z xx k .c o mw ww .z x x k.c o mw w w .z xx k .c o mw ww .z x x k.c o mw w w .z xx k .c o mw ww .z x x k.c o mw w w .z xx k .c o mw ww .z x x k.c o mw w w .z xx k .c o mw ww .z x x k.c o mw w w .z xx k .c o mw ww .z x x k.c o mw w w .z xx k .c o mw ww .z x x k.c o mw w w .z xx k .c o mw ww .z x x k.c o mw w w .z xx k .c o m。
第20届全国高中化学竞赛决赛(冬令营)理论试题及答案.pdf

变色为终点,消耗 HCI 标准溶液 22.78mL。
步骤二:称取纯的有机弱酸(H2B)样品 0.1963g。将样品定量溶解在 50.00mL 纯水中,选择
甲基橙为指示剂进行滴定。当加入新标定的 0.0950mol/L 氢氧化钠标准溶液 9.21mL 时,发
现该法不当,遂停止滴定,用酸度计测定了停止滴定时溶液的 pH=2.87。已知 H2B 的 pKal=2.86,
构式。
(3 分)
第 3 题(10 分)
无机高分子絮凝刑具有效能高、价格低廉的优点,广泛用于给水排水、工业废水及城市污水
处理。
3-1 大多数金属离子都能生成多核水解产物。铁盐溶于水后生成水合铁(Ⅲ)离子,当溶液 pH
升高时发生水解,首先生成黄色的水解产物[FeOH(H2O5)]2+,写出水解反应方程式。 (1 分)
(2 分)
1-4 精制后的 TiCl4 用金属镁还原可得海绵钛,写出化学反应方程式。
(1 分)
1-5 菱镁矿(主要成分为 MgCO3)煅烧分解后与焦炭混合在氯化器中加热到 1373 K,通入氯
气生成 MgCl2。在 1023 K 电解熔融 MgCl2 得到金属镁。
(1)写出用菱镁矿煅烧及氯化制取 MgCl2 的化学反应方程式。
(2) 写出 B 中氨基酸的结构式式并命名。
(3) 写出 C 中糖分子的费歇尔投影式,并给出该糖的名称。
O OO
HO
HO
OH
C
OH
(2 分) (2 分) (2 分)
第 8 题(15 分) 8-1 化合物 A(C10H12O3)具有旋光性,能溶于 NaHCO3 水溶液,并可起碘仿反应。将 A 加热
的化合物 B,B 无旋光性,也能溶于 NaHCO3 水溶液。B 经臭氧化,并在 Zn 粉和醋酸存在下 分解得化合物 C 和 D,C 可进行碘仿反应。D 加强热放出 CO2,并得化合物 E(C7H6O),E 可进行银镜反应,试写出 A、B、C、D、E 的结构式。(10 分)
商业赠送:2003年全国高中学生化学竞赛决赛(冬令营)试题及答案(全国化学竞赛预赛模拟试卷-2003-9)
2004年全国高中学生化学竞赛决赛理论试题第一题(6分)选取下表中的合适物质的字母代号(A~H)填入相应标题(①~⑧)后的括号中(单选)①()不是平面分子,其衍生物用作高能燃料。
②()存在两种异构体,其中一种异构体的结构为:。
③()具有线型结构,Lewis结构式中每个键的键级为2.0。
④()是无色的,平面分子,它的一种等电子体是。
⑤()既有酸性,又有碱性,可作制冷剂。
⑥()既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做剂。
⑦()是顺磁性分子。
⑧()水溶液会分解生成N2O,反应式为。
第二题(6分)元素的Δf G m /F-Z图是以元素的不同氧化态Z与对应物种的Δf G m /F在热力学标准态pH=0或pH=14的对画图。
图中任何两种物种联机的斜率在数值上等于相应电对的标准电极电势φA 或φB ,A、B分别表示pH=0(实线)和pH=14(虚线)。
Δf G m /F-Z图1.用上表提供的数据计算:φA (IO3-/I-) φB (IO3-/I-) φA (ClO4-/HClO2)2.由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于还是小于其含氧酸盐的氧化性。
3.溴在自然界中主要存在于海水中,每吨海水约含0.14kg溴。
Br2的沸点为58.78℃;溴在水中的溶解度3.58g/100gH2O(20℃)。
利用本题的信息说明如何从海水中提取Br2,写出相应的化学方程式,并用方框图表达流程。
第三题(6分)过氧乙酸是一种广谱消毒剂,可用过氧化氢与乙酸反应制取,调节乙酸和过氧化氢的浓度可得到不同浓度的过氧乙酸。
过氧乙酸含量的分析方法如下:准确称取0.5027g过氧乙酸试样,置于预先盛有40mL H2O、5mL 3mol/L H2SO4溶液和2~3滴1mol/L MnSO4溶液并已冷却至5℃的碘量瓶中,摇匀,用0.02366mol/L KMnO4标准溶液滴定至溶液呈浅粉色(30s不退色),消耗了12.49mL;随即加入10mL 20% KI 溶液和2~3滴(NH4)2MoO4溶液(起催化作用并减轻溶液的颜色),轻轻摇匀,加塞,在暗处放置5~10min,用0.1018mol/L Na2S2O3标准溶液滴定,接近终点时加入3mL 0.5%淀粉指示剂,继续滴定至蓝色消失,并保持30s不重新显色,为终点,消耗了Na2S2O3 23.61mL。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 1 页 共 7 页 第 1 页 共 7 页 全国高中学生化学竞赛(决赛)理论试题 竞赛时间4小时。迟到超过30分钟者不能进考场。开始考试后1小时内不得离场。时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。 试卷装订成册,不得拆散。所有解答必须写在答卷纸的指定地方(方框内),不得用铅笔填写,写在其他地方的应答一律无效。使用指定的草稿纸。不得持有任何其他纸张。 把营号写在所有试卷(包括草稿纸)右上角处,不写姓名和所属学校,否则按废卷论。 允许使用非编程计算器、直尺、橡皮等文具,但不得带文具盒进入考场。
1.008
Zr NbMo Tc RuRhPdAgCdInSnSbTe I Hf TaW Re OsIrPt AuHgTl PbBiPoAtAc-LrHLiBeBCNOFNaMgAlSiPClSKCaScTiVCrMnFeCoNiCuZnGaGeAsSeBrRbCsFrSrBaRaYLaLu
-
6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.454.00320.1839.9583.80131.3[222]
HeNeArKrXeRn
Ïà ¶Ô Ô- ×Ó ÖÊ Á¿
第1题 A的单质和B的单质在常温下激烈反应,得到化合物X。X的蒸气密度是同温度下的空气密度的5.9倍。X遇过量水激烈反应,反应完全后的混合物加热蒸干,得一难溶物,后者在空气中经1000oC以上高温灼烧,得到化合物Y。Y在高温高压下的一种晶体的晶胞可与金刚石晶胞类比,A原子的位置相当于碳原子在金刚石晶胞中的位置,但Y晶胞中A原子并不直接相连,而是通过E原子相连。X与过量氨反应完全后得到含A的化合物Z。Z经高温灼烧得化合物G。G是一种新型固体材料。 1-1 写出X的化学式。1-2 写出Y的化学式。1-3 写出Z的化学式。 1-4 写出G的化学式。1-5 你预计G有什么用途?用一两句话说明理由。
第2题 已知:原电池H2(g)| NaOH(aq) | HgO(s),Hg(l) 在298.15K下的标准电动势E=0.926V 反应H2(g) + 1/2 O2(g) = H2O(l) rGm(298K) = –237.2kJ·mol–1
物 质 Hg(l) HgO(s) O2(g) Sm(298K)/J·mol–1·K–1 77.1 73.2 205.0
2-1写出上述原电池的电池反应与电极反应(半反应)。 2-2计算反应HgO(s)=Hg(l) + ½ O2(g) 在298.15K下的平衡分压p(O2)和rHm(298.15K)。 2-3设反应的焓变与熵变不随温度而变,求HgO固体在空气中的分解温度。 第3题 超氧化物歧化酶SOD(本题用E为代号)是生命体中的“清道夫”,在它的催化作用下生命体代谢过程产生的超氧离子才不致过多积存而毒害细胞:
O2-2+ 2H+O2+H2O2
E
今在SOD的浓度为co(E) = 0.400X10-6 mol·L–1,pH=9.1的缓冲溶液中进行动力学研究,在常温下测得不同超氧离子的初始浓度co(O2–)下超氧化物歧化反应的初始反应速率ro如下:
co(O2–)/mol·L–1 7.69 X 10–6 3.33 X 10–5 2.00 X 10–4 第 2 页 共 7 页 第 2 页 共 7 页 ro/mol·L–1·s–1 3.85 X 10–3 1.67 X 10–2 0.100 3-1 依据测定数据确定歧化反应在常温下的速率方程r = k c(O2–)n的反应级数。 3-2 计算歧化反应的速率常数k。要求计算过程。 3-3 在确定了上述反应的级数的基础上,有人提出了歧化反应的机理如下:
E+ O2-k1E-+O
2
E-+O2-E+ O
2
2-k2
其中E–为中间物,可视为自由基;过氧离子的质子化是速率极快的反应,可以不予讨论。试由上述反应机理推导出实验得到的速率方程,请明确指出推导过程所作的假设。 3-4 设k2 = 2k1,计算k1和k2。要求计算过程。
第4题 铂的配合物{Pt(CH3NH2)(NH3)[CH2(COO)2]}是一种抗癌新药,药效高而毒副作用小,其合成路线如下:
K2PtCl4 I A(棕色溶液) II B(黄色晶体) III C(红棕色固体) IV
D(金黄色晶体) V E(淡黄色晶体) (I)加入过量KI,反应温度70oC;(II)加入CH3NH2;A与CH3NH2的反应摩尔比=1:2;(III)加入HClO4和乙醇;红外光谱显示C中有两种不同振动频率的Pt—I键,而且C分子呈中心对称,经测定,C的相对分子质量为B的1.88倍;(IV)加入适量的氨水得到极性化合物D;(V)加入Ag2CO3和丙二酸,滤液经减压蒸馏得到E。在整个合成过程中铂的配位数不变。铂原子的杂化轨道类型为dsp2。 4-1 画出A、B、C、D、E的结构式。 4-2 从目标产物E的化学式可见,其中并不含碘,请问:将K2PtCl4转化为A的目的何在? 4-3 合成路线的最后一步加入Ag2CO3起到什么作用?
第5题 业已发现许多含金的化合物可以治疗风湿症等疾病,引起科学家广泛兴趣。在吡啶(N)的衍生物2,2'-联吡啶(代号A)中加入冰醋酸与30% H2O2的混合溶液,反应完成后加入数倍体积的丙酮,析出白色针状晶体B(分子式C10H8N2O2)。B的红外光谱显示它有一种A没有的化学键。B分成两份,一份与HAuCl4在温热的甲醇中反应得到深黄色沉淀C。另一份在热水中与NaAuCl4反应,得到亮黄色粉末D。用银量法测得C不含游离氯而D含游离氯7.18%。C的紫外光谱在211nm处有吸收峰,与B的213nm特征吸收峰相近,而D则没有这一吸收。C和D中金的配位数都是4。 5-1 画出A、B、C、D的结构式。 5-2 在制备B的过程中加入丙酮起什么作用? 5-3 给出用游离氯测定值得出D的化学式的推理和计算的过程。
第6题 目标产物C(分子式C11H12O2)可通过如下合成路线合成:
+OO
IAIIhnBIII
SmI2
C 第 3 页 共 7 页 第 3 页 共 7 页 该合成路线涉及3个著名有机反应,分别举例介绍如下: 反应I是Diels-Alder反应:共轭双烯与烯烃或炔烃共热生成环已烯的衍生物,例如:
+ 反应II是[2+2]环加成反应:在光照下两分子烯烃可双聚成环丁烷衍生物,举例如下;若分子内适当位置有2个C=C键,也有可能发生分子内的[2+2]环加成反应,
+hn
+COOCH3
hn
COOCH3
反应III是酮还原偶联反应,在二碘化钐等还原剂作用下两分子酮被还原并偶联生成相邻的二醇,例如:
O+OSmI2
OHOH
6-1 画出A、B、C的结构式,请尽可能清楚地表达出它们的立体结构。 6-2 上述合成反应体现了哪些绿色化学的特征?
第7题 环丙沙星(G)是一种新型的广谱抗菌药物,其工艺合成路线如下: FClClAlCl
3
CH3COClC8H5Cl2FONaHC2H5OCOC2H5
O
C11H9Cl2FO3
FClClOCOOC2H5
OC2H5
HC(OC2H5)3NaOC2H5NH
2C15H14Cl2FNO3
NaOHC15H13ClFNO3C13H9ClFNO
3
H3ONHHN
NHN
COOHONF
ABDEF
CG 7-1 画出A、B、D、E、F的结构式。 7-2 为何由A转化为B需使用强碱NaH而由B转化为C的反应使用NaOC2H5即可? 7-3 由C转化为D是一步反应还是两步反应?简要说明之。 第 4 页 共 7 页 第 4 页 共 7 页 2000全国高中学生化学竞赛(决赛)理论竞赛试题参考答案及评分标准
第1题 1-1 X——SiCl4 (5分) 1-2 Y——SiO2 (3分) 1-3 Z——Si(NH2)4 (2分) 1-4 G——Si3N4 (2分) 1-5 耐磨材料 (1分) 耐高温材料 (1分) Si3N4是原子晶体,其中Si—N键的键能高,键长短,因此该晶体的熔点高,硬度大。 (1分) 第2题 2-1 电极反应 (–) H2(g) + 2OH- = 2H2O(l) + 2e (0.5分) 电极反应 (+) HgO(s) + H2O + 2e = OH– + Hg(l) (0.5分) 电池反应 H2(g) + HgO(s) = H2O(l) + Hg(l) (1分) 2-2 rGm = nFE = –2 X96500 C·mol–1X0.926 V = –178.7 X103 J·mol–1 (1分) H2(g) + 1/2 O2(g) = H2O(l) rGm(2) = –237.2 kJ/moL H2(g) + HgO(s) = H2O(l) + Hg(l) rGm(1) = –178.7 kJ/mol HgO(s) = Hg(l) + 1/2 O2(g) rGm(3)=rGm(1)–rGm(2)= +58.46kJ/mol(1分) lnKp= –(G/RT) = –(58.46X103J/mol)/[(8.314J/mol·K)X(298.15K)] = –23.60 Kp = 5.632X10–11 (1分) Kp = [p(O2)/p]1/2 p(O2) = (Kp)2Xp =3.17X10–21X101.3kPa (2分) H = G + TS = 58.46X103kJ/mol + 298.15KX106.7Jmol-1K–1 = +90.28 kJ/mol (2分) 不计算Kp直接得出氧的分压p(O2)得分相同。 2-3 HgO(s) 稳定存在, p(O2) ≤ 0.21X101.3kPa. ln(K2/K1)= ln(p21/2/p11/2)=1/2ln(p2/p1)=H/R(1/T1–1/T2) 1/T2=1/T1–{[Rln(p2/p1)]/2H}=1/298.15K –[8.314Jmol–1K-1ln(0.21/3.17X10–21)]/2X90278Jmol-1 = 0.00125K-1 T2 = 797.6 K (3分) 其他计算方法得分相同。 算式答对,数据计算错误,给一半分。计算错误不作二次惩罚。答案中有效数字错误扣0.5分。 第3题 3-1.首先根据题给r和c(O2)的数据确定反应级数和速率常数k r1/r2 = {c1(O2–)/c2(O2–)}n ; 3.85X10–3/1.67X10–2 = (7.69X10–6/3.33X10-5)n; n=1 r2/r3 = {c2(O2–)/c3(O2–)}n ; 1.67X10–2/0.100 = (3.33X10–5/2.000X10-4)n; n=1 ∴ r = kc(O2–) ∴r=k[O-2], 即 k=r1/[O-2]1=3.85×10-5/7.69×10-6 = 501 s-1 k=r2/[O-2]2=1.67×10-2/3.33×10-5 = 502 s-1 k=r3/[O-2]3=0.1/2.00×10-4 = 500 s-1 平均k = 501 s-1 3-2.
