14烷烃及环烷烃课件
有机化学-烷烃和环烷烃

成键的电子云并不沿轴向重叠,而是形成一种弯曲键。 造成重叠程度小, 键能下降,产生角张力。
开链或较大脂环化合物 中轨道可达到最大重叠
Banana bond
环丙烷分子中 轨道部分重叠
H
H
C
105.5°
H
60°
H
C
C
CH2
亚甲基
CH
次甲基
系统命名法
关键是如何确定主链和处理取代基的位置
分三步:一选主链、二编号、三写全称。 1.选主链(母体):选取代基最多的最长碳链 2.编号: 从靠近取代基一端开始 3.写全称:按先小后大,把取代基的位次、数
目及名称列在母体前。
在英文命名中,取代基按词首的字母排列顺序先后列出
烷烃系统命名法的要点:
张力学说:
1885年,Baeyer AV 假定,环烷烃具有平面正多边形的结构 :
60° 90° 108° 120°
128.6 135°
• 环上C-C之间的键角偏离正常键角109°28′,
•环丙烷每个键必须向内偏转24.75°,就会产生角张力。
•环丁烷、环己烷分别向内偏转9.75°, 0.75°。
•环己烷每个键向外偏转5.25°。
第二节、烷烃的命名
(一)普通命名法 (二)系统命名法(IUPAC法)
(一)普通命名法
• 1~10以内的碳原子数用天干字表示:
甲、乙、丙、丁、戊、己、庚、辛、 壬、癸。从十一个碳原子开始用中文数
字表示。
• 直链的烷烃称“正某烷”,“正”(n-)一般 略去。如:
CH3CH2CH3
丙烷
CH3(CH2)10CH3 十二烷
有机化学第章烷烃和环烷烃

脂环烃:碳原子之间相互连成环,其性质类似链烃 的碳氢化合物。
脂环烃
饱和脂环烃,又称环烷烃,通式:CnH2n
不饱和脂环烃
环烯烃 环炔烃
单环脂环烃:分子中只有1个碳环。 环丙烷
环丁烷
分子中含有两个或两个以上碳环结构的脂环烃称为双环或 多环脂环烃。
两个碳环共用一个碳原子的脂环烃,称为螺环烃(spiro hydrocarbon)。“螺”字表示两个碳环只共用一个碳原子,此 碳原子称为螺原子。
Alkyl group names are obtained by removing the –ane from the alkane name , and replacing it with -yl
中文名 英文名 中文名 英文名 甲烷 methane 甲基 methyl 乙烷 ethane 乙基 ethyl 丙烷 propane 丙基 propyl 丁烷 butane 丁基 butyl
2. 编号:从第一桥头(共用碳原子)开始,沿最长桥路到第二桥 头,再沿次长桥路回到第二桥头,然后编最短的桥路。(先编大 桥,再编小桥)。取代基的位置最小。
3.命名: 某基二环[n.m.p]某烷。 n.m.p---指各桥路上碳原子数。
2 1
3
7
4
6
5
8 6
4 5
7 1
2
3
1-甲基二环[4.1.0]庚烷
Homolog
同系物: 同系列中各化合物互称同系物。
同系列差:相邻两个同系物在组成上的不变差数 CH2。
烷烃中的伯、仲、叔、季碳原子。
伯碳原子:只与1个碳原子直接相连的碳原子。 (primary) 也称一级碳原子,以1° 表示。 仲碳原子:只与2 个碳原子直接相连的碳原子。 (secondary) 也称二级碳原子,以2 ° 表示。 叔碳原子:只与3 个碳原子直接相连的碳原子。 (tertiary) 也称三级碳原子,以3 ° 表示。 季碳原子:与4个 碳原子直接相连的碳原子。 (quaternary) 是四级碳原子,以4 ° 表示。
有机化学课件第-二-章烷烃和环烷烃_图文

烷烃熔点的特点 (1) 随相对分子质量增大
而增大。 (2) 偶数碳烷烃比奇数碳
烷烃的熔点升高值 大 (如右图)。 (3)相对分子质量相同的烷 烃,叉链增多,熔点 下降。
偶数碳 奇数碳
(二) 沸点
沸点大小取决于分子间的作用力
烷烃沸点的特点
(1)沸点一般很低。 (非极性,只有色散力)
H2O2 + Fe2+
RCOO-
-e-
电解
HO• + HO- + Fe3+ RCOO •
自由基的稳定性
均裂 H=359.8kJ/mol (88kcal/mol) 共价键均裂时所需的能量称为键解离能。 键解离能越小,形成的自由基越稳定。
苯甲基自由基
稀丙基自由基 三级丁基自由基 异丙基自由基
乙基自由基 甲基自由基 苯基自由基
Hammond假设:过渡态总是与能量相近 的分子的结构相近似。
甲烷氯代反应势能图
甲烷氯代反应势能图的分析
1、第一步反应的活化能比较大,是速控步骤。 2、第二步反应利于平衡的移动。 3、反应 1 吸热,反应 2 放热,总反应放热,所以反应 只需开始时供热。 4、过渡态的结构与中间体(中间体是自由基)相似, 所以过渡态的稳定性顺序与自由基稳定性顺序一致。 推论:3oH最易被取代,2oH次之,1oH最难被取代。
甲烷氯代反应的适用范围
1、 该反应只适宜工业生产而不适宜实验室制备。 2 、该反应可以用来制备一氯甲烷或四氯化碳,不适 宜制备二氯甲烷和三氯甲烷。 3、无取代基的环烷烃的一氯代反应也可以用相应方法 制备,C(CH3)4的一氯代反应也能用此方法制备。
(2) 甲烷卤代反应活性的比较
第二章 烷烃和环烷烃
C H3C H2C H2 C H3C H2C H2C H2 C H3C HC H 2 C H3
(正)丁基 Bu 异丁基 i -Bu
C H3C HC H C H3 仲丁基 2 s-Bu C H3 C H3 C C H3 叔丁基 t-Bu
在生理状况下,机体自由基一方面不断产 生,另一方面又不断清除,活性氧处于产生与清 除平衡状态。一旦活性氧的产生和清除失去平衡 ,过多的自由基就会造成对机体的损害,从而引 起多种疾病,并可诱发癌症和导致衰老。 天然抗氧化酶系统:超氧化物歧化酶(SOD) 、 过 氧 化 氢 酶 ( CAT)、 谷 胱 甘 肽 过 氧 化 物 酶 (GSH-Px)
构象异构
(一) 烷烃的构造异构(constitutional isomerism)
戊烷有3种碳链异构体
CH3 CH3CH2CH2CH2CH3 CH3CHCH2CH3
正戊烷 异戊烷
CH3 CH3-C-CH3 CH3
新戊烷
碳原子数 异构体数 4 5 6 7 2 3 5 9
碳原子数 8 9 10 20
异构体数 18 35 75 366 319
天然抗氧剂(自由基清除剂):VE、 Vc、 2巯基乙胺、谷胱甘肽、辅酶Qn(泛醌)、-硫辛酸 等
第二节 环 烷 烃
一、脂环烃的分类和命名
(一) 分类 C3-C4
根 据 环 数 多 少 分
小环 普通环
单脂环烃
C5-C6
C7-C12
中环
C13以上 大环 多脂环烃 桥环 螺环
(二) 命名
1. 单脂环烃: 在相应的烃名前加“环”字;英文名加词头cyclo
《烷烃和环烷烃》课件
第二章 烷烃和环烷烃
8
例1 CH3-CH2 5
32 1
CH2-CH-CH2 -CH-CH2-CH3
CH2
CH3
CH3
3-甲基-5-乙基辛烷
取读 代作 基: 位位 次
连基 母
字名 体
符
名
例2 CH3-CH2-CH—CH-CH2-CH3 CH3-CH CH-CH3 CH3 CH3
2,5-二甲基-3,4-二乙基己烷 2,5-甲基-3,4二乙基己烷 2,5-2甲基 3,4-2乙基己烷
8 7 65 43 2 1
CH3
2024/8/14
22
第二章 烷烃和环烷烃
2、确定取代基小结
(给主链编号)
(1)近取代基端编号;
CH3
CH2CH3
(2)若两个不同取代 基位于相同位次时, 按次序规则使小取代
CH3CH2CHCH 2CHCHCH 2CH2CH3 CH2CH2CH3
CH3 CH3
基编号较小(不考虑 下一个取代基);
12
456
例3 6CH3-5CCHH-3CH2—3CCHH—2CCHH—3 1CH3
CH3 CH3
2,5-二甲基-3-异丙基己烷 2,5-二甲基-4-异丙基己烷
上页 下页 首页
第二章 烷烃和环烷烃
①
CH3 CH3
C7 H3C6 H25CH4CH3CHC2 HC1H 3 CH2 CH3
③
CH2 CH3
正戊烷
(CH3)2CHCH2CH3 (CH3)2C(CH3)2
异戊烷 新戊烷
第二章 烷烃和环烷烃
碳链异构的特点:
随着分子中碳原子数目增加,异构 体数目急剧增加。
例: C6H14 异构体数目 5个
第二章 烷烃和环烷烃
甲基
CH3CHCH3
乙基
正丙基
CH3CHCH2 CH3
正丁基 CH3
CH3C CH3
CH3 CH3C CH2 CH3
CH3CH2CHCH3
异丙基
仲丁) 主链的选择:选择一个最长的连续碳链为主链(stem chain),按 其所含碳原子数称为某烷,并以此作为母体。当分子中有几个等长 碳链可选择时,应选择含取代基较多的碳链为主链。
H H C H H H H C H H C H H H H C H H C H H C H H
烷烃的来源
•石油(petroleum) •煤(coal)
甲烷
乙烷
丙烷
•天然气(natural gas):甲烷(90%~95%)+乙烷(5%~10%)+其它低沸点烷烃
boling point (oC) < 30 30-200 200-300 300-400 >400 carbon atoms C1-C4 C4-C12 C12-C15 C15-C25 >C25 products Natural gas, methane, propane, butane, liquefied petroleum gas Petroleum ether, ligroin, naphtha, straight-run gasoline Kerosene, heater oil Gas oil, diesel fuel, lubricating oil, waxes, asphalt Residual oil, paraffin waxes, tar
CH3CH2CH2CH3
隔绝空气 CH4 + CH3CH3 + CH3CH2CH3 600oC + CH2 CHCH3 + CH2 CH2 等
2.烷烃和环烷烃

③ 写出少二个碳原子的直链式为主链
CH3 H3C C CH3
CH3
新戊烷
第一节 分类、构造异构和碳原子的级
烃:仅由C、H两种元素组成的化合物。
烷烃 脂肪烃 烯烃 烃 脂环烃 炔烃
芳香烃
(2)单环烷烃的构造异构 环的大小和环上取代基的不同而引起的异构; 与单烯烃互为异构。
C4H8
H2C C CH3 CH3
e
四、环己烷的构象
1、椅式、船式和扭船式构象 角偏差(α) = (109.5o-120o) / 2=-5.25o 较大。
通过环内C-Cσ键旋转,调整其内角接近109.5o, 使完全无角张力——椅式和船式构象。
(1)椅式构象
H
H
H
5
H
6
H
1
H
4
3H
H
H
2
H
H
① 无角张力。
② C1、C3、C5上或C2、C4、C6上处于竖直向上或 向下的三个氢原子间距离为2.3Å,约等于氢原子范 德华半径之和(2.5Å)——无范德华排斥力(跨环张力)。
把支链作为取代基。
1、常见的烷基: 相应的烷烃去掉一个氢原子后留下的原子团。
通式:CnH2n+1
常以 R- 表示
甲基(Me)—— CH3乙基(Et) —— C2H5-
异丙基(i-Pr)—— H3C CH
CH3
正丁基(n-Bu)—— CH3CH2CH2CH2-
异丁基(i-Bu)—— H3C CH CH2
一、烷烃的结构
结构
C:sp3 Csp3-Hs Csp3-Csp3 σ键
1、σ键:轴向重叠形成的共价键(头碰头), 呈圆柱形轴对称。
2、σ键特性 ① 原子轨道轴向重叠(重叠程度大,键较牢固)。 ② 成键轨道呈轴对称,可“自由旋转”。
烷烃和环烷烃

10 只与一个碳原子相连 20 与两个碳原子相连 30 与三个碳原子相连 40 与四个碳原子相连
2o 1o
CH3 CH3 3o 2o 2o 1o H3C C4o CH2CHCH2CH2CH3 H3C C3o CH3 CH3 CH3
CH3CH2CH CH3
CH3CH2CH2CH2
叔丁基 tert-butyl
第四章 烷烃和环烷烃
重点讲解内容 一、烷烃的结构 二、烷烃的命名 三、烷烃的物理性质 四、烷烃的化学性质 五、烷烃的构象异构
烃(hydrocarbon):仅由碳和氢两种元素组
成的有机化合物。
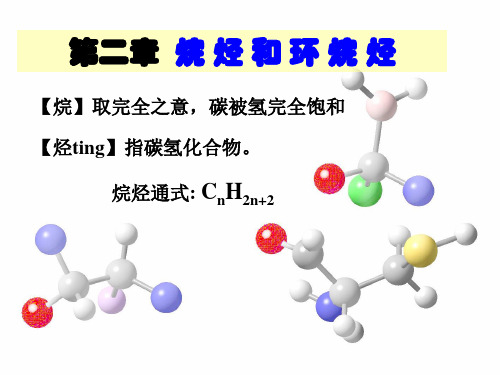
烷烃(alkane):烃分子中的碳原子彼此以C-C
单键连接,碳的其余键都与氢原子相连。
最简单的烷烃为甲烷:Molecular formula CH4
CH3
CH3CH2CH CHCH CHCH3 2,3,5- 三甲基-4-丙基庚烷 CH3 CH2 CH3 CH2CH3
(B)主链的编号(最近、最小、小小)
原则:从最靠近支链的一端开始编号,用 1 , 2 , 3……表示,即取代基位次最小。有几个取代基 时,取代基位次的和最小。和相同时,小的取 代基位次小为宜。
另外,若要画出三维结构,可用下述方法表示:
F Cl C Br H
表示该键指向纸面的背后 表示该键指向纸面的前面
二、构造异构和命名 (一)碳链异构
烷烃同系列中,甲、乙、丙无同分异构,丁烷有: CH3CH2CH2CH3 C4H10 b.p. -0.5℃ CH3CHCH3 C4H10 b.p. -10.2℃
重叠式的能量比交叉式高12.6kJ/mol(单键旋转的能垒 一般在12.6~41.8kJ/mol),这种能垒非常低,室温下的 分子热运动即可达到,因此常温下分离不出纯的烷烃的分 子构象)。
第二章烷烃和环烷烃

与另外三个碳原子相连,剩余一个键与氢结合的碳原子 称为三级碳原子,也称叔碳原子。用3O表示。
与另外四个碳原子相连,不与氢结合的碳原子称为四级 碳原子,也称季碳原子。用4O表示。
C6 H3 C7 H3
H3C1
⑶ 含有双键或叁键的基团。可以认为连有两个或三个相同 的原子。
第一节 烷烃 一 烷烃的结构
在烷烃中,C均以sp3杂化轨道成键,价键分呈四面体形, 且又由于σ键可以自由旋转,所以烷烃的结构不象我们所写的 那样一成不变,而是运动的,一般以锯齿形存在。 甲烷中的碳为sp3杂化,四个杂化轨道完全一样,分别与氢形 成σ键,故呈四面体。这种σ键,电子云重叠是沿键轴方向, 键的旋转不影响电子云的重叠,故可以自由旋转。
序数大小排列,原子序数大(次序大)的基团为较优基团, 原子序数小(次序小)的基团为较小基团,同位素中质量高 的为较优基团。例如:
I>Br>Cl>S>……>C>D>H ⑵ 若取代基为多原子基团,则比较与碳原子相连的原子的
次序大小,若取代基为多原子基团,且与碳直接相连的原子 B均相同时,则比较与B相连的原子的次序大小,比较时,按 原子序数排列,先比较原子序数大的,若相同,再向下依次 比较。
B Staggered
乙烷分子构象转化能量示意图
HAHA
HCHA
HH BA
HAH A
CHH C
HHB B
BHHC
HHAB
AH H
C
H HB
C
CH H
C
HHB B
E
0
HC HC
60
120
180
240
有机化学第四章烷烃和环烷烃

1. 乙烷的构象
小于两个H 的 von der waals 半 径(1.2Å)之和, 有排斥力
<60o
2 H
H C H H
2.3 Å
H C H H
60o
H H H H 1 1 2 H H H
C1旋转
H H
1 1 H
C1旋转
H H
2H 11 H H H
H
交叉式构象 staggered conformer 原子间距离最远 内能较低 (最稳定)
奇数碳
沸点
沸点大小取决于分子间的作用力
烷烃沸点的特点
(1)沸点一般很低(非极性,只有色散力)。 (2)随相对分子质量增大而增大(运动能量增大,范德华引力增大)。 (3)相对分子质量相同、叉链多、沸点低。(叉链多,分子不易接近)
密度
烷烃的密度均小于1(0.424-0.780) 偶极矩均为0。
饱和烃的偶极矩 溶解度
自由基型链反应(chain reaction)
甲烷的溴代反应机理
(1) (2) (3)
Br Br Br +
hv or
Br
+ Br Br H + CH3
链引发 chain initiation
H
CH3
CH3 + Br
Br
CH3 Br + Br
第(2), (3)步反应重复进行 (4) (5) (6) Br Br CH3 + + + Br CH3 CH3 Br Br
扭曲式构象 skewed conformer (有无数个)
重叠式构象 eclipsed conformer 键电子云排斥, von der waals排斥力,内能较高 (最不稳定)
烷烃和环烷烃

烷烃分子中只有σ键,化学性质比较稳定, 不易发生化学反应。可以燃烧,也可以发生 卤代反应。
1、 燃烧
CnH2n+2
+
3n 1
(
2
) O2
n CO2 + (n+1)H2O
陈明
2、 卤代反应
(1) 甲烷的氯代
H
H
D or hv
H C H + Cl2
HC
H
H
H
D or hv
D or hv
H C Cl
H
根据碳原子数称某烷,前面不加“正”。
CH3CH2CH2CH3 丁烷 CH3(CH2)13CH3 十五烷
2) 支链烷烃 (1)把其看作直链烷烃的衍生物,把支链 作为取代基。在整个名称中包括母体和取代 基两部分,取代基部分在前,母体部分在后。
陈明
CH3CHCH2CH2CH3
CH3
2-甲基戊烷
(2)主链的选择: a、最长碳链为主链
陈明
Step 1 链的引发
D or hv
Cl Cl
Cl + Cl
Step 2 链的增长
H
H
H C H + Cl
H C + HCl
H
H
H
H
H C + Cl Cl
H C Cl+ Cl
H
H
陈明
Step 1 链的中止
H
HC
H H
+ Cl H
HC H
+ CH H
Cl + Cl
H H C Cl
H HH H CC H HH
陈明
二、命名( Nomenclature)
1、烷基 (alkyl) 的名称
烷基是烷烃去掉一个或几个 H 后剩下的 原子基团,用 R-表示,通式:CnH2n+1; 甲基常表示为 Me、乙基表示为 Et 。
烷烃和环烷烃课件

环烷烃
2
常见用途。
医药、香料、化妆品、橡胶等广泛应 用于生产和制造工业。
烷烃和环烷烃的合成方法
烷烃合成
催化裂化、加氢裂化和加氢法等多种方法可用于 烷烃的合成。
环烷烃合成
金属催化、酶法和化学合成等多种方法可用于环 烷烃的合成。
总结和要点
1 重要性
烷烃和环烷烃是有机化 合物中重要的类别。
2 特性
烷烃具有直链和支链结 构,而环烷烃具有环状 结构。
环烷烃的结构和构,具有稳定 性和不反应性。
由多个环状结构组成,具有药理活性和生 物学功能。
烷烃和环烷烃之间的区别和相似之处
相似之处
都是有机化合物,由碳和氢原子组成。
区别之处
烷烃是直链或支链,环烷烃是环状结构。
烷烃和环烷烃的应用领域
1
烷烃
汽车燃料、热水剂、溶剂、润滑剂等
烷烃和环烷烃ppt课件
烷烃和环烷烃是有机化合物的重要类别,它们在化学和生物学领域中有广泛 应用。
烷烃和环烷烃的定义
烷烃是由碳和氢组成的一类无环脂肪烃化合物,而环烷烃是由碳原子组成的 环状结构。
烷烃的结构和特性
直链烷烃
由一根直链上的碳原子组成,具有高熔点和 沸点。
支链烷烃
含有一个或多个支链,对流动性和燃烧性能 有影响。
3 应用
烷烃和环烷烃在化学和 生物学领域中有广泛的 应用。
烷烃、环烷烃

烷烃、环烷烃烷烃烷烃即饱和烃(saturated group),是只有碳碳单键的链烃,是最简单的⼀类有机化合物。
烷烃分⼦⾥的碳原⼦之间以单键结合成链状(直链或含⽀链)外,其余化合价全部为氢原⼦所饱和。
烷烃分⼦中,氢原⼦的数⽬达到最⼤值,它的通式为CnH2n+2。
分⼦中每个碳原⼦都是sp3杂化。
最简单的烷烃是甲烷。
烷烃中,每个碳原⼦都是四价的,采⽤sp3杂化轨道,与周围的4个碳或氢原⼦形成牢固的σ键。
连接了1、2、3、4个碳的碳原⼦分别叫做伯、仲、叔、季碳;伯、仲、叔碳上的氢原⼦分别叫做伯、仲、叔氢。
为了使键的排斥⼒最⼩,连接在同⼀个碳上的四个原⼦形成四⾯体(tetrahedro n)。
甲烷是标准的正四⾯体形态,其键⾓为109°28′(准确值:arccos(-1/3))。
理论上说,由于烷烃的稳定结构,所有的烷烃都能稳定存在。
但⾃然界中存在的烷烃最多不超过50个碳,最丰富的烷烃还是甲烷。
由于烷烃中的碳原⼦可以按规律随意排列,所以烷烃的结构可以写出⽆数种。
直链烷烃是最基本的结构,理论上这个链可以⽆限延长。
在直链上有可能⽣出⽀链,这⽆疑增加了烷烃的种类。
所以,从4个碳的烷烃开始,同⼀种烷烃的分⼦式能代表多种结构,这种现象叫同分异构现象。
随着碳数的增多,异构体的数⽬会迅速增长烷烃还可能发⽣光学异构现象。
当⼀个碳原⼦连接的四个原⼦团各不相同时,这个碳就叫做⼿性碳,这种物质就具有光学活性。
烷烃失去⼀个氢原⼦剩下的部分叫烷基[1],⼀般⽤R-表⽰。
因此烷烃也可以⽤通式RH来表⽰。
烷烃最早是使⽤习惯命名法来命名的。
但是这种命名法对于碳数多,异构体多的烷烃很难使⽤。
于是有⼈提出衍⽣命名法,将所有的烷烃看作是甲烷的衍⽣物,例如异丁烷叫做2-⼀甲基丙烷。
现在的命名法使⽤IUPAC命名法,烷烃的系统命名规则如下:找出最长的碳链当主链,依碳数命名主链,前⼗个以天⼲(甲、⼄、丙、丁、戊、⼰、庚、⾟、壬、癸)代表碳数,碳数多于⼗个时,以中⽂数字命名,如:⼗⼀烷。
第2章烷烃和环烷烃

英文名
n-butane isobutane
正丁烷 异丁烷
C4
CH3 CH3CHCH3 CH3(CH2)3CH3 CH3 CH3CHCH2CH3
正戊烷
n-pentane
异戊烷
isopentane
C5
CH3 CH3CCH3 CH3
新戊烷
neopentane
异构词头用词头“正”、“异”和“新”等区分 相应的英文词头为 n- (normal)、iso和neo(注意不加“-”) 缺点:C原子数较少时可以采用,若C数较多、支链较多,则无法命名。
各种原子或取代基按先后次序排列的规则称为顺序规则。
规则1:先比较取代基中与主链直接相连的原子按原 子序数由大到小排列,原子序数大的为优先基团。 若为同位素,则质量数高的顺序在前。
I > Br > Cl > F > O > N > C > D > H
不同原子按原子序数排列
同位素按质量 数由高到低的 顺序排列
【学习要求】
1. 了解C原子和H原子的类型以及烷基的概念。 2. 掌握普通命名法和系统命名法的基本原则,并能熟练 命名烷烃和环烷烃。 3. 了解同系物沸点、熔点变化规律。 4. 掌握烷烃和环烷烃的化学性质及影响因素。 5. 掌握构象异构和顺反异构产生的原因、特 点、命名及书写。
第一节
一、 烷烃的命名
烃
环状烃
脂环烃 芳香烃
饱和脂环烃(如环烷烃) 不饱和脂环烃(如环烯烃、环炔烃) 含苯芳烃(如萘、蒽、菲) 非苯芳烃
第一节 烷
一 二 三 四 五
烃
烷烃的命名 烷烃的结构 烷烃的物理性质 烷烃的化学性质 烷烃卤代反应的历程
14烷烃及环烷烃

n=8,9,10,11 中环化合物 n≧12 大环化合物
B. 命名
有机化合物命名
a.单环烃 A. 单环烃
按照链状烃命名,前面加“ 环” 字
已经讲过的 单环烃 IUPAC命名 桥环烃 规则(普遍 螺环烃 规则)
环丙烷 环丁烷 环戊烷 环己烷
芳香组化合物 命名规则
环己烯 1,3-环戊二烯 环辛炔 (最小环状炔烃)
3
* 三个环都是六元环,无大小之分。此时选取代基多的为主环。
*若环上有取代基,则取代基的编号,名称放在母体前。若有 多个取代基:中文命名时,取代基的位次按顺序规则由小到 大排列;英文命名时,取代基的位次按英文字母排列; *编号的方式若有各种选择时, 要使取代基的号码尽可能小。
c. 螺环烃 (1) 确定母体烃的名称:根据成环碳原子的数目确 定母体烃的名称。 ( 2 )从螺碳原子旁边的碳原子开始编号:从小环到 大环, 并使特征官能团及取代基位号最小; (3)书写顺序: 取代基-螺数(环)[小,大]母体
H
CH3 H
实 例 五
H3C
(1S,2S)-1,2-二甲基环丙烷 (1S,2S)-1,2-dimethylcyclopropane
H3C H H CH3
带有二个或二 个以上取代基 时,分子有对 称性,构型用 顺反表示。分 子没有对称性 ,构型用R, S 表示。
(1R,2R)-1,2-二甲基环丙烷 (1R,2R)-1,2-dimethylcyclopropane
用最低系列原 则无法确定选 哪一种编号时, 则用下面方法 确定编号。中 文, 让顺序规 则中顺序较小 的基团位次尽 可能小。英文, 按英文字母顺 序, 让字母排 在前面的基团 位次尽可能小。
实 例 四
H3C H
高中化学《环烷烃》课件

H2O
CH3 CH3 H3C C CH CH3
OH
四元环及四元环以上的环烷烃与HX,H2SO4 不易发生反应
相当 于烷对氧化剂稳定,不 被高锰酸钾、臭氧、氧气 等氧化剂氧化
O
O
CO2H
O O
可用高锰酸钾溶液来区 别烯烃与环丙烷衍生物
性质小结
▪小环烷烃(3,4元环)易加成,难氧 化,似烷似烯。
L-(-)-乳酸 mp: 53°
构象异构:
H
CH3 H
H CH3CH3
H
HH
H
CH3
H
对位交叉 邻位交叉
3.1.3 环烷烃的命名
(1) 根据分子中成环碳原子数目,称为环某烷。 (2) 单取代的环烷烃,将取代基的名称写在环烷烃的名称前面。 (3) 多取代的环烷烃则须加以编号。编号时,由小基团所在碳
原子编起,沿着距第2个取代基最近的环边依次编号。当环 上有不饱和键时,从不饱和键处开始编号。 (4) 取代基位次按“最低系列”原则列出,基团顺序按“次序 规则”小的优先列出。 (5) 有顺反异构时,须标明。
+ HBr CH3
+ HBr
+ H2SO4
CH3CH2CHCH3 Br
CH3 CH3
H3C C CH CH2
Br
H
CH3 CH3 H3C C CH CH2
OSO3H H
不对称取代环丙烷与不 对称试剂进行加成开环 反应时,环从取代基最 多和最少的环边打开, 氢加在氢多的碳上,卤 素或试剂的负电荷部分 加在氢少的碳上
多的构象。 4°环上有不同取代基时,大的取代基在e键上构
象最稳定。
§3.4 多环烃
3.4.1 多环烷烃的命名
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
烷烃是非极性分子,分子中的碳碳键或碳氢键是 非极性或弱极性的σ键,因此在常温下烷烃是不活泼的, 它们与强酸.强碱.强氧化剂.强还原剂及活泼金属都不 发生反应。
A. 氧化反应:烷烃很容易燃烧,燃烧时发出光并放 出大量的热,生成CO2和 H2O。自由基链锁反应 点燃 CH4 + 2O2 CO2 + 2H2O + 热量
B.裂化:烷烃在隔绝空气的条件下加强热,分子中 的碳碳键或碳氢键发生断裂,生成较小的分子,这 种反应叫做热裂化。如: CH3CH2CH2CH3
500℃
CH4 + CH2=CHCH3 CH3CH3 + CH2=CH2
CH2=CHCH2CH3 + H2
C.取代反应:卤代反应是烷烃分子中的氢原子 被卤素原子取代。
⑶物理性质 A.状态:在常温常压下,1至4个碳原子的直链烷烃是 气体,5至16个碳原子的是液体,17个以上的是固体。
B.沸点:直链烷烃的沸点随分子量的增加而有规律地 升高。(低级烷烃的沸点相差较大,随着碳原子的增加,沸点升 高的幅度逐渐变小。)支链烷烃的沸点比直链烷烃要低。支 链越多,沸点越低。色散力
C.熔点:直链烷烃的熔点,其本上也是随分子量的增 加而逐渐升高。 色散力、晶体中的排列 D.溶解度:烷烃是非极性分子,又不具备形成氢键的结 构条件,所以不溶于水,而易溶于非极性的或弱极性的 有机溶剂中。
E.密度:烷烃是在所有有机化合物中密度最小的一 类化合物。无论是液体还是固体,烷烃的密度均比水 小。随着分子量的增大,烷烃的密度也逐渐增大。 ⑷化学性质
(20)
(10)
★ 超共轭效应——
C-H键的共轭效应
由于氢原子半径非常小,导致 C-H 键的电子 云近似桶型;其键角为109.5,与90较为接近,CH键的电子云与双键的部分重叠形成的类似共轭的 效应。 只存在于C-H键,并且只是推电子的。
超共轭效应实例:CH3CH=CH2
H
H C C C
CH4:1H: 2H: 3H=(1/270)/1.0/3.5/5.0
B. 溴代反应
CH3CH2CH3 Br2 hv Br CH3CH2CH2Br 3% CH3 CH3CHCH3 Br2 hv CH3 CH3CHCH2Br <1% + CH3CHCH3 97% Br + CH3CCH3 CH3 >99%
CH3• + CH3•
Cl2
CH3CH3
CH3• + Cl•
CH3Cl
★自由基的结构与稳定顺序
A. 自由基的构型
H H H C H sp3转化为sp2 H C
自由基的单电子 H
H
B. 自由基的稳定顺序
CH2 R3C CH2=CHCH2
> R CH > RCH >
2 2
CH3
> CH=CH
2
(30)
反应的选择性是指反应部位的专一程度。 结论:溴代反应选择性比氯代反应好。 对于同一烷烃,大量的实 验证明叔氢原子最容易被 取代,伯氢原子最难被取代。
卤代反应机理: 1)链引发: 在光照或加热至250—400度时,反应引发。 Cl2
hυ
2Cl• HCl + CH3•
2)链增长: 氯原子游离基能量高,反应性能活泼 Cl• + CH4
CH3 CH3CHCH3
CH3CH2CH3
Cl2
Cl CH3CH2CH2Cl + CH3CHCH3 75% 46%
CH3 CH3CHCH2Cl 90% 36%
25% 54%
Cl + CH3CCH3 CH3 10% 64%
Cl2 hv
按照不同种类氢原子的比例,产率应为 实际反应的产率为
反应活性
反应的难易程度
CH3• + Cl2 CH3Cl + Cl•
CH2Cl• + Cl2
CH3Cl + Cl• CH2Cl• + HCl3
CH2Cl2 + Cl•
反应一步又一步地传递下去,所以称为链反应。
3)链终止: 随着反应的进行,甲烷迅速消耗,游离 基的浓度不断增加,游离基与游离基之间发生碰撞结 合生成分子的机会就会增加。 Cl• + Cl•
H H
H H
电子效应的影响
共轭效应>超共轭效应>诱导效应
• 解释自由基稳定性顺序
烯丙基自由基
CH2=CHCH2
H H
H C C C
H H
共轭效应Leabharlann 苄基自由基H C H
CH2
共轭效应
3自由基
H H
CH3
H
CH3 - C CH3
sp2 杂化
H
C C C H
超共轭效应
C H H
⑸ 烷烃的制法
2、环烷烃
室温
CH4 + Cl2
不反应
CH4 + Cl2
or hv
CH3Cl + HCl
Cl2
or hv
CH2Cl2 + HCl
Cl2
or hv
CHCl3 + HCl
Cl2
or hv
CCl4 + HCl
卤素反应的活性次序为:F2 >Cl2 > Br2 > I2
★ 卤代反应的活性与选择性
A. 氯代反应
hv 按照不同种类氢原子的比例,产率应为 实际反应的产率为
相应产物的产率除以相应氢原子的个数为该级别氢 原子的反应活性,
1H: 2H=(46/6)/(54/2)=1/3.5 1H: 3H=(64/9)/(36/1)=1/5.0
反应活性还可以通过反应速率的比值得到, 甲烷与乙烷氯代时的反应速率之比为: CH4/CH3CH3=1/270。 • 反应活性比例为:
⑴ 命名与分类
A.分类 单环烃 多环烃 桥环烃:公用两个以上碳原子
O
螺环烃:公用一个碳原子
O O
集合环烷烃:以一个碳原子用单键或双键直接相连
2 3 1 1' 2' 3'
单环烷烃的通式:CnH2n 单 环 烷 烃 的 分 类
n=3,4 n=5,6,7 小环化合物 不稳定,性质活泼
普通环化合物 稳定,易形成 稳定 稳定
n=8,9,10,11 中环化合物 n≧12 大环化合物
B. 命名
有机化合物命名
a.单环烃 A. 单环烃
按照链状烃命名,前面加“ 环” 字
已经讲过的 单环烃 IUPAC命名 桥环烃 规则(普遍 螺环烃 规则)
环丙烷 环丁烷 环戊烷 环己烷
二、烃
1、烷烃
⑴定义、通式和同系列 定义:由碳和氢两种元素组成的饱和烃称为烷烃。 通式: CnH2n+2 同系列: 相邻的两种烷烃分子组成相差一个碳原 子和两个氢原子,像这样结构相似,而在组成上相 差一个或几个CH2的一系列化合物称为同系列。
⑵烷烃的结构 SP3杂化 a.重叠程度大,不容易断裂,性质不活泼。 b.能围绕其对称轴进行自由旋转。
