异常事件调查表
实验室OOS超标管理规程(含表格)

实验室OOS/OOT/AD(超标/超趋势/异常数据)管理规程(ISO13485-2016/YYT0287-2017)1.0目的规范OOS/OOT/AD(超标/超趋势/异常数据)的管理流程和方式,使异常检验结果的处理符合GMP规定。
2.0适用范围适用于实验室OOS/OOT/AD(超标/超趋势/异常数据)的处理。
3.0引用/参考文件药品生产质量管理规范《偏差控制程序》《纠正与预防措施控制程序》4.0职责4.1质量控制实验室负责对检验异常情况进行计算过程、检验过程、样品、取样等的调查确认和执行后续相关的复测、重新取样、重新检测、纠正预防等工作。
4.2QA负责给定OOS/OOT/AD调查编号,参与异常调查全过程,跟踪封闭后续的纠正预防。
4.3生产部需要时,参与生产调查。
5.0程序5.1术语和定义5.1.1OOS:超出质量标准的试验结果。
5.1.2OOT:超出趋势的试验结果,结果虽然在质量标准之内,但仍然比较反常,与长期观察到的趋势或者预期结果不一致。
5.1.3AD:异常数据,指超出标准及超趋势意外的异常数据或来自异常测试过程的数据或者事件。
例如:仪器设备停机、认为差错、系统适用性不合格、样品或者样品溶液异常等产生的数据或事件。
5.1.4初始样品复验:用相同的样品或相同数量的样品重复试验。
5.1.5重新进样:从依然有效的试验溶液中重复进样,以确认是否为分析仪器的影响。
5.1.6重新取样:遵循预定的计划从一批中重新取样,可以与原始取样计划不同。
此计划应该事先批准。
5.1.7OOS/OOT/AD编号规则为OOS-四位年度号+三位流水号,例如OOS-2017009标识2017年发生的第009个OOS/OOT/AD调查。
调查编号由QA给定,并及时更新台账。
5.2处理流程示意图:见附件。
5.3调研阶段5.3.1调研阶段1证明实验室检查结果异常情况是否为明显的分析错误引发。
需要至少确认一下内容:5.3.1.1计算错误重新进行计算,以确定是否为计算错误。
医院异常事件报告制度

医院异常事件报告制度一、目的规范医院异常事件的主动报告,增强风险防范意识,及时发现医院异常事件和安全隐患,最大限度地收集与本院安全相关的信息,通过数据汇总和分析,及时发现医院运行中的安全隐患与薄弱环节,从医院管理体系、运行机制及规章制度上保障患者安全并进行有针对性的持续改进。
二、适用范围本制度适用于全院医疗、护理、医技、行管后勤。
凡发生或发现医院异常事件,以及任何有安全隐患潜在异常事件,均有责任上报。
三、异常事件的定义、分级与警讯事件内容(一)定义与分级异常事件是指在医院内发生的非预期的(未预料到的)、不利的或有潜在危险的事件。
异常事件分为四级:Ⅰ级事件又称警讯事件,是指涉及死亡或严重身体伤害或心理伤害的意外事件。
严重身体伤害具体包括丧失四肢或功能。
Ⅱ级事件又称不良后果事件,是指造成机体与功能损害的事件。
Ⅲ级事件又称未造成后果事件,是指虽然发生了错误事实,但未造成任何不良后果的事件。
Ⅳ级事件又称接近错误事件,是指发现的任何缺陷或错误,未形成事实,未造成危害,但其再发生很有可能带来严重的不良后果的事件。
(二)警讯事件内容警讯事件的内容包括:1.意外死亡,与患者病情的自然发展或基本状况无关的死亡(例如,因术后感染或肺栓塞而死亡);足月婴儿的死亡;自杀死亡;2.与患者病情的自然发展或基本状况无关的主要功能永久丧失;3.手术部位错误、操作错误和患者错误;4.因输注血液或血液制品而造成感染慢性病或绝症;5.婴儿被绑架或被盗或者抱错;6.强奸、职场暴力,例如在医院现场攻击(导致死亡或功能永久丧失);或谋杀。
7.院内感染的爆发。
四、异常事件的类别(一)医疗处置事件1.治疗错误事件:患者、部位、器材、剂量等选择错误的不认真查对事件;2.方法/技术错误事件:遗忘、未治疗、延期、时间或程序错误、不必要的治疗、灭菌/消毒错误、体位错误等事件;3.信息传递、沟通错误:医师、护理、医技判定(读)意见错误;医嘱错误(口头及书面)、其他传递方式错误等事件;4.非预期事件:非预期重返ICU,非计划再次手术事件。
异常情况处理记录表
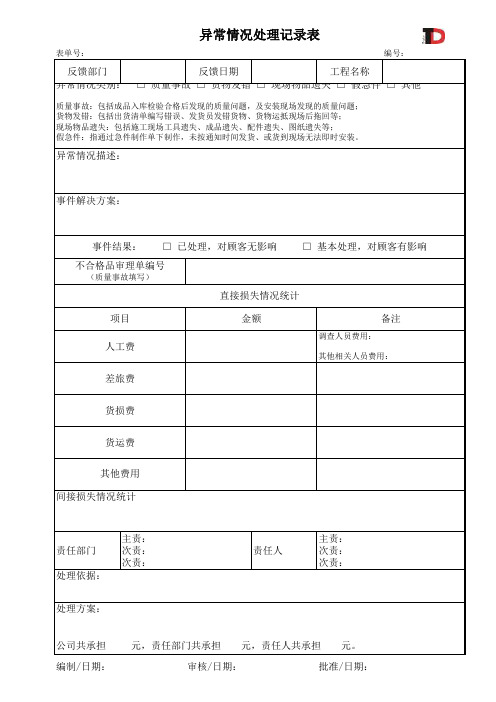
公司共承担 编制/日期:
元,责任部门共承担 元,责任人共承担 元。
审核/日期:
批准/日期:
异常情况描述:
事件解决方案:
事件结果: □ 已处理,对顾客无影响 □ 基本处理,对顾客有影响
不合格品审理单编号
(质量事故填写)
直接损失情况统计
项目 人工费
金额
备注
调查人员费用: 其他相关人员费用:
差旅费
货损费
货运费
其他费用 Leabharlann 接损失情况统计责任部门 处理依据:
主责: 次责: 次责:
处理方案:
责任人
主责: 次责: 次责:
异常情况处理记录表
表单号:
编号:
反馈部门
反馈日期
工程名称
异常情况类别: □ 质量事故 □ 货物发错 □ 现场物品遗失 □ 假急件 □ 其他
质量事故:包括成品入库检验合格后发现的质量问题,及安装现场发现的质量问题; 货物发错:包括出货清单编写错误、发货员发错货物、货物运抵现场后拖回等; 现场物品遗失:包括施工现场工具遗失、成品遗失、配件遗失、图纸遗失等; 假急件:指通过急件制作单下制作,未按通知时间发货、或货到现场无法即时安装。
疑似预防接种异常反应监测报告与调查诊断

调 查 诊 断 专 家 组 的 组 成
30
3.资料收集-临床资料
31
3.资料收集-疫苗与接种资料
• 预防接种证
32
4.诊断
调查诊断依据: 1. 法律、行政法规、部门规章和技术规范 2. 临床表现、医学检查结果 3. 疫苗储存、运输情况,接种实施情况等 4. 疫苗质量检验结果等 死亡病例诊断需要尸检结果的,受种方拒绝或者不配合尸检,承担 无法进行调查诊断的责任
判定证据
随机对照临床试验、队列研究或 病例对照研究
具有明确生物学标志 不同人体研究结果一致 存在剂量-反应关系 活疫苗发生的类似自然感染,时
间合理 疫苗附加物引起的特异性反应 排除实施差错、疫苗质量问题、
心理因素
36
AEFI的分类流程
不良反应
37
疫苗的一般反应发生率-WHO
资料来源:WHO
受种者在接种时,正处于某种 疾病的潜伏期或者前驱期,接 种后巧合发病
不是由疫苗的固有性质引起的
常见偶合症 急性传染病 内科疾病 神经精神疾病 婴儿窒息或猝死
13
5.心因性反应
(Psychogenic Reaction或 Injection Reaction )
因受种者心理因素发生 的个体或者群体的反应
不是由疫苗的固有性质 引起的
泗县甲肝疫苗事件 调查结论:群发性癔症
14
群体性疑似预防接种异常反应(AEFI Cluster)
AEFI Cluster
•突发公共卫生事件
短时间内同一接种单位的受种者 中,发生的2例及以上相同或类似 临床症状的严重疑似预防接种异 常反应
•突然发生,造成或者可能 造成社会公众健康严重损害 的重大传染病疫情、群体性
一、二类障碍、异常(未遂)管理制度

一、二类障碍、异常(未遂)管理制度1 范围1.1 本标准规定了xx电厂一、二类障碍、异常、未遂管理职能、管理内容和要求、检查与考核。
1.2 本标准适用于xx电厂一、二类障碍、异常、未遂认定管理工作。
2 术语和定义2.1一类障碍凡属人员过失,监视、监护不严,检查不认真,联系或操作不当,设备缺陷发现或处理不及时,检修质量不良,违反规程制度等原因,造成6KV以上母线停运,机组停运,变压器停运,锅炉爆管等主设备停止运行或直接损失超过5万元的情况。
2.2 二类障碍凡属人员过失,监视、监护不严,检查不认真,联系或操作不当,设备缺陷发现或处理不及时,检修质量不良,违反规程制度等原因,造成主设备和主要设备异常运行或损坏,设备停役或返工,情节尚未构成一类障碍但超出异常者。
2.3 异常凡属人员过失,监视、监护不严,检查不认真,联系或操作不当,设备缺陷发现或处理不及时,检修质量不良,违反规程制度等原因,造成设备、设施处于非正常状态或损坏,设备停役或返工,情节尚未构成二类障碍者。
2.4 未遂由于违反规定险些造成严重后果的或出现事故苗头后被及时制止的事件。
3 职能与职责3.1 安健环部是本标准的归口管理部门。
发生一、二类障碍、异常、未遂事件,由事件责任部门主任(副主任)或指定专人负责组织分析;发生事件涉及两个及以上部门由安健环部组织分析,由责任部门各自写出书面报告上报安健环部。
3.2 发生一二类障碍、异常、未遂事件,责任部门必须及时向安健环部汇报,并按照“四不放过”的原则,迅速准确地进行调查和原因分析,召开分析会,分析事件原因,吸取教训,制定反措,三日内将详细资料书面报安健环部。
3.3 调查分析发生事件必须实事求是,严肃认真,严禁隐瞒不报、漏报。
3.4 发生事件的相关部门、班组及人员,认真履行安全生产职责,正确处理异常事件,防止扩大化,并做好相关记录。
4 流程与风险分析4.1 二类障碍、异常(未遂)管理流程图见附录A4.2 控制点:二类障碍认定标准、异常认定标准、未遂认定细则、职能与职责、事件的分析报告。
乌市火灾事故原因调查表

乌市火灾事故原因调查表一、事故基本情况1. 事故发生时间:____年____月____日____时____分2. 事故发生地点:____(具体地址)3. 事故起因:____(初步判断)4. 单位名称:____5. 事故规模:____(火灾面积、人员伤亡情况等)二、事故基本情况调查1. 事故地点周边环境:____(地理位置、交通状况等)2. 建筑物的结构类型:____(建筑年代、建筑结构等)3. 火灾发生前的火灾隐患排查记录:____(最近一次排查结果)4. 火灾发生前的消防安全检查记录:____(最近一次检查结果)5. 火灾发生前的用电安全检查记录:____(最近一次检查结果)6. 火灾发生前单位内部的火灾预防措施:____(灭火器的数量、安全出口的设置等)7. 与事故相关的人员:____(事故现场工作人员、当时在场的负责人员等)8. 火灾发生前的气象条件:____(是否存在干旱、高温等不利气象条件)9. 火灾发生前的交通情况:____(周边车辆、行人的情况)10. 相关法律法规、政策制度、标准和规范:____(事发地区的消防法规、建筑安全规定等)三、事故原因分析1. 火灾发生的主要原因:____(初步分析)2. 直接原因:____(导致火灾发生的直接原因)3. 间接原因:____(与火灾发生有关的间接因素)4. 火灾逃生和救援过程中存在的问题:____(例如安全出口设置、逃生通道通畅性等)5. 火灾扑救过程中存在的问题:____(例如消防器材是否齐全、人员是否受过消防知识培训等)6. 监管部门在火灾预防和扑救工作中存在的问题:____(例如消防安全责任单位是否做好了防范工作等)7. 企业和单位自身在火灾预防和扑救工作中存在的问题:____(例如是否制定了完善的火灾逃生预案、是否定期组织演练等)8. 社会公众在火灾预防和扑救工作中存在的问题:____(例如火灾自救知识掌握情况等)9. 其他可能的事故原因分析:____(从其他可能的角度分析事故原因)四、应急救援措施情况1. 火灾发生后,企业或单位采取的应急救援措施:____(灭火方式、疏散人员等)2. 现场救援力量情况:____(本单位内部救援力量、外部救援力量等)3. 火灾扑救的困难和不足:____(例如救援力量不足、火灾扑救装备不足等)4. 救援过程中具体的问题和改进措施:____(例如扑救困难、后续救援困难等)五、事故应急预案执行情况1. 企业或单位的应急预案内容:____(含详细内容)2. 火灾发生后,企业或单位应急预案的执行情况:____(是否按照预案要求进行)3. 预案执行中存在的问题和改进措施:____(涉及预案实施中遇到的困难、需要改进的地方等)六、事故救援和善后工作情况1. 火灾扑救后的善后工作:____(灾后搜救、伤员救治情况等)2. 受伤人员及其家属的安抚和帮助情况:____(包括伤员的伤情、治疗情况、心理安抚等)3. 社会力量的救助情况:____(社会各界对事故的救助情况)4. 造成的经济损失情况:____(包括财产损失、人员伤亡的赔偿等)七、事故预防和治理建议1. 对事故原因的治理建议:____(从消防、建筑安全等方面提出具体建议)2. 对事故应急救援和善后工作的建议:____(例如加强火灾扑救力量、健全应急救援系统等)3. 对事故预防工作的建议:____(从教育宣传、行业管理等方面提出具体建议)4. 其他相关建议:____(其他可能的治理建议)八、立案调查及责任追究建议1. 是否需要立案调查:____(初步认定事故性质)2. 是否需要对相关责任人追究责任:____(初步认定责任)3. 对相关责任人的责任追究建议:____(对相关责任人的处理建议)以上调查表为初步版本,具体情况还需进一步调查核实。
护理异常(不良)事件报告制度

护理异常(不良)事件报告处理制度护理异常(不良)事件是指医院内意外的,由于技术、服务、管理等方面的失误,所出现的不在计划中的、未预计到的或不希望发生的护理事件。
伤害程度可以是从“无伤害”到“死亡”,具体分类分级如下:一、护理异常(不良)事件分类分级1.警告事件(Ⅰ级):非预期的死亡,或是非疾病自然进展过程中造成永久性功能丧失。
范围包括:①患者意外死亡,如自杀等;②与患者所患疾病无关的器官重大损害或永久性功能丧失;③手术错误:包括患者错误、手术方式错误、部位错误;④婴儿在院内丢失。
2.不良后果事件(Ⅱ级):在疾病医疗过程中是因诊疗活动而非疾病本身造成的患者机体与功能的损害。
具体包括:给药错误、输血错误、管路滑脱、皮肤压疮、意外伤害事件(误吸/窒息、跌倒、坠床、走失、磕碰伤、针刺伤、自杀未遂等),药物外渗及静脉炎等,化疗药物严重污染等事件。
3.未造成后果事件(Ⅲ级):虽然发生的错误事实,但未给患者机体与功能造成任何损害,或有轻微后果,不需要任何处理完全可以康复。
4.隐患事件(Ⅳ级):由于及时发现错误,未形成事实。
患者最终未得到错误的医疗护理服务。
二、护理异常(不良)事件报告的原则1.严格执行医院制定的《医疗安全(不良)事件报告制度》(试行)的有关规定。
2.坚持非惩罚性、主动报告的原则。
3.鼓励护理人员主动、自愿报告异常(不良)事件。
对于主动上报者,按照医院制订的奖励制度对个人或科室进行奖励,给予报告者个人每例100元奖励;对阻止重大安全事故发生的报告者,每例奖励1000元;对排名在全院前六名的科室给予年度一次性奖励5000元。
4.对于瞒报、漏报的护理单元及个人,按照医院制订的处置制度对个人或科室进行处罚,详见《医疗安全(不良)事件报告制度》(试行)。
三、护理异常(不良)事件报告的时限1.严重不良事件(包括Ⅰ级、Ⅱ级):必须立即口头/电话上报,24小时内网报《医疗安全(不良)事件报告表》并提交相关部门。
药品不良反应表格

附表1
药品不良反应/ 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
突发公共卫生事件、异常信息、传染病疫情报告处理登记表 - 副本

金沙县突发公共卫生事件、异常信息快速反应、传染病疫情报告处理登记表
报告单位: 报告人: 报告时间: 联系电话:
突发事件、异常信息、传染病疫情信息:
累计发病(中毒)人数/死亡人数/病例分别情况:
发病及接触史: 主于
年
月
日
时
分以(报告方式:口头、电话、传真) 日 时 分上报卫计行政
报(中心主任、副主任、科长或疫情管理员) 部门(教育部门) 处理情况: 并把初步处理情况于 院填写) 采取措施和处理情况: 1、对患者严格实行隔离治疗 同志。 同志于 日 时 年 月
同志;并于
日
时
分出发,到疫点核实调查处理, 同志.(卫生
分(电话、电子邮件、传真)反馈中心
2、对患者家庭及周边开展消毒工作,发放宣传单,并对儿童家庭及周边儿童家庭发放84消毒液、漂白粉 3、对密切接触者进行至少7天的医学观察,并做好相关记录 4、加强对患儿周围医疗机构的疫情主动搜索,出现相关症状,及时就诊并报告镇卫生院公共卫生科 5、 备注 记录人: 记录日期:
生产现场的异常事件处理与记录

异常事件处理的重要性
保障生产安全
及时处理异常事件可以预 防安全事故的发生,确保 员工生命安全和设备完好
。
提高生产效率
迅速解决异常事件可以减 少生产停顿时间,提高整
体生产效率。
保证产品质量
有效处理异常事件可以降 低产品缺陷率,提高产品
质量,减少客户投诉。
02
异常事件处理流程
识别与报告
总结词
及时发现并准确报告
预防措施的制定不是一次性的任务,而是一个持续改进的过程。生产现场应定期评估异常事件的处理 效果,总结经验教训,不断完善预防措施。同时,鼓励员工提出改进意见和建议,持续提高生产过程 的安全性和稳定性。
03
异常事件记录与报告
记录标准与要求
准确性
确保记录的信息准确无误,不遗漏任何关 键细节。
及时性
在事件发生后及时进行记录,避免时过境 迁导致信息失真。
谢谢您的聆听
THANKS
完善异常事件处理流程
制定应急预案
针对可能发生的异常事件,制定详细的应急 预案,明确应对措施和责任人,确保快速响 应。
定期演练
组织员工进行异常事件处理演练,提高实际操作能 力,确保在紧急情况下能够迅速、准确地采取应对 措施。
优化流程
对现有异常事件处理流程进行审查和改进, 简化操作步骤,提高处效率,降低事故风 险。
根本原因分析
总结词
深入调查,找出根本原因
详细描述
在紧急处理完成后,应组织 专门人员对异常事件进行深 入调查,找出根本原因。通 过分析事件发生的条件、过 程和结果,以及涉及的人员 、设备、材料和环境等因素 ,确定问题的根源。
总结词
全面分析,考虑各种可能
详细描述
AEFI个案报告卡和调查表表样

附表1疑似预防接种异常反应个案报告卡1.编码□□□□□□□□□□□□□□2.姓名*3.性别* 1男2女□4.出生日期* 年月日□□□□/□□/□□5.职业□□6.现住址7.联系电话8.监护人10.反应发生日期* 年月日□□□□/□□/□□11.发现/就诊日期* 年月日□□□□/□□/□□12.就诊单位13.主要临床经过*发热(腋温℃)* 1 37.1-37.5 2 37.6-38.5 3 ≥38.6 4无□局部红肿(直径cm) * 1 ≤2.5 2 2.6-5.0 3 >5.0 4无□局部硬结(直径cm)* 1 ≤2.5 2 2.6-5.0 3 >5.0 4无□14.初步临床诊断□□15.是否住院* 1是2否□16.病人转归* 1痊愈2好转3 后遗症4死亡5不详□17.初步分类* 1一般反应2待定□18.反应获得方式1被动监测2主动监测□19.报告日期* 年月日□□□□/□□/□□20.报告单位*21.报告人22.联系电话说明:* 为关键项目。
附表2群体性疑似预防接种异常反应登记表群体性疑似预防接种异常反应编码:县国标码□□□□□□-首例发生年份□□□□-编号□□发生地区:疫苗名称*:生产企业*:规格(剂/支或粒) :有无批签发合格证:接种单位:接种人数*:反应发生人数*:报告单位*:报告人:联系电话:- 2 -附表3疑似预防接种异常反应个案调查表一、基本情况1.编码* □□□□□□□□□□□□□□2.姓名*3.性别* 1男2女□4.出生日期* 年月日□□□□/□□/□□5.职业□□6.现住址7.联系电话8.监护人二、既往史1.接种前患病史1有2无3不详□如有,疾病名称2.接种前过敏史1有2无3不详□如有,过敏物名称3.家族患病史1有2无3不详□如有,疾病名称4.既往异常反应史1有2无3不详□如有,反应发生日期年月日□□□□/□□/□□接种疫苗名称临床诊断三、可疑疫苗情况(按最可疑的疫苗顺序填写)疫苗1 疫苗2 疫苗31.疫苗名称*2.规格(剂/支或粒)3.生产企业*4.疫苗批号*5.有效日期6.有无批签发合格证书7.疫苗外观是否正常8.保存容器9.保存温度(℃)10.送检日期11.检定结果是否合格四、稀释液情况疫苗1 疫苗2 疫苗31.稀释液名称2.规格(ml/支)3.生产企业4.稀释液批号5.有效日期6.稀释液外观是否正常7.保存容器8.保存温度(℃)9.送检日期10.检定结果是否合格五、注射器情况疫苗1 疫苗2 疫苗31.注射器名称2.注射器类型3.规格(ml/支)4.生产企业5.注射器批号6.有效日期7.送检日期8.检定结果是否合格六、接种实施情况疫苗1 疫苗2 疫苗31.接种日期*2.接种组织形式*3.接种剂次*4.接种剂量(ml或粒)*5.接种途径*6.接种部位*7.接种单位8.接种地点9.接种人员10.有无预防接种培训合格证11.接种实施是否正确七、临床情况1.反应发生日期* 年月日□□□□/□□/□□2.发现/就诊日期* 年月日□□□□/□□/□□3.就诊单位4.主要临床经过*发热(腋温℃)* 1 37.1-37.5 2 37.6-38.5 3 ≥38.6 4无□局部红肿(直径cm) * 1 ≤2.5 2 2.6-5.0 3 >5.0 4无□局部硬结(直径cm)* 1 ≤2.5 2 2.6-5.0 3 >5.0 4无□5.初步临床诊断□□6.是否住院* 1是2否□如是,医院名称病历号住院日期年月日□□□□/□□/□□出院日期年月日□□□□/□□/□□7.病人转归* 1痊愈2好转3 后遗症4死亡5不详□如死亡,死亡日期年月日□□□□/□□/□□是否进行尸体解剖1是2否□尸体解剖结论八、其他有关情况1.疫苗流通情况及接种组织实施过程2.同品种同批次疫苗接种剂次数及反应发生情况3.当地类似疾病发生情况九、报告及调查情况1.反应获得方式1被动监测2主动监测□2.报告日期* 年月日□□□□/□□/□□3.报告单位*4.报告人5.联系电话6.调查日期* 年月日□□□□/□□/□□7.调查单位8.调查人十、结论1.做出结论的组织* 1医学会2调查诊断专家组3疾控机构4医疗机构□5接种单位组织级别* 1省级2市级3县级4乡级5村级□2.反应分类* 1一般反应2异常反应3疫苗质量事故4接种事故□5偶合症6心因性反应7待定如为异常反应,机体_____________(参照《医疗事故分级标准》)□损害程度3.最终临床诊断* □□4.是否严重疑似预防接种1是2否□异常反应是否群体性疑似预防接1是2否□种异常反应如是,群体性疑似预防接□□□□□□□□□□□□种异常反应编码说明:* 为关键项目。
疑似预防接种反应报告

疑似预防接种反应一、定义疑似预防接种异常反应(Adverse Event Following Immunization,简称AEFI)是指在预防接种后发生的怀疑与预防接种有关的反应或事件。
二、报告(一)报告范围。
疑似预防接种异常反应报告范围按照发生时限分为以下情形:——24小时内:如过敏性休克、不伴休克的过敏反应(荨麻疹、斑丘疹、喉头水肿等)、中毒性休克综合征、晕厥、癔症等。
——5天内:如发热(腋温≥38.6℃)、血管性水肿、全身化脓性感染(毒血症、败血症、脓毒血症)、接种部位发生的红肿(直径>2.5cm)、硬结(直径>2.5cm)、局部化脓性感染(局部脓肿、淋巴管炎和淋巴结炎、蜂窝组织炎)等。
——15天内:如麻疹样或猩红热样皮疹、过敏性紫癜、局部过敏坏死反应(Arthus反应)、热性惊厥、癫痫、多发性神经炎、脑病、脑炎和脑膜炎等。
——6周内:如血小板减少性紫癜、格林巴利综合征、疫苗相关麻痹型脊髓灰质炎等。
——3个月内:如臂丛神经炎、接种部位发生的无菌性脓肿等。
——接种卡介苗后1-12个月:如淋巴结炎或淋巴管炎、骨髓炎、全身播散性卡介苗感染等。
——其他:怀疑与预防接种有关的其他严重疑似预防接种异常反应。
(二)报告单位和报告人。
医疗机构、接种单位、疾病预防控制机构、药品不良反应监测机构、疫苗生产企业、疫苗批发企业及其执行职务的人员为疑似预防接种异常反应的责任报告单位和报告人。
(三)报告程序。
疑似预防接种异常反应报告实行属地化管理。
责任报告单位和报告人发现属于报告范围的疑似预防接种异常反应(包括接到受种者或其监护人的报告)后应当及时向受种者所在地的县级卫生行政部门、药品监督管理部门报告。
发现怀疑与预防接种有关的死亡、严重残疾、群体性疑似预防接种异常反应、对社会有重大影响的疑似预防接种异常反应时,责任报告单位和报告人应当在发现后2小时内向所在地县级卫生行政部门、药品监督管理部门报告;县级卫生行政部门和药品监督管理部门在2小时内逐级向上一级卫生行政部门、药品监督管理部门报告。
产品批量异常事故调查报告

产品批量异常事故调查报告英文回答:Product Mass Defect Incident Investigation Report.Executive Summary.On [date], it was discovered that a significant number of units within the [product name] product line exhibited a critical defect that rendered them unusable.An immediate investigation was launched to determine the root cause of the defect and to implement corrective actions to prevent its recurrence.This report outlines the findings of the investigation, including the identified root cause, corrective actions taken, and recommendations to enhance product quality and reliability.Incident Description.The defect was first reported by [name] on [date], who observed that several units within their facility exhibited [symptoms of defect].Subsequent reports from other customers confirmed the widespread nature of the issue, with affected units accounting for approximately [percentage]% of the total production batch.The defect prevented the affected units from performing their intended function, resulting insignificant financial losses and customer dissatisfaction.Root Cause Analysis.A multidisciplinary team was assembled to conduct a thorough investigation into the root cause of the defect.The team examined the affected units, reviewed production records, and interviewed personnel involved inthe manufacturing process.The investigation revealed that the defect was caused by [root cause].Specifically, [further explanation of root cause].Corrective Actions.To address the immediate issue, all affected units were recalled from the field and either repaired or replaced.The manufacturing process was revised to eliminate the root cause of the defect.New quality control measures were implemented to prevent the recurrence of similar issues in the future.Recommendations.To enhance product quality and reliability, thefollowing recommendations were made:Establish a more rigorous quality control program with increased sampling and testing.Implement a root cause analysis protocol for all product defects.Provide regular training for production personnel on quality control procedures.Conclusion.The product mass defect investigation identified the root cause of the defect and implemented corrective actions to prevent its recurrence.Recommendations were also made to enhance product quality and reliability.By implementing these findings, the company can significantly reduce the risk of similar incidents in thefuture, ensuring customer satisfaction and the reputation of the product line.中文回答:产品批量异常事故调查报告。
分析样品异常事件调查报告

分析样品异常事件调查报告一、事故概述20xx年6月26日,墨西哥客户委托专业检验人员对我司所生产的产品进行抽样检验,现对客户抽检过程中发现的质量问题综述如下:1、RA1990批1100.F状态,5.16*914*2438型号铝板产品,长度尺寸边最大可达12mm,报废量大;2、RA1989批1100F12.7*914*2438型号铝板产品,板面极脏且有明道压坑;3、4.19mm型号铝板产品板面很多泪痕印、亮辊印(支撑辊印痕);4、2.11m型号铝板产品板面汽油印痕矫直辊印痕、麻面明显;5、0.47mm型号铝板产品垛板不齐,边部出折印。
二、原因分析1、综述以上产品质量问题,全部是明显已见的低级质量问题,尽管在质量管理规定上已经三令五申,要求有自检、复检、专检、包装前必捡,但由于质量管理松懈,没有按照规定进行生产,是发生此次产品质量事故的主要原2、部分主操或班长、质检人员没有经过必要严格的质量管理体系培训是发生以上事故的次要原因。
三、应对措施为了避免再次发生类似的错误,生产部在20xx年6月27日下午召开了中层干部及车间管理人员质量分析报告会,大家都发表了意见,汇总如下:1、强化在制品过程检验,不接受不良、不制造不良、不传递不良,严把成品终检关。
各生产工序严格按照首料必检,中间抽检,尾料必检的原则;以各工序主操、班长自检为主,为本工序的第一责任人;下道工序主操或班长复检为主,为本工序的第一责任人;各车间质检员及车间主任抽检为辅,为第二责任人;成品包装前质检员必须进行专检的产品质量管理体系。
2、经检验合格后由质检员加盖产品合格章后,方可入库;凡不盖章入库者,本班班长或组长为产品质量事故的第一责任人,仓库管理人员为第二责任人;凡盖章入库质量不合格者,质检员为不合格产品的第一责任人,班长或组长为不合格产品的第二责任人;属批量事故的,车间主任负连带责任;属重大质量事故的,生产部负连带责任。
3、生产部要求各车间、各部门重新审核本车间、本部门的生产质量管理检验规程,对职工加强培训,对需要注意的事项定期进行培训(每月一次),争取做到人人懂工艺,人人懂检验,人人懂规矩,只有这样全员参与,才是最终减少质量问题的最好办法。
根本原因分析(RCA)

临
严重
重度
中度
轻度
无伤害或 轻度伤害
3 4 4 4 4
轻微
床 病人因非疾病因素死 病人因非疾 病人因非疾 病人因非疾 病 人 虽 发 生
结 亡或有以下状况:
病 因 素 造 成 病 因 素 造 成 病 因 素 导 致 意外事件,但
果 1、手术部位或病人身 永 久 性 功 能 永 久 性 功 能 医 疗 照 护 之 是 未 造 成 任
严重
重度
中度
轻度
轻微
1、因意外导 1、因意外导 1、因意外导 1、只需紧急 未 造 成 任 何
致员工死亡 致 员 工 永 久 致 员 工 额 外 处置,无其它 伤害
2、员工自杀 性伤害
医疗处置或 后遗症或影
员工
3、三名以上 2、二名员工 暂 时 无 法 工 响
员工住院
住院
作
3、三名以上 2、二名员工
四、应用的工具
(一)严重度评估(SAC):是依据事件严重程度与事件发生频率为两
轴呈现出的风险矩阵,透过 SAC 分级级数可协助医院判断发生的异常
事件是否优先处理,以评估介入的必要性。
表 1:异常事件严重度评估准则(SAC) 结果
死亡 极重度伤害 重度伤害 中度伤害
数周
1
1
2
3
频 率
一年数次 1-2 年一次 2-5 年一次
份错误
丧失,或有以 障碍,或有以 增加,包括以 何 伤 害 也 无
2、院内自杀
下情况:
下情况:
下情况:
需额外的医
3、器物或物料留置体 1、因医疗意 1、因医疗意 1、再评估或 疗照护
内需手术移除
外 致 容 貌 毁 外 事 件 造 成 诊断
热水袋烫伤RCA分析2022

访谈12月30日术后病房责任护士单x 问:那天天气寒冷有无提前开启病房暖气?
答:处于新冠病毒流行期间,病房需要加强通风,给予盖被保暖,暂不开启暖气。
2.资料收集
人证、物证
访谈12月30日值班护士江xx、郑xx 问:为什么患者术后当班突然使用电热水袋? 答:因为术后患者感觉左足冷,于是自行让家属购买热水袋后直接敷在左足背上。 问:患者家属有无询问过护士是否能使用热水袋? 答:没有 问:护士夜间何时巡视病房?有无关注是否使用热水袋这个问题? 答:16:40交接班查看患者是没有使用热水袋的,家属17:00左右自行下小卖部购买热水袋,半小 时后出现烫伤,护士立即查看并处理。
轻微
3 4 4 4 4
临床结果发生频率:1-2年一次
3.确定问题
2022-12-30 一例使用热水袋致皮肤浅Ⅱ度烫伤不良事件RCA分析
3.严重度与再发频率识别与分析
严重 (警讯事件)
重度 (Ⅰ级不良事件)
中度 (Ⅱ级不良事件)
轻度 (Ⅲ级不良事件)
轻微 (Ⅳ级不良事件、接近失
误)
病人非疾病因素死亡,或有以下 状况: 1.手术部位或病人身份误 2.院内自杀 3.器物或物料留置 4.血管内气栓塞致死或导致严重 神经学后遗症 5.输血相关之溶血反应 6.药物错误致死 7.产妇致死或生产所致之严重后 遗症 8.新生儿遗失或抱错婴儿
3.事件描述
记事法(举例)
1.2022年12月29日 患者于1年余前因左股骨干骨折在我院行左股骨干骨折切开复位+髓内钉内固定术,术后恢复 良出院。现来我院复诊,要求入院取左股骨内固定装置,门诊医师检查后拟“左股骨术后取 出内固定装置”收入我科进一步诊治。体查:四肢肌力5级,左大腿外侧见手术疤痕,ADL评 分100分,跌倒评分0分。入院后行入院宣教包括:环境、用电安全、贵重物品保管等。
突发公共卫生事件防治知识调查表

0
1
2
3
25. 无法控制过分的紧张害怕
0123
26. 想一死了之
0123
27. 想到与突发公共卫生事件有关的东 西,就没有心思干别的事情
0
1
2
3
简易应对方式调查表
指导语: 各位市民: 您好!以下列出的是在突发公共卫生事件发生时,或在生活中经受
到挫折打击时,您可能采取的态度和做法。请您仔细阅读每一项,然后 在右边选择回答,“不采取”为0,“偶尔采取为1,“有时采取为2,“经 常采取”为3,请在最适合您本人情况的数字上打勾。
食物。 ② 加强体育锻炼活动,增强体质,提高抗病能力 ③ 远离患者,不与患者交流说话 ④ 采取各种免疫措施,有重点地进行预防接种
19. 密切接触者是指在未采取有效防护措施情况下接触传染期病例的人群, 下列那类人群
属于密切接触者:(可多选) ① 诊断、治疗或护理流感病例的人员 ② 与传染期病例共同生活或有过近距离接触的人员 ③ 暴露于病例污染的环境或物体的人员 ④ 与传染期病例经常电话交流的人员 20. 出现食物中毒事件时,应如何应对?(可多选) ① 立即停止食用可疑食品 ② 喝大量洁净水以稀释毒素 ③ 用筷子或手指伸向喉咙深处刺激咽后壁、舌根进行催吐、并及时 就医 ④ 了解与病人一同进餐的人有无异常,并告知医生 ⑤ 向所在地疾病预防控制机构或卫生监督机构报告
2
3
12. 头痛、浑身肌肉酸痛
0123
13. 有种不祥的预感
0123
14. 在人群聚集的地方特别是医院附 近,感到提心吊胆、紧张不安
0
1
2
3
15. 对什么都没有兴趣
0123
16. 非常在意身体上出现的任何不舒服 0 1 2 3
