金属及其化合物之间的转化关系
2020届江苏高考化学二轮总复习题型全练物质的转化(50张)

D.Fe2O3(s)―高―A温l→Fe(s)H―C―l(―a―q→)FeCl3(aq)
解析: NaAlO2(aq)与过量 HCl(aq)反应,生成 AlCl3,B 项错误; 蔗糖(aq)中无醛基,不能与[Ag(NH3)2]+(aq)反应生成 Ag(s),C 项 错误;Fe(s)与 HCl(aq)反应生成 FeCl2(aq),D 项错误。 答案:A
C.SiO2(s)―H―2O→H2SiO3(s)―N―aO―H―(―a―q)→Na2SiO3(aq) D.Al2O3(s)―N―aO―H―(―a―q)→Al(OH)3(s)――H―2S―O―4(―a―q)―→
Al2(SO4)3(aq)
解析: A 项,Cu 与 HCl(aq)不反应,错误;C 项,SiO2 不溶于水,也不能与水反应,错误;D 项,Al2O3 溶于 NaOH 溶液生成 NaAlO2,不能生成 Al(OH)3,错误。 答案:B
生成 CO2,错误;C 项,由于 Mg2+水解,加热 MgCl2 溶液,
HCl 挥发,最终生成 Mg(OH)2,得不到无水 MgCl2,错误;
D 项,NH3 催化氧化生成Hale Waihona Puke NO,不是 NO2,错误。 答案:B
3.(2018·扬州一模)在给定条件下,下列选项所示的物质间转
化均能实现的是
()
A.Si―O―△2→SiO2浓―△―盐→酸SiCl4
_2_H__2O__=_=_=_A__l(_O_H__)3_↓__+__H__C_O__- 3 __
3.铁及其化合物之间的转化关系
写出图中标号的化学方程式或离子方程式:
点燃 ① 2Fe+3Cl2=====2FeCl3
高温
高温
② Fe2O3+3CO=====2Fe+3CO2 或 Fe2O3+2Al=====2Fe+Al2O3
【新教材】3.1.2 铁及其化合物之间的转化关系教学设计(2)-鲁科版高中化学必修第一册 (2)

3.1.2 铁及其化合物之间的转化关系本节教学内容是鲁教版高中化学必修第一册第三章第一节《铁的多样性》的第二课时。
该部分的教学内容涉及到铁元素的相关知识和概念,铁的各种重要化合物的相关性质和反应现象,不同铁的化合物的用途。
通过研究铁的化合物的性质和用途,可以使我们从物质类别和元素价态的视角认识物质间的转化关系,深化对物质及其变化多样性的认识。
本节安排了“铁及其化合物的“价----类”二维图”、“补铁剂中铁元素价态检验”这两部分内容。
通过学习这部分知识,学生将学习并掌握铁的氧化物及相关反应;学习并掌握铁盐和亚铁盐及相关反应;学习并掌握铁的氢氧化物及相关反应。
通过本节内容的学习,学生将感受铁元素的多种化合物的不同特性和用途。
并学习到检验溶液中三价铁原子的方法。
宏观辨识与微观探析:从宏观上学习铁的多种化合物的特点和用途,从微观上辨析不同化合物之间的区别与相似点,体会微观粒子的变化对宏观物质的性质的影响。
证据推理与模型认知:通过物质分类的基本模型,理解铁元素的氧化物、氢氧化物和各类铁盐、亚铁盐的区别,通过结合理论与实际感知化学学习的魅力,为后续的化学知识的学习奠定坚实的方法基础。
科学探究与创新意识:熟悉并掌握多种铁的化合物的概念,熟练掌握通过实验分析不同化合物的性质和用途的能力,体会化学研究过程中的科学方法。
科学精神与社会责任:通过对铁单质以及铁的化合物的规律的学习和探究,掌握更高效的学习方法,建立高效学习的科学精神。
重点:学习并掌握铁的氧化物及相关反应;学习并掌握铁盐和亚铁盐及相关反应;学习并掌握铁的氢氧化物及相关反应多媒体、某补铁口服液、稀硫酸溶液、氢氧化钠溶液、酸性高锰酸钾溶液、氯水、硫氰化钾溶液、试管、胶头滴管一、知识回顾1.铁元素可以形成三种氧化物,分别是氧化亚铁(FeO)、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)。
2.铁有两种氢氧化物,氢氧化铁(Fe(OH)3)和氢氧化亚铁(Fe(OH)2)它们可以分别由相对的可溶性盐与碱溶液反应而制得。
必修1_物质转化关系图及相应化学方程式

必修1 物质转化关系图及相应化学方程式一、金属钠及其重要化合物的相互转化(括号内写离子方程式)1、4 Na + O 2 === 2 Na 2O2、2 Na +O 2△Na 2O 23、2 Na +2 H 2O===2 NaOH +H 2↑ (2 Na +2 H 2O===2 Na ++2 OH -+H 2↑)4、Na 2O + H 2O===2 NaOH (Na 2O +H 2O===2 Na ++2 OH -) *5、2Na 2O 2 +2H 2O === 4 NaOH +O 2↑ (2Na 2O 2+2 H 2O =4Na ++4OH -+O 2↑) *6、2 Na 2O 2 + 2 CO 2 === 2 Na 2CO 3+O 27、2 NaOH + CO 2 === Na 2CO 3+H 2O (CO 2+ 2 OH - = CO 32-+H 2O ) 8、NaOH + HCl === NaCl +H 2O (OH — + H += H 2O)9、Na 2CO 3+2HCl =2NaCl +CO 2↑+H 2O (CO -23+ 2H + = CO 2↑ + H 2O )10、NaHCO 3+HCl =NaCl +CO 2↑+H 2O (HCO -3+ H + = CO 2↑ + H 2O )11、Na 2CO 3+CO 2+H 2O= 2 NaHCO 3 (CO 32— + CO 2 + H 2O= 2 HCO 3—)12、NaHCO 3+NaOH =Na 2CO 3+H 2O (HCO -3+OH - = CO -23 + H 2O )2 NaHCO 3△Na 2CO 3+CO 2↑+H 2ONa 2O Na ①NaCl NaHCO 3Na 23Na 2O 2 ② ③ ④ ⑤ ⑥⑦ ⑧ ⑨⑩ ⑾ ⑿二、非金属氯及其化合物的相互转化(括号内写离子方程式)1、H 2 + Cl 2点燃2HCl 2、2Na + Cl 2 点燃2NaCl3、Cu + Cl 2 点燃CuCl 24、2Fe + 3Cl 2点燃2FeCl 35、HCl +AgNO 3 = AgCl↓+HNO 3 (Cl -+Ag +=Ag Cl↓)6、NaCl +AgNO 3 = AgCl↓+NaNO 3 (Cl -+Ag +=AgCl↓)7、CuCl 2+2AgNO 3 = 2AgCl↓+Cu(NO 3)2 (Cl -+Ag +=AgCl↓)8、FeCl 3+3AgNO 3 = 3AgCl↓+Fe(NO 3)3 (Cl -+Ag +=AgCl↓)9、Cl 2 + 2NaOH = NaCl + NaClO + H 2O (Cl 2 + 2OH - = Cl - + ClO - + H 2O) 10、2Cl 2 + 2Ca(OH)2 = CaCl 2+ Ca(ClO)2 +2 H 2O(Cl 2 + 2OH - = Cl - + ClO - + H 2O)11、Cl 2 + H 2O = HCl + HClO (Cl 2 + H 2O = H ++Cl -+ HClO) 12、NaClO +HCl = NaCl + HClO (ClO - +H += HClO)2NaClO+H 2O+CO 2= Na 2CO 3+ 2HClO (2ClO -+H 2O+CO 2= CO 32-+ 2HClO) 13、Ca(ClO) 2+2HCl = CaCl 2 + 2HClO (ClO - +H += HClO)Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO (Ca 2++2ClO -+H 2O+CO 2=CaCO+ 2HClO)14、2HClO 2HCl+O 2↑NaCl 23AgCl⑤ ⑥ ⑦ ⑧光照三、金属铝及其重要化合物的相互转化(括号内写离子方程式)1.4Al +3O 2点燃2Al 2O 3 2.2 Al (OH )3△Al 2O 3 +3H 2O3.2Al +6HCl==2AlCl 3+3H 2↑ ( 2Al +6H +==2 Al 3++3H 2↑) 4.2Al +2NaOH +2H 2O==2NaAlO 2+3H 2↑ (2 Al +2OH -+2H 2O =2AlO 2-+3 H 2↑)5.Al 2O 3+6HCl =2AlCl 3+3H 2O ( Al 2O 3+6H +=2Al 3++3H 2O ) 6. Al 2O 3+2NaOH =2Na AlO 2+H 2O (Al 2O 3+2OH -=2 AlO 2-+H 2O )7、Al (OH )3+3HCl =AlCl 3+3H 2O ( Al (OH )3+3H + = Al 3++3H 2O )8、Al (OH )3+NaOH =NaAlO 2+2H 2O ( Al (OH )3+OH - = AlO 2-+2H 2O )9、实验制取Al (OH )3: AlCl 3+3NH 3·H 2O = Al (OH )3↓+3NH 4Cl (Al 3++3 NH 3·H 2O = Al (OH )3 ↓+ 3NH 4+ )AlAl (OH )3NaAlO 2Al 2O 3AlCl 3①②③④ ⑤ ⑥⑦ ⑧四、金属铁及其化合物的相互转化(括号内写离子方程式)1、3Fe +2O2 点燃Fe3O42、Fe+2HCl=FeCl2+H2↑(Fe+2H+=Fe2++H2↑)Fe+CuCl2=FeCl2+Cu (Fe+Cu2+=Fe2++Cu)3、FeO+2HCl=FeCl2+H2O(FeO+2H+=Fe2++H2O)4、Fe2O3+6HCl=2 FeCl3+3H2O (Fe2O3+6H+=2Fe2++3H2O)5、FeCl2+2NaOH =Fe(OH)2↓+2NaCl (Fe2++2OH-=Fe(OH) 2)↓6、Fe(OH)2 + 2HCl=FeCl2+2H2O(Fe(OH)2+2H+=Fe2++2H2O)7、FeCl3+3NaOH =Fe(OH)3↓+3NaCl ( Fe3++3OH-=Fe(OH) 3↓)8、Fe(OH) 3+3HCl=FeCl3+3H2O (Fe(OH) 3+3H+=Fe3++3H2O)9、2FeCl2+Cl2=2FeCl3 (2Fe2++Cl2=2 Fe3++2Cl—)10、属于化合反应的:Fe+2FeCl3 =3FeCl2(Fe +2 Fe3+=3 Fe2+) 印刷腐蚀电路板:Cu+2FeCl3 =CuCl2+2FeCl2 (Cu+2 Fe3+=Cu2++2 Fe2+)11、2 Fe(OH)3△Fe2O3+3H2O12、白色沉淀,然后迅速变为灰绿色,最后变为红褐色4 Fe(OH)2+ O2 + 2 H2O ═ 4 Fe(OH) 3①Fe3O4②23⑾⑿。
山西省金科大联考2022至2023学年高三上学期11月质量检测化学试题附参考答案

绝密★启用前2022~2023学年度高三11月质量检测化 学全卷满分100分,考试时间90分钟。
注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上,并将条形码结贴在答题卡上的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号,回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结来后,将本试卷和答题卡一并收回。
4.本卷主要考查内容:金属、非金属及其化合物,物质结构元素周期律,化学反应的热效应,化学反应速率与化学平衡。
可能用到的相对原子质量:O 16 Na 23 Cl 35.5 Fe 56一、选择题:本题共14小题,每小题3分,共42分。
在每小题给出的四个选项中,只有一项符合题目要求。
1.近年来我国出土了大量的文物。
下列文物的主要制造原料为合金的是A .秦代青铜甬钟B .汉代陶灯C .五代南汉青瓷盏D .清代玉簪2.下列事实不能用元素周期律解释的是A .稳定性:B .酸性:33NH PH >23HCl H CO >C .氧化性:D .与水反应的剧烈程度:22Cl Br >K Na >3.类推思维是化学分析中常用的一种思维方法,下列类推错误的是A .浓氨水遇浓盐酸产生白烟,浓氨水遇浓硝酸也产生白烟B .是碱性氧化物,FeO 也是碱性氧化物23Fe O C .Fe 与S 共热生成FeS ,Cu 与S 共热也生成CuSD .可用浓硫酸干燥,也可用浓硫酸干燥2CO 2SO 4.合成氨及其相关工业中,部分物质间的转化关系如下:下列说法错误的是A .反应Ⅰ属于人工固氮B .反应Ⅱ、Ⅲ、Ⅳ均属于化合反应C .Ⅴ中发生反应32234NH CO H O NaCl NaHCO NH Cl+++↓+D .流程图中的氮肥和纯碱均属于含有共价键的离子化合物5.三氟化溴有强氧化性和强反应活性,是一种良好的非水溶剂,遇水立即发生反应。
物质的转化规律全解

(5)用含杂质的铁 10 g(杂质不溶于水,也不参加反应)与 100 g 稀硫酸恰好完全 反应, 滤去杂质, 得到滤液质量为 108.1 g, 则含杂质的铁中, 铁的质量分数为__ __。
1. (2014· 天津)某钢铁厂高炉炼铁的主要原料是焦炭、 赤铁矿石(主要含 Fe2O3)、 空气等,主要反应过程如下: 请回答: (1)A 的化学式__CO2__。 高温 2CO__。 (2)反应②的化学方程式__CO2+C===== 高温 2Fe+3CO __。 (3)反应③的化学方程式__Fe2O3+3CO===== 2 (4)向硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,反应停止后过滤, 得到滤渣和滤液。 向滤渣中滴加稀盐酸, 无气泡产生, 则滤渣中一定含有__Ag__(填 化学式),滤液中一定含有的溶质是__Fe(NO3)2__(填化学式)。 (5)用含杂质的铁 10 g(杂质不溶于水,也不参加反应)与 100 g 稀硫酸恰好完全 反应,滤去杂质 ,得到滤液质量为 108.1 g,则含杂质的铁中, 铁的质量分数为 __84%__。
物质的转化规律
一、非金属及其化合物之间的转化
1.非金属单质与其化合物的转化
2.非金属在一定条件下可以转化为相应的化合物,如: 点燃 SO S+O2===== 2 CO2+H2O===H2CO3 SO3+H2O===H2SO4 点燃 CO C+O2===== 2 SO2+H2O===H2SO3 3.某些非金属氧化物可的转化
1.金属单质与其化合物的转化
2.金属单质和非金属单质在一定条件下可以相互反应,生成相应的盐或 金属氧化物。如: △ __FeS__ Fe+S===== △ __2FeCl __ 2Fe+3Cl2===== 3 点燃 __Fe O __ 3Fe+2O =====
新浙教版九年级科学上册习题课件:2.5 物质的转化 第1课时 非金属、金属及其化合物之间的转化

①
A—C 反应的化学方程式
C__+__2_C_u_O__=_高=_=_温=_=_2__C_u_+__C__O_2_↑__(_或__C__O_+__C__u_O_=__=△_=_=_=_C_u__+__C_O__2)__;
② D→F 反应的化学方程式_ _N_a_2_C_O__3_+__C_a_(_O_H__)_2=__=_=_C_a_C__O_3_↓__+______ __2_N_a_O__H__[或__N__a_2C__O__3+__B__a_(O__H__)2_=_=_=_B__a_C_O__3↓___+__2_N_a_O__H_或__K__2_C_O__3+_____ _C__a_(O__H__)2_=_=_=_C__a_C_O__3_↓__+__2_K_O__H__或__K_2_C_O__3_+__B_a_(_O_H__)_2=_=__=_B_a_C__O_3_↓__+___
7.有如下化学反应过程:X―+―H→ClY+―N―aO→HZ――△→X。其中 X 代表的
物质是( D )
A.Mg
B.AgNO3
C.Na2O D.Fe2O3
8.下列物质的制备方案理论上正确的是( C )
A.S加O―2―,→点燃SO3加――H2→OH2SO4 B.C在空―气―中→燃烧CO加――H2→OH2CO3 C.CaO加――H2→OCa(OH)2 溶液加―N―a2→CO3NaOH 溶液 D.Cu加O―2―,→加热CuO加――H2→OCu(OH)2
为反应物,将图中指定序号的转变过程用化学方程式表示。(所写化学方程式
不得重复) 例:①C+O2=点==燃==CO2 ②_ CO2+H2O===H2CO3 __。 ③_Fe+2HCl===FeCl2+H2↑__。 ④_CaO+2HCl===CaCl2+H2O __。 ⑤_Ca(OH)2+2HCl===CaCl2+2H2O __。 ⑥_CaO+H2O===Ca(OH_)2_。 ⑦__3_F_e_+__2_O_2_=_点=_=_燃=_=__F_e_3O__4_____。
北京市昌平区第二中学2022-2023 学年高三上学期期中考试化学试题 附答案

2022-2023学年昌平二中高三化学期中考试试题时间:90分钟 满分:100分一、单选题(本大题共14小题,共42.0分)1.科技助力北京2022年冬奥会.下列变化不属于化学变化的是()A .AB .BC .CD .D2.下列物质的应用中,与氧化还原反应无关的是( ) A .用含23Fe O 的铁矿石冶炼FeB .用22Na O 作潜水艇的供氧剂C .用NaOH 作沉淀剂去除粗盐水中的2Mg+D .以3NH 为原料制备3HNO3.下列有关物质的性质与用途具有对应关系的是( ) A .铝的金属活泼性强,可用于制作铝金属制品 B .氧化铝熔点高,可用作电解冶炼铝的原料 C .氢氧化铝受热分解,可用于中和过多的胃酸 D .明矾溶于水并水解形成胶体,可用于净水4.常温下24N H 为液体,可作为火箭发动机的燃料,与氧化剂24N O 发生反应:2424222N H N O 3N 4H O ++点燃。
分子球棍模型如图所示,A N 为阿伏加德罗常数的值,下列叙述正确的是( )A .32 g 24N H 中含有共用电子对数为A 6NB .标准状况下,22.4 L 24N H 中含有的分子数为A NC .24N H 和24N O 混合的总物质的量为1 mol 时,含氮原子数为A 4ND .上述反应消耗1 mol 24N H ,转移电子数为A 4N 5.下列解释事实的方程式不正确的是( )A .向碳酸氢钠溶液中加入少量石灰水:2332HCO Ca OH CaCO H O -+-++↓+B .呼吸面具中用过氧化钠吸收二氧化碳产生氧气:2222322Na O 2CO 2Na CO O ++C .铝粉和氧化铁组成的铝热剂用于焊接钢轨:23232Al Fe O Al O 2Fe ++高温D .用稀硝酸除去试管内壁上附着的铜:2328H 2NO 3Cu3Cu 2NO 4H O +-++++↑+6.金属及其化合物之间的转化关系是化学学习的重要内容之一,下列各组物质的转化关系中不全部是通过一步反应完成的是( )A .23Na NaOH Na CO NaCl →→→B .()2333Al Al O Al OH AlCl →→→C .()242Mg MgCl Mg OH MgSO →→→D .()()32333Fe Fe NO Fe OH Fe O →→→ 7.下列物质分类正确的是( )A .混合物:空气、盐酸、王水、氯水、水玻璃B .弱电解质:HClO 、32NH H O ⋅、AgCl 、43NH NOC .胶体:分散质粒子直径为1~100 mm 的分散系D .有机物:丙醇、丙酸、1,2-二溴戊烷、碳酸钠8.利用海水提取溴和镁的过程如图,下列说法不正确的是( )A .富集溴元素过程中,空气吹出法利用了溴易挥发的性质B .工业上常利用电解熔融2MgCl 冶炼金属镁C .吸收塔内的反应为22223SO Br 2H O H SO 2HBr +++D .若提取1 mol 2Br ,至少需要标准状况下44.8 L 的2Cl 9.探究亚硝酸钠(2NaNO )的化学性质,实验如下:资料:2AgNO 是淡黄色难溶于水的固体;溶液中3Cr +为绿色. 由上述实验所得结论不正确的是( ) A .2NaNO 溶液显碱性B .可与某些盐发生复分解反应:22NO AgAgNO -++↓C .2NaNO 有氧化性:22222I 2H 2NO I 2NO H O -+-+++↑+D .2NaNO 有还原性:2327232Cr O 3NO 8H 3NO 2Cr 4H O --+-+++++10.有机物X 是医药合成的中间体,其结构如下。
高中化学 金属与非金属的思维导图
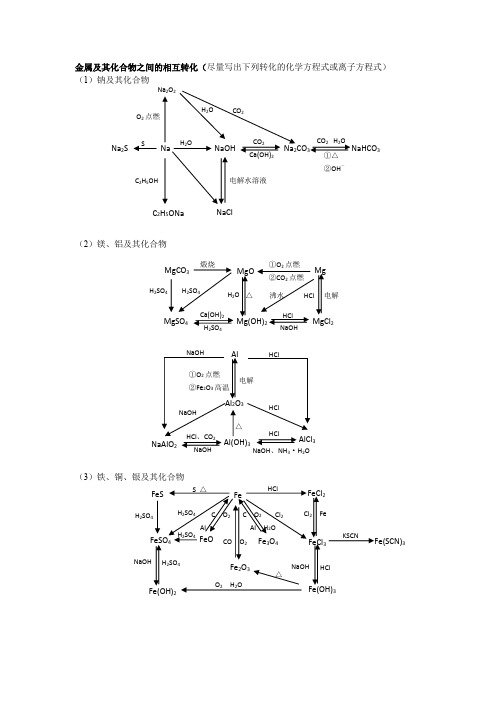
金属及其化合物之间的相互转化(尽量写出下列转化的化学方程式或离子方程式) (1)钠及其化合物(2)镁、铝及其化合物(3)铁、铜、银及其化合物Na Na 2S NaOH Na 2CO 3 NaHCO 3 CO 2 H 2O ①△②OH -CO 2 Ca(OH)2 H 2O SNa 2O 2 H 2O O 2点燃 CO 2C 2H 5ONa NaCl C 2H 5OH 电解水溶液HCl △ Mg MgOMgCO 3 Mg(OH)2 MgCl 2MgSO 4 H 2SO 4 H 2SO 4 H 2SO 4 电解 沸水HClNaOH Ca(OH)2H 2O 煅烧 ①O 2点燃 ②CO 2点燃 Cl 2 Fe FeO H 2SO 4 Cl 2 FeFeCl 2 FeS FeSO 4 Fe 2O 3 FeCl 3Fe(SCN)3 Fe(OH)3 Fe(OH)2 Fe 3O 4 H 2SO 4 H 2SO 4H 2SO 4 HCl NaOH HCl NaOH C O 2 Al H 2O C O 2 AlCO O 2 O 2 H 2O△S △ KSCN Al Al 2O 3 NaAlO 2AlCl 3 Al(OH)3 ①O 2点燃②Fe 2O 3高温电解 NaOH NaOHNaOH NaOH 、NH 3·H 2O HCl HCl HClHCl 、CO 2 △H 2SO 4 △ NaOHFeFe HNO 3Cu H 2SO 4△HNO 3 CuO Cu(OH)2Cu 2OCu(NO 3)2CuSO 4Cu 2S CuSH 2S浓H 2SO 4S 点燃O 2 △CO △ HNO 3 高温 RCHO 水浴加热 AgOHNa 2SS △FeAgAgNO 3Ag 2SAg(NH 3)2OHRCHO 水浴加热Ag 2CO 3AgI AgBr AgClH 2SHNO 3 HNO 3 NH 3·H 2O NH 3·H 2OHCl硅及其化合物之间的相互转化关系氯气及其化合物相互转化关系Cl2PCl 3、PClO 2②点燃NaClAgClNaOH光照3硫及其化合物相互转化关系H3Na SO 4223H 22SO 4O ,燃烧2NaOHO 2BaCl 2H 2O2氮及其化合物相互转化关系NH 4N NO 3243N 23·H 2ONH 4+ OH +H 2,催化剂高温 高压O 2 , 放电2O 2浓H 2SO 4△①浓酸,Cu ②见光或△③C点燃2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6
NaO H 7
4
Na2CO3
9 10
11
8
NaHCO3
2、铝及其化合物之间的转换关系
3.“铝三角”转化关系
4、铁及其化合物间的转化
Fe3O4
Fe
FeCl2
Fe(OH)2
Fe(OH)3
FeCl3
5、铁三角
1.过氧化钠跟足量的NaHCO3混合后,
A_________;B_________;C_________;
D_________;E__________.
3.已知A、B、C是三种常见的单质,其中A为固体, B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶 液呈红褐色;B和C反应的产物极易溶于水得无色 液E.它们之间转化关系如图所示.
(1)写出D和E分别与A反应的离子方程式: D+A: E+A: (2)写出在F中加入NaOH并在空气中放置所发生的反 应的化学方程式:
在密闭容器中充分加热,排除气体物 质后冷却残留的固体物质是( ) A.Na2O2、Na2CO3 B.NaOH、Na2CO3 C.Na2CO3 D.Na2O2、NaOH、Na2CO3
2.图中表示A~E五种物质的转化关系.若
将它们灼烧,火焰都呈黄色;A能跟水起剧 烈反应,D常用作潜水艇里的氧气来源.试 推断A~E各物质(写化学式):
