碳酸钠和碳酸氢钠ppt
2.2.2 碳酸钠和碳酸氢钠的性质与应用 课件(苏教版必修1)

168×31 g 则有:168∶x=62∶31 g,所以 x= =84 g, 62 原混合物中 Na2CO3 的质量 m(Na2CO3)=100 g-84 g = 16 g ; 原 混 合 物 中 NaHCO3 的 质 量 分 数 为 : 84 g w(NaHCO3)= ×100%=84%。 100 g 答案 (1)16 g (2)84%
由于形成 Na2CO3· 2O, 10H 而使溶液中的水减少, 造成 原来的 Na2CO3 再次析出,所以,析出的晶体中所含 Na2CO3 应大于 1.06 g,折合成 Na2CO3· 2O 应大于 10H 2.86 g。
7.某干燥粉末可能由 Na2O2、Na2O、Na2CO3、NaHCO3、 NaCl 中的一种或几种组成, 将粉末与盐酸反应有气体 X 放出, 通过足量的氢氧化钠溶液后体积减小(相同条件 X 下测定), 若将原混合粉末在空气中用酒精灯加热, 也有 气体放出,且剩余固体的质量大于混合粉末的质量,下 列判断正确的是 A.粉末中一定含有 Na2O2、Na2O、NaHCO3 B.粉末中一定不含 Na2CO3 和 NaCl C.粉末中一定不含 Na2O 和 NaCl D.粉末中一定含有 Na2CO3 和 NaCl ( A )
2NaHCO3+Ca(OH)2(少)===CaCO3↓+Na2CO3+2H2O
随堂训练
1.常温下向下列溶液中通入足量的 CO2,有明显变化的是 A. 饱和 Na2CO3 溶液 C.饱和 NaHCO3 溶液 ( A ) B.NaOH 稀溶液 D.CaCl2 溶液
解析
由 于 发 生 下 列 反 应 : Na2CO3 + CO2 +
三、Na2CO3 与 NaHCO3 的相互转化及部分性质比较 (写出实现下列转化的化学方程式)
碳酸钠和碳酸氢钠PPT课件

优点:提高了食盐利用率,缩短了生产流程,减少了对 环境的污染,降低了纯碱的成本,克服了氨碱法的不足
侯侯侯氏德氏制榜制制碱碱碱法法法
侯德榜发明的侯氏制碱法的原理是将二氧化碳通入氨的氯化钠饱和溶液中, 使溶解度较小的碳酸氢钠从溶液中析出。 1、原料: NaCl(饱和)、NH3、CO2等
(2)Na2CO3溶液逐滴加入到稀盐酸中 ①现象:立即有无色气体放出
②原理:CO32- +2H+ =CO2↑+ H2O
NaHCO3的化学性质
盐
NaHCO3
与酸反应
NaHCO3 + HCl == NaCl + H2O + CO2
①与Ca(OH)2反应
与碱反应 ②与NaOH反应
NaHCO3 + Ca(OH)2 == Na2CO3 + CaCO3 + H2O NaHCO3 + NaOH == Na2CO3 + H2O
①CO2 + H2O ②HCl(少量)
Na2CO3
NaHCO3
①
②NaOH
你 明 白 了吗?
1.去污粉中主要含碳酸钠,它为什么能去污? 碳酸钠溶液呈碱性,能和油脂发生反应,生成可溶性物质。 2.碳酸氢钠干粉灭火器中灭火剂主要是碳酸氢钠,加工饼干、 蛋糕等食品时也常用到碳酸氢钠,碳酸氢钠起什么作用?
---------------------
思考:Na长时间暴露空气,最后生成什么物质?
银白色金属钠
O2
表面变暗
H2O 出现白色固体
(Na)
①
(生成Na2O) ②
(生成NaOH)
白色粉末状物质
风化
白色块状物
《碳酸钠和碳酸氢钠》课件

热稳定性
加热时,碳酸氢钠会分 解为碳酸钠、水和二氧
化碳。
与酸的反应
与酸反应放出二氧化碳 气体。
与碱的反应
碳酸氢钠与碱反应,生 成碳酸盐和氢氧化钠。
03
碳酸钠和碳酸氢钠的用途
碳酸钠的用途
玻璃工业
碳酸钠可用于制造平板玻璃、 瓶罐玻璃、光学玻璃等,提高
玻璃制品的硬度和耐用性。
肥皂工业
碳酸钠是生产肥皂的主要原料 之一,能够去除油脂和污垢, 保持皮肤清洁。
化学工业
碳酸钠可用于生产染料、油漆 、油墨等化学品,以及作为催 化剂和溶剂等。
食品工业
碳酸钠可作为膨松剂、面团调 节剂等,提高食品的口感和品
质。
碳酸氢钠的用途
食品添加剂
碳酸氢钠可作为发酵粉、饼干、面包等食品 的膨松剂,增加食品的体积和口感。
清洁剂
碳酸氢钠可用作清洁剂,去除污垢和异味, 保持物品的清洁和卫生。
以碳酸钙、纯碱或氯化钠为原料,与 酸反应制得碳酸氢钠。
气相法
以氯化钠、氨气和二氧化碳为原料, 在高温、加压条件下反应制得碳酸氢 钠。
固相法
将纯碱和氯化钠的混合物加热至高温 ,再与二氧化碳反应制得碳酸氢钠。
碳化法
以石灰石、煤灰或重质碱灰为原料, 与碳酸气反应制得碳酸氢钠。
05
碳酸钠和碳酸氢钠的鉴别方 法
药品
碳酸氢钠可用于治疗胃酸过多、消化不良等 病症,缓解胃痛和不适感。
化工原料
碳酸氢钠可用于生产其他化学品,如醇钠、 丙酮等,以及作为催化剂和溶剂等。
04
碳酸钠和碳酸氢钠的制备方 法
碳酸钠的制备方法
侯氏制碱法
利用氨气、二氧化碳、水和氯化钠为原料,在加压、低温 条件下先制得碳酸氢钠,再通过加热分解碳酸氢钠得到碳 酸钠。
新人教版高中化学必修一第二章第一节碳酸钠与碳酸氢钠ppt

Page 12
H+
H+
2H+
CO2与 NaOH:
CO2 + 2OH - = H2O + CO3 2 -
CO2 + OH - = HCO3 HCO3 - + OH - = H2O + CO3 2 -
盐酸逐滴加入碳酸钠溶液中 CO3 2 - + H+ = HCO3 -
HCO3 - + H+ = H2O + CO2↑
色态
白色粉末
白色细小晶体
溶解性 溶液碱性
热稳定性
与酸反应
与NaOH 反应 相互转化
Na2CO3 > NaHCO3
相同条件下: Na2CO3 > NaHCO3 受热易分解
稳定、不分解 2NaHCO3==Na2CO3+H2O+CO2↑
产生气体较慢
产生气体较快
CO32-+2H+=H2O+CO2↑ HCO3-+H+=H2O+CO2↑
人教版必修一
NaHCO3 小苏打的用途
发酵粉的主要成分
食用治疗胃酸过多
制作泡沫灭火器
Na2CO3 苏打的用途
玻璃纤维 造纸
玻璃制品 制皂
碳酸钠(苏打、纯碱) 碳酸氢钠(小苏打)
白色粉末
白色晶体
2、碳酸钠和碳酸氢钠
名称化学式
碳酸钠(Na2CO3 )
俗称
纯碱、苏打
碳酸氢钠 (NaHCO3 ) 小苏打
① 等质量的碳酸钠和碳酸氢钠与足量的盐酸反应, 碳酸氢钠 放出CO2气体多。
② 泡沫灭火器为什么用碳酸氢钠,而不用碳酸钠?
碳酸钠和碳酸氢钠的区别

碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)碳酸钠(Na2CO3)俗名纯碱,又叫苏打.碳酸氢钠(NaHCO3)俗名小苏打.碳酸钠和碳酸氢钠都属于盐类,但都被用做食用碱.碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)的区别碳酸钠(Na2CO3)碳酸氢钠(NaHCO3)外观白色粉末细小的白色晶体溶解性较大比Na2CO3热稳定性稳定,受热不分解不稳定,受热容易分解溶于水后的酸碱性显较强碱性碱性比Na2CO3碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)的各种化学反应.与盐酸反应:Na2CO3+2HCl=2NaCl+CO2↑+H2ONaHCO3+2HCl=NaCl+CO2↑+H2O与NaOH溶液反应:Na2CO3不与NaOH反应.NaHCO3+NaOH=Na2CO3+ H2O与Ca(OH) 2或Ba(OH) 2反应:Na2CO3+ Ca(OH) 2= CaCO3↓+2NaOHNaHCO3+ Ca(OH)2= CaCO3↓+H2O+NaOHNa2CO3+ Ba(OH)2= BaCO3↓+2NaOHNaHCO3+Ba(OH)2=BaCO3↓+H2O+NaOH与CaCl2或BaCl2反应:Na2CO3+CaCl2= CaCO3↓+2NaClNa2CO3+BaCl2 = BaCO3↓+2NaClNaHCO3不与BaCl2和CaCl2反应Na2CO3和的NaHCO3相互转换向饱和的Na2CO3溶液通入CO2:Na2CO3 + CO2+ H2O =2 NaHCO3加热NaHCO3:2 NaHCO3 == Na2CO3 + H2O + CO2↑鉴别Na2CO3和NaHCO3的方法:①加热固体,产生能使澄清石灰水变浑浊的气体的是NaHCO3②溶解,向水溶液中加入BaCl2或CaCl2,产生沉淀的是Na2CO3CO2气体中混有HCl气体,如何去除杂质?把混合气体通入Na2CO3或NaHCO3溶液中,Na2CO3或NaHCO3与HCl反应生成CO2。
碳酸钠和碳酸氢钠ppt课件

Na2CO3+CO2+H2O=2NaHCO3
思考 向饱和Na2CO3溶液中通入CO2,有什么现象?
归纳总结
物质
颜色状态 溶解性 水溶液酸碱性 热稳定性
与酸反应
主要用途
Na2CO3
白色粉末
NaHCO3
白色细小晶体
都易溶于水,相同温度下,溶解度:Na2CO3 > NaHCO3 溶液均呈碱性,相同浓度时,碱性:Na2CO3 > NaHCO3
Na2CO2CO3 Na₂CO₃+BaCl₂ = BaCO₃↓ +2NaCl
与CaCl2溶液
Na2CO3+CaCl2 = CaCO3 ↓ +2NaCl
NaHCO3
——
——
可用于鉴别Na2CO3与 NaHCO3
Na2CO3与 NaHCO3的相互转化
2NaHCO3 ∆= Na2CO3 + H2O + CO2↑ HCO3- + OH- = H2O + CO32-
焰色试验
钠(元素):黄色
钾(元素):浅紫色
透过蓝色钴玻璃观察
焰色试验是物理变化!
铜(元素):绿色
焰色实验步骤: ① 洗:将铂丝(或光洁无锈的铁丝)用盐酸洗净 ② 烧:将洗净的铂丝在火焰上灼烧至与原火焰颜色一致 ③ 蘸:蘸取试样 ④ 烧:在无色火焰上灼烧,并观察火焰的颜色 ⑤ 洗:再用盐酸洗净铂丝(或铁丝)并在火焰上灼烧至无色
焰色试验
注意事项:
① 焰色试验是物理变化,是金属元素的性质,既可以是单质,也可以是化合物, 如不论灼烧Na2CO3、NaCl、Na2SO4还是钠单质,均发出黄色火焰。 ②用稀盐酸清洗的原因:生成金属氯化物,而金属氯化物再高温时可挥发。 ③并非所有金属元素都能发生焰色反应,如Fe、Pt等金属元素均不发生焰色反应, 故可用铂丝或铁丝来蘸取待测溶液做焰色反应。 ④观察钾的焰色时,必须透过蓝色钴玻璃,以滤去钠的黄光,避免钠盐造成干扰。
碳酸钠与碳酸氢钠一轮复习课件

(6)(2016· 全国卷Ⅰ)用热的烧碱溶液洗去油污,是因为Na2CO3可 直接与油污反应( ) (7)(2016· 全国卷Ⅱ)碳酸氢钠受热分解实验如图乙所示( )
作业:微专题21
谢谢大家,再见.
课堂练习:
(2016江苏高考)根据侯氏制碱原理制备少量 NaHCO3的实验,经过制取氨气、制取NaHCO3、 分离NaHCO3、干燥NaHCO3四个步骤,下列图示 装置和原理能达到实验目的的是( C )
(2)Na2CO3、NaHCO3的用途。P55(自学)
随堂巩固
(1)( 2018江苏)NaHCO3受热易分解,故可用于制胃酸中和剂( ) (2)(2018· 全国卷Ⅱ)碳酸钠溶液可以清洗餐具上的油污。 ( ) (3)(2017· 江苏高考)干燥NaHCO3的方法(见图甲)( ) (4)(2017· 全国卷Ⅱ)将稀盐酸滴入碳酸钠与氢氧化钠混合溶液,立 即产生气泡( ) (5)( 2017天津)为了除去NaHCO3 固体中的Na2CO3,将固体加热 至恒重。 ( )
课堂练习:P56.题组1第1题
3、Na2CO3的工业制备 (1)制备原理:
把二氧化碳通入氨的氯 化钠饱和溶液中,使溶解度 较小的碳酸氢钠从溶液中析 出,过滤得到碳酸钠晶体, 碳酸氢钠受热分解生成碳酸 钠。
侯氏制碱法
NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓ 2NaHCO3
∆
Na2CO3+H2O+CO2↑
与NaOH溶液反应
不反应
OH- + HCO3- = CO32- +H2O
- + 2HCO - = CaCO ↓+ CO 2- + 2 H Ca(OH)2少量:Ca2+ + 2OH 3 3 3 2+ + CO 2- = CaCO Ca ↓ 与Ca(OH) 2+ 3 3 2溶液反应 Ca(OH) 2过量: HCO3 + OH + Ca = CaCO3↓+ H2O
碳酸钠与碳酸氢钠PPT精品课件

碳酸钠和碳酸氢钠
一、物理性质 二、化学性质 三、相互转化 四、用 途
四、用 途
Na2CO3
制玻璃
制肥皂 造纸 纺织等
玻璃制品 肥皂
NaHCO3
发酵剂 灭火剂等
制药
蛋糕
灭火剂
纺织品 中国古代造纸流程
侯氏制碱法
侯德榜,我国著名化工专家。 1921年,侯德榜在美国留学回国,克服了国外技术封 锁,全身心投入制碱工艺和设备的改进上,于1924年8月 正式投产。该法生产的碱,质量优良,纯白如雪,在 1926年获美国费城“万国博览会金质奖章”。 其主要步骤: ①低温下用氨饱和的食盐水通入二氧化碳(CO2) 可析出碳酸氢钠(NaHCO3); ②再将NaHCO3焙烧制得纯碱,CO2循环使用; ③析出小苏打的母液中加入NaCl固体,使NH4Cl 晶体析出,滤液循环使用。最终生产出纯碱和NH4Cl。 这便是举世闻名的“候氏制碱法”,又称联合制 碱法。
答:
(1)从图中看出,全球 水资源利用中,耗水量 最大的是______。
(2)如何解决农业用水 量过大的问题?___ __________。
(3)工业生产节约用水 的措施是:_____ __________。
44g
0.3g
m2
问题2:碳酸氢钠与稀盐酸反应为什么比碳 酸钠与稀盐酸反应剧烈得多?
问题2:碳酸氢钠与稀盐酸反应为什么比碳 酸钠与稀盐酸反应剧烈得多?
探究实验Ⅱ:先用两支试管分别取相同体积相同浓度
的碳酸钠溶液和碳酸氢钠溶液,然后向试管中分别逐滴加
《微专题 碳酸钠与碳酸氢钠的性质与相互转化》示范课教学课件【化学人教版高中必修第一册(新课标)】

一、碳酸钠与碳酸氢钠性质的比较与鉴别
3.下列有关NaHCO3和Na2CO3性质的叙述中正确的是 A.碳酸钠可用于治疗胃溃疡病人的胃酸过多症 B.发酵粉中主要含有碳酸钠,能使焙制出的糕点疏松多孔
√C.在Na2CO3和NaHCO3溶液中滴加澄清石灰水均产生白色沉淀
D.Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应
一、碳酸钠与碳酸氢钠性质的比较与鉴别
5.(2019·新乡高一检测)小苏打和苏打分别和等浓度的盐酸反应,下列说法正确的是 A.Na2CO3与盐酸反应比NaHCO3与盐酸的反应剧烈得多
√B.106 g Na2CO3和84 g NaHCO3与盐酸完全反应,产生CO2的质量相等
C.实验室制取CO2通常用NaHCO3和盐酸反应 D.相同质量的Na2CO3和NaHCO3与盐酸反应完全,耗去盐酸的量一样多
二、碳酸钠与碳酸氢钠的转化与应用
9.A、B、C、D、E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,它 们有如图所示的转化关系:
(1)推断各符号所代表的物质的化学式: A._N__a_,B._N__a2_O__2 ,C._N_a_O__H__,D._N_a_2_C_O__3_,E._N_a_H__C_O_3_。 解析 推断题的关键是找突破口,根据B为淡黄色固体可知B为Na2O2,前后联系 可推知其他物质。
√A.通入二氧化碳气体
B.加入氢氧化钡溶液
C.加入澄清石灰水
D.加入稀盐酸
解析 除杂方法要操作简便、效果好、不引入新的杂质、保留非杂质成分。除去 NaHCO3 溶 液 中 混 有 的 少 量 Na2CO3 可 以 通 入 CO2 : Na2CO3 + H2O + CO2===2NaHCO3↓。
二、碳酸钠与碳酸氢钠的转化与应用
碳酸钠和碳酸氢钠写出离子方程式课件

碳酸氢钠与盐酸反应的离子方程式
$HCO_{3}^{-} + H^{+} = + CO_{2} uparrow +$
04 碳酸钠和碳酸氢钠的应用
在生活中的实际应用
01
02
03
清洁剂
碳酸钠和碳酸氢钠可以作 为清洁剂的主要成分,用 于清洁餐具、浴室、瓷砖 等表面。
05 总结与回顾
对碳酸钠和碳酸氢钠离子方程式的总结
01
碳酸钠的离子方程式
$CO_{3}^{2 -} + 2H^{+} = H_{2}O + CO_{2} uparrow$
02
碳酸氢钠的离子方程式
$HCO_{3}^{-} + H^{+} = H_{2}O + CO_{2} uparrow$
03
总结
溶液中离子存在形式的对比
碳酸钠溶液中,存在$Na^{+}$、$CO_{3}^{2 -}$、 $HCO_{3}^{-}$、$H_{2}CO_{3}$等离子。
碳酸氢钠溶液中,存在$Na^{+}$、$HCO_{3}^{-}$、 $H_{2}CO_{3}$等离子。
与酸反应的离子方程式的对比
碳酸钠与盐酸反应的离子方程式
01
碳酸氢根离子在溶液中的存在形式
碳酸氢根离子(HCO3-)在溶液中可以发生水解和电离 两种反应。
02
水解方程式
HCO3- + H2O → H2CO3 + OH-
03
电离方程式
HCO3- → H+ + CO32-
第二章第一节第3讲 碳酸钠及碳酸氢钠
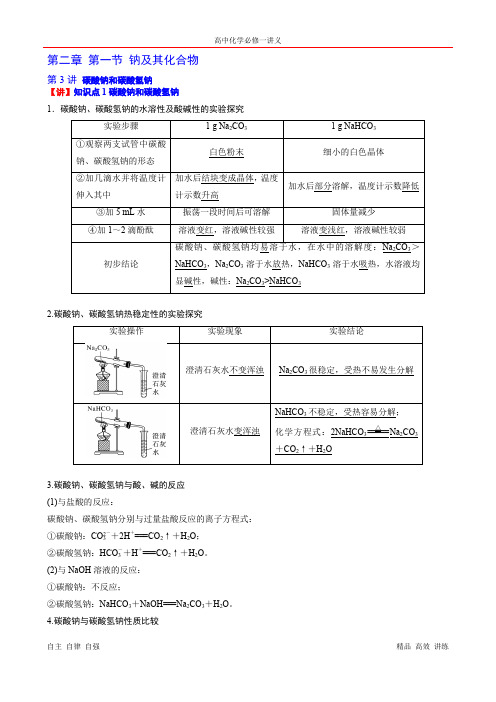
第二章第一节钠及其化合物第3讲碳酸钠和碳酸氢钠【讲】知识点1碳酸钠和碳酸氢钠1.碳酸钠、碳酸氢钠的水溶性及酸碱性的实验探究2.碳酸钠、碳酸氢钠热稳定性的实验探究3.碳酸钠、碳酸氢钠与酸、碱的反应(1)与盐酸的反应:碳酸钠、碳酸氢钠分别与过量盐酸反应的离子方程式:①碳酸钠:CO2-3+2H+===CO2↑+H2O;②碳酸氢钠:HCO-3+H+===CO2↑+H2O。
(2)与NaOH溶液的反应:①碳酸钠:不反应;②碳酸氢钠:NaHCO3+NaOH===Na2CO3+H2O。
4.碳酸钠与碳酸氢钠性质比较【练】1.判断题(1)碳酸氢钠可用于治疗胃酸过多()(2)HCO-3在强酸性、强碱性溶液中均不能大量共存()(3)Na2CO3固体中的NaHCO3可加热除去()(4)Na2CO3、NaHCO3都能与NaOH溶液反应()(5)Na2CO3俗称纯碱,所以Na2CO3属于碱()答案(1)√(2)√(3)√(4)×(5)×2.(1)向Na2CO3溶液中逐滴滴入稀盐酸并振荡,开始几乎无气泡产生,一段时间后有大量气泡产生,试用离子方程式及必要文字解释原因?提示开始盐酸量少,发生反应CO2-3+H+===HCO-3,无气泡,一段时间后当CO2-3完全变成HCO-3后,再滴加盐酸,发生反应HCO-3+H+===H2O+CO2↑,产生大量气泡。
(2)向盐酸中逐滴滴入Na2CO3溶液的现象呢?试用离子方程式及必要文字解释原因?提示开始即有大量气泡,由于盐酸量多,开始直接发生CO2-3+2H+===CO2↑+H2O。
(3)试着利用图像粗略描述上述两种情况,Ⅰ.向Na2CO3溶液中逐滴滴入盐酸,Ⅱ.向盐酸中逐滴滴入Na2CO3溶液。
提示2.根据初中所学CO 2通入澄清石灰水中的现象及反应,联系所学Na 2CO 3、NaHCO 3的性质,思考下列问题。
(1)Na 2CO 3和NaHCO 3相互转化的方法? 提示 Na 2CO 3溶液中通入CO 2①固体加热分解②加NaOH 溶液NaHCO 3(2)能否用加Ba(OH)2的方法鉴别Na 2CO 3、NaHCO 3溶液?试用离子方程式说明原因。
碳酸钠与碳酸氢钠反应

碳酸钠与碳酸氢钠反应
碳酸钠与碳酸氢钠的反应可以看作是两种化合物之间发生的复分解反应。
在水中,碳酸氢钠与碳酸钠可以相互转化。
碳酸氢钠和碳酸钠在水溶液中的反应是可逆的,碳酸氢钠的水解平衡是电离平衡的逆反应,表示生成水解平衡产物和产生氢氧化钠的能力,并且二氧化碳溶于水会产生碳酸氢钠,水解生成碳酸钠,这会进一步增强溶液的碱性。
如果是在常温常压下,反应非常慢,所以日常生活中很少能见到反应的产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Na2CO3 和 NaHCO3 的水溶性
步骤
①(分别取一小 勺药品,加3滴 水振荡,用手摸 试管底部)
Na2CO3 加水结块变为 晶体,放热
振荡时间长时可 溶解
NaHCO3 加水部分溶解, 无明显温度变 化
固体量减小,但 不能全部溶解
② (加6mL水 )
③ (加1~2滴酚 溶液变红(较深) 溶液变微红色 酞)
与碱反应
用途
不反应
制玻璃、肥皂、造纸、纺织等
NaHCO3+ NaOH== Na2CO3+H2O
发酵粉、灭火剂、制药等 End
练习一:
下列物质在酒精灯加热时不发生分解的 是( ) A.NaHCO3 B.KMnO4 C.HNO3 D.Na2CO3
练习二:
关于碳酸盐与碳酸氢盐的说法正确的是 ( ) A.热稳定性:Ca(HCO3)2>CaCO3 B.常温时的溶解度:NaHCO3<Na2CO3 C.等浓度时溶液的pH:KHCO3>K2CO3 D.等质量时与酸反应耗酸量KHCO3=CaCO3
碳酸钠和碳酸氢钠
碳酸钠和碳酸 氢钠的用途有哪些? 你们都知道吗?
江苏省苏州中学
一、碳酸钠与碳酸氢钠的用途
碳 酸 钠 的 用 途
玻璃纤维
玻璃制品
制皂
造纸
3 15:58
江苏省苏州中学
一、碳酸钠与碳酸氢钠的用途
碳 酸 氢 钠 的 用 途
发酵粉的主要成分
制作泡沫灭火器
食用治疗胃酸过多
4 15:58
江苏省苏州中学
练习三:
下列有关NaHCO3与Na2CO3的性质说法中, 正确的是( ) A.往两者饱和溶液中通入CO2,最终会形成 澄清溶液的是NaHCO3 B.除去碳酸氢钠固体中混有的少量碳酸钠可 以采用加热的方法 C.碳酸钠与盐酸反应放出二氧化碳的剧烈程 度强于碳酸氢钠 D.二者配成溶液,再加入石灰水,无白色沉 淀生成的是NaHCO3
溶解性
热稳定性
易溶(溶液呈碱性) 较易溶(溶液呈碱性) 热稳定性:Na2CO3 > NaHCO3 2NaHCO3==Na2CO3+ CO2 ↑+H2O
——
与酸反应的 快慢、离子 方程式
NaHCO3 比Na2CO3快 Na2CO3+2HCl= 2NaCl+H2O+CO2↑ NaHCO3+HCl= NaCl+H2O+CO2↑
End
区别Na2CO3和NaHCO3的方法:
① 加热
加热固体,产生能使澄清石灰水 变浑浊的气体的是NaHCO3
②滴入CaCl2 或BaCl2溶液
产生白色沉淀的是Na2CO3
③逐滴滴 首先产生气体且反应较剧烈 入稀盐酸 的是NaHCO 3
End
思考:
1、在Na2CO3饱和溶液中通入CO2 后会有什么现象呢,原因是什么?
[解析] 有沉淀析出Fra bibliotek1 、将 CO2 通入 Na2CO3 溶液中,发生如下反 应: Na2CO3+H2O+CO2=2NaHCO3
2、生成的NaHCO3的溶解度比Na2CO3的 溶解度小。
名称 化学式
碳酸钠 Na2CO3 苏打、纯碱 白色粉末
碳酸氢钠 NaHCO3 小苏打 白色细小晶体
俗名 色、态
二、碳酸钠和碳酸氢钠的物理比较
物质 俗名 摩尔质量g/mol 颜色、状态
碳酸钠 纯碱、苏打 106 白色粉末
碳酸氢钠 小苏打 84
细小白色晶体
5 15:58
碳酸钠和碳酸氢钠的 化学性质又是怎样的呢?
让我们一起来进入实验探究。
科学探究1
Na2CO3 和 NaHCO3 的水溶性
根据实验, 我们得出什 么样的结论 呢?
初步结论
1:水溶性: Na2CO3﹥ NaHCO3, Na2CO3溶于水放热。 2: Na2CO3 和 NaHCO3 的水溶液均为碱性, 且碱性: Na2CO3 ﹥ NaHCO3
科学探究2
Na2CO3 和 NaHCO3 的热稳定性
你们能想 出什么方法 来探究它们 的稳定性呢?
实验结果
现象 发生反应的化学方程式 结论
澄清的 Na2CO3 石灰水 不浑浊
受热不 易分解
澄清的 2NaHCO = Na CO 受热 3 2 3 NaHCO3 石灰水 +H2O +CO2↑ 易分解 变浑浊
科学探究3
把Na2CO3和NaHCO3分别与稀 盐酸中,会有什么现象?为什么?
步骤:在两根试管中分别加入2mL稀盐酸, 将等量(1/3药匙)的Na2CO3和NaHCO3加 入试管中,注意:比较反应的剧烈程度。
练习四:
能用来鉴别Na2CO3和NaHCO3两种白色固体 的方法是( ) A.分别放入水中,观察溶解速率 B.分别取少量加入到石灰水中,观察有无沉淀 生成 C.分别取少量溶于水后,滴入HCl溶液观察有无 气体生成 D.分别取少量溶于水后,滴入CaCl2溶液观察有 无沉淀生成
练习五:
下列有关碳酸钠与碳酸氢钠的说法中不正确 的是( ) A.都可与盐酸反应放出二氧化碳 B.都可与澄清石灰水反应产生白色沉淀 C.用酒精灯加热时,两者都不分解 D.相同温度时,碳酸氢钠的溶解度小于碳酸钠
Na2CO3与NaHCO3和盐酸的反应 实验: 现象:
分析:
(2) Na2CO3 和 NaHCO3 与酸的反应
Na2CO3+2HCl = CO2↑+H2O+2NaCl
NaHCO3+HCl = CO2↑+H2O+NaCl
(3) Na2CO3 和 NaHCO3 与碱的反应
End
如何鉴别
Na2CO3、NaHCO3?
