Product_Preparation_Process翻译版本
GMP词汇常规翻译

GMP词汇一更衣室 Changing Room一更 First Changing Room手消室 Hands Disinfection Room气闸室 Airlock Room洁具室 Cleaning Tools Room清洗室 Cleaning Room模具室 Dies Room内包装室Immediate Package Room安全门 Emergency Door外包清室Outer Package Removing Room 存料间 Storage Room of Raw Materials 粉碎室 Pulverizing Room备料室 Materials Preparing Room硬胶室 Hard Capsules Filling Room软胶室 Soft Capsules Room制粒干燥室 Granulating and Drying Room 总混间 Blending Room中间站 Intermediate Station压片室 Tablets Room Compression Room 包衣室 Coating Room配浆间 Coating Mixture Preparing Room 铝塑包装间 Packing Room传递窗 Transferring Window外包装室Outer Packing Room蒸馏水室Water Purifying Room质检室 Quality Control Room浓配室 Concentrated Solution Room 稀配室 Diluted Solution RoomBATCH PRODUCTION:批量生产;分批生产BATCH PRODUCTION RECORDS:生产批号记录POST-OR PRE- MARKET SURVEILLANCE:销售前或销售后监督INFORMED CONSENT:知情同意(患者对治疗或受试者对医疗试验了解后表示同意接受治疗或试验)PRESCRIPTION DRUG:处方药OTC DRUG(OVER—THE—COUNTER DRUG):非处方药U.S.PUBLIC HEALTH SERVICE:美国卫生福利部药品制备preparation of drug products针对 pertain to人用生物制品 biological products for human use补充 supplement代替条例supersede the requlation提议免除proposed exemption一般销售和消费 ordinarily marketed and consumed美德,优点,效力 virtue联邦注册表 FR/federal register人用物品 human foods用于鉴别,测定 shall be applied in determining生产,加工,包装,贮存 manufacture,process,pack,hold,职责和权力responsibility and authority批准和拒收 approve or reject/withhold复查生产记录review production records对qc来说可以获得的shall be available to QC适当的 adequate效价和含量 strength提供证明文件 shall be documented符合 conform to制订完善 sound每装货量 each shipment变质的is subject to deteriorationaccommodation (车,船,飞机等的)预定铺位批号 batch有害微生物 objectionable microorganism联合批号 the number of units准确性,灵敏性,特异性,重复性accuracy, sensitivity, specificity, and reproducibility特征,属性attribute配伍reconstitution设计 project顺势治疗药品 homeopathic drug products可配伍性compatibility标明 purporting to应成文并遵循shall be in writing and shall be followed.可检出水平 detectable levels通过参考文献具体化 incorporated by reference副作用 adeverse/side effect类型 type混放 mixups签收 receipt处理 disposition正压下过滤 be filtered under positive pressure层流或非层流laminar or nonlaminar;无菌环境aseptic conditions照明 lighting通风、空气过滤、空气加热与冷却 Ventilation, air filtration, air heating and cooling. 空气输送系统 Air-handling systems附近建筑物immediate premises专用毛巾 single-service towels进料 Charge-in标示量或规定量labeled or established amount实际产量 Actual yields理论产量 theoretical yields生产周期 the production of a batch of a drug product药品的一致性和完整性uniformity and integrity of drug products崩解时间 Disintegration time溶液的澄明度、溶解完全性及pH值 Clarity, completeness, or pH of solutions稳定性评估 variability estimates装卸 handlingNIH(NATIONAL INSTITUTE OF HEALTH):(美国)全国卫生研究所CLINICAL TRIAL:临床试验ANIMAL TRIAL:动物试验ACCELERATED APPROVAL:加速批准FDA(FOOD AND DRUG ADMINISTRATION):(美国)食品药品管理局IND(INVESTIGATIONAL NEW DRUG):临床研究申请(指申报阶段,相对于NDA而言);研究中的新药(指新药开发阶段,相对于新药而言,即临床前研究结束)NDA(NEW DRUG APPLICATION):新药申请ANDA(ABBREVIATED NEW DRUG APPLICATION):简化新药申请EP诉(EXPORT APPLICATION ):出口药申请(申请出口不被批准在美国销售的药品)TREATMENT IND:研究中的新药用于治疗ABBREVIATED(NEW)DRUG:简化申请的新药DMF(DRUG MASTER FILE):药物主文件(持有者为谨慎起见而准备的保密资料,可以包括一个或多个人用药物在制备、加工、包装和贮存过程中所及的设备、生产过程或物品。
Lenovo_QSA中英文对照

Supplier Quality System Assessment 供应商质量体系评估Section 1: Quality Management System 质量管理体系1. Quality Function, ISO standard & Responsibilities 质量机能,ISO标准&职责2. Internal Audits Quality System and other Compliance 内部稽核质量体系和其他3.Training for all Level of Organization 对组织各层次的训练Section 2: Resource Management and Capacity Planning 资源管理和能力培训4. New Product Introduction and Qualification Process 新产品介绍和承认过程5. Capacity Planning 能力培训6. Change Management Process, Product and Material 管理过程,产品和物料变更7. Process Capability / Process Characterization 制程能力和制程关键特性8. Product & Process Quality Metric Review 产品&过程的质量基准检讨9. Customer and Field Performance Quality Data 客户和现场性能质量数据10. Quality Data and Communication 质量数据和传达Section 3: Production Process生产过程11.Calibration System and Control校验系统和控制12. Measurement System Analysis (Gauge R and R)量测系统分析13. Control & Disposition of Non-conforming Material 不合格物料的控制和处理14. Receiving Material Quality System and Procedure进料质量系统和控制15. Work Instructions for Manufacturing Processes 作业指导书和制造过程16. Final Inspection and Acceptance Procedure 终检和允收程序17. Packaging, Storage, Shipping, Material Handling and Bar Code Requirements 包装,储存,运输,物料搬运和Bar code要求18. Housekeeping, POPI(protection of proprietary information 知识产权保护) and Preventive Maintenance Housekeeping,知识产权和预防性的保持Housekeeping19. Out of Control Actions for an Internal Defect for Mfg/Assembly/Service Site制造/组装/服务地点内部缺陷失控的措施Section 4: Sub-Tier Quality Control and Quality Improvements质量控制和质量改进20. Sub-Tier Supplier Selection and Management供货商的选择和管理21. Sub-Tier Supplier Corrective and Preventative Action供货商的纠正和预防措施22. Process Flow, FMEA, Control Plan and Statistical Tool 流程,FMEA,控制计划和统计工具23. Statistical Methods / SPC on Box X Dimensions 统计方法/ box X 尺寸SPC24. Problem Solving Techniques 问题解决技术25. Continuous Improvement and Mistake Proofing 持续改进和缺点预防Use the ED12695 Quality System Assessment Scoring Form to document the results of the audit and any required actions.Rating:SCORE 1: Unacceptable - This e lement is not included in the organization’s quality management system.无法接受 - 这个要素没有被组织的质量管理体系所包涵SCORE 2: Unacceptable - Both planning and execution for this element require substantial improvement.无法接受 - 这个要素的计划和执行都需要进一步改进SCORE 3: Marginally Acceptable - This element is included in the supplier’s quality management system and planning is adequate. However, execution requires improvement.边缘接受 - 此要素包含于供货商的质量体系,计划比较完善。
Product Preparation Process Training

• During design stages, clear view of product manufacturability should be present, otherwise, we will be manufacturing the same way we have done before.
Post on Wall/Board Resist the Urge to Examine the Existing Process. This will only Create a Bias and Stifle Creativity.
Production Preparation Process
Important things to remember:
• Every product delivery process step is equally important.
• The objective is not to design products but to design, build and deliver quality products that can be manufactured at the appropriate cost and level of conformity.
C) Design mistake proof production and delivery processes.
D) Guarantee that production and delivery processes are capable to meet Takt time and to eliminate waste (Muda), unevenness (Mura) and unreasonableness (Muri).
信息工程专业英语术语

信息工程专业英语术语(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如职场文书、合同协议、总结报告、演讲致辞、规章制度、自我鉴定、应急预案、教学资料、作文大全、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, our store provides various types of classic sample essays for everyone, such as workplace documents, contract agreements, summary reports, speeches, rules and regulations, self-assessment, emergency plans, teaching materials, essay summaries, other sample essays, etc. If you want to learn about different sample essay formats and writing methods, please stay tuned!信息工程专业英语术语20XX信息工程专业英语术语信息工程专业是建立在超大规模集成电路技术和现代计算机技术基础上,研究信息处理理论、技术和工程实现的专门学科。
制药工程专业英语课文翻译

Unit 1 Production of DrugsDepending on their production or origin pharmaceutical agents can be split into threegroups: I .Totally synthetic materials synthetics,Ⅱ.Natural products,and Ⅲ.Products from partial syntheses semi-synthetic products.The emphasis of the present book is on the most important compounds of groups I andⅢ一thus Drug synthesis. This does not mean,however,that natural products or otheragents are less important. They can serve as valuable lead structures,and they arefrequently needed as starting materials or as intermediates for important syntheticproducts.Table 1 gives an overview of the different methods for obtaining pharmaceuticalagents.1 单元生产的药品其生产或出身不同药剂可以分为三类:1。
完全(合成纤维)合成材料,Ⅱ。
天然产物,和Ⅲ。
产品从(半合成产品)的部分合成。
本书的重点是团体的最重要的化合物Ⅰ和Ⅲ一所以药物合成。
这并不意味着,但是,天然产品或其他代理人并不太重要。
它们可以作为有价值的领导结构,他们常常为原料,或作为重要的合成中间体产品的需要。
体外诊断试剂注册 中英文对照
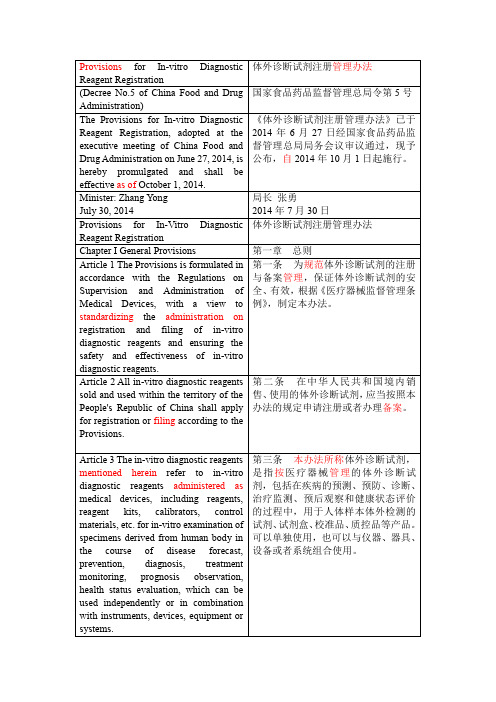
体外诊断试剂注册管理办法
(Decree No.5 of China Food and Drug Administration)
国家食品药品监督管理总局令第5号
The Provisions for In-vitro Diagnostic Reagent Registration, adopted at the executive meeting of China Food and Drug Administration on June 27, 2014, is hereby promulgated and shall be effectiveas ofOctober 1, 2014.
境内第一类体外诊断试剂备案,备案人向设区的市级食品药品监督管理部门提交备案资料。
Class II in-vitro diagnostic reagents shall be reviewed by the food and drug regulatory department of the provinces, autonomous regions and municipalities directly under the central government, and themedical device registration certificateshall be issued after approval.
香港、澳门、台湾地区体外诊断试剂的注册、备案,参照进口体外诊断试剂办理。
Article 7 Where aregistration applicantor filing entityof an in-vitro diagnostic reagent brings the products to the marketin his own name,he shallproduct.
制药工程专业英语 Unit 13 课文翻译

Unit 13 Sterile ProductsSterile ProductsSterile products are dosage forms of therapeutic agents that are free of viable microorganisms. Principally,these include parenteral,ophthalmic,irrigating preparations. Of these, and parenteral products are unique among dosage forms of drugs because they are injected through the skin or mucous membranes into internal body compartment. Thus,because they have circumvented the highly efficient first line of body defense,the skin and mucous membranes,they must be free from microbial contamination and from toxic components as well as possess an exceptionally high level of purity. All components and processes involved in the preparation of these products must be selected and designed to eliminate,as much as possible,contamination of all types,whether of physical,chemical,or microbiologic origin.Preparations for the eye, though not introduced into internal body cavities,are placed in contact with tissues that are very sensitive to contamination. Therefore,similar standards are required for ophthalmic preparations).Irrigating solutions are now also required to meet the same standards as parenteral solutions because during an irrigation procedure,substantial amounts of these solutions can enter the bloodstream directly through open blood vessels of wounds or abraded mucous membranes. Therefore,the characteristics and standards presented in this chapter for the production of large-volume parenteral solutions apply equally to irrigating solutions. Sterile products are most frequently solutions or suspensions,but may even be solid pellets for tissue implantation. The control of a process to minimize contamination for a small quantity of such a product can be achieved with relative ease. As the quantity of product increases,the problems of controlling the process to prevent contamination multiply. Therefore,the preparation of sterile products has become a highly specialized area in pharmaceutical processing. The standards established,the attitude of personnel,and the process control must be of a第13 单元无菌产品无菌产品无菌产品是不含微生物活体的治疗剂剂型,其主要包括非肠道用的、眼用的和冲洗用的制剂。
Manufacturing Process生产过程管理程序(中英文)
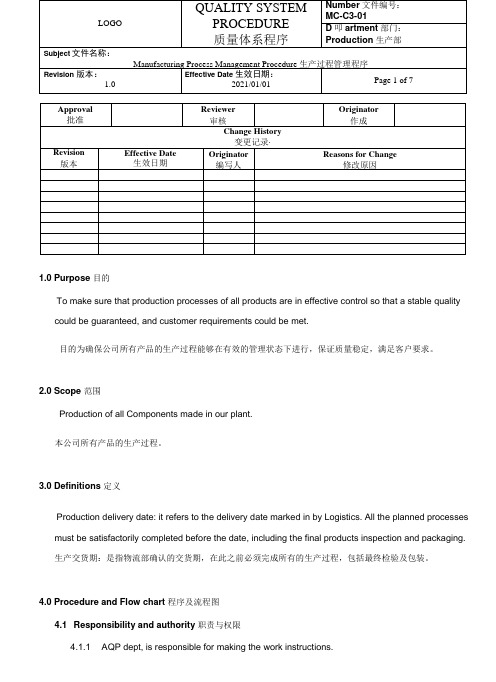
1.0 Purpose 目的To make sure that production processes of all products are in effective control so that a stable quality could be guaranteed, and customer requirements could be met.目的为确保公司所有产品的生产过程能够在有效的管理状态下进行,保证质量稳定,满足客户要求。
2.0 Scope 范围Production of all Components made in our plant.本公司所有产品的生产过程。
3.0 Definitions 定义Production delivery date: it refers to the delivery date marked in by Logistics. All the planned processes must be satisfactorily completed before the date, including the final products inspection and packaging.生产交货期:是指物流部确认的交货期,在此之前必须完成所有的生产过程,包括最终检验及包装。
4.0 Procedure and Flow chart 程序及流程图4.1 Responsibility and authority 职责与权限4.1.1 AQP dept, is responsible for making the work instructions.项目部负责作业指导书制定。
4.1.2 Process engineer and quality engineer are responsible for making the inspection instructionof production working procedure, and also responsible for planning reference points ofdifferent working procedure.工艺工程师与质量工程师负责制订生产过程工序检验指导书和过程检验标准,并负责策划各工序控制点以及生产工艺流程。
美国cGMP-中英文对照

PART 210 CURRENT GOOD MANUFACTURING PRACTICE IN MANUFACTURING, PROCESSING, PACKING, OR HOLDING OF DRUGS;GENERAL210部分有关于生产、加工、包装和药品的储存的现行GMP —般准则Sec. 210.1 Status of current good manufacturing practice regulations.(a) The regulations set forth in this part and in parts 211 through 226 of this chaptercontain the minimum current good manufacturing practice for methods to be used in, and the facilities or controls to be used for, the manufacture, processing, packing, or holding of a drug to assure that such drug meets the requirements of the act as to safety, and has the identity and strength and meets the quality and purity characteristics that it purports or is represented to possess.(b) The failure to comply with any regulationset forth in this part and in parts 211 through 226 of this chapter in the manufacture, processing, packing, or holding of a drug shall render such drug to be adulterated undersection 501(a) (2)(B) of the act and such drug, as well as the person who is responsible forthe failure to comply, shall be subject to regulatory action.(c) Owners and operators of establishments engaged in the recovery, donor screening, testing (including donor testing), processing, storage, labeling, packaging, or distributionof human cells, tissues, and cellular andtissue-based products (HCT/Ps), as defined in 1271.3(d) of this chapter, that are drugs (subject to review under an application submitted under section 505 of the act or under a biological product license application under section 351 of the Public Health Service Act), are subject to the donor-eligibility and applicable current good tissue practice procedures set forth in part 1271 subparts C and D of this chapter, in addition to the regulations in this part and in parts 211 through 226 of this chapter. Failure to comply with any applicable210.1 cGMP 的法规地位。
制药专业英语原文翻译

1、Digitalis is one of the most frequently used medications in the treatment of heart failure and arrhythmia. It increases the contractility of the heart muscle and modifies vascular resistance. It also slows conduction through the atrioventricular node in the heart, making it useful in the treatment of atrial fibrillation and other rapid heart rhythms洋地黄是其中一个最常用的药物治疗心力衰竭和心律失常。
它增加了的心肌收缩血管阻力和修改。
它也减慢传导通过传导节点的心使它有用的治疗房颤和其他快速心律2、The formulation of a parenteral product involves the combination of one or more ingredientswith a medicinal agent to enhance the convenience,acceptability,or effectiveness of the product. Rarely is it preferable to dispense a drug singly as a sterile dry powder unless the formulation of a stable liquid preparation is not possible非肠道用产品的配方涉及一个或者更多组成部分间的结合,这些组成部分(各自)都含有一种用以提高产品方便性、可接受性或者疗效的有效成分。
3P(生产准备流程)博文 from KICG

By Jon Miller Amy 翻译
采用生产准备流程(3P)的 5 大原因
发布人: Kai | 评论: 1
上周我们有机会为一家汽车制造商作关于生产准备流程(3P)及采用它的 5 大理由的演示。我 们讨论采用生产准备流程对削减供应链整体成本的影响,同时对供应商开发也有相当的好处,因 为生产准备流程的实践改善是重新评估生产流程和产品设计流程。3P 有助于构建对精
被选择的方案是按照精益生产方式来设计,设计过程确保精益原则不被破坏。按照这样的准备, 设备的设计和建造也是依照标准作业文件而成。
生产准备流程和早期传统选择单个设计然后“丢给下一部门”方式完全不同。传统的方式无法确保 投产后流程能力能够满足要求,同时设计产能也无法在投产开始阶段达到,虽然设计了作业单元 但其物流没有仔细考虑,作业指导没有完成,目标成本无法达到等等。
在我们开始讨论采用生产准备流程的 5 大理由之前,我和可能对 3P 不熟悉的读者分享一下什么 是生产准备流程(3P)。
生产准备流程(3P)是整体精益设计方法中的一部分,即采用跨职能团队方式去改善新系统中 的任何缺陷,其中包括质量功能展开(QFD)、设计评估和投产后跟踪。生产准备流程的好处 在于采用跨职能团队方式、快速测试建议方案和在流程与产品设计中嵌入精益制造原则。
大多数企业采用 3P 解决这些问题中的某一个。有些企业用于降低设备成本,或重新设计流程实 现单件流。如果企业面临上述的问题,可制定相关政策如果有下列 5 大原因的任何一个,即可 采用生产准备流程:
1. 新产品开发. 在尽可能早的阶段让设计者学习精益。 2. 资本性投资设备审批. 没有实施 3P 之前,不要签署任何资本性设备投资审批。 3. 产品设计变更. 在没有进行 3P 评估之前,不要批准任何产品变更。 4. 产量面临巨大的改变. 如果还没有采用精益设计生产流程,这是第二次机会。 5. 工厂搬迁. 如果打算搬迁工厂,你最好先进行流程精益化。
包装文字对照翻译

Warning Statement警告Important Notice : Breast Milk is best for Babies. Before you decide to use this product, consult your doctor or Health worker for Advice.重要提示:母乳是婴儿最好的食品。
在使用本产品前,请咨询您的医生或健康工作者。
Warning : Following instructions exactly. Prepare Bottles, teats and water as directed. Do not change prposortions of powder except on medical advice. Incorrect preparation can make your baby very ill. Infant over 67 months should be offered solid food in addition to this product.警告:严格遵照指导。
按照图示准备奶瓶和奶嘴。
不要改变奶粉的比例,除非有医嘱。
不正确的奶粉准备可能会使你的宝宝严重不适。
6-7个月婴儿食用本产品时,应辅助添加固体食物。
(应配合添加辅助食品)Manufacture生产商Manufactured by Blend and Pack 6-7 Colrado Crt Hallam, Australia, Reg Est 7278Trade Description产品说明Is the product a Infant Formula, Toddler Formula, or Grow up Formula.本产品为婴幼儿配方奶粉。
Preparation Guide冲调及使用说明As per Current按照当前的就可以Feeding Table喂哺表As per Current按照当前的表就可以Storage Statement贮藏说明Product is to be stored in a cool,dry environment. Use contents within 4 weeks of opening.产品应贮藏在阴凉、干燥处。
APQP新产品开发程序(中英文)

1.0 PURPOSE 目的1.1 The procedure defines the method to assure that the product satisfies the customers.定义公司内产品实现所策划的步骤及执行情况,以保证产品满足客户的要求。
2.0SCOPE 范围2.1 Apply to all of new projects and new products in MAMKo适用于公司所有新产品和新项目。
3.0 DEFINITIONS 定义3.1 Product Quality Planning is a structured method of defining and establishing the steps necessaryto assure that a product satisfies the customers.产品质量策划是一种结构化的方法,用来确定和制定确保某产品使顾客满意所需的步骤。
4.0 REFERENCE DOCUMENTS 参考文件4.1 APQP Manual APQP 参考手册4.2 PD-C2-03 Production Part Approval Process 生产件批准程序5.0 RECORDS 记录5.1 APQP Schedule项目开发计划5.2 New project Development Review Report 新项目开发评审表5.3 Team feasibility commitment 小组可行性承诺5.4 Part Submission Warrant 零件提交保证书5.5 Product quality planning summary 产品质量策划总结6.0 RESPONSIBILITY 职责6.1 Program manager as project leader, set up APQP team, launch and control new projects.项目经理作为项目的主导,负责成立APQP小组,开展并跟踪项目。
英文产品编译流程

英文产品编译流程The product compilation process in English involves several key steps.1. Market Research: The first step in product compilation is conducting market research to identify consumer needs, preferences, and trends. This helps in determining the demand for certain products and potential opportunities in the market.2. Idea Generation: After conducting market research, the next step is to generate ideas for new products or improvements to existing products. This can be done through brainstorming sessions, customer feedback, or collaboration with product development teams.3. Concept Development: Once ideas are generated, the next step is to develop concepts for the product. This involves creating sketches, prototypes, or mock-ups to visualize the product and its features.4. Design and Engineering: After finalizing the concept, the product design and engineering phase begins. This involves creating detailed specifications, CAD drawings,and prototypes to ensure the product meets quality and performance standards.5. Manufacturing: Once the design is finalized, the product moves into the manufacturing phase. This involves sourcing materials, setting up production processes, and testing prototypes to ensure quality control.6. Marketing and Sales: After manufacturing, the product is ready to be marketed and sold to consumers. This involves creating marketing campaigns, packaging designs, and distribution strategies to reach the target audience.7. Launch and Feedback: The final step in the product compilation process is the launch of the product in the market. This involves monitoring sales, collecting customer feedback, and making improvements based on consumer reactions.产品编译流程包括几个关键步骤。
典型工艺流程翻译

典型工艺流程翻译典型工艺流程(Typical Technological Process)工艺流程(Technological Process)是指对于某一产品或工件的生产过程进行合理组织和安排的步骤集合。
以下是一个典型的工艺流程的翻译。
一、加工准备(Preparation)在进行加工之前,需要对设备和原材料进行准备。
首先,检查设备是否正常运行,并且准备好所需要的刀具和工装。
同时,还需要对原材料进行检查和分类,以确保质量符合要求。
二、加工工序(Machining Process)1. 下料(Blanking)首先,根据产品的尺寸要求,将原材料锯开或者剪开成适当的尺寸。
2. 开粗车削(Rough Turning)将下料得到的工件固定在车床上,进行开粗车削。
通过以较高的切削速度和深度进行车削,去除工件表面的不必要材料,并使其接近最终尺寸。
3. 精细车削(Finishing Turning)在进行开粗车削后,需要进行精细车削。
通过降低切削速度和深度,使工件表面更加光滑,并确保尺寸精确。
4. 镗削(Boring)有时候,需要在工件上制造大小和形状符合要求的孔洞。
通过镗削工序,使用特殊刀具在工件上加工出孔洞。
5. 攻丝(Tapping)如果工件需要有螺纹结构,那么就需要进行攻丝。
在攻丝过程中,使用攻丝刀具在孔洞中切削出螺纹。
三、表面处理(Surface Treatment)在加工过程中,往往需要进行表面处理,以改善产品的表面质量和性能。
常见的表面处理方法包括镀铬、电镀、喷涂等。
四、组装(Assembly)当所有工序完成后,需要对各个零件进行组装,形成成品。
在组装过程中,需要按照设计要求正确连接各个零件,并且进行紧固,焊接或者胶合等操作。
五、质量检验(Quality Inspection)在完成组装后,需要对成品进行质量检验。
通过使用各种检测设备和工具,确保产品的质量符合要求。
六、包装和运输(Packaging and Transport)最后,对质量合格的产品进行包装。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
产量变化方式
①
现阶段
制造成本
过程分割与整合 产量
固定的制造成本
变动的生产
L型工程的实际产量与生产能力
4.0
提示
实际产量 生产能力
31,000 27,300
3.5
10000/月 3.0 2.5
22,600
生产数量
2.0
15,500
18,600 16,900 20,600
1.5 1.0
6,200
0.5 0
零件的设计或 再设计
产品设计3P
制造 过程 准备.
生产准备过程
将品质贯彻于我们的生产系统
1. 定义功能
活动的主题和范围是什么?
功能
1. 点 3P 2. 线/工位 3P 3. 工厂范围 3P
贴在墙上或黑板上
抵制对现有流程的检查,只会形成偏见,抑制创造力.
生产准备过程
将品质贯彻于我们的生产系统
2. 确定功能的本质
在建立提案之前,建立一目了然的过程单.
7
Designs
Moonshine
快速地使用可利用的原料完成你的模型, 不要把这一步搞得过于复杂.
生产准备过程
将品质贯彻于我们的生产系统
8. 进行实验和试验,收集真实数据
每一项设计与标准的差异是如何产生的?
收集真实的数据
记录
数据
即使你的模型并不完美,但它能给你的改进提供资料。
生产准备过程
16 条标语 1. 生产准备越快越好.
生产准备过程
16 条标语
2.线体及设备的建设要能够支撑生产原料的快速流动.
标准作业
① ② ③ ④
进
出
原料
生产准备过程
16 条标语 3.适度的附加设备,不需要像战舰一样庞大.
生产准备过程
16 条标语 4.设备应当容易快速切换.
转换型号时的流动缺口 5 4 老产品 5 3 2 5 4
当客户一天只要1个产品时,不要一次性花7天生产7个.
1 Day
1 Day
节拍= 1 天
生产准备过程
16 条标语 13. 建立模具、机器的快速设置、快速换型机制.
灵活地移动位置
生产准备过程
16 条标语
14.连接机器使工件平滑流动,避免半成品过多。
哇! 不能有更多的半成品 五件 就是标准
5
生产准备过程
生产准备过程
Product Preparation Process
什么是3P?
3P的目标即为,在最短的时间内开发出合适的“生产系统”,满足的 要求包括: • 设计质量要求
• 生产要求
• 成本要求
和更多的重要因素
最终客户需求
生产系统不仅仅是指设备和硬件,更多的是指人( 人员)、检查和维护。
为什么要进行生产准备?
3,400 400
‘81
‘85
‘90
‘95
‘00
生产备过程
重点提示
生产备过程
重点提示
MACHINES
不要单向机器
把零件送回给操作员
不要恐龙型机器
我们知道这些恐龙发生了什么(灭绝了)
生产备过程
重点提示
用想法而不是用钱
生产备过程
重点提示
使用必要的设备,一个流生产
生产备过程
重点提示
工厂所有物品的高度都要保持低高度(眼到手到)
• 工艺和设备必须能够对生产需求波动做出快速反应。 • 产品必须按照排产表来生产 • 售价与利润的差别可以用一个等式来表达:利润=售价-成本;在激烈竞争的市场环境下, 售价是由消费者决定的,因此,我们必须降低成本以增加利润。
什么是3 P?
•产品设计质量(Product Design Quality) • 所需的生产量(Required ProductionVolume)
变为这种图示:
105 度旋转
插座衬里
受力均匀
48~94 度弯曲
记住!要用你12岁时候的思维方式
生产准备过程
将品质贯彻于我们的生产系统
6. 结合自然中的各种例子创新设计草图
每个团队成员必须完成至少7幅设计草图
Fly
7点建议
要有创造力,不要害怕提出建议
生产准备过程
将品质贯彻于我们的生产系统
7.结合类似的设计,选取7种方法来构建
目前的设计
或新的设计
(初步)
将产品分 解为部件
草拟背景(5)
定义 功能 (1)
关键词 是什么(2)
依据相似性进 行分组(7)
进行创造性思 维设计(6)
用草图的形式描 述案例(4)
在自然界中寻 找案例(3)
凭想象构建原 型(8)
在现有的设计 中选出最佳的3 个(9)
继续思索 收集数据 (10)
继续选出最好的 一个设计(11)
高度合适的机器
未负载机器
不要加载不必要的附加物
机器易于运作
机器运作时间最多为2秒
重组改良
容易修改为新的程序
窄小的空间
零部件尺寸+18寸
防呆防错
内置于过程
采用穿梭式进出,短程运作
不要采用单方向运动
生产准备过程
16 条标语
1. 生产准备越快越好. 2. 线体及设备的建设要能够支撑生产原料的快速流动. 3. 适度的附加设备,不需要像战舰一样庞大. 4. 设备应当容易快速切换. 5. 设备应该能够灵活拆装并重新安置. 6. 多功能设备能够较容易被重新装配. 7. 让操作员工的空间变窄,操作位置变深. 8. 设备和设置都应该能够让操作者灵活快速的移动,开放的空间观念使操作员的视 野更开阔。 9. 消除机器浪费,改善机器的动作。 10. 建立设备以适应小型快速的流水线. 11. 消除水平流动,建立分支流程. 12. 严格按照节拍拉动生产,不留多余产能与空间. 13. 建立设备以适应迅速重置与快速调整。 14. 连接机器使工件平滑流动,避免半成品过多 15. 使用多重线路,避免人工流动. 16. 坚持实施螺旋向上式的自动化生产,将人工任务转化为机器任务。
生产准备过程
重点提示
不要笨重的大船大炮
多选择小而精巧
生产准备过程
重点提示
ING
没必要解释,只需要做自己该做的事情(少说多做)
生产准备过程
重点提示
一个流生产
生产准备过程
重点提示
3 P
心态开放,改变陈旧观念,接受新鲜事物
生产准备过程
重点提示
原材料
$
$
$ $
$
$
$
成品
$
$
$
通过生产过程的持续改善来达到产品增值的目的
关键词是什么? 方向
转动
夹
坚硬
选择
自旋 锁 制动 系住 关键词
震荡
压
卷
钻 剪切
纽带
平移
画一幅能最好的描述关键词的草图
生产准备过程
将品质贯彻于我们的生产系统
3. 在自然中寻找关键词的例子
自然已经花费了数百万年来锤炼这些现象.
叮 自旋 移动 抓
滑 剪切 粘
装
铰链
掉落
漂浮
爬行
抵制所有使用人造的例子,大自然的例子往往是最简单纯粹的
生产准备过程
将品质贯彻于我们的生产系统
4. 手绘例子,并检查发生了什么.
把常见的例子分类 作业 手绘草图 审视细节 举例归类
附着
铰链
仔细观察这些现象并深入理解, 分析什么是这些现象发生的必要条件?
生产准备过程
将品质贯彻于我们的生产系统
5. 手绘背景,限定条件
你必须要理解自然现象是怎么运作的
从这种图示:
持续“月光工作”,并改进设计
如果出现问题 立即解决问题,不要多加谈论, 坚持身体力行,不要高谈阔论
生产准备过程
将品质贯彻于我们的生产系统
11.汇集功能选择最佳设计
质量
制造工程 产品设计 健康安全
建议l #1
机械设计 模具设计
采购
生产
管理
评估委员会
提交模型和资料给评估委员会来评估
决定最终方案,并开始预生产过程的改善
生产准备过程
16 条标语 7.让操作员工的空间变窄,操作位置变深.
大牧场 风格 设置
宽而浅
垂直状态 原理
减少足迹
城市建筑 风格 设置
窄而宽
减少步行 工位间距为1步
生产准备过程
16 条标语
8.设备和设置都应该能够让操作者灵活快速的移动, 开放的空间观念使操作员的视野更开阔.
修改 设置
增加了要求而没有改变设置, 标准作业可能被改变
生产准备过程
重点提示
CO$T
Q Q T
不要只考虑成本
导向应该为: 质量, 数量 和时间测定
类似于动物的机器
前面送进物料,后面送出废料
建立安灯系统 适当的尺寸
不要太快或者太有力
一次触摸式装置 容易保养
TPM 容易执行
自动吐出
自动喷出
局限化的盖子
在源头出吸尘或细料
不存在万能的机器
一个工序一台机器
较小的高度
但首先,是要确保整个系统能够满足 最终客户的质量要求。
生产准备与JIT
生产准备对JIT原则的支撑点:
1) 品质:
• • • • 建立过程中必备的质量 开发工艺与设备以保障良好的品质,不以执行者的变化而变化. 提供完备的图纸、工具、以及维护。 建立与工艺水平相适应的设计规范。
2) 数量 3) 时间 4) 成本
生产备过程
重点提示
Machines
避免机器增加不必要的附件,用原始的方式思考, 必要的时候才增加选项
生产备过程
