鲁科版电解质PPT教学课件1
合集下载
化学课件《电解质》优秀ppt24 鲁科版

醋酸 (导部电分能电力离_弱_)__
思考与交流
HCl (导全电部能电力离_强_)__
电解质溶液导电能力与什么有关?
电解质 在水溶液里
是否完全电离
强电解质
弱电解质
强酸(HCl、H2SO4、HNO3等)
强碱(NaOH、KOH、
Ca(OH)2Ba(OH)2)
盐 (NaCl、 NaHCO3、AgCl等) 弱酸(H2CO3、CH3COOH等)
们是非电解质。( √ )
练习2. 下列物质中,属于电解质的是 ①④⑤⑧ ,属 于非电解质的是_③__⑦______,能够导电的是 ②⑥⑧ 。
①NaCl固体 ②盐酸 ③C2H5OH ④Ca(OH)2 ⑤BaSO4 ⑥:
1. 以上导电的物质,导电的原理相同吗? 2. NaCl固体不导电而溶于水或者受热熔 融之后为什么能导电?
④NaCl溶液 观察指示灯是 否变亮。判断
⑤NaOH溶液 溶液是否导电 。
⑥盐酸
实验现象
不亮 不亮 不亮 亮
亮 亮
是否导电(填导电或不导电)
不导电 不导电 不导电 导电 导电
导电
根据刚才的实验思考这些物质在什么条件下能 导电?
HCl(气体) 溶于水 导电
溶于水
NaOH(固体) 或熔融
导电
化 合
NaCl (固体)
当堂练习
1. A 2. C 3.C 4.B 5. C 6.D 7. (1)Ca(OH)2 = Ca2+ + 2OH-
(2)(NH4)2CO3 = 2NH4+ + CO3 2(3)HNO3 = H+ + NO3( 4 )NaHSO4 = Na+H+ +SO42-
思考与交流
HCl (导全电部能电力离_强_)__
电解质溶液导电能力与什么有关?
电解质 在水溶液里
是否完全电离
强电解质
弱电解质
强酸(HCl、H2SO4、HNO3等)
强碱(NaOH、KOH、
Ca(OH)2Ba(OH)2)
盐 (NaCl、 NaHCO3、AgCl等) 弱酸(H2CO3、CH3COOH等)
们是非电解质。( √ )
练习2. 下列物质中,属于电解质的是 ①④⑤⑧ ,属 于非电解质的是_③__⑦______,能够导电的是 ②⑥⑧ 。
①NaCl固体 ②盐酸 ③C2H5OH ④Ca(OH)2 ⑤BaSO4 ⑥:
1. 以上导电的物质,导电的原理相同吗? 2. NaCl固体不导电而溶于水或者受热熔 融之后为什么能导电?
④NaCl溶液 观察指示灯是 否变亮。判断
⑤NaOH溶液 溶液是否导电 。
⑥盐酸
实验现象
不亮 不亮 不亮 亮
亮 亮
是否导电(填导电或不导电)
不导电 不导电 不导电 导电 导电
导电
根据刚才的实验思考这些物质在什么条件下能 导电?
HCl(气体) 溶于水 导电
溶于水
NaOH(固体) 或熔融
导电
化 合
NaCl (固体)
当堂练习
1. A 2. C 3.C 4.B 5. C 6.D 7. (1)Ca(OH)2 = Ca2+ + 2OH-
(2)(NH4)2CO3 = 2NH4+ + CO3 2(3)HNO3 = H+ + NO3( 4 )NaHSO4 = Na+H+ +SO42-
鲁科版高中化学必修一 优质课课件 电解质的电离-课件

研究流程
驱动问题1:泡腾片里哪 些物质发生了化学反应?
泡腾片产生气体的猜想 模拟实验验证猜想
观察成分表
NaHCO3和柠檬酸是否发生反应
任务一:模拟泡腾片中的反应—认识“电离”过程
活动1-1:验证碳酸氢钠和柠檬酸是否发生了反应 【实验1】 1.取2药匙NaHCO3固体和2药匙柠檬酸固体,混合均匀,观
任务二:认识电解质及电解质的分类
活动2-2:【思考】 实验表明,0.1mol·L-1盐酸比0.1mol·L-1醋酸导电性强,这是为什么?
强电解质:在水溶液中能完全电离的电解质 弱电解质:在水溶液中部分电离的电解质
任务二:认识电解质及电解质的分类
六大强酸
HNO3 HClO4 H2SO4 HCl HBr HI
晶体中的作用力 绘制微观示意图
加水之后产生了自由移动的离子
任务一:模拟泡腾片中的反应—认识“电离”过程
【思维拓展1】 NaHCO3在其他条件下能电离出自由移动 的离子吗?
任务一:模拟泡腾片中的反应—认识“电离”过程
【思维拓展2】有机酸在熔融状态下能否电离?
【实验3】 分取适量冰醋酸 、 适量冰醋酸与蒸馏水于干燥洁净的烧杯中, 测定其导电性。
D.导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由
移动离子数目多
课后作业:
必做:研究膨松剂中碳酸氢钠发生的离子反应。 选做:尝试用柠檬酸除去水垢,并探究其反应原理。
NaHCO3 NaHCO3
柠檬酸 固体
不亮
亮
微亮
亮
不亮
研究流程
驱动问题1:泡腾片里哪 些物质发生了化学反应
泡腾片产生气体的猜想 模拟实验验证猜想
驱动问题2:固体时为 什么没有气体产生?
2.2第1课时电解质及其电离课件(鲁科版必修1)

第2节 电解质
第1课时 电解质及其电离
1.知道电解质和非电解质的区别;认识强电解质和弱 电解质的区别。 2.了解酸、碱、盐在溶液中的电离和电离方程式的含 义。
你知道吗?
出汗后人体更容易触电,为什么呢?
汗液中主要 成分是氯化
钠
有自由移动 的离子
1、氯化钠的水溶液为什么能够导电? 2、在NaCl晶体中有没有自由移动的离子呢?
4、蔗糖、酒精在水溶液和融化状态下均不导电,所以它
们是非电解质。
(√ )
5、下列状态的物质,既能导电又属于电解质的是( D )
A、MgCl2晶体
B、NaCl溶液
C、氯化氢气体
D、熔融烧碱
3.酸、碱、盐的电离方程式
用化学式和离子符号来表示电离过程的式子。 HCl ==== H + + ClNaOH ==== Na + + OHNaCl ==== Na+ + Cl-
集腋成裘,聚沙成塔。几秒钟虽然不 长,却能构成永恒长河中的伟大时代。
没有自由移动离子,不导电。
食 盐 的 电 离
氯化钠晶体
知道什么是电离吗? 物质在溶解于水或受热熔化时,离解成能自由移动
的离子的过程称为电离。 电离与通电有关吗? 让我好好想想?
电离与通电无关,若化合物发生电离则能导电。
思考:下列化合物溶于水导电吗? 电解质
HCl(气体) NaOH(固体) NaCl(固体) 蔗糖(固体) 酒精(液体)
2、氢氧化钾、氢氧化钡; 3、硫酸铜、氯化钡。
H2SO4 ====2 H + + SO42 HNO3 ==== H + +NO3-
电离的阳离子全是H+。 酸
第1课时 电解质及其电离
1.知道电解质和非电解质的区别;认识强电解质和弱 电解质的区别。 2.了解酸、碱、盐在溶液中的电离和电离方程式的含 义。
你知道吗?
出汗后人体更容易触电,为什么呢?
汗液中主要 成分是氯化
钠
有自由移动 的离子
1、氯化钠的水溶液为什么能够导电? 2、在NaCl晶体中有没有自由移动的离子呢?
4、蔗糖、酒精在水溶液和融化状态下均不导电,所以它
们是非电解质。
(√ )
5、下列状态的物质,既能导电又属于电解质的是( D )
A、MgCl2晶体
B、NaCl溶液
C、氯化氢气体
D、熔融烧碱
3.酸、碱、盐的电离方程式
用化学式和离子符号来表示电离过程的式子。 HCl ==== H + + ClNaOH ==== Na + + OHNaCl ==== Na+ + Cl-
集腋成裘,聚沙成塔。几秒钟虽然不 长,却能构成永恒长河中的伟大时代。
没有自由移动离子,不导电。
食 盐 的 电 离
氯化钠晶体
知道什么是电离吗? 物质在溶解于水或受热熔化时,离解成能自由移动
的离子的过程称为电离。 电离与通电有关吗? 让我好好想想?
电离与通电无关,若化合物发生电离则能导电。
思考:下列化合物溶于水导电吗? 电解质
HCl(气体) NaOH(固体) NaCl(固体) 蔗糖(固体) 酒精(液体)
2、氢氧化钾、氢氧化钡; 3、硫酸铜、氯化钡。
H2SO4 ====2 H + + SO42 HNO3 ==== H + +NO3-
电离的阳离子全是H+。 酸
【鲁科版】电解质PPT课件分析1

SP
1、定义
在一定条件下,难溶性电解质形成饱和溶液,达到溶解 平衡,其溶解平衡常数叫做溶度积常数或简称溶度积.
2.表达式:
AmBn(s)
mAn+(aq)+nBm-(aq)
Ksp, AnBm= [An+]m . [Bm-]n
例:写出下列难溶电解质的溶解平衡关系式和溶度
积表达式。
AgBr
Ag+ + Br-
变
例题(2) 石灰乳中存在下列平衡: Ca(OH)2(s) ≒ Ca2+(aq)+2OH-(aq),加入下列溶液,可使
Ca(OH)2减少的是( AB ) A、Na2CO3溶液 B、AlCl3溶液 C、NaOH溶液 D、CaCl2溶液
【鲁科版】电解质PPT课件分析1
【鲁科版】电解质PPT课件分析1
(6)溶解平衡常数—溶度积KSP
溶解度与溶解性的关系:20℃
难溶 微溶
可溶
0.01
1
易溶
10 S /g
1、问题讨论: Ag+和Cl-的反应能进行到
底吗?
【实验】向盛有2 mL 0.1mol/LAgNO3溶液的试 管中加入2 mL 0.1 mol/L NaCl溶资液料。:化学上通常认
(1)、恰好反应没有?
为残留在溶液中的离 子浓度小于10-5 mol/L
解: Fe(OH)3
Fe3+ + 3OH-
Fe3+ 沉淀完全时的[OH-]为:
[OH-] 3
K sp [Fe3 ]
3
4.0 1039 1105
1.5 1011 mol L1
pOH = 10.8 , pH = 3.2
【鲁科版】电解质PPT课件分析1
鲁科版必修1第二章第二节电解质课件第一课时.ppt
4. 下列说法正确的是
(A)
A.在水溶液中能够电离出离子的化合物是电解质
B.固态时不能导电的物质一定是非电解质
C.能导电的物质一定是电解质
D.某物质不是电解质就一定是非电解质
5、.为了维持人体内电解质平衡,人在大量出汗后
应及时补充(C)
A.Mg2+ B. Ca2+ C. Na+ D. Fe3+
作业: 写出下列物质在水溶液中的电离方程式 Na2SO4 = H2SO4 = Ba(OH)2 =
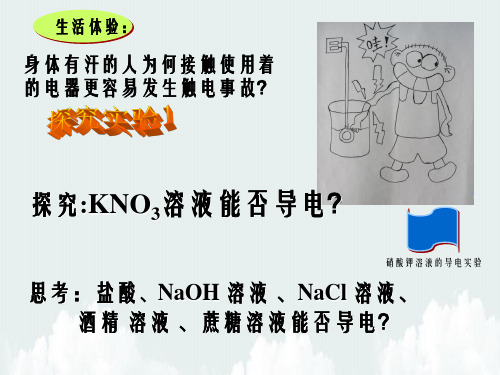
生活体验:
身体有汗的人为何接触使用着 的电器更容易发生触电事故?
探究:KNO3溶液能否导电?
硝酸钾溶液的导电实验
思考:盐酸、NaOH 溶液 、NaCl 溶液、 酒精 溶液 、蔗糖溶液能否导电?
导电:
NaOH 溶液 、HCl 溶液 、 NaCl 溶液、KNO3溶液。
(都是酸、碱、盐的溶液)
不导电: 蔗糖溶液、酒精溶液
微粒存在状态: 阴、阳离子
范围: 强酸、强碱、盐等
2、弱电解质 定义:在水溶液里只部分电离的电解质
微粒存在状态:阴、阳离子和分子
范围: 弱酸、弱碱、水
注意: 弱电解质的电离方程式用
连接。强电解质
用=连接。(如:弱碱氨水的电离方程式)
如:N3H.H2O
NH4++OH-
自己动手,考一 考!
1、下列电离方程式中,错误的是( A)
Ba(OH)2= Ba2++2OH-
CuCl2= Cu2++2Cl-
你能否从以上三组物质电离后的阴阳离 子类型及共同特点入手,给酸、碱、盐下定 义呢?
3. 酸、碱、盐的电离:
类 别
定义
实例
鲁科版高中化学必修一课件化学《电解质》ppt课件.pptx

4、电解质在水溶液和熔融状态下都能导电(× )
【练习2】
下列物质能导电的有( 3、4、7、10 )
其中属于电解质的是( 1、2、3、9
)
属于非电解质的是( 1.液态HCl 2.固体NaCl
6
、3.8熔融NaCl
)
4.KNO3溶液 5.蔗糖溶液 6.CO2 7.铜 8.乙醇 9.纯硫酸 10.氨水
知识总结
A.熔融氢氧化钠
B.石墨棒
C.盐酸溶液
D.固态氯化钾
3、下列电离方程式中,正确的是 ( C )
A. Al2(SO4)3=2Al+3+3SO4-2 B. HClO = H++ClO-
C. HCl = H+ +Cl-
D. Na2CO3=Na++CO32-
4. 下列叙述正确的是( )D
A. 液态HCl、固态NaCl均不导电,所以HCl和 NaCl均为非电解质
NaHSO4能电离出金属阳离子和酸根 阴离子,属于盐。
强电解质:在水溶液里全部电离成离子的电解质
弱电解质: 在水溶液里只部分电离成离子的电解
质
强电解质的电离:H2SO4 = 2H+ + SO42Na2CO3=2Na++CO32HCl = H+ + Cl-
弱电解质的电离:
CH 3COOH
H CH3COO
【反思】:在理解电解质和非电解质的概念 中应注意什么?
①电解质和非电解质是化合物,单质、混 合物既不是电解质也不是非电解质。
②能导电的不一定是电解质;电解质也不 一定能导电。
③必须是在一定条件下,本身发生电离而导电的化合物。
活动·探究
【练习2】
下列物质能导电的有( 3、4、7、10 )
其中属于电解质的是( 1、2、3、9
)
属于非电解质的是( 1.液态HCl 2.固体NaCl
6
、3.8熔融NaCl
)
4.KNO3溶液 5.蔗糖溶液 6.CO2 7.铜 8.乙醇 9.纯硫酸 10.氨水
知识总结
A.熔融氢氧化钠
B.石墨棒
C.盐酸溶液
D.固态氯化钾
3、下列电离方程式中,正确的是 ( C )
A. Al2(SO4)3=2Al+3+3SO4-2 B. HClO = H++ClO-
C. HCl = H+ +Cl-
D. Na2CO3=Na++CO32-
4. 下列叙述正确的是( )D
A. 液态HCl、固态NaCl均不导电,所以HCl和 NaCl均为非电解质
NaHSO4能电离出金属阳离子和酸根 阴离子,属于盐。
强电解质:在水溶液里全部电离成离子的电解质
弱电解质: 在水溶液里只部分电离成离子的电解
质
强电解质的电离:H2SO4 = 2H+ + SO42Na2CO3=2Na++CO32HCl = H+ + Cl-
弱电解质的电离:
CH 3COOH
H CH3COO
【反思】:在理解电解质和非电解质的概念 中应注意什么?
①电解质和非电解质是化合物,单质、混 合物既不是电解质也不是非电解质。
②能导电的不一定是电解质;电解质也不 一定能导电。
③必须是在一定条件下,本身发生电离而导电的化合物。
活动·探究
【鲁科版】电解质ppt优质课件1

【鲁科版】电解质ppt优质课件1
【鲁科版】电解质ppt优质课件1
问题 讨论2
如何书写离子方程式?
基本原则:
①要符合反应事实,没参加反应的 离子及不是难溶物、难电离物(水) 易挥发物(气体)不应当出现在离子 方程式中; ②要符合质量守恒定律; ③要符合电荷守恒原则 。
【鲁科版】电解质ppt优质课件1
【鲁科版】电解质ppt优质课件1
知识 将离子方程式改为符合 迁移 反应事实的化学方程式
请将下列离子方程式分别改写成不同的 两个化学方程式:
Ag++Cl-=AgCl↓
H++OH-=H2O
【鲁科版】电解质ppt优质课件1
【鲁科版】电解质ppt优质课件1
问题 解决2
离子反应的应用
1、检验离子的存在
【例】待测液中Cl-的检验实验: 在待测液(已知不含SO42-)中加入AgNO3溶液→ 产生白色沉淀→猜测沉淀的可能成分→在猜测的 基础上做实验验证→往所得沉淀中再加稀硝酸→ 白色沉淀不溶→得出结论:溶液中有Cl-
【鲁科版】电解质ppt优质课件1
【鲁科版】电解质ppt优质课件1
问题 请说明下列反应实质: 迁移2 NaOH溶液与盐酸的反应
NaOH溶液与盐酸的反应实质是 : H+与OH-结合生成难电离的水 本质特点是: 溶液中离子间结合生成了难电离的物质
【鲁科版】电解质ppt优质课件1
【鲁科版】电解质ppt优质课件1
(× )
④ H+ K+ CO32- SO42- (× ) ⑤ Na+ K+ CO32- OH- (√ )
【鲁科版】电解质ppt优质课件1
【鲁科版】电解质ppt优质课件1
【鲁科版】电解质PPT公开课课件1
试根据课本中“一些弱酸和弱碱的电离平衡 常数”比较它们的相对强弱。
草酸>磷酸>柠檬酸>碳酸
【鲁科版】电解质PPT公开课课件1
【鲁科版】电解质PPT公开课课件1
再见 祝同学们学习进步
【鲁科版】电解质PPT公开课课件1
【鲁科版】电解质PPT公开课课件1
探究实验设计建议:
【鲁科版】电解质PPT公开课课件1
3
CH3COOH
CH3COO-+H+
电离程 n(H+) C(H+) 导电能
度
力
加水 升温
加 NH4Cl 加HCl
加 NaOH
【鲁科版】电解质PPT公开课课件1
【鲁科版】电解质PPT公开课课件1
练习
1.将0 .1mol/L的氨水稀释10倍A,C随着氨水浓度 的降低,下列数据逐渐增大的是( )
A. [H+]
B. [OH]-
C. [OH]- /[NH3·H2O] D. [NH4]+
2 .一定量的盐酸跟过量的铁粉反应时,为减
缓反应速率而不影响生成氢气的总量,可向盐
酸中加入BD适量的( )
A.NaOH(固) B.H2O C.NH4Cl(固) D.CH3COONa (固)
【鲁科版】电解质PPT公开课课件1
H2S
H++HS-
[H+]=1×10-4mol/L
HS-
H++S2-
[H+]=1×10-13mol/L
电离难的原因:
a、一级电离出H+后,剩下的酸根阴离子带
负电荷,增加了对H+的吸引力,使第二个H+离
子电离困难的多;
草酸>磷酸>柠檬酸>碳酸
【鲁科版】电解质PPT公开课课件1
【鲁科版】电解质PPT公开课课件1
再见 祝同学们学习进步
【鲁科版】电解质PPT公开课课件1
【鲁科版】电解质PPT公开课课件1
探究实验设计建议:
【鲁科版】电解质PPT公开课课件1
3
CH3COOH
CH3COO-+H+
电离程 n(H+) C(H+) 导电能
度
力
加水 升温
加 NH4Cl 加HCl
加 NaOH
【鲁科版】电解质PPT公开课课件1
【鲁科版】电解质PPT公开课课件1
练习
1.将0 .1mol/L的氨水稀释10倍A,C随着氨水浓度 的降低,下列数据逐渐增大的是( )
A. [H+]
B. [OH]-
C. [OH]- /[NH3·H2O] D. [NH4]+
2 .一定量的盐酸跟过量的铁粉反应时,为减
缓反应速率而不影响生成氢气的总量,可向盐
酸中加入BD适量的( )
A.NaOH(固) B.H2O C.NH4Cl(固) D.CH3COONa (固)
【鲁科版】电解质PPT公开课课件1
H2S
H++HS-
[H+]=1×10-4mol/L
HS-
H++S2-
[H+]=1×10-13mol/L
电离难的原因:
a、一级电离出H+后,剩下的酸根阴离子带
负电荷,增加了对H+的吸引力,使第二个H+离
子电离困难的多;
【鲁科版】电解质PPT精美课件1

•
2.“我试图描写一个真正的老人,一 个真正 的孩子 ,真正 的大海 ,一条 真正的 鱼和许 多真正 的鲨鱼 。然而 ,如果 我能写 得足够 逼真的 话,他 们也能 代表许 多其他 的事物 。
•
3.后面一系列的情节都是老人的内心 表白, 一个是 与大海 与大鱼 的对话 ,一个 是自言 自语, 说给自 己听, 一个是 自己心 里的想 法。
•
7.着力追求一种含蓄、凝练的意境。 海明威 曾经以 冰山来 比喻创 作,说 创作要 像海上 的冰山 ,八分 之一露 在上面 ,八分 之七应 该隐含 在水下 。露出 水面的 是形象 ,隐藏 在水下 的是思 想感情 ,形象 越集中 鲜明, 感情越 深沉含 蓄。另 外,为 使“水 下”的 部分深 厚阔大 ,他还 借助于 象征 的手法 ,使作 品蕴涵 深意。
Ca(OH)2(S) Ca2+(aq) + 2OH-(aq)时, 为使氢氧化钙固体的量减少,需加入少量的
(双选)(AD)
A NH4NO3 C CaCl2
B NaOH D NaHSO4
【鲁科版】电解质PPT精美课件1
【鲁科版】电解质PPT精美课件1
当堂训练
2、下列有关AgCl沉淀的溶解平衡的说法中,
【鲁科版】电解质PPT精美课件1
【鲁科版】电解质PPT精美课件1
思考讨论 若要除去溶液中的SO42-离子你选择钙 盐还是钡盐?为什么? 加入可溶性钡盐.因硫酸钡的溶解度 比硫酸钙小,用Ba2+沉淀SO42-更完全
【鲁科版】电解质PPT精美课件1
【鲁科版】电解质PPT精美课件1
当堂训练
1、当氢氧化钙固体在水中达到溶解平衡
•
8.围绕本专题的话题,通过组织讨论 ,要求 学生把 人生积 累和经 验带入 文本, 演绎自 己的认 识,与 文本化 为一体 ,在大 师的思 想沐浴 下真正 得到一 次精神 的洗礼 。最后 ,还可 要求学 生在鉴 赏文章 观点表 达充满 诗意的 基础上 ,也动 手用形 象隽永 的语言 来概括 对本板 块话题 的理性 认识, 并在交 流的过 程中升 华自己 的思想 。
电解质PPT课件27(8份打包) 鲁科版

化合物 盐
NaCl
有机物
乙醇 蔗糖
物质状态 能否导电
溶于水 熔融 溶于水 熔融 固态 溶于水 熔融 溶于水 熔融 溶于水 熔融
ห้องสมุดไป่ตู้
导电 不导电
导电 导电 不导电 导电 导电 不导电 不导电 不导电 不导电
根据能否导电 再分类
电解质
非电解质
2.电解质的电离
(1)定义 电离:氯化钠这样溶解于水或受热熔化时,离 解成自由移动离子的过程称为电离。 注意:电离与“通电” 没有关系
24
敬请各位专家老师批评指正!
祝同学们学习进步,梦想成真!
谢谢大家!
•
15、如果没有人为你遮风挡雨,那就学会自己披荆斩棘,面对一切,用倔强的骄傲,活出无人能及的精彩。
•
16、成功的秘诀在于永不改变既定的目标。若不给自己设限,则人生中就没有限制你发挥的藩篱。幸福不会遗漏任何人,迟早有一天它会找到你。
电解质
非电解质
1.电解质和非电解质
电解质:在水溶液里或熔融状态下能够导电的 化合物。酸、碱、盐都是电解质 非电解质:在水溶液里和熔融状态下都不能导电的 化合物。乙醇和蔗糖等有机物大多数为非电解质, 注意: (1)电解质和非电解质都是化合物,
不是单质,也不是混合物
1.电解质和非电解质 2min
【巩固练习】 1.判断下列说法是否正确
② BaSO4难溶于水,其水溶液不导电,为什么 它还是电解质?
在熔融状态下, BaSO4发生电离,能导电 ③Na2O固体中含有哪些离子?其水溶液能导电,
Na2O是否是电解质? 含有Na+、 O2-,是电解质,因熔融状态发生电离
电解质和非电解质深入理解
(1)电解质和非电解质的对象是:化合物 (2)电解质和非电解质的界定本质: 在溶于水或熔融状态下,物质能否自身电离 ( SO2 、CO2等非金属氧化物是非电解质)
电解质 PPT课件18(4份) 鲁科版1

•
10、有些事想开了,你就会明白,在世上,你就是你,你痛痛你自己,你累累你自己,就算有人同情你,那又怎样,最后收拾残局的还是要靠你自己。
•
11、人生的某些障碍,你是逃不掉的。与其费尽周折绕过去,不如勇敢地攀登,或许这会铸就你人生的高点。
•
12、有些压力总是得自己扛过去,说出来就成了充满负能量的抱怨。寻求安慰也无济于事,还徒增了别人的烦恼。
A C 13、(1) ②⑥⑦⑧⑿⒀;
(2)①④⑩⒁;(3) ②⑦⑿⒀;
(4)⑥⑧;(5)③⑤⑾
•
15、如果没有人为你遮风挡雨,那就学会自己披荆斩棘,面对一切,用倔强的骄傲,活出无人能及的精彩。
•
16、成功的秘诀在于永不改变既定的目标。若不给自己设限,则人生中就没有限制你发挥的藩篱。幸福不会遗漏任何人,迟早有一天它会找到你。
•
18、努力也许不等于成功,可是那段追逐梦想的努力,会让你找到一个更好的自己,一个沉默努力充实安静的自己。
•
19、你相信梦想,梦想才会相信你。有一种落差是,你配不上自己的野心,也辜负了所受的苦难。
•
20、生活不会按你想要的方式进行,它会给你一段时间,让你孤独、迷茫又沉默忧郁。但如果靠这段时间跟自己独处,多看一本书,去做可以做的事,放下过去的人,等你度过低潮,那些独处的时光必定能照亮你的路,也是这些不堪陪你成熟。所以,现在没那么糟,看似生活对你的亏欠 ,其实都是祝愿。
第二节 电解质
第1课时
预习检测
1、电解质与非电解质的概念 2、强电解质和弱电解质的概念 3、电离的概念 4、物质能导电的条件是什么?
演示实验
按照左图装置,用 以下几种物质分别 做导电性实验,根 据下表结果思考: 哪些物质能导电? 为什么能导电?
电解质及其电离ppt1 鲁科版1

酒精、蔗糖、部分非气态氢化物、非金属氧化物均是非电解质。
【典题训练】
关于电解质的说法,正确的是(
A.导电性很强的物质
)
B.在溶于水或熔融状态下能导电的化合物
C.在溶于水或熔融状态下全部电离的化合物
D.可溶性盐类
【解析】选B。电解质的概念有两点:一是化合物,二是在水
溶液中或熔融状态下能够导电,导电性强弱不是判断物质是否
【解析】选D。K2CO3和KClO3是盐,它们电离后的产物是金属阳 离子和酸根阴离子,二者对应的酸根阴离子分别是 CO32-和ClO3-;
Ca(OH)2和H2SO4分别是碱和酸, A、B、C项均符合电解质的电离
原理及电离方程式的书写要求,均正确; D项,ClO3-是一个整体, 在水中不能进一步电离成Cl5+和O2-,正确的电离方程式为 KClO3====K++ClO3-。
质吗?(2)电解质导电的条件是什么?
【思路分析】判断不导电的物质是不是电解质,应该看该物质 在水溶液里或熔融状态下能否导电。
提示:(1)NaCl晶体中Na+与Cl-不能自由移动,液态HCl未发生
电离,故二者均不导电,但NaCl溶于水或熔融时、HCl溶于水 时均能导电,所以NaCl与HCl都是电解质。 (2)电解质导电的条件是溶于水或熔融状态。
2.下列物质的水溶液能导电,但属于非电解质的是( A.HClO B.Cl2 C.NaHCO3 D.CO2
)
【解析】选D。CO2溶于水生成碳酸,碳酸是弱电解质,能产生 自由移动的离子,故能导电。但CO2本身不会电离产生自由移
动的离子,故是非电解质。
3.下列说法中,正确的是(
)
A.SO2能溶于水,水溶液能导电,所以SO2是电解质 B.NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- C.H2SO4在电流作用下在水中电离出H+和SO42-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•
2.我公司在开工前,将根据合同中明 确规定 的永久 性工程 图纸, 施工进 度计划 ,施工 组织设 计等文 件及时 提交给 监理工 程师批 准。以 使监理 工程师 对该项 设计的 适用性 和完备 性进行 审查并 满意所 必需的 图纸、 规范、 计算书 及其他 资料; 也使招 标人能 操作、 维修、 拆除、 组装及 调整所 设计的 永久性 工程。
•
3.在施工全过程中,严格按照经招标 人及监 理工程 师批准 的“施 工组织 设计” 进行工 程的质 量管理 。在分 包单位 “自检 ”和总 承包专 检的基 础上, 接受监 理工程 师的验 收和检 查,并 按照监 理工程 师的要 求,予 以整改 。
•
、4.贯彻总包单位已建立的质量控制 、检查 、管理 制度, 并据此 对各分 包施工 单位予 以检控 ,确保 产品达 到优良 。总承 包对整 个工程 产品质 量负有 最终责 任,任 何分包 单位工 作的失 职、失 误造成 的严重 后果, 招标人 只认总 承包方 ,因而 总承包 方必须 杜绝现 场施工 分包单 位不服 从总承 包方和 监理工 程师监 理的不 正常现 象。
•
2.我公司在开工前,将根据合同中明 确规定 的永久 性工程 图纸, 施工进 度计划 ,施工 组织设 计等文 件及时 提交给 监理工 程师批 准。以 使监理 工程师 对该项 设计的 适用性 和完备 性进行 审查并 满意所 必需的 图纸、 规范、 计算书 及其他 资料; 也使招 标人能 操作、 维修、 拆除、 组装及 调整所 设计的 永久性 工程。
新课标人教版选修四化学反应原理
第三章水溶液中的离子平衡
第一节 弱电解质的电离
北京十中 燕丹丹
主要成分:盐酸
主要成分:醋酸
实验1
体积相同,浓度相同的盐酸和醋酸与 等量镁条反应 对比实验
加酸到刻度线
1mol/L盐酸
等量镁条 (用砂纸打 磨过的)
与镁条 的反应
1mol/L盐酸
快
1mol/L醋酸
1mol/L醋酸
•
3.在施工全过程中,严格按照经招标 人及监 理工程 师批准 的“施 工组织 设计” 进行工 程的质 量管理 。在分 包单位 “自检 ”和总 承包专 检的基 础上, 接受监 理工程 师的验 收和检 查,并 按照监 理工程 师的要 求,予 以整改 。
•
、4.贯彻总包单位已建立的质量控制 、检查 、管理 制度, 并据此 对各分 包施工 单位予 以检控 ,确保 产品达 到优良 。总承 包对整 个工程 产品质 量负有 最终责 任,任 何分包 单位工 作的失 职、失 误造成 的严重 后果, 招标人 只认总 承包方 ,因而 总承包 方必须 杜绝现 场施工 分包单 位不服 从总承 包方和 监理工 程师监 理的不 正常现 象。
慢
溶液中 c(H+)
1mol/L盐酸 1mol/L
1mol/L醋酸 小于1mol/L
[讨论提纲]从离子反应的角度思考:
1、金属与酸反应全 强的部 电实质是什么? 部弱分电 2、引起现象不同电 解的离 质原因是什么? 电解离质
3、pH数值与c(酸)关系说明酸的电离程度如何?
猜想:
只有部分醋酸发生电离,另一部 分没有发生电离。
•
5.所有进入现场使用的成品、半成品 、设备 、材料 、器具 ,均主 动向监 理工程 师提交 产品合 格证或 质保书 ,应按 规定使 用前需 进行物 理化学 试验检 测的材 料,主 动递交 检测结 果报告 ,使所 使用的 材料、 设备不 给工程 造成浪 费。
•
谢谢观看
•
1.我公司将积极配合监理工程师及现 场监理 工程师 代表履 行他们 的职责 和权力 。
NH3+H2O
NH3·-H2O
NH4 + + OH
试分析向溶液中分别加入下列物质时,平衡如何移动:
加入的物质 氯化铵固体 氨气 氢氧化钠固体
平衡移动方向 逆向
正向
逆向
小结: 强电解质
(全部电离)
电
解 质
电离过程是可逆的
弱电解质 电离平衡
内因
(部分电离)Biblioteka 电离平衡的移动外因
浓度 温度
•
1.我公司将积极配合监理工程师及现 场监理 工程师 代表履 行他们 的职责 和权力 。
醋酸的电离为可逆过程。
弱电解质电离的v-t图像
v
在一定条件(如温度、 浓度)下,当电解质分
V电离
子电离成离子的速率和
V电离= V结合 离子重新结合成分子的
速率相等时,电离过程
平衡状态 就达到了平衡状态——
V结合
电离平衡
0
t
特点: 逆、动、等、定、变
影响电离平衡的因素:
主要因素:物质本身结构与性质
外界条件: 温度? 、浓度?压强? 1、浓度对电离平衡如何影响
向1mol/L醋酸溶液中加入醋酸铵固体、HCl 气体、氢氧化钠固体电离平衡如何移动?
[讨论提纲]1、原溶液中有何粒子?
2、加入物质后溶液中增加了什么粒子?对原
粒子浓度有何影响?
3、电离平衡移动方向如何?
平衡移动 n(H+) C(H+) C(CH3COO-) 电离程度
醋酸钠 晶体
逆向
HCl气 体
逆向
NaOH 固体
正向
温度 正向
NH3•H2O电离过程中体系各粒子浓度的变化
等体积等浓 度的NH4+ OH-溶液相
混合时
达到电离平 衡前
达到电离平 衡
c(NH4+)
最大
减小
不变
c(OH-) C(NH3•H2O)
最大 最小
减小
不变
增大
不变
思考与讨论:课本p43
稀氨水中存在下述平衡:
•
5.所有进入现场使用的成品、半成品 、设备 、材料 、器具 ,均主 动向监 理工程 师提交 产品合 格证或 质保书 ,应按 规定使 用前需 进行物 理化学 试验检 测的材 料,主 动递交 检测结 果报告 ,使所 使用的 材料、 设备不 给工程 造成浪 费。
•
谢谢观看
