化学:2.2《电解质》课件(鲁科版必修1)
【化学】鲁科版必修1课件:第2章2节(第1课时)电解质及其电离

自主探究
精要解读
实验探究
【慎思3】判断正误
(1)液态HCl、固态NaCl均不导电,所以HCl和NaCl均是非 电解质 ( ( (3)铜丝、石墨均导电,所以它们是电解质 是非电解质 ( ( (4)蔗糖、酒精在水溶液中或熔融时均不导电,所以它们 ) ) ) )
(2)NH3、SO3的水溶液均导电,所以NH3、SO3均是电解质
正确判断离子间能否大量共存。
自主探究
精要解读实验探究源自第1课时 电解质及其电离自主探究
精要解读
实验探究
笃学一
电解质和非电解质
1. 电解质和非电解质 熔融状态下能够导电的 水溶液里 或_________ (1)电解质:在_________ 酸、碱、盐 都是电解质。 化合物 。如___________ _______ 水溶液 里和_________ 熔融状态下都不能导电的 (2)非电解质:在________ 化合物 。如蔗糖、乙醇等都是非电解质。 _______ 2. 电解质的电离 (1)概念 溶解于水 或_________ 受热熔化 时,离解成能够__________ 自由移动的 电解质_________ 离子 的过程。 _____
自主探究 精要解读 实验探究
弱电解质 2.
只部分电离 的电解质。 (1)概念:在水溶液中___________ (2)与物质分类的关系 弱酸、弱碱、水 等都是弱电解质。 _______________ (3)电离方程式
弱电解质的电离方程式用“ ”,如 - + CH COOH CH COO + H CH3COOH:___________________________ , 3 3 + - NH3·H2O NH4 +OH NH3·H2O:____________________________ 。,
2019精选教育鲁科版化学必修一《2.2.2 电解质在水溶液中的反应》ppt课件43页.ppt
()
(5)复分解反应一定有沉淀或气体或水生成。
()
(6)Na2O2固体放入水中,发生了离子反应
()
返回
电解 分析:2H2O=====2H2↑+O2↑,有气体生成但不是离子
反应。有离子参加或生成的化学反应都是离子反应,溶液
中离子的浓度可能变小,也可能增大,如 Na 与 H2O 的反 应,由于生成了强碱 NaOH,溶液中离子浓度会增大;H2 与 O2 反应,H2 与 Cl2 反应等不是离子反应。复分解反应有 沉淀或气体或水生成之外,还可有弱酸弱碱等难电离的物
返回
(2)写出下列物质在水溶液中的电离方程式:
①NH4HCO3:
NH4HCO3===NH
+4+HCO
3
,
②H2SO4:
H2SO4===2H++SO
24
,
③NH3·H2O: NH3·H2O
NH+4+OH- ,
④CH3COOH: CH3COOH CH3COO-+H+ ,
⑤Fe(OH)3: Fe(OH)3 Fe3++3OH-。
返回
(3)看离子反应是否遵守电荷守恒:
例:铜与硝酸银溶液的反应:
Cu+Ag+===Cu2++Ag(错误),电荷数:左边≠右边;
Cu+2Ag+===Cu2++2Ag(正确),电荷数:左边=右边。
(4)看反应物和生成物拆分是否正确:
例:NaHCO3溶液与稀盐酸反应:
CO
23
+2H+===CO2↑+H2O(错误);
返回
[特别提醒] 在判断离子共存时,应特别注意题中的 隐含条件,如“酸性环境”“碱性环境”,“无色”、指示剂 变色等。
返回
[例 2] 在下列溶液中,各组离子一定能够大量共存的是( ) A.无色溶液中:Na+、Cl-、SO24-、Fe3+ B.使紫色石蕊试液变红的溶液中:Na+、Mg2+、CO32-、Cl- C.含 SO42-的水溶液中:K+、Ba2+、Cl-、Br- D.pH<7 的水溶液中:Na+、SO24-、Cl-、NH+ 4 [解析] A 中 Fe3+为棕黄色,B 是酸性溶液,CO32-不存在。
鲁科版必修1第二章第二节电解质课件第一课时.ppt
4. 下列说法正确的是
(A)
A.在水溶液中能够电离出离子的化合物是电解质
B.固态时不能导电的物质一定是非电解质
C.能导电的物质一定是电解质
D.某物质不是电解质就一定是非电解质
5、.为了维持人体内电解质平衡,人在大量出汗后
应及时补充(C)
A.Mg2+ B. Ca2+ C. Na+ D. Fe3+
作业: 写出下列物质在水溶液中的电离方程式 Na2SO4 = H2SO4 = Ba(OH)2 =
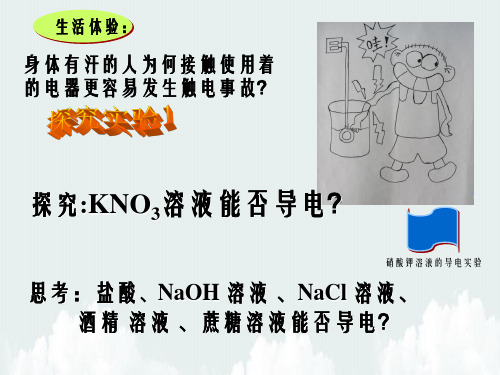
生活体验:
身体有汗的人为何接触使用着 的电器更容易发生触电事故?
探究:KNO3溶液能否导电?
硝酸钾溶液的导电实验
思考:盐酸、NaOH 溶液 、NaCl 溶液、 酒精 溶液 、蔗糖溶液能否导电?
导电:
NaOH 溶液 、HCl 溶液 、 NaCl 溶液、KNO3溶液。
(都是酸、碱、盐的溶液)
不导电: 蔗糖溶液、酒精溶液
微粒存在状态: 阴、阳离子
范围: 强酸、强碱、盐等
2、弱电解质 定义:在水溶液里只部分电离的电解质
微粒存在状态:阴、阳离子和分子
范围: 弱酸、弱碱、水
注意: 弱电解质的电离方程式用
连接。强电解质
用=连接。(如:弱碱氨水的电离方程式)
如:N3H.H2O
NH4++OH-
自己动手,考一 考!
1、下列电离方程式中,错误的是( A)
Ba(OH)2= Ba2++2OH-
CuCl2= Cu2++2Cl-
你能否从以上三组物质电离后的阴阳离 子类型及共同特点入手,给酸、碱、盐下定 义呢?
3. 酸、碱、盐的电离:
类 别
定义
实例
化学:2.2《电解质》第二课时课件(鲁科版必修1)

电子合同 艾滋病的病原体是A.HIVB.HBVC.HCVD.HDVE.HV 贫液流量设计值是Kg/HA.275076B.92374C.383760D.3790 治疗缺铁性贫血患者,最重要的措施是。A.补充铁剂B.中药治疗C.输血治疗D.应用促红细胞生长素E.病因治疗 以下不属于《基础电信协议》的主要部分的是。A.一般义务和纪律B.电信附录C.禁止性条款D.各国开放电信市场的承诺 最容易导致住院患者蛋白质能量营养不良的情况是A.高热、大面积烧伤等高代谢状态B.心血管疾病C.胆囊炎D.骨折E.择期非消化道手术 初孕妇,平时月经正常,停经43周,无产兆,NST2次无反应,OCT10min内宫缩2次持续40~50s,均出现晚期减速,1周前雌破膜引产C.立即剖宫产D.吸氧密观1周后复查E.服雌激素3天后复查 公司是指依照公司法规定,成立和从事活动的,以且兼顾社会利益的,具有法人资格的企业。 汉语标准失语症检查项目不包括A.听理解B.复述C.会话D.阅读理解E.抄写 关于二级生物安全水平实验室,不正确的是A.门保持关闭并贴适当的危险标志B.不需要配备生物安全柜C.就近配备压力蒸汽灭菌器或其他设施清除感染因子D.已知的或潜在的感染废弃物与普通废弃物分开E.执行生物学操作技术规范,配备个人防护装备 强调以病人为中心,由一位责任护士运用护理程序的工作方法指的是A.专人护理B.责任制护理C.综合护理D.功能制护理E.个案护理 不属于筛检评价指标的是A.可靠性B.正常值C.收获量和筛检费用D.真实性E.预测值 信号辅助继电器XFJ和主信号继电器ZXJ是在13网络线路上。 某轮装载后尚需加载少量货物,要求加载后吃水差不变,则该货物应加载在A.通过船中的垂直线上B.通过漂心的垂直线上C.通过浮心的垂直线上D.通过重心的垂直线上 中年女性,呼吸困难,曾有股骨外伤手术史,胸部CT正常,行99Tcm-MAA肺灌注显像如图,诊断是。A.正常的肺灌注显像B.左肺动脉主干栓塞C.多发肺栓塞D.肺动脉高压E.以上都不是 证券公司或其分支机构未经批准擅自经营融资融券业务的,可以对直接负责的主管人员和其他直接责任人员给予警告,撤销任职资格或者证券业从业资格,并处以万元以上万元以下的罚款。A.1;10B.2;20C.3;30D.5;50 《建设工程价款结算暂行办法》规定,合同中没有适用于变更工程的价格,计算变更合同价款按。A.合同中类似的价格执行B.当地权威部门指导的价格执行C.监理工程师提出的价格执行D.承包商提出的价格,工程师确认后执行 目前在建筑材料与装饰材料中最引起人们关注的物质是()A.甲醇和氡B.甲醛和氡C.甲醇和氨D.甲醛和氨E.氨和氡 关于循证医学的实质,以下哪种说法最为恰当A.循证医学就是进行系统综述和临床试验B.循证医学就是临床流行病学C.循证医学就是基于证据进行实践D.循证医学就是检索和评估文献E.以上所有选项 具有典型“附丽病”表现的是A.RAB.ASC.Reiter综合征D.牛皮癣性关节炎E.肠病性关节炎 慢性乙、丙型肝炎治疗的趋势是强调A.保肝治疗B.促进肝细胞再生C.免疫调节治疗D.防治肝纤维化E.抗病毒治疗 我国降水变率自沿海向内陆;全国而言,降水变率冬季。 某市化妆品生产企业为增值税一般纳税人,2014年10月上旬从国外进口一批高档化妆品,关税完税价格为150万元,进口关税60万元。本月内企业将进口化妆品的80%继续生产加工化妆品7800件,对外批发销售6000件,取得不含税销售额300万元;剩余的20%进口化妆品直接对外销售,取得不含税收 编制有两种方法,一种叫“实物法”,另一种叫“单价估价法”。A.投资估算B.设计概算C.施工预算D.工程决算 预防医学是研究A.人体健康与环境的关系B.个体与群体的健康C.人群的健康D.社会环境与健康的关系E.健康和无症状患者 脑DSA检查可将导管置于A.颈静脉B.静脉窦C.颈外动脉D.椎动脉E.椎静脉 在项目生命周期中,项目团队的大部分工作及支出都通常发生在。A.项目开发阶段B.项目实施阶段C.项目控制阶段D.项目收尾阶段 下列哪项为乌梅丸的主要功效A.温脏清腑B.平调寒热C.缓急止痛D.温脏安蛔E.驱蛔消疳 [155]<sub1>10=;16=。 简述影响皮肤美容的因素 触按疮疡局部,肿处烙手而压痛者,病属A.实寒证B.实热证C.虚寒证D.虚热证E.气血虚证 核周空穴细胞又称为()A.角化细胞B.挖空细胞C.湿疣细胞D.角化不良细胞E.产后细胞′ 代理的种类有哪些? 监理招标有哪些特点? 患者男性,20岁。昨日进食海产品,今日开始较频繁腹泻,水样便,继之呕吐,但无腹痛,不发热,口渴,腓肠肌疼痛,体查:体温36℃,BP60/40mmHg,脱水,呼吸平稳,心肺正常,腹平软、无压痛,四肢微凉。血象:WBC20.0×10/L,粪便镜检:WBC0~2/HP。抢救该病人,最紧急措施是A.大量 狐狸犬温热的防治? 患者,女性,60岁,脑梗死后2个月余,能说简单的词如"好"等,但找词困难,不能根据指令做抬手等动作,患者应进行哪项检查评估患者言语情况A.Frenchay构音障碍评估法B.汉语失语成套测验C.NCSE检查D.FIM检查E.注意力障碍检查 人类免疫缺陷病毒(HIV)主要感染的细胞是A.单核细胞B.神经胶质细胞C.B淋巴细胞D.CD+4T淋巴细胞E.NK细胞 男性患者29岁,一年前因左肾、左输尿管及膀胱结核,行左肾和左输尿管切除术,手术后行抗结核治疗8个月。日前患者尿常规检查阴性,IVP显示右肾轻度积水,但患者尿频症状明显加重,原因是A.结核引起的尿道综合征B.膀胱结核未能控制C.结核复发D.合并有泌尿系统感染E.膀胱挛缩 小鼠的的生理结构有利于灌胃操作。A、胃容量小,功能较差B、食管较短,较细C、食管内壁有一层厚的角质化鳞状上皮D、胃分为前胃和腺胃
§2-2电解质(鲁科化学必修1)

§2-2电解质——鲁科版必修1 第二章元素与物质世界作者:史学强Email:suifengpiaoguo@20011年3月15日§2-2电解质【知识梳理】1电解质的电离1.酸、碱、盐的电离(1)电离的概念:物质溶解于水或熔化时,离解成自由移动的离子的过程称为电离。
注意:电离的条件是在水的作用下或受热熔化,绝不能认为是通电。
(2)酸、碱、盐电离时生成的阳离子全部是H+的化合物称为酸;电离时生成的阴离子全部是OH-的化合物称为碱;电离时生成的阳离子是金属阳离子(或NH4+离子)、阴离子全部是酸根离子的化合物称为盐。
(3)电离方程式:用离子符号和化学式来表示电解质电离的式子。
如:H2SO4=2H++SO42-;NaOH=Na++OH-;NaHCO3=Na++HCO3-电离的条件是在水溶液中或融化状态下,并不是在通电的条件下。
2.酸、碱、盐是电解质(1)电解质与非电解质在水溶液或熔化状态下能导电的化合物称为电解质;在水溶液和熔化状态下都不能导电的化合物称为非电解质。
说明:①电解质和非电解质都是化合物,单质既不属于电解质,也不属于非电解质。
②电离是电解质溶液导电的前提。
③能导电的物质不一定是电解质,如石墨等;电解质本身不一定能导电,如食盐晶体。
④有些化合物的水溶液能导电,但因为这些化合物在水中或熔化状态下本身不能电离,故也不是电解质.如SO2、SO3、NH3、CO2等,它们的水溶液都能导电,是因为跟水反应生成了电解质,它们本身都不是电解质。
⑤电解质溶液中,阳离子所带正电荷总数与阴离子所带负电荷总数是相等的,故显电中性,称电荷守恒。
(2)强电解质与弱电解质根据电解质在水溶液里电离能力的大小又可将电解质分为强电解质和弱电解质.能完全电离的电解质叫做强电解质,如强酸、强碱和绝大多数盐,只能部分电离的电解质叫做弱电解质,如弱酸、弱碱等。
(3)常见的电解质①强电解质强酸:H2SO4、HCl、HNO3、HClO4、HBr、HI。
鲁科版高中化学必修一 2.2 电解质(共30张PPT)

②酸、碱、盐是电解质(其水溶液或熔融物能导电) ③酸、碱、盐能发生电离(在水溶液中或熔融状态下)
④电解质溶液的导电能力与自由离子浓度
大小成正比。
第十页,共30页。
问题 思考
③酸、碱、盐能发生电离(在水溶液中或熔融状态下) 普通高中课程标准实验教科书 化学1(必修) ②铁屑加入CuSO4溶液中
电解质在水溶液中
能发生反应的条件
溶液中的离子间发生反应后,有难电离
物(水)或难溶物或易挥发物生成—— 酸、碱、盐发生复分解反应的条件。
第十八页,共30页。
小结2 离子反应
⑴电解质溶液间的反应实质是离子间
的反应,即反应有离子参加;
⑵在化学上我们把有离子参加的反应
叫做离子反应;
⑶离子反应是化学反应中的一种; ⑷它有相应的书写方式,即离子方程式。
⑴易溶于水的强电解质都要拆开成离子形式; H+与OH-结合生成难电离的水
③要符合电荷守恒原则 。
④ H+ K+ CO32- SO42-
③要符合电荷守恒原则 。
(四强酸、四强碱、易溶盐) 电流计指针读数变小,溶液导电能力减弱,自由离子
② Ba2+ Na+ SO42- NO3-
离子间不发生化学反应(不生成沉淀、 ①电解质是具有特定性质的化合物
普通高中课程标准实验教科书 化学1(必修)
第二章
第二节 电解质
第一页,共30页。
问题探究一
电解质的电离
第二页,共30页。
化合物的另一种分类方法
元素
单质
纯
净
物
物质混合物 Nhomakorabea溶液浊液
胶体
(教师参考)高中化学 2.2.1 电解质及其电离课件1 鲁科版必修1

HNO3 H2SO4 KOH
Ba(OH)2 Na2CO3 CuSO4 BaCl2
酸 碱 盐
电解质 非电解质
强电解质 弱电解质
精选ppt
8
铁√
√
铜 √
氯化钠 晶体
氯化钠 溶液
× 盐酸 √
√ 稀硫酸 √
×
×
锌 √ 硝酸钾 √ 烧碱固 √
晶体√×体×铝硝酸钾 精选ppt 烧碱溶
4
问题 为什么上述物质的溶液具有导电性? 探究
金属能导电
盐酸、NaOH溶液 NaCl溶液能导电
定向迁移
定向迁移
金属内部有自由移 动的带负电的电子
溶液中也有自由 移动的带电微粒
第2章 元素与物质世界 第2节 电解质
第1课时 电解质及其电离
精选ppt
1
问题探究一
电解质的电离
精选ppt
2
化合物的另一种分类方法
物 质
溶液
元素
纯 净 物 混 合 物
浊液
单 质
化 合 物
胶体
精选ppt
酸、碱、盐 氧化物
?电解质 非电解质 在水溶液中或熔化状 态下是否导电 3
一、电解质的电离
【问题1】下列哪些物质能导电?
精选ppt
5
[质疑]
物质中有阴阳离子就能导电吗?
电离——
在水分子作用下或受热时,晶体中 被束缚着的离子解离为可自由移动的离子, 这个过程就叫做电离 。
电离与通电与否无关。
精选ppt
6
电离的表示方法——电离方程式
HCl=H++ClNaOH=Na++OHNaCl=Na++Cl-
鲁科版高中化学必修一课件电解质2第一课时.pptx

D、氯化氢水溶液能导电,所以氯化氢是电解质
பைடு நூலகம்
E、氯化钠溶液能导电,所以氯化钠溶液是电解质
(3)从电离的角度认识酸、碱、盐
酸:电离时生成的阳离子全部是氢离子
的化合物叫做酸
碱:电离时生成的阴离子全部是氢氧根
离子的化合物叫做碱
盐:电离时生成金属阳离子(或铵根离
子)和酸根阴离子的化合物叫做盐。
(4)强电解质和弱电解质
HNO3=H++NO3-
练
②H2SO4
H2SO4 = 2H+ + SO42-
③KOH
KOH=K++OH-
④Ba(OH)2 Ba(OH)2 = Ba2++ 2OH-
下列叙述正确的是
( D)
A、固体氯化钠不导电,所以氯化钠是非电解质
B、铜丝能导电,所以铜是电解质
C、二氧化碳溶于水能导电,所以二氧化碳是电解质
B、酒精 D、HCl
1、上述物质为什么有的能导电而有的不能呢? 2、电解质的导电原理与金属有什么不同吗?
电解质在溶液中 存在
熔融态的电解质中
存在
金属内部
自 离子
由
移
外加电压 导 电
定向移动
动 电子
NaCl溶液、熔融NaCl导电的原因: 液体中有离子,且离子能自由移动
晶体食盐不导电的原因: 离子不能自由移动
第1课时 电解质及其电离
物 质
溶液
元素 纯 净 物 混 合 物
浊液
单 质
化 合 物
依据分散物 质颗粒的大
小
胶体
根据化合 物的性质
酸、碱、盐 氧化物
电解质 非电解质
化学:2.2《电解质》第一课时课件(鲁科版必修1) - 副本

ACD )
下列物质中:
1、硫酸 2、蔗糖
3、氨气
4、醋酸
5、铜
6、氨水
7、乙醇 8、二氧化碳
9、石墨 10、碳酸 11、醋酸铵 12、烧碱
1属3于、非氯电化解钠质溶的液是__2_____3______7_ 8
属于电解质的是__1_____4____1_0___1_1 12
属于强电解质的是___1_____1_1_____ 12
。
和 不能 化合物 非电解质:在水溶液里 熔化状态下都
导电的
。
如:部分气态氢化物NH3;非金属 氧化物CO、CO2、SO2;酒精等大 多数有机物
下列物质既不是电解质,也不是非电解质的(C )
A、Na2SO4
B、酒精
C、Cl2
D、HCl
下列物质的水溶液能导电,但属于非电解质的是(C)
A.CH3COOH B. Cl2 C. CO2 D.NH4HCO3
例如:S03,NH3,溶于水后可以导电, 但是相应的电解质分别是 H2SO4 , NH3.H2O.
概念理解3
具备下列条件之一即为电解质: 1.在水溶液里能导电。 2. 在熔融状态下能导电。
BaCO3是电解质,虽然BaCO3是沉 淀物,在水中不导电,但是其熔融 状态可以导电,是电解质。
你能从物质分类的角度认识电解质、非电 解质吗?
晶体食盐不导电的原因: 离子不能自由移动
决定溶液导电性强弱的因素: 溶液中自由移动离子浓度的大小
2、电解质的电离
Na+
Cl-
食 盐 的 电 离
2、电解质的电离
(1)电离: 物质溶于水或受热熔化时,离解成能
够自由移动的离子的过程,称为电离。
(2)表示方法
鲁科版高中化学必修一课件2.2.2电解质.pptx

3.在下列化学方程式中,不能用离子方程式Ba2++SO42====BaSO4↓来表示的是() A.Ba(NO3)2+H2SO4====BaSO4↓+2HNO3 B.BaCl2+Na2SO4====BaSO4↓+2NaCl C.BaCO3+Na2SO4====BaSO4↓+Na2CO3 D.BaCl2+H2SO4====BaSO4↓+2HCl
5.(2010·运城高一检测)下列实验中的试剂b不可能 是()
A.AgNO3B.NaOHC.HClD.H2SO4
【解析】选C。A项:加入足量AgNO3后,发生:Ag++Cl====AgCl↓,符合出现的现象;B项:加入足量NaOH后,
发生:HCO3-+OH-====CO32-+H2O,CO32-+Ba2+==== BaCO3↓,符合出现的现象;C项:加入足量HCl后,发 生:HCO3-+H+====H2O+CO2↑,不符合出现的现象;D项: 加入足量H2SO4后,发生:HCO3-+H+====H2O+CO2↑, SO42-+Ba2+====BaSO4↓,符合出现的现象,故选C项。
空白演示
在此输入您的封面副标题
【典例1】下列操作能使溶液导电能力显著增强的是 A.将HCl气体通入NaOH溶液中B.将CO2通入石灰水中 C.将NH3通入CH3COOH溶液中D.将NH3通入盐酸中 【思路点拨】溶液的导电能力主要由溶液中自由移动的 离子浓度决定!
【自主解答】选C。A选项中发生的反应为HCl+NaOH==== NaCl+H2O,溶液中Na+不变,OH-变为Cl-,物质的量不变, 但因为有水生成,使离子浓度略有下降;B中 CO2+Ca(OH)2====CaCO3↓+H2O,反应生成难溶的CaCO3, 离子浓度降低;C中NH3+CH3COOH====CH3COONH4, CH3COOH是弱电解质,生成了等量的强电解质,离子浓 度增大,导电能力显著增强;D中NH3+HCl====NH4Cl,溶 液中的离子由H+、Cl-变为NH4+、Cl-,离子浓度不变。
鲁科版高中化学必修一课件2.2.1电解质.pptx

是强电解质的理由是:测得溶液中的氢离子浓度_______ 0.2mol·L-1(选填“>”、“<”或“=”)。 (3)同学们在实验的基础上,进一步查阅资料得知:一 般来说,_______是强电解质,_________是弱电解质。根 据以上结论推测:如果将上述实验中的醋酸和氨水中分别 加入0.03mol的NaOH和HCl,混合均匀(假设体积不变), 接通电源,可以观察到的现象是__________。 A.与混合前无任何区别 B.5只灯泡都亮起来,亮度几乎完全相同 C.只有盐酸、氯化钠、氢氧化钠溶液对应的灯泡亮起来, 另外两只不亮
答案:(1)由亮变暗,最后熄灭 溶液中有白色沉淀产生且逐渐增多,小球下沉到烧杯 底部 (2)H2SO4+Ba(OH)2====BaSO4↓+2H2O
一、选择题(本题包括5小题,每小题4分,共20分) 1.下列物质的水溶液能导电,但属于非电解质的是 () A.CH3COOHB.Cl2 C.NH4HCO3D.SO2 【解析】选D。非电解质通常为非金属氧化物、NH3、大 多数有机物等。A、C均为电解质,B为单质,既不是电解 质也不是非电解质,D中SO2为非金属氧化物属于非电解 质,它在水溶液中生成了H2SO3,能导电。
知识点一:电解质和非电解质 1.(2010·雅安高一检测)下列物质属于电解质并能导 电的是() A.酒精B.氯化钾晶体 C.液态氯化氢D.熔融态的氢氧化钠 【解析】选D。酒精为非电解质,KCl、HCl、NaOH均为 电解质,但只有熔融态NaOH导电。
2.(2010·天津五校联考)化学兴趣小组在家中进行化学 实验,按照左图连接好线路发现灯泡不亮,按照右图连接 好线路发现灯泡亮,由此得出的结论正确的是()
ห้องสมุดไป่ตู้
2.(14分)小明等同学为了探究电解质强弱与物质分类的 关系,设计了如下实验: (Ⅰ)在5只250mL烧杯中分别加入浓度均为0.2mol·L-1的 盐酸、CH3COOH溶液、NaOH溶液、NaCl溶液、氨水各 150mL。 (Ⅱ)在5种溶液中分别放入相同规格的石墨电极,按图 连接好。
鲁科版高中化学必修一课件化学《电解质》ppt课件1.pptx

2.(2008年广东高考)下列化学反应的离子方程式正确 的是( )
答案:A
2.离子的推断 (1)解题思路:依据溶液性质推出溶液中一定含有的 离子(或一定不含的离子),然后依据离子共存,推出一 定不含的离子。
(2)解题技巧 ①先看题干:如溶液颜色、pH值、酸碱性等。 ②再据溶液性质或实验现象推断。
1.下列叙述正确的是( )
①硝酸钾溶液能导电,所以硝酸钾溶液是电解质
②固态氯化钾不导电,但氯化钾是电解质
③氯化氢溶液能导电,所以氯化氢是电解质
④SO2溶于水能导电,所以SO2是电解质 ⑤铁导电,所以铁是电解质
⑥H2不导电,所以H2是非电解质
A.①④
B.②③
C.①②③④
D.④⑤⑥
答案:B
离子方程式的书写及正误判断
书写方法步骤:
a.定义完全反应物质的物质的量为1 mol。 b.找出完全反应物质各组成微粒的物质的量。 c.计算参加反应的过量物质的物质的量。 d.运用离子反应完成的条件完成反应离子方程式的 书写。
(2009年上海高三十四校联考)下列离子方程式错误 的是( )
【答案】 B
【方法技巧】 判断离子方程式的正误应抓住两 易、两等、两查:
(1)两易:易溶、易电离的物质(可溶性的强电解质 包括强酸、强碱、大多数可溶性盐)以实际参加反应 的离子的符号表示;非电解质、弱电解质、难溶物、 气体等物质用化学式表示。
化学课件《电解质》优秀ppt24 鲁科版

思考与交流
HCl (导全电部能电力离_强_)__
电解质溶液导电能力与什么有关?
电解质 在水溶液里
是否完全电离
强电解质
弱电解质
强酸(HCl、H2SO4、HNO3等)
强碱(NaOH、KOH、
Ca(OH)2Ba(OH)2)
盐 (NaCl、 NaHCO3、AgCl等) 弱酸(H2CO3、CH3COOH等)
们是非电解质。( √ )
练习2. 下列物质中,属于电解质的是 ①④⑤⑧ ,属 于非电解质的是_③__⑦______,能够导电的是 ②⑥⑧ 。
①NaCl固体 ②盐酸 ③C2H5OH ④Ca(OH)2 ⑤BaSO4 ⑥:
1. 以上导电的物质,导电的原理相同吗? 2. NaCl固体不导电而溶于水或者受热熔 融之后为什么能导电?
④NaCl溶液 观察指示灯是 否变亮。判断
⑤NaOH溶液 溶液是否导电 。
⑥盐酸
实验现象
不亮 不亮 不亮 亮
亮 亮
是否导电(填导电或不导电)
不导电 不导电 不导电 导电 导电
导电
根据刚才的实验思考这些物质在什么条件下能 导电?
HCl(气体) 溶于水 导电
溶于水
NaOH(固体) 或熔融
导电
化 合
NaCl (固体)
当堂练习
1. A 2. C 3.C 4.B 5. C 6.D 7. (1)Ca(OH)2 = Ca2+ + 2OH-
(2)(NH4)2CO3 = 2NH4+ + CO3 2(3)HNO3 = H+ + NO3( 4 )NaHSO4 = Na+H+ +SO42-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
下面是从电解质非电解质的角度对物质进行的分类, 下面是从电解质非电解质的角度对物质进行的分类,请 你总结说明电解质、非电解质与单质、氧化物、 你总结说明电解质、非电解质与单质、氧化物、酸、碱、 非金属氢化物、有机物有何关系?水溶性如何? 盐、非金属氢化物、有机物有何关系?水溶性如何? 物质
是否电解质 非电解质
写出下列反应的离子方程式: 写出下列反应的离子方程式: (1)氯化钡溶液和硫酸锌溶液反应 ) (2)碳酸钠溶液和稀硫酸反应 ) (3)氢氧化钡溶液和稀硫酸反应 ) (4)碳酸钙和稀盐酸反应 ) (5)醋酸和氢氧化钠溶液反应 ) (6)氨水和醋酸溶液反应 ) (7)金属钠与水反应 ) (8)三氧化二铁与稀硫酸反应 ) (9)二氧化碳通入到澄清石灰水中 ) (10)碳酸氢钠溶液与氢氧化钠溶液混合 )
电解质:在水溶液里或 电解质:在水溶液里或者融化状态下能够导
电的化合物 电的化合物 在水溶液里和 在水溶液里和融化状态下都不能 非电解质: 非电解质: 够导电的化合物 够导电的化合物
电解质: 电解质:酸、碱、盐、典型金属氧化物、 典型金属氧化物、 某些非金属氢化物、 某些非金属氢化物、某些有机物等 非电解质:非金属氧化物、 非电解质:非金属氧化物、某些非金属 氢化物、 氢化物、绝大多数有机物等 单质既不是电解质,也不是非电解质。 单质既不是电解质,也不是非电解质。 电解质、非电解质可以是溶于水的, 电解质、非电解质可以是溶于水的,也 可以是不溶于水的
是
是 是
Cu
物质
是否电解质 非电解质
CH4 CH3COOH
是
是
是
CO2
物质
是否电解质 非电解质
葡萄糖
CuSO4·5H2O
是
Cu (OH)2 Cu2(OH)2CO3 NH4HCO3
物质
是否电解质 非电解质
是
是
是
2、电解质的电离 、
(1)定义: )定义: 电解质溶于水或受热熔化时, 电解质溶于水或受热熔化时,离解成自由移动的 溶于水或受热熔化时 离子的过程 的过程。 离子的过程。
判断下列物质属于酸、 判断下列物质属于酸、碱、还是盐? 还是盐?
物质 HNO3 NH3·H2O KMnO4 NaHSO4 类别 HF Ba(OH)Cl
酸
碱
盐
盐
酸
盐
溶液的酸碱性与PH值及氢离子浓度、 溶液的酸碱性与 值及氢离子浓度、氢氧根离子浓 值及氢离子浓度 度的关系 PH 值 H+浓 度 OH浓度 酸碱 性 0 1 2 3 4 14 5 6 7 8 9 10 11 12 13
• (1) Ag(NO3)3+NaCl==AgCl(沉淀)+NaCl 沉淀) 沉淀 • (2) CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 • (3) SO2 + 2NaOH = Na2SO3 + H2O • (4) CuSO4+Fe=FeSO4+Cu • (5) NaHCO3+HCl=NaCl+H2O+CO2 ↑
氢离子浓度逐渐减小 氢氧根 离子浓度逐渐增大 酸性逐渐减弱, 酸性逐渐减弱,碱性逐渐增强
(4)强电解质与弱电解质: )强电解质与弱电解质:
定义 电离程度 水溶液中存在 的粒子 电离方程式 与常见物质类 别的关系 实例 强电解质 在水溶液里能完全电 离的电解质 完全(不可逆) 完全(不可逆) 阴、阳离子 HCl = H+ + Cl离子化合物 部分共价化合物
研讨交流
离子反应方程式: 离子反应方程式:用实际参加反应的离子的符号来 表示离子反应的式子。 表示离子反应的式子。
以硫酸与氢氧化钡在溶液中发生的反应 为例,学习离子方程式的书写。 为例,学习离子方程式的书写。
离子方程式的书写步骤: 离子方程式的书写步骤: (1)写出反应的化学方程式。 写出反应的化学方程式。 反应的化学方程式 (2)把易溶于水的强电解质改写成离子,单质、 把易溶于水的强电解质改写成离子,单质、 改写成离子 氧化物、沉淀、气体、弱电解质、 氧化物、沉淀、气体、弱电解质、非电解质保 留化学式。 留化学式。 删去方程式两边没有参加反应的离子 方程式两边没有参加反应的离子。 (3)删去方程式两边没有参加反应的离子。调 系数比为最简整数比。 整系数比为最简整数比。 检查离子方程式两边电荷总数是否相等 离子方程式两边电荷总数是否相等、 (4)检查离子方程式两边电荷总数是否相等、 各原子个数是否相等。 各原子个数是否相等。
•
•
• •
碳酸氢钙和氢氧化钠溶液混合,氢氧化 碳酸氢钙和氢氧化钠溶液混合, 钠足量和少量的两个分子、 钠足量和少量的两个分子、离子方程式 氢氧化钠足量: 氢氧化钠足量: Ca(HCO3)2+2NaOH=CaCO3+Na2CO3+2 H2O 氢氧化钠少量: 氢氧化钠少量: Ca(HCO3)2+NaOH=CaCO3+NaHCO3+H 2O 离子方程式与是否过量无关 Ca2++HCO3-+2OH-=2H2O+CaCO3↓
H2CO3、H2SO3、 CH3COOH、NH3·H2O、 、 、 Al(OH)3、H2O、Fe2O3 、
①H2O,②CH3COOH,③Fe,④石墨, , , ④石墨, 蔗糖, ⑤H2SO4,⑥NaCl,⑦NaOH, ⑧蔗糖, ⑦ ⑨酒精中属于电解质的是 ①② _______________;属于非电解质的是 ; _________;属于强电解质的是 ; _______________;属于弱电解质的是 ; ___________(填序号)。 (填序号)。
◆电解质溶液的导电性: 电解质溶液的导电性:
(1)导电的实质 ) 阴阳离子在外加电场作用下发生定向移动。(阳离子奔向阴极, 。(阳离子奔向阴极 阴阳离子在外加电场作用下发生定向移动。(阳离子奔向阴极, 阴离子奔向阳极。) 阴离子奔向阳极。) (2)导电性强弱 ) 溶液中离子的浓度大小 取决于、盐的定义: 盐的定义:
酸:电离时,生成的阳离子全部是H+的化合 电离时,生成的阳离子全部是H 物为酸。 物为酸。 碱:电离时,生成的阴离子全部是OH-的化 电离时,生成的阴离子全部是OH 合物为碱。 合物为碱。 盐:电离时,能生成金属(或者NH4+离子)阳 电离时,能生成金属(或者NH 离子) 离子和酸根阴离子的化合物为盐。 离子和酸根阴离子的化合物为盐。
FeCl3 H2SO4 Na2CO3 BaSO4 NaOH
是
Fe
是
S
是
HNO3
是
BaO
是
H2O
物质
是否电解质 都不是 都不是 非电解质
是
CaCO3
是
SO3
是
KNO3
物质
是否电解质 非电解质
Mg(OH)2
NH3
是
是
是
物质
是否电解质 非电解质
石墨
酒精
AgCl
H2CO3 NH3·H2O
是
Na2O Na2O2 HF
强酸、强碱、酸式盐、碱式盐、 强酸、强碱、酸式盐、碱式盐、绝大 多数盐
弱电解质 在水溶液中部分 电离的电解质 部分(可逆) 部分(可逆) 阴、阳离子和分子 H2O H+ + OH-
部分共价化合物
弱酸、弱碱、 弱酸、弱碱、水、金属氧化物、个别盐 金属氧化物、
H2SO4、HNO3、HCl、 、 NaOH、KOH、Ba(OH)2 、 、 KNO3、Na2SO4、NH4Cl、 、 NaHCO3、Cu(OHCO3)2 、 (
把下列离子方程式改写成化学方程式 (1) Ag+ + Cl- = AgCl↓ (2) Cu2+ + 2OH- = Cu(OH)2↓ (3) SO2 + 2OH- = SO32- + H2O (4) Fe + Cu2+ = Fe2+ + Cu (5) HCO3- + H+ = H2O + CO2↑
下列反应的离子方程式错误的是 BD A.氯化铜溶液与铁粉反应 + Cu2+ = Fe2+ + Cu 氯化铜溶液与铁粉反应Fe 氯化铜溶液与铁粉反应 B.氢氧化钡溶液和稀硫酸反应 2+ + SO42- = BaSO4↓ 氢氧化钡溶液和稀硫酸反应Ba 氢氧化钡溶液和稀硫酸反应 C.醋酸和氢氧化钠溶液反应 + + OH- = H2O 醋酸和氢氧化钠溶液反应H 醋酸和氢氧化钠溶液反应 D.铁与稀盐酸反应 铁与稀盐酸反应2Fe + 6H+ =2Fe3+ + 3H2↑ 铁与稀盐酸反应
第二节 电解质
主要内容
• 一、电解质及其电离 1.酸、碱、盐的电离 酸 2.酸、碱、盐是电解质 酸 • 二、电解质在水溶液中的反应 1.电解质在水溶液中反应的实质 电解质在水溶液中反应的实质 2.离子方程式 离子方程式
一、电解质及其电离
1、电解质、非电解质 、电解质、
化合物 根据在水溶液里或熔 融状态下能否导电 电解质 非电解质
• (1) Ba2++SO42-=BaSO4↓ ) • (2)2H++CO32-=CO2 +H2O ) • (3)2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O ) • (4)CaCO3+2H+==H2O+CO2↑+Ca2+ ) • • • • • • • • (5)化学方程式 )化学方程式NaOH+CH3COOH=CH3COONa+H2O 离子方程式OH-+CH3COOH=CH3COO-+H2O 离子方程式 (6)化学方程式 )化学方程式NH3H2O+CH3COOH=CH3COONH4+H20 离子方程式NH3H2O+CH3COOH=CH3COO- + NH4+ +H20 离子方程式 (7) 2Na+2H2O=2Na++2HO-+H2↑ ) (8)Fe2O3 + 6H+=2 Fe3+ + 3H2O . ) (9)Ca^(2+)+2OH^(-)+CO2==H2O+CaCO3↓ ) (10)OH- +HCO3- ==H2O+CO3 2)
