元素周期表的结构
元素周期表的概念和结构

元素周期表的概念和结构
(一)周期 把具有相同的电子层数而又按照原子序数递
增的顺序排列的一系列元素称为一个周期。 元素周期表共有7个横行即有7个周期。周期 的序数就是该周期元素原子具有的电子层数 。
把含有元素较少的一、二、三周期称为短周期; 含有元素较多的四、五、六周期称为长周期; 第七周期称为不完全周期。
元素周期表的概念和结构
稀有• 气体化学性质不活泼,在通常情况下很难发
生化学反应,把它们的化合价看作为零,因此叫0 族。 主族的族系数与该元素的最外层电子数相等。
整个元素周期表,有7个周期, 即3个长周期,3个短周期,1个不完全周期; 16个族,即7个主族,7个副族,1个第Ⅷ族, 1个0族。
课堂互动
元素周期表
元素种元素,根据元素周期律, 按照原子序数递增的顺序从左到右排成横行, 再把不同横行最外层的电子数相同的元素按 电子层递增。顺序由上到下排成纵行。这样 制成的一张表称为元素周期表(见附表)。 元素周期表是元素周期律的具体表现形式, 它反映了元素性质之间的相互联系和变化规 律。
• 某元素的原子最外层电子层结构(内层已 填满)为3S23P1,它在元素周期表中第几 周期?第几族?是什么元素?
元素周期表的概念和结构
(二)族
把最• 外层电子结构相似的元素,按电子层数递增
的顺序自上而下排列成的一个个纵行,称为族。 元素周期表中共有18个纵行。从左到右, 第8、9、10三个纵行合称为第Ⅷ族, 其余15个纵行,每个纵行表示一族。 、由长周期和短周期元素构成的族叫主族, 用A表示;完全由长周期元素构成的族叫副族 用B表示。族的系数用罗马数字来表示。 如ⅠA、ⅡA、ⅢA、……ⅠB、ⅡB、ⅢB……。
《元素周期表》(元素周期表的结构)

自我测评————(做一做)
2.思考: (1)最外层电子数是2的元素一定为ⅡA族的元素吗?
提示:不一定。可能是第ⅡA族元素,可能是稀有气体元素
He,也可能是过渡元素。 (2)元素周期表中同主族相邻两元素的原子序数相差多少? 提示:根据元素周期表可知,同主族相邻两元素的原子序数 相差2或8或18或32。
+
,则 X 元素在元素周期表中位 B.第四周期第ⅠA 族 D.第三周期第ⅦA 族
解析:X+带一个单位正电荷,故X 原子 的最外层 电子数 为1,X为19号元素钾,该元素原子的核外电子层数为4, 所以X元素位于第四周期第ⅠA族。
9.元素周期表是一座开放的元素大厦,元素大厦尚未客满。 请在元素大厦中为119号元素安排好它的房间( A ) A.第八周期第ⅠA族 B.第七周期第ⅦA族
(1)一个横行即是一个周期,一个纵行即是一个族。( × )
分析:元素周期表有7个横行,即7个周期;有18个纵行,但 有16个族,第Ⅷ族占据三个纵行。 (2)对于原子或离子都有以下关系式:原子序数=核电荷数= 核外电子数。( × )
分析:对于原子,该关系式成立,但对于离子,核电荷数不
等于其核外电子数。
把电子层数目相同的元素,按原子序数递增的顺序从左 到右排成横行,再把不同横行中最外层电子数相同的元素, 按电子层数递增的顺序由上而下排成纵行。
周期
把电子 层数相 同的元 素,按 原子序 数递增 的顺序 从左到 右排成 的横行
周期 序数 1 2 3 4 5 6 7
元素 种类数 2 8 短周期(3个) 8 18 18 32
Ⅷ
ⅠB ⅡB
阅读教材第四、五页,思考并填空:
二、现行元素周期表
1.原子序数
元素周期表 中的顺序给元素的编号。 (1)含义:按照元素在___________ (2)原子序数与原子结构的关系 质子数 核外电子数 核电荷数 =___________ 原子序数=__________ =
化学元素周期表的结构与特点

化学元素周期表的结构与特点化学元素周期表是化学领域中一张重要的工具,用于分类和组织元素。
它的结构和特点反映了元素的性质和规律。
本文将介绍化学元素周期表的结构与特点。
一、周期表的结构化学元素周期表基本上由一系列的水平行(周期)和垂直列(族)组成。
每个元素都根据其原子序数(即核中质子的数量)进行排序和编号。
以下是元素周期表的一些重要结构特点:1. 期(或主能级):元素周期表的水平行被称为期。
它们按照原子的能级顺序排列,从1到7。
随着周期数的增加,原子的能级也逐渐增大。
每个新的周期都代表着新的电子壳的填充。
2. 组(或族):元素周期表的垂直列被称为组。
它们是根据原子的电子配置和化学性质进行分类。
第1组到第2组被称为“s”区,第3组到第8组被称为“p”区,第9组到第10组被称为“d”区,第11组到第18组被称为“f”区。
3. 过渡元素区和稀土元素区:在元素周期表中,第4周期到第7周期被称为过渡元素区。
这个区域包含具有类似化学性质的元素。
稀土元素区则包括在f区内,这些元素在化学性质上也有一定的相似性。
4. 分区:元素周期表通常被分为两个部分,即主族元素和过渡元素。
主族元素一般是周期表最左边的一列,包括所有的s和p区元素。
过渡元素则在主族元素的右边,包括所有的d和f区元素。
二、周期表的特点元素周期表不仅反映了元素的结构,还展示了一些重要的周期性规律和特点。
以下是几个周期表的特点:1. 周期性:元素周期表的排列遵循一定的周期性规律,即元素的性质会随着原子序数的增加而呈现出周期性的变化。
例如,原子半径、离子半径、电负性等属性在周期表中都有可见的趋势规律。
2. 原子半径:原子半径是指元素中心核和最外层电子之间的距离。
周期表中,原子半径呈现出一个明显的趋势:从左到右呈递减,而从上到下呈递增。
这是由于核电荷的增加和电子层的填充。
3. 电离能:元素的电离能是指从一个原子中去除一个电子所需的能量。
周期表中,电离能也呈现出一定的规律:从左到右呈递增,在同一周期内,电离能随着原子序数的增加而递增。
1-2 元素周期律和周期表
性质
Na
Mg
Al
单质与水(或酸) 的反应情况
与冷水反应缓慢,与沸 与冷水剧烈反 与酸迅速反应放 水迅速反应,放出氢气, 应放出氢气 出氢气 与酸剧烈反应放出氢气
最高价氧化物对应 水化物的碱性强弱
NaOH 强碱
Mg(OH)2 中强碱
Al(OH)3 两性氢氧化物
金属性的强弱: Na > Mg > Al
内容 原子半径 电子层结构 失电子能力 得电子能力 金属性非金属性 主要化合价 同周期(从左到右) 同主族(从上到下) 大→小 电子层数相同、 最外层电子增多 逐渐减小 逐渐增大 小→大 电子层增多最外层 电子数相同 逐渐增大 逐渐减小
金属性减、非金属性增 金属性增、非金属性减
最高正价+1→+7 最高价氧化物对应的 碱性逐渐减弱 水化物酸碱性 酸性逐渐增强 形成:难→易 非金属元素气态氢 化物的形成与稳定性 稳定性:弱→强
元素性质呈周期性变化
归纳出
原子半径 大→小 (稀有气体元素突然增大)
化合价:+1→+7 -4→-1 (稀有气体元素为零)
元素周期律
3.微粒半径大小的判断规律 一层、二核、三电子
影响 半径 大小 的因素
①电子层数: 电子层数越多,原子半径越大 ②核电荷数: 当电子层数相同时核电荷数增多,使原子 半径有减小的趋向。 ③核外电子数: 电子数增多,增加了相互排斥,使原子 半径有增大的倾向。
最高正价=族系数 碱性逐渐增强 酸性逐渐减弱
形成:易→难 稳定性:强→弱
非金属性逐渐增强
ⅠA ⅡA
ⅢA ⅣA ⅤA
ⅥA ⅦA
0
1
2 3 4 5 6 7
金属性逐渐增强 金 属 性 逐 渐 增 强
元素周期表

元素周期表一、元素周期表的结构3个短周期(1、2、3周期)周期(7个)3个长周期(4、5、6周期)1个不完全周期(7周期)元素周期表主族(7个)IA~VIIA副族(7个)IB~VIIB族(16个)VIII族(1个)8、9、10三个纵行零族(1个)最右边一个纵行(惰性气体元素)归纳:七主、七副、一八、一零;三长、三短、一不完全。
四、元素周期表与原子结构的关系原子序数=核电荷数=核内质子数=核外电子数周期序数=电子层数主族序数=最外层电子数=元素的最高正价数*|最高正价数|+|负价数|=8元素周期表结构的记忆方法如下:横行叫周期,共有七周期;三四分长短,第七不完全;一八依次现,一零再一遍;竖行称作族,总共十六族;Ⅷ族最特殊,三行是一族;二三分主副,先主后副;镧锕各十五,均属ⅢB族;构位性一体,相互可推断。
三、元素周期表的应用3.元素周期表的应用1、预测元素的性质(由递变规律推测)常见的题目给出一种不常见的主族元素(如砹、碲、铋、铅、铟、镭、铯等),或尚未发现的主族元素,推测该元素及其单质或化合物所具有的性质。
解答的关键是根据该元素所在族的熟悉的元素的性质,根据递变规律,加以推测判断。
2、 按周期表的位置寻找元素 启发人们在一定区域内寻找新物质(农药、半导体、催化剂等)。
3、启发人们在一定区域内寻找新物质。
四、注意点1、判断元素金属性强弱。
a 、单质跟水或酸反应置换氢的氢的难易,易则强...。
b 、最高价氧化物的水化物的碱性强弱,碱性强则强.....。
c 、置换反应,强换弱...。
2、判断元素非金属性的强弱。
a 、跟随氢气形成气态氢化物的难易,易则强...。
b 、氢化物的稳定性,稳则强...。
c 、最高价氧化物的水化物的酸性强弱,酸性强则强.....。
d 、置换反应,强换弱...。
3、核素和同位素区别(1)核素:具有一定数目的质子和一定数目的中子的一种原子。
如1H(H)、2H(D)、3H(T)就各为一种核素。
原子结构与元素周期表 (1)讲解

ds区元素
ⅠB和ⅡB族
价层电子构型是(n-1)d10ns1~2,即次
外层d轨道是充满的,最外层轨道上有1~ 2个电子。它们既不同于s区,也不同于d 区,故称为ds区,它包括ⅠB和ⅡB族, 处于周期表d区和p区之间。它们都是金属, 也属过渡元素。
f区元素
镧系和锕系元素
最后1个电子填充在f轨道上,价电子构型
金属,容易失去电子形成+1 或+2价离子。
元
外围电子排布
周素
期 数 ⅠA-ⅡA ⅢB-Ⅷ ⅠB-ⅡB ⅢA- 0族
目
ⅦA
12
1S1
1S2
28
2S1-2
2S22p1 -5 2S22p6
3 18 3S1-2
3S23p1 -5 3S23p6
4 18 5 32 6 32
4S1-2 5S1-2 6S1-2
3d1-9 4s2 4d1-9 5s2
p区
S区
d区
ds区
下午12时23分
f区
小结
各区元素特点
包括元素 价电子排布 化学性质
s区 ⅠA、ⅡA族
ns1、ns2
活泼金属(H除外)
p区 ⅢA~ⅦA族和0族元素 ns2np1~6
大多为非金属
d区 ⅢB~ⅦB族和Ⅷ族 (n-1)d1~ ds ⅠB、ⅡB族 1(n0n-s11~)2d10ns1~2 区 镧系和锕系
金属 0 2 3 14 15 30 ?
元素 数目
31
由于随着核电荷数的递增,电子在能级里的填 充顺序遵循构造原理,元素周期系的周期不 是单调的,每一周期里元素的数目不总是一 样多,而是随着周期序号的递增渐渐增多。 因而,我们可以把元素周期系的周期发展形 象的比喻成螺壳上的螺旋。
高三化学元素周期表与元素的电子结构

高三化学元素周期表与元素的电子结构化学元素周期表是化学学科的重要基础知识,它是按照元素的原子序数从小到大排列的表格,用来系统地组织和展示元素的化学性质和物理性质。
同时,元素周期表也反映了元素电子结构的规律。
本文将介绍高中化学中元素周期表以及元素的电子结构方面的内容。
一、元素周期表的组织结构元素周期表的组织结构主要包括周期、族和区块等概念。
1. 周期:元素周期表的水平行称为一个周期,元素周期表一共有7个周期。
周期数与元素的原子核外层电子的主量子数n相同。
周期一中的元素电子层数为1,周期二中的元素电子层数为2,依此类推。
2. 族:元素周期表的垂直列称为一个族,元素周期表一共有18个族。
族数与元素的原子核外层电子的价壳层数相同。
3. 区块:元素周期表中的每个小方格称为一个区块,它包含了一个元素的所有重要信息,如元素的原子序数、元素符号、原子量等。
二、元素周期表的重要特点元素周期表中的元素按照一定的规律排列,这些规律包括周期律和离子律等。
1. 周期律:周期律指的是元素周期表中的元素按照一定的顺序排列,其化学性质呈现规律性的重复。
具体而言,元素周期表中的元素按照原子序数递增的顺序排列,能够使得每一个周期内元素的外层电子数依次增加,从而使每个周期内的元素具有相似的化学性质。
2. 离子律:离子律指的是元素周期表中的元素根据其原子核外层电子的失去或获得情况,形成带电离子,而这些离子又具有一定的规律性。
例如,一族元素的离子带正电,其电子结构相似,化学性质也相似。
三、元素的电子结构元素的电子结构是指元素的原子核外层电子的分布方式。
根据电子结构的规律,我们可以推导出元素的化学性质和物理性质。
1. 电子排布规律:根据泡利不相容原理、奥卡规则和洪德规则,可以确定元素的电子填充顺序。
简单来说,泡利不相容原理指出一个轨道上的电子应该尽可能地分布得离散,而不是集中在同一个状态;奥卡规则指出在填充轨道时,电子会先填充低能级轨道;洪德规则指出,一个轨道能容纳的最多电子数为2。
第一节元素周期表

归纳:碱金属的主要物理性质
相似性: 1) 银白色有金属光泽(铯略带金色) 2) 较柔软,有延展性 3) 密度小 4) 熔点低(均小于200℃) 5) 导电、导热
递变性: 随着核电荷数的增加:
• 密度增大 (但K 反常) • 熔、沸点逐渐降低
2、卤族元素
(1)物理性质
物理性质
随原子序数的递增: 1.颜 色: 颜色逐渐加深 2.状 态: 气态~液态~固态 3.熔沸点: 逐渐升高 4.密 度: 逐渐增大
(2)原子结构
(3)化学性质
①卤素单质与氢气反应
卤素单质与氢气反应 剧烈程度:F2>Cl2>Br2>I2 生成氢化物稳定性:
HF>HCl>HBr>HI
②卤素单质间的置换反应
颜色
溶于水
溶于CCl4
Cl2
黄绿色
黄绿色
黄绿色
Br2
深红棕色 橙黄色
橙红色
I2
紫黑色
褐色
紫红色
实验1—1
实验
现象
化学方程式
57
6 55 56 - 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
71
7 87 88 89103
104
105
106
107
108
109
110
111
112
过渡元素
镧 系 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71
碳有两个电子层,位于第二周期,镁有三个电子层, 位于第三周期;溴有四个电子层,位于第四周期。
(2)族(16个) 七个主族 七个副族 一个第Ⅷ族(3个纵行) 一个0族
元素周期表的结构和性质

元素周期表的结构和性质一.门捷列夫元素周期表是元素周期律的具体体现形式,其构成为7个横行,又叫7个周期,1、2、3为短周期,4、5、6为长周期,7为不完全周期,每个周期包含的元素种类数分别为2、8、8、18、18、32、26 。
镧系,位于第6周期第ⅢB族,57 La—71Lu 共15种元素,锕系位于第7周期第ⅢB族,89Ac—103Lr共15种元素,它们各占一格,是因为所含元素结构和性质相似。
92U 以后元素是人工核反应制得,叫超铀元素,具有放射性。
同周期元素特点,是电子层相同,原子序数递增,周期序数=电子层数,每个周期均由ⅠA元素开始,以零族元素结尾,除第1和第7周期外每个周期的元素的最外层电子数大致以1递增到8.二.18个纵行,16个族、7个主族、7个副族、一个第Ⅷ族、一个零族。
短周期和长周期共同形成的族为主族(除零族),主族用罗马数字加A表示。
主族序数=最外层电子数;只有长周期元素形成的族叫副族,副族用罗马数字加B表示;8、9、10三个纵行自为一族,叫第Ⅷ族,稀有气体为零族,短周期中既有非金属又有金属的族为第ⅠA族和第ⅢA族,同主族元素序数间存在2倍关系的为第ⅥA族的O 和S 稀有气体的Ar和Kr,含有第一周期元素的族为第ⅠA族和零族。
三.副族和第Ⅷ族元素称为过度金属元素,共10列,其特点是最外层电子数均为1和2个电子,除第ⅠB和第ⅡB外,其次外层电子均不是8或18的稳定结构。
四.族序数=列数的个位数,先主族后副族,2、3位置主副转换即第ⅡA 族和第ⅢA族从第4周期被过度元素的10个纵行分开,因此,同周期主族序数相邻的元素,原子序数差不一定为1.例同周期的第ⅡA 族和第ⅢA族元素序数差可为11或25.五.同主族元素位于相邻周期的序数差,若为第ⅠA族和第ⅡA 族,序数差一次为2、8、8、18、18、32,若为第ⅢA族至零族,序数差为8、8、18、18、32.六.金属盒非金属区1、周期表中,金属元素位于左下方,非金属元素位于右上方,分界线附近时金属和非金属的过渡区,在分界线附近的元素通常既有金属性又有非金属性,通常在该区域内寻找半导体材料和两性物质。
元素周期表的结构和应用

元素周期表的结构和应用元素周期表是化学中最重要的工具之一,它以一种有序的方式展示了所有已知元素的特性和属性。
这个表的结构和应用对于理解化学现象和推动科学发展起到了重要作用。
一、周期表的结构元素周期表是由俄罗斯化学家门捷列夫于1869年首次提出的。
它的结构是基于元素的原子序数(即元素的核外电子数)和化学性质的周期性变化而设计的。
周期表按照原子序数从小到大排列,同时将具有相似化学性质的元素放在同一列中。
周期表的主要结构是由横行和纵列组成的。
横行被称为周期,纵列被称为族。
每个周期都代表了一个新的能级,而每个族则代表了具有相似电子配置和化学性质的元素。
二、周期表的应用1. 元素周期表的预测作用周期表的结构使得科学家可以通过已知元素的特性来预测未知元素的性质。
例如,根据周期表中元素的排列规律,我们可以推测出新发现的元素的化学性质和反应活性。
这种预测性的应用有助于科学家们更好地理解元素之间的关系,并为新材料的发现和应用提供了指导。
2. 元素周期表在化学教育中的作用元素周期表是化学教育中必不可少的工具。
通过周期表,学生可以了解不同元素的特性和周期性变化规律。
这有助于学生更好地理解化学反应和化学方程式,并培养他们对元素和化学的兴趣。
周期表还可以帮助学生记忆元素的名称、符号和原子序数,为他们的学习提供了便利。
3. 元素周期表在材料科学中的应用周期表的结构和性质对于材料科学也有重要意义。
通过研究周期表中元素的特性和周期性变化规律,科学家们可以设计和合成新的材料,如高温超导体、新型催化剂和半导体材料等。
周期表的应用使得材料科学取得了巨大的进展,为人类创造了更多的科技应用和发展机会。
4. 元素周期表在环境保护中的应用元素周期表的应用还延伸到了环境保护领域。
通过研究元素的毒性和环境行为,科学家们可以更好地评估和管理环境中的污染物。
周期表的结构和性质为环境监测和治理提供了依据,有助于保护地球的生态平衡和人类的健康。
总结:元素周期表的结构和应用是化学领域的重要内容。
元素周期表的结构与应用

元素周期表的结构与应用元素周期表是化学科学中一个无比重要的工具,它以一种简洁明了的方式呈现出所有已知元素的物理和化学特性,也提供了化学工业和实验室研究所需的一些重要信息。
本文将介绍元素周期表的结构和应用。
元素周期表的结构元素周期表根据元素的物理和化学性质排列,最初由俄国化学家迪米特里·门捷列夫在19世纪周期性定律的基础上发明。
所谓周期性定律是指,元素的物理和化学性质有规律地随着原子序数增加而变化,原子序数在相邻元素之间每增加一个单位,元素的物理和化学性质就会周期性地重复。
元素周期表由若干个横排和若干个竖排组成。
横排称为周期,是元素原子核中质子数量(也就是原子序数)相同的一组元素。
竖排称为族,是元素原子中电子结构相同的一组元素。
周期和族分别代表元素的周期性和相似性。
元素周期表中每个元素都有一个简称的符号,叫做元素符号,用于标识元素。
此外,元素周期表还提供了每个元素的原子序数,相对原子质量和电子结构等信息。
元素周期表的应用元素周期表的应用十分广泛,包括以下几个方面:1. 化学反应元素周期表为化学反应提供了指导。
根据周期法则,我们可以预测一些元素的化学反应和物理特性。
例如,第一族元素钾、钠等,都是极易放电的金属,因为它们基本上放弃了价电子,形成正离子,化学反应中会释放出电子,产生电流。
而类似于氢、氦这样的第一周期元素,则处于更稳定的状态,基本不会被激发或反应。
2. 化学工业元素周期表对于化学工业的发展也具有重要意义。
化学通常以某个燃料作为起点,经过反应和炼制等工艺过程将化学物质转化为另一种有用的化学品。
这个炼制过程通常会受到一些难以控制的化学反应或化学副作用的影响,因此我们需要大量的研究和合成以找到各种可能的反应路径。
在这个过程中,元素周期表提供了一个基础框架,可帮助化学家理解元素之间的相互关系和反应机制,加快新化学品的开发进度。
3. 生物化学元素周期表也在生物化学和医学研究中发挥着作用。
可以发现,健康和生长需要人体内部元素的平衡和稳定。
元素周期表的组成与结构

元素周期表的组成与结构元素周期表是化学领域中最为重要的参考工具之一,它以一种系统、有序的方式展示了所有已知元素的信息。
本文将探讨元素周期表的组成与结构,介绍其基本原理以及对科学研究和应用的重要性。
1. 元素周期表的组成元素周期表由一系列元素组成,每个元素都具有独特的原子序数、原子符号和原子质量。
目前已发现的元素共有118种,按照原子序数的顺序排列在周期表中。
这些元素被分为周期和族,周期对应元素的能级,族则指具有相似化学性质的元素。
在周期表中,元素周期递增,就如同一条长蛇。
2. 元素周期表的结构元素周期表通常被分为若干个区域,包括主要区、过渡区和稀有气体区。
主要区是周期表最为常见的部分,包含了大多数元素。
过渡区则位于主要区和稀有气体区之间,包含了过渡金属元素。
稀有气体区指的是位于周期表最右侧的元素,这些元素通常不与其他元素形成化学反应。
3. 周期与族的特征周期表的周期性特征是十分显著的,每个周期的第一元素通常是碱金属,具有低熔点和高反应性。
而最后一元素则是稀有气体,具有稳定的电子结构。
族与周期的排列方式则突显了元素之间的相似性质。
例如,第一族为碱金属,在反应性和电子构型方面表现出相似的特征。
其他族的元素也有类似的特点,这使得周期表成为了研究元素化学性质和规律的有力工具。
4. 元素周期表的重要性元素周期表为研究元素和化合物的性质提供了便捷的途径。
它揭示了元素的周期性规律,包括原子半径、电离能、电负性等。
通过周期表,我们可以推测出元素的化学性质和反应性,进而预测他们在化学反应中的行为。
元素周期表也在开发新材料和发现新元素方面发挥着重要的作用。
总结起来,元素周期表是一种用于展示元素信息和规律的工具。
它的组成由一系列具有特定原子序数、原子符号和原子质量的元素构成,并按照周期和族的方式排列。
周期表的结构包括主要区、过渡区和稀有气体区。
元素周期表的周期性特征以及族的相似性质有助于研究元素间的规律和化学性质。
元素周期表在科学研究和应用中具有重要价值,为理解元素以及化合物的性质提供了支持,并在材料科学和新元素发现方面发挥了重要作用。
元素周期表的基本结构和特点

元素周期表的基本结构和特点一、元素周期表的起源和发展•1869年,门捷列夫发现了元素周期律,并编制出第一个元素周期表。
•随着化学元素的不断发现和核反应技术的进步,周期表逐渐完善和扩展。
二、元素周期表的基本结构•横行称为周期,竖列称为族。
•周期表共有7个周期,从第1周期到第7周期。
•周期表共有18个族,包括7个主族、7个副族、1个0族和1个第Ⅷ族。
三、周期表的排列规律•周期表中,元素的原子序数依次增加。
•周期表中,同一周期的元素电子层数相同,同一族的元素最外层电子数相同。
四、元素周期表的特点•周期表反映了元素的原子结构与元素性质之间的关系。
•周期表中,周期与周期的交界处往往是一些特殊元素的所在,如超铀元素。
•周期表中,族与族之间的过渡元素往往具有相似的化学性质。
五、元素周期表的应用•周期表是化学领域的重要工具,可以查找到元素的物理和化学性质。
•周期表有助于预测和解释新元素的发现及其可能的性质。
•周期表为化学教育和研究提供了系统的分类和归纳方式。
六、元素的命名和符号•元素以化学符号表示,符号通常由一个或两个字母组成。
•元素符号的第一个字母大写,第二个字母小写。
•元素名称通常以英文表示,也有一些元素的名称来源于其他语言。
七、周期表的拓展•周期表还包括了一些具有特定性质的元素,如过渡元素、镧系元素和锕系元素。
•周期表的研究还涉及到同位素、元素周期律的微观解释等方面。
以上是关于元素周期表的基本结构和特点的知识点介绍,希望对你有所帮助。
习题及方法:1.习题:元素周期表中有多少个周期?解题方法:回顾元素周期表的基本结构,周期表共有7个周期。
答案:7个周期。
2.习题:元素周期表中有多少个族?解题方法:根据元素周期表的基本结构,周期表共有18个族。
答案:18个族。
3.习题:请列举出周期表中的7个主族。
解题方法:根据元素周期表的基本结构,主族元素位于周期表的左侧。
答案:第1主族(碱金属族)、第2主族(碱土金属族)、第3主族(硼族)、第4主族(碳族)、第5主族(氮族)、第6主族(氧族)、第7主族(卤素族)。
元素周期表的基本结构和特点

元素周期表的基本结构和特点元素周期表是化学领域中一项重要的工具,为科学家们研究和理解元素的性质以及元素之间的相互作用提供了基础。
本文将介绍元素周期表的基本结构和特点。
一、基本结构元素周期表主要由一张方形表格构成,表格中按照一定规律排列了所有已知的化学元素。
这些元素按照原子序数的顺序从左至右排列,并且根据元素的共性进行分类和分组。
每个元素都用一个简写或符号表示,这些符号通常由元素的拉丁名的前一个或前两个字母组成。
表格的水平行称为周期,垂直列称为族。
元素周期表共有七个周期和十八个族。
在周期表的左侧是金属元素,右侧是非金属元素。
金属元素通常位于周期表的中部,而非金属元素则位于两侧。
二、特点1. 周期性元素周期表将元素按照原子序数的增加顺序排列。
原子序数是指元素原子核中的质子个数或者是元素中电子的数目。
按照这个排列顺序,元素周期表可以看到元素性质的周期性变化。
2. 原子量元素周期表中的每一个元素都标有其对应的原子量。
原子量是指元素一个普通原子的相对质量。
在周期表中,原子量通常以小数形式表示,对应该元素不同同位素的平均质量。
3. 周期规律元素周期表中的元素具有明显的周期性规律。
例如,周期表中在同一周期的元素具有相似的电子排布和能级结构。
而在同一族的元素,由于共享相同的化学性质,常常表现出相似的反应性和化学行为。
4. 元素分类元素周期表将元素分为金属、非金属和类别不明的元素三大类。
金属元素通常具有良好的导电和热导性能,而非金属元素则主要以半导体或绝缘体的形式存在。
类别不明的元素则是指一些尚未被归类到金属或非金属的特殊元素。
5. 变价性元素周期表中的元素通常具有多种不同的氧化态,即变价性。
变价性指的是元素在化合物中能够失去或获得的电子数目。
由于元素周期表中的分组和周期划分得当,因此我们可以根据元素在周期表中的位置预测其可能的氧化态。
结论元素周期表作为化学中极为重要的工具,为科学家们提供了一个理解元素性质和元素之间相互作用的基础。
化学元素周期表的基本结构和分类原则是什么

化学元素周期表的基本结构和分类原则是什么化学元素周期表是化学元素按照一定规律排列的表格,通过周期表我们可以了解到元素的基本性质、原子结构以及元素之间的关系。
本文将介绍化学元素周期表的基本结构以及分类原则。
一、化学元素周期表的基本结构1. 元素周期表的排列方式化学元素周期表按照一定的规则排列,一般可以分为横排(周期)和竖排(族)。
横排代表元素的周期数,竖排代表元素所属的族。
2. 元素周期表的重要信息在化学元素周期表中,每个元素的方块内通常包含有如下的信息:- 元素符号:用来表示该元素的简写,例如H代表氢元素。
- 原子序数:表示元素在周期表中的位置,也表示了元素的原子核中质子的数量,例如氢元素的原子序数为1。
- 原子质量:代表元素一个普通原子的平均质量,通常以原子单位表示。
- 元素名称:元素符号对应的名称,例如H对应氢元素。
二、化学元素周期表的分类原则1. 以周期数为基础的分类元素周期表的周期数表示了元素的电子层数,不同周期的元素拥有不同数量的电子层。
第一周期元素只有1个电子层,第二周期元素有2个电子层,以此类推。
这种分类方式将元素按照电子层的增加顺序进行排列。
2. 以族为基础的分类元素周期表的族数表示了元素的化学性质。
同一族的元素具有相似的化学性质,这是由于它们具有相同的电子结构。
例如,第一族是碱金属元素,它们都是高活性金属,具有较低的电离能和较大的电负性。
3. 分类的规律在化学元素周期表中,元素的性质和周期、族的位置有一定的规律性。
同一周期中,元素的原子半径和电离能呈现出规律性的变化。
同一族中,元素的化学性质相似,往往具有相同的氧化态和化合价。
此外,除了周期数和族数,元素周期表还可以根据元素的其他性质进行分类,如金属和非金属元素的区分,化学元素周期表还可以根据以往的研究发现的新元素进行更新和扩展。
综上所述,化学元素周期表是一种以周期数和族为基础的分类体系,展示了元素的基本结构和化学性质的规律。
通过学习和理解元素周期表,我们可以更好地了解和研究元素及其化合物的性质和应用。
元素周期表的结构

元素周期表的结构
1,周期含义:元素周期表共有7个横行,每一横行是一个周期,第1横行是第一周期,第2横行是第二周期,以此类推共7个周期。
2,族的含义:元素周期表共有18个纵行,每一纵行叫一族(其中8、9、10三个纵行共同组成一个族),共16个族。
3,周期的特点:同一周期元素的原子核外电子层数相同,从左到右:核外电子数依次增多,最外层电子数由1——8
4,族的特点:同一族元素的原子最外层电子数相同,均为8个电子(氦特殊情况最外层是2个电子),从上到下:电子层数逐渐增多(由1层——7层)。
5,元素周期表中每一格中元素的相关信息
原子序数=核电荷数=核内质子数=核外电子数。
相对原子质量的近似值=质子数+中子数。
高考化学考点26 元素周期表的结构
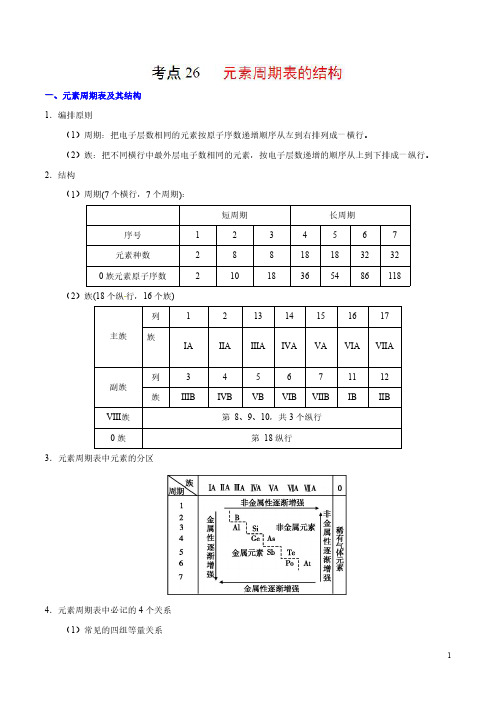
一、一、元素周期表及其结构1.编排原则(1)周期:把电子层数相同的元素按原子序数递增顺序从左到右排列成一横行。
(2)族:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序从上到下排成一纵行。
2.结构(1)周期(7个横行,7个周期):短周期长周期序号1234567元素种数288181832320族元素原子序数21018365486118(2)族(18个纵行,16个族)主族列121314151617族ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 副族列345671112族ⅢBⅣBⅤBⅥBⅦBⅠBⅡBⅧ族第8、9、10,共3个纵行0族第18纵行3.元素周期表中元素的分区4.元素周期表中必记的4个关系(1)常见的四组等量关系①核电荷数=质子数=原子序数;②核外电子层数=周期序数;③主族序数=最外层电子数=最高正价;④非金属元素:最低负价=最高正价−8。
(2)同主族元素的原子序数差的关系①位于过渡元素左侧的主族元素,即第ⅠA、第ⅡA族,同主族、邻周期元素原子序数之差为上一周期元素所在周期所含元素种数;②位于过渡元素右侧的主族元素,即第ⅢA~第ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。
例如,氯和溴的原子序数之差为35−17=18(溴所在第四周期所含元素的种数)。
(3)同周期第ⅡA族和第ⅢA族元素原子序数差的关系周期序数1234567原子序数差无1111112525增加了过渡元素和原因——增加了过渡元素镧系或锕系元素(4)奇偶关系①原子序数是奇数的主族元素,其所在主族序数必为奇数;②原子序数是偶数的主族元素,其所在主族序数必为偶数。
二、元素周期表的应用考向一元素周期表的结构典例1如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为A.5x+10B.5x C.5x+14D.5x+16【解析】【答案】A【规律总结】同主族、邻周期元素的原子序数差的关系①ⅠA族元素,随电子层数的增加,原子序数依次相差2、8、8、18、18、32。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
按照原子的核电荷数从大到小进行排列
原子序数=核电荷数=质子数=核外电子数
将电子层数相同的元素,按原子序数递增 的顺序从左到右排成横行,称为周期 周期数=电子层数 将最外层电子数相同的元素,按电子层数 递增的顺序由上而下排成纵行,称为族 主族序数=最外层电子数
短周期
周期
(7个) 长周期
第 1周期 第 2周期
第 3周期 第 4周期
第 5周期 第 6周期 第 7周期
—— 2 种 —— 8 种 —— 8 种 —— 18 种
—— 18 种 —— 32 种 —— 26 种
三七
短主
三七 长副
一一
不 VIII 全一
0
族Байду номын сангаас
(16个)
主族 副族
共 7 个主族,包括短周期和长周期元素 共 7 个副族,只包括在长周期中
第VIII族 包括第8、9、10 纵行
0族
稀有气体元素
