浅谈氢负离子还原剂LiAlH4与NaBH4.
制取lialh4的实验原理 -回复

制取lialh4的实验原理-回复制取LiAlH4的实验原理1. 引言(Introduction)LiAlH4(四氢化铝锂)是一种重要的还原剂,广泛应用于有机合成中。
它能够与醛、酮、酸酐等含氧化合物发生还原反应,生成相应的醇、胺等产物。
制备LiAlH4的方法有多种,其中常用的是通过反应母体法进行制备。
本文将介绍通过反应母体法制备LiAlH4的实验原理。
2. 实验原理(Experimental principle)制取LiAlH4的实验原理依赖于碱金属反应母体与铝的反应。
具体反应方程式如下:4LiH + AlCl3 →LiAlH4 + 3LiCl3. 实验装置与试剂(Experimental setup and reagents)实验装置一般包括反应器、加热设备和气体分离装置等。
所需试剂包括纯度较高的LiH和AlCl3。
4. 实验步骤(Experimental procedure)(1)将适量的LiH和AlCl3分别放入反应器中;(2)将反应器密封,在真空下进行干燥处理,以去除不含水的气体;(3)升高反应器温度,使LiH开始分解;(4)升高温度至足以引发反应,并继续加热一段时间,使反应得以充分进行;(5)待反应结束后,冷却反应器,取出生成的白色固体产物。
5. 实验结果分析与结论(Analysis and conclusion)制备得到的白色固体产物即为LiAlH4。
为了验证产物的纯度,可以使用X射线衍射(XRD)等方法进行鉴定。
此外,产物的熔点和元素分析也可用于进一步确认LiAlH4的生成。
6. 实验原理解释(Explanation of experimental principle)(1)反应母体法:在制备过程中,反应母体(LiH)是主要的原料,而铝(AlCl3)主要起辅助催化剂的作用。
反应母体法中,LiH会生成Li+和H-离子,H-离子与AlCl3反应生成LiAlH4。
(2)热分解反应:通过加热LiH和AlCl3,LiH会发生热分解,生成Li+和H-离子。
(na,li)alh4体系放氢性能的第一性原理研究

(na,li)alh4体系放氢性能的第一性原理研究NaLiAlH4体系放氢性能的第一性原理研究一直是热研究课题。
NaLiAlH4是一种常用的固体氢气储藏电催化剂。
它具有优良的可溶性和放氢性能,因此在电催化放氢和重金属在线烧结放氢技术开发方面具有重要的研究价值。
从理论上来看,NaLiAlH4放氢的机理比较复杂,常见的放氢机理有物理放氢和化学放氢两种,在这两种机理之间,有关NaLiAlH4反应过程的涉及非常复杂,涉及包括库仑势面、能带结构、反应路径、准备活化能等等,这些都影响着NaLiAlH4放氢性能。
因此,对NaLiAlH4放氢性能进行细节机理研究,研究者往往采用量子化学理论,如分子动力学(Molecular Dynamics,MD)[1]、自洽多多位相(Self-Consistent-Field,SCF)[2], 全占据分子轨道(Full Occupied Molecular Orbital,FOMO)[3]和密度泛函理论(Density Functional Theory,DFT)[4,5]等方法,对NaLiAlH4放氢反应进行微观层次的分析研究。
总的来说,使用密度泛函理论方法对NaLiAlH4放氢反应的机理进行深入研究,可以获取系统内关键结构-能量变化的洞察,进而深入研究NaLiAlH4的放氢机理,为今后研究和开发NaLiAlH4放氢体系提供理论参考和依据。
参考文献:[1]R. P. Saini,H. U. Jain andR. Saini, Molecular Dynamics Simulations of Hydrogen Release from NaAlH4 and LiAlH4, J. Phys. Chem. C, 2009, 113(17), 7084-7091.[2]Y. Li, X. Li, B. Li and S. Y. Zhang, DFT studies on dehydrogenation of LiAlH4 and NaAlH4, Chem Phys Lett, 2004, 387(1-2), 86-91.[3]J. Kang, G. Qin and Q. Xu, First Principals Study of Hydrogen Release from NaAlH4 and LiAlH4, J. Phys. Chem. C, 2010, 114(20), 9490-9496.[4]J. Kang and G. Qin, A Theoretical Insights into the Hydrogen Storage Properties of LiAlH4, J. Phys. Chem. C, 2009, 113 (2), 688-694.[5]J. Hu,H. Liu and X. Huang, A First Principles Study of the Dehydrogenation Characteristics of NaAlH4, J. Phys. Chem. C, 2012, 116 (14), 8503-8509.。
有机lialh4作用

有机lialh4作用
有机锂铝氢化物(LiAlH4)是一种常用的还原剂,它在有机合
成中具有广泛的应用。
它的作用主要体现在以下几个方面:
1. 还原酮和醛,LiAlH4可以将酮和醛还原为相应的醇。
它的
还原能力很强,可以将碳氧双键还原为碳碳单键,生成醇。
例如,
乙酰酮可以被LiAlH4还原为乙醇。
2. 还原酯和酰卤,LiAlH4可以将酯和酰卤还原为醇和相应的
氯化物。
这个反应通常用于制备醇化合物或氯化物。
3. 还原羧酸和酰胺,LiAlH4可以将羧酸和酰胺还原为醇和胺。
这个反应通常用于合成醇和胺化合物。
4. 还原烯烃和炔烃,LiAlH4可以将烯烃和炔烃还原为相应的烃。
这个反应通常用于合成烃化合物。
5. 还原其他官能团,除了上述常见的官能团,LiAlH4还可以
还原其他一些官能团,如酰亚胺、硝基、卤代烷基等。
需要注意的是,使用LiAlH4时需要在惰性气氛下进行,因为它与空气中的水分和氧气反应剧烈。
此外,LiAlH4是一种强还原剂,具有较高的反应活性,因此在使用时需要小心操作,并遵循安全操作规程。
总结起来,有机锂铝氢化物(LiAlH4)是一种常用的还原剂,可以将酮、醛、酯、酰卤、羧酸、酰胺、烯烃、炔烃等多种官能团还原为相应的化合物。
它在有机合成中发挥着重要的作用。
LiAlH4还原剂

CH3(CH2)8CH2Br 机理: Li+ H3Al H
LiAlH4
CH3(CH2)8CH3
3.1 卤 代 烃 的 还 原
+ CH2 R
X
RCH3
+
AlH3 + LiX
羰基化合物很容易被LiAlH4还原成羟基化合物 还原成羟基化合物, 羰基化合物很容易被 这类反应室温下可在乙醚中平稳地、 这类反应室温下可在乙醚中平稳地、当量地进 行。
3.3 腈 类 化 合 物 的 还 原
酰胺和酰亚胺可以被LiAlH4还原成碳 酰胺和酰亚胺可以被 原子数相同的胺。 原子数相同的胺。
例:
3.4 酰 胺 和 酰 亚 胺 的 还 原
环氧化合物经氢化锂铝还原得到醇。 环氧化合物经氢化锂铝还原得到醇。 负氢离子进攻位阻较小的一边。 负氢离子进攻位阻较小的一边。顺序 是伯碳优先于仲碳,仲碳优先于叔碳。 是伯碳优先于仲碳,仲碳优先于叔碳。
◎
◎
氢化铝锂》 《化合物中的新秀——氢化铝锂》——任道华 任道华
黄培强, 《有机合成》——黄培强,靳立人,陈安齐; 有机合成》 黄培强 靳立人,陈安齐; 高等教育出版社, 高等教育出版社,2004,6 ,
◎
伯醇
反应机子的转移实现。 其还原过程是通过氢化锂铝的负氢离子的转移实现。
LiAlH4还原 ,β—不饱和羰基化合 还原α, 不饱和羰基化合 物,主要得到羰基还原产物 :
例:CH 3CH CHCHO 1. LiAlH 4 干乙醚 2. H 2 O CH 3CH CHCH 2OH
2、LiAlH4的合成 、
600~700℃
传统方法: 传统方法:
(加热回流) 加热回流)
28~31℃ ℃
可以产生氢负离子的化合物

可以产生氢负离子的化合物
标题:产生氢负离子的化合物
氢负离子是一种带有一个额外电子的氢离子,可以在化学反应中产生。
以下是几种能够产生氢负离子的化合物。
1. 锂铝氢化物(LiAlH4):作为一种常见的还原剂,锂铝氢化物可以与水反应产生氢气和氢氧化铝。
在这个反应中,锂铝氢化物中的氢负离子与水中的氢离子结合形成氢气,释放出能量。
2. 氨(NH3):氨分子中的氮原子带有孤对电子,可以与质子结合形成氢离子。
因此,氨可以产生氢负离子。
氨是一种常见的氢源,在氢气的合成和氢燃料电池中被广泛使用。
3. 锂铝氮化物(Li3N):锂铝氮化物是一种具有高电负性的化合物,其中的氮原子可以与锂离子结合形成氮负离子。
这个氮负离子可以与氢离子结合形成氢负离子。
4. 锂硼氢化物(LiBH4):锂硼氢化物是一种常用的氢源,可以在合成氢燃料和储氢材料时产生氢负离子。
锂硼氢化物中的硼原子带有孤对电子,可以与质子结合形成氢离子,进而形成氢负离子。
5. 钠硼氢化物(NaBH4):钠硼氢化物是另一种常用的氢源,可以产生氢负离子。
钠硼氢化物中的硼原子也带有孤对电子,可以与质子结合形成氢离子,从而形成氢负离子。
通过使用以上化合物,我们可以产生氢负离子,并在不同的化学反应和应用中利用它们。
这些氢负离子的形成为我们提供了更多的选择和机会,来开发新的能源技术和环保材料。
浅谈氢负离子还原剂LiAlH4与NaBH4
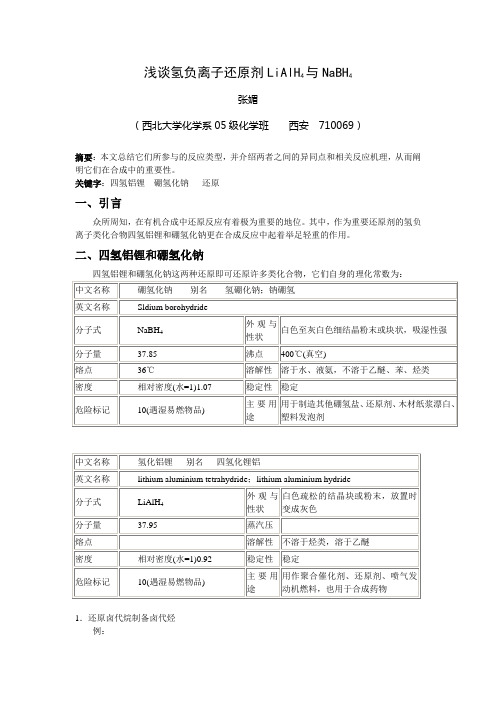
浅谈氢负离子还原剂LiAlH4与NaBH4张媚(西北大学化学系05级化学班西安710069)摘要:本文总结它们所参与的反应类型,并介绍两者之间的异同点和相关反应机理,从而阐明它们在合成中的重要性。
关键字:四氢铝锂硼氢化钠还原一、引言众所周知,在有机合成中还原反应有着极为重要的地位。
其中,作为重要还原剂的氢负离子类化合物四氢铝锂和硼氢化钠更在合成反应中起着举足轻重的作用。
二、四氢铝锂和硼氢化钠1.还原卤代烷制备卤代烃例:CH 3(CH 2)8CH 2Br LiAlH 4CH 3(CH 2)8CH 3机理:Li + H 3AlHCH 2RCH 3+AlH3LiX++RCH 3(CH 2)6CH 2X4二甘醇二甲醚CH 3(CH 2)6CH 3注意:四氢铝锂只能在无水条件下进行反应,而硼氢化钠没有此限制,这表明两种物质反应时所需要的介质是不一样的。
2.还原炔氢四氢铝锂还原为反式烯烃CH 3CCH1 LiAlH 42CH 3CH CH 2注意:硼氢化钠不能还原炔烃 3.还原羰基化合物(1):醇的制备RCH 2OH CH OHR'RR C OHO R C H O RCH 2OH RC OR'O Na, EtOHRCH 2OHR C R'O LiAlH 4LiAlH 4NaBH 4 或 LiAlH 4或 催化氢化伯醇伯醇或伯醇NaBH 4 或 LiAlH 4或 催化氢化仲醇以上表明,四氢铝锂可以还原醛、羧酸、酯、酮等羰基化合物,而硼氢化钠只能还原醛和酮以及酰卤等类化合物。
例:1. NaBH 42.H 2OCH 3CH CHCH 2OHCH 3CH CHCHOC H 3C HC H C H O42C H C H 2OHC H 3C H例:OHCH 3LiAlH 4OCH 31.Et O 2+98%H 2C CHCH 2COOH4,Et 22H 2CCHCH 2CH 2OHCH 3COOHNaBH 不反应特点:双键不受影响,四氢铝锂还原性强于硼氢化钠RC ClOLiAlH RCH 2OH酰氯:2R C O OOLiAlH 4R'R'CH 2OH酐:2. H 2ORCH2OH +:酮:RCRO 21. NaBH 4OHR R C ROBH 3HNaO R C ROBH 2H C RH O O O 2HCOB OCHR 2OCHR 2OCHR 2Na R C R OH H4B(OH)3NaOH++机理:(2):制备胺类21.LiAlH 4,N(CH 3)2CO Et 2OCH 2N(CH 3)2(88%)N,N-二甲基环己基甲酰胺N,N-二甲基环己基甲酰胺O2C 6H 5C 6H 5NOHC 6H 5C 6H 5NH 2Et 2OLiAlH 4C 6H 5C 6H 5(80%)2,2-二苯基环己酮2,2-二苯基环己胺RCl NaCN RCNRCH 2NH 24.氢负离子还原羰基化合物的反应历程氢负离子的还原羰基化合物实质上就是亲核加成反应,四氢铝锂和硼氢化钠对羰基的还原反应原理是一样的,它们都不能还原碳碳双键;而且,这类羰基加成反应实际上为不可逆反应,通常无副反应,所以可用于完成某些特定的合成工作。
氢化铝锂还原反应注意事项

氢化铝锂还原反应注意事项氢化铝锂是一种强还原剂,化学式为LiAlH4。
它广泛应用于有机合成中,用于还原醛、酮、羰基化合物等。
在进行氢化铝锂还原反应时,需要注意以下几点事项:1. 无水条件:氢化铝锂在空气中非常易吸湿,吸湿后会迅速分解生成氢气和氢氧化铝。
因此,在操作氢化铝锂之前,需要确保所使用的溶剂、试剂、容器以及氢化铝锂本身都是干燥的。
一般来说,可以通过干燥剂如四氧化三磷(P4O10)或四乙氧基铝锂(LiAlH(OC2H5)4)等来去除水分。
2. 空气敏感性:氢化铝锂对空气非常敏感,在空气中迅速分解。
因此,在操作过程中应避免长时间接触空气,尽量在惰性气氛下进行反应。
3. 温度控制:在进行氢化铝锂还原反应时,需要控制反应的温度。
一般来说,反应温度通常在室温到80C之间,较低温度有助于避免副反应的发生。
同时,反应的温度也应适合所使用的溶剂和反应物的特性。
4. 溶剂选择:氢化铝锂在有机溶剂中可以溶解,并利用溶剂中的个别亲电基团进行还原反应。
常用的溶剂有乙醚、二甲基甲酰胺(DMF)等。
在选择溶剂时,要考虑反应物对溶剂的亲和性,以及溶剂本身的稳定性等因素。
5. 亲电试剂的选择:氢化铝锂是一种非常强的还原剂,对羰基和其他亲电基团具有很高的选择性。
在进行氢化铝锂还原反应时,需要选择适合的反应物,并避免过量使用氢化铝锂,以防止过度还原或副反应的发生。
6. 反应过程监控:在进行氢化铝锂还原反应时,应密切关注反应的进展情况。
可以使用一些常见的检测方法,如红色苯酚酞试剂测定溶液的可滴定酸度,以了解反应的进行程度。
7. 安全操作:氢化铝锂是一种有毒、易燃、易爆的物质,操作时应严格遵循安全操作规程。
应在通风良好的地方操作,并采取防护措施,如佩戴防护眼镜、手套等。
反应后的废液应妥善处理,避免对环境造成污染。
总之,氢化铝锂还原反应是一种常用的有机合成方法,但在操作时需要注意上述事项,以确保反应的安全性和效果。
lialh4和nabh4的还原反应

lialh4和nabh4的还原反应
一、背景介绍
还原反应是一种无机化学反应,即氧原子或氧化物原子从化合物中除去。
在该还原反应中,反应物之间发生改变,导致比原有更多的氢原子在化合物中。
因此,还原反应有着许多广
泛的应用,包括核反应,发展新的能源技术以及净化水分子。
目前使用最多的还原反应有脲醛和NABH4的还原反应,他们的反应原理是同样的,但他
们的还原效果却有很大的不同。
脲醛的还原反应效率较高,NABH4的还原反应效率较低。
二、脲醛和NABH4的还原反应
1、脲醛还原反应
脲醛还原反应是一种常见的还原反应,主要是将有机物质中的羰基原子还原为氢原子。
典型的脲醛还原反应如下:
R-CO-O-H + 3H2 → R-CH2OH +H2O + CO2
脲醛还原反应有着很好的还原效果,它可以大幅度提高有机物质中氢原子的含量,而且反应中没有氧化剂参与,因此被大量应用于化学制品的合成中。
2、NABH4的还原反应
NABH4的还原反应通常将反应物中的氧原子或氧化物原子还原为氢原子。
NABH4的还原
反应非常简单,无需特殊的条件,只需将NABH4溶液添加到反应物中,反应即可完成。
典型的NABH4还原反应如下:
R-O-H + 2NABH4 → R-H2 + N2 + 4H2O
NABH4反应效果一般,但因为它只涉及添加少量溶剂,并且不需要特殊条件,所以它仍
然被大量使用于合成有机物质中。
三、结论
虽然脲醛和NABH4的还原反应的原理相同,但是从还原效果上来看,脲醛的还原效果要比NABH4的要好,因此脲醛的还原反应被更多的人使用,尤其是在合成有机物质中。
硼氢化钠和四氢铝锂还原乙酸乙酯的原理

硼氢化钠和四氢铝锂还原乙酸乙酯的原理硼氢化钠和四氢铝锂是常用的还原剂,它们在有机合成中发挥着重要的作用。
本文将介绍硼氢化钠和四氢铝锂还原乙酸乙酯的原理及其应用。
让我们了解一下硼氢化钠和四氢铝锂的性质。
硼氢化钠(NaBH4)是一种无色晶体,可溶于水,并且在水中呈现弱碱性。
它是一种强还原剂,可以与许多有机化合物发生反应。
四氢铝锂(LiAlH4)也是一种无色晶体,可溶于乙醚和二甲基甲酰胺等有机溶剂。
它是一种非常强力的还原剂,可以还原许多有机化合物中的羰基(C=O)键。
乙酸乙酯是一种常见的酯类化合物,其结构中含有一个酯基(R-COOR')。
酯类化合物通常可以通过还原反应转化为相应的醇。
在这里,我们将使用硼氢化钠和四氢铝锂来还原乙酸乙酯。
硼氢化钠和四氢铝锂在还原乙酸乙酯的过程中起到了还原剂的作用。
它们能够将乙酸乙酯中的羰基碳上的氧原子还原为羟基(OH)。
具体来说,硼氢化钠和四氢铝锂中的氢原子会与乙酸乙酯中的羰基碳上的氧原子发生反应,形成相应的醇和相应的金属盐。
还原乙酸乙酯的反应可以用以下方程式表示:乙酸乙酯+ 4H2 → 乙醇 + 2H2O在实际操作中,通常将硼氢化钠或四氢铝锂与乙酸乙酯在适当的溶剂中反应。
反应条件可以根据具体实验要求进行调整,例如温度、反应时间等。
在反应结束后,可以通过蒸馏或其他分离技术来纯化所得的乙醇产物。
硼氢化钠和四氢铝锂还原乙酸乙酯的反应具有许多应用。
乙醇是一种重要的溶剂和化工原料,广泛用于制药、化妆品、涂料等行业。
通过还原乙酸乙酯制备乙醇可以提供一种有效的合成途径。
此外,乙醇还可以用作生物燃料和溶剂,具有广泛的应用前景。
硼氢化钠和四氢铝锂是常用的还原剂,可以将乙酸乙酯还原为乙醇。
这种还原反应在有机合成中具有重要的应用价值,可以为乙醇的制备提供一种有效的方法。
通过深入研究还原反应的原理和条件,我们可以更好地理解有机化学反应的机理,并为相关领域的研究和应用提供支持。
四氢铝锂有效氢含量

四氢铝锂有效氢含量
四氢铝锂是一种固态氢化物,化学式为LiAlH4。
它是一种重要的氢源,可用于合成有机化合物中,特别是在有机合成中作为还原剂。
四氢铝锂的有效氢含量指的是其能够释放多少摩尔的氢气。
根据其化学式LiAlH4,可以计算出其有效氢含量为4摩尔的氢气。
这是因为每个LiAlH4分子中含有4个可释放的氢原子。
因此,四氢铝锂的有效氢含量为4摩尔。
从化学反应的角度来看,四氢铝锂在适当的条件下可以与许多化合物反应,释放出氢气。
这种反应可以用于有机合成中的加氢还原反应,将双键还原成饱和键等。
因此,四氢铝锂作为氢源在有机合成中具有重要的应用价值。
另外,从实际应用的角度来看,四氢铝锂作为氢源具有一定的储氢能力,可以作为氢能源技术的一种潜在候选。
它在固态状态下储存氢气,相比于液态氢和压缩氢气,具有更高的储存密度和安全性,因此在氢能源领域也备受关注。
总的来说,四氢铝锂的有效氢含量为4摩尔,具有重要的有机合成应用价值,同时也具有潜在的氢能源技术应用前景。
LiAlH4在药物合成中的应用

LiAlH4在药物合成中的应用[ 摘要]:LiAlH4作为还原剂在药物合成过程中具有不可替代的作用.可由于其活性强不易控制,从而具有限制性.故本文主要探讨了降低活性提高其反应选择性的几种方法以及近期LiAlH4在药物合成中的具体应用.[ 关键词]:氢化铝锂还原不对称合成[ Abstact ] Nothing can take place of the lithium-aluminum hydride as agent in the Synthesis of durg. But ,because of its strong activity , it is very difficult to contral the reaction , it has some shortcoming .So in this article we will talk about some methods which reduce the activity of lithium-aluminum hydride and boost the reaction of selectivity ,as well introduce some applications with the lithium-aluminum hydride in recent years.[ Keywords ]:lithium-aluminum hydride reduction asymmetric synthesis引言:自从1946年发现了LiAlH4的制备和应用以来,其在药物合成中作为还原剂的应用研究得到极大重视.由于他们具有反应条件温和、反应速度快、反应单一、反应产率高及选择性好等优点,在药物合成中已成为不可缺少的还原手段。
LiAlH4作为最先发现的金属复氢化物目前在药物合成中的还原剂占有重要的位置。
下表就各种金属复氢化物的还原特性进行比较总结:一.由表中金属复氢化物还原特性的比较可看出LiAlH4作为还原剂活性在众多金属复氢化物中最高,在药物合成中有时为了控制反应进度要求控制LiAlH4的活性,降低反应活性的方法具体有以下几种: 1.控制LiAlH4在反应中的加入量:羧酸酯用0.5mol 的LiAlH4还原时可得伯醇,而用0.25mol 并在低温下反应或降低LiAlH4的还原能力则可得到醛R 1OOR‘LiAlH 4R 1OAlH 3OR'R 1OR'OH-R'OHR 1OHLiAlH 4CH 3OAlH 3RCH 2OH RCHO目前,关于PPAR 受体激动剂的研究在化学结构方面已经从噻唑烷二酮(TZD)类扩展到其他结构类型,已有许多生物活性很高的化合物处于不同的临床阶段 。
LiAIH_4和NaBH_4的还原反应

文章编号:1000 1735(2003)01 0056 03LiAIH 4和NaBH 4的还原反应于世钧, 郭 宏(辽宁师范大学化学系,辽宁大连 116029)摘 要:Li AlH 4和NaBH 4是有机合成中常用的两种还原剂.对NaBH 4在有机合成中的发展予以简要概述,并论述分析了Li Al H 4和NaB H 4在不同有机化学教材中存有争议的问题,从而帮助广大读者更清楚准确的认识LiAl H 4和NaB H 4的还原能力及选择性.关键词:氢化铝锂;硼氢化钠;还原反应中图分类号:O621.254.2 文献标识码:A自从1946年发现了LiAlH 4的制备和应用以来[1],金属氢化物在有机合成中作为还原剂的应用研究得到极大重视.由于他们具有反应条件温和、反应速度快、反应单一、反应产率高及选择性好等优点,在有机合成中已成为不可缺少的还原手段.特别是LiAlH 4和NaB H 4在基础有机化学教材中都进行了介绍,二者之间有明显的差别.但对一些还原反应,很多书论述并不详细,甚至不准确.这往往给初学者带来一些认识模糊和误解.另外,随着现代化学技术的发展,它们同一些新的催化技术相结合,提高了它们还原选择性,这使它们在有机合成中得到更广泛的应用.而这些新技术在现有的教科书中并未介绍,这使学生对它们的认识仍比较落后.本文就这两点问题做以介绍和解析,使读者能够更好的认识LiAlH 4和NaB H 4的还原反应.1 LiAl H 4和NaBH 4还原性的比较表1 LiAl H 4和NaB H 4在一般情况下还原性的比较基团LiAl H 4NaB H 4产物 C HO ++ C H 2OH C O ++CHOH COCl ++ C H 2OH C O OCO ++ C H 2OH C O 2R +- C H 2OH+ROH C O 2H 或RCO 2+- C H 2OH CONHR +-RCH 2NHR C N +- CH 2NH 2C N OH +-C HNH 2R * NO 2+-R NH 2RX+?RHR 为烷基;当R 为苯基时产物是ArNHNHAr 或ArN NAr .收稿日期:2002 11 12作者简介:于世钧(1960 ),男,辽宁瓦房店人,辽宁师范大学副教授,硕士.第26卷第1期2003年3月 辽宁师范大学学报(自然科学版)Journal of Liaoning Normal University (Natural Science Edi tion)Vol.26 No.1Mar. 2003由上表可以看出在一般情况下LiAlH 4和NaB H 4都能还原醛、酮、酰氯、酸酐化合物,而对于腈、酯(内酯除外)、硝基化合物等NaBH 4不能还原.这说明LiAlH 4还原能力强,但选择性差;而NaB H 4还原作用比较温和,具有很高的选择性.现有基础有机化学教材认为NaB H 4不能还原酯、腈、硝基化合物,但实际上NaB H 4在一定条件下能够还原上述化合物,并且由于NaB H 4反应条件温和、价格便宜、易于处理以及能够用于水相;而LiAl H 4选择性差、危险、不能用于水相等原因,人们更倾向于使用NaB H 4作为还原剂.2 NaB H 4对酯、腈、硝基化合物的还原2.1 对酯的还原虽然在通常条件下,NaB H 4不能还原酯.但研究表明,NaB H 4能够将 羟基、 和 羰基酯分别还原成1,2 和1,3 二醇[2].此外,金属氢化物在一些金属盐存在下其还原性能往往大大改变.比如:NaB H 4在有LiCl 存在时,可以还原酯[3].NaB H 4 ZnCl 2在叔胺存在下是一个很强的还原试剂,能够将酯还原成醇.但该反应在无胺存在时不发生.NaBH 4 I 2在回流条件下也能将酯还原成醇[4].CO 2R XNaBH 4/ZnCl 2叔胺,THF,加热,2hCH 2OH XR=Me,EtX=2Br,2 SC H 2Ph 4 NO 2,4 OH52%~98%PhC H 2COOEtNaB H 4 I 2,THF 70!,0.5hH 2OPhC H 2CH 2OH 85%2.2 对腈的还原用一些金属盐(如二价铜盐、钴、镍等金属卤化物、硫酸盐和羧酸盐)与NaB H 4共同作用,以及用NaB H 4 I 2在THF 中回流都能够将腈还原成胺.如[4]:PhC H 2CNNaB H 4 ZrCl 4THF,r.t.PhCH 2C H 2NH 2 91%,PhC NNaBH 4 I 2THFNaO HPhC H 2NH 2 72%2.3 对硝基化合物的还原在金属离子作用下,NaB H 4可使N O 键断裂.如:用NaB H 4 CuSO 4或NaB H 4 BiCl 3能将硝基化合物还原成胺[4].RNO 2NaBH 4/BiCl 3THFRNH 2 35%~90%,RhNO 2NaBH 4/CuSO 4EtO H,0!,r.tPhNH 2 94%3 NaB H 4在还原选择性方面的提高把NaB H 4载于惰性材料上是近几年发展起来的新方法.此法是把NaB H 4均匀地分散于载体(如大孔树脂、聚乙二醇等)的表面、孔穴或骨架上,使NaB H 4与被作用物充分的接触,可有效的弥补NaB H 4不溶于大多数有机溶剂的不足.此外,用这种方法还能够提高NaB H 4的还原能力及选择性.3.1 NaB H 4做载体上的试剂还原不活泼酮[4]NaB H 4 大孔树脂 15(H +)就是一种新的催化剂.它具有很强的还原能力,能够还原不活泼酮.对缩酮、烯丙基乙酸、烯丙基 内酯、羧酸酯、卤素和孤立的双键等在还原过程中都不受干扰.3.2 用PEG NaB H 4作用选择性还原醛[5]用NaB H 4、聚乙二醇、二甘醇二甲醚和苯甲酸共同作用,得到的是在网状结构中含有硼氢键的白色腊状缩聚物.该物质能够降低试剂的活泼性;在相转移过程中提高还原选择性:只还原醛而不还原酮.第1期于世钧等: Li AlH 4和NaB H 4的还原反应57RC HO+RCOC H 3PEG NaBH 4,苯甲酸甲苯RCH 2OH+RCOC H 34 NaB H 4对卤代烃的还原NaB H 4能否还原卤代烃,不同教科书[3,6]对此观点不一,但从查阅的文献来看,NaB H 4不象LiAlH 4那样能在非极性溶液中还原卤代烃.NaB H 4需要在二甲基亚砜、六甲基磷酸酰胺、二甲基甲酰胺和二甘醇等极性溶剂中对伯、仲、叔、烯丙基、苄基等各种卤化物以及某些二卤化物还原.但反应主要在80!左右才能进行[7].C H 3(C H 2)8C H 2INaBH 4,M e 2SO 485!,0.25hC 10H 32 93%Rolla 等在三丁基十六烷基溴化作用下,成功地用NaBH 4在18!以下使有机卤化物还原,而对有机卤化物分子中同时存在的酰基、酰胺和腈基等官能团不起作用[7].总之,对于LiAlH 4和NaBH 4在有机合成中的应用,应根据具体的反应,控制适当的反应条件(如金属盐、温度、溶剂以及利用离子交换技术等),改变LiAlH 4和NaB H 4的还原能力及选择性以达到满意的效果,从而使它们在有机合成及实际生产中都得到广泛的应用.参考文献:[1] FINHOLT A E ,BOND A C,J R,et al.Li thium Aluminum Hydride and Lithium Gallium Hydride and s ome of their Application i n Organic and Inorganic Che mis try [J].J A m Chem Soc,1947,69:1199 1203.[2] D ALLA V,Catteau J P,PALE P.Mechanis tic R ationale for the NaBH 4Reduction of keto Es ter[J].Tetrahedron Lett,1999,40:5193 5196.[3] 王葆仁.有机合成反应(上册)[M ].北京:科学出版社,1982.139,158.[4] MARIAPPAN P,M UNIAPP AN T.M ethods of Enhancement of Reacti vity and Selecti vity of Sodi um Borohydride for Applications in Organic Synthesis[J].J Organo met Chem,2000,609:137 151.[5] BLAN TON J R.the Selective Reducti on of Aldehydes using Polyethylene Gl ycol sodium Borohydride Deri vatives as Phase [J].Synth Commun,1997,27(12):2093 2102.[6] 邢其毅.基础有机化学(上册)[M ].北京:人民教育出版社,1981.299.[7] 车荣睿.硼氢化钠在有机合成中的应用[J].化学试剂,1986,8(2):94 96.The Reduction of LiAlH 4and NaBH 4YU Shi jun, GU O Hong(Department of Chemis try,Liaoning Normal Universi ty,Dalian 116029,China)Abstract :Li A l H 4and NaB H 4are common reductive reagents in organic synthesis.This paper reports the development of NaB H 4in organic synthesis and discusses some controversial problems in different reference books ,then analyzes them in order to help readers better understand the reductibility and chemoselectivity of LiAlH 4and NaB H 4.Key words :lithium aluminium hydride;sodium borohydride;reduction58辽宁师范大学学报(自然科学版)第26卷。
氢化铝锂和硼氢化钠的还原能力

氢化铝锂和硼氢化钠的还原能力以氢化铝锂和硼氢化钠的还原能力为标题,我们将探讨它们在化学反应中的应用和特点。
让我们了解一下氢化铝锂和硼氢化钠的基本性质。
氢化铝锂是一种无机化合物,化学式为LiAlH4。
它是一种白色结晶固体,可以溶解在无水乙醇和二甲基甲酰胺中。
氢化铝锂是一种强还原剂,具有很高的还原能力。
硼氢化钠(NaBH4)是一种无机化合物,化学式为NaBH4。
它是一种白色结晶固体,可以溶解在水和醇中。
硼氢化钠也是一种强还原剂,具有较高的还原能力。
氢化铝锂和硼氢化钠的还原能力主要体现在它们与其他化合物发生反应时。
其中,氢化铝锂在有机合成中广泛应用,可以还原酮、醛、酯等功能团。
它可以将酮还原成相应的醇,醛还原成相应的醇或醛醇混合物,酯还原成相应的醇和醚。
氢化铝锂还可以将羧酸酯还原成醇和醚。
这些还原反应在有机合成中非常重要,可以合成各种有机化合物,如醇、醚、胺等。
与氢化铝锂相比,硼氢化钠的还原能力稍弱一些,但它仍然是一种常用的还原剂。
硼氢化钠主要用于还原醛和酮。
它可以将醛还原成相应的醇,酮还原成相应的醇。
硼氢化钠还可以还原酸类和酯类化合物。
在有机合成中,硼氢化钠也是一种重要的还原剂。
氢化铝锂和硼氢化钠的还原能力在有机合成中有许多优点。
首先,它们具有较高的还原效率和选择性,可以在温和的条件下完成反应。
其次,它们对许多官能团都具有良好的兼容性,可以与其他官能团共存而不受干扰。
此外,氢化铝锂和硼氢化钠的操作相对简单,易于使用。
然而,氢化铝锂和硼氢化钠也有一些不足之处。
首先,它们对水和空气敏感,容易分解生成氢气。
因此,在使用时需要注意防止水和空气的接触。
其次,它们对一些特殊官能团,如羧酸和酮醇混合物,还原效果不佳。
此外,氢化铝锂和硼氢化钠的价格较高,对于大规模合成来说成本较高。
氢化铝锂和硼氢化钠是两种常用的还原剂,具有较高的还原能力。
它们在有机合成中起着重要的作用,可以还原各种功能团。
然而,使用时需要注意它们的操作条件和特点。
氢化铝锂和硼氢化钠的还原能力

氢化铝锂和硼氢化钠的还原能力以氢化铝锂和硼氢化钠的还原能力为标题,本文将分别介绍氢化铝锂和硼氢化钠的特性和应用,以展示它们在还原反应中的重要作用。
氢化铝锂是一种无机化合物,化学式为LiAlH4。
它是一种白色固体,具有很强的还原性。
氢化铝锂可以将许多有机化合物还原为相应的醇、醚和胺。
在有机合成中,氢化铝锂常用于还原酮、醛和羧酸等官能团。
它被广泛应用于医药、农药、染料和香料等领域的有机合成过程中。
氢化铝锂的还原能力源于其中的LiH键。
在还原反应中,氢化铝锂会释放出一氢根离子(H^-),这个离子具有强还原性。
当氢化铝锂与有机化合物反应时,氢根离子会与它们的官能团发生反应,从而实现还原反应。
与氢化铝锂相比,硼氢化钠(NaBH4)也是一种常用的还原剂。
硼氢化钠是一种白色固体,可溶于水。
它的还原能力较弱,通常用于对醛和酮等化合物进行选择性还原。
硼氢化钠不会对酯、酰胺等官能团产生明显的还原作用,因此在有机合成中具有较高的选择性。
硼氢化钠的还原反应是通过离子机制进行的。
在反应中,硼氢化钠释放出一氢根离子(H^-),并与有机化合物中的羰基(C=O)发生反应,形成相应的醇。
这个反应过程是一种加成反应,产物的立体构型与底物的立体构型相同。
总结起来,氢化铝锂和硼氢化钠都是常用的还原剂。
氢化铝锂具有较强的还原能力,适用于多种官能团的还原反应;而硼氢化钠具有较弱的还原能力,适用于对醛和酮的选择性还原。
它们在有机合成中发挥着重要的作用,为合成有机化合物提供了可靠的手段。
需要注意的是,由于氢化铝锂和硼氢化钠具有较强的还原性,使用时需要小心操作,避免与水和氧气接触产生危险。
在实验室和工业生产中,需要采取相应的安全措施,确保操作的安全性。
氢化铝锂和硼氢化钠作为常用的还原剂,具有不同的特性和应用。
了解它们的特点和反应机制,有助于合理选择合成方法,并提高有机合成的效率和选择性。
四种常用还原剂的还原性比较及应用

四种常用还原剂的还原性比较及应用一.还原性比较氰基硼氢化钠(NaBH3CN)<硼氢化钠(NaBH4)<二异丁基氢化铝(DIBAL)<氢化铝锂(LAH)还原性差异原因:氰基硼氢化钠(NaBH3CN)中的氰基是吸电子基团,导致氰基硼氢化钠给出氢负离子的能力减弱。
此外,硼氢化钠中硼电负性比铝强,硼氢键极性相对铝氢键较弱,氢铝键更容易给出氢负离子,且铝原子的亲氧性比硼强,反应过程中DIBAL比硼氢化钠更容易活化羰基氧;异丁基增大空间位阻,阻碍铝原子活化羰基氧,所以DIBAL还原性弱于LAH。
二.常见应用四种还原剂最常见的应用:1.氰基硼氢化钠(NaBH3CN)一般只用来在酸性条件下还原醛生成醇,或生成胺(Borch还原胺化),一般不能还原酯。
2. 硼氢化钠(NaBH4)一般只用来还原醛或酮生成相应的醇,一般不能还原酯。
还原α,β-不饱和醛酮时,优先发生1,4-还原,加入铈盐后优先发生1,2-还原。
注意:当酯基的α位存在能与硼原子螯合的原子即α位存在—OR 或—NR2(R=H、Alkyl等)时,酯基能被还原成相应的醇。
从反应机理角度解释,当能参与螯合的基团存在时,能生成较稳定的中间体,且将分子间反应转化成类似于分子内反应,降低反应活化能,促进反应的发生。
3.DIBAL和LAH的还原性都较强相同点:能将醛、酮、酯、酸还原成相应的醇,亚胺、酰胺、腈还原成相应的胺,烷基卤还原成相应烷烃。
不同点:DIBAL除具有还原性还有较强的Lewis酸性质,可参与Beckmann重排(酮肟→环胺);而LAH则可以在一定的条件下还原炔烃生成相应烯烃,再引入卤素原子。
注意:在全合成的过程中,我们需要控制DIBAL或LAH的还原性,不将酯还原成相应的醇而是相应的酮或醛(一般情况下,中间体酮的活性比底物要高,不稳定,因此不能通过控制还原剂的用量来控制反应)。
有两种方法,一是降低反应的温度,在低温下,中间体更稳定些,二是在酯的α位置引入螯合基团如—OR或—NR2(R=H、Alkyl等)。
关于氢化铝锂和硼氢化钠还原醛酮成醇的反应式_蒋达荣

4
R R ′
C
O
Na B ( O R R ′
+
-
CH ) 4 R ′
( 8) ( 9)
R + ( CHO) 4 B + 3H 2O + H R ′
4
CHOH + B( OH) 3
综上所述 , 无论是 LiAlH 4 , 还是 NaBH 4 还原醛 、酮成醇都分两步进行 。 第一步是醛 、酮与 LiAlH 4 或 NaBH 4 反应生成相应的醇铝盐或烷氧基硼烷盐 。 第二步醇铝盐或烷氧基硼烷盐水 解( 或酸解) 生成相应的醇 。 因此 , 醛 、 酮经与 LiAlH 4 或 NaBH 4 反应后 , 接着进行水解( 或酸 解) 生成醇 , 例如( 1) 、 ( 2) 式无疑是合理的 、 正确的 ; 而醛 、 酮与 LiAlH 4 或 NaBH 4 反应直接生成 醇 , 例如( 3) 、 ( 4) 、 ( 5) 式显然有些欠妥 , 不规范 。 今后 , 我们在书写 LiAlH 4 或 NaBH 4 还原醛 、 酮成醇的反应式时 , 水解或酸解一步切不可省去 。
R + ( CHO) 4 Al + 3H 2O + H R ′ 4 R R ′ CHOH + A l( OH) 3
( 7)
NaBH 4 还原醛 、 酮的原理与 LiAlH 4 相同 , 只不过 NaBH 4 与醛 、酮完全反应后生成烷氧基 硼烷盐 。 该烷氧基硼烷盐水解生成相应的醇[ 6] 。 反应式如下 :
酮 , 其实质就是氢负离子与羰基的亲核加成反应 。 在 LiAlH 4 中 , 有效的还原剂是 AlH 4 , 充当
强还原剂 H 的给予体 。H 作为强亲核试剂 , 不可逆地加到醛 、酮羰基的碳原子上 。AlH 4 的 四个 Al —H 键可以逐步参加反应 , 反应式如下 :
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
浅谈氢负离子还原剂LiAlH4与NaBH4
张媚
(西北大学化学系05级化学班西安 710069)
摘要:本文总结它们所参与的反应类型,并介绍两者之间的异同点和相关反应机理,从而阐明它们在合成中的重要性。
关键字:四氢铝锂硼氢化钠还原
一、引言
众所周知,在有机合成中还原反应有着极为重要的地位。
其中,作为重要还原剂的氢负离子类化合物四氢铝锂和硼氢化钠更在合成反应中起着举足轻重的作用。
二、四氢铝锂和硼氢化钠
四氢铝锂和硼氢化钠这两种还原即可还原许多类化合物,它们自身的理化常数为:
1.还原卤代烷制备卤代烃
例:
CH3(CH2)8CH2Br机理:
Li+ H3Al
H
CH3(CH2)8CH3
CH2R
X
RCH3
+
AlH
3+
LiX
CH3(CH2)6CH2X
二甘醇二甲醚
CH3(CH2)6CH3
注意:四氢铝锂只能在无水条件下进行反应,而硼氢化钠没有此限制,这表明两种物质反应时所需要的介质是不一样的。
2.还原炔氢
四氢铝锂还原为反式烯烃
1 LiAlH4
CH3C
CH
2CH3CHCH2
注意:硼氢化钠不能还原炔烃 3.还原羰基化合物
(1):醇的制备
OR
COR
COR
COR
C
R'
NaBH4 或 LiAlH4或催化氢化
R
OR'
LiAlH4
Na, EtOH
RCH2OH
OHCH
R'
仲醇
伯醇
OH
LiAlH4
RCH2OH
伯醇
H
NaBH4 或 LiAlH4或催化氢化
RCH2OH
伯醇
以上表明,四氢铝锂可以还原醛、羧酸、酯、酮等羰基化合物,而硼氢化钠只能还原醛和酮以及酰卤等类化合物。
例:
1. NaBH4
CH3CHCHCHO
CH3CHCHCH2OH
2.H2O
2. H2O
CH3CH
CHCH2OH
例:CH3CH
CHCHO
O
+LiAlH4
1.EtO2OH
98%
H2CCHCH2COOH
,Et2H2CCHCH2
CH2OH
NaBH4
CH3COOH
O
不反应
特点:双键不受影响,四氢铝锂还原性强于硼氢化钠酰氯:O
酐:
R
CO
OC
R'
LiAlHCl
2. H2O
RCH2OH
RC
2. H2O
RCH2OH
+
R'CH2OH
:
OH
酮:机理:R
1. NaBH4
2
OBH3
Na
OR
ORCH
R
OBH2OR
CHR
CR
H
O2HCO
OCHRB
2
2
OCHR
2
Na
OCHR
OH
4R
CH
R+B(OH)
+NaOH
(2):制备胺类
CH3)2
2.H2O
N,N-二甲基环己基甲酰胺
2N(CH3)2
(88%)
N,N-二甲基环己基甲酰胺
C6H5
C6H5
2,2-二苯基环己酮6H5C6H5 22C6H5C6H5(80%) 2,2-二苯基环己胺RCl
RCNRCH2NH2
4.氢负离子还原羰基化合物的反应历程
氢负离子的还原羰基化合物实质上就是亲核加成反应,四氢铝锂和硼氢化钠对羰基的还原反应原理是一样的,它们都不能还原碳碳双键;而且,这类羰基加成反应实际上为不可逆反应,通常无副反应,所以可用于完成某些特定的合成工作。
但是硼氢化钠的还原活性比四氢铝锂的低,这是因为NaBH4、与LiAlH4的极性不同,所以它们中的氢极性不同,所以 LiAlH4中的氢活性更高.表现为硼氢化钠等只能还原醛、酮和酰卤的羰基,而不能还原其他的羧酸衍生物、硝基等化合物,但氢化铝锂却可以。
硼氢化钠的优点是除了他们的反应选择性外,常可以在羟基溶剂中使用,所以也是一类很方便的还原剂。
三、总结
由上述介绍可见,四氢铝锂与硼氢化钠这两种还原剂在许多反应中有相同或类似的机理,但也因为无力与化学性质的差异,两者也有区别。
所以在有机反应及以后的合成路线设计中,我们一定要注意它们的相同与不同之处,正确选择与使用还原剂,从而高效的合成出有机物。
