[有机波谱分析]紫外光谱
紫外光谱

6 . 增 色 效 应 ( hyperchromic effect ) 和 减 色 效 应 (hypochromic effect) 增色效应:由于化合物结构改变或其他原因使吸收强 度增强的效应,也称浓色效应。 减色效应:使吸收强度减小的效应,也称淡色效应。
四、吸收带类型和影响因素 (一)吸收带类型
第一章 紫外吸收光谱(UV) Ultraviolet Absorption Spectra
教学要求: 1、掌握紫外吸收光谱的基本原理,电子跃迁类型、 影响位移的因素及有关术语。 2、熟悉吸收光谱与分子结构的关系。 3、了解紫外光谱在有机化合物结构测定中的应用。
第一节 紫外吸收光谱的基础知识
一、紫外-可见吸收光谱的产生
★ 三、含共轭体系的分子
1、 共轭烯类化合物的紫外光谱
一般把共轭体系的π →π *吸收带称为K带。K带 对近紫外吸收是重要的,因其出现在近紫外范围,且 摩尔吸光系数也高一般ε max>10000。 共轭体系越长,其最大吸收越移往长波方向,甚 至到可见光部分。随着吸收移向长波方向,吸收强度 也增大。 π*2 π* π*1 π π2
化合物 H2O CH3OH CH3CL CH3I CH3NH2 max(nm) 167 184 173 258 215 max 1480 150 200 365 600
3. π→ π*跃迁: 不饱和基团(—C=C—,—C = O ) E较小,λ~ 200nm 体系共轭,E更小,λ更大,强吸收 4. n→ π*跃迁: 含杂原子不饱和基团(—C ≡N ,C= O ) E最小,λ 200~400nm(近紫外区)
图示
back
3.生色团(发色团)(chromophore): 产生紫外或可见吸收的不饱和基团 有机化合物:具有不饱和键和未成对电子的基团 具n 电子和π电子的基团 产生n→ π*跃迁和π→ π*跃迁 跃迁E较低 例: C=C;C=O;C=N;—N=N— 等 注:当出现几个发色团共轭,则几个发色团所产生的 吸收带将消失,代之出现新的共轭吸收带,其波 长将比单个发色团的吸收波长长,强度也增强
波谱解析 第一章 紫外光谱习题参考答案

习题参考答案第一章紫外光谱1.(1) 饱和化合物,吸收在远紫外区,故在近紫外区无吸收峰;(2) 结构可看成乙烯中引入了助色基团甲氧基,吸收波长红移,但吸收峰仍在远紫外区,近紫外区无吸收峰;(3) π→π*跃迁。
氨基为助色团,其孤对电子与苯环发生p→π共轭,所以E带和B带均发生红移,E1吸收位于远紫外区,E2带(230 nm)和B带(280 nm)处在近紫外区。
(4)取代基与苯环形成大的共轭体系,有π→π*跃迁;结构中含有羰基,有n→π*跃迁。
吸收带有K带、B带和R带;(5) 取代基与苯环形成大的共轭体系,π→π*跃迁,主要吸收带为K带和B带;(6) 羰基有n→π*跃迁,为R带吸收。
(该结构的烯醇异构体有K带和R带)(7) 该结构为α,β-不饱和羰基化合物,有π→π*跃迁和n→π*跃迁,吸收带为K带和R带。
2.(1) a为饱和烷烃,仅有σ→σ*跃迁,吸收位于远紫外;b有两个双键,但未共轭,吸收位于远紫外;c为共轭二烯,吸收在近紫外;所以最大吸收波长c>b>a;(2) a为同环共轭双烯,波长最大,c和b相比,结构中多了一个甲基,存在超共轭效应,吸收红移。
综上所述,a>c>b;(3) a, c为共轭体系,吸收波长均高于b。
a和c相比,结构中拥有更多的取代甲基,存在超共轭效应,吸收红移。
综上所述,a>c>b;3. (1)同环共轭双烯基本值2534个烷基取代+ 4×52个环外双键+ 2×5计算值283(nm)(3)(4)(5)(6)骈环异环共轭双烯基本值214 4个烷基取代+ 4×52个环外双键+ 2×5 计算值244(nm)同环共轭双烯基本值253 4个烷基取代+ 4×5 计算值273(nm)直链α,β-不饱和酮基本值215 1个烷基α取代+ 10 计算值225(nm)五元环α,β-不饱和酮基本值202 1个烷基α取代+ 102个烷基β取代+12×22个环外双键+5×2 计算值246(nm)六元环α,β-不饱和酮基本值215 1个烷基α取代+ 102个烷基β取代+12×2 计算值249(nm)(7)直链α,β-不饱和酮基本值2151个烷基γ取代+ 182个烷基δ取代+18×2延长一个共轭双键+30计算值299(nm)(8)无共轭结构,无K带吸收(9)烷基单取代羧酸(β)基本值208β位N(CH3)2取代+ 60计算值268(nm)(10)苯甲酰酮基本值2461个邻位-OH取代+ 71个间位-CH3取代+3计算值256(nm)(11)苯甲酸基本值2301个对位-OH取代+ 25计算值255(nm)4.(1)a.非骈环共轭双烯基本值2173个烷基取代+ 3×5计算值232(nm)b.非骈环共轭双烯基本值2174个烷基取代+ 4×51个环外双键+ 5计算值242(nm) 综上所述,两种化合物可以用紫外光谱区分。
波谱分析第6章 紫外可见光谱(1)
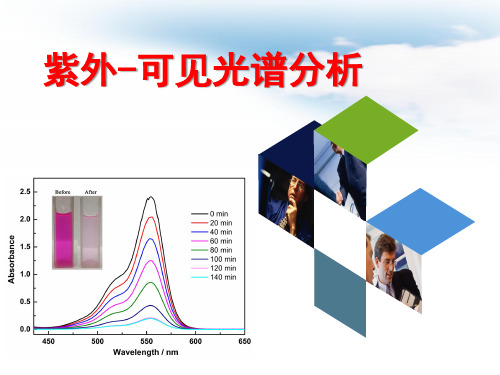
图 分子轨道的能级和电子跃迁类型
s*
*
E
n
s
跃迁能量大小:
σ→σ* > n →σ* > π→π* > n→π*
仅在远紫外区可能观察到它们的吸收峰。
杂原子非键轨道中的电子向σ*轨道的跃迁,一般在 200 nm左右。
电子由成键轨道向*轨道的跃迁。如具有一个孤 立键的乙烯,跃迁的吸收光谱约在165 nm。分子中 如有两个或多个键处于共轭的关系,则这种谱带将 随共轭体系的增大而向长波方向移动。
max
254nm
270nm
红移和蓝移 增色效应与减色效应
最大吸收波长(λmax);在峰旁边一个小 的曲折称为肩峰;在吸收曲线的波长最 短一端,吸收相当大但不成峰形的部分 称为末端吸收。整个吸收光谱的形状是
鉴定化合物的标志。
吸收带分类
根据电子和轨道的种类,可以把吸收谱带分为四 类: K 吸收带、R 吸收带、B 吸收带和 E 吸收带。
图 (a) Frank-Condon原理示意图
(b) 紫外光谱的精细结构
6.1.2 电子跃迁选择定则(Selection rule)
跃迁必须遵守选择定则
理论上,允许的跃迁,跃迁几率大,吸收强度高( max大);禁阻的跃迁,
跃迁几率小,吸收强度低或者观察不到。 实际上禁阻的跃迁也可以观察到,只是其强度要比允许跃迁要小得多。
紫外-可见光谱分析
6.1.1紫外-可见光谱的基本原理
紫外-可见吸收光谱(UV-VIS) 分子吸收10~800nm光谱区的电磁波而产生的吸收光谱。该数 量级能量的吸收,可导致分子的价电子由基态(S0)跃迁至高能 级的激发态(S1, S2, S3, …) 紫外-可见光区分为三个区域:
有机波谱分析--紫外-可见光谱法

②呈一宽峰,且有精细结构。 ③当苯环被烷基以外的基团取代或溶剂极性增大时,精细
结构将会减弱甚至消失。
(4)E 带:芳香族化合物的特征谱带。
Ethylene
●E1带:苯环中“乙烯键”的π→π*跃迁产生的吸收带。 λmax=180~200nm,远紫外区; εmax=5×104L·mol-1·cm-1,强吸收。(不常用)
3.互变异构
4.氢键效应 1)溶质分子间氢键
使n→*共轭受限,轨道能差增大,波长蓝移。
2)分子内氢键:能差减小,波长红移。
例如:邻硝基苯酚和间硝基苯酚
分子内氢键
max=278nm =6.6103
无分子内氢键
max=273nm =6.6103
邻硝基苯酚, 由于分子内氢键的形成,红移了5nm。
3)溶质与溶剂间形成的氢键(属于溶剂效应)
波谱范围:10~800nm
(1)远紫外光区10~200nm (2)近紫外光区200~400nm (3)可见区400~800nm.
一般的紫外光谱是指近紫外区。
1、紫外光谱产生的条件
2、有机分子的化学键类型
★构成分子的化学键主要有 键、 键,还 有未成键孤
对电子构成的非键(n 键)。
★ 5种轨道分别是:
54
2)单环共轭烯烃(乙醇溶剂) ◆母体值: ①共轭二烯不在同一环内
217nm
②共轭二烯在同一环内
◆扩展共轭: ◆取代基增加值: 烷基 卤素 ◆环外双键
253nm
+30nm
+5nm +17nm +5nm
55
●注意: (1)母体值只是指共轭二烯母体本身的λ值,不包括C=C-C=C
波谱分析紫外和可见光谱
3)要考虑溶质和溶剂分子之间的作用力。 一般溶剂分子的极性强则与溶质分子的作 用力强,因此应尽量采用低极性溶剂。
吸收波长渐增
1单,选取一定 溶剂,将适量样品溶于其中,即可进行测 定。当需测定摩尔吸收系数时,需定量称 取样品。 由于不同官能团的摩尔吸收系数可以有 四、五个数量级之差,因此当样品的紫外 吸收不强时,需要特别注意样品的纯度, 否则杂质可能造成主要的吸收。
当样品有几个吸收带时,在不同的波 段可用不同浓度作图,即尽可能使每个吸 收带都较明显。 紫外—可见分光光度计可自动扫描波 长,得出波长(横坐标)和吸光度(纵坐 标)的曲线。 选取溶剂需要注意下列几点:
1)当光的波长减小到一定数值时,溶 剂会对它产生强烈的吸收(即溶剂不透明), 这即是所谓“端吸收”,样品的吸收带应处 于溶剂的透明范围。透明范围的最短波长称 透明界限。常用的透明界限如表1.1所示。
2)样品在溶剂中能达到必要的浓度(此浓 度值决定于样品摩尔吸收系数的大小)。
表1.1 常用溶剂的透明界限
分子的能量 = 电子状态能 + 振动能 + 转动能 分子的电子状态能约为8.38×104—8.38 × 105J/mol(4.19×105 J/mol相当于286nm处发生紫外 吸收)。
分子振动能约为4.19× 103—2.09×104 J/mol。
分子转动能约为4.19—41.9 J/mol。
上式右端各项能量大约顺次差两个数量级。需 要说明的是,每种能量虽然有一定变化范围,但其 变化均是量子化的。
波谱分析第六章UV谱

b.二取代苯:
Ⅰ.对位二取代苯
若两个取代基属同一类型,则E2带红移值由红移效应 最大的基团决定;若两个取代基属不同类型,则E2 带红移值由二者协同作用决定,且红移增值大于二 者单取代的红移增值之和。
Ⅱ.邻位和间位二取代苯
此类二取代苯不论取代基是何类型,对E2带红移值的 贡献大致等于两个取代基红移值增值之和。
根据量子理论,光子(或电磁辐射)的能量为: E=hν=hc/λ=hcσ 紫外光的能量与化学键的能量相仿,有足够的能量
使分子进行光化学反应。
6.1.2.紫外吸收光谱的产生及其表示方法
1.分子中价电子在电子能级间跃迁产生紫外吸收光 谱;
分子和原子一样,也有它的特征分子能级,这些能 级是由分子内部运动决定的。分子内部运动包括① 电子围绕原子核的运动;②分子内原子在平衡位置 附近的振动;③分子绕其重心的转动;④分子重心 的平移;⑤分子中各基团的内旋转。
b. Woodward-Fieser规则只适合成串共轭的分子, 不适合交叉共轭的分子。交叉共轭体系只能选取一 个,分叉上的双键不算延长双键。
同环双键母体 253
五个取代烷基5×5 两个环外双键5×2
288nm(285nm)
c.选择较长共轭体系作为母体。若同时存在同环双 键和异环双键时,应选取同环双键作为母体。
(3)含不饱和杂原子化合物:例如:醛、酮、酯、酰胺、 酰氯、睛、重氮、硝基、亚硝基、亚砜等。此类化合物可发 生σ→σ*,n→σ*,π→π*和n→π*其中n→π*(R吸收带) 跃迁所需能量较低,吸收带处在近紫外区,易于检测,可用 于结构分析,只不过吸收强度弱。
对于醛、酮类化合物,R带在270~300 nm,εmax=10~ 20L·mol-1·cm-1
紫外光谱总结

紫外光谱总结第1章紫外光谱紫外可见光谱(Ultraviolet and Visible Spectroscopy, UV-Vis)是由分⼦吸收能量激发价电⼦或外层电⼦跃迁⽽产⽣的电⼦光谱。
其波长范围为10~800 nm,⼜可以细分为三个波段:可见光区(400~800nm):有⾊物质在此区段有吸收;近紫外区(200~400nm):芳⾹族化合物或具有共轭体系的物质在此区域有吸收;远紫外区/真空紫外区(10~200nm):空⽓中的O2、N2、CO2和⽔蒸⽓在此区域有吸收,对测定有⼲扰,需要在真空条件下测定。
近紫外区是紫外光谱的主要研究对象,即通常所说的紫外光谱。
市售的紫外分光光度计测试波段较宽,⼀般包括紫外和可见光谱范围。
由于分⼦中价电⼦能级跃迁的同时伴随着振动能级和转动能级的跃迁,电⼦光谱通常不是尖锐的吸收峰,⽽是⼀些平滑的峰包,如图1所⽰。
图1紫外-可见吸收光谱(S. He, G. S. Wang, C. Lu, X. Luo, B. Wen, L. Guo and M. S. Cao, ChemPlusChem, 2013, 78,250-258.)1.1 紫外光谱的基本原理1.1.1 紫外吸收的产⽣光是电磁波,其能量(E)的⾼低可以⽤波长()或频率()来表⽰:式中:c——光速();h——普朗克(Planck)常量()光⼦的能量与波长成反⽐,与频率成正⽐,即波长越长,能量越低;频率越⾼,能量越⾼。
表1列出了不同电磁波段的相应波长范围以及分⼦吸收不同能量电磁波所能激发的分⼦能级跃迁。
波长范围波谱区名称跃迁类型光谱类型0.0005~0.1nm γ射线原⼦核反应莫斯鲍尔谱0.1~10nm X射线内层电⼦X射线电⼦能谱10~200nm 远紫外外层电⼦真空紫外吸收光谱200~400nm 近紫外外层电⼦紫外可见吸收光谱400~760nm 可见外层电⼦0.76~2.5µm近红外分⼦振动红外吸收光谱、拉曼光谱2.5~50µm中红外分⼦振动、转动50~1000µm远红外分⼦振动、转动0.1~100cm 微波分⼦转动电⼦⾃旋电⼦⾃旋共振1~1000m ⽆线电波原⼦核⾃旋核磁共振1.1.2 朗伯-⽐尔定律朗伯-⽐尔定律是吸收光谱的基本定律,也是吸收光谱定量分析的理论基础。
波谱解析紫外光谱

电磁波根据波长λ分成的区段
X射线. 紫外.可见光. 红外. 微波. 无线电波
X 射线:0.1-1 nm; 紫 外:1-400 nm;
1-200nm远紫外,200-400nm近紫外 可见光: 400-800 nm; 红 外:800nm-400 μm; 微波和无线电波:400 μm以上
电磁波与有机光谱的对应关系
n →σ * • 无P- π共轭:n → σ * ;π → σ * ;π →π*;
σ → π* ; σ → σ *
3.6、电子跃迁选律
• 光谱选律:原子和分子与电磁波相互作 用,从一个能级跃迁到另一个能级要服 从一定的规律,这些规律叫光谱选律。
• 允许跃迁:能级的跃迁根据选律是可能 的。跃迁几率大,吸收强度大。
• σ轨道
• (4).未成键电子构成的轨道时,该原子 未与对方作用。
• n轨道
图1-8 s-p轨道重叠形成的σ分子轨道
3.4.电子跃迁的类型: 1.σ → σ *; 2. n→ σ * ; 3.π →π*; 4. n→ π*; 5. σ → π* 6. π → σ*
E
* * n * n * * *
•
E平《E转《 E振《 E电子
•
S 电子能级
•
V 振动能级
•
J 转动能级
3. 电子跃迁的类型与吸收光谱:
• 3.1 紫外光谱主要研究的是价电子在不同的分子 轨道之间能级的跃迁,一个原子或分子吸收一定 的电磁辐射能量(ΔE)后,就由一种稳定的基态跃 迁到另一种高能态——激发态,它所吸收的电磁 辐射的能量应等于体系的能量增加值(ΔE),由于 分子各能量状态是分立的,故ΔE也只能取某些分 立的值,从而只有特定能量的光子才能被分子吸 收,分子选择性吸收一定波长的光,使透过的光 谱中这些波长光的强度减弱或不呈现,从而产生 吸收光谱:
第一章 紫外光谱

精选2021版课件
18Eσ* Nhomakorabeaπ*
π
* 4
π
* 3
n
π
π2
π1
σ
C-C C=C C=O
C=C-C=C
能级跃迁图
精选2021版课件
19
三、 分子吸收光谱的表达(紫外光谱图)
UV:A~λ;IR:T~ v 有时仅记录吸收峰的相关参数:λmax和εmax
Ultraviolet Absorption Spectrometry
3. B吸收带(Benzenoid):苯环π→π*跃迁产生,
230-270nm , 中 心 在 256nm 处 , 宽 而 弱 , 有 精 细 结
构,是苯环的特征吸收ε约220
4. E吸收带(Ethylenic):芳环中碳碳双键π→π* 跃迁产生,在184(E1)( ε约60000)和204(E2)nm 处( ε约7900)。
精选2021版课件
10
二、分子能级图
1. 分子能级
分子的总能量:
E = Et + Ee + Ev + Er 其中:Et(平动动能)是连续的,分子光谱 主要取决于Ee(电子能量)、Ev(振动能量) 和Er(转动能量) 的变化,即:
E = Ee + Ev + Er 这些能量都是不连续的、量子化的
分子能级图:
吸收带: K带; R带 含硫化合物:类似于醇、醚和羰基化合物,
吸收带λmax较大。
精选2021版课件
52
二、共轭双键化合物
跃迁类型: σ→σ*;π→π*; (n →π*)
吸收谱带: K(、R)吸收带
Woodward等人提出了一套计算此类化 合物π→π*跃迁的λmax的方法,可用于确定 此类化合物的可能结构。
有机波谱解析-第二章 紫外光谱

C
Hale Waihona Puke n<pOC
C
p*
n > p p*
n
n C
p* p
p*
n
p n 非极性
p
O 非极性
C C
p
极性
极性
n → p*跃迁:兰移; ; pp np
(4)尽量和文献中所用的溶剂一致。
(5)溶剂挥发性小、不易燃、无毒性、价格便宜。
5. 电子跃迁的类型
紫外吸收光谱是由价电子的能级跃迁而产生的,有机化 合物的紫外—可见吸收光谱是三种电子跃迁的结果:σ电子、 π电子、n电子。 s* n p* H C O
s
p E 分子轨道理论:成键轨道—反键轨道。
各种电子能级的能量及电子跃迁类型如右图
3. 紫 外 光 谱 图
横坐标:波长或频率 纵坐标:吸光度(A) 或 透过率(T)
紫外光谱(图)的特点: 吸收谱带少; 吸收谱带宽; 通常以谱带吸收最强的波长表示谱带位置,称 为最大吸收波长(λmax) ,是分子的特征常数, 与分子电子结构相关,可推测化合物中生色团类 型和共轭大小; 吸收强度以最大吸收波长处的摩尔吸光系数 (εmax)表示,也是分子特征常数和鉴定化合物 的重要依据。
H H c H
取代基 红移距离 -SR 45(nm)
c H
max=162nm 助色基团取代 p
-NR2 40(nm) -OR 30(nm)
p*(K带)发生红移。
-Cl 5(nm) CH3 5(nm)
(2)共轭烯烃中的
p → p*
波谱分析第二章03,04有机化合物紫外光谱解析

邻 3 7 0 2 13 20
间 3 7 0 2 13 20
对 10 25 10 15 58 85
例1
CO O H
Y= OH X=NH2
基值 取代值
230 nm 58 nm 288 nm
NH2
实测 288 nm
例2 计算4-乙酰氨基苯甲醛 CH3CONH 的K吸收带。
基值 对位NHAc取代 计算值 实测值 250nm 45nm 295nm 292nm
10
35 35 6 15 25
β
12
30 30 6 12 30 80 95
γ
18
17 50 6 12 25
18
31 50 6 12 25
溶剂校正:
二氧六环 +5nm 乙醚 +7nm
氯仿 水
+1nm -8nm
例1
例2
O
基值 烷基取代 α β
215nm 10 nm(=1*10) 12 nm(=1*12) 计算 实测
10~1000
π4 π*
*
π* π3 n π2 π π
*
εmax
n
随着与羰基共轭数目的增加, π→π* 跃迁能量不断降低,K带 迅速红移,且吸收强度增加。 n→π* 跃迁因共轭链的增加影 响较小。
π1
C=C
C=O
C=C
C=O
不饱和羰基分子轨道和电子跃迁
α,β不饱和羧酸及其衍生物
R带比相应醛酮显著地紫移。 RCO-X中,X基团中n占据p轨道与 羰基π轨道发生p-π共轭效应, 形成多电子的大π体系。 X基团的亲电诱导效应羰基n轨道 能级轨道略有降低。 由于反键轨道能级较高,K带也 发生紫移。 烷基取代的α,β不饱和羧酸及 其衍生物,由于 -π共轭效应, K带向红移动。
有机波谱分析紫外

含饱和杂原子的化合物: σ*、 n*,吸收弱, 只有部分有机化合物(如C-Br、C-I、C-NH2) 的n*跃迁有紫外吸收。
01
同一碳原子上杂原子数目愈多, λmax愈向长波移动。
03
CHCl3237nm ,CCl4 257nm
01
生色基:能在某一段光波内产生 吸收的基团,称为这
( C=C、C≡C、C=O、COOH、
0 3 COOR、
05
助色基: 当具有非键电子的原子 或基团连在双键或
07
共轭(p- 共轭),从而使电子的 活动范围增
09
种效应称为助色效应。能产生助 色效应的
0 2 一段波长的生色团或生色基。
0 4 COR、CONH2、NO2、-N=N
○ σ *、 n * 、 π π*属于远紫 外吸收
○ n π *跃迁为禁 戒跃迁,弱吸收带 --R带
取代基对羰基化合物 的影响
○ 当醛、酮被羟基、 胺基等取代变成酸、 酯、酰胺时,
○ 由于共轭效应和诱 导效应影响羰基, λmax蓝移。
硫羰基化合物
R2C=S 较 R2C=O 同系物中n π *跃 迁λmax红移。
导致 B 带、E2带红移。
不同助色团的红移顺序为:
NCH3)2 ﹥NHCOCH3 ﹥ O-,SH ﹥NH2﹥ OCH3﹥OH﹥ Br﹥Cl﹥CH3﹥NH3+ 助色团取代苯:助色团含有孤电子对,它能与苯环 π 电子共轭。使 B 带、E 带均移向长波 方向。
生色团取代的苯:含有 π 键的生色团与苯环相连时, 产生更大的 π π* 共轭体系,使
2
例如:乙烯 165nm(ε 15000),
研究生波谱解析紫外光谱

紫外光谱的形成
物质分子在入射光的作用下吸收了特定波长的电 磁波,发生了价电子的跃迁形成的。 远紫外(10-200nm)→近紫外(200-400nm)→可 见光区( 400-800nm )
紫外光谱的形成
• 价电子的跃迁
紫外光谱形成的微观解释
自旋多重性及电子跃迁选定原则
单重态 (singlet state)
0.5 0.4
0.3
ε值大于104是属于完全允许的跃迁,
0.2 0.1 0.0
ε值小于100,则是禁阻跃迁。
• (Absorption spectra )
370 420 470 吸收曲线
1紫外吸收谱带的强度 2紫外吸收峰的位置
常见的紫外光谱术语
生色团(chromophore) C=C、C=O、COOH、COOR、NO2、N=N、芳基等含有π电子的基团。
第二章 紫外光谱
• 紫外光谱的基本原理 • 仪器装置 • 实验技术 • 紫外吸收与分子结构关系 • 应用
基本原理
• 紫外电磁波谱
• 紫外光谱的形成(示意图):分子在入射光的作用下发生了价电 子的跃迁,吸收了特定波长的光波形成。
• 紫外光谱表示方法 • 常见的紫外光谱术语 • 电子跃迁的类型 • 影响紫外吸收的因素
自旋量子数 I±1/2,S=0
三重态 (triplet state)
当处于S0态的一对电子吸收光子受激后,产生了 在两个轨道中自旋方向平行的电子,这时S = 1, M=2S+1=3,这种状态称为三重态。
因为在磁场中,电 子的总自旋角动量在磁 场方向可以有三个不同 值的分量,是三度简并
的状态,用T表示。按
能量高低可表示为
T1,T2……激发态。
有机波谱分析 第二章-紫外光谱

2= - 2 1
反键轨道
能量
2
成键轨道
1
1
= + 1
2
电子通常在成键轨道上,当分子吸收能量后可以激发到反键轨道上
三、紫外光谱表示法
1.图示法 紫外光谱可用图表示,也可用数据表示 紫外光谱图是由横坐标、纵坐标和吸收曲线组成的。
对甲苯乙酮的紫外光谱图
横坐标表示吸收光的波长,用nm(纳米)为单位。 纵坐标表示吸收光的吸收强度,可以用A(吸光度)、T(透射比或透光率或 透过率)、1-T(吸收率)、(吸收系数) 中的任何一个来表示。
§2.1 紫外光谱的基本知识
3.红移(red shift): 也称向长波移动(bathochromic shift),当 有机物的结 构发生变化(如取代基的变更)或受到溶剂效应 的影响时,其吸收带的最大吸 收波长(λmax)向长波方向移动的效应。 4.蓝移(blue shift): 也称向短波移动(hypsochromic shift),与红移相反 的效应,即由于某些因素的影响使得吸收带的最大吸收波长(λ max)向短波 方向移动的效应。
5.增色效应(hyperchromic effect): 或称浓色效应, 使吸收带的吸收强度增加的效应。
6.减色效应(hypochromic effect): 或称浅色效应, 使吸收带的吸收强度减小的效应。
7.强带:在紫外光谱中,凡摩尔吸光系数大于104的吸收带称为强带。 产生这种吸收带的电子跃迁往往是允许跃迁。 8.弱带:凡摩尔吸光系数小于1000的吸收带称为弱带。产生这种吸收 带的电子跃迁往往是禁阻跃迁。 9.末端吸收(end absorption): 指吸收曲线随波长变短而强度增 大,直至仪器测量极限(190nm),在仪器极限处测出的 吸收为末端吸收。 10.肩峰:指吸收曲线在下降或上升处有停顿,或吸收稍微增加或降低 的峰,是由于主峰内隐藏有其它峰。
有机波谱分析复习参考含答案
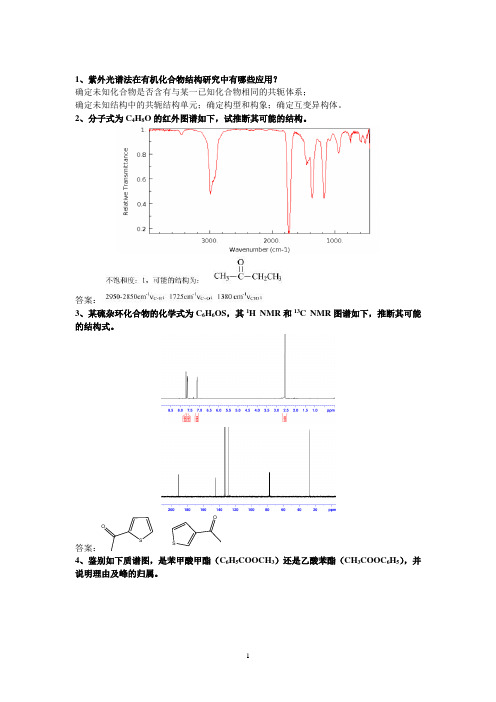
1、紫外光谱法在有机化合物结构研究中有哪些应用?确定未知化合物是否含有与某一已知化合物相同的共轭体系;确定未知结构中的共轭结构单元;确定构型和构象;确定互变异构体。
2、分子式为C4H8O的红外图谱如下,试推断其可能的结构。
答案:3、某硫杂环化合物的化学式为C6H6OS,其1H NMR和13C NMR图谱如下,推断其可能的结构式。
答案:SOSO4、鉴别如下质谱图,是苯甲酸甲酯(C6H5COOCH3)还是乙酸苯酯(CH3COOC6H5),并说明理由及峰的归属。
答案:C 6H 5COOCH 35、某化合物的紫外光谱:OH H C m ax 52λ 262nm (m ax ε15);红外光谱:3330~2500cm -1间有强宽吸收,1715 cm -1处有强宽吸收;核磁共振氢谱:δ11.0处为单质子单峰,δ2.6处为四质子宽单峰,δ2.12处为三质子单峰,质谱如图所示。
参照同位素峰强比及元素分析结果,分子式为C 5H 8O 3,试推测其结构式。
答案:CH 3COCH 2CH 2COOH1、紫外光谱在有机化合物结构鉴定中的主要贡献是什么?答:在有机结构鉴定中,紫外光谱在确定有机化合物的共轭体系、生色团和芳香性等方面有独到之处2、红外光谱产生必须具备的两个条件是什么?答:一是红外辐射的能量应与振动能级差相匹配,即E 光=△E ν,二是分子在振动过程中偶极矩的变化必须不为零。
3、核磁共振谱是物质内部什么运动在外部的一种表现形式?答:是具有核磁矩的原子核的自旋运动在外部的一种表现形式。
4、解释什么是碳谱的γ-效应答:当取代基处在被观察的碳的γ位,由于电荷相互排斥,被观察的碳周围电子云密度增大,δC 向高场移动。
6、根据图 6-1~图6-4推断分子式为C 11H 20O 4未知物结构答案:1.当体系的共轭双键增多时,紫外光谱图会发生什么变化?阐明发生变化的原因。
答:当体系的共轭双键增多时,吸收光会向长波方向移动,即发生红移现象。
有机化学波谱分析 紫外光谱 练习题

紫外练习题(-)判断题(正确的在括号内填“√”号;错误的在括号内填“×”号。
)1.在分光光度法中,根据在测定条件下吸光度与浓度成正比的比耳定律的结论,被测定溶液浓度越大,吸光度也越大,测定的结果也越准确。
()2.有机化合物在紫外一可见光区的吸收特性,取决于分子可能发生的电子跃迁类型,以及分子结构对这种跃迁的影响。
()3。
不同波长的电磁波,具有不同的能量,其大小顺序为:微波>红外光>可见光>紫外光>x射线,()4.符合比耳定律的有色溶液稀释时,其最大吸收峰的波长位置不移动但吸收峰强度发生浅色效应。
()5。
区分一化合物究竟是醛还是酮的最好方法是紫外光谱分析法。
()6。
有色化合物溶液的摩尔吸光系数随其浓度的变化而改变。
()7.由共轭体系π-π*跃迁产生的吸收带称为K吸收带。
()8。
紫外一可见吸收光谱是分子中电子能级变化产生的,振动能级和转动能级不发生变化。
()9。
极性溶剂一般使π-π*吸收带发生红位移,使n-π*吸收带发生蓝位移。
()10.在紫外光谱中,发色团指的是有颜色并在近紫外和可见区域有特征吸收的基团。
()11.利用物质分子吸收光或电磁波的性质,建立起来的分析方法属于吸收光谱分析。
()12。
紫外吸收光谱、红外吸收光谱、核磁共振谱和质谱是有机结构分析的四种主要的有机光谱分析方法,合称为四大谱()13.电磁波的波长越长,能量越大。
()14. 电子能级间隔越小,跃迁时吸收光子的频率越大。
()(二)单选题第一节1。
光或电磁波的二象性是指()。
A.电磁波是由电矢量和磁矢量组成;B.电磁波具有波动性和电磁性;C.电磁波具有微粒性和光电效应; D. 电磁波具有波动性和微粒性。
2。
光量子的能量与电磁波的哪一个物理量成正比?()A。
频率;B.波长;C。
周期; D. 强度3.可见光区、紫外光区、红外光区、无线电四个电磁波区域中,能量最大和最小的区域分别为()。
A.紫外光区和无线电区;B.紫外光区和红外光区;C。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机波谱解析
3. 紫 外 光 谱 图
横坐标:波长或频率
纵坐标:吸光度(A) 或 透过率(T)
A = lg(I0/I1) = lg(1/T)= εcl
有机波谱解析
紫外光谱(图)的特点:
吸收谱带少; 吸收谱带宽; 通常以谱带吸收最强的波长表示谱带位置,称 为最大吸收波长(λmax) ,是分子的特征常数, 与分子电子结构相关,可推测化合物中生色团类 型和共轭大小; 吸收强度以最大吸收波长处的摩尔吸光系数 (εmax)表示,也是分子特征常数和鉴定化合物 的重要依据。
有机波谱解析
优点:快速,灵敏度高,应用广泛,对 全部金属及大部分有机化合物进行测定。
缺点:只提供分子中共轭体系和一些基 团的结构信息,不能推知分子结构。
有机波谱解析
紫外图谱讨论:
① 同一种物质对不同波长光的吸光度不同。吸光度最大处
对应的波长称为最大吸收波长λmax ② 不同浓度的同一种物质,其吸收曲线形状相似λmax不 变。而对于不同物质,它们的吸收曲线形状和λmax则不同。
第一节 紫外吸收光谱分析基本原理
一、 紫外吸收光谱的产生 二、 有机物紫外吸收光谱与电子跃迁 三、 影响紫外吸收波长的因素
有机波谱解析
一、紫外吸收光谱的产生 1.概述
紫外-可见光谱:是分子吸收紫外-可见光区10-800纳米的电 磁波而产生的吸收光谱,简称紫外光谱。故:又称电子吸收 光谱(分子价电子的跃迁 基态→激发态)。
⑤ 在λmax处吸光度随浓度变化的幅度最大,所以测
定最灵敏。吸收曲线是定量分析中选择入射光波长的重 要依据。
有机波谱解析
4. 溶剂的选择
由于溶剂对电子光谱图影响很大,因此,在吸收光谱图 上或数据表中必须注明所用的溶剂。与已知化合物紫外光谱 作对照时也应注明所用的溶剂是否相同。
在进行紫外光谱法分析时,必须正确选择溶剂。选择溶 剂时注意下列几点:
(1)溶剂应能很好地溶解被测试样,溶剂对溶质应该是惰性 的。即所成溶液应具有良好的化学和光学稳定性。
(2)在溶解度允许的范围内,尽量选择极性较小的溶剂。 (3)溶剂在样品的吸收光谱区应无明显吸收。 (4)尽量和文献中所用的溶剂一致。 (5)溶剂挥发性小、不易燃、无毒性、价格便宜。
有机波谱解析 5. 电子跃迁的类型
波长范围:10-800 nm. (1) 远紫外光区(真空紫外区): 10-200nm (2) 近紫外光区: 200-400nm (3) 可见光区: 400-800nm
可用于结构鉴定和定量分析。
电子跃迁的同时,伴随着振动、转动能级的跃迁;带状光谱。
有机波谱解析
2. 朗伯-比尔定律
定律:被吸收的入射光的分数正比于光程中吸 收物质的分子数目;对于溶液,如果溶剂不吸收, 则被溶液所吸收的光的分数正比于溶液的浓度和光 在溶液中经过的距离。公式表示如下:
助色团: n→π* < π→π* < n→σ* < σ→σ*
有一些含有n电子的基团(如-OH、-OR、-NH2、-NHR、-X 等),它们本身没有生色功能(不能吸收λ>200nm的光),但当它们 与生色团相连时,就会发生n—π共轭作用,增强生色团的生色 能力(吸收波长向长波方向移动,且吸收强度增加),这样的基团 称为助色团。
A = lg(I0/I1) = lg(1/T)= εcl A:吸光度;T:透光度(透光率);l:光在溶液中经过的距 离,一般为吸收池厚度;ε:摩尔吸光系数,样品浓度为 (1mol/L) 置于1cm 样品池,在一定波长下测得之吸光度值。
T = I1/I0
其中:I1: 透过光强度; I0: 入射光强度。
有机波谱解析
红移与蓝移
有机化合物的吸收谱带 常常因引入取代基或改变溶
剂使最大吸收波长λmax和吸
收强度发生变化:
λmax向长波方向移动称
为红移,向短波方向移动称 为蓝移 (或紫移)。吸收强度
即摩尔吸光系数ε增大或减
小的现象分别称为增色效应 或减色效应,如图所示。
有机波谱解析
吸收带:吸收峰在紫外区域中的位置
紫外吸收光谱是由价电子的能级跃迁而产生的,有机化
合物的紫外—可见吸收光谱是三种电子跃迁的结果:σ电子、
π电子、n电子。
s*
HC O
子轨道理论:成键轨道—反键轨道。
s
电子能级和跃迁示意图
各种电子能级的能量及电子跃迁类型如右图
当外层电子吸收紫外或可见辐射后,就从基态向激发态(反
键轨道)跃迁。主要有四种跃迁所需能量ΔΕ大小顺序为:
R 带(基团型): 主要 n →π* ,ε< 100, λ> 270nm;
K 带(共轭型): π→π*引起,ε>104;一般在 210-250 nm;
B 带(苯型): 专指苯环π→π*,在230-270 nm形成多重峰;
E 带(乙烯型): 产生于π→π*,可看成苯环中π电子相互作用
n→π* < π→π* < n→σ* < σ→σ*
有机波谱解析
6. 紫外光谱中常用的名词术语
生色团(又叫发色团): 最有用的紫外—可见光谱是由π→π*和n→π*跃迁产生的。
这两种跃迁均要求有机物分子中含有不饱和基团。这类含有π键 的不饱和基团称为生色团。简单的生色团由双键或叁键体系组 成,如乙烯基、羰基、亚硝基、偶氮基—N=N—、乙炔基、腈 基—C㆔N等。
可作为物质定性分析的依据之一。
有机波谱解析
③ 不同物质对光能的吸收程度不同,即ε不同,若跃 迁是完全“允许的”,则ε大于104,若是“禁阻的”, 则小于几十,故可作为物质定性分析的依据之一。
④ 不同浓度的同一种物质,在某一定波长下吸光度 A 有差异,在λmax处吸光度A 的差异最大。此特性可作为
物质定量分析的依据。
有机波谱解析
紫外-可见吸收光谱
Ultraviolet-visible absorption spectroscopy UV-Vis
有机波谱解析
主要内容
第一节 紫外吸收光谱基本原理 principles of ultraviolet spectrometry 第二节 紫外可见分光光度计 ultraviolet spectrometer 第三节 各类化合物的紫外吸收光谱 第四节 紫外吸收光谱的应用 application of Ultraviolet spectrometry
