第二节 蛋白质的共价结构
蛋白质的共价结构.doc

蛋白质的共价结构蛋白质分子是由一条或多条肽链构成的生物大分子。
多肽链是由氨基酸通过肽键共价连接而成的,各种多肽链都有自己特定的氨基酸序列。
蛋白质的相对分子质量介于6000到1000000或更高。
蛋白质分为两大类:单纯蛋白质和缀合蛋白质。
根据分子形状可分为纤维状蛋白质、球状蛋白质和膜蛋白质。
此外还可按蛋白质的生物学功能分类。
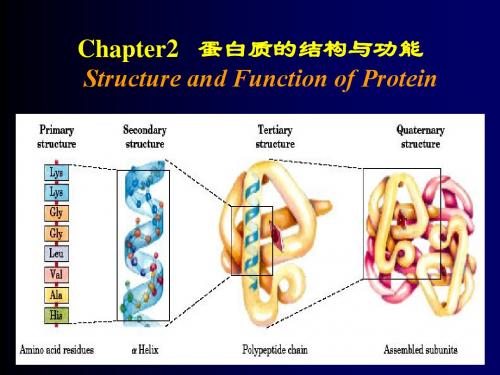
为了表示蛋白质结构的不同组织层次,经常使用一级结构、二级结构、三级结构和四级结构这样一些专门术语。
一级结构就是共价主链的氨基酸序列,有时也称化学结构。
二、三和四级结构又称空间结构(即三维结构)或高级结构。
蛋白质的生物功能决定于它的高级结构,高级结构是由一级结构即氨基酸序列决定的,二氨基酸序列是由遗传物质DNA的核苷酸序列规定的。
肽键(CO—NH)是连接多肽链主链中氨基酸残缺的共价键,二硫键是使多肽链之间交联或使多肽链成环的共价键。
多肽链或蛋白质当发生部分水解时,可形成长短不一的肽段。
除部分水解可以产生小肽之外,生物界还存在许多游离的小肽,如谷胱甘肽等。
小肽晶体的熔点都很高,这说明短肽的晶体是离子晶格、在水溶液中也是以偶极离子存在的。
测定蛋白质一级结构的策略是:(1)测定蛋白质分子中多肽链数目;(2)拆分蛋白质分子的多肽链;(3)断开多肽链内的二硫桥;(4)分析每一多肽链的氨基酸组成;(5)鉴定多肽链的N-末端和C-末端残基;(6)断裂多肽链成较小的肽段,并将它们分离开来;(7)测定各肽段的氨基酸序列;(8)利用重叠肽重建完整多肽链的一级结构;(9)确定半胱氨酸残基形成的S-S交联桥的位置。
序列分析中的重要方法和技术有:测定N-末端基的苯异硫氰酸酯(PITC)法,分析C-末端基的羧肽酶法,用于多肽链局部断裂的酶裂解和Br化学裂解,断裂二硫桥的巯基乙醇处理,测定肽段氨基酸序列的Edman化学降解和电喷射串联质谱技术,重建多肽链一级序列的重叠肽拼凑法以及用于二硫桥定位的对角线电泳等。
蛋白质的共价结构

WORK IN BIOCHEMISTRY
原理:首先实现蛋白质降解成多肽,通过电离源将蛋白质分 子转化为气相离子,然后利用质谱没分析仪的电场、 磁场将具有特定质谱与电荷比值(m/z值)的多肽离 子分离开来,经过离子检测器收集分离的离子,确 定的m/z值,分析鉴定未知蛋白质。
WORK IN BIOCHEMISTRY
每种蛋白质都有独特 的三维结构,形成独特的 功能,每种蛋白质也各有 特殊的氨基酸序列。通过 对不同蛋白质的氨基酸序 列测定,对人类遗传疾病 的跟踪研究,并且在比对 了不同物种间功能相似的 蛋白质之后,我们可以大 致得出结论——氨基酸序 列决定蛋白质的功能。
氨基酸序列决定蛋白质功能
对于一个特定蛋白质,其氨基酸序列也不是绝对固定 不变的。大约20%~30%的人类蛋白质是多态的。这些变动 大多数对蛋白质功能没有影响或影响很小。而且关系较远 的物种间执行相似功能的蛋白质在大小和氨基酸序列上可 能差异很大。 在蛋白质的氨基酸序列中常常有关键区域,直接影响 其功能,而其他区域的氨基酸序列可以有很大变动,且不 影响其功能。关键区域在不同蛋白质间互不相同,使得联 系序列与三维结构、机构与功能之间关系的任务变得复杂。
WORK IN BIOCHEMISTRY
ESI-MS测量法
ESI-MS测量法是在液态下完成的,多肽离子带有多个电 荷,由高效液相层析等分离方法分离的液体多肽混合物, 去除这些杂质成分后,多肽离子进入连续质量分析仪 (Tandem mass analyzer),连续质量分析仪选取某 一特定m/z值的多肽离子,并以碰撞解离的方式将多肽离 子碎裂成不同电离或非电离片段。随后,依据m/z值对电 离片段进行分析并汇集成离子谱,通过数据库检索,得到 相应的蛋白。
3.4 蛋白质的共价结构
第二章蛋白质的结构和生理功能

二、氨基酸的性质和生理特点 (一)性质 1.物理性质 无味、无色晶体物质; 熔点200-300oC之间,会分解成胺和CO2; 具有较高的介电常数; 一般可溶于水,其水溶液为无色透明液体, 溶解度各不相同; 一般不溶于有机溶剂; 均溶于稀酸或稀碱。
2.氨基酸的晶体存在形式
氨基酸晶体是以离子晶格组成的,维系晶 格中质点的作用力是较强的静电吸引力,因而 熔点高,而一般的有机化合物晶体是由分子晶 格组成,其维系力为较弱的范德华力,此类物 质熔点较低。
蛋白质功能的多样性
• 具有储藏氨基酸的功能。用作有机体及其胚胎 或幼体生长发育的原料。如蛋类中的卵清蛋白、 乳中的酪蛋白、小麦种子中的麦醇蛋白。 • 运输功能。脊椎动物红细胞里的血红蛋白、无 脊椎动物中的血蓝蛋白在呼吸过程中起着输送 氧气的作用;血液中的脂蛋白随血流输送脂质; 生物氧化过程中的某些色素蛋白如细胞色素C 等起电子传递体的作用。
• • • • 氨基酸排列随机性 周期性的重复未发现 二硫键的数目和位置也没有明显的规律 每种蛋白质化学结构的独特性 在同源蛋白质氨基酸顺序中有许多位置的氨基 酸对所有种属来说是相同的(不变残基),但 其他位置的氨基酸却不同(可变残基)。这种 相似性被称为顺序同源现象。
蛋白质一级结构的重要性
氨基酸组成及顺序不同会导致蛋 白质生物功能的改变(病态现象)。如 镰刀形细胞贫血病就是血红蛋白(4个 亚基,582个氨基酸组成)中的一个谷 氨酸变为缬氨酸导致的。 一级结构是立体结构的基础。
在研究蛋白质氨基酸组成时一般先用完全 水解的方法,将蛋白质水解成各种氨基酸的 混合物,然后采用高效液相色谱等方法进行 定量测定。通常采用的水解方法有酸水解、 碱水解和酶水解。
酸水解
用硫酸(6 mol/L)或盐酸(4 mol/L)煮沸回流20小时。
蛋白质化学蛋白质的共价结构

肽键具有高度的稳定性,是维持 蛋白质一级结构的主要化学键
肽键的形成是蛋白质合成过程中 关键的化学反应之一
二硫键的形成
二硫键是由两个相邻 的半胱氨酸分子中的 巯基(-SH)脱氢氧化 形成的共价键
二硫键的形成通常需 要特定的化学环境, 如还原剂的存在
二硫键对于维持蛋白 质的高级结构和功能 具有重要作用
疾病关联
许多疾病的发生和发展都与蛋白 质变异有关,如癌症、神经退行
性疾病、遗传性疾病等。
疾病治疗
针对蛋白质变异的疾病治疗是当 前研究的热点之一,如通过药物 或基因治疗等方法来纠正异常的
蛋白质表达或功能。
05
蛋白质的分离与纯化
蛋白质的分离方法
离心分离法
利用不同物质在离心力场中的 沉降速度不同,将蛋白质与其
02
蛋白质的共价结构
氨基酸的共价结构
氨基酸是蛋白质的基本组成单位,具 有一个羧基(-COOH)和一个氨基(NH2)
肽键是蛋白质一级结构的基础,具有 高度的稳定性
通过脱水缩合反应,氨基酸分子中的 羧基和氨基之间形成肽键,连接成肽 链
肽键的形成
肽键是氨基酸在肽链中连接的化 学键,由一个氨基酸的羧基与另 一个氨基酸的氨基脱水缩合而成
感谢您的观看
THANKS
磷酸化酶和磷酸酯酶
磷酸化过程由磷酸化酶催化,而磷酸酯酶则可以 水解磷酸化蛋白质,使其去磷酸化。
3
磷酸化与信号转导
磷酸化在信号转导过程中起着至关重要的作用, 通过磷酸化可以调节蛋白质的活性,进而影响细 胞内的各种生理过程。
蛋白质的乙酰化修饰
乙酰化修饰
乙酰化是一种通过将乙酰基团连接到蛋白质的特定氨基酸残基上, 从而改变蛋白质的稳定性和功能。
第二章 蛋白质结构的组织形式

结构模体(motif,structural motif)
αα模体 ββ模体(发夹式β模体) βαβ模体 反平行β层回纹模体 螺旋-转折-螺旋模体
αα
αα:常为两股平行或反平行的右手螺旋段缠绕
形成的左手超螺旋。两螺旋的排列如图,是纤 维状蛋白质的主要结构元件;
ββ(发夹式β模体)
成,其螺旋含量一般在60%以上,有的高 达80%。α螺旋在这类蛋白质中大多以反 平行方式排布和堆积,所以又称反平行α 结构。 按照螺旋排布的不同拓扑学特征,又可分 为一些亚组。肌红蛋白、血红蛋白、烟草 花叶外壳蛋白、细胞色素b,等均属此类结 构。
α型结构(αstructure)分类
(1) 线绕式α螺旋(coiled-coil α helix):纤维蛋白的结构基础,有足够 强度和柔性 (2) 四螺旋束 (four helix bundle) (3) 珠状折叠(globin fold):血红蛋白 (4) 复杂螺旋组合
a、DNA结合模体(DNAbinding motif):专一地 与DNA结合。λCro、阻 遏蛋白等中发现 b、钙结合模体 (calcium-binding motif): 对钙结合专一,又称 “EF手”。小白蛋白、 钙调蛋白、肌钙蛋白等
超二级结构特征描述
序列模式:是指蛋白质一段肽链上
每一残基构象和其氨基酸序列的关 系,描述的是蛋白质空间结构与氨 基酸序列的关系。 每一类型的超二级结构都有确定的 序列模式 应用:从蛋白质一级结构中预测哪 一段肽链含有哪种类型的基序。
/scop/
蛋白质是具有高度组织、结构极复杂的生物
大分子
第三节 蛋白质结构的形成 —多肽链的生物合成与折叠
了解这种复杂蛋白质结构的形成机理,对于
蛋白质主要结构以及功能含举例

蛋白质的主要结构以及功能含举例
25
(2) 肽 1) 氨基酸通过肽键相连的化合物, 蛋白质不完全水解的产物。 2) 氨基酸残基 (amino acid residues) 3) N-末端(H)与C末端(OH) 4) 多肽(>10肽)、寡肽(<10肽)、 开链肽与环肽
蛋白质的主要结构以及功能含举例
27
蛋白质的主要结构以及功能含举例
23
R1 NH2 CH
COOH
R2 H2N CH COOH
肽链氨基端
R1 O
NH2 CH C N
N-/H
肽键
H
肽
R2
肽链羧基端
CH COOH
C-/OH
蛋白质的主要结构以及功能含举例
24
肽键平面
➢ 单键,部分双键性质 ➢ 连接肽键两端的C=O、 N-H 和 2 个 Cα 共 6 个 原 子 的空间位置处在一个相对 接近的平面上 ➢ 相邻2个氨基酸的R侧链 形成反式结构
2
二、蛋白质的氨基酸组成 1、构件分子( building block molecule):
L-结构以及功能含举例
3
(α-氨基)NH2
COO (α-羧基)
H
C
R(侧链/侧基)
H
L,α-氨基酸
蛋白质的主要结构以及功能含举例
4
2、参与蛋白质组成的氨基酸20种 受遗传密码控制,无种族特异性
蛋白质的主要结构以及功能含举例
第二节 蛋白质的分子组成 一、元素组成和分子量
1.主要元素:C、H、O、N 稀有元素:P、Fe、Zn、Mn、I 等
2.特点:N含量恒定,平均16% 100克蛋白质中含 16克N。 1克N=6.25 克蛋白质
第二节蛋白质的结构

末 端 氨 基 酸 测 定
N
O O2N
R
O
CH C
HN CH C NO2 DNP 衍生物
N- 端氨基酸 R
O + 氨基酸
H2O
O2N
HN CH C OH NO2 DNP- 氨基酸
Sanger试剂(DNFB)标记N末端
② 丹磺酰氯法
• 在碱性条件下,丹磺酰氯(二甲氨基萘磺酰氯)可以 与N-端氨基酸的游离氨基作用,得到丹磺酰-氨基酸。 • 此法的优点是丹磺酰-氨基酸有很强的荧光性质,检 测灵敏度可以达到110-9mol。DNS氨基酸直接鉴定
●
在多肽链中连续的出现带同种电荷的极性氨基酸,α-螺旋就不稳定。
●
在多肽链中只要出现pro,α-螺旋就被中断,产生一个弯曲 (bend)或结节(kink)。
●
Gly的R基太小,难以形成α-螺旋所需的两面角,所以和Pro一样 也是螺旋的最大破坏者。
●
肽链中连续出现带庞大侧链的氨基酸如Ile,由于空间位阻,也难 以形成α-螺旋。
除了上面这种典型的α-螺旋外,还有一些不典型的α-螺 旋,所以规定了有关螺旋的写法,用“nS”来表示,n为螺
旋上升一圈氨基酸的残基数。S为氢键封闭环内的原子数,
典型的α-螺旋用3.613表示,非典型的α-螺旋有3.010, 4.416 (π螺旋)等。
一些一条长的多肽链先折叠成几个相对独立的区域再缔合成三级结构要比直接折叠成三级结构更合从功能的角度耒看酶蛋白的活性中心往往位于结构域之间因为连接各个结构域的常常是一条松散的肽链使结构域在空间上摆动比较自由容易形成适合底物结合的空间
第二节 蛋白质的结构
一、蛋白质概念
蛋白质(protein)是由许多氨基酸 (amino acids)通过肽键(peptide bond)相连 形成的高分子含氮化合物。 蛋白质(protein)是源自希腊字proteios , 意思就是primary。
4 蛋白质的共价结构

肽键的共振
• 羧基氧和氨基氮间有共 振/部分共用两对电子 • 中间态的酰胺氮带部分正 电荷,羰基氧带部分负电 荷,肽键具有永久偶极
刚性肽平面和单键的部分自由旋转
• 与Cα相连的键可以旋转 φ (phi): N-Cα绕Cα旋转的键角 ψ (psi): C-Cα绕Cα旋转的键角 • 将多肽链完全伸展时的ψ 和φ 定为180° • 由于肽链骨架和侧链空间位阻的限制, ψ 和φ的值是受限制 的
蛋白质分类
单纯蛋白质 缀合蛋白质=蛋白质 + 辅基
脂蛋白 糖蛋白 磷蛋白 血红素蛋白 黄素蛋白 金属蛋白
蛋白质:大小差异大
残基数 细胞色素c
肌连蛋白
蛋白质中氨基酸残基数的估算
简单蛋白质:残基数 = Mw ÷110 20种常见氨基酸的平均分子量为138 组成蛋白质的氨基酸的平均分子量为128 每个氨基酸残基的平均分子量为110
0
10 10
14 14 20
18 18 11 26
29 29 24 28 26
31 31 27 33 26 28
44 44 44 47 1 44 47
43 43 46 43 46 50 41 47 13
哺乳类 鸟和爬虫类 真菌
根 据 细 系 统 树 素
肽段排序
所得资料:N-末端残基 H 第一套肽段 OUS PS EOVE RLA HOWT C-末端残基S 第二套肽段 SEO WTOU VERL APS HO
借助重叠肽确定肽段次序: 末端残基 H S 末端肽段 HOWT APS 第一套肽段 H O W T O U S E O V E R LA P S 第二套肽段 H O W T O U S E O V E R LA P S 推断全序列 H O W T O U S E O V E R LA P S
第二节蛋白质的共价结构

作业:
什么叫氨基酸的等电点?
现有含Asp、Arg、Ala的待测样品, 若在pH为6.8的缓冲系统中电泳,按下图 标出各氨基酸的名称,并说明之。
-
+
试述蛋白质多肽链的氨基酸排列顺序 测定的一般步骤。
一个七肽,其氨基酸组成是:Lys 、
Pro、Arg、Phe、Ala、Tyr、Ser ; 未经糜蛋白酶处理,与DNFB反应, 不产生α-DNP-氨基酸,经糜蛋白酶处 理后,断裂成两个肽段(Ala、Tyr、 Ser 和Lys、Pro、Arg、Phe),两肽 分别与DNFB反应,产生DNP- Ser和 DNP- Lys;此七肽与胰蛋白酶反应, 生成两个肽段( Pro、Arg 和Lys、 Phe、Ala、Tyr、Ser 。问此七肽的一 级结构?
R n-1O
Rn O
HN CH C HN CH C OH
N-端氨基酸
C-端氨基酸
H+
RO
Rn O
NH2NH2H2N CH C NHNH2 +H2N CH C OH
氨基酸酰肼
C-端氨基酸
羧肽酶法
羧肽酶是一种肽链外切酶,它能从多肽链的 C-端逐个的水解。根据不同的反应时间测出 酶水解所释放出的氨基酸种类和数量,从而 知道蛋白质的C-末端残基顺序。
B法水解得到三个小肽: B1 Ala-Phe-Gly-Lys B2 Asn-Tyr-Arg B3 Tyr- His-Val
9.确定原多肽链中二硫键的位置。
一般采用胃蛋白酶处理没有断开二硫 键的多肽链,(切点多,二硫键稳定)
再利用双向电泳技术分离出各个肽段, 用过甲酸处理后,将每个肽段进行组 成及顺序分析,
多肽链断裂法:酶解法和化学法
酶解法: 胰蛋白酶,糜蛋白酶,胃蛋白酶,嗜热菌蛋白 酶,羧肽酶和氨肽酶 化学法:可获得较大的肽段 溴化氰水解法,它能选择性地切割由甲硫氨酸 的羧基所形成的肽键。
2 蛋白质的结构与功能
但氢键的键能较低(~12kJ/mol),易被破坏。
蛋白质分子中氢键的形成源自2. 疏水键:非极性物质在含水的极性环境中存在时,会产生一种相
互聚集的力,这种力称为疏水键或疏水作用力
(hydrophobic interaction)。
蛋白质分子中的许多氨基酸残基侧链也是非极性的,这 些非极性的基团在水中也可相互聚集,形成疏水键,从 而在蛋白质分子内部形成疏水核心。如Leu,Ile,Val, Phe,Ala等的侧链基团。
• 例如毛发的纤维是由多个原纤维平行排列,并 由氢键和二硫键作为交联键聚集成不溶性的蛋 白质。 • -角蛋白的伸缩性能很好,当-角蛋白被过度 拉伸时,则氢键被破坏而不能复原。此时-角 蛋白转变成-折叠结构,称为-角蛋白。
角 蛋 白 分 子 中 的 二 硫 键
•角蛋白富含半胱氨酸,不溶性、抗伸展
象角。
α-碳原子
非键合原子 接触半径
侧链
Φ=1800,ψ=1800
完全伸展的肽主链构象
Φ=00,ψ=00的多肽主链构象
• 然而 和 同时等于0°时的构象实际上并不能存在, 因为两个相邻平面上的酰胺基H原子和羰基O原子的 接触距离比其范德华半径之和小,因此将发生空间重 叠(steric overlap)。这样的构象是立体化学所不允许的 。 • 二面角(, )所决定的构象否存在,主要取决于两个 相邻肽单位中,非键合原子之间的接近有无阻碍。
3. 离子键: 离子键(salt bond)是由带正电荷基团与带负电 荷基团之间相互吸引而形成的化学键。 在近中性环境中,蛋白质分子中的酸性氨基酸 残基侧链电离后带负电荷,而碱性氨基酸残基 侧链电离后带正电荷,二者之间可形成离子键。
蛋白质分子中离子键的形成
4.范德华力(vander Waals forces): 两个相邻的不带电荷的原子之间存在的相 互作用力。 是一种比较弱的、非特异性的作用力。 主要在蛋白质的三级结构的形成中发挥作
专业课生物化学蛋白质2-一级结构

第二节(一) 蛋白质测序的策略
测 确定aa残基的数 目或分子比,如: 测 定 完全水解 H残基2个,O残 拆断 定 多 基3个等 A法裂解+测序 裂 分 多 肽 确定中间次序 HOW+THO+OU+SER+LA 二 HOWTHOOUSERLA 多 肽 链 HO+WT+HOO+USE+RLA B法裂解+测序 肽硫 链 链 键 组 分析N末端和C末端 N末端为H, C末端为A 数 成 目 使多肽链完全打开 aa
偶联
环化断裂
ATZ(不稳定中间产物)
转化
此方法还可以用来测 定氨基酸顺序。
N末端分析(四)
氨肽酶法 方法:
氨肽酶是肽链外切酶(外肽酶),能从多肽链的N端 逐个地向里切。根据不同的反应时间测出酶水解所释放 的氨基酸种类和数量,按反应时间和残基释放量作动力 学曲线,就能知道该蛋白质的N末端残基顺序。 缺点:
•主要的化学键
肽键,二硫键
一级结构是蛋白质空间构象和特异生 物学功能的基础。
肽链间/内的连接——二硫键:
-OOC-CH-CH
+NH 3
-SH + HS-CH2-CH-COO2
-HH
+NH 3
-OOC-CH-CH
+NH 3
-S S-CH2-CH-COO2
+NH 3
二硫键
胱氨酸
二硫键的连接种类有多 种。可以稳定肽链空间 结构;赋予肽链一定生 物活力。
胰岛素全合成: 带保护基的21肽和30肽衍生物分别用Na-液NH3处 理后,用连四硫酸钠和亚硫酸钠进行S-磺酸化,经初步 提纯后得到21肽和30肽的SS03- 衍生物。A链和B链按1.2: 1.0混合,以巯基乙酸还原,然后在空气中氧化。
蛋白质的结构与功能(5)

二、蛋白质的一级结构
蛋白质多肽链中氨基酸残基的组成及其排列顺序称为蛋白质的 一级结构(primary structure)。从化学本质上讲,是指蛋白质中 氨基酸间的共价连接与顺序。各种蛋白质所含氨基酸的数目不同、 氨基酸的组成和各种氨基酸的比例也不相同,所以生物界中各种蛋 白质的一级结构是千差万别的。蛋白质的一级结构是由遗传基因决 定的,不同的生物有不同的基因组成,编码各自的蛋白质,表现出 的生物性状和功能是不相同的。从生物进化的角度看,所有的生物 都是同源的。所以,存在于不同种类生物体内的同种蛋白质其一级 结构必然存在相似之处.而且生物的亲缘关系越近,其蛋白质一级 结构就越相似。例如,从单细胞真核生物酵母到植物、低等动物、 高等动物乃至人类,都存在一种在体内起电子传递构作比较, 在所有的氨基酸残基中只有35个是相目的。而人与猴的比较,两者 仅差1个氨基酸残基。
与异硫氰酸苯酯反应 氨基酸中的α-氨基可以 与异硫氰酸苯酯(PITC)反应,
产生相应的苯氨基硫甲酰氨基酸(简称PTC-氨基 酸),在无水酸中,PTC-氨基酸环化变为苯硫乙 内酰脲(简称PTH)。
蛋白质多肽链N-末端氨基酸的α-氨基也可与PITC 起上述反应,生成PTC-蛋白质,经酸液部分水解, 释放出末端的PTH氨基酸和比原来少了一个
•以胰岛素为例说明蛋白质一级结构。胰岛
素是第一个被阐明一级结构的蛋白质,是 1953年被Sanger提出,并因此于1958年被授 予获诺贝尔奖,牛胰岛素是我国科学家1965 年完成的第一个人工合成天然蛋白质。它由 51个氨基酸组成,分子量5734,A和B两条肽 链通过两对二硫键连接起来, A链中有21个 氨基酸,B链中有30个氨基酸,A链本身6位 和11位上的两个半胱氨酸通过二硫键相连形 成链内小环。牛胰岛素的一级结构如下:
第二节蛋白质的组成、分类与结构简介

课本第 113 页
12
⑵ 多肽链
是指蛋白质分子的一级结构的基本结构形式。
肽链有两个游离的末端,分别称为氨基末端(或N 末端)和羧基末端(或C末端)。有些蛋白质分子的一级 结构是一条多肽链,有些蛋白质分子的一级结构是由两 条以上的肽链组成的,如胰凝乳蛋白酶、胰岛酶等。除 肽链连接之外,一级结构中还配置有二硫键。
课本第 113 页
13
二硫键:由两个半胱氨酸分子的巯基(-SH) 脱氢氧化形成的硫桥(-S-S-)。
它对稳定蛋白质分子的空间起着重要的作用。
14
胰岛素由51个氨基酸组成,分为A链+B链。
A链:由21个氨基酸组成;B链:由30个氨基酸 组成;A链和B链由2对-S-S-键连起来。
N-端
C-端
Ile-Gly S───────── S
21Asn
│
│
│
│
Val-Glu-Gln-Cys-Cys-Ala-Ser-Val-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys
5
│
10
15
│20
S
S
│
│
S
S
\
│
Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys
课本第 112 页
7
2)结合蛋白质
由单纯蛋白质与耐热的非蛋白质物质结合而成。其非蛋白质部分称为辅基。 对结合蛋白质则根据辅基成分分成若干小类。
1.脂蛋白:为油脂与蛋白质结合的复合物,具有极性的乳化能力,存在于牛乳和蛋 黄中。与蛋白质结合的油脂有甘油三脂、磷脂、胆固醇及其衍生物。有些蛋白质如视 紫红蛋白能与细胞的生物膜相结合,与生物膜的脂双层结合的部分为富含疏水氨基酸 的肽段,它们呈α一螺旋结构,这类蛋白质称为膜蛋白。2.糖蛋白:糖蛋白是碳水 化合物与蛋白质结合的复合物。这些碳水化合物是氨基葡萄糖、氨基半乳糖、半乳糖、 甘露糖、海藻糖等中的一种或多种,与蛋白质间的共价键或羟基生成配糖体。糖蛋白 可溶于碱性溶液。哺乳动物的物的粘性分泌物、血浆蛋白、卵粘蛋白及大豆某些部位 中之蛋白质都属于糖蛋白。3.核蛋白:由核酸与蛋白质结合而成的复合物。存在细 胞核及核糖体中。4.磷蛋白:为许多主要食物中一种很重要的蛋白质。磷酸基团是 与丝氨酸或苏氨酸中的羟基结合,如牛乳中的酪蛋白和鸡蛋黄中的磷蛋白即是。 5.色蛋白:为蛋白质与有色辅基结合而成的复合物,后者多为金属。色蛋白有许多 种,如血红蛋白、肌红蛋白、叶绿素蛋白及黄素蛋白等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ala-Tyr-AspGly
N端
N C
C端
N末 端
C末端
牛核糖核酸酶
(四).肽的理化性质:
1.旋光性 一般短肽的旋光度等于其各个氨基酸的 旋光度的总和。 2.酸碱性质 偶极离子形式存在。 pH0―14范围内,肽键中的亚氨基不解离 酸碱性质主要取决于: N:α-NH2 C:α-COOH 侧链R上可解离的基团。 肽末端α-羧基pKa值比游离AA中的大。 肽末端α-氨基pKa值比游离AA中的小。
3、蛋白质的形状
Collagen 纤维状蛋白质
Myoglobin 球状蛋白质
Bacteriorhodopsin 膜结合蛋白质
4、蛋白质的大小
蛋白质与多肽并无严格的界线,通常是将分子 量在6000道尔顿以上的多肽称为蛋白质。
蛋白质分子量变化范围很大, 从大约6000到
1000000道尔顿甚至更大。
% % % % %
有些蛋白质还含有少量的 P 、 Fe 、 Cu 、 Mn 、 Zn 、 Se、I等。
蛋白质元素组成的特点
各种蛋白质的含氮量很接近,平均为16%。 凯氏定氮法:
由于体内的含氮物质以蛋白质为主,因此,只要 测定生物样品中的含氮量,就可以根据以下公式推算出
蛋白质的大致含量:
100克样品中蛋白质的含量 ( g % )
C和Y。羧肽酶A能释放除Pro、Arg和Lys之外的任
何一种C末端氨基酸;羧肽酶 B只能水解以碱性氨
基酸 Arg 和 Lys 为 C末端的氨基酸;羧肽酶 C和 Y可
以释放任何一种C末端氨基酸。
…… -Val-Ser-Gly
(四)二硫桥的断裂
还原法断裂二硫桥
蛋 白 质 一 级 结 构 的 测 定
4、测定每条多肽 链的氨基酸组成, 并计算出氨基酸 成分的分子比; 氨基酸自动分析仪和 肽链氨基酸顺序自动 测定仪,对蛋白质多 肽氨基酸排列顺序的 测定提供了极大的方 便。
(三)N-末端和C-末端氨基酸残基的测定
1、N末端分析
二硝基氟苯法( DNFB 法):用 DNFB ( Sanger 试剂)与肽链N末端的氨基反应,生成DNP-多肽 或 DNP -蛋白质。然后水解肽链,分离得到 DNP
分布广:所有器官、组织都含有蛋白质;细胞的各个 部分都含有蛋白质。
含量高:蛋白质是细胞内最丰富的有机分子,占人体
干重的45%,某些组织含量更高,例如脾、肺及横纹
肌等高达80%。
大事记:
1833年 1864年 Payen和Persoz分离出淀粉酶。 Hoppe-Seyler从血液分离出血红蛋白, 并将其制成结晶。 19 世纪末 Fischer 证明蛋白质是由氨基酸组成 的,并将氨基酸合成了多种短肽 。 1938年 德国化学家Gerardus J. Mulder引用 “Protein” 一词来描述蛋白质。
一条肽链是有方向性的,肽链的一端具有游 离的α-氨基,称其为 N 端;另一端具有游离的α -羧基,称其为 C 端。有少数小分子量的肽,其首 尾也缩合成肽键,成为环肽。 对于生物体内的具有特定结构和功能的小分
子量肽,还有特别名称,如脑啡肽、内啡肽、催产
素、加压素等。
多肽链有方向性:
N 末端:多肽链中有自由氨基的一端 C 末端:多肽链中有自由羧基的一端
如血红蛋白、免疫球蛋白等
简 单
• 清蛋白和球蛋白 albumin and globulin 广泛存在于动物组织 • 谷蛋白和醇溶谷蛋白 glutelin and prolamin 植物蛋白,不溶于水,易溶于稀酸/碱 • 精蛋白和组蛋白 碱性蛋白存在于细胞核 • 硬蛋白
蛋 白
结 合 蛋 白
• 色蛋白:简单蛋白+色素物质 • 糖蛋白:简单蛋白+糖类物质 • 脂蛋白:简单蛋白+脂类结合 • 核蛋白:简单蛋白+核酸
第二节 蛋白质的共价结构
(Covalent structure of protein)
一、蛋白质通论 二、肽 三、蛋白质一级结构的测定 四、蛋白质的氨基酸序列与生物功能 五、肽和蛋白质的人工合成
一、蛋白质通论
• Protein —— 来自希腊字母,意思是“头等重要的,原始的” 蛋白质 —— 来源于对蛋清(清蛋白)的研究
二、肽
(一)肽(peptide)的定义 肽是由氨基酸通过肽键缩合而形成的化合物。
(二)肽键的结构
• 肽键 (peptide bond) :是由一个氨基酸的 - 羧 基与另一个氨基酸的 - 氨基脱水缩合而形成的 化学键,本质为酰胺键。 • 氨基酸残基(residue) :肽链中的氨基酸分子因 为脱水缩合而基团不全,被称为氨基酸残基。
蛋 白 质 (protein) 是 由 许 多 氨 基 酸 (amino acids) 通过肽键 (peptide bond) 相连形成的高分 子含氮化合物。
(二)蛋白质的化学组成和分类
1、化学组成: 主 要 元 素 组 成
C H O N S
50 ~ 55 6~ 7 19 ~ 24 13 ~ 19 0~4
(二) 蛋白质具有重要的生物学功能
Hale Waihona Puke 1)酶的生物催化作用2)调控作用
参与基因调控:组蛋白、非组蛋白等 参与代谢调控:如激素或生长因子等
3)运动与支持
机体的结构蛋白:头发、骨骼、牙齿、肌肉等
4)参与运输贮存的作用
血红蛋白 ——运输氧 铜蓝蛋白 ——运输铜 铁蛋白 ——贮存铁
5)免疫保护作用
抗原抗体反应 凝血机制
• 2、测定蛋白质分子中多肽链的数目。 蛋 通过测定末端氨基酸残基的摩尔数与蛋 白 • 质 白质分子量之间的关系,即可确定多肽链的 一 级 数目。 结 构 的 测 定
3、二硫键的断裂
蛋 • 几条多肽链通过二硫键交联在一起。可 白 在可用 8mol/L 尿素或 6mol/L 盐酸胍存在下, 质 一 用过量的 - 巯基乙醇处理,使二硫键还原为 级 结 巯基,然后用烷基化试剂保护生成的巯基, 构 的 以防止它重新被氧化。 测 定
GSH 有抗氧化剂的作用,可还原细胞内产生 的过氧化氢。
H 2 O2
2GSH
GSH过氧 化物酶
NADP+ GSH还原酶 NADPH+H+
2H2O
GSSG
谷胱甘肽的生理功用:
解毒作用; 参与氧化还原反应; 保护巯基酶的活性; 抗氧化剂作用,维持红细胞膜的稳定。
2. 多肽类激素及神经肽
• 体内许多激素属寡肽或多肽
O NH2-CH-C H
甘氨酸
+
OH
O NH-CH-C H
甘氨酸
H
OH
-HOH
O O NH2-CH-C-N-CH-C H HH OH
甘氨酰甘氨酸
肽键
蛋白质氨基酸残基数的估计
组成蛋白质的氨基酸的平均分子量为128, 每个氨基酸残基的平均分子量为110; 对于简单蛋白质,用 110除它的相对分子量 即可约略估计出其氨基酸残基数目。
1951年
Pauling采用X(射)线晶体衍射发现了蛋白
质的二级结构——α-螺旋(α-helix)。
1953年
1962年
Frederick Sanger完成胰岛素一级序列测定。
John Kendrew 和 Max Perutz确定了血红蛋
白的四级结构。
20世纪90年代以后 后基因组计划。
(一)什么是蛋白质?
计算题:
• 一 种 蛋 白 质 按 其 重 量 含 有 1.65% 亮 氨 酸 和
2.48% 异亮氨酸,计算该蛋白质最低分子量。
(注:两种氨基酸的分子量都是131Da)。
肽 键
O C N O C C N H C O
-
C
N
+
•
肽键的特点是氮原子上的孤对 电子与羰基具有明显的共轭作用。 • 组成肽键的原子处于同一平 面——酰胺平面。 • 肽键中的 C-N 键具有部分双键 性质,不能自由旋转。 • 在大多数情况下,以反式结构 存在。
= 每克样品含氮克数× 6.25×100 1/16%
2、蛋白质的分类
* 根据蛋白质组成成分 单纯蛋白质:如:血清清蛋白 结合蛋白质 = 蛋白质部分 + 非蛋白质部分
如:糖蛋白、脂蛋白、磷蛋白、金属蛋白等
* 根据蛋白质形状 纤维状蛋白质:多为结构蛋白,难溶于水,
如丝心蛋白等
球状蛋白质:多数具有生理活性,多数可溶 膜蛋白
2、诊断遗传病、合成基因探针等高新技术的 研究具有重要意义。
蛋白质氨基酸顺序的测定是蛋白质化 学研究的基础。自从1953年F.Sanger测定 了胰岛素的一级结构以来,现在已经有上 千种不同蛋白质的一级结构被测定。
(一)蛋白质测序的要求
1,样品必需纯(>97%以上); 2,知道蛋白质的分子量; 3,知道蛋白质由几个亚基组成; 4,测定蛋白质的氨基酸组成;并根据分子量计 算每种氨基酸的个数。
5,测定水解液中的氨量,计算酰胺的含量。
(二)测定步骤
• 1、多肽链的拆分。 蛋 • 由多条多肽链组成的蛋白质分子,必须先进 白 行拆分。 质 一 级 结 构 的 测 定
• 1、多肽链的拆分。
蛋 白 • 几条多肽链借助非共价键连接在一起, 质 称为寡聚蛋白质,如血红蛋白为四聚体,烯 一 级 醇化酶为二聚体;可用 8mol/L 尿素或 6mol/L 结 构 盐酸胍处理,即可分开多肽链(亚基). 的 测 定
3.肽的化学反应
肽的α— 羧基,α— 氨基和侧链 R 基上的活性
基团都能发生与游离氨基酸相似的反应。
肽的化学反应和氨基酸的一致, N 端的氨基酸
残基可以与茚三酮反应。
双缩脲反应是肽和蛋白质特有的,氨基酸没有
此反应。
(五) 几种生物活性肽
活性肽(active peptide): 生物体内存在大量的多肽和寡肽有很强的生物活 性,称活性肽。 1. 谷胱甘肽(glutathione, GSH)
