硝化与硝化反应
同步硝化反硝化

同步硝化反硝化的出路,究竟在何方?古语云:殊途同归。
对于污水脱氮来说,亦是如此。
处理方法并不是只有一种。
方法一:依照传统生物脱氮理论,在脱氮过程中需要经过硝化和反硝化两个过程,最终将氨氮转化为氮气而解决污水处理脱氮问题。
生物脱氮原理如下:硝化作用是在亚硝酸菌作用下将氨氮转化为NO2-N,然后硝酸菌将NO2-N转化为NO3-N。
反硝化作用是指在厌氧或缺氧情况下将NO3-N转化为NO2-N,并最终将NO2-N转化为N2。
方法二:然而,近年来,国内外的不少研究和报告证明存在着同步硝化反硝化现象。
同步硝化反硝化又称短程硝化反硝化。
是指在同一反应器内同步进行硝化反应和反硝化反应。
这样的反应中,反硝化可以直接利用硝化作用转化的NO2-N进行反应,而不必将氨氮转化为NO3-N,可以减少能源的消耗,以及对氧的需求。
条条道路通罗马,那么总有一条是最合适的吧?那么,相对于传统脱氮反应来说,同步硝化反硝化又具有什么样的优势呢?根据化学计量学统计,与传统硝化反硝化脱氮反应相比,同步硝化反硝化具有以下优势:1.在硝化阶段可以减少25%左右的需氧量,减少对曝气的需求,就是减少能耗;2.在反硝化阶段减少了40%的有机碳源,降低了运行费用;3.NO2-N的反硝化速率比NO3-N的反硝化速率高63%左右;4.减少50%左右污泥;5.反应器容积可以减少30%-40%左右;6.反硝化产生的OH-可以原地中合硝化作用产生的H+,能有效保持反应容器内的PH。
(以上数据出自论文:《同步硝化反硝化脱氮机理分析及影响因素研究》)既然有这么多的优势,那么为什么同步硝化反硝化工艺一直没能得到推广呢?这个,就要用一句古语来解释了:祸兮,福之所倚,福兮,祸之所伏。
也就是说,有利就有弊。
同步硝化反硝化工艺进入人们的视线以来,科学家以及相关的研究人员在上面倾注了大量的精力进行研究,对影响同步硝化反硝化反应的因素有了详细的了解。
同步硝化反硝化的影响因素总结如下:1.溶解氧(DO)控制系统中溶解氧,对获得高效的同步硝化反硝化具有极其重要的意义。
硝化反应和反硝化反应

硝化反应和反硝化反应 Prepared on 22 November 2020一、硝化反应在好氧条件下,通过亚硝酸盐菌和硝酸盐菌的作用,将氨氮氧化成亚硝酸盐氮和硝酸盐氮的过程,称为生物硝化作用。
硝化反应包括亚硝化和硝化两个步骤:NH4+++H2O+2H+NO2-+硝化反应总方程式:NH3++若不考虑硝化过程硝化菌的增殖,其反应式可简化为NH4++2O2NO3-+H2O+2H+从以上反应可知:1)1gNH4+-N氧化为NO3-需要消耗2*50/14=碱(以CaCO3计)2)将1gNH4+-N氧化为NO2--N需要,氧化1gNO2--N需要,所以氧化1gNH4+-N需要。
硝化细菌所需的环境条件主要包括以下几方面:a.DO:DO应保持在2-3mg/L。
当溶解氧的浓度低于L时,硝化反应过程将受到限制。
b.PH和碱度:,其中亚硝化菌,硝化菌。
最适合PH为。
碱度维持在70mg/L以上。
碱度不够时,应补充碱c.温度:亚硝酸菌最佳生长温度为35℃,硝酸菌的最佳生长温度为35~42℃。
15℃以下时,硝化反应速度急剧下降;5℃时完全停止。
d.污泥龄:硝化菌的增殖速度很小,其最大比生长速率为~(温度20℃,~。
为了维持池内一定量的硝化菌群,污泥停留时间必须大于硝化菌的最小世代时间。
对于实际应用中,活性污泥法脱氮,污泥龄一般11~23d。
e.污泥负荷:负荷不应过高,负荷宜。
因为硝化菌是自养菌,有机物浓度高,将使异养菌成为优势菌种。
总氮负荷应≤(m3硝化段·d),当负荷>(m3硝化段·d)时,硝化效率急剧下降。
f.C/N:BOD/TKN应<3,比值越小,硝化菌所占比例越大。
g.抑制物浓度:NH4+-N≤200mg/L,NO2--N10-150mg/L,L。
h.ORP:好氧段ORP值一般在+180mV左右。
二、反硝化反应在缺氧条件下,由于兼性脱氮菌(反硝化菌)的作用,将NO2--N和NO3--N还原成N2的过程,称为反硝化。
硝化-反硝化-碱度-DO与pH值关系

硝化系统与pH值关系(2007-05-19 22:51:41)分类:七彩水质专题发生硝化反应,那么必须控制污泥龄大于硝化细菌的世代时间方可。
按照污水处理的理论,硝化细菌世代周期5~8天,反硝化细菌世代周期15天左右。
碱度是为硝化细菌提供生长所需营养物质,氧化1mg NH4-N需要碱度7.14 mg。
硝化过程只有在污泥负荷<0.15kgBOD/(kgSS·d)时才会发生。
在反应过程中氧化1kg氨氮约消耗4.6kg氧,同时消耗约7.14kg碳酸钙碱度。
为保证硝化作用的彻底进行,一般来说出水中应有剩余碱度。
合适的pH是微生物发挥最佳活性必须的,一般微生物要在pH6-9范围内比较合适。
实际上,因为水质的差异,相同pH的水,碱度可以相差很多。
对于A/O工艺。
其中硝化液回流进行反硝化,这样可以利用原污水中的有机物做为反硝化的电子供体,同时可提供部分碱度,抵消硝化段的部分碱度消耗。
该工艺脱氮率的提高要靠增加回流比实现,但回流比不宜太高,否则回流混合液中夹带的DO会影响到反硝化段的缺氧状态,另外回流比增大,运行费用也会增加。
水的碱度是指水中含有能接受氢离子的物质的量,例如氢氧根,碳酸盐,重碳酸盐,磷酸盐,磷酸氢盐,硅酸盐,硅酸氢盐,亚硫酸盐,腐植酸盐和氨等,都是水中常见的碱性物质,它们都能与酸进行反应。
因此,选用适宜的指示剂,以酸的标准溶液对它们进行滴定,便可测出水中碱度的含量.。
碱度可分为酚酞碱度和全碱度两种。
酚酞碱度是以酚酞作指示剂时所测出的量,其终点的pH值为8.3;全碱度是以甲基橙作指示剂时测出的量,终点的pH值为4.2.若碱度很小时,全碱度宜以甲基红-亚甲基蓝作指示剂,终点的pH值为5.0。
碱度以CaCO3(碳酸钙)浓度表示,单位为mg/l。
PH的值是H离子浓度的体现,当PH=7是,说明H离子浓度为10的-7次幂,所以OH离子的浓度也是10的-7次幂,为中型,当PH=8时,H离子浓度为10的-8次幂,OH离子浓度是10的-6次幂,这都是H离子的浓度小于1mol/L时的计算方法,当H离子浓度大于1时,就不用了。
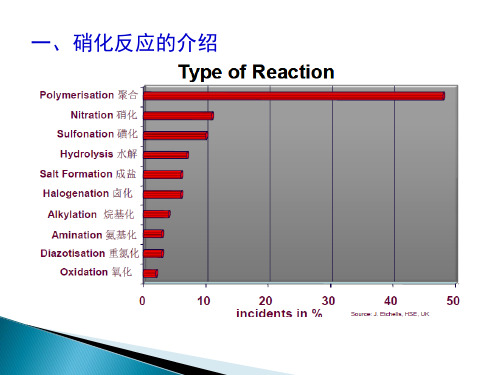
硝化、氟化、氯化、过氧化、重氮化知识整理

根据安监总管三〔2009〕116号对硝化、氟化、氯化、过氧化、重氮化的整理1.硝化反应:)的反应,最常见硝化工艺简介:硝化是有机化合物分子中引入硝基(-NO2的是取代反应。
硝化方法可分成直接硝化法、间接硝化法和亚硝化法,分别用于生产硝基化合物、硝胺、硝酸酯和亚硝基化合物等。
涉及硝化反应的工艺过程为硝化工艺。
反应类型为放热反应;工艺危险特点:(1)反应速度快,放热量大。
大多数硝化反应是在非均相中进行的,反应组分的不均匀分布容易引起局部过热导致危险。
尤其在硝化反应开始阶段,停止搅拌或由于搅拌叶片脱落等造成搅拌失效是非常危险的,一旦搅拌再次开动,就会突然引发局部激烈反应,瞬间释放大量的热量,引起爆炸事故;(2)反应物料具有燃爆危险性;(3)硝化剂具有强腐蚀性、强氧化性,与油脂、有机化合物(尤其是不饱和有机化合物)接触能引起燃烧或爆炸;(4)硝化产物、副产物具有爆炸危险性。
重点监控工艺参数:硝化反应釜内温度、搅拌速率;硝化剂流量;冷却水流量;pH值;硝化产物中杂质含量;精馏分离系统温度;塔釜杂质含量等。
安全控制的基本要求:反应釜温度的报警和联锁;自动进料控制和联锁;紧急冷却系统;搅拌的稳定控制和联锁系统;分离系统温度控制与联锁;塔釜杂质监控系统;安全泄放系统等。
宜采用的控制方式:将硝化反应釜内温度与釜内搅拌、硝化剂流量、硝化反应釜夹套冷却水进水阀形成联锁关系,在硝化反应釜处设立紧急停车系统,当硝化反应釜内温度超标或搅拌系统发生故障,能自动报警并自动停止加料。
分离系统温度与加热、冷却形成联锁,温度超标时,能停止加热并紧急冷却。
硝化反应系统应设有泄爆管和紧急排放系统。
2.氟化工艺氟化工艺工艺简介:氟化是化合物的分子中引入氟原子的反应,涉及氟化反应的工艺过程为氟化工艺。
氟与有机化合物作用是强放热反应,放出大量的热可使反应物分子结构遭到破坏,甚至着火爆炸。
氟化剂通常为氟气、卤族氟化物、惰性元素氟化物、高价金属氟化物、氟化氢、氟化钾等。
污水处理中的硝化与反硝化过程

污水处理厂的硝化与反硝化应用
污水处理厂是硝化与反硝化过程的重要应用场所,通过硝化反应将有机 氮转化为硝酸盐,再通过反硝化反应将硝酸盐转化为氮气,从而达到去 除氮污染物的目的。
硝化反应通常在好氧条件下进行,由硝化细菌将氨氮氧化成硝酸盐;反 硝化反应则在缺氧条件下进行,由反硝化细菌将硝酸盐还原成氮气。
THANKS
THANK YOU FOR YOUR WATCHING
硝化反应的微生物学基础
硝化细菌是一类好氧性细菌,能够将氨氮氧化成硝酸盐。
硝化细菌主要包括亚硝化Байду номын сангаас菌和硝化细菌两类,分别负责亚硝化和硝化两个阶段 。
硝化反应的影响因素
溶解氧
硝化反应是好氧反应,充足的溶解氧是保证硝化 反应顺利进行的关键。
pH值
硝化细菌适宜的pH值范围为7.5-8.5。
ABCD
温度
硝化细菌对温度较为敏感,适宜的温度范围为 20-30℃。
应对气候变化
资源回收利用
探索污水处理过程中资源的回收利用,如能源、肥 料等,提高污水处理的经济效益和社会效益。
随着气候变化加剧,污水处理系统需应对极 端天气和自然灾害的挑战,保障硝化与反硝 化过程的稳定运行。
国际合作与交流
加强国际合作与交流,引进先进技术与管理 经验,推动硝化与反硝化技术的创新发展。
害。
城市污水处理中的硝化与反硝化应用
城市污水中的氮污染物主要来源于生活污水和部分工业废水,硝化与反硝化过程在 城市污水处理中具有重要作用。
城市污水处理厂通常采用生物反应器进行硝化与反硝化反应,通过合理控制反应条 件,提高脱氮效率。
城市污水处理中的硝化与反硝化应用可以有效降低水体中氮污染物含量,改善城市 水环境质量。
精细化工 第五章 硝化反应

1
5.1 5.2 5.3 5.4 5.5 5.6 5.7 5.8 5.9
概述 硝化反应历程 混酸硝化 硫酸介质中的硝化 有机溶剂-混酸硝化 在乙酐或乙酸中的硝化 稀硝酸硝化 臵换硝化 亚硝化
2
5.1
概述
一、定义
向有机物分子的碳原子上引入硝基生成C-NO2键的反 应称硝化反应。 Ar-H + HO-NO2 →Ar-NO2 + H2O 硝化反应是最普遍,最早的有机反应之一1834年 在脂肪族碳原子上的硝化反应,因难于控制,工业 上很少应用。芳族硝化反应像磺化反应一样是非常 重要的一类化学过程,其应用十分广泛。
21
例如:在采用多锅串联法对甲苯进行混酸 硝化时在第一硝化锅中,酸相中的硝酸浓 度较大,硫酸浓度也较高,反应受传质控 制。
而在第二锅中,由于酸度降低和硝酸含量 减少,反应速率将转变为受动力学控制, 即受化学反应速度控制。
22
二、混酸的硝化能力 对于每个具体硝化过程用的混酸都要求具有适当的 硝化能力。 硝化能力太强,虽然反应快,但容易产生多硝化副 反应; 硝化能力太弱,反应缓慢,甚至硝化不完全。 工业上通常利用硫酸脱水值(D.V.S)和废酸计算浓 度(F.N.A)来表示混酸的硝化能力。 混酸的硝化能力,只适用于混酸硝化,不适用于在 浓硫酸介质中的硝化。
时所用的硝酸约过量10~65%。
5、臵换硝化
11
5.2
硝化反应历程
一、硝化剂的活性质点
已经证实,多数硝化剂参加硝化反应的活性质点 为硝基阳离子。
HNO3 2H2 SO4 NO2 H3O 2HSO4
硝化反应和反硝化反应

一、硝化反应在好氧条件下,通过亚硝酸盐菌和硝酸盐菌的作用,将氨氮氧化成亚硝酸盐氮和硝酸盐氮的过程,称为生物硝化作用。
硝化反应包括亚硝化和硝化两个步骤:NH4++1.5O2NO2-+H2O+2H+NO2-+0.5O2NO3-硝化反应总方程式:NH3+1.86O2+1.98HCO3-0.02C5H7NO2+1.04H2O+0.98NO3--+1.88H2CO3若不考虑硝化过程硝化菌的增殖,其反应式可简化为NH4++2O2NO3-+H2O+2H+从以上反应可知:1)1gNH4+-N氧化为NO3-需要消耗2*50/14=7.14g碱(以CaCO3计)2)将1gNH4+-N氧化为NO2--N需要3.43gO2,氧化1gNO2--N需要1.14gO2,所以氧化1gNH4+-N需要4.57gO2。
硝化细菌所需的环境条件主要包括以下几方面:a.DO:DO应保持在2-3mg/L。
当溶解氧的浓度低于0.5mg/L时,硝化反应过程将受到限制。
b.PH和碱度:PH7.0-8.0,其中亚硝化菌6.0-7.5,硝化菌7.0-8.5。
最适合PH为8.0-8.4。
碱度维持在70mg/L以上。
碱度不够时,应补充碱c.温度:亚硝酸菌最佳生长温度为35℃,硝酸菌的最佳生长温度为35~42℃。
15℃以下时,硝化反应速度急剧下降;5℃时完全停止。
d.污泥龄:硝化菌的增殖速度很小,其最大比生长速率为0.3~0.5d-1(温度20℃,pH8.0~8.4)。
为了维持池内一定量的硝化菌群,污泥停留时间必须大于硝化菌的最小世代时间。
对于实际应用中,活性污泥法脱氮,污泥龄一般11~23d。
e.污泥负荷:负荷不应过高,负荷宜0.05-0.15kgBOD/(kgMLSS·d)。
因为硝化菌是自养菌,有机物浓度高,将使异养菌成为优势菌种。
总氮负荷应≤0.35kgTN/(m3硝化段·d),当负荷>0.43kg/(m3硝化段·d)时,硝化效率急剧下降。
同步硝化反硝化和短程硝化反硝化

同步硝化反硝化和短程硝化反硝化随着人类对环境保护意识的提高,对水体生态系统的关注愈发增加。
其中,氮循环作为生态环境中的重要一环,也备受关注。
在氮循环中,“同步硝化反硝化”和“短程硝化反硝化”是两个重要的过程,对于水体的氮素转化和利用具有重要的作用。
以下将从深度和广度的角度进行全面评估,以便更好地了解这两个过程。
1. 同步硝化反硝化的概念同步硝化反硝化是指在同一微生物体内,氨氮直接转化为硝酸盐,然后直接再被还原为氮气的过程。
这一过程通常由单一微生物完成,也被称为全硝化或类全硝化反应。
在自然界中,同步硝化反硝化主要由厌氧异养细菌完成,这些细菌具有很强的氨氧化和硝化能力,能够将氨氮快速氧化为亚硝酸盐,然后在厌氧条件下迅速还原为氮气,从而将氨氮转化为无害的氮气释放到大气中。
2. 短程硝化反硝化的概念短程硝化反硝化指的是在很短的时间和空间内,氨氮被氧化为硝酸盐然后迅速还原为氮气的过程。
这一过程通常发生在水体底泥或水体微缝隙中,因此被称为短程硝化反硝化。
在水体中,短程硝化反硝化通常由微生物和底泥中的细菌完成,底泥中的微生物可以迅速氧化水体中的氨氮为硝酸盐,然后水体中的细菌则可以迅速还原硝酸盐为氮气,从而在水体中形成短程硝化反硝化过程。
3. 两者的联系和区别同步硝化反硝化和短程硝化反硝化虽然是两种不同的氮素转化过程,但它们之间也存在着联系和区别。
联系在于,两者都是对氨氮进行氧化和还原的过程,最终都将氨氮转化为无害的氮气释放到大气中。
而区别在于,同步硝化反硝化主要发生在水体中的微生物体内,而短程硝化反硝化则主要发生在水体底泥和微缝隙中,两者的位置和速率都存在较大差异。
在我们对同步硝化反硝化和短程硝化反硝化进行全面评估之后,可以发现两者在氮素转化和利用过程中都起着非常重要的作用,对于维护水体生态系统的健康具有重要意义。
总结回顾:通过全面的评估和深入的探讨,我们对同步硝化反硝化和短程硝化反硝化有了更深入的理解。
也了解到两者在水体氮素转化中的重要性和作用。
污水处理技术之关于硝化反硝化的碳源、碱度的计算

污水处理技术之关于硝化反硝化的碳源、碱度的计算一、硝化细菌硝化反应过程:在有氧条件下,氨氮被硝化细菌所氧化成为亚硝酸盐和硝酸盐。
他包括两个基本反应步骤:由亚硝酸菌(N i t r o s o m o n a s s p)参与将氨氮转化为亚硝酸盐的反应;硝酸菌(N i t ro b a c t e r s p)参与的将亚硝酸盐转化为硝酸盐的反应,亚硝酸菌和硝酸菌都是化能自养菌,它们利用C O2、C O32-、H C O3-等做为碳源,通过N H3、N H4+、或N O2-的氧化还原反应获得能量。
硝化反应过程需要在好氧(A e ro bi c或O x i c)条件下进行,并以氧做为电子受体,氮元素做为电子供体。
其相应的反应式为:亚硝化反应方程式:55N H4++76O2+109H C O3→C5H7O2N﹢54N O2-+57H2O+104H2C O3硝化反应方程式:400N O2-+195O2+N H4-+4H2C O3+H C O3-→C5H7O2N+400N O3-+3H2O硝化过程总反应式:N H4-+1.83O2+1.98H C O3→0.021C5H7O2N+0.98N O3-+1.04H2O+1.884H2C O3通过上述反应过程的物料衡算可知,在硝化反应过程中,将1克氨氮氧化为硝酸盐氮需好氧4.57克(其中亚硝化反应需耗氧3.43克,硝化反应耗氧量为1.14克),同时约需耗7.14克重碳酸盐(以C a C O3计)碱度。
在硝化反应过程中,氮元素的转化经历了以下几个过程:氨离子N H4-→羟胺N H2O H→硝酰基N O H→亚硝酸盐N O2-→硝酸盐N O3-。
二、反硝化细菌反硝化反应过程:在缺氧条件下,利用反硝化菌将亚硝酸盐和硝酸盐还原为氮气而从无水中逸出,从而达到除氮的目的。
反硝化是将硝化反应过程中产生的硝酸盐和亚硝酸盐还原成氮气的过程,反硝化菌是一类化能异养兼性缺氧型微生物。
当有分子态氧存在时,反硝化菌氧化分解有机物,利用分子氧作为最终电子受体,当无分子态氧存在时,反硝化细菌利用硝酸盐和亚硝酸盐中的N3+和N5+做为电子受体,O2-作为受氢体生成水和O H-碱度,有机物则作为碳源提供电子供体提供能量并得到氧化稳定,由此可知反硝化反应须在缺氧条件下进行。
第六章 硝化以及亚硝化

不同硝化剂对于乙酰苯胺一硝化产物的影响
硝化剂
温度/℃ 邻位% 间位% 对位% 邻位/对位
HNO3+H2SO4
20
19.4
2.1
78.5
0.25
90% HNO3
-20 23.5
-
76.5
0.31
80% HNO3
-20 40.7
-
59.3
0.69
HNO3 在醋酐中
20
67.8
6.3.3温度 硝化反应是一强的放热反应,温度上升太 快产生的影响: (1)产生多硝化、氧化、置换、断键等; (2)硝酸分解,产生NO2
硝化产物的分离
硝化异构产物的分离
5.亚硝化 反应历程,亚硝化剂,典型反应(酚、 胺类的亚硝化反应)
硝化反应中的相比是指
(1)硝酸和被硝化物的分子比; (2)混酸与被硝化物的重量比; (3)混酸和被硝化物的摩尔比; (4)混酸中硝酸与硫酸的分子比。 烷基苯或多烷基苯用混酸硝化时,若硝化条件不 适宜,硝化液会发黑变暗,其原因是:
CH3
O2N
NO2 O2N N N NO2
H2C
N
ON N
NO2
NO 2
H2C
N CH2 O2N CH2 N NO
N CH2
CH3 NO2
C(CH 3)3 NO2
2,4,6-三硝基甲苯 三亚甲基三硝胺 二亚硝基五次甲基四胺
(TNT)
(Hexogen)军用烈性炸药
(发泡剂)
人造麝香
3.工业硝化的方法
D.V
.S.
废酸含硫酸重 废酸含水重
=
混酸含硫酸重
混酸含水重 硝化生成水重
D.V.S.↑——→硝化能力↑
硝化反应与反硝化反应原理

硝化反应与反硝化反应原理硝化反应与反硝化反应是生态系统中氮循环的重要环节。
硝化反应是指将氨和铵离子转化为亚硝酸和硝酸盐的化学反应。
而反硝化反应则是将硝酸盐还原为气体态的氮,释放到大气中的化学反应。
这两种反应是氮循环在生态系统中不可或缺的环节。
硝化反应是由硝化细菌完成的。
首先,氨通过生物膜才可以进入到硝化细菌的细胞内。
目前已知的硝化细菌有两种:硝化氨氧化细菌和硝化亚硝酸氧化细菌。
前者将氨(NH3)氧化为亚硝酸(NO2-);后者将亚硝酸进一步氧化为硝酸盐(NO3-),这个过程是通过一种叫硝化酶的酶来完成的。
硝化反应在土壤和水田都会发生。
在农业生产中,土壤中增加化肥的使用,硝化反应对土壤肥力有着很大的影响。
因为硝酸盐在土壤中很容易被淋走,这会导致土壤中的氮元素流失。
此外,硝酸盐还会被植物吸收,但过多的吸收会导致植物生长,从而影响农作物的产量和质量。
反硝化反应是一个与生态系统中的微生物有关的过程,由一组还原细菌完成。
在气体态的氮缺乏的条件下,通过还原硝酸盐来释放氮气。
这种反应通常在水中或土壤中发生,微生物通过吸收和代谢硝酸盐、亚硝酸盐等物质来获得自主产生的能量,同时还可以还原硝酸盐为氮气,并释放到环境中。
反硝化反应在生态系统中,起到了重要的作用,它可以释放出大量的氮气,在一定程度上可以改善水体的气体浓度,使水体的呼吸更加顺畅。
同时,这个过程也会为氮的循环提供必要的不同形态的氮营养素。
综上所述,硝化反应与反硝化反应是生态系统中的重要过程。
硝化反应将氨或铵离子转化为亚硝酸和硝酸盐,反硝化反应则释放出大量的氮气。
它们促进了生态系统中氮循环的进行和维持生态平衡的重要作用。
第二章-硝化反应

SO3H
(三) 硝化试剂及性质
• 能生成NO2+的反应试剂。 能生成NO 的反应试剂。 • 98%(wt)发烟硝酸(常用) ( )发烟硝酸(常用) 对铝腐蚀小, 对铝腐蚀小,可用铝容 硝酸 器运输储备 • 65%(wt)浓硝酸 ( ) 应用最广泛 • 混酸 • 硝酸盐 过量硫酸 硝酸盐+过量硫酸 硝化能力相当于混酸 • 硝酸 乙酸或乙酐 硝酸+乙酸或 乙酸或乙酐
硝酸在乙酐中能任意溶解 适用于易被氧化或被混酸分解的芳烃硝化
(四)硝化方法
(1)稀硝酸酸化(<70% HNO3); 稀硝酸酸化(<70% (2)浓硝酸硝化; 浓硝酸硝化; ① 均相硝化 (3) 混硝酸硝化 ② 非均相硝化 (4)有机溶剂中硝化。 有机溶剂中硝化。 ( 5 )气相硝化法 )气相硝化法
NO 2
o/p 0.69 0.31 0.25 2.28
• 特殊硝化剂 (1)HNO3-H2SO4(H3PO4):增加p-位异构体收率。 :增加p 位异构体收率。 可良好控制硝化剂量, (2)NaNO3(KNO3)-H2SO4:可良好控制硝化剂量,减 可良好控制硝化剂量 少水的积累,用于苯甲醛、苯甲酸等的硝化。 少水的积累,用于苯甲醛、苯甲酸等的硝化。 (3)HNO3-(CH3CO)2O:无氧化性,与酚醚或N-酰芳 :无氧化性,与酚醚或N 胺反应,可提高o/p o/p。 胺反应,可提高o/p。 (4)RONO2:碱性条件的硝化剂。 碱性条件的硝化剂。 (5)SO3-HNO3; (6)NO2PF6,NO2BF4
• 废酸计算浓度(F.N.A.,废酸计算质量分数) 废酸计算浓度( ,废酸计算质量分数) 硝化终了时废酸中硫酸的质量百分数叫做 硝化终了时废酸中硫酸的质量百分数叫做 硫酸的质量百分数 废酸计算含量(质量分数), ),也叫做硝化活性 废酸计算含量(质量分数),也叫做硝化活性 因数(Factor of Nitrating Activity)。 因数( )。
硝化反应(精品)

硝化反应硝化反应(1)硝化及硝化产物在有机化合物分子中引人硝基(一 NO2)取代氢原子而生成硝基化合物的反应,称为硝化反应。
常用的硝化剂是浓硝酸或混合酸(浓硝酸和浓硫酸的混合物)。
如下的硝化过程是染料、炸药及某些药物生产的重要反应过程。
硝化过程中硝酸的浓度对反应温度有很大的影响。
硝化反应是强烈放热的反应,因此硝化需在降温条件下进行。
对于难硝化的物质以及制备多硝基物时,常用硝酸盐代替硝酸。
先将被硝化的物质溶于浓硫酸中,然后在搅拌下将某种硝酸盐(KNO3、NaNO、NH,NO「渐渐加人浓酸溶液中。
除此之外,氧化氮也可以做硝3化剂。
硝基化合物-般都具有爆炸危险性,特别是多硝基化合物,受热、摩擦或撞击都可能引起爆炸。
所用的原料甲苯、苯酚等都是易燃易爆物质。
硝化剂浓硫酸和浓硝酸所配制的混合酸具有强烈的氧化性和腐蚀性。
(2)混酸制备安全硝化多采用混酸,混酸中硫酸量与水量的比例应当计算(在进行浓硫酸稀释时,不可将水注人酸中,因为水的比重比浓硫酸轻,上层的水被溶解放出的热加热沸腾,引起四处飞溅,造成事故),混酸中硝酸量不应少于理论需要量,实际上稍稍过量1%~10%。
在制备混酸时,可用压缩空气进行搅拌,也可机械搅拌或用循环泵。
用压缩空气不如机械搅拌好,有时会带人水或油类,并且酸易被夹带出去,造成损失。
酸类混合中,放出大量热,温度可达到909C或更高。
在这个温度下,硝酸部分分解为二氧化氮和水,假若有部分硝基物生成,高温下可能引起爆炸。
所以必须进行冷却。
机械搅拌和循环搅拌可以起到一定的冷却作用。
由于制备好的混酸具有强烈的氧化性能,因此应防止和其他易燃物接触,避免因强烈氧化而引起自燃。
(3)硝化器搅拌式反应器是常用的硝化设备。
这种设备由锅体(或釜体)、搅拌器、传动装置、夹套和蛇管组成。
-般是间歇操作。
物料由.上部加入锅内,在搅拌条件下迅越地混合并进行硝化反应。
如果需要加热,可在夹套或蛇管内通入蒸汽;如果需要冷却,可通冷却水或冷冻剂。
硝化反应和反硝化反应

一、硝化反应在好氧条件下,通过亚硝酸盐菌和硝酸盐菌的作用,将氨氮氧化成亚硝酸盐氮和硝酸盐氮的过程,称为生物硝化作用。
硝化反应包括亚硝化和硝化两个步骤:NH4++1.5O2 NO2-+H2O+2H+NO2-+0.5O2NO3-硝化反应总方程式:NH3+1.86O2+1.98HCO3- 0.02C5H7NO2+1.04H2O+0.98NO3--+1.88H2CO3若不考虑硝化过程硝化菌的增殖,其反应式可简化为NH4++2O2 NO3-+H2O+2H+从以上反应可知:1)1gNH4+-N氧化为NO3- 需要消耗2*50/14=7.14g碱(以CaCO3计)2)将1gNH4+-N氧化为NO2--N需要3.43gO2,氧化1gNO2--N需要1.14gO2,所以氧化1gNH4+-N需要4.57gO2。
硝化细菌所需的环境条件主要包括以下几方面:a.DO:DO应保持在2-3mg/L。
当溶解氧的浓度低于0.5mg/L时,硝化反应过程将受到限制。
b.PH和碱度:PH7.0-8.0,其中亚硝化菌6.0-7.5,硝化菌7.0-8.5。
最适合PH为8.0-8.4。
碱度维持在70mg/L以上。
碱度不够时,应补充碱c.温度:亚硝酸菌最佳生长温度为35℃,硝酸菌的最佳生长温度为35~42℃。
15℃以下时,硝化反应速度急剧下降;5℃时完全停止。
d.污泥龄:硝化菌的增殖速度很小,其最大比生长速率为 0.3~0.5d-1(温度20℃,pH8.0~8.4)。
为了维持池内一定量的硝化菌群,污泥停留时间必须大于硝化菌的最小世代时间。
对于实际应用中,活性污泥法脱氮,污泥龄一般11~23d。
e.污泥负荷:负荷不应过高,负荷宜0.05-0.15kgBOD/(kgMLSS·d)。
因为硝化菌是自养菌,有机物浓度高,将使异养菌成为优势菌种。
总氮负荷应≤0.35kgTN/(m3硝化段·d),当负荷>0.43kg/(m3硝化段·d)时,硝化效率急剧下降。
3.2 硝化和亚硝化反应

三、其他硝化方法
(一)硝酸硝化
1、浓硝酸硝化——1,4-二甲氧基硝基苯的合成
OCH3 + HNO3 OCH3 OCH3 OCH3 NO2 + H2O
2、稀硝酸硝化——蓝色基BB,一种冰染色基染 OC H OC H 料的合成 NO
2 5 2 5
+ HNO3
2
+ H2O
OC2H5 OC2H5 NHCOC6H5 OC2H5 + HNO3
水相
(七)硝化异构产物的分离 1) 物理法:利用异构体间的物理性质差别进行 分离。见p93表4-6。常用精馏、结晶、再结晶法。
2) 化学法:如利用亚硫酸钠法分离间二硝基苯, 其异构体与亚硫酸钠反应产物磺酸钠盐溶于水而被 除去。
NO2 NO2 NO2 NO2 + Na2SO3 NO2 SO3Na SO3Na NO2 + NaNO2
硝基苯 邻、对硝基甲苯 邻、对硝基氯苯 间-二硝基苯 1-硝基萘
1.01~1.05 1.01~1.05 1.02~1.05 1.0连续法 间歇法 58%废酸 循环
(三)配酸工艺
配制混酸时应注意的问题:
1)设备的防腐措施;2)有效的机械混合装置;
3)及时导出热量的冷却装置;4)配酸温度控制在 40℃以下;
2. 硝化反应历程 典型的芳香族亲电取代反应历程
H + NO2+ fast NO2 配合物
+
NO2 + fast
NO2 + H+
slow
配合物
3.工业硝化方法 (1)直接硝化法 稀硝酸和浓硝酸硝化 稀硝酸:适用于某些易硝化的带致活基团的芳香 族化合物,如酚类、酚醚类、茜素和N-酰化芳胺。 浓硝酸:仅用于少数芳烃化合物的硝化。
硝化反应顺序口诀

硝化反应顺序口诀硝化反应是指硝化细菌将氨氧化为亚硝酸,再将亚硝酸氧化为硝酸的过程。
这个过程在自然界中广泛存在,对于生态系统的氮循环起着至关重要的作用。
为了帮助人们更好地理解硝化反应的顺序和过程,下面是一个硝化反应顺序的口诀。
“氨生亚,蓝细菌。
亚生硝,硝化菌。
”这句简洁明了的口诀可以帮助我们记住硝化反应的顺序。
下面,我们将详细介绍硝化反应的顺序和每个步骤的具体过程。
氨生亚:氨氧化为亚硝酸硝化反应的第一步是将氨氧化为亚硝酸。
氨氧化是一种由氨氧化细菌完成的过程。
这些细菌能够利用氨氮作为能量来源,并将其氧化为亚硝酸。
亚硝酸通常以化学式NO2-表示。
氨氧化的化学反应如下所示:NH3 + 1.5O2 -> NO2- + 2H+ + H2O蓝细菌:亚硝酸转化为亚硝酸盐和硝酸盐在硝化反应的第二步中,亚硝酸将被蓝细菌转化为亚硝酸盐和硝酸盐。
蓝细菌是一类特殊的细菌,它们具有亚硝酸还原酶这一特殊的酶,可以将亚硝酸还原为氮气。
亚硝酸转化为亚硝酸盐的化学反应如下:2NO2- + 4H+ -> N2O + 2H2O亚硝酸转化为硝酸盐的化学反应如下:2NO2- + O2 -> 2NO3-硝化菌:硝酸的形成在硝化反应的最后一步中,硝化细菌将亚硝酸盐进一步氧化为硝酸盐。
硝化菌利用硝酸盐作为能量来源,并将其还原为氮气。
硝化菌不同于蓝细菌,它们只能进行氧化反应,而不能进行还原反应。
亚硝酸盐转化为硝酸盐的化学反应如下:2NO2- + O2 -> 2NO3-综上所述,硝化反应可分为氨生亚、蓝细菌和硝化菌这三个步骤。
通过记住硝化反应顺序的口诀“氨生亚,蓝细菌。
亚生硝,硝化菌”,我们可以更好地理解硝化反应的过程和每个步骤的具体作用。
硝化反应在自然界中起着重要的作用,它能够将氨氧化为硝酸盐,提供植物所需的营养元素。
同时,硝化反应还参与了地球氮循环的过程,对维持生态系统的平衡起到了重要作用。
最后,希望这个口诀和相关解析能够帮助您更好地理解硝化反应的顺序和过程。
硝化反应主要危险及控制措施
三、硝化过程的危害因素及预防对策(续)
4、硝化设备危害的预防对策 (1)设备设计、材质选择要合理,特别对耐腐蚀要求。
(2)硝化釜搪玻璃涂层的完整性必须定期检查 。
(3)电器仪表要防爆,设备、管道要有防静电措施并定期进行 防静电检测。 (4)仪表控制报警联锁要定期检查并试运行。 (5)泄压、防有害气体外泄装置要经常巡查确保有效。
四、案例2——希克森和韦尔奇公司事件
• 1915年希克森和韦尔奇公司建立在英国西约克郡卡斯尔福德 镇,该公司雇佣了900名员工,生产有机化学品。
专业生产硝基甲苯
工艺概述:甲苯与混酸(96%硝酸和80%硫酸)发生硝化反应, 产生邻位、间位、对位异构体,同时也产生二硝基甲苯和硝 基甲苯酚。
在初始蒸馏之后,剩下的是低挥发性的二硝基甲苯和硝基甲 苯酚的混合物。
馏的速率降低。 • 最终,1992年9月21日该公司
决定清理设备里的残留物。
四、案例2——希克森和韦尔奇公司事件(续)
四、案例2——希克森和韦尔奇公司事件(续)
四、案例——希克森和韦尔奇公司事件(续)
四、案例2——希克森和韦尔奇公司事件(续)
事故经过 • 员工接到区域经理指示,用蒸汽升温软化残留物,温度不要
结果造成:5人死亡
四、案例2——希克森和韦尔奇公司事件(续)
直接原因: • 残留物不稳定,加热时发生了热分解。
根本原因: • 温度探测杆没有接触到残留物(温度控制不足) • 蒸汽压力存在问题,设计的安全阀是不超过100psig(0.7 Mpa,165℃),但安装的是135psig(1.0Mpa,180℃)(维 护不足) • 设备使用了三十年,残留物从未清理过(维护不足) • 工艺改变后,残留物不断增多(未经授权的修改)
硝化反应机理

硝化反应机理
硝化反应的机理如下:
1、对于脂肪族化合物的硝化一般是通过自由基历程来实现的,其具体反映比较复杂,在不同体系中均有所不同,很难有可以总结的共性。
2、对于芳香族化合物来说,其反应历程基本相同,是典型的亲电取代反应。
硝化反应,硝化是向有机化合物分子中引入硝基(-NO2)的过程,硝基就是硝酸失去一个羟基形成的一价的基团。
芳香族化合物硝化的反应机理为:硝酸的-OH基被质子化,接着被脱水剂脱去一分子的水形成硝酰正离子(nitroniumion,NO2)中间体,最后和苯环行亲电芳香取代反应,并脱去一分子的氢离子。
在此种的硝化反应中芳香环的电子密度会决定硝化的反应速率,当芳香环的电子密度越高,反应速率就越快。
由于硝基本身为一个亲电体,所以当进行一次硝化之后往往会因为芳香环电子密度下降而抑制第二次以后的硝化反应。
常用的硝化剂主要有浓硝酸、发烟硝酸、浓硝酸和浓硫酸的混酸或是脱水剂配合硝化剂。
脱水剂:浓硫酸、冰醋酸、乙酐、五氧化二磷。
硝化剂:硝酸、五氧化二氮(N2O5)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硝化与硝化反应4.1生物脱氮的过程和条件
A、废水当中的氮分为有机氮和氨氮即硝酸及亚硝酸盐氮,氮的脱除经过以下三步反应
(1)氨化反应。
在氨化菌的作用下,有机氮化合物分解,转化为氨氮。
(2)硝化反应。
在亚硝化及硝化菌的作用下,氨氮进一步分解氧化为亚硝酸及硝酸盐氮。
(3)反硝化反应。
在反硝化菌的作用下,少部分亚硝酸及硝酸盐氮同化为有机氮化物,成为菌体,大部分异化为气态(70~75%)。
B、硝化菌对环境的变化很敏感,它所需要的环境条件主要包括以下几方面:
(1)好氧条件,DO≥1mg/l,并保持一定碱度,适宜的PH值为8.0~8.4。
(2)有机物含量不宜过高,污泥负荷≤0.15kgBOD/kgMLVSS·d,因为硝化菌是自养菌,有机基质浓度高,将使异氧菌快速增殖而成为优势。
(3)适宜温度20~30℃。
(4)硝化菌在反应器中的停留时间必须大于最小世代时间。
(5)抑制浓度尽可能的低,除重金属外,抑制硝化菌的物质还有高浓度有机基质,高浓度氨氮、NOx-N 以及络合阳离子。
(6)硝化过程NH3-N耗于异化氧化和同化的经典公式
NH4++1.83O2 +1.98HCO3- 0.98NO3-+0.021C5H7NO2+1.88H2CO3+1.04H2O
因此表明,去除1gNH3-N约:耗去4.33gO2;生成0.15g 细胞干物质;
减少7.14g 碱度;耗去0.08g无机碳。
C、反硝化反应的适宜条件:
(1)最适宜的PH值为6.5~7.5。
PH高于8或低于6,反硝化速率将大为降
低。
(2)反硝化菌需要缺氧、好氧(合成酶系统)条件交替存在,系统DO≤0.5mg/l
(3)最适宜温度为20~40℃,低于15℃,反硝化反应速率降低。
(4)(4)BOD/TN≥3~5。
反硝化菌是异氧兼性厌氧菌,可作为其碳源的有机物较多.
反硝化过程NO3-+1.08CH3 OH+0.24H2CO3→0.06C5H7NO2 +0.47N2+1.68H2O+HCO3-
因此表明:每1gNO3--N 被硝化,消耗3.7gCOD产生0.45g新细胞产生3.57g 碱度
对于一般城镇污水,没有试验资料时,前置反硝化系统利用原污水碳源作为电子供体时,在20℃情况下,反硝化速率可取0.03~0.06gNO3--N/(gMLVSS·d);对于没有外来碳源的后置反硝化系统,反硝化速率可取0.01~0.03gNO3--N/(gMLVSS·d).。
