XX医院病理科免疫组化制片和结果判读规程
XX医院病理科免疫组化制片和结果判读规程

病理科免疫组化制片和结果判读规程
免疫组化染色已经成为现代病理学中不可或缺的重要工具,准确的免疫组化染色极大地帮助病理诊断,或提供准确的分子治疗靶标;而不准确的免疫组化染色反而产生误导,造成误诊。
因此必须对影响免疫组化染色的各个环节进行严格的质控,对技术人员和进行培训,保证准确的染色结果。
1、免疫组化染色相关操作人员必须经过专门的培训和授权。
2、每一批次的免疫组化染色必须设阳性和阴性对照,可利用组织中的内对照。
3、必须建立本实验室免疫组化染色的操作规程,并根据染色效果及时更新。
4、更换抗体或试剂后,需要用阳性和阴性组织对新试剂进行有效性验证,并有相应的文字记录和染色切片档案,相关档案保留2年。
5、免疫组化染色过程中产生的有毒液体(如DAB)应专门回收,严禁随处倾倒。
6、免疫组化染色结果必须由病理医师结合形态学综合判断,并将染色结果写到病理报告中。
- 1 -。
免疫组化染色(石蜡切片)操作步骤及结果分析方法(精髓版)

免疫组化染色(石蜡切片)操作步骤及结果分析方法一、原理及应用免疫组化,简单说是用标记的抗体对组织中相应抗原进行定位、定性和部分定量的分析。
二、操作步骤:(1)将石蜡组织切片置于65°C恒温箱,烤片1h左右。
(2)脱蜡:二甲苯I 10min→二甲苯II 10min →梯度酒精(由高到低)各5min。
(3)1×PBS 洗涤3次,每次 5min。
(4)0.5% Triton X-100通透(PBS配制),目的是使抗体能够充分地进入胞内进行结合反应。
Triton X-100 可以溶解细胞膜、细胞核膜、细胞器膜上的脂质而使抗体及大分子结构的物质进入胞浆和胞核内,这样抗体就能顺利进入胞内与相应抗原结合。
当然了,如果检测的是膜抗原无需通透,忽略该步骤。
(4)抗原修复:使用柠檬酸盐缓冲液进行抗原修复,微波炉微波高火 3min,之后转成低火 15-30min。
注:福尔马林或多聚甲醛固定,会导致蛋白交联,而解交联的过程称为抗原修复。
所以冰冻切片不需要抗原修复!!抗原修复方法有多种,一般包括两大类:酶抗原修复(胰蛋白酶、胃蛋白酶、蛋白酶K) 热抗原修复(高压蒸汽法、微波法、水浴加热法)。
微波法最为常用。
(5)1×PBS 洗涤3次,每次5min。
(6)3% H2O2,室温孵育30min,目的是灭活内源性过氧化物酶。
(7)1×PBS 洗涤3次,每次5min。
(8)使用1% BSA 进行室温封闭30min,用于封闭非特异性抗原表位。
(9)根据抗体说明书使用合适浓度的特异性一抗,4°C 湿盒中静置过夜孵育。
(10)次日取出切片,室温下复温30min。
(11)1×PBS 洗涤3次,每次5min。
(12)按照免疫组化二抗试剂盒说明书操作。
(13)DAB 显色:DAB 显色液按说明书配制,使用时滴加到血管组织上,显微镜下观察并计时,待目的蛋白显色呈棕黄色时结束显色。
(14)苏木素染细胞核:苏木素染液5-10min(根据苏木素染液使用时间的长短,来调整染色时间)→ 流水清洗1min→ 1%盐酸酒精分化瞬时→ 流水清洗1 min→1%氨水反蓝瞬时→流水清洗1min。
免疫组化判读标准

免疫组化判读标准
免疫组化判读标准主要包括以下几个方面:
1. 染色结果的合格性:合格的染色结果应该是背景颜色浅淡或无着色,而阳性标志物清晰和定位明确。
2. 阳性信号的分布和形态特征:在判断染色结果时,不仅要看所检组织中是否存在阳性标记物,还要注意阳性信号的分布部位和形态特征。
一般来说,阳性信号应与被测抗原所在的部位一致,包括组织和细胞的不同区域。
3. 阴性结果的解读:阴性染色结果表示组织内预期特定区域中未见抗原表达,但这并不意味着抗原不表达。
阴性结果可能受到多种因素影响,如标本处理、方法学因素等。
因此,阴性结果不能立即视为否定意义。
4. 阳性标记的色度特征:阳性结果的显色程度取决于抗原含量、分布密度和标记方法及其敏感性。
根据阳性标记的显色程度,可分为淡黄色(弱阳性)和棕黑色(强阳性)。
在结果判断中,后两者较有意义,可作为判断依据。
5. 对照实验的设置:免疫组化染色实验必须设置阳性对照和阴性对照,以确保抗原表达的特异性和IHC技术操作的正确性。
如果对照组的结果出现问题,如阴性对照呈阳性反应或阳性对照呈阴性反应,则说明实验结果失去意义,需要重新进行实验或换用其他抗体。
6. 抗原表达的特定部位:抗原表达必须在特定部位进行判断。
如果抗原在非预期部位表达,则可能存在假阳性或假阴性结果。
综合以上标准,免疫组化染色结果的判读需要综合考虑多个因素,包括染色结果的合格性、阳性信号的分布和形态特征、阴性结果的解读、阳性标记的色度特征、对照实验的设置以及抗原表达的特定部位等。
通过综合分析这些因素,可以对免疫组化染色结果进行准确的判断。
免疫组化实验结果分析

免疫组化实验结果分析在免疫组化实验中,结果分析是一个关键的步骤,它能够帮助研究者准确评估目标分子的表达情况。
通过对免疫组织染色结果的观察和分析,我们可以了解到免疫反应的程度和位置,从而为研究提供有力的依据和指导。
本文将围绕免疫组化实验结果的分析展开讨论。
1. 实验结果描述在开始分析之前,首先要对实验结果进行描述。
描述应当包括样本编号、实验日期、染色报告等基本信息,并对结果进行文字描述,如颜色的强度、分布情况、阳性细胞数量等。
此外,还可以结合图像或照片进行结果展示,以便更直观地表达实验结果。
2. 染色结果的分析根据染色结果的颜色强度和阳性细胞的分布情况,可以分析免疫反应的程度和位置。
通常,颜色较深且阳性细胞较多的区域表示目标分子的高表达区域,而颜色较浅或无阳性细胞的区域则表示其低表达或无表达区域。
通过对颜色和阳性细胞数量的定量分析,可以量化目标分子的表达水平,并与其他样本进行比较和分类。
3. 阳性细胞计数和分布情况在免疫组化实验中,阳性细胞的计数和分布情况是结果分析的重要指标之一。
通过对染色结果图像的定量分析,可以计算出阳性细胞的数量,并使用统计学方法对不同样本之间的差异进行比较和验证。
此外,还可以通过细胞计数的分析,了解阳性细胞在组织中的分布情况,从而为目标分子的功能和作用机制提供线索。
4. 结果的统计学分析除了定性和定量分析,还可以使用统计学的方法对结果进行进一步的分析。
例如,可以计算平均值、标准差和标准误等统计指标,并进行方差分析和t检验等统计检验,以评估不同样本之间的显著性差异。
此外,还可以使用聚类分析、主成分分析等多元分析方法,对大规模的实验结果进行系统整理和分类。
5. 结果的生物学意义和临床应用最后,要将实验结果的分析归纳到生物学意义和临床应用上。
通过对目标分子的表达情况进行分析,可以了解其在生理和病理过程中的功能和作用机制,进而为相关疾病的预防、诊断和治疗提供新的线索和靶点。
此外,还可以将实验结果的分析与其他实验数据进行综合,构建更完整和准确的分子机制模型。
免疫组化结果判读

免疫组化相关资料
• https:///PathIQ/ Home.do • /web/hist opathology_help.htm • /neq asicc.shtml
CD20
细胞质阳性
GFAP
Mammaglobin
PSMA
细胞质/细胞膜
CD8
CD30
CD21
细胞核/细胞质
p16
S-100
PGP9.5
细胞外基质
CollegenII
其他
HP Villin EBV
例1:患者女性,43岁,左颈部肿物2个月
CD30和CD15表达
CD30
CD15
CD30
CD15
058313
高分子CK(34β E12)
-
058314
AMACR/p504s(13H4)
+
免疫组化染色结果分析:
设置的各种对照实验染色正常,送检组织中见有多数的肿瘤性腺上皮细胞(细胞核大 且有明显核仁)细胞质中AMACP/p504s强阳性,肿瘤性腺体周围未见P63和高分子CK 表达,组织中残留的正常腺体周围见有明显的P63和高分子CK表达但腺上皮细胞未见 AMACP/p504s表达。免疫组化染色结果提示符合前列腺癌的特征。 病理医师 何深震
表2
病理免疫组化报告单样本 XX病理科免疫组化报告单 患者姓名 王大山 性别 男 年龄 75 申请免疫组化日期 2005/12/7 申请医生 许如云 蜡块编号 0512117.12 免疫组化实验日期 2005/12/8 组织名称 前列腺 HE初步诊断 前列腺癌待排除 免疫组化检测方法 MaxVision法 显色剂 DAB
免疫组化结果判定标准

免疫组化结果判定标准免疫组化(Immunohistochemistry,IHC)是一种利用抗体与抗原特异性结合的原理,通过显色反应来检测组织中特定蛋白的方法。
在临床病理诊断中,免疫组化技术被广泛应用于肿瘤诊断、分子靶向治疗策略制定以及预后评估等方面。
而对于免疫组化结果的判定标准,是保证免疫组化结果准确性和可重复性的关键。
一、阳性判定标准。
1. 强阳性,细胞膜、细胞核或细胞质呈现明显的棕色沉积,且在显微镜下呈现出浓烈的阳性信号。
2. 中度阳性,细胞膜、细胞核或细胞质呈现较浅的棕色沉积,且在显微镜下呈现出中等强度的阳性信号。
3. 弱阳性,细胞膜、细胞核或细胞质呈现微弱的棕色沉积,且在显微镜下呈现出轻微的阳性信号。
二、阴性判定标准。
1. 完全阴性,组织中无任何棕色沉积,仅呈现蓝色或无色。
2. 部分阴性,部分细胞呈现棕色沉积,但大部分细胞呈现蓝色或无色。
三、判定标准的影响因素。
1. 抗体质量,抗体的纯度、稀释度、保存条件等因素会直接影响免疫组化结果的准确性。
2. 组织取材及处理,组织取材的新鲜度、固定方法、切片厚度等都会对免疫组化结果产生影响。
3. 染色条件,染色的时间、温度、染色试剂的配制等都是影响免疫组化结果的关键因素。
四、结果判定的标准化。
为了保证免疫组化结果的一致性和可比性,临床病理实验室需要建立完善的质控体系,确保免疫组化结果的准确性和可靠性。
同时,临床病理医师需要接受系统的免疫组化技术培训,熟悉不同抗体的特异性和染色条件,以保证结果的准确判定。
总之,免疫组化结果的判定标准是保证免疫组化技术在临床病理诊断中准确应用的重要保障。
只有严格按照标准操作,才能保证免疫组化结果的准确性和可靠性,为临床诊断和治疗提供有力支持。
免疫组化结果判断标准

免疫组化结果判断标准免疫组化结果判断标准指的是在免疫组化检测中,根据染色结果和特定的标准对检测样本进行判断和解读的规则。
免疫组化是一种常用的实验方法,用于检测组织切片或细胞中特定的蛋白质表达情况。
在免疫组化实验中,通常使用标记有特异性抗体的试剂与目标抗原结合,形成颜色沉积或荧光信号。
免疫组化结果根据检测物的染色程度、强度和分布模式来判断。
以下是一些常见的免疫组化结果判断标准:1. 阳性(Positive):表示目标抗原在组织或细胞中存在。
阳性结果通常可以观察到明显的染色和强度,其分布模式可能是全细胞膜、核、细胞质等。
2. 阴性(Negative):表示目标抗原在组织或细胞中不存在。
阴性结果通常观察不到染色或染色非常弱,且不符合阳性的染色模式。
3. 弱阳性(Weak Positive):染色结果显示为弱的阳性信号,通常比阳性样本的染色强度要低。
4. 血管内内皮细胞阳性(Vascular Endothelial Cell Positive):此结果表示目标抗原在血管内皮细胞中存在。
5. 炎症细胞阳性(Inflammatory Cell Positive):表示目标抗原在炎症细胞中存在。
6. 异常强阳性(Aberrantly Strong Positive):表示目标抗原在组织或细胞中出现异常高的染色强度,超过了正常表达水平。
每种免疫组化实验都具有独特的结果判断标准,这些标准通常由经验丰富的病理学家或专业领域的专家制定和解读。
此外,合适的对照实验和质量控制也是确保免疫组化结果可靠性的重要因素。
总之,免疫组化结果判断标准对于准确解读免疫组化实验结果至关重要。
了解并遵循这些标准可以确保免疫组化实验结果的准确性和可靠性,从而对研究和临床诊断产生重要的参考价值。
免疫组化结果判读标准

免疫组化结果判读标准
免疫组化技术用于检测和定量特定蛋白质在组织或细胞中的表达情况。
免疫组化结果的判读标准会因所检测的蛋白质和研究目的的不同而有所不同。
以下是一般免疫组化结果判读的一般原则:
1. 强阳性(Strong positive):细胞或组织中存在大量的目标蛋白表达,通常显示为强烈的染色信号。
2. 中阳性(Moderate positive):细胞或组织中存在适度的目标蛋白表达,染色信号强度介于强阳性和弱阳性之间。
3. 弱阳性(Weak positive):细胞或组织中存在轻微的目标蛋白表达,染色信号强度较弱。
4. 阴性(Negative):细胞或组织中不存在目标蛋白的表达,通常显示为无或非特异性染色。
需要注意的是,免疫组化结果的判读可能还需要结合组织或细胞的生理背景、对照组样本以及其他实验数据进行综合分析。
与实验室或领域专家进行讨论和解释结果也是非常
重要的。
此外,具体研究领域和目的可能会有特定的判读标准,因此建议参考相关的研究文献和指南以确定适用的判读标准。
免疫组化结果的分析和判断

⒉阴性组织对照 指用已证实不 含靶抗原的同步处理和免疫标记染 色的组织对照。正确的结果应为阴 性,目的是除外假阳性。
⒊阴性试剂对照 是指用于证实在免疫 组化染色中所用试剂,尤其是特异性抗 体试剂的有效性和可靠性而所设立的同 步免疫染色对照,包括有:空白对照; 替代对照;吸收试验和抑制试验等。目 的在于除外假阳性和证实所用免疫组化 试剂及其技术方法的有效性和待检实验 切片免疫标记阳性结果的可靠性。
免疫显色强度和阳性细胞密度是定 性定量指标,实际工作中常采用强度和 密度结合的方法综合计量,与抗原含量 有关;阳性细胞的着色形态及组织分布 特点主要是定位指标,与功能有关。
一 、 阳 性 标 记 免 疫 特 征 : 分 " 弱 (+) 、中(++)、强(+++)"三级。免疫荧光法( FITC为例) 则表现为浅绿色荧光、明显 绿色荧光和亮绿色耀眼荧光;
* 第三节 非特异染色
非特异染色是指免疫组化染色过程 中产生的非靶抗原的呈色结果,属假阳 性,又称背景着色,能严重干扰免疫组 化染色结果的正确判断,应竭力避免或 减轻。其原因涉及免疫组化染色流程的 各个环节,可来自:
①内源性干扰(自发荧光、内源酶、内源 性生物素等);
②试剂污染(质量差,交叉反应,Fc受体 干扰等);
⑶吸收试验 是指用事先经过量抗原吸收的 第一抗体上清液取代第一抗体,其他步骤 不变的免疫染色试剂对照。结果应是阴性 或阳性着色明显减弱(吸收不全时)。
⑷抑制试验 是指用标记抗体和未标记抗 体(可以是一抗,也可以是二抗或桥抗 体)两者的混合物作试剂,其他步骤不 变的免疫组化染色试剂对照,结果其阳 性着色应成比例的减弱(等量或1:9) 。此试剂对照多用于直接法。
免疫组化方法和步骤

免疫组化方法和步骤免疫组化是一种常用的实验技术,用于检测细胞或组织中特定蛋白质的表达水平,以及研究细胞或组织中的蛋白质定位和相互作用。
免疫组化方法涉及一系列步骤,包括样本固定、抗原检测与标记、抗体与抗原结合、可视化和结果分析。
以下是免疫组化方法及步骤的详细介绍。
一、样本固定免疫组化实验的第一步是固定样本,通常使用福尔马林或乙醛等化学物质进行固定。
固定的目的是保持细胞和组织的形态结构,并防止蛋白质的降解。
固定过程中,需要将样本固定在载玻片或膜上,以便之后的实验操作。
可使用刷子或杆状工具将样本涂布在载玻片上,或者使用离心管和离心机将细胞沉淀在载膜上。
二、抗原检测与标记样本固定后,下一步是检测和标记目标抗原。
有两种常用的方法供选择:直接法和间接法。
1.直接法:直接法在一个步骤中同时检测和标记抗原。
直接法可以快速获得结果,但受到抗体的特异性和标记物的可用性的限制。
2.间接法:间接法需要两个步骤,先使用特异性初级抗体与抗原结合,再使用标记有染料或标记物的二级抗体与初级抗体结合。
间接法具有较高的灵敏度和特异性,可以用于多重标记和检测多个蛋白质。
三、抗体与抗原结合蛋白质和抗体结合是免疫组化的关键步骤。
待检样本上固定的抗原与抗体结合可以直接检测或通过信号增强来检测。
抗体与抗原结合的时间和温度取决于抗体的亲和力和特异性,通常需要在较低的温度下进行孵育,并在孵育过程中提供充分的抗体与抗原接触时间。
四、可视化可视化是将抗原抗体结合信号转化为可见光信号的过程。
最常见的可视化方法之一是使用酶标测定法。
酶标测定法将酶(如辣根过氧化物酶)结合到标记物(如荧光素黄标记的二级抗体)上,然后通过加入底物(如DAB)产生可见的色素反应。
除了酶标测定法外,还有其他可视化方法,如免疫荧光技术和原位杂交。
免疫荧光技术使用标记的荧光染料标记一级或二级抗体,然后通过荧光显微镜观察样本。
原位杂交使用与DNA序列互补的标记探针识别特定的DNA序列,并通过可视化标记(如荧光)来检测靶标。
免疫组化实验结果的判定和分析

免疫组化实验结果的判定和分析免疫组化实验是一种广泛应用于生物医学研究领域的分析方法,它用于检测和定量分析细胞或组织中特定分子的表达水平。
该实验主要通过特异性抗体与目标分子结合并产生可视化信号来实现。
在进行免疫组化实验的结果判定和分析时,需要考虑多个因素,如抗体的选择、染色的强度和分布等。
首先,在实验结果的判定和分析时,抗体的选择是非常重要的因素之一、选择合适的抗体可以确保实验结果的准确性和可靠性。
抗体需要具有高度的特异性,能够与目标分子结合形成稳定的抗原-抗体复合物。
此外,抗体还需要具有良好的亲和力和灵敏度,以便能够捕获并检测到目标分子的最低表达水平。
其次,实验结果的判定和分析需要考虑染色的强度和分布。
免疫组化实验中常用的染色方法有荧光染色和酶标染色等。
染色的强度可以反映目标分子在细胞或组织中的表达水平,而染色的分布则可以提示目标分子的亚细胞定位或组织定位。
通过评估染色的强度和分布,可以对目标分子的表达及其在生物学过程中的作用进行初步分析。
另外,实验结果的判定和分析还需要结合负对照和阳性对照组的结果。
负对照组通常是将待测样本中的目标分子结合位点堵塞或与非特异性抗体结合,以排除非特异性染色的可能性。
而阳性对照组则是使用已知表达目标分子的样本进行染色,以验证实验方法的可靠性。
通过与负对照和阳性对照组的比较,可以进一步确定实验结果的准确性和特异性。
此外,实验结果的判定和分析还可以应用定量分析方法。
免疫组化实验通常使用染色强度的定量参数,如光密度或荧光信号强度来评估目标分子的表达水平。
这可以通过计算图像中目标区域的颜色强度来实现。
定量分析可以帮助研究者确定目标分子在不同条件下的变化趋势,并进一步研究其与疾病发生和发展的关联。
最后,实验结果的判定和分析应该结合其他相关的实验数据和研究背景进行综合分析。
免疫组化实验的结果往往只能提供目标分子在组织或细胞中的表达水平,而无法直接确定其功能和作用机制。
因此,需要将实验结果与其他实验手段和研究结果相结合,以获得更全面的分析结果。
免疫组化判读方法

免疫组化判读方法
免疫组化结果的判读方法如下:
1. 必须设阳性对照和阴性对照。
阳性对照是已知的阳性标本,用于验证试剂和技术方法的可靠性;阴性对照是已知不含待测抗原的标本,用于确定本底情况。
如果阳性对照阴性,表明检测操作方法可能有误,需要重新检测。
2. 抗原表达必须在特定部位。
有些免疫组化的定位在细胞膜,有些在细胞质,有些在细胞核,所以在特定部位阳性表明是真正阳性;如果在非特定部位阳性,或者整个切片阴性,都会判定免疫组化是阴性,或者是假阳性。
此外,根据使用的染色方法不同,判读方法也有所不同。
例如ABC法(卵
白素-生物素-过氧化物酶复合物法)和SP法(抗生物素蛋白链酶素-过氧化物酶复合物法)。
以上信息仅供参考,如果您还有疑问,建议咨询专业人士。
免疫组化结果判定标准

免疫组化结果判定标准免疫组化(Immunohistochemistry,IHC)是一种利用抗体与抗原特异性结合的原理,通过染色反应来检测组织中特定蛋白质的方法。
它在病理诊断、疾病发病机制研究和药物靶点筛选等领域有着广泛的应用。
然而,免疫组化结果的判定标准对于结果的准确性和可靠性至关重要。
首先,免疫组化结果的判定标准应包括阳性和阴性对照。
阳性对照是用已知表达目标蛋白的组织作为对照,而阴性对照则是用不表达目标蛋白的组织作为对照。
这样可以确保实验条件的准确性,避免假阳性和假阴性结果的出现。
其次,判定标准还应考虑到染色的强度和分布。
染色强度一般分为强阳性、中阳性、弱阳性和阴性,而染色分布则包括细胞膜、细胞浆和细胞核等。
对于不同的标记物,其染色强度和分布的判定标准可能会有所不同,需要根据具体情况进行调整。
另外,对于免疫组化结果的判定标准还应考虑到组织学特征。
不同的组织在形态学上有着不同的特点,可能会对染色结果产生影响。
因此,在判定标准中需要考虑到组织的特异性,避免将正常组织误判为阳性或将肿瘤组织误判为阴性。
此外,对于免疫组化结果的判定标准还应考虑到实验操作的一致性和重复性。
在进行免疫组化实验时,需要严格控制实验条件,确保每次实验的操作流程和条件一致。
同时,还需要进行重复实验来验证结果的可靠性,避免由于偶然因素导致的结果偏差。
总的来说,免疫组化结果的判定标准对于结果的准确性和可靠性至关重要。
在制定判定标准时,需要考虑到阳性和阴性对照、染色强度和分布、组织学特征以及实验操作的一致性和重复性等因素。
只有制定科学合理的判定标准,才能保证免疫组化结果的准确性和可靠性,为临床诊断和科研工作提供可靠的依据。
病理科检查及结果分析制度

病理科检查及结果分析制度一、总则1.1 目的本制度旨在规范医院病理科的检查流程和结果分析,确保病理学检查的准确性和可靠性,为临床诊断和治疗供应可信的依据。
1.2 适用范围本制度适用于医院内的全部病理科工作人员和相关科室的临床医生、护士等。
1.3 定义病理学检查:指通过对组织、细胞等进行病理学的分析与诊断,以揭示疾病的本质和发展规律的检查方法。
二、病理学检查的操作流程2.1 标本接收与登记2.1.1 接收标本病理科接收标本时,应将接收的标本记录在接收登记本上,并确保标本的完整性和规范性,避开污染和损坏。
2.1.2 登记标本信息在接收登记本中,应准确记录标本的基本信息,包含病人姓名、年龄、性别、病历号、标本种类、手记位置、手记部位等,并调配唯一的标本编号。
2.2 标本处理与制片2.2.1 标本固定依照病理学检查要求,将接收的标本进行固定处理,保持其组织结构的完整性。
2.2.2 制作切片对固定后的标本,进行切片制作,并依照相关操作规范进行染色或特殊处理,确保切片的质量和可读性。
2.3 病理学检查与分析2.3.1 镜检对制作好的病理切片,进行显微镜下的察看和分析,记录病变区域和特征。
2.3.2 疑难病例讨论对于显现疑难病例或疑难病变区域的切片,病理科应组织多学科的讨论会议,邀请临床医生、放射科医生、内科医生等参加,共同研究和分析,提高病理诊断的准确性和可靠性。
2.3.3 病理诊断报告依据镜检和讨论的结果,病理科医生应撰写病理诊断报告,包含病变的类型、程度、侵害范围、特征等,确保报告的准确性和完整性。
2.4 病理学结果分析与解读2.4.1 病理学结果统计病理科应对每个疾病的病例进行统计,包含疾病的类型、发病率、发展趋势等,为临床医生供应疾病流行病学数据和预后推断的依据。
2.4.2 结果解读与报告病理科应定期将病理学结果及时报告给相关科室,供应病理分析和结果解读,为临床医生供应有效的临床引导和治疗方案。
2.4.3 质量掌控与质量评估病理科应建立规范的质量掌控体系,包含常规标本的质量评估、质检抽查和误诊率评估等,连续提高病理学检查的准确性和可靠性。
山东省医疗机构病理科质量管理规程

《山东省医疗机构病理科质量管理规程》一、病理科的工作范畴 (1)二、病理科的设置及基本条件 (1)(一)病理科的设置 (1)(二)病理科人员的数量 (2)(三)病理医师和技术员的任职要求 (2)(四)病理科的用房 (3)(五)病理科必需的专业技术设备 (3)(六)专业参考图书 (4)三、病理科各类人员职责及相关规章制度 (4)(一) 病理科工作制度 (4)(二) 病理科人员准入制度 (5)(三) 病理科各类人员岗位职责 (6)(四) 病理科员工健康管理制度 (8)(五) 病理科质量管理制度 (9)(六) 病理科标本验收制度 (10)(七) 病理科工作交接制度 (11)(八) 病理科复审和集体阅片制度 (12)(九) 病理科疑难病理会诊制度 (13)(十) 病理科尸体解剖工作制度 (13)(十一) 病理科资料档案管理制度 (15)(十二) 病理切片、涂片借阅制度 (15)(十三) 病理科工作量统计制度 (17)(十四) 病理科教学、科研管理制度 (17)(十五) 病理科进修及实习人员管理制度 (17)(十六) 病理科设备管理制度 (18)(十七) 病理科办公用品、耗材及试剂管理制度 (18)(十八) 病理科消毒隔离管理制度 (18)(十九) 感染性材料管理制度 (19)(二十) 病理科生物安全工作自查制度 (20)(二十一) 生物安全管理及人员的培训和考核制度 (20)(二十二) 病理科意外事件处理与报告制度 (21)(二十三) 病理科安全保卫制度 (22)(二十四) 病理科服务承诺(便民措施) (23)四、病理科工作质量控制规程 (23)(一)标本送检及组织固定 (24)(二)病理申请单 (25)(三)病理标本检查和取材 (25)(四)常规病理制片 (26)(五)病理诊断、复查制度、科内会诊制度 (26)(六)病理诊断报告书 (26)(七)细胞学诊断 (32)(八)术中冰冻切片病理诊断 (32)(九)尸体解剖 (35)(十)特殊染色(组织化学染色) (36)(十一)免疫组织化学染色和结果判读 (36)(十二)分子病理检测 (36)《山东省医疗机构病理科质量管理规程》为加强医疗机构病理科的管理,提高病理诊断水平,保证医疗质量和医疗安全,促进临床工作,根据《中华人民共和国执业医师法》、《医疗机构管理条例》、《病理科建设与管理指南》和《临床技术操作规范——病理学分册》等有关法律、法规和专业规范,特制定本规程。
乳腺癌HER2免疫组化判读及报告SOP

广东省人民医院病理医学部病理科乳腺癌HER2免疫组化判读及报告SOP1.目的:保证乳腺HER2判读的准确。
2.责任人:负责乳腺癌治疗相关指标专项报告的责任医生。
3.步骤:3.1拿到切片后,常规核对编号、标识等资料;3.2低倍镜(2×或4×)扫描整个切片(包括阴性及阳性对照片),查看有无掉片、皱褶、缺损等影响判读的情况;3.3低倍镜观察,评估组织的质量,对浸润癌进行大致定位,浸润癌的大致范围,染色效果;3.4观察阳性及阴性对照片的染色效果,如果正常,进行下一步观察;3.5观察正常乳腺导管的着色情况,应该无染色或弱(至多弱-中度强度)染色,且整个切片对比鲜明,间质无着色,再进行下一步观察;3.6在10×观察,判断浸润癌着色细胞的比例;3.720×(必要时40×)观察膜染色的完整性,染色的深浅,再按标准进行评分;3.8评分标准(中国乳腺癌HER2检测指南2009版):0: 无着色;1+:任何比例的浸润癌细胞膜的呈现微弱、不完整的细胞膜着色;2+:>10%的浸润癌细胞呈现弱-中等强度、完整但不均匀的细胞膜棕黄着色或<30%的浸润癌细胞呈现强且完整的细胞膜棕褐着色;3+:>30%的浸润癌细胞呈现强且完整的细胞膜棕褐着色;3.9报告的内容:患者信息,标本信息(病理号和蜡块号),标本类型,标本固定液的种类,标本固定前时间,标本固定的时间,抗体信息(克隆号及生产商),使用方法(检测方法及生产商),对照片情况,样本量是否足够用于评估,判读标准(乳腺癌HER2检测指南2009版),判读结果及结论,注释。
4.质量控制:4.1两名判读医生交互阅片,计算两人的一致率,需达95%以上;4.2每月统计分析HER2评分的分布情况,与文献报道及既往本科室的HER2评分的分布不能有太大的偏差;4.3每月分析HER2免疫组化与FISH结果的一致性,达到ASCO/CAP的标准。
免疫组化结果判读

ې2、阳性细胞分布:-阴性,+少数细胞阳性,++ 中等细胞阳性,+++多数细胞阳性。
例3:乳腺癌组织中C-erbB-2的免疫组化染 色结果判读
判读标准: 0===在肿瘤细胞中无阳性 染色或者小于10%肿瘤细 胞出现有细胞膜染色。 (No staining is observed or membrane staining is observed in less than 10% of tumor cells)
细胞核阳性
CDX2 ER
CyclinD1 TDT
细胞膜阳性
CD20
C-erbB-2
CD44v3
细胞质阳性
GFAP
Mammaglobin PSMA
细胞质/细胞膜
CD8
CD30
CD21
细胞核/细胞质
p16 S-100
PGP9.5
细胞外基质
CollegenII
其他
HP Villin
EBV
例1:患者女性,43岁,左颈部肿物2个月
???
HER2(C-erbB-2) 免疫组化方法检测
计数 0 1+ 2+ 3+
结果 阴性 阴范的化疗治疗失败后,采用人源 性的单克隆抗体Herceptin®治疗有较好的相关性。(HER2 overexpression is associated with a varied positive response to the humanized monoclonal antibody Herceptin® in patients that have failed standard
免疫组化实验结果的判定和分析

免疫组化实验结果的判定和分析免疫组化实验结果的判定和分析就实验结果而言,免疫组化技术服务主要涉及抗体实验结果的描述与分析、图片的确定与选取、相关数据的提供,上述工作是免疫组化工作的重点内容。
只有严格的实验设计、标准的实验操作、专业化的结果分析才能满足客户的要求,更好地为客户提供最优质的服务。
免疫组化结果的判定原则:⒈必须同时设对照染色。
没有对照染色的免疫组化染色结果是不可信的。
⒉抗原表达必须在特定部位。
如LCA应定位在细胞膜上;CK应定位在细胞浆内;PCNA 及p53蛋白应定位在细胞核内;EMA应定位在细胞膜上等等。
不在抗原所在部位的阳性着色,一概不能视为阳性。
⒊阴性结果不能视为抗原不表达。
由于检测方法灵敏度有高低之分,有时可因染色方法灵敏度不够,而导致阴性反应,判断时应注意。
⒋尽量避开出血、坏死及切片刀痕和界面边缘细胞的阳性表达,特别是酶免疫标记。
因为这类阳性着色多系内源干扰,或系人为因素所致。
⒌对免疫组化标记结果的意义不能绝对化,应结合临床资料、X线等影像学及实验结果综合分析。
对照染色设计:(一)对照染色的目的设对照的目的是为了排除假阴性和假阳性。
假阴性的原因主要有三种:①组织处理不当,抗原丢失过多或被遮蔽;②抗体失活、效价过低或稀释度不合适(主要指一抗,即特异性抗体);③染色步骤遗漏及差错,或显色剂的选择、缓冲液pH和离子强度不当等。
假阳性均系由多种因素造成的非特异着色所致,原因主要有:①自发荧光或内源酶等干扰;②抗体试剂不纯(特别是一抗);③操作失误,如污染、切片干枯或显色剂操作不当等;④Fc受体的干扰,等等。
(二)对照的种类及其选用目的对照染色大致可分为四类:即阳性组织对照、阴性组织和阴性试剂对照及自身对照。
⒈阳性组织对照指用已证实含有靶抗原的同源及不同源组织切片或细胞涂片与待检实验切片同时作同样处理和免疫染色的组织对照。
正确的结果应呈现阳性,目的是为了证实所用免疫组化染色流程的有效性,排除假阴性的可能。
判读表及免疫组化关键步骤的说明
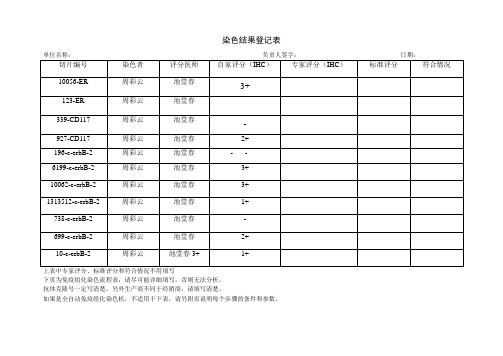
染色结果登记表单位名称:负责人签字:日期:切片编号染色者评分医师自家评分(IHC)专家评分(IHC)标准评分符合情况10056-ER 周彩云池堂春3+123-ER 周彩云池堂春-339-CD117 周彩云池堂春-927-CD117 周彩云池堂春2+196-c-erbB-2 周彩云池堂春--6199-c-erbB-2 周彩云池堂春3+10062-c-erbB-2 周彩云池堂春3+1313512-c-erbB-2 周彩云池堂春1+738-c-erbB-2 周彩云池堂春-699-c-erbB-2 周彩云池堂春2+10-c-erbB-2 周彩云池堂春3+ 1+上表中专家评分、标准评分和符合情况不用填写下页为免疫组化染色流程表,请尽可能详细填写,否则无法分析。
抗体克隆号一定写清楚,另外生产商不同于经销商,请填写清楚。
如果是全自动免疫组化染色机,不适用于下表,请另附页说明每个步骤的条件和参数。
免疫组化质控流程表轮次ER联系人信息联系人姓名手机号电子邮箱通讯地址邮编池堂春139******** Ctc1974@ 滁州市第一人民医院病理科239000抗体情况单/多克隆号稀释度稀释缓冲液孵育时间温度单过也4度生产商产品编号批号室温简写为RT (Room Temperature)福州迈新RMA-501 140402501C室内对照组织组织固定液,参比片酶修复情况10%中性缓冲福马林√10%普通福马林90%或无水乙醇B-5其他酶修复是否酶的类型浓度修复时间温度: ℃如使用其他固定液,请写明品名、浓度等热修复无热孵育微波炉✓压力锅蒸锅其他热修复缓冲液枸橼酸缓冲液pH6EDTA/EGTA pH8✓tris-EDTA/EGTA pH9其他N/A热修复详情升热时间加热维持时间最高温度放置冷却时间5分钟2分钟120度10分钟其他修复生物素封闭是否显色系统ABCS-P✓EnVision 二步法Polymer conjugate其他显色系统详情生产商产品号孵育时间温度福州迈新Kit-5010140408407B30分钟RT显色剂✓DABAEC其他显色剂详情生产商产品号孵育时间温度福州迈新140209412ADAB-0031A,B,C显微镜下观察RT染色方式手工苏木素复染请填写自动染色机的型号,如为手工染色,注明“手工”免疫组化质控流程表轮次第一轮HER-2联系人信息联系人姓名手机号电子邮箱通讯地址邮编池堂春139******** Ctc1974@ 滁州市第一人民医院病理科239000抗体情况单/多克隆号稀释度稀释缓冲液孵育时间温度单过夜4度冰箱生产商产品编号批号室温简写为RT (Room Temperature)福州迈新MAB-0198 140409198A室内对照组织组织固定液,参比片酶修复情况10%中性缓冲福马林✓10%普通福马林90%或无水乙醇B-5其他酶修复是否酶的类型浓度修复时间温度: ℃如使用其他固定液,请写明品名、浓度等热修复无热孵育微波炉✓压力锅蒸锅其他热修复缓冲液枸橼酸缓冲液pH6EDTA/EGTA pH8✓tris-EDTA/EGTA pH9其他N/A热修复详情升热时间加热维持时间最高温度放置冷却时间5分钟2分钟120度10分钟其他修复生物素封闭是否显色系统ABCS-P✓EnVision 二步法Polymer conjugate其他显色系统详情生产商产品号孵育时间温度福州迈新Kit-5010140408407B30分钟RT显色剂✓DABAEC其他显色剂详情生产商产品号孵育时间温度福州迈新40209412ADAB-0031A,B,C显微镜下观察RT染色方式手工苏木素复染请填写自动染色机的型号,如为手工染色,注明“手工”免疫组化质控流程表轮次第一轮CD117联系人信息联系人姓名手机号电子邮箱通讯地址邮编池堂春139******** Ctc1974@ 滁州市第一人民医院病理科239000抗体情况单/多克隆号稀释度稀释缓冲液孵育时间温度单过夜4度冰箱生产商产品编号批号室温简写为RT (Room Temperature)RMA-0632 140205632D室内对照组织组织固定液,参比片酶修复情况10%中性缓冲福马林✓10%普通福马林90%或无水乙醇B-5其他酶修复是否酶的类型浓度修复时间温度: ℃如使用其他固定液,请写明品名、浓度等热修复无热孵育微波炉✓压力锅蒸锅其他热修复缓冲液枸橼酸缓冲液pH6EDTA/EGTA pH8✓tris-EDTA/EGTA pH9其他N/A热修复详情升热时间加热维持时间最高温度放置冷却时间5分钟2分钟120度10分钟其他修复生物素封闭是否显色系统ABCS-P✓EnVision 二步法Polymer conjugate其他显色系统详情生产商产品号孵育时间温度福州迈新Kit-5010140408407B30分钟RT显色剂✓DABAEC其他显色剂详情生产商产品号孵育时间温度福州迈新40209412ADAB-0031A,显微镜下观察RTB,C染色方式手工苏木素复染请填写自动染色机的型号,如为手工染色,注明“手工”。
病理科操作规范及流程

病理科操作规范及流程什么是病理科?病理科学是一门研究疾病形成和发展机制的学科,它通过对患者组织和细胞的检测、分析和诊断,为患者的疾病诊治提供科学依据。
病理科常见操作组织切片组织切片是病理科较为常见的操作,其流程如下:1.选择合适的组织样本进行取材。
2.将取材的组织样本进行处理:固定、脱水、透明化、浸渍、包埋及切片。
3.进行切片染色,常用的染色方法包括血液学上的偏心染色、常规染色、免疫组化染色等。
4.对切片进行观察、分析和描述,并作出诊断。
细胞学检查细胞学检查是针对细胞进行的检查。
其流程包括以下步骤:1.采集样本:包括液态或固态细胞的采集。
如痰液、血液、骨髓、白带、尿液等。
2.样本制片:涂片或离心沉淀后制成薄片。
3.细胞染色:通常采用偏心染色、Papanicolaou染色、Giemsa染色等。
4.细胞学分析:观察细胞形态学和结构差异,并作出诊断。
病理科操作规范个人保护在进行病理科操作时,操作人员必须严格遵守个人保护措施。
使用手套、口罩、护目镜等防护用品,以防止病原体感染。
检验样本标识在进行病理科操作时,必须严格遵守样本标识的规定,避免样本混淆。
在每次操作前,必须先检查样本标识是否符合规定,以确保结果正确。
操作流程规范在进行病理科操作时,必须严格按照流程进行。
对于处理过程中的每一个细节都必须认真操作,以确保结果的准确性和可靠性。
环境卫生在进行病理科操作时,操作人员必须保持操作环境的清洁和卫生。
需要定期清洁操作台、工具和耗材,避免因环境污染而对样本造成影响。
病理科常见问题及建议样本数量不足在采集样本时,样本数量不足是常见的问题。
此时,应及时通知医师,重新采集样本。
同时,在操作时应适度保留,以防止样本损失。
样本标识不全样本标识不全可能会导致样本混淆和误判的出现。
此时,应立即停止操作并及时通知医师,确保标识齐全和准确。
操作流程不规范在进行操作时,必须按照规范的流程进行,避免操作不规范导致的误诊和误判。
操作环境不卫生操作环境的卫生对样本的质量有着重要的影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
病理科免疫组化制片和结果判读规程
免疫组化染色已经成为现代病理学中不可或缺的重要工具,准确的免疫组化染色极大地帮助病理诊断,或提供准确的分子治疗靶标;而不准确的免疫组化染色反而产生误导,造成误诊。
因此必须对影响免疫组化染色的各个环节进行严格的质控,对技术人员和进行培训,保证准确的染色结果。
1、免疫组化染色相关操作人员必须经过专门的培训和授权。
2、每一批次的免疫组化染色必须设阳性和阴性对照,可利用组织中的内对照。
3、必须建立本实验室免疫组化染色的操作规程,并根据染色效果及时更新。
4、更换抗体或试剂后,需要用阳性和阴性组织对新试剂进行有效性验证,并有相应的文字记录和染色切片档案,相关档案保留2年。
5、免疫组化染色过程中产生的有毒液体(如DAB)应专门回收,严禁随处倾倒。
6、免疫组化染色结果必须由病理医师结合形态学综合判断,并将染色结果写到病理报告中。
- 1 -。
