高中化学常见离子检验(修订)
高中化学离子检验(全)

高中化学离子检验(全)高中化学离子检验H+的检验使用试剂:石蕊试液,Na2CO3溶液或pH试纸。
操作步骤和反应现象:将含有H+的溶液取出放入试管中,滴加Na2CO3溶液,会产生气泡。
将溶液用玻璃棒蘸取少量滴到蓝色石蕊试纸或pH试纸上,会呈现红色。
离子方程式:2H++CO32- CO2↑+H2O。
Na+、K+的检验使用试剂:XXX、HCl。
操作步骤和反应现象:取含钠离子的溶液,用烧过的铂丝蘸溶液或固体少许在酒精灯焰上灼烧,观察会出现黄色火焰。
用蘸HCl溶液烧铂丝进行清洗,直到看不出黄色为止,再取K+盐或其溶液在酒精灯焰上灼烧,透过钴玻璃片观察会出现紫色火焰。
NH4+的检验使用试剂:浓HCl、NaOH溶液、红色石蕊试纸。
操作步骤和反应现象:取含NH4+的盐或溶液加入浓NaOH溶液后加热,会产生气体,接触湿润红色石蕊试纸会变蓝。
或者用玻璃棒蘸上浓HCl挨近上述气体时冒大量白烟。
离子方程式或化学方程式:NH4++OH- NH3↑+H2O,NH3+H2O NH3•H2O,NH3+HCl NH4Cl。
Mg2+检验使用试剂:NaOH溶液。
操作步骤和反应现象:将含Mg2+的溶液中加入NaOH溶液,会生成白色不溶于过量NaOH的沉淀。
离子方程式:Mg2++2OH- Mg(OH)2↓。
Al3+的检验使用试剂:NaOH溶液,HCl溶液。
操作步骤和反应现象:在含有Al3+的溶液中滴加少量NaOH溶液,会产生白色絮状沉淀。
过量NaOH溶液沉淀会溶解,白色状沉淀也会溶于盐酸。
离子方程式:Al3++3OH-Al(OH)3↓,Al(OH)3+OH- AlO2-+2H2O,Al(OH)3+3H+Al3++3H2O。
Cu2+的检验使用试剂:NaOH溶液,NH3•H2O。
操作步骤和反应现象:取含Cu2+的蓝色溶液加入NaOH 溶液,会生成蓝色的沉淀。
再加NH3•H2O振荡,会呈现深蓝色溶液。
离子方程式:Cu2++2OH- Cu(OH)2↓,Cu(OH)2+4NH3 Cu(NH3)4(OH)2.Fe2+的检验使用试剂:NaOH溶液。
高中化学知识点总结之常见离子检验(可编辑修改word版)
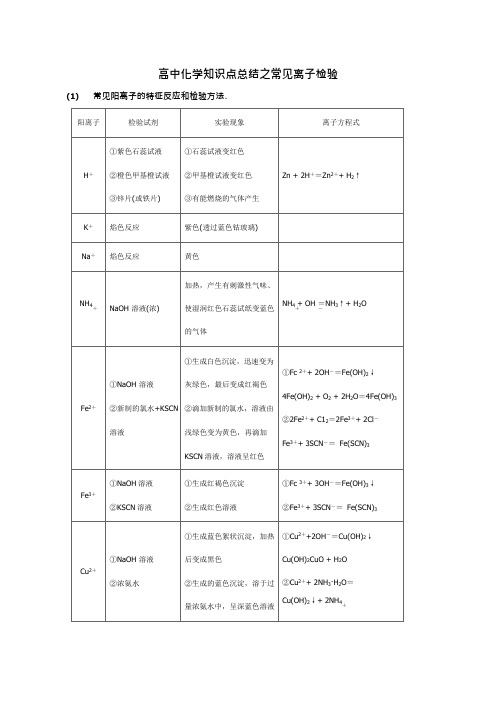
(1)常见阳离子的特征反应和检验方法.
阳离子
检验试剂
实验现象
离子方程式
H+
①紫色石蕊试液
②橙色甲基橙试液
③锌片(或铁片)
①石蕊试液变红色
②甲基橙试液变红色
③有能燃烧的气体产生
Zn + 2H+=Zn2++ H2↑
K+
焰色反应
紫色(透过蓝色钴玻璃)
Na+
焰色反应
黄色
NH4
+
NaOH溶液(浓)
加热,产生有刺激性气味、
使湿润红色石蕊试纸变蓝色的气体
NH4+ OH=NH3↑+ H2O
+-
①NaOH溶液
②新制的氯水+KSCN溶液
①生成白色沉淀,迅速变为灰绿色,最后变成红褐色
②滴加新制的氯水,溶液由浅绿色变为黄色,再滴加
KSCN溶液,溶液呈红色
Fe2+
①Fc2++ 2OH-=Fe(OH)2↓4Fe(OH)2+ O2+ 2H2O=4Fe(OH)3
①产生白色沉淀
②产生白色胶状沉淀,过量的NaOH溶液使沉淀溶解
①A13++3NH3·H2O=
Al(OH)3↓+3NH4
+
Al3+
②A13++ 3Oபைடு நூலகம்-=Al(OH)3↓
A1(OH)3+ OH-=A1O2+ 2H2O
-
Mg2+
NaOH溶液
产生白色絮状沉淀,过量的
NaOH溶液不能使沉淀溶解
Mg2++2OH-=Mg(OH)2↓
Ca2+
Na2CO3溶液+稀盐酸
产生白色沉淀,沉淀溶于稀
高中化学常见离子检验大全(精品范文).doc

【最新整理,下载后即可编辑】(一)常见阳离子的检验方法
2Fe2++ Cl
2Fe3++
2
2Cl-
Fe3++3SCN-=
Fe(SCN)
3
即显红色。
-+8H+
5Fe2+ + MnO
4
5Fe3+ +Mn2++4 H
O
2
(二)常见阴离子的检验方法
【最新整理,下载后即可编辑】 注意:
1.若SO 42-与Cl-同时检验,需注意检验顺序。
应先用Ba(NO 3)2溶液将SO 42-检出,并滤去BaSO 4,然后再用AgNO 3检验Cl-。
2.检验SO 32-的试剂中,只能用盐酸,不能用稀硝酸。
因为稀硝酸能把SO 32-氧化成SO 42-。
3.若Ag +和Ba 2+同时检验,也需注意检验顺序,应先用盐酸将Ag +检验出并滤去沉淀,然后再用稀硫酸检验Ba 2+。
4.若Ag +和Ba 2+同时检验,也需注意检验顺序,应先用盐酸将Ag +检验出
5.若CO 32-和HCO 3-同时检验,应先用足量的BaCl 2溶液将CO 32-检出,静置,取上层清夜用Ba(OH)2或Ca(OH)2检出HCO 3-。
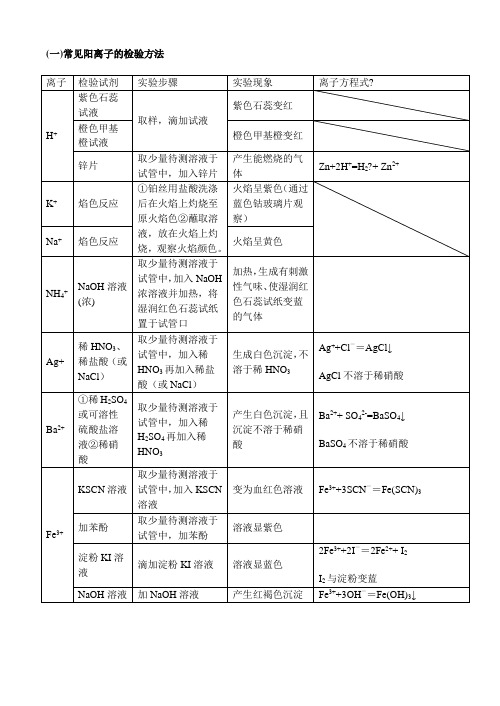
高中化学常见离子检验(修订)
NO3-浓溶液或晶体中加入铜片、浓硫酸加热,放出红棕色气体。
(一)常见阳离子的检验方法
离子
检验试剂
实验步骤
实验现象
离子方程式?
H+
紫色石蕊试液
取样,滴加试液
紫色石蕊变红
橙色甲基橙试液
橙色甲基橙变红
锌片
取少量待测溶液于试管中,加入锌片
产生能燃烧的气体
Zn+2H+=H2+ Zn2+
K+
焰色反应
①铂丝用盐酸洗涤后在火焰上灼烧至原火焰色②蘸取溶液,放在火焰上灼烧,观察火焰颜色。
Mg2+
NaOH溶液、NH4Cl溶液
取少量待测溶液于试管中,逐滴加入NaOH溶液至过量
生成白色沉淀,该沉淀不溶于过量NaOH溶液
Mg2++2OH-=Mg(OH)2↓
Ca2+
Na2CO3溶液 稀盐酸
取少量待测溶液于试管中,加入Na2CO3溶液,再加入稀盐酸
产生白色沉淀,且沉淀溶于稀盐酸
Ca2++CO32-=CaCO3↓
4Fe(OH)2十O2+2H2O=4Fe(OH)3
(无其它还原性物质如SO32-)酸性高锰酸钾
取少量待测溶液于试管中,加入酸性高锰酸钾溶液
加入酸性高锰酸钾溶液紫色褪去
Al3+
NaOH溶液
取少量待测溶液于试管中,逐滴加入NaOH溶液至过量
加入适量NaOH溶液后生成白色沉淀,该沉淀溶于过量NaOH溶液中
加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色。
高中化学常见离子检验篇

高中化学常见离子检验篇WTD standardization office【WTD 5AB- WTDK 08- WTD 2C】常见物质性质小结之离子检验篇下面这些,完全可以在化学推断题、实验设计题中直接使用。
像亚铁离子这种有多种检验方法的,一般情况下选用第一种,有时候可用第二种,第三种等(如实验条件限制,原溶液中所含离子颜色干扰等)一、阳离子1.氢离子(H+):取少量溶液,滴加紫色石蕊试液或甲基橙试液,溶液显红色,则可证明溶液中含有氢离子。
2.钠离子(Na+):焰色反应,火焰呈黄色。
3.钾离子(K+):焰色反应,透过蓝色钴玻璃观察,火焰呈蓝色。
4.钡离子(Ba2+):取少量溶液,加稀盐酸酸化,无明显现象(排除Ag+),再滴加稀硫酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有钡离子。
5.镁离子(Mg2+):取少量溶液,滴加NaOH溶液,析出白色沉淀且沉淀溶于NH4Cl溶液,则可证明溶液中含有镁离子。
6.铝离子(Al3+):取少量溶液,逐滴滴加NaOH溶液,先析出白色絮状沉淀,然后沉淀消失,则可证明溶液中含有铝离子。
7.银离子(Ag+):取少量溶液,滴加稀盐酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有银离子。
8.铵离子(NH4+):取适量溶液,加入浓的NaOH溶液并加热,放出能使湿润的红色石蕊试纸变蓝的刺激性气味气体,则可证明溶液中含有铵离子。
9.亚铁离子(Fe2+):①取少量浅绿色溶液,滴加NaOH溶液,先生成白色沉淀,迅速变为灰绿色,最后沉淀变为红褐色,则可证明溶液中含有亚铁离子。
(请注意“先”“迅速”“最后”,不要更改) ②取少量浅绿色溶液,加入KSCN溶液,不显红色,滴加少量新制氯水,溶液立即显红色(或血红色),则可证明溶液中含有亚铁离子。
10.三价铁离子(Fe3+):①取少量黄色溶液,滴加KSCN溶液,溶液变为血红色,则可证明溶液中含有三价铁离子。
②取少量黄色溶液,滴加NaOH溶液,生成红褐色沉淀,则可证明溶液中含有三价铁离子。
离子的检验

一、常见阳离子的检验1、Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH溶液.2、Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水.3、Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸.4、Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸.②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解.5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3].②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红.6、Fe3+:①加入KSCN溶液,溶液变为血红色.②加入NaOH溶液,生成红褐色沉淀.7、Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2].②插入铁片或锌片,有红色的铜析出.8、NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝.9、H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红.二、常见阴离子的检验1、OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝.2、Cl-:加入AgNO3溶液,生成白色沉淀(AgCl).该沉淀不溶于稀硝酸,能溶于氨水.3、Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸.②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色.4、I-:①加入AgNO3溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸.②加入氯水和淀粉试液,溶液变蓝.5、 SO42-:加入BaCl2溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸.6、SO32-:①加入盐酸或硫酸,产生无色、有刺激性气味的气体(SO2),该气体可使品红溶液褪色.②加入BaCl2溶液,生成白色沉淀(BaSO3),该沉淀可溶于盐酸,产生无色、有刺激性气味的气体(SO2).7、S2-:①加入盐酸,产生臭鸡蛋气味的气体,且该气体可以使湿润的Pb(NO3)2试纸变黑.②能与Pb(NO3)2溶液或CuSO4溶液生成黑色的沉淀(PbS或CuS).8、CO32-:①加入CaCl2或BaCl2溶液,生成白色沉淀(CaCO3或BaCO3),将沉淀溶于强酸,产生无色、无味的气体(CO2),该气体能使澄清的石灰水变混浊.②加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向原溶液中加入CaCl2溶液,产生白色沉淀.9、HCO3-:加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向原溶液中加入CaCl2溶液,无明显现象.10、NO3-:向浓溶液中加入铜片、浓硫酸加热,放出红棕色、有刺激性气味的气体(NO2).碘钟反应碘钟反应是一种化学振荡反应,其体现了化学动力学的原理。
常见离子检验大全.docx
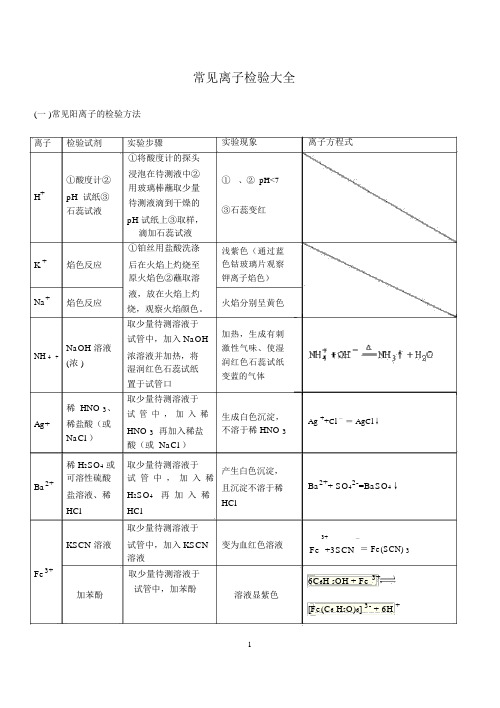
常见离子检验大全(一 )常见阳离子的检验方法离子检验试剂实验步骤①将酸度计的探头①酸度计②浸泡在待测液中②用玻璃棒蘸取少量H+pH 试纸③待测液滴到干燥的石蕊试液pH 试纸上③取样,滴加石蕊试液①铂丝用盐酸洗涤K +焰色反应后在火焰上灼烧至原火焰色②蘸取溶Na+焰色反应液,放在火焰上灼烧,观察火焰颜色。
取少量待测溶液于NaOH 溶液试管中,加入 NaOHNH 4+浓溶液并加热,将(浓 )湿润红色石蕊试纸置于试管口稀 HNO 3、取少量待测溶液于试管中,加入稀Ag+稀盐酸(或HNO 3再加入稀盐NaCl )酸(或 NaCl )实验现象①、② pH<7③石蕊变红浅紫色(通过蓝色钴玻璃片观察钾离子焰色)火焰分别呈黄色加热,生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体生成白色沉淀,不溶于稀 HNO 3离子方程式Ag ++Cl -= AgCl↓稀 H2SO4或取少量待测溶液于产生白色沉淀,可溶性硫酸试管中,加入稀Ba2+且沉淀不溶于稀盐溶液、稀H2SO4再加入稀HClHCl HCl取少量待测溶液于KSCN 溶液试管中,加入 KSCN变为血红色溶液溶液Fe3+取少量待测溶液于加苯酚试管中,加苯酚溶液显紫色Ba2++ SO42-=BaSO4↓3+-Fe +3SCN= Fe(SCN) 36C6H 5OH + Fe 3+[Fe(C6 H5O)6] 3- + 6H +淀粉 KI溶滴加淀粉 KI 溶液溶液显蓝色2Fe3++2I-=2Fe2++ I 2液加 NaOH 溶加 NaOH 溶产生红褐色沉淀Fe3++3OH -= Fe(OH) 3↓液离子检验试剂实验步骤实验现象离子方程式Fe2+Al 3+2+ CuMg 2+①KSCN 溶取少量待测溶液于加入 KSCN 溶液不显红色,加入液,新制的试管中,加入 KSCN少量新制的氯水氯水溶液,新制的氯水后,立即显红色。
取少量待测溶液于开始时生成白色②NaOH 溶试管中,加入 NaOH 沉淀,迅速变成液溶液并露置在空气灰绿色,最后变中成红褐色沉淀。
高中常见离子检验方法

高中常见离子检验方法
1. 火焰试验:将待检离子溶液挂在锥形玻璃棒上,送入酒精灯火焰中,观察火焰的颜色和特点变化。
2. 沉淀法:将待检离子溶液与特定试剂混合,观察是否生成沉淀或颜色变化。
3. 电化学法:利用电化学方法,如电解或电沉积法来检验离子。
4. 复分析法:通过多种化学反应组合,将待检离子与已知离子进行比较,以确定待检离子的种类和含量。
5. 分光光度法:利用光谱仪测量溶液对特定波长的光的吸收或发射特性,来分析离子的含量和浓度。
6. 离子交换法:利用离子交换树脂对离子交换特性进行分析。
高中化学常见离子检验(可以直接打印)
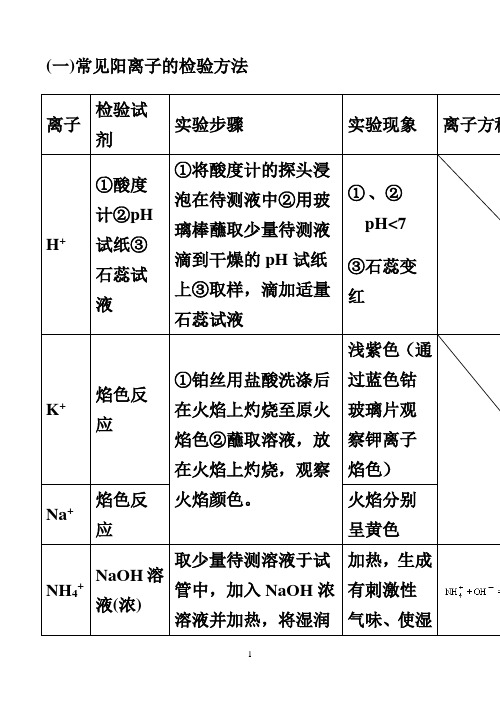
(一)常见阳离子的检验方法(二)常见阴离子的检验方法注意:1.若SO42-与Cl-同时检验,需注意检验顺序。
应先用Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再用AgNO3检验Cl-。
2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸。
因为稀硝酸能把SO32-氧化成SO42-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
4.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出5.若CO32-和HCO3-同时检验,应先用足量的BaCl2溶液将CO32-检出,静置,取上层清夜用Ba(OH)2或Ca(OH)2检出HCO3-三:常见气体的检验物质检验的一般程序及答题要领⑴实验操作:通常分两步进行,第一步取少量试样(如试样是固体的要先配制成溶液)放入容器(通常用试管)。
第二步各取少许溶液,根据要求在试样中加入已知成分和性质的试剂,并根据所发生的现象,进行分析、判断,作出结论。
⑵答题要领:①不许用原瓶操作:鉴别的目的是为了以后的使用,若用原瓶操作,污染了原瓶中的试剂。
要有“各取少许”字样。
②不许“指名道姓”:结论的得出,来自实验现象,在加入试剂之前,该物质是未知的,应该叙述为“若……(现象),则证明有……”,叙述时不可出现“取某某物质加入某某试剂……”的字样,一般间答顺序为:各取少许→溶解→加入试剂→描述现象→得出结论。
气体检验方法和思路:⑴检验气体的思路一般从以下几个方面考虑①气体的颜色和气味;②②水溶液的酸碱性;③③助燃、可燃及燃烧现象和产物;④④遇空气的变化;⑤⑤其它特性。
⑵方法:①观察法:对于有特殊颜色的气体如Cl2(黄绿色)、NO2(红棕色)、I2蒸汽(紫色)科举颜色辨别。
②溶解法:根据溶于水现象不同区分。
如NO2和Br2蒸汽均为红棕色,但溶于水后NO2形成无色溶液,Br2形成橙色溶液。
③退色法:如SO2和CO2克用品红溶液区分。
高中化学常见离子检验大全

Cu2+
NaOH溶液
取少量待测溶液于 试管中,加入
NaOH溶液
加入话量NaOH
溶液后生成蓝色 沉淀
Cu2++2OH J Cu(OH)2J
2+
NaOH溶液
取少量待测溶液于 试管中,加入
NaOH溶液
加入话量NaOH
溶液后生成白色 沉淀,该沉淀不
溶于过量NaOH
生成不溶于稀 盐酸的白色沉 淀
Ba2++ SO42-=BaSO4J
SO32-
①稀盐酸、 品红溶液
取少量待测溶液 于试管中,加入 稀盐酸后放出的 气体通入品红溶 液
加入稀盐酸后 放出的气体使 品红溶液褪色
SO32-+2H+=H2O+SO2?
②BaCl2溶
液、稀盐酸
取少量待测溶液 于试管中,加入BaCl2溶液再向沉 淀中加入稀盐 酸。
浅紫色(通过蓝 色钴玻璃片观察 钾离子焰色)
Na+
焰色反应
火焰分别呈黄色
NH4+
NaOH溶液
(浓)
取少量待测溶液于 试管中,加入NaOH浓溶液并加 热,将湿润红色石 蕊试纸置于试管口
加热,生成有刺 激性气味、使湿 润红色石蕊试纸 变蓝的气体
WH;+0H-十也0
Ag+
稀HNO3、
稀盐酸(或
NaCl)
取少量待测溶液于 试管中,加入稀HNO3再加入稀盐
溶液中
Mg2++2OH—=Mg(OH)2J
(仅用于鉴别Mg2+和Al3+)
(二)常见阴离子的检验方法
高中各离子或物质的检验方法

高中各离子或物质的检验方法一、常见阳离子的检验1、 Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH溶液。
2、 Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。
3、 Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。
4、 Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。
②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。
5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3]。
②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。
6、 Fe3+:①加入KSCN溶液,溶液变为血红色。
②加入NaOH溶液,生成红褐色沉淀。
7、 Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2]。
②插入铁片或锌片,有红色的铜析出。
8、 NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3)①使沾有浓HCL的玻璃棒冒白烟。
②使湿润的红色石蕊试纸变蓝。
9、 H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红。
10、Ca2+:①焰色反应砖红色。
②加入Na2CO3后产生白色沉淀。
11、K+:焰色反应紫色12、Na+:焰色反应黄色二、常见阴离子的检验1、 OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。
2、 Cl-:加入稀HNO3酸化的AgNO3溶液,生成白色沉淀(AgCl)。
该沉淀不溶于稀硝酸,能溶于氨水。
3、 Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。
②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色。
4、 I-:①加入AgNO3溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸。
高中化学常见离子检验修订
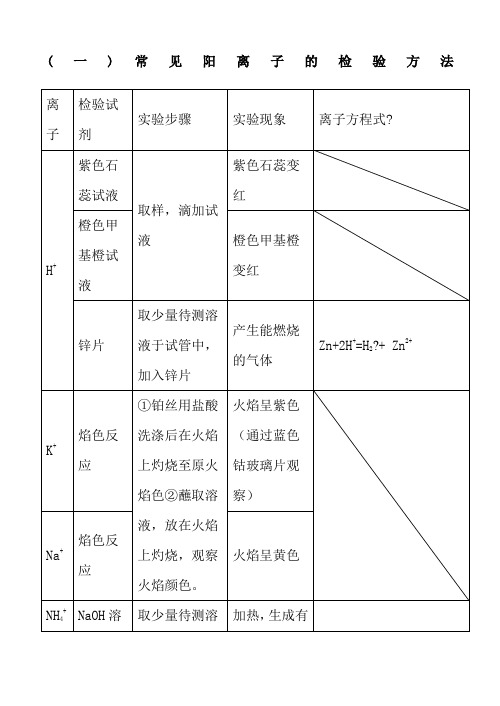
(一)常见阳离子的检验方法加苯酚取少量待测溶液于试管中,加苯酚溶液显紫色淀粉KI 溶液滴加淀粉KI溶液溶液显蓝色2Fe3++2I-=2Fe2++ I2I2与淀粉变蓝NaOH溶液加NaOH溶液产生红褐色沉淀Fe3++3OH-=Fe(OH)3↓Fe2+ ①KSCN溶液○2新制的氯水取少量待测溶液于试管中,加入KSCN溶液,新制的氯水加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色。
2Fe2++ Cl22Fe3++ 2Cl-Fe3++3SCN-=Fe(SCN)3加NaOH溶液取少量待测溶液于试管中,加入NaOH溶液并露置在空气中开始时生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。
Fe2++2OH —=Fe(OH)2↓4Fe(OH)2十O2+2H2O=4Fe(OH)3(二)常见阴离子的检验方法注意:1.若SO42-与Cl-同时检验,需注意检验顺序。
应先用Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再用AgNO3检验Cl-。
2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸。
因为稀硝酸能把SO32-氧化成SO42-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
4.若CO32-和HCO3-同时检验,应先用足量的BaCl2溶液将CO32-检出,静置,取上层清夜用Ba(OH)2或Ca(OH)2检出HCO3-NO3-浓溶液或晶体中加入铜片、浓硫酸加热,放出红棕色气体。
高中化学常见离子检验修订

(一)常见阳离子检验方法Zn+2H+=H2+ Zn2+NH4+NaOH溶液(浓)溶液于试管中,参加NaOH浓溶液并加热,将湿润红色石蕊试纸置于试管口加热,生成有刺激性气味、使湿润红色石蕊试纸变蓝气体Ag+稀HNO3、稀盐酸〔或NaCl〕取少量待测溶液于试管中,参加稀HNO3再参加稀盐酸〔或NaCl〕生成白色沉淀,不溶于稀HNO3Ag++Cl-=AgCl↓AgCl不溶于稀硝酸Ba2+①稀H2SO4或可溶性硫酸盐溶液②稀硝酸取少量待测溶液于试管中,参加稀H2SO4再参加稀HNO3产生白色沉淀,且沉淀不溶于稀硝酸Ba2++ SO42-=BaSO4↓BaSO4不溶于稀硝酸Fe3+KSCN溶液溶液于试管中,参加KSCN溶液变为血红色溶液Fe3++3SCN-=Fe(SCN)3加苯酚取少量待测溶液于试管中,加苯酚溶液显紫色淀粉KI溶液滴加淀粉KI溶液溶液显蓝色2Fe3++2I-=2Fe2++ I2I2与淀粉变蓝NaOH溶液加NaOH溶液产生红褐色沉淀Fe3++3OH-=Fe(OH)3↓Fe2+①KSCN溶液○2新制氯水取少量待测溶液于试管中,参加KSCN溶液,新制氯水参加KSCN溶液不显红色,参加少量新制氯水后,立即显红色。
2Fe2+ + Cl22Fe3+ +2Cl-Fe3++3SCN-=Fe(SCN)3Al3++3NH3H2O=Al(OH)3+3NH4+Ca2++ CO32-=CaCO3↓CaCO3+2H+= Ca2++ CO2+ H2O〔二〕常见阴离子检验方法注意:1.假设SO42-与Cl-同时检验,需注意检验顺序。
应先用Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再用AgNO3检验Cl-。
2.检验SO32-试剂中,只能用盐酸,不能用稀硝酸。
因为稀硝酸能把SO32-氧化成SO42-。
3.假设Ag+与Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
(完整word版)高中化学常见离子的检验和物质的鉴别
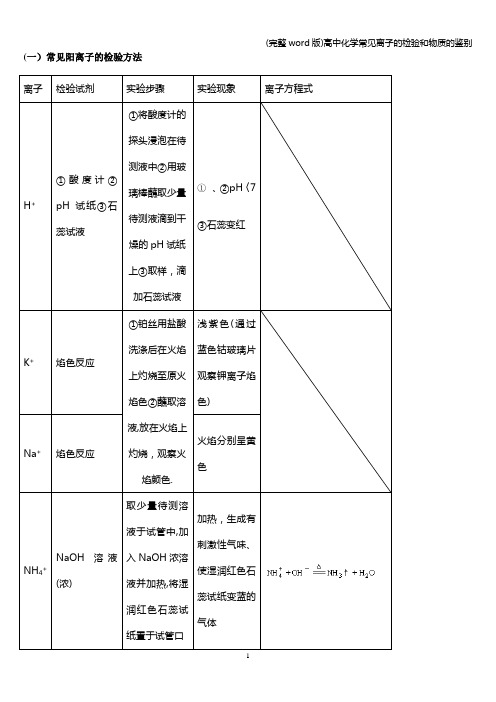
(一)常见阳离子的检验方法离子检验试剂实验步骤实验现象离子方程式H+①酸度计②pH试纸③石蕊试液①将酸度计的探头浸泡在待测液中②用玻璃棒蘸取少量待测液滴到干燥的pH试纸上③取样,滴加石蕊试液①、②pH〈7③石蕊变红K+焰色反应①铂丝用盐酸洗涤后在火焰上灼烧至原火焰色②蘸取溶液,放在火焰上灼烧,观察火焰颜色.浅紫色(通过蓝色钴玻璃片观察钾离子焰色)Na+焰色反应火焰分别呈黄色NH4+NaOH溶液(浓)取少量待测溶液于试管中,加入NaOH浓溶液并加热,将湿润红色石蕊试纸置于试管口加热,生成有刺激性气味、使湿润红色石蕊试纸变蓝的气体Fe2+①KSCN溶液,新制的氯水①取少量待测溶液于试管中,加入KSCN溶液,新制的氯水①加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色.2Fe2++ Cl22Fe3++2Cl—Fe3++3SCN-=Fe(SCN)3②加NaOH溶液②取少量待测溶液于试管中,加入NaOH溶液并露置在空气中②开始时生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。
Fe2++2OH —=Fe(OH)2↓4Fe(OH)2十O2+2H2O=4Fe(OH)3②加K3[Fe(CN)6]取少量待测溶液于试管中,加入铁氰化钾特征性蓝色沉淀Al3+NaOH溶液取少量待测溶液于试管中,逐滴加入NaOH溶液至过量加入适量NaOH溶液后生成白色沉淀,该沉淀溶于过量NaOH溶液中Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+2H2O(二)常见阴离子的检验方法注意:1.若SO42-与Cl-同时检验,需注意检验顺序。
应先用Ba(NO3)2溶液将SO42—检出,并滤去BaSO4,然后再用AgNO3检验Cl-。
2.检验SO32—的试剂中,只能用盐酸,不能用稀硝酸.因为稀硝酸能把SO32—氧化成SO42—.3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
高中化学中各种离子的检验方法

高中化学中各种离子的检验方法
K+:焰色反应紫色
Na+:焰色反应黄色
加入SO42-产生不溶于稀硝酸的白色沉淀。
Ca2+:焰色反应砖红色,加入Na2CO3后产生白色沉淀
加入NaOH后先产生白色沉淀,后沉淀溶解。
Fe3+:加入KSCN变为血红色或加苯酚变为紫色。
先检验原溶解液无Fe3+,先加强氧化剂(K2Cr2O7、
HNO3、H2O2酸性KMnO4、HClO……)然后检验有没有Fe3+。
一般为蓝色溶液,加入OH-产生蓝色沉淀。
Ag+:加入Cl-产生不溶于稀HNO3的白色沉淀。
NH4+:加入OH-,加热产生无色气体,可使紫色石蕊试纸变蓝。
NO3-:加入H+、Fe产生红棕色气体,或无色气体与O2反应后显红棕色。
CL-:加入Ag+产生不溶于稀HNO3的白色沉淀。
Br-:加入Ag+产生不溶于稀HNO3的浅黄色沉淀。
I-:加入Ag+产生不溶于稀HNO3的黄色沉淀。
SO42-:加入Ba2+产生不溶于稀HNO3的白色沉淀。
加入Ca2+产生白色沉淀,加入H+产生气体,能使品红褪色。
HSO3-:加入Ca2+产生白色沉淀,加入H+产生气体,能使品红褪色。
CO32-:加入Ca2+产生白色沉淀,加入H+产生气体,
不能使品红褪色。
HCO3-:加入Ca2+不产生白色沉淀,加入H+产生气体,不能使品红褪
S2-:加入Cu2+产生黑色沉淀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(一)常见阳离子的检验方法
离子检验试剂实验步骤实验现象离子方程式
H+紫色石蕊
试液
取样,滴加试液
紫色石蕊变红
橙色甲基
橙试液
橙色甲基橙变红
锌片
取少量待测溶液于
试管中,加入锌片
产生能燃烧的气
体
Zn+2H+=H2 + Zn2+
K+焰色反应①铂丝用盐酸洗涤
后在火焰上灼烧至
原火焰色②蘸取溶
液,放在火焰上灼
烧,观察火焰颜色。
火焰呈紫色(通过
蓝色钴玻璃片观
察)
Na+焰色反应火焰呈黄色
NH4+NaOH溶液
(浓)
取少量待测溶液于
试管中,加入NaOH
浓溶液并加热,将
湿润红色石蕊试纸
置于试管口
加热,生成有刺激
性气味、使湿润红
色石蕊试纸变蓝
的气体
Ag+ 稀HNO3、
稀盐酸(或
NaCl)
取少量待测溶液于
试管中,加入稀
HNO3再加入稀盐
酸(或NaCl)
生成白色沉淀,不
溶于稀HNO3
Ag++Cl-=AgCl↓
AgCl不溶于稀硝酸
Ba2+①稀H2SO4
或可溶性
硫酸盐溶
液②稀硝
酸
取少量待测溶液于
试管中,加入稀
H2SO4再加入稀
HNO3
产生白色沉淀,且
沉淀不溶于稀硝
酸
Ba2++ SO42-=BaSO4↓
BaSO4不溶于稀硝酸
Fe3+KSCN溶液
取少量待测溶液于
试管中,加入KSCN
溶液
变为血红色溶液Fe3++3SCN-=Fe(SCN)3加苯酚
取少量待测溶液于
试管中,加苯酚
溶液显紫色
淀粉KI溶
液
滴加淀粉KI溶液溶液显蓝色
2Fe3++2I-=2Fe2++ I2
I2与淀粉变蓝
NaOH溶液加NaOH溶液产生红褐色沉淀Fe3++3OH-=Fe(OH)3↓
Fe2+ ①KSCN溶
液○2新制
的氯水
取少量待测溶液于
试管中,加入KSCN
溶液,新制的氯水
加入KSCN溶液
不显红色,加入少
量新制的氯水后,
立即显红色。
2Fe2+ + Cl22Fe3+ + 2Cl-
Fe3++3SCN-=Fe(SCN)3
加NaOH溶
液
取少量待测溶液于
试管中,加入NaOH
溶液并露置在空气
中
开始时生成白色
Fe(OH)2沉淀,迅
速变成灰绿色,最
后变成红褐色
Fe(OH)3沉淀。
Fe2++2OH —=Fe(OH)2↓
4Fe(OH)2十O2+2H2O=4Fe(OH)3
(无其它
还原性物
质如SO32-)
酸性高锰
酸钾
取少量待测溶液于
试管中,加入酸性
高锰酸钾溶液
加入酸性高锰酸
钾溶液紫色褪去
Al3+NaOH溶液
取少量待测溶液于
试管中,逐滴加入
NaOH溶液至过量
加入适量NaOH
溶液后生成白色
沉淀,该沉淀溶于
过量NaOH溶液
中
Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=AlO2-+ 2H2O
氨水
取少量待测溶液于
试管中,加入氨水
生成白色沉淀Al3++3NH3⋅H2O= Al(OH)3+3NH4+
Cu2+NaOH溶液取少量待测溶液于
试管中,加入NaOH
溶液
加入适量NaOH
溶液后生成蓝色
沉淀
Cu++2OH-=Cu(OH)2↓
Mg2+ NaOH溶
液、NH4Cl
溶液
取少量待测溶液于
试管中,逐滴加入
NaOH溶液至过量
生成白色沉淀,该
沉淀不溶于过量
NaOH溶液
Mg2++2OH-=Mg(OH)2↓
Ca2+○1Na2CO3
溶液○2稀
盐酸
取少量待测溶液于
试管中,加入
Na2CO3溶液,再加
入稀盐酸
产生白色沉淀,且
沉淀溶于稀盐酸
Ca2++ CO32-=CaCO3↓
CaCO3+2H+= Ca2++ CO2↑+ H2O
(二)常见阴离子的检验方法
注意:
1.若SO42-与Cl-同时检验,需注意检验顺序。
应先用Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再用AgNO3检验Cl-。
2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸。
因为稀硝酸能把SO32-氧化成SO42-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
4.若CO32-和HCO3-同时检验,应先用足量的BaCl2溶液将CO32-检出,静置,取上层清夜用Ba(OH)2或Ca(OH)2检出HCO3-
NO3-浓溶液或晶体中加入铜片、浓硫酸加热,放出红棕色气体。
