1.7分子间作用势能与真实气体物态方程讲解
1.7分子间作用势能与真实气体物态方程

2、利用分子势能曲线解释固体内分子的运动是振动
分子振动 的平衡位
置曲线
表示总能量 不变的曲线
3、利用分子势能曲线解释固体的热膨胀
r
r'
r" 2
r0
r 随着温度上升而增加,因而产生线膨胀。
四、范德瓦耳斯方程
• 1873年荷兰物理学家范德瓦耳斯针对理想气体的两条基本 假定:
• 忽略分子固有体积、 • 忽略除碰撞外分子间相互作用力 • 作出了两条重要修正,得出了能描述真实气体行为的范德
• 气体分子每与器壁碰撞往返一次所导致器壁的冲量减少了2△k的数值 (往返各减少△k )。
pi {单位时间内碰在单位面积上平均分子数} 2k
(1 / 6)nv 2k
△k与分子数密度n 成正比,设比例系数为K,1 nv 2Kn 6
( N A )2 v 2( K
排斥力 吸引力
用势能来表示相互作用要比直接用 力来表示相互作用方便有用,所以 分子互作用势能曲线常被用到。
势能极小值
平衡位置 平衡位置
三、碰撞有效直径、固体分子热振动、固体热膨胀 1、用分子势能曲线解释分子间对心碰撞
表示动能的横坐标
表示势能的横坐标
表示两分 子碰撞时 挤压情况
在图中a2向 a1靠近时,在相互距离为d 时,它们受到的挤压达到最大,然 后a2反向运动。所以
分子吸引力作用半径的存在:
只有当分子质心相互接近到某一距离内,分 子间相互吸引力才较显著,把这一距离称为 ---分子吸引力作用半径。
很多物质的分子引力作用半径约为分子直径的2-4倍左 右,超过这一距离,分子间相互作用力已很小,可予 忽略。
(2)排斥力 能说明排斥力的现象: ①固体、液体都很难压缩; ②气体分子经过碰撞而相互远离。 排斥力作用半径:
实际气体状态方程PPT课件

v
图2 p v 图上的等温线
第30页/共103页
理想气体等容线为直线,实际气体等容线不为直线
lim(
p0
2 p T 2
)v
0
lim(
T
2 p T 2
)
v
图2 p T 图上的等容线
第31页/共103页
第 三 节 维 里 状 态 方 程
第32页/共103页
理论分析 数据拟合
方程模型 经验常数
特别注意: 使用范围
能量变化是离散型而不是连续型。
第23页/共103页
流体极性判别式(pitzer提出):
r
4 pc2
Tc4
(5)
式中,pc为临界压力,为偶极矩,T为c 临界温度。
非极性流体:
如:
微极性流体:
如:
强极性流体:
如:
r 0
CH 4 , C2 H6 , C3 H8 , C4 H8
r 0.5106
NO, NO2,CO, N2, R11, R12, R13, R114
方向出现的几率相同,则相互作用1平均 2势能 。
然而,按玻尔兹曼分布定律,温度越低, 和 在低
势能的相对方向出现的可EK能性0 越大,因此对各方向
加
和后
,
平
均
静
电Ek相互
作2 3
用12势22能
kTr6
,而是(2)
式中,r为两偶极矩中心距离,k为玻尔兹曼常数。
第14页/共103页
⑵诱导力(德拜力)
分子的电荷分布受到其他分子电场的影响,
(16)
和范德瓦尔斯方程不同的是内压力项, RK方程考虑到温度对分子相互作用力的影 响做出的新的假定。
§1.7 分子间作用力势能与真实气体物态方程
与分子作用力曲线所对应的互作用势能曲线
r
E p ( r ) F ( r )dr ~ r
在平衡位置 r = r0处,分子 力F(r) = 0,势能有极小值 , 它是负的. 在r>r0处,F(r)<0, 势能曲线斜率是正的—吸引 力
图中的 d 是两分子对心碰撞时相互接近最短 质心间距离,故称 d = 分子碰撞有效直径 当温度升高时,EK0 也增加,因而横轴升高, d 将减小,说明 d 与气体温度有关。 温度越高,d 越小。
• 设分子在相互分离时的吸 引力为球对称分布, 吸引力作用半径为R0, • 每一分子均有以 R0 为半径 的吸引力作用球。 • 气体内部的分子在越过界面层向器壁运动, 以及在与器壁碰撞以后返回、穿过界面层过 程中,都受到一指向气体内侧的力。
分子吸引力修正
器壁实际受到压强要比气体内部的压强小, 使气体施于器壁的压强减少了一个量值pi , 这称为气体内压强修正量。若仪器所测出的气 体压强为p, 则 p = p内 - pi 因气体内部分子受到其它分子吸引力的合力相 消,故气体的内部压强 p内 与分子吸引力无关. 气体内部压强等于理想气体压强 p内 = p理
(三) 范德瓦尔斯方程 (Van der Waals equation of state)
将△pi = a/Vm2 代入 p +△pi = RT/ (Vm-b)
得到
a ( p 2 )(Vm b) RT Vm
m 2 a m m [p( ) ( 2 )][V ( )b] RT Mm V Mm Mm
§1.7.1分子间互作用势能曲线
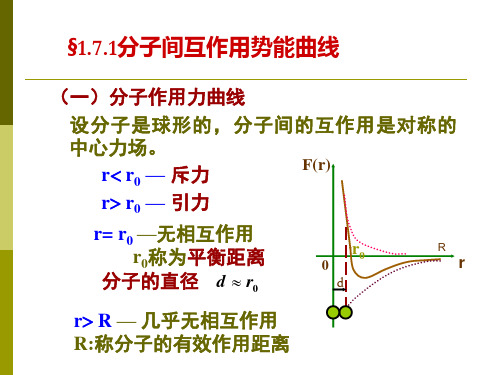
(一)分子作用力曲线 设分子是球形的,分子间的互作用是对称的 中心力场。 F(r) r r0 — 斥力 r r0 — 引力 r= r0 —无相互作用 r0称为平衡距离 分子的直径 d r0 r R — 几乎无相互作用 R:称分子的有效作用距离
重力场中真实气体内能与状态方程的关系

h
பைடு நூலகம்
kT
h
dh
1 Na
P
kT
气体的量为 1mol,(1.10)变为
气体的内能为:
Ep
1
P
RT
(1.11)
E
x RT 2
E p
(1.12)
对(1.12)对密度微分得到
E 1 P RT
E
E0
2b V
w2 P 1 P V 2 s M V
下面计算绝热下,P 和 V 的微分关系。由于绝热,
dQ dE PdV E dT E dV PdV 0 T V
(2.1) (2.2)
(2.3) (2.4)
E P dV dT V
uP
1 Na
Ep
(0.2)
外力作用下,气体密度不均匀,分子作用力在宏观表现为
f1
u p r
(0.3)
在外场作用下,气体的内部相互作用影响宏观分布,通过分析气体的宏观分布可以得 出气体的内能。本文主要研究重力场中气体。
这里讨论的气体密度 的单位是[mol/m3],后面要用到的一个密度 ' ,单位是[kg/m3]。
112对112对密度微分得到113考虑气体的量为1mol状态方程和声速之间的关系的推导状态方程可以改写为21由1105可以得到气体内能22音速的计算公式为23下面计算绝热下ppdvdvpdvdedq2425压强的微分式为dv2626代入26得到27将212718代入23得到28而密度比较小时有2929代入28得到210音速第二维里系数如下2113
气体动理论公式总结

气体动理论公式总结气体动理论是研究气体运动的基本理论,涉及到气体的压力、体积、温度等性质。
在研究气态物质的行为和性质时,气体动理论公式是非常重要的工具。
本文将对一些常用的气体动理论公式进行总结和解析。
1. 状态方程公式状态方程是描述气体状态的物理方程,常见的状态方程包括理想气体状态方程和范德华方程。
理想气体状态方程:PV = nRT其中,P表示气体的压力,V表示气体的体积,n表示气体的摩尔数,R为气体常数,T表示气体的绝对温度。
范德华方程:(P + an^2/V^2)(V - nb) = nRT其中,a和b为范德华常数,和实际气体分子之间的作用有关。
2. 理想气体状态方程的推导理想气体状态方程可以通过气体分子的平均动能推导得到。
根据气体分子的平均运动能量定理,可得到以下公式:KE = (3/2)kT其中,KE表示气体分子的平均动能,k为玻尔兹曼常数,T表示气体的绝对温度。
另外,气体分子的动能与气体分子的速度和质量有关:KE = (1/2)mv^2其中,m为气体分子的质量,v为气体分子的速度。
将上述两个公式相等,可以得到:(1/2)mv^2 = (3/2)kT由此,可以推导出理想气体状态方程:PV = (1/3)Nm<v^2>其中,N为气体分子的个数,<v^2>表示气体分子速度的平方的平均值。
3. 分子平均自由程公式分子平均自由程是指气体分子在碰撞间隔期间所飞过的平均距离。
分子平均自由程与气体分子的摩尔数、体积和气体分子直径有关。
分子平均自由程的公式为:λ = (1/√2) * (V/nπd^2)其中,λ表示分子平均自由程,V表示气体的体积,n表示气体的摩尔数,d表示气体分子的直径。
4. 均方根速度公式气体分子的运动速度可以用均方根速度来描述,均方根速度是指所有气体分子速度平方的平均值的平方根。
均方根速度的公式为:v(rms) = √(3kT/m)其中,v(rms)表示气体分子的均方根速度。
§1.7.5 几种典型的分子作用力势能曲线

p(Vm-b)= RT
(三)苏则朗模型
• 在刚球模型基础上,考虑到分子在相互分离时有吸引 力,其势能为 E ( r ) , 当 r d
p
E p (r ) Φ 0 (
r0 r
) ,当 r d
t
•其中t 是常数,
• 0 > 0, - 0 是 r = r0 时的势能, 通常t = 6 , 势能曲线如图(c)所示, 对应的物态方程是范氏方程。
*§1.7.5 几种典型的分子作用力势能曲线
• 由于分子间互作用的规律很复杂,很难用简单的数学 公式较精确地描述。
• 在统计物理中,一般是在实验基础上采用一些简化模 型来表示分子互作用势能的,
• 每一种模型都可有某一气体物态方程与之对应。下面
介绍几种典型的模型。
(一)体积趋于零的刚球模型
• 作为两分子质心距离r 的函数的势能满足
0
(四)米势
1907年米(Mie)提出了如下的分子或原子间势能的 表达式
A r
m
•
E p (r )
B r
n
• 其中A > 0,B > 0,n > m, • 式中第一项为吸引势,第二项为排斥 势,其排斥势作用半径比吸引势作用 半径小,其势能曲线由图(d)表示, 所对应方程为昂内斯方程。
理想气体物态方程

目录
• 理想气体定义 • 理想气体物态方程的应用 • 理想气体物态方程的特性 • 理想气体物态方程与其他物理量的关系 • 理想气体物态方程的实验验证
01
理想气体定义
理想气体假设
气体分子无体积、无相互作用, 且分子运动速度远大于分子间的
平均距离。
气体分子在容器内自由移动,不 受容器壁的限制,且不与容器壁
利用统计物理学和热力学的原理,通过数学推导得到理想气体物态方程的 表达式。
通过实验验证理想气体物态方程的正确性和适用范围,并不断修正和完善 方程的形式和参数。
02
理想气体物态方程的应 用
计算气体体积
总结词
理想气体物态方程可以用于计算气体 的体积。
详细描述
根据理想气体物态方程,气体的体积 V可以通过气体的物质的量n、气体常 数R和气体的热力学温度T计算得出。 公式为:V = nRT/P,其中P表示气体 的压力。
发生碰撞。
气体分子之间以及气体分子与容 器壁之间的碰撞可以忽略不计。
理想气体状态方程
• 理想气体状态方程是描述理想气体状态变 量之间关系的方程,即PV=nRT,其中P表 示压强,V表示体积,n表示摩尔数,R表 示气体常数,T表示温度。
理想气体物态方程的推导
从理想气体假设出发,通过分析气体分子运动和相互作用的微观过程,推 导出理想气体物态方程。
数据分析
对实验数据进行统计分析,计算误差范围和置信区间。
结果对比
将实验结果与理论值进行对比,分析误差来源和影响因子。
结果可靠性
评估实验结果的可靠性和稳定性,确保实验结论的可信度。
实验结论
01
理想气体物态方程的实验验证 表明,在一定条件下,理想气 体物态方程能够准确描述气体 的状态变化。
高三物理气体选修知识点

高三物理气体选修知识点在高三物理学习中,气体是一个重要的知识点。
掌握气体的性质、状态方程、分子运动和热力学过程等方面的知识,对于理解物质的宏观特性以及解决实际问题具有重要意义。
本文将介绍高三物理气体选修知识点,帮助同学们更好地掌握这一部分内容。
一、气体的性质在研究气体的性质时,常用的参数有压力、温度和体积。
压力是气体对容器壁的作用力,可用于描述气体的强弱程度;温度则与气体的分子平均动能直接相关;体积是气体所占据的空间大小。
二、状态方程气体的状态方程描述了气体的状态与压力、温度以及体积之间的关系。
理想气体状态方程可以表示为PV=nRT,其中P为气体的压力,V为气体的体积,n为气体的物质量,R为气体常数,T为气体的温度。
对于理想气体,该状态方程成立;而对于实际气体,可能需要考虑修正。
三、分子运动气体的性质与其中分子的运动方式密切相关。
分子在气体中以高速运动,并作无规则的碰撞。
分子间的碰撞会导致气体的压强,而分子运动的速度与温度直接相关。
分子运动的平均自由程与气体分子数量和体积之间有关,可用于描述气体的稀薄程度。
四、热力学过程热力学过程是气体学习的重点之一,主要包括等温过程、绝热过程、等容过程和等压过程。
在等温过程中,气体的温度保持不变,体积和压力呈反比关系;绝热过程中,气体无法与外界交换热量,体积和压力呈反比关系;等容过程中,体积保持不变,温度和压力呈正比关系;等压过程中,压力保持不变,温度和体积呈正比关系。
五、理想气体与实际气体理想气体是用来简化描述气体行为的模型,其中假设气体分子无体积、无吸引力和无相互作用。
实际气体则考虑了分子间的相互作用和体积,其状态方程需要进行修正,例如范德瓦尔斯方程和爱因斯坦方程。
六、气体的溶解度气体在液体中的溶解度也是气体学习的一部分。
溶解度与气体分压和温度成正比,与液体的性质有关。
亨利定律描述了气体在线性温度范围内的溶解度与分压的关系。
通过对以上知识点的学习,我们能够更好地理解气体的性质和行为规律,掌握气体的状态方程以及热力学过程。
物态方程知识点

物态方程知识点物态方程(也称状态方程)是描述物质物态变化的数学关系,通常表示为PV = nRT,其中P为气体的压强,V为气体的体积,n为气体的物质量(摩尔数),R为气体常数,T为气体的温度。
物态方程是研究气体性质和热力学过程的基础。
一、理想气体物态方程理想气体物态方程是对理想气体性质的描述。
理想气体是指气体分子之间没有相互作用力的气体,在高温、低压下表现出理想气体行为。
在理想气体状态下,物态方程可以表示为PV = nRT。
其中P为气体的压强,V为气体的体积,n为气体的物质量,R为气体常数,T为气体的温度。
1. 压强与体积的关系根据理想气体物态方程PV = nRT,可以得到P与V之间的关系。
当温度T和物质量n保持不变时,理想气体的压强与体积呈反比关系。
2. 压强与温度的关系根据理想气体物态方程PV = nRT,可以得到P与T之间的关系。
当体积V和物质量n保持不变时,理想气体的压强与温度成正比关系。
3. 压强与物质量的关系根据理想气体物态方程PV = nRT,可以得到P与n之间的关系。
当体积V和温度T保持不变时,理想气体的压强与物质量成正比关系。
二、非理想气体物态方程非理想气体物态方程用于描述不符合理想气体行为的气体。
非理想气体在高压、低温或分子间相互作用较强的情况下会显现出非理想气体行为。
常见的非理想气体物态方程有范德瓦尔斯方程和柯西方程。
范德瓦尔斯方程考虑了气体分子之间的相互作用力,可以修正理想气体物态方程。
柯西方程则适用于具有多个气体组分的混合气体。
除了理想气体和非理想气体物态方程外,还存在其他形式的物态方程,如van der Waals方程、三态方程等,用于描述特定条件下气体的物态变化。
三、物态方程的应用与实验验证物态方程是研究气体性质和热力学过程的基础,具有广泛的应用价值。
它可以用于计算气体的压强、体积和温度的关系,预测气体的行为。
实验上通常通过测量气体的压强、体积和温度,以及已知物质量来验证物态方程的准确性。
气体的分子速率与理想气体状态

气体的分子速率与理想气体状态气体是由大量的分子或原子组成,它们在自由状态下运动,并且具有很高的能量。
分子速率是描述气体分子运动速度的物理量,而理想气体状态是指满足理想气体方程的气体。
一、气体的分子速率气体分子速率是指气体分子在三维空间内的速度。
根据动能定理,分子平均动能(E)与其速率(v)之间存在以下关系:E=mv²/2。
其中,m是分子的质量。
气体分子速率的大小与气体分子间的平均距离和温度有关。
根据理论推导和实验研究,我们可以得出以下结论:1. 分子速率与温度正相关:根据麦克斯韦速率分布定律,气体分子的速率服从高斯分布曲线。
当温度升高时,高速分子占比增加,低速分子占比减少,平均速率也随之增加。
2. 分子速率与分子质量反相关:相同温度下,分子质量较小的气体分子具有更高的速率。
因此,分子速率与分子质量成反比。
3. 分子速率与气体密度无关:无论气体密度如何,气体分子的速率不会受到密度的影响。
因此,在相同温度下,不同压力下的气体分子速率是相等的。
二、理想气体状态理想气体状态是指满足理想气体方程(PV=nRT)的气体状态。
其中,P为气体压强,V为气体体积,n为气体的物质的量,R为气体常数,T为气体的绝对温度。
理想气体状态的特点包括:1. 分子间无相互作用:理想气体假设分子间没有相互作用力,分子之间的碰撞相互独立,不会发生能量损失。
2. 分子运动自由无碰撞:理想气体中的分子可自由运动,并且分子之间的碰撞是完全弹性碰撞。
这种假设使得理想气体的分子速率与分子间的相对位置无关。
3. 体积可忽略:理想气体的分子体积可以忽略不计,气体分子间的距离远大于分子自身的体积。
理想气体状态方程(PV=nRT)是描述理想气体行为的数学关系,它建立了气体的物态方程,使得我们可以通过测量气体的P、V、T等参数来计算气体的物质的量和常数R。
综上所述,气体的分子速率与理想气体状态密切相关。
分子速率受温度和分子质量的影响,而理想气体状态满足理想气体方程,描述了满足一定条件下的气体性质及行为。
§1[1].7分子间作用力势能与真实气体物态方程
![§1[1].7分子间作用力势能与真实气体物态方程](https://img.taocdn.com/s3/m/b5688b58be23482fb4da4cb7.png)
3.说明 说明:* 说明
固体及液体中分子的振动* 二.固体及液体中分子的振动*
三.利分子势能曲线解释固体的热膨胀(阅读教材39页) 利用分子势能曲线解释固体的热膨胀(阅读教材39页 39
范德瓦斯方程* §1.7.3范德瓦斯方程 范德瓦斯方程
一.非理想气体与理想气体的本质区别
我们推导范氏方程的思路是: 我们推导范氏方程的思路是:从微观结构上找到非理 想气体与理想气体的本质区别, 想气体与理想气体的本质区别,考虑到这些区别对气体压 强造成的影响,将理想气体压强进行修正, 强造成的影响,将理想气体压强进行修正,就得到了非理 想气体的范氏方程. 想气体的范氏方程. 非理想气体与理想气体在微观结构上的区别主要是 非理想气体分子数密度大,因此: 非理想气体分子数密度大,因此: 1.分子平均距离小 分子线度与平均距离比较不能忽略. 分子平均距离小, 1.分子平均距离小,分子线度与平均距离比较不能忽略. 所以,分子不能当质点看待,即分子本身体积不能忽略(分 所以,分子不能当质点看待,即分子本身体积不能忽略( 子斥力不能忽略). 子斥力不能忽略). 2.分子间平均距离小,在引力力程之内分子引力不能忽略, 2.分子间平均距离小,在引力力程之内分子引力不能忽略, 分子间平均距离小 分子间除碰撞外还有引力作用, 分子间除碰撞外还有引力作用,这个引力的存在对分子碰 撞器壁的冲量产生一定的影响. 撞器壁的冲量产生一定的影响.
2
a p + 2 ( v − b ) = RT v
3.说明:* 说明:* 说明 4.习题: 习题: 习题
例1.根据公式 P = 2 nε t 和 ε t = 3 KT,试从分子运动论推证玻意 根据公式 3 2 马略特定律. 耳-马略特定律. 的容器内装有理想气体, 例2.在容积为V = 60l 的容器内装有理想气体,当T = 300 K 在容积为 时,气体的压强 P = 5.0 ×103 Pa .问容器中气体的分子数 是多少? 是多少? O 组成的混合气体, 例3.在容积为 5.0l的容器内贮有 2和 N 2 组成的混合气体,其 在容积为 .试求容 中O2 有3.2 ×10−5 g .已知混合气体的T =350K, P = 2.7 Pa .试求容 分子数. 器中N 2 分子数. 一容器内贮有O 试求: 例4.一容器内贮有 2,,其P = 1.0 ×10 Pa, T = 300 K ,试求: 一容器内贮有 , (1)分子数密度 分子数密度;(2)O2的密度 的密度;(3)氧分子的质量 分子间 氧分子的质量;(4)分子间 分子数密度 氧分子的质量 的平均距离;(5)分子的平均平动动能. 分子的平均平动动能. 的平均距离 分子的平均平动动能
物态方程与气体状态变化

物态方程与气体状态变化物态方程是描述气体状态的基本方程之一,通过物态方程可以揭示气体在不同条件下的状态变化规律。
气体状态的变化是物质的一种状态转变,具有重要的理论和应用价值。
一、理想气体状态方程理想气体状态方程是描述理想气体行为的基本方程,它表达了气体的压强、体积和温度之间的关系。
一般而言,理想气体状态方程可用以下形式表示:PV = nRT其中P表示气体的压强,V表示气体的体积,n表示气体的物质量,R为气体常数,T表示气体的绝对温度。
理想气体状态方程对于理解气体行为具有重要的意义。
它揭示了气体压强与体积、温度之间的关系,遵循了布尔-马略特定律。
在常温下,气体分子之间几乎不发生相互作用,因此可以看作是理想气体。
理想气体状态方程也为研究气体的热力学性质提供了基础。
二、非理想气体状态方程除了理想气体外,现实中存在着各种非理想气体,它们的状态变化不完全符合理想气体状态方程。
针对不同的气体,人们提出了一系列修正的非理想气体状态方程。
1. 范德瓦尔斯方程范德瓦尔斯方程是一种修正理想气体状态方程的方程,它在理想气体状态方程的基础上引入了修正因子a和b,考虑了气体分子之间的分子力和分子体积。
(P + a(n/n)²)(n− nn) = nnn其中P、V、n、R、T分别表示气体的压强、体积、物质量、气体常数和绝对温度。
2. 万德特方程万特特方程是气体状态方程的另一种修正形式,它引入了修正因子c,考虑了气体分子的偶极矩对气体状态的影响。
(P + a(n/n)²)(n− nn) = nnn + (n²/n)n其中P、V、n、R、T分别表示气体的压强、体积、物质量、气体常数和绝对温度。
三、气体状态变化规律气体状态可以通过改变温度、压强和体积等参数来进行变化。
根据物态方程和热力学定律,气体在状态变化过程中遵循一定的规律。
1. 等温过程在等温过程中,气体的温度保持恒定,因此根据理想气体状态方程可以得到P 与V的关系为P1V1 = P2V2,即压强与体积成反比。
范德瓦耳斯方程的气体动理论推导

范德瓦耳斯方程的气体动理论推导荷兰物理学家范德瓦耳斯(Johannes Diderik Van der Waals,1837—1923)改进了气体的状态方程,把分子间的作用力和分子的有限体积放进方程中去。
他论证了,分子间距离较远时,它们间必定存在吸引力,这一作用附加到容器壁施加的压强上去。
他进一步提供论据,假设附加产生的压强反比于气体比容的平方。
还有,由于分子占有体积,它们可利用的空间必须减少,或者说得更明白些,减少的总体积就正比于分子在相互接触时所占有的体积。
于是一摩尔真实气体的状态方程变成(p+an2/V2)(V-nb)=RT。
这简单方程包含两个常数,即a和b,对于每一种物质它们可由实验确定。
R是普适气体数学。
1873 年在博士论文《论气态和液态的连续性》中考虑了分子体积和分子间吸力的影响,推出了著名的物态方程:(p+a/V2)(V-b)=RT 后来人们称之为范德瓦耳斯方程。
他还导出了b 是分子体积的4 倍。
这个方程不仅能解释安德纽斯的实验结果及J.汤姆生的见解,而且能从常数a、b 值计算出临界参数,这对“永久气体”液化的理论起了指导作用。
下面以理想气体状态方程为基础,推导范氏方程。
若把气体视为由体积无限小、相互之间无作用力的分子组成,这种模型便是理想气体模型,与其相对应的状态方程是:p=kT/V.若抛弃前一个的假设,把组成气体的分子视为有一定大小的刚性球(其半径称为范德瓦尔斯半径),用b 表示这些“球”的体积,上面的方程便改写为:p=kT/(V-b).在这里,每个分子的“占有体积”v 被所谓“排斥体积”v - b 代替,反映了分子在空间中不能重叠。
若气体被压缩至体积接近分子体积之和(即分子间空隙v - b 趋向于0),那么其压强将趋于无穷大。
下一步,我们考虑原子对之间的引力。
引力的存在会使分子的平均亥姆霍兹自由能下降,减少量正比于流体的密度。
但压强的大小满足热力学关系。
综述:范德瓦耳斯方程的产生是这样的:先由范德瓦耳斯提出假设,再通过计算证明假设的成立,因此当初方程的产生并不是由于数学推导,而是一种经验性的假设,通过计算,符合事实,便成为一个结论。
01-7分子互作用势能曲线.pdf

Ep (r ) F r d r
r
互作用势能曲线
1. 在平衡位置 r = r0 处 分子力 F(r) = 0 说明在r = r0 处的 势能有极小值 为什么有极小值? 2. r>r0处,势能曲 线斜率是正的, 即 F(r)<0. 3. 在r < r0处, F(r) > 0 ,排斥力.
范德瓦耳斯方程
范德瓦耳斯方程是所有真实气体方程中最 简单、使用最方便的一个。 最重要的特点是:
它的物理图像十分鲜明,它能同时描述气体,液 体及气液相互转变的性质,也能说明临界点的 特征,从而揭示相变与临界现象的特点。
范德瓦耳斯方程
比理想气体方程进了一步, 但仍然是近似 方程。
例如对于0 ℃、100个大气压的氮气,其误差仅 2%;但0 ℃的 CO2,压强达10个大气压时方 程已不适用。 一般说来,压强不是很高 (如5 atm以下), 温度不是太低的很多真实气体(但是 CO2 等 气体除外),范氏方程是很好的近似。
举例说明
如在2维情况下,一个 分子将同时与6个分子 碰在一起。
在3 维情况下接触分子 将更多。这类情况都 是范德瓦耳斯气体所 不允许的。
排斥球
对于B而言 有效的排斥体积b
1 4 3 b N A 1 d 2 3 1 4 3 b N A 1 2r 2 3 4 3 b NA4 r 3
昂内斯方程
1908年首次液化氦气,又于1911年发现超 导电现象的荷兰物理学家卡默林· 昂内斯 (Onners)在研究永久性气体(指氢、氦 等沸点很低的气体)的液化时,于1901年 提出了描述真实气体的另一物态方程昂内 斯方程。
昂内斯方程
• 以 体 积 展 开 的 昂 内 斯 以压强展开的昂内斯 方程。 方程
理想气体状态方程与分子动理论

理想气体状态方程与分子动理论理想气体状态方程与分子动理论是研究气体行为和性质的重要理论基础。
通过这两个理论,我们可以深入认识气体分子的运动方式、气体的性质以及气体体积、压强、温度之间的相互关系。
一、理想气体状态方程理想气体状态方程是描述理想气体状态的方程,通常记作PV=nRT。
其中,P为气体的压强,V为气体的体积,n为气体的物质量,R为气体常数,T为气体的绝对温度。
这个方程的推导基于分子动理论,将气体看作是由大量微观粒子(分子或原子)组成的。
具体来说,气体分子在容器中自由运动,与容器壁碰撞时会产生压力,而气体的体积则取决于容器的大小。
理想气体状态方程在实际应用中非常重要。
它可以被用来计算气体的性质,例如气体的摩尔质量、密度以及其他涉及压强、体积、温度关系的物理量。
通过理想气体状态方程,我们可以更好地理解气体的宏观特性。
二、分子动理论分子动理论是描述气体微观粒子行为的理论。
它假设气体分子是微小的、质量可以忽略不计的,它们之间没有相互作用力。
根据这个理论,气体分子在运动过程中具有以下特点:1. 分子自由运动:气体分子在容器内自由运动,并且具有各向同性,即没有固定的方向。
2. 分子碰撞:气体分子之间以及与容器壁之间不断发生碰撞,这些碰撞是弹性碰撞,即能量和动量守恒。
3. 分子速度分布:气体分子的速度符合麦克斯韦-波尔兹曼分布,即速度的分布不均匀,符合高斯曲线。
通过分子动理论,我们可以解释气体的几个重要性质。
首先,气体的压强取决于气体分子与容器壁的碰撞频率和碰撞力量。
其次,气体的温度与气体分子的平均动能有关,即温度越高,分子的平均动能越大。
总结理想气体状态方程与分子动理论为我们理解气体的行为和性质提供了基础。
理想气体状态方程通过关联气体的压强、体积、物质量和温度之间的关系,帮助我们计算气体的性质。
而分子动理论则从微观角度解释了气体的行为,揭示了气体分子的运动状态和碰撞特点。
通过深入理解理想气体状态方程与分子动理论,我们可以更好地理解气体的宏观特性,从而应用于实际问题的解决。
理想气体微观模型压强动能和真实方程

3、理想气体物态方程的另一种形式
将
p nkT
k ,t
1 3 2 m v kT 2 2
带入
2 p n k 3
得
2 2 3 P n k ,t n kT nkT 3 3 2
P nkT
' v 及 v [例1.3] 试求273K时氢分子及空气分子的均方根速率 rms rms
Δ k指每个分子进入界面层时平均动量减少量
k F
F n
k an
1 1 a 2 pi nv cn n 2 2 3 Vm Vm
一摩尔气体范德瓦耳斯方程:
a [ p 2 ]Vm b RT Vm
M Vm 代入, 将 V Mm
a [ p 2 ]Vm b RT Vm
o
r0
r
分子力
分子力是一种电磁相互作用力, 故它是一种保守力,它对应有分子作 用力势能。
二、分子间互作用势能曲线
Ep(r)
平衡位置: r r0
r0 Ep0 分子互作用势能曲线 r
dEp (r ) F (r )dr或F E p (r ) F (r )dr
r
dEp dr
得气体质量为M的气体方程
M 2 a M M [p ( ) 2 ] V b RT Mm V Mm Mm
a---引力修正系数,b---斥力修正系数。
4 d 3 b 4 N A ( ) 10 5 m 3 3 2
2、昂纳斯( Onnes )方程
B C pV A 2 ...... V V
E Ek E p 0
二、真实气体物态方程
为了建立真实气体的物态方程,人们进行了许多理论和实 验的研究工作。目前已积累起非常多的资料,导出了大量的物 态方程,所有的物态方程可分为两类。一类是对气体的结构作 一些简化假设后推导出来的。虽然这类方程中的一些参数仍需 由实验来确定,因而多少带有一些半经验的性质,但其基本出 发点仍是物质结构的微观理论。这类方程的特点是形式简单, 物理意义清楚,具有一定的普通性和概括性,但在实际应用时 所得的结果常常不够精确。另一类是为数极多的经验的和半经 验的物态方程。它们在形式上是复杂的,而且每个方程只在某 一特定的较狭小的压强和温度范围内适用于某种特定的气体或 蒸汽。也正因为如此它们才具有较高的准确性,在实际工作中 主要靠这类方程来计算。下面对达两类方程各举一例略加介绍。
理想气体物态方程的两种表达式

理想气体物态方程的两种表达式理想气体物态方程是描述理想气体状态的重要公式,可以揭示气体的压强、体积、温度等物理量之间的关系。
它有两种表达式,一种是基于摩尔物质的观点,一种是基于粒子物理统计理论的观点。
基于摩尔物质观点的理想气体物态方程为PV=nRT,其中P表示气体的压强,V表示气体的体积,n表示气体的摩尔数,R表示气体常量,T表示气体的绝对温度。
这个公式的物理意义非常清晰。
气体的压强,是由气体分子碰撞容器壁而产生的作用力所导致的。
气体的体积,是由容器限制所形成的空间大小。
摩尔数表示气体分子数量的大小,与物质的量直接关联。
气体常量R在不同的气体中是相同的,因为它是由普适的物理常数推导而来。
绝对温度则是气体分子热运动的表现,它与气体分子的动能直接相关。
在这个公式中,各个物理量之间既独立又密切相关。
通过这个方程,可以计算出气体的状态变化,比如在变温、变压、变容等条件下气体体积的变化,从而研究气体的性质和行为。
除了基于摩尔物质的观点,另一种基于粒子物理统计理论的观点也提出了理想气体的物态方程。
它的形式为P=ρkT,其中ρ是气体的密度,k是玻尔兹曼常数。
这个公式的出发点是:气体是由众多分子所组成的,它们之间的相互作用形成了气体的宏观状态。
因此,通过统计分子的热运动和相互作用,可以推导出气体的状态方程。
在这个方程中,密度ρ代替了摩尔数n,可以更加直观地描述气体的量。
玻尔兹曼常数k则表征了气体分子的热运动性质和分子间相互作用的强度。
基于粒子物理统计理论的物态方程更加深入地揭示了气体分子之间的运动、相互作用、涨落、能量转移等微观机制,从而更好地反映了气体的本质。
但同时也比较复杂,需要更多的数学知识和计算技巧。
两种物态方程的表达式,不同的角度解释了气体状态的变化。
它们都基于实验事实和原理的推导,确立了我们对气体特性的认识和理解。
研究理想气体物态方程,不仅是基础物理学和化学学科的一部分,更是应用于工程、环境、大气研究等方面的基础工具。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
当温度升高时,EK0 增加,横轴r’升高,d 将减小,说明 d 与气体温度
有关。温度越高,d 越小。
表示动能的横坐标
分子碰撞 有效直径 表示势能的横坐标
表示两 分子碰 撞时挤 压情况
关于分子的直径:
• 由于原子核外的电子呈电子云分布,因而原子或分子没有明确的边界, 也就谈不上有什么明确的直径。
分子力是一种电磁相互作用力,因此它是一 种保守力,具有势能,称为分子作用力势能。
二、分子间互作用势能曲线 1、分子间互作用势能曲线 • 分子力是一种保守力,具有势能,而保守力作功的负值 等于势能Ep的增量, • 故分子作用力势能的微小增量为
dE p (r ) F (r)dr
dr 若令分子间距离r 趋向无穷远时的势能为零,则
(2)另一种理解的分子直径是指:
分子碰撞有效直径 d —两分子相互作 对心碰撞时,两分子质心间最短距离。
图中r0 与 d 不相等,但通常情况下差异不大。 • 图中对分子间碰撞的分析限于两分子间对心碰撞(即两分子间的碰撞 均在分子联心轴线上发生)。
• 实际发生的分子间碰撞基本上都是非对心的,因而以后要引入分子碰 撞截面的概念。
只有两分子相互“接触”、“挤压”时才呈现出排斥力。
可简单认为排斥力作用半径就是两分子刚好“接触”时两质心间的距离, 对于同种分子,它就是分子的直径。
因为吸引力出现在两分子相互分离时,故排斥力作用半径 比吸引力半径小。
引力和斥力都随着分子间距离的增大而减小,随着分子间距 离的减小而增大,但是斥力变化更为剧烈。
f
斥
分
子
力
力
o
r
力
引
分子力曲线
2、分子力与分子热运动
• 分子间相互吸引力、排斥力有使分子聚在一起,并在空间形成某种有 序排列的趋势,但分子热运动却力图破坏这种趋向,使分子尽量相互 散开。
• 在这一对矛盾中,温度、压强、体积等环境因素起了重要作用。
物质气--液--固状态变化:
• 气体分子由于受到容器的约束而使热运动范围受到限止。 • 随着气体密度增加,分子平均间距越来越小,分子间相互吸引力不 能予以忽略且越来越大。
• 再将温度降低,分子热运动也渐趋缓慢,分子力与热运动这对矛盾 中,分子力渐趋主导地位。
• 到一定时候,分子吸引力使分子间相互“接触”而束缚在一起,此时 分子不能像气体那样自由运动,只能在平衡位置附近振动,但还能发 生成团分子的流动,这就是液体。 • 若继续降低温度,分子间相互作用力进一步使诸分子按某种规则有序 排列,并作振动,这就是固体。
第一章
§1.7 分子间作用力势能与 真实气体物态方程
作业:1.7.1、1.7.3
§1.7
分子间作用力势能真实气体物态方程
下图是对真实气体测量画出的一条条等温线。 图中的纵坐标是 pVm /RT,横坐标是 p 。
对于一定质量的理想气体, pVm/RT =1应该是不变的量,它应
和 p 的大小无关。 也就是说,在图中所有的等温线 应该都是同一条水平直线。
分子吸引力作用半径的存在:
只有当分子质心相互接近到某一距离内,分 子间相互吸引力才较显著,把这一距离称为 ---分子吸引力作用半径。
很多物质的分子引力作用半径约为分子直径的2-4倍左 右,超过这一距离,分子间相互作用力已很小,可予 忽略。
(2)排斥力
能说明排斥力的现象: ①固体、液体都很难压缩; ②气体分子经过碰撞而相互远离。 排斥力作用半径:
排斥力
平衡位置
吸引力
平衡位置
势能极小值
三、碰撞有效直径、固体分子热振动、固体热膨胀
1、用分子势能曲线解释分子间对心碰撞
表示动能的横坐标
表示势能的横坐标
表示两分 子碰撞时 挤压情况
在图中a2向 a1靠近时,在相互距离为d 时,它们受到的挤压达到最大,然 后a2反向运动。所以
d 是两分子对心碰撞时相互接近的最短质心间距,
但是现在只有在 p = 0 的情况
下才满足理想气体条件。
理想气体,始终满足 pVm/RT= =常量
一、分子间的吸引力与排斥力 1、吸引力和排斥力 (1)吸引力
能说明分子间存在吸引力的现象:
① 汽化热; ② 锯断的铅柱加压可黏合; ③ 玻璃熔化可接合; ④ 胶水、浆糊的黏合作用;
这些现象不仅说明分子间存在吸引力,而且③、④还说明: 只有当分子质心相互接近到某一距离内,分子间相互吸引力 才较显著。
2、利用分子势能曲线解释固体内分子的运动是振动
分子振动 的平衡位 置曲线
表示总能量 不变的曲线
3、利用分子势能曲线解释固体的热膨胀
r ' r" r r0 2
r
随着温度上升而增加,因而产生线膨胀。
四、范德瓦耳斯方程 • 1873 年荷兰物理学家范德瓦耳斯针对理想气体的两条基本 假定: • 忽略分子固有体积、 • 忽略除碰撞外分子间相互作用力 • 作出了两条重要修正,得出了能描述真实气体行为的范德 瓦耳斯方程。
E p ( p) F (r )dr
r
F
dE p
作出与分子作用力曲线所对应的互作用势能曲线 注意:
E p (r ) ~ r
E p (r ) F (r )dr
rБайду номын сангаас
排斥力
平衡位置
显然在平衡位置 r = r0 处,分子力 F(r) = 0, 说明在r = r0 处的势能有极小值 。 而极小值是负的。
分子固有体积修正
• 理想气体方程中容器的体积 V 就是每个分子可以自由活动的空间。 如果把分子看作有一定大小的刚性球,则每个分子能有效活动的 空间不再是V 。 • 若 1mol气体占有 Vm体积,分子能自由活动空间的体积为 Vm -b。 则有
吸引力
在r>r0处,势能曲线斜率是正的,F(r)<0,
显然这时是吸引力。
势能极小值
平衡位置
在 r<r0 处, F(r)>0 ,势能曲线斜率是负 的,这时是排斥力。
两分子在平衡位置附近的吸引和排斥, 和弹簧在平衡位置附近被压缩和拉伸 类似。 液体和固体中分子的振动可利用分子 力这一特性来解释。
用势能来表示相互作用要比直接用 力来表示相互作用方便有用,所以 分子互作用势能曲线常被用到。
• 通常提到的分子直径有两种理解:
• (1 )一种指分子的大小,这主要是指由它们组成固体时,最邻近分子 间的平均距离。
• 由于固体中的分子(或原子)处于密堆积状态,分子(或原子)均在平 衡位置附近振动。这相当于两个能扩张及收缩的弹性球相互接触时所发 生的情况。
分子直径r0指固体分子在振动的平衡位置时两分子 质心间平均距离。
