高二化学第四章第一节原电池(学案).ppt.Convertor
人教版化学选修4第四章第一节:原电池19ppt

第一课时 探究原电池的形成条件
探究原电池形成的条件
教学目标
过程设计
教法设计
教学反思
学法设计
自我评价
教学目标
1(、1(1、1)知)知通识通过识探过与与究探技实技验究能能让实:学:验生了让解学原电生池了的工解作原原电理和池形的成条工件作。原理 (和(形22))成通通条过探件过究。实探验究,培实能、过。过程程与与方方法法::
2.通过分组实验来增强学生的动手操 作能力,同时基于核心素养下提高了 学生的创新素养。
教学反思与自我评价
本实验的优点:
1、本实验装置简单,操作安全、方便,实验器材 在生活中到处都有,学生自己就能进行实验探究。 2、本实验不会产生任何污染物,比较绿色环保
本实验的不足:
1、本实验由于所用的锌片和铜片不纯会给实验带 来一定的影响。 2.由于柠檬酸的酸性不是特别的强实验过程中产生 的电流小影响音乐贺卡的声音。
2、【实验探究二】
将电极全部换成碳棒插入柠檬中,去接触贺卡, 让学生观察是否有音乐,再让学生分析,得出
结论: ②必须是两个活泼型不同的电极。
e
e
柠檬酸
实验过程设计
3、【实验探究三】 再将电极换成碳棒和铜片重复上面的实验,,让学 生观察贺卡是否有音乐,再让学生分析得出结论:
③必须能自发进行的氧化还原反应。
e
e
柠檬酸
实验过程设计
4、 【实验探究四】
为了体现团队的合作精神将两个组的柠檬合放到一起分 别将铜、锌电极分别插入两个柠檬中,再去接触贺卡, 让学生去观察贺卡是否有音乐,再让学生观察分析得出
结论: ④必须形成闭合回路
e
ee
实验过程设计 原电池形成的条件:
人教版高二化学选修4教学课件:第四章4.1 原电池(共12张PPT)

达标练习
教材 P73 习题
课后作业
学法 P105-106
不习惯读书进修的人,常会自满于现状,觉得再没有什么事情需要学习,于是他们不进则退。经验丰富的人读书用两只眼睛,一只眼睛看到纸面上的话,另 一眼睛看到纸的背面。2022年4月3日星期日2022/4/32022/4/32022/4/3 书籍是屹立在时间的汪洋大海中的灯塔。2022年4月2022/4/32022/4/32022/4/34/3/2022 正确的略读可使人用很少的时间接触大量的文献,并挑选出有意义的部分。2022/4/32022/4/3April 3, 2022 书籍是屹立在时间的汪洋大海中的灯塔。
2. 工作原理
电极反应式的书写
(1)遵循离子方程式书写规则。 注意:生成难溶物沉积在电极上,不标“↓”。
(2)方法步骤 标变价→列物质→注得失→配守恒
负极:氧化反应,还原剂 − ne- ══ 氧化产物 正极:还原反应,氧化剂 + ne- ══ 还原产物 电池反应 = 负极反应式 + 正极反应式
注意:同时书写正负极反应式,以得失电子数 相等配平;书写单个电极反应式,化为最简整数比 。
谢谢观赏
You made my day!
我们,还在路上……
例:写出下列装置的电极反应式
二、设计原电池
设计思路
1. 写出电极反应式 将Βιβλιοθήκη 知的氧化还原反应拆分为氧化反应和还原
反应两个半反应。 2. 确定电极材料
以两极反应原理为依据,确定电极材料。 如,发生氧化反应的物质为金属单质,可用该 金属直接作负极;用较不活泼的金属(或能导电的惰 性材料)作正极。 3. 确定电解质溶液 一般选用总反应式中的电解质溶液;若有盐桥 ,阳离子与电极相对应,电极不与电解质溶液反应
化学选修四第四章第一节原电池 说课11ppt

—— 说课环节 ——
教材分析 学情分析
教学目的 重点难点
教学方法 学习方法
板书设计 课后反思
教学过程 流程图
一
—— 教材分析 ——
学生对于原电池的认识已有一定的基础知识,高一在必 修教材《化学2》中第二章第二节《化学能与电能》的 基础上,初步认识了原电池的组成和工作原理,知道正 负极的判断方法,会写简单的电极反应方程式和总反应 方程式。高二在选修教材《化学反应原理》中,将进行 深入的学习。教材通过对单液原电池电池效率的探究, 引出双液原电池,引出半电池、盐桥、内电路、外电路 等概念,对原电池工作原理的概貌有比较深入的了解。 由于原电池在实际生活、工农业生产、科学研究中应用 广泛,学好本节知识,具有比较重要的理论意义和现实 意义。
改进: 1.实验创新不足; 2.分组实验。
Thanks for listening
一个不是我们有所求的朋友才是真正的朋友,交友不是为了向对方索取什么。衣服新的好,朋友老的好。 才智之民多则国强,才智之士少则国弱。故今天之教,宜先开其智。 教师的威信首先建立在责任心上。——马卡连柯 明天的希望会让我们忘了今天的痛苦。 来是偶然的,走是必然的。所以你必须随缘不变,不变随缘。 勤学和知识是一对最美的情人。 如果知识不是每天在增加,就会不断地减少。 如果你不给自己烦恼,别人也永远不可能给你烦恼。因为你自己的内心,你放不下。 当你知道迷惑时并不可怜,当你不知道迷惑时,才最可怜。
得不到的东西,我们会一直以为他是美好的,那是因为你对他了解太少,没有时间与他相处在一起。当有一天,你深入了解后,你会发现原不 是你想像中的那么美好。 任何人都可以变得狠毒,只要你尝试过嫉妒。 衷心的说一句:承诺就像“操他妈”一样,经常说,却很难做得到。 实现自己既定的目标,必须能耐得住寂寞单干。
部编人教版高二化学选修4《第4章电化学基础第1节原电池》课堂教学精品ppt课件

5.原电池的“盐桥”中装的必须是电解质,原电池工
作时导线上有电子通过,盐桥中也一定有电子通
过
()
提示:错误.因为金属导体是靠自由电子的定向
移动而导电,电解质溶液只能是靠阴、阳离子的
定向移动而导电,故盐桥上定向移动的只能是离
子而不是电子.
返回
返回
一、原电池工作原理 1.原电池工作原理图示
返回
返回
1.如下图所示的装置能够组成原电池产生电流的是( )
返回
解析:依据构成原电池的四个必要条件分析:A中两电 极相同;C中没有构成闭合回路;D中酒精是非电解 质.唯有B符合条件. 答案: B
返回
考查点二 原电池原理的应用
[例2] X、Y、Z、W四块金属板分别用导线两两相连浸
入稀硫酸中构成原电池.X、Y相连时,X为负极;Z、
返回
二、原电池正负极的判断和电极反应式的书写 1.原电池正负极的判断 (1)由组成原电池的两电极材料判断.对原电池而言,活
泼的金属是负极,活泼性较弱或能导电的非金属是 正极. (2)根据电流方向或电子流动方向判断.原电池中,电流 由正极流向负极,电子由负极流向正极.
返回
(3)根据电解质溶液内离子的定向移动方向判断.在原电 池内,阳离子移向正极,阴离子移向负极.
的关系).
返回
返回
考查点一 原电池原理
[例1] (2010·陵水高二检测)某原电池总反应的离子方程
式为:2Fe3++Fe===3Fe2+,不. 能实现该反应的原电池
是
()
A.正极为Cu,负极为Fe,电解质溶液为FeCl3 B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3 C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3 D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3
人教版化学选修四第四章第一节-原-电-池优秀课件PPT

(电池的电极必须导电)
①活泼性不同的两种金属。如锌铜原电池,锌作负极,铜作正极
②金属和非金属。如锌锰干电池,锌作负极,石墨棒作正极
③金属和化合物。如铅蓄电池,铅版作负极,PbO2作正极 ④惰性电极。如氢氧燃料电池中,两根电极均可用Pt
宏观判断:
较活泼的电极材料 ——负极 ①根据电极材料
较不活泼的电极材料——正极
②根据原电池电极 发生氧化反应的极 ——负极
发生的反应
发生还原反应的极 ——正极 质量增加的电极
——正极
③根据电极增重还是减重 工作后
质量减少的电极 ——负极
④根据电极有气泡冒出: 工作后,有气泡冒出的电极为正极 4
7、电解质溶液和电极材料的选择
第四章 电化学基础
1
一、与原 电 池 相关的概念
外电路
1.电路:
内电路
电子流向:负极流向正极 电流方向:正极流向负极 阴离子流向负极
阳离子流向正极
2.电极:负极:电子流出的一极
正极:电子流入的一极
负极: Zn-2e-= Zn2+
3.电极反应式:
正极: 2H++ 2e-= H2↑
4.总反应式:Zn+ 2H+ = Zn2+ + H2↑
②比功率 [符号是W/kg,W/L)]
指电池单位质量或单位体积所能输出功率的大小
③电池的储存时间的长短
7
5、各类电源 (1)普通锌锰干电池
负极:Zn – 2e- == Zn2+ 正极:2NH4+ +2MnO2 + 2e== 2NH3 + Mn2O3 + H2O
人教版高中化学选修4第四章第一节 原电池 课件(共34张PPT)

(∨)
总反应:Zn+Cu2+=Zn2++Cu
或 Zn+CuSO4=ZnSO4+Cu
2、如图所示,在铁圈和银圈的焊接处, 用一根棉线将其悬在盛水的烧杯中,使之 平衡;小心的向烧杯中央滴入CuSO4溶液, 片刻后可观察到的现象是
A. 铁圈和银圈左右摇摆不定
B. 保持平衡状态
C. 铁圈向下倾斜,银圈向上倾斜
D. 银圈向下倾斜,铁圈向上倾斜 D
[探究回顾]
请根据反应:
Zn + CuSO4 = ZnSO4 + Cu
设计一个单液原电池,并进行实 验。
CuSO4 溶液
电流表指针发生 偏转,但不稳定。
两个电极上都有 红色物质生成
分析:由于锌片与硫酸铜溶液直接接 触,锌片失去的电子一部分经导线传 递到铜片表面,另一部分电子直接传 递给硫酸铜溶液中的Cu2+,铜在锌片表 面析出,锌片表面也构成了原电池, 进一步加速铜在锌表面析出,致使向 外输出的电流强度减弱。当锌片表面 完全被铜覆盖后,不再构成原电池, 也就没有电流产生。
Zn + H2SO4 == ZnSO4 + H2↑ 指出发生氧化反应和还原反应的物质 以及电子转移的情况 氧化反应: Zn → Zn2+
还原反应:H+ → H2
要产生电流,必须的条件是什么? 有电子的转移 氧化还原反应
2.原电池的构成条件
1.有两种活泼性不同的金属(或非金属)作电极 2.电极材料均插入电解质溶液中 3.能自发地发生氧化还原反应 4.两极相连形成闭合回路
2、 实验室氢气选用纯锌粒好还是选用粗锌好?为什么?
选用粗锌好,形成原电池可加快反应。一般先把锌用硫酸 铜溶液浸泡一下。
人教版 高中化学(选修四) 第四章 第一节《原电池》 (共25张PPT)
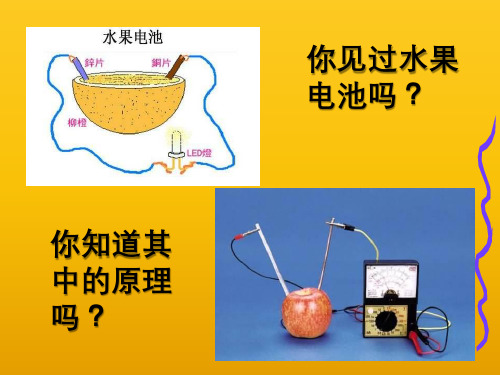
⑶、将一Zn片,Cu片平行插入 稀象H?2为SO什4溶么液?中,有什么现
(4)、若将Zn片,Cu片用一 导线连接,导线间接一电流 计,再浸在稀H2SO4溶液中, 有什么现象?为什么?
原 电 池 的 工 作 原 理
定向移动方向:电子、离子
原电池
盐电池
反应:
Cu2++Zn=Zn2++Cu
根据检流计指针偏转方向 知电流方向: Cu→Zn
盐桥:在U型管中装 满用饱和KCl溶液 和琼胶作成的冻 胶。
盐桥的作用:
使Cl-向锌盐方向移动, K+向铜盐方向移动,使 Zn盐和Cu盐溶液一直保 持电中性,从而使电子 不断从Zn极流向Cu极。
正、负两极分别发 生的反应,称为电 极反应。
小心的向烧杯中央滴入CuSO4溶液,片刻后
可观察到的现象是
A. 铁圈和银圈左右摇
(D )
摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
4、我国发射的神州五号载人飞 船是采用先进的甲烷电池为电能 的,该电池以KOH溶液为电解 质,其总反应的化学方程式为: CH4+2O2+2OH-=CO32-+3H2O
正极(铜电极): Cu2+ + 2e- = Cu 负极(锌电极): Zn = Zn2+ + 2e-
Cu2++Zn=Zn2++Cu
2、原电池形成的条件: 1.两个活泼性不同的电极
2. 电解质溶液 3.能自发地发生氧化还原反应 4.形成闭合回路
3、电极判断:
负极:电子流出的一极,发生氧化反应
高中化学 人教版选修4 课件:第四章 第一节 原 电 池(36张PPT)

要点二 原电池的设计
理论上,能自发进行的氧化还原反应均能设计成原电池, 实际设计时应注意以下几方面: 提供 (1) 用 还原性较强 ________ 的物质作为负极,向外电路 ________ 得到 电子;用 氧化性较强 ________ 的物质作为正极,从外电路 ________ 电子。
阴阳离子的定向移动 (2) 将两极浸在电解质溶液 ________ 中,通过 __________________ 形成内电路。 导线 流向正极,再通过 (3) 放电时负极上的电子通过 ________ 溶液中离子移动形成的内电路构成闭合回路,其中阳离子移 向________ 正 正 极,阴离子移向________ 负 极。
负极——电子流出极,电流流入极或阴离子定向移向极
正极——电子流入极,电流流出极或阳离子定向移向极
栏 目 链 接
3.根据两极发生的变化判断
负极——失去电子,化合价升高,发生氧化反现象判断
负极——会逐渐溶解,质量减小
正极——有气泡逸出或质量增加
栏 目 链 接
三、原电池正负极的判断方法
负极:活泼性__强__的金属,发生__氧化__反应。
正极:活泼性__弱__的金属或导体,发生__还原__反应。 原电池正负极判断: 1.根据电极材料判断 负极——活泼性较强的金属
栏 目 链 接
正极——活泼性较弱的金属或能导电的非金属
注意:活泼金属不一定做负极,如Mg、Al在NaOH溶液中, Al做负极。 2.根据电子流动方向或电流方向或电解质溶液内离子 的定向移动方向判断
栏 目 链 接
(1) 将氧化还原反应拆成氧化反应和还原反应两个半反应,
(2)确定电极材料。
如发生氧化反应的物质为金属单质,可用该金属直接作负
高中化学人教版选修四 第四章 电化学基础 第一节 原电池 课件(共15张PPT)(共15张PPT)

反应
正极:还原反应 溶液中离子得电子
总反应:负极金属与电解液的离子反应
3、化学电池的反应本质
氧化还原反应
原电池将自发的氧化还原反应分割为 氧化、还原两个反应在负、正两极同 时不同地进行,正负两极上进出电子 总数相等。
根据电子守恒原Leabharlann 进行计算练习1、判断下列哪些装置构成了原电池?若不是,请说明理由; 若是,请指出正负极名称,并写出电极反应式.
Fe+CuSO4=Cu+FeSO4
⑥ (×)
负极: Zn-2e-=Zn2+
⑦
正极: Cu2++2e-=Cu
(∨)
总反应:Zn+Cu2+=Zn2++Cu
或 Zn+CuSO4=ZnSO4+Cu
2、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬 在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入
CuSO4溶液,片刻后可观察到的现象是 ( D )
①两极: 正极:较不活泼的金属或非金属(如石墨) 负极:较活泼的金属 ②电解质溶液 ③形成闭合回路
下列装置中属于原电池的是
失e-,沿导线传递,有电流产生
氧化反应
负极 锌——铜 正极
Zn-2e-=Zn2+
原电池
电解质溶液
阴离子
阳离子
还原反应
2H++2e-=H2↑
电 负极: Zn-2e-=Zn2+ (氧化反应)
①
②
(×)
(×)
负极: Zn-2e=Zn2+
③
正极: 2H++2e=H2↑
(∨)
总反应: Zn+2H+=Zn2++H2↑
负极: Zn-2e-=Zn2+
④
正极: 2H++2e-=H2↑
(∨)
总反应:Zn+2H+=Zn2++H2↑
第四章第一节原电池PPT30张

解析 根据已知的氧化还原反应设计原电池的思路:首
课 时
先将已知的反应拆成两个半反应(即氧化反应和还原反
栏 目
应):Cu-2e-===Cu2+,2Fe3++2e-===2Fe2+;然后结合
开
原电池的电极反应特点,分析可知,该电池的负极应该
关
用 Cu 作材料,正极要保证 Fe3+得到负极失去的电子,一
般用不能还原 Fe3+的材料,如 Pt 或碳棒等,电解质溶液
本
负极反应式___________________________________;
课 时
总反应方程式_________________________________。
栏 目
答案 2H++2e-===H2↑ Fe-2e-===Fe2+
开 关
Fe+H2SO4===FeSO4+H2↑
学习·探究区
第一节
做完实验后,在读书卡片上记录如下:
卡片:NO.28 时间:2012.03.20
实验后的记录:
本
①Zn 为正极,Cu 为负极
课
②H+向负极移动
时
栏
③电子流动方向为 Zn―→Cu
目 开
④Cu 极有 H2 产生
关
⑤若有 1 mol 电子流过导线,则产
生的 H2 为 0.5 mol ⑥正极反应式:Zn-2e-===Zn2+
关
为电能
。
学习·探究区
第一节
[归纳总结]
1.原电池原理是把 氧化反应和还原反应分开 进行,还原
剂在 负 极上失去电子发生 氧化 反应,电子通过导线流向
正 极,氧化剂在 正 极上得到电子发生还原 反应。
本
课 时
2.原电池电极及电极反应特点
人教化学选修4第四章第一节 原 电 池(共21张PPT)

N a C l溶 液
Zn C u Zn Cu
Fe
Cu
Zn
Cu
√E
F
M
N
CCuu2SSOO 44
酒精
N a C l溶 液
H2SO4 H2SO4
三.简单原电池的工作原理:
外电路
负极
电子沿导线传递,产生电流 正极
活泼金属
A
失去电子 Zn-
不活泼金属或石墨
Cu 溶液中阳离子
氧化反应
得到电子
Zn- 2e- = Zn2+
相同点:电极反应本质相同 不同点: 构造不同
优点: 1.有效避免了电极材料与电解质溶液的直接反应, 增加了原电池的使用寿命。
2.离子在盐桥中作定向移动,使离子移动更加有序, 电流持续稳定 ,提高了原电池的使用效率。
练习三
(高考真题)依据氧化还原反应: 2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)
第四章 电化学基础
第1节 原电池
• 实验:将锌片和铜片用导线连接(导线中间 接入一个电流表),平行插入盛有稀硫酸 的烧杯中,观察现象
[实验现象]:铜片上有气泡产生,锌片不断溶解 ,电流表的指针发生偏转。 [实验结论]:导线中有电流通过
为什么会出现上面的现象?
一、原电池: 是将化学能转化为电能的装置
1、构成原电池的条件 2、探究“单液电池”,寻找 改进方法—“双液电池” 3、具有盐桥原电池的反应原 理作用
二、原电池的构成条件
1.两种不同的金属 (或一种金属与石墨或金属氧化物) 做电极
2.用导线相连(或直接接触)形成闭合回路
3.电极插入电解质溶液里
新人教版高中化学选修4-第4章第1节《原电池》课件

B.在原电池的电解质溶液中,阳离子移向的电 极是正极。
C.在原电池中,电子流出的一极是负极,该电 极被还原。
D.原电池放电时,电流的方向是从负极到正极。
问题3:你可以从那些方面来判断原电池的正负极?
电极材料、离子移动方向、电子流向、 电流方向、氧化还原方面、实验现象等 等
④ 现象:Zn棒变细,Cu棒 变粗,蓝色溶液变 浅
[问题切入]
问题8:人们发现,按此方法设计的原电池,如果用它做 电源,不但效率低,而且时间稍长电流就很快减弱,因此 不适合实际应用。这是什么原因造成的呢?
A
单液原电池
H2SO4 溶液 主要原因:负极与阳离子直接接触【说明】由于右图装置中Cu2+与 Zn直接接触,Zn失电子后, Cu2+可以直接在锌片上得到电子,所 以这种原电池的效率不高,电流在短时间内就会衰减。
*根据组成原电池的两极材料判断:
一般活泼的金属为负极 活泼性较弱的金属或能导电的非金属为正极
*根据原电池两极发生的变化来判断:
失电子发生氧化反应是负极, 得电子发生还原反应是正极。
*根据电子移动方向或者电流的方向来判断:
电流是由正极流向负极; 电子流动方向是由负极流向正极。
1、已知反应 Cu + 2FeCl3 = CuCl2 +2FeCl2 , 请设计原电池,写出电极反应式。
强到弱的顺序为 (a>c>d>)b
有下列材料:Zn片(2片)、Cu片(2片)、导线、 水果 (西红柿、苹果等)、电流计,请设计一个装置
使电流计指针发生偏转,并画出设计草图。
用水果和现有的实验器材试做水果电池
你知道吗? 2380块橙子能给一个手机充电
高二化学选修4第四章电化学基础第一节原电池课件

A
Cu
CuSO4
1、盐桥起什么作用? 、盐桥起什么作用? 2、确定该原电池的正、负极,判 、确定该原电池的正、负极, 断电子的流动路线及溶液中阴、 断电子的流动路线及溶液中阴、 阳离子移动趋势? 阳离子移动趋势? 3、分析原电池的构造,并写出原 、分析原电池的构造, 电池中的两个电极反应和电池反 应方程式。 应方程式。
思考: 思考 怎样改进原电池的装置, 怎样改进原电池的装置,才能获 得持续、稳定的电流呢? 得持续、稳定的电流呢?
实验探究2 实验探究2
按下图所示, 将置有锌片的ZnSO 按下图所示, 将置有锌片的ZnSO4溶液和置有铜片的 溶液分别通过导线与电流计连接,有什么现象? CuSO4溶液分别通过导线与电流计连接,有什么现象? 电流计指针不偏转, 电流计指针不偏转,且 铜片和锌片上均无明显 现象( 现象(即:无电子定向 移动) 移动)
第四章 电化学基础
第一节 原电池
复习与回顾
1、原电池的定义: 将化学能转变为电能的装置。 2、原电池的实质: 将氧化还原反应的电子转移变成电子的定 向移动。即将化学能转化成电能。 3、组成原电池的条件:
A Zn Cu Zn
A Zn Zn
A C
煤油 (x) A Zn H+ - SO42- + H
H2SO4
H+ - SO42- + H (x)
H2SO4
H+ - SO42- + H (√) A Cu
H2SO4
木条 (x)
Zn
H SO42— + H
H2SO4
+
H+ - + SO42- H
H2SO4
(x)
化学:第四章第一节《原电池》.ppt

③根据电极增重还是减重
质量增加的电极 ——正极
工作后
质量减少的电极 ——负极
④根据电极有气泡冒出: 工作后,有气泡冒出的电极为正极
三、原电池的设计
化合价升高 失2e-
利用Fe + Cu2+=Fe2+ +Cu,设计
一个原电池.
化合价降低 得2e-
Fe
Cu
1、根据氧化还原反应电子 转移判断电极反应。
②原电池的内部及盐桥,通过阴阳离子的定 向运动而形成内电路。
二、原电池的正负极的判断方法
微观判断 电子流出的极
(根据电子
流动方向) 电子流入的极
——负极 ——正极
宏观判断: ①根据电极材料
较活泼的电极材料 ——负极
②根据原电池电极 发生的反应
较不活泼的电极材料——正极 发生氧化反应的极 ——负极
发生还原反应的极 ——正极
3、如图所示,在铁圈和银圈的焊接处, 用一根棉线将其悬在盛水的烧杯中,使之 平衡;小心的向烧杯中央滴入CuSO4溶液, 片刻后可观察到的现象是
A. 铁圈和银圈左右摇摆不定 B. 保持平衡状态 C. 铁圈向下倾斜,银圈向上倾斜
D D. 银圈向下倾斜,铁圈向上倾斜
4、利用下面反应设计原电池选择电极材料和电 解质溶液,写出电极方程式;并画出原电池简意 图。
该反应是___氧__化___反应;Cu电极是__正__极,
其电极反应为C_u__2+__+__2_e__- _=__C__u,该反应是__还__原_____反应.
原电池的工作原理
负极
电子e- 电流I
正极
失e-
得e-
氧化反应
还原反应
装置的关键: 把氧化反应和还原反应分开在不同的区域进行,再 以适当的方式连接起来,就可以获得电流.
高中化学人教选修四课件:第4章 第1节 原电池(共80张PPT)

4.下图是锌、 铜和稀硫酸组成的原电池,某实验兴趣小组同 学做完实验后,在读书卡片上记录如下: 卡片:No.28 时间:2015.03.20 实验后的记录: ①Zn 为正极,Cu 为负极 ②H+向负极移动 ③电子流动方向为 Zn ④Cu 极有 H2 产生 ⑤若有 1 mol 电子流过导线,则产生的 H2 为 0.5 mol ⑥正极反应式:Zn-2eZn2+ Cu
【解析】 在该原电池中负极为 Zn,电极反应式为 Zn-2e正极为铜,电极反应式为 Cu2++2e移电子数(由 a 到 b)为
0.64 g
-1
Zn2+,
Cu,当铜电极增加 0.64 g 时,转
64 g · mo l
×6.02×1023 mol-1×2=1.204×1022。盐
桥中 K+向正极区(右侧烧杯)移动,Cl-向负极区(左侧烧杯)移动。 【答案】(1)由 a 到 b(或 a→b) (2)Zn-2eZn2+
1.原电池的概念 原电池是利用①氧化还原反应原理将②化学能转化为③电能的 装置。 2.原电池工作原理(以锌铜原电池为例)
装置
Байду номын сангаас
电极材料 电极名称 得失电子 电子流向 反应类型 电极反应式 总反应式
Zn 电极 ④负极 ⑥失电子 流⑧出 ⑩氧化反应 Zn-2e- Zn2+
Cu 电极 ⑤正极 ⑦得电子 流⑨入 还原反应 Cu2++2e- Cu Cu2++2e- Cu
(3)1.204×1022 (4)B
活动探究 2:原电池原理的应用
1.若用纯锌与粗锌(含 Fe、C 等)分别与同浓度的稀 H2SO4 反应 制取 H2,哪种方法产生 H2 的速率快?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章电化学基础
第一节原电池学案
班级_____________姓名____________
【学习目标】
1、了解原电池原理;
2、掌握原电池正、负极的判断及构成原电池的条件;电极反应式的书写;
3、理解铜锌原电池的原理与结构。
【学习重点】原电池原理
【学习过程】
一、原电池
1、定义:把______________转变为_________的装置
负极:电子流出的一极,发生_________反应
负极反应:____________________________________
正极:电子流入的一极,发生_________反应
正极反应:____________________________________
总反应式:____________________________________
2、工作原理:自发的______________反应
3、粒子流向:
外部(电子):________极经外电路流向_______极
内部(阴、阳离子):阳离子向_______移动,阴离子向______移动。
4、构成条件:
①一般要具备__________的两个电极(可以是金属与金属、金属与非金属导体或金属氧化物)(燃料电池的两个电极可以相同—如Pt);
②要有________溶液;③构成____________;④一个自发进行的___________反应。
5、原电池正、负极的判断方法
(1)由组成原电池的两极材料判断:
一般负极——活泼性_______的金属;
正极——活泼性_______的金属或非金属导体以及某些金属氧化物。
(2)根据电流方向或电子流向判断:
负极——电子________或电流________;正极——电子_________或电流________。
(3)根据电极反应类型来判断:
负极——_____电子,发生________反应;正极——______电子发生________反应。
(4)根据电极现象来判断:
负极——不断溶解,质量减少;
正极——产生气体,或质量增加或不变。
(5)根据电解质溶液离子移动的方向判断:
阴离子——向_____极移动(负极带正电荷);阳离子——向_____极移动(正极带负电荷);
(6)燃料电池中:燃料在______极反应、氧化剂在______极反应。
二、对锌铜原电池工作原理的进一步探究
【思考】改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?
1.盐桥的作用:
维持溶液电中性,保证电子流动,使电池更为稳定;可用NH4NO3代替KCl作盐桥。
2.盐桥中离子的流向:
Cl—向__________溶液扩散和迁移,阳离子K+则向_________溶液扩散和迁移
3.电解质溶液和电极材料的选择(电池的电极必须导电)
电解质溶液一般要能够与负极发生反应,左右两个烧杯中的电解质溶液应与电极材料具有相同的________离子。
4.电极反应式的书写:
从上述实验可以看出,原电池由两个半电池组成,Zn 和ZnSO4溶液组成锌半电池;Cu和CuSO4溶液组成铜半电池,中间通过盐桥连接起来。
负极(锌片):___________________(______反应)
正极(铜片):___________________ (______反应)
电池反应(总化学方程式):Zn + Cu2+ = Zn2+ + Cu
原电池的表示方法:
电池符号:Zn ︱ZnSO4‖CuSO4 ︱Cu
负极盐桥正极
设计成如右图所示的原电池。
下列
例1、控制适合的条件,将反应2Fe3++2I—2Fe2++I
判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
Fe 被还原
B.反应开始时,甲中石墨电极上3
C.电流计读数为零时,反应达到化学平衡状态
FeCl固体,
D.电流计读数为零后,在甲中溶入
2
乙中的石墨电极为负极
三、电极方程式的书写
例2、判断右边原电池的正、负极,并写出电极反应式。
先写出总反应:即负极与电解质溶液反应
_______________________________________________________
拆成离子方程式:_______________________________________
根据化合价升降判断正负极
负极:______________________________ 正极:____________________________
例3、请写出右边原电池的电极方程式。
总反应方程式:_____________________________________________
拆成离子方程式:___________________________________________
根据化合价升降判断正负极
负极:_____________________________________________________
负极总反应:_______________________________________________
正极:总反应-负极反应_____________________________________
即时巩固将镁条、铝条平行插入盛有一定浓度NaOH溶液的烧杯中,用导线和电流表连接
成原电池,装置如图所示。
此电池工作时,下列叙述正确的是()
A.Mg比Al活泼,Mg失去电子被氧化成Mg2+
B.铝条表面虽有氧化膜,但可不必处理
C.该电池的内外电路中,电流均是由电子定向移动形成的
D.Al是电池负极,开始工作时溶液中会立即有白色沉淀析出
四、原电池的设计
例:将下列反应设计一个原电池:Fe + Cu2+=Fe2+ +Cu
(1)先确定还原剂和氧化剂;
(2)再确定电极材料和电解质溶液。
【课堂练习】
1、根据以下反应设计一个能持续稳定产生电流的原电池装置,画出装置图。
Cu+2AgNO3=Cu(NO3)2+2Ag
2、下列装置中电流表指针会发生偏转的是()
3、锌铜原电池产生电流时,阳离子()
A、移向Zn极,阴离子移向Cu 极
B、移向Cu极,阴离子移向Zn极
C、和阴离子都移向Zn极
D、和阴离子都移向Cu 极
4、把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。
若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,
b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A、a > b > c > d
B、a > c > d > b
C、c > a > b .> d
D、b > d > c > a
5、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使
之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
A、铁圈和银圈左右摇摆不定
B、保持平衡状态
C、铁圈向下倾斜,银圈向上倾斜
D、银圈向下倾斜,铁圈向上倾斜
【课后检测】
1.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段
时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
2.(广东卷)用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3 的U型管)构成一个原电池。
以下有关该原电池的叙述正确的是()
①在外电路中,电流由铜电极流向银电极②正极反应为:Ag++ e- =Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①②B.②③C.②④D.③④
3.(执信中学高三期中考试)关于右图所示的原电池,下列说法正确的是()
A.电子从锌电极通过检流计流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是2H++2e- =H2↑
4. 依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如下图所示。
请回答下列问题:
(1)电极X的材料是__________;电解质溶液Y是__________;
(2)银电极为电池的________极,发生的电极反应为_____________________________;
X电极上发生的电极反应为_________________________________________________;(3)外电路中的电子是从__________电极流向__________电极。
