食品微生物(菌落总数、大肠菌群)的测定
食品中菌落总数和大肠菌群检验的质量控制

质量控制的概念
质量控制是指为达到一定的目的而采用的一系列管理和技术手段,其目的是确 保产品或服务的质量满足规定的要求。在食品中菌落总数和大肠菌群检验中, 质量控制主要包括以下方面:制定质量控制计划,选择合适的检验方法,评估 质量结果等。
菌落总数和大肠菌群检验的质量 控制
1、样品采集、运输和保存
2、分子生物学方法
随着分子生物学技术的发展,分子生物学方法逐渐应用于菌落总数和大肠菌群 检验的质量控制中。该方法主要包括聚合酶链式反应(PCR)技术、基因测序 等方法,具有快速、准确、灵敏度高等优点。同时,该方法能够直接检测食品 中的微生物,避免了传统微生物学方法中培养基和生化反应的繁琐操作。
3、代谢组学方法
菌落总数是指一定数量样品中在同一培养条件下生长的微生物菌落的总数,是 用来判断食品被细菌污染的程度。大肠菌群则是肠道中最常见的细菌,其存在 通常表示卫生条件较差,是评价食品卫生质量的重要指标之一。
本次演示旨在探讨月饼中菌落总数来自大肠菌群的检测方法和标准。在实验室内, 我们采用了不同品牌、不同工艺的月饼样品进行微生物检测。首先,将月饼样 品进行实验室培养,然后通过计数和统计分析等方法,分别计算出菌落总数和 大肠菌群的数量。
3、结果评估
结果评估是菌落总数和大肠菌群检验的质量控制的最后一个环节。根据实验结 果,应对检验过程进行总结和评估,以发现存在的问题和不足之处。同时,应 采用统计分析等方法,对检验结果进行修正和优化,以提高检验的准确性和可 靠性。
1、传统微生物学方法
传统微生物学方法是菌落总数和大肠菌群检验的基本方法,也是目前常用的质 量控制方法之一。该方法主要包括培养法、生化反应法等,能够较为准确地测 定菌落总数和大肠菌群的数量和种类。然而,该方法操作繁琐,耗时较长,且 需要专业人员操作。
食品卫生微生物学检验菌落总数测定

整理课件
4.7.2 制法 将除琼脂以外的各成分溶解于蒸馏水内,加入
15 %氢氧化钠溶液约2mL,校正pH至7.2 ~7.4 。 加入琼脂,加热煮沸,使琼脂溶化。分装烧瓶, 121℃高压灭菌15 min 。 注:此培养基可供一般细菌培养之用,可倾注平板 或制成斜面。如用于菌落计数,琼脂量为 1.5 %; 如作成平板或斜面,则应为2%。
整理课件
5.2 磷酸盐缓冲液:按GB/T 4789.28 — 2003 中 3.22 规定
磷酸二氢钾 1mol/L氢氧化钠溶液 蒸馏水 pH 7.2
34 g 175 mL 825 mL
整理课件
制法: 先将磷酸盐溶解于 500 mL蒸馏水中,用
1mol/L 氢氧化钠溶液校正pH后,再用蒸馏水稀 释至 1000 mL。 稀释液:取储存液 1.25 mL,用蒸馏水稀释至 1000 mL。分装每瓶 100 mL 或每管 10 mL, 121 ℃ 高压灭菌 15 min。 5.3 0.85 %灭菌生理盐水 5.4 75 %乙醇
固体检样在加入稀释液后,最好置均质器中 以8000~10000 r/min的速度处理 1 min,做成 1:10的均匀稀释液。
整理课件
7.1.2 用 1 mL灭菌吸管吸取 1:10稀释液 1 mL, 沿管壁徐徐注入含有 9 mL灭菌生理盐水或其 他稀释液的试管内(注意吸管尖端不要触及管 内稀释液),振摇试管,混合均匀,做成 1: 100 的稀释液。
整理课件
7.2 菌落计数方法 做平板菌落计数时,可用肉眼观察,必要
时用放大镜检查,以防遗漏。在记下各平板的 菌落数后,求出同稀释度的各平板平均菌落总 数。 注: 到达规定培养时间,应立即计数。如果不 能立即计数,应将平板放置于 0-4 ℃,但不 得超过 24 h。
菌落总数大肠菌群检验范例
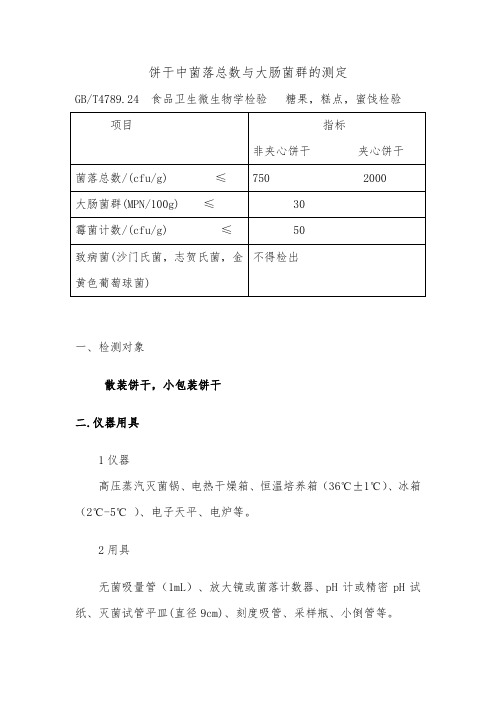
饼干中菌落总数与大肠菌群的测定GB/T4789.24 食品卫生微生物学检验糖果,糕点,蜜饯检验一、检测对象散装饼干,小包装饼干二.仪器用具1仪器高压蒸汽灭菌锅、电热干燥箱、恒温培养箱(36℃±1℃)、冰箱(2℃-5℃ )、电子天平、电炉等。
2用具无菌吸量管(1mL)、放大镜或菌落计数器、pH计或精密pH试纸、灭菌试管平皿(直径9cm)、刻度吸管、采样瓶、小倒管等。
三.食品的采样方法采样应遵循无菌操作程序,采样工具和容器应无菌、干燥、防漏,形状及大小适宜。
1.即食类预包装食品取相同批次的最小零售原包装,检验前要保持包装的完整,避免污染。
2. 散装食品或现场制作食品根据不同食品的种类和状态及相应检验方法中规定的检验单位,用无菌采样器现场采集5倍或以上检验单位的样品,放入无菌采样容器内, 采样总量应满足微生物指标检验的要求。
3. 采集样品的标记应对采集的样品进行及时、准确的记录和标记,采样人应清晰填写采样单(包括采样人、采样地点、时间、样品名称、来源、批号、数量、保存条件等信息)。
4.5 采集样品的贮存和运输采样后,应将样品在接近原有贮存温度条件下尽快送往实验室检验。
运输时应保持样品完整。
如不能及时运送,应在接近原有贮存温度条件下贮存。
四.菌落总数的测定1.菌落总数aerobic plate count:食品检样经过处理,在一定条件下(如培养基、培养温度和培养时间等)培养后,所得每g(mL)检样中形成的微生物菌落总数。
2. GB 4789.2-2010 菌落总数测定流程检样25 g(mL)样品+225 mL稀释液,均质↓10 倍系列稀释↓选择2 个~3 个适宜稀释度的样品匀液,各取1 mL 分别加入无菌培养皿内,每皿中加入15 mL~20 mL平板计数琼脂,混匀↓36 ℃±1 ℃,48 h± 2 h培养,计数各平板菌落数↓报告2.菌落计算公式有两个稀释度的菌落数在合适范围,按照如下公式计算:N = ΣC / [n1 + (0.1×n2) ] ×(d)N = 样品中菌落数ΣC =平板菌落数之和n1 = 含合适范围菌落数的第一稀释度(低)平板数n2 =含合适范围菌落数的第二稀释度(高)平板数d = 第一稀释度(低)3. 平板计数琼脂培养基成分A胰蛋白胨 5.0gB 酵母浸膏 2.5 gC 葡萄糖 1.0 gD 琼脂 15.0 gE 蒸馏水 1000 mLpH 7.0 +/- 0.2制法将上述成分加于蒸馏水中,煮沸溶解,调节pH.分装试管或锥形瓶,经121℃高压灭菌15min.五.大肠菌群的测定1.GB 4789.3-2010大肠菌群计数a.检样25 g+225 mL稀释液b.适当十倍稀释样品c.选择3个适宜的连续稀释度的样品稀释液,每个稀释度接种三管LST 肉汤(每管9 mL LST肉汤并加有导管),每管接种1 mLd.36℃,24 ± 2 h ~48 ± 2 he.没有产气管有产气管,报告阴性有产气管,接种BGLB肉汤管,36 ±℃,48 ±2h,查MPN表报告结果(大肠菌群).有产气管,接种EC肉汤,44.5±0.5 ℃(水浴培养),24 ± 2 h ~48 ±2 h.产气管接种EMB平板(36℃、18~24 h).从EMB平板上挑取5个可疑菌转接到PCA斜面,进行革兰氏染色、IMVC生化鉴定、接种LST复检产气,查MPN表报告结果(大肠杆菌)2.培养基Ⅰ .LST成份胰蛋白胨或胰酪胨 20.0 g乳糖 5.0 g氯化钠 5 .0g磷酸氢二钾 2.75g磷酸二氢钾 2.75g月桂基硫酸钠 0.1g蒸馏水 1000 mLpH 6.8 +/- 0.2制法将上述成分溶解于蒸馏水中,调节pH.分装到有玻璃小倒管的试管中,每管10mL。
食品中细菌菌落总数和大肠菌群的检测

二0一三年一月
概念认识——菌落总数ቤተ መጻሕፍቲ ባይዱerobic plate count
食品检样经过处理,在一定条件下(如培养基、 培养温度和培养时间等)培养后,所得每 g(mL)检样中形成的微生物菌落总数。
概念认识——大肠菌群coliforms
在一定培养条件下 能发酵乳糖、产酸 产气的需氧和兼性 厌氧革兰氏阴性 无芽孢杆菌
食品微生物学检验 菌落总数测定
解读标准——GB/T 4789.3-2003
食品卫生微生物学检验 大肠菌群测定
为规范食品中大肠菌群指标的检测工作,现公告如下: 现行食品标准中规定的大肠菌群指标以“MPN/100克或 MPN/100毫升”为单位的,适用《食品卫生微生物学检验大 肠菌群测定》(GB/T4789.3-2003)进行检测;以“MPN/克或 MPN/毫升”、“CFU/克或CFU/毫升”为单位的,适用《食品 卫生微生物学检验大肠菌群计数》(GB/T4789.3-2008)进行 检测。 特此公告。
二○○九年十月二十六日
解读标准
GB 7099-2003 糕点、面包卫生标准
GB/T 4789.24-2003 食品卫生微生物学检验 糖果、糕点、蜜饯检验 GB 4789.1-2010 食品安全国家标准 食品微生物学检验 总则
GB 4789.2-2010 食品安全国家标准 食品微生物学检验 菌落总数测定
GB/T 4789.3-2003 食品卫生微生物学检验 大肠菌群测定
解读标准——GB 7099-2003 糕点、面包卫生标准
解读标准——GB/T 4789.24-2003 食品卫生微生物学检验
糖果、糕点、蜜饯检验
解读标准——GB 4789.1-2010 食品安全国家标准
9.6.186.食品微生物快速检测大肠菌群快速检测
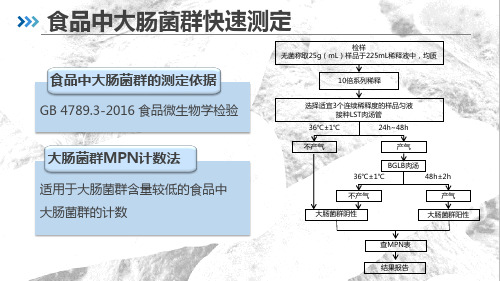
食品中大肠菌群的测定依据
检样 无菌称取25g(mL)样品于225mL稀释液中,均质
10倍系列稀释
GB 4789.3-2016 食品微生物学检验
大肠菌群MPN计数法
适用于大肠菌群含量较低的食品中 大肠菌群的计数
选择适宜3个连续稀释度h
演示完毕,感谢您的聆听
不产气
产气
BGLB肉汤
36℃±1℃
48h±2h
不产气
产气
大肠菌群阴性
大肠菌群阳性
查MPN表 结果报告
结果判读
1 大肠菌群在测试片上生长后产酸。 2 pH指示剂使培养基颜色变深,在红色
菌落周围有气泡者为大肠菌群。 3 记录每个稀释度大肠菌群阳性纸片数。 4 根据大肠菌群MPN表查出相应的大肠菌群数。
是微生物检验诸多快速方法中比较成熟的方法之一。
已被广大卫生检验者所接受。目前已广泛应用于食品、 餐饮业、卫生、环保、水质检验等。
总结
思考题
1.大肠菌群快速检测方法与国标检测方法的异同? 2.大肠菌群快速检测的测试片为什么会使产生使纸片颜 色加深周围并有气泡的菌落? 3.如何对测试片的生长结果进行计数? 4.大肠菌群快速检测适合在那些领域使用?
测试片结果解读
测试片可能会出现如下现象
1)没有任何菌落生长,不要计算圆形培养基外的菌落。因为泡棉上 已不含选择性培养基。
测试片结果解读
测试片可能会出现如下现象
2)当菌落数超过220时,可选择其中一个或几个有代表性的小方格,计算 平均菌落数,再乘以20得到整个测试片的菌落数。当有许多气泡,培养基 颜色变深暗,有很多小菌落时,记为多不可计。
测试片结果解读
测试片可能会出现如下现象
食品微生物检验的指标

2、大肠菌群 、 大肠菌群包括大肠杆菌和产气杆菌的一些中 间类型的细菌。这些细菌是寄居于人及温血动物 肠道内的肠居菌,它随着的大便排出体外。食品 中如果大肠菌群数越多,说明食品受粪便污染的 程度越大。故以大肠菌群作为粪便污染食品的卫 生指标来评价食品的质量,具有广泛的意义。
3、致病菌 、 致病菌既能够引起人们发病的细菌。对不同 的食品和不同的场合,应该选择一定的参考菌群 进行检验。例如:海产品以副溶血性弧菌作为参 考菌群,蛋与蛋制品以沙门氏菌、金黄色葡萄球 菌、变形杆菌等作为参考菌群,米、面类食品以 蜡样芽孢杆菌、变形杆菌、霉菌等作为参考菌群, 罐头食品以耐热性芽孢菌作为参考菌群等等。
三 食品微生物检验的指标 食品微生物检验的指标就是根据食品卫生的要 求,从微生物学的角度,对不同食品所提出的与 食品有关的具体指标要求。
ห้องสมุดไป่ตู้
我国卫生部颁布的食品微生物指标有菌落总 数、大肠菌群和致病菌三项。
1、菌落总数 、 菌落总数是指食品检样经过处理,在一定条 件下培养后所得1g或1ml检样中所含细菌菌落的总 数。它可以反应食品的新鲜度、被细菌污染的程 度、生产过程中食品是否变质和食品生产的一般 卫生状况等。因此它是判断食品卫生质量的重要 依据之一。
4、霉菌及其毒素 、 我国还没有制定出霉菌的具体指标,鉴于有 很多霉菌能够产生毒素,引起疾病,故应该对产 毒霉菌进行检验。例如:曲霉属的黄曲霉、寄生 曲霉等,青酶属的桔青酶、岛青酶等,镰刀酶属 的串珠镰刀酶,禾谷镰刀酶等等。
5、其它指标 、 微生物指标还应包括病毒,肝炎病毒、猪瘟 病毒、鸡新城疫病毒、马立克氏病毒、口蹄疫病 毒,狂犬病病毒,猪水泡病毒等;另外,从食品 检验的角度考虑,寄生虫也被很多学者列为微生 物检验的指标:如旋毛虫,囊尾蚴,住肉孢子虫、 蛔虫,肺吸虫,弓形体,螨,姜片吸虫,中华分 枝睾吸虫等等 。
食品微生物学检验

GB4789.2-2016 菌落总数测定
c、其中一个平板有较大片装菌落生长时,而应以无片装菌落生长的平板作 为该稀释度的菌落总数,若片装菌落不到平板的一半,而其余一半中菌 落分布又很均匀,即可计算半个平板后乘以2,代表一个平板菌落数。 d、当平板上出现菌落间无明显界限的链状生长时,则将每条单链作为一个 菌落计数。
6.3如空白对照平板长有菌落出现,此次结果无效 6.4以CFU/g或CFU/ml为单位报告,报告或分别报告霉菌和/或酵 母菌数霉菌蔓延生长覆盖整个平板的可记录为菌落蔓延!
多不可计
GB4789.3-2016 大肠菌群计数
1.范围 1.1本标准第一法(MPN)法适用于大肠菌群含量较低的食品中大肠菌群 的计数 1.2第二法(平板计数法)适用于大肠菌群含量较高的食品中大肠菌群的 计数 2.设备 3.培养基和试剂:月桂基硫酸盐胰蛋白胨,煌绿乳糖胆盐,结晶紫中性 红胆盐琼脂,磷酸盐缓冲液,无菌生理盐水。
2.6.4对实验室分离菌株(野生菌株),经过鉴定后,可作为实验 室内部质量控制菌株。
总则GB4789.1-2016 实验室的基本要求
3.样品的采集 3.1采样原则:无菌操作,应遵循随机性、代表性。 3.2采样方案 3.2.1根据采检样目的、食品的特点、批量、检验方法、微生物 的危害程度等确定采样方案。采样方案分为二级n、c、m和三 级采样方案n、c、m、M
国标号 2003版 2016版
培养基
证实试验
单位报告
乳糖胆盐发酵管 伊红美蓝平板 乳糖发酵管 分离培养基 证实试验 革兰氏染色 复发酵试验 MPN/100ml(g)
LST发酵管 BGLB发酵管
仅进行复发酵试验
MPN/ml(g)
大肠菌群MPN 检索表(2010和2016)
实验四食品中细菌总数及大肠菌群的检测

1、掌握食品中微生物学基本指标的检测 方法。了解食品质量与细菌和大肠菌群数 量的重要关系 2、通过实验,初步掌握食品中污染的活 细菌计数方法,以判别食品的卫生质量
二、实验原理
1、菌落总数主要作为判别食品被污染程度的标志,也可以应 用这一方法观察细菌在食品中繁殖的动态,以便对被检样品进 行卫生学评价时提供依据。
2、大肠菌群系指一群能发酵乳糖,产酸产气,需氧和兼性厌 氧的革兰氏阴性无芽孢杆菌。
由肠杆菌科中四个菌属内的一些细菌所组成,即艾希氏菌属、 枸橼酸杆菌属、产气克雷伯氏菌属和肠杆菌属。
该菌主要来源于人畜粪便,故以此作为粪便污染指标来评价 食品的卫生质量,具有广泛的卫生学意义。
三、实验材料
一、待测样品: 奶粉还原液、豆腐等。 二、培养基
将所有产气的LST发酵管分别转接在BGLB肉汤管中,置 361℃温箱内,培养48h 2 小时,然后取出,观察产气情况。 产气者,计为大肠菌群阳性管 3.报告
根据复发酵试验的阳性管数,查大肠菌群最可能数(MPN)检 索表。得出每1m1(g)食品中存在的大肠菌群数的近似值。
检样25g或25ml+225ml稀释液,均质
(3) 另取枪头,按上述操作进行10系列稀释成不同浓度的稀释液,如此每递增 稀释一次,即换用1支无菌枪头。
(4) 根据对标本污染情况的估计,选择2-3个稀释度,分别在作10倍递增稀释的 同时,即吸取该稀释度的稀释液1ml于灭菌培养平皿内,每个稀释度作两个 平皿。
(5) 稀释液吸入平皿后,将融化并冷却至45℃的平板计数琼脂培养基注入平皿 约15ml,并转动平皿使其混合均匀,同时将营养琼脂培养基倾入加有1ml灭 菌生理盐水的灭菌平皿作空白对照。
(6) 待琼脂凝固后,翻转平板,置36+1℃恒温箱内培养482小时后取出,计算 平板内菌落数目,乘以稀释倍数,即得每克样品所含25g(或25ml)样品+225ml稀释液,均质
细菌菌落总数的测定

编辑课件
22
(三)菌落总数的计算
1、若只有一个稀释度平板上的菌落数在 适宜计数范围内,计算两个平板菌落数的 平均值,再将平均值乘以相应稀释倍数, 作为每g(mL)中菌落总数结果。
编辑课件
23
编辑课件
24
2、若有两个连续稀释度的平板菌落数在适宜计
数范围内时,按如下公式计算: N=∑C/(n1+0.1n2)d…………(1 ) 式中: N ― 样品中菌落数; ∑C ― 平板(含适宜范围菌落数的平板)菌落 数之和; nl ― 第一个适宜稀释度平板数; n2 ― 第二个适宜稀释度平板数; d ― 稀释因子(第一稀释度)。
编辑课件
9
三 、 材料
1、 食品检样 2、 培养基 平板计数培养基,无菌生理盐水或磷酸 盐缓冲液 3、 其它 无菌培养皿,无菌吸管,电炉、恒温培 养箱等。
编辑课件
10
四、 流程
1、检样 2、做几个适当倍数的稀释液 3、选择2~3个适宜稀释度各1 mL,分别加入
灭菌平皿内 4、平皿内倾注15~20 mL琼脂培养基,混匀 5、36 ±1℃培养48±2小时或(24±2)小
编辑课件
20
2、其中一个平板有较大片状菌落生 长时,则不宜采用,而应以无片状菌落 生长的平板作为该稀释度的菌落数;若 片状菌落不到平板的一半,而其余一半 中菌落分布又很均匀,则可以计算半个 平板后乘以2,以代表一个平板的菌落数。
编辑课件
21
3、当平板上有链状菌落生长时, 如呈链状生长的菌落之间无任何明显 界限,则应作为一个菌落计,如存在 有几条不同来源的链,则每条链均应 按一个菌落计算,不要把链上生长的 每一个菌落分开计数。
编辑课件
25
例如:
食品中细菌菌落总数及大肠菌群的检测实验报告

实验九食品中细菌菌落总数及大肠菌群的检测[实验目的]1、了解国家规定的食品质量与细菌菌落总数和大肠菌群数量的重要关系。
2、掌握食品细中细菌菌落总数及大肠菌群的检测方法。
[实验原理]菌落总数根据稀释平板技术法检测每mL/g检样在牛肉膏蛋白胨琼脂培养基上,经37℃、24h培养后,所生长的细菌菌落的总数。
它所反映的是检样中的活菌数,细菌数越多,说明污染程度越大,这项指标可作为判定待测样品被污染的程度。
大肠菌群数是在100mL(g)食品中(或1000 mL水中)大肠菌群最近似值。
它是指肠杆菌科中的4个属,即埃希氏菌属、柠檬酸杆菌属、克雷伯氏菌属和肠杆菌属。
这一菌群致病力不强,具有共同特点:好氧和兼性厌氧、革兰氏染色阴性反应、无芽孢杆菌、37℃培养24-48h能发酵乳糖产酸产气。
大肠菌群在人畜肠道内含量最多,可随排泄物进入水源或污染食品。
国际公认以大肠菌群的存在作为粪便污染指标。
这项指标可判定待测样品有无被粪便污染及污染的程度。
[实验材料]1、检样牛乳(饮料、酱油)2、培养基普通营养琼脂平板、单料乳糖胆盐发酵培养基、乳糖发酵培养基、EMB平板3、仪器和其他物品恒温箱、水浴锅、无菌培养皿、无菌吸管、无菌盐水瓶(内装225 mL无菌生理盐水)、无菌试管(内装9 mL无菌生理盐水)、灭菌剪刀、镊子等[实验内容]1、细菌菌落总数的测定(1)制备样品及样品稀释取待测样品(牛乳、酱油)一瓶,用点燃的酒精棉球烧灼瓶口,若是塑料瓶则用75%的酒精棉球擦拭灭菌。
在无菌条件下取样25 mL放入内装225 mL生理盐水的瓶中,充分混匀,制成10-1的稀释液。
用1 mL无菌吸管吸取10-1稀释液1mL,沿管壁徐徐注入装有9mL无菌生理盐水的试管中(注意,吸管尖端不要触及管内稀释液),振荡试管,混合均匀,制成10-2的稀释液。
另取1mL无菌吸管,按上述操作方法做成10-3稀释液。
每次稀释,换用一支无菌吸管,共做10-1、10-2、10-3三个稀释度,分别含样品0.1mL,0.01mL,0.001mL。
食品中菌落总数和大肠菌群检验

122 食品安全导刊 2020年1月T logy科技分析与检测食品安全问题与人们的饮食健康息息相关,因此受到了人们的高度重视。
为了让人们吃的安心和放心,相关检测部门必须要积极开展食品检验工作,从安全和营养角度入手进行严格的检测工作。
1 开展食品检验工作时的前期准备环节在食品检验工作当中,为了保证检验工作的质量和水平,确保检验工作结果的精准性,应当要做好充足的前期准备环节。
1.1 人才培训教育首先,食品检验工作一般需要由专门的工作人员完成。
因此,为了推动检验工作的顺利开展,检验部门应当积极开展人员考核工作,考察检验人员的工作能力。
并积极展开人才教育培训工作,研究提高检验人员工作能力和工作素质的关键方法。
其次,应当建立健全监管机制,利用内部严格的管理条例,保证检验人员能够按照规定的检验工作流程,有序完成各项工作,确保检验结果的真实性和有效性。
1.2 基础设施完善在实际开展食品检验工作时,应当确保检验使用的仪器设备及药品准备齐全。
采取试运行操作,观察仪器的运行状态,避免发生安全隐患。
并应当关注药品的保存方式,避免药品出现过期或者失效的情况而影响食品检验的结果。
同时,要对检验空间做好消毒处理,保证整个过程都在无菌环境下进行。
这是保证检验工作卫生程度的基础前提,为食品检验工作的顺利开展提供了基础保障。
2 食品菌落总数的整体检验工作流程根据国家标准方法GB 4789.2-2016《食品安全国家标准 食品微生物学检验 菌落总数测定》,对菌落总数的检验实行平皿计数法。
以确保检验工作的质量和效果。
2.1 稀释实验在进行食品菌落总数检验的质量控制工作时,首先应当对不同的食品种类进行分析,结合食品的生产加工特点及营养价值成分,选择合适的稀释度,一般都将稀释度保持在2~3个连续稀释度上。
稀释度的高低应当结合食品当中含有的细菌种类和数量进行调整,比如,在对销售环节的矿泉水进行检测时就可以适当降低稀释度,这是因为饮用水当中的细菌含量相对较低,且都经过了人工过滤处理,检查的重点就是水体是否存在污染问题。
微生物检测注意事项——大肠菌群和菌落总数

分析与检测T logy科技30 食品安全导刊 2018年9月我国卫生部颁布的食品微生物指标有菌落总数、大肠菌群和致病菌3项,其中致病菌一般指“肠道致病菌和致病性球菌”,主要包括沙门氏菌、志贺氏菌、金黄色葡萄球菌、致病性链球菌4种。
此外,鉴于很多霉菌能够产生毒素,引起消费者食物中毒及其他疾病,故特定产品也应对产毒霉菌进行检验。
大肠菌群检测注意事项方法选择大肠菌群(C o l i f o r m b a c t e r i a)是指一群能发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。
该菌主要来源于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,推断食品中是否有污染肠道致病菌的可能。
大肠菌群分布较广,在温血动物粪便和自然界中广泛存在。
调查研究表明,大肠菌群多存在于温血动物粪便、人类经常活动的场所以及有粪便污染的地方。
人、畜粪便对外界环境的污染是大肠菌群在自然界存在的主要原因之一,粪便中多以典型大肠杆菌为主,而外界环境中则大肠菌群的其他菌株较多。
大肠菌群检测的关键在于方法的选用,食品中大肠菌群检测有两种表示方法,其一是以100m L(g)检样内大肠菌群最大可能数(M P N)表示,检测方法需使用G B/T4789.3-2003《食品卫生微生物学检验大肠菌群测定》;其二以每g(m L)样品中大肠菌群的MP N值表示,检测方法需使用G B4789.3-2016《食品安全国家标准食品微生物学检验大肠菌群计数》。
G B/T4789.3-2003《食品卫生微生物学检验大肠菌群测定》虽然被后更新的方法代替,但卫生部关于规范食品中大肠菌群指标的检测工作公告(2009年第16号)明确指出,为规范食品中大肠菌群指标的检测工作公告如下:现行食品标准中规定的大肠菌群指标以“M P N/100克或M P N/100毫升”为单位的,适用《食品卫生微生物学检验大微生物检测注意事项——大肠菌群和菌落总数□ 董玲 上海英斯贝克商品检验有限公司大肠菌群(Coliform bacteria)是指一群能发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。
菌落总数和大肠菌群测定方法

菌落总数和大肠菌群测定方法菌落总数和大肠菌群的测定方法如下:一、菌落总数的测定方法菌落总数是指食品样品在一定条件下培养后,得到的1克或1毫升样品中所含的活菌个数。
它反映了食品在生产过程中的卫生状况,是判定食品质量的重要指标之一。
1.样品处理:根据样品是固体或液体,采用不同的处理方法。
对于固体样品,先进行均质化处理,将其粉碎并混匀。
对于液体样品,直接进行摇匀。
2.稀释:根据样品的污染程度,将样品稀释至适当浓度。
通常采用系列稀释的方法,即先将样品稀释10倍,再稀释10倍,直到适合接种。
3.接种:将稀释后的样品接种到培养基上,可以采用倾注法或涂布法。
倾注法是将稀释后的样品倒入培养皿中,摇匀后倾注培养基;涂布法是将稀释后的样品均匀涂布在培养基表面。
4.培养:将接种后的培养皿放在适宜的温度和湿度下培养,一般培养时间为24-48小时。
5.计数:观察培养后的菌落数量,并计算每克或每毫升样品中的菌落总数。
二、大肠菌群的测定方法大肠菌群是指一群能在30℃-37℃的伊红美蓝琼脂平板上生长并产生深紫色素的革兰氏阴性无芽孢杆菌。
它主要来源于肠道,是人类肠道中的主要菌群之一。
大肠菌群的测定对于食品卫生质量的控制具有重要意义。
1.样品处理:与菌落总数测定类似,将固体或液体样品进行均质化处理和稀释。
2.接种:将稀释后的样品接种到伊红美蓝琼脂平板上,可以采用倾注法或涂布法。
3.培养:将接种后的平板放在适宜的温度和湿度下培养,一般培养时间为24-48小时。
在培养过程中,大肠菌群会在伊红美蓝琼脂平板上形成深紫色的菌落。
4.验证试验:为了确保结果的准确性,需要进行验证试验。
可以采用革兰氏染色法对可疑菌落进行染色,以便确认是否为大肠菌群。
5.计数:观察培养后的菌落数量,并计算每克或每毫升样品中的大肠菌群数。
需要注意的是,上述方法仅供参考,具体操作步骤可能会因不同的检测机构或标准而有所差异。
在实际操作中,应根据具体情况进行调整和修改。
另外,为了保证检测结果的准确性和可靠性,需要注意实验室的卫生条件、仪器的校准、试剂的质量以及操作人员的专业素质等方面的因素。
食品中菌落总数与大肠菌群测定能力验证结果与分析

食品中菌落总数与大肠菌群测定能力验证结果与分析陈新颜,喻喜华*(国药控股星鲨制药(厦门)有限公司,厦门市母婴健康营养产品重点实验室,福建厦门 361026)摘 要:为了提高实验室菌落总数与大肠菌群检测能力,参加了2023年中国检验检疫科学研究院测试评价中心与一般财团法人日本食品检查协会联合组织的ACAS-PT1578(2023)中日联合微生物检测技能考核。
依据《食品安全国家标准食品微生物学检验菌落总数测定》(GB 4789.2—2022)、《食品安全国家标准食品微生物学检验大肠菌群计数》(GB 4789.3—2016)以及能力验证作业指导书要求进行样品检测,并采用不同方法进行结果比对。
本次能力验证两项测定结果均为满意。
其中,菌落总数测定|Z|值为0,大肠菌群计数|Z|值为0.2。
通过参加能力验证为实验室出具数据结果的可靠性和有效性提供了客观证据,提升了检验人员的检测水平。
关键词:能力验证;平板计数法;菌落总数;大肠菌群Analysis of the Validation Results of the Total Bacterial Count and Coliform Group Determination Ability in FoodCHEN Xinyan, YU Xihua*(Xiamen Key Laboratory of Maternal and Infant Health and Nutrition Products, Sinopharm Xingsha Pharmaceuticals(Xiamen) Co., Ltd., Xiamen 361026, China)Abstract: In order to improve the total number of bacterial colonies and coliform bacteria detection ability in the laboratory, we participated in the ACAS-PT1578 (2023) China-Japan joint microbial detection skills assessment jointly organized by the Test and Evaluation Center of the Chinese Academy of Inspection and Quarantine and the Japan Food Inspection Association. The samples were tested according to GB 4789.2—2022, GB 4789.3—2016 and the requirements of the capability verification operation instructions, and the results were compared by different methods. The results of both tests were satisfactory. Among them, the total number of colonies |Z| was 0, and the coliform count |Z| was 0.2. The participation ability verification provides objective evidence for the reliability and validity of data results issued by the laboratory, and improves the testing level of inspectors.Keywords: capability verification; plate counting method; total number of bacterial colonies; coliform group能力验证是利用实验室间比对,按照预先制定的准则评价参加者的测量或检测能力[1]。
食品微生物检验中菌落总数测定的注意事项

食品微生物检验中菌落总数测定的注意事项食品微生物检验中,菌落总数测定是一个重要的指标,它能够反映食品中的微生物质量。
但是,进行菌落总数测定需要注意以下几点: 1. 样品的采集和处理要严格按照规定程序进行,避免污染和误差。
2. 选择适当的培养基和培养条件,以保证菌落的正常生长和形成。
3. 在进行菌落计数时,要注意避免菌落重叠和合并,否则会影响计数的准确性。
4. 为了保证结果的可靠性,应该进行多次测定,取平均值作为最终结果。
5. 在测定中,要注意消毒和清洁操作,避免交叉污染。
通过以上几点的注意,可以有效提高菌落总数测定的准确性和可靠性,保证食品的安全和质量。
- 1 -。
食品微生物学检验 大肠菌群计数和菌落总数的测定

食品微生物学检验大肠菌群计数和菌落总数的测定摘要:菌落总数和大肠菌群超标是食品产品卫生指标中常见的质量问题,我国的国家标准对绝大多数食品都制订了菌落总数和大肠菌群的指标,并对其数量做了详细的规定。
菌落总数和大肠菌群是食品中安全性指标,是影响产品质量问题的常见指标,在对食品进行检测的时候菌落总数以及大肠菌群两项指标容易出现相应的检测问题[1],为了熟悉和掌握大肠菌群计数和菌落总数测定的方法和技术,本次实验以未经清洗的生菜为实验对象,用MPN计数法对大肠菌群进行计数,用平板倾注的方法培养微生物后观察获得的单菌落来测定菌落总数。
关键词:生菜;大肠菌群 MPN计数法;菌落总数;平板倾注一、前言:食品中菌落总数是指食品样检经过处理,在一定条件下(如培养基成分、培养温度和时间、PH值、需氧性质等)培养后,所得1mL(或1g) 检样中形成菌落的总数。
菌落总数测定通常是用来判定食品被微生物污染的程度及卫生质量,测定结果反映食品在生产过程中是否符合卫生要求,以便对被检样品做出适当的卫生学评价。
大肠菌群是一群在36℃条件下培养48h能发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴性无芽孢杆菌。
该菌群主要来源于人、畜粪便,作为粪便污染指标评价食品的卫生状况,推断食品中肠道致病菌污染的可能。
食品中大肠菌群数系以每1mL(g) 检样内大肠菌群最可能数(the most probable number,MPN)表示。
[2]二、实验材料与方法(一)实验材料1、实验器材高压灭菌锅恒温培养箱电子天平2、实验材料及试剂未经清洗的生菜无菌生理盐水3、菌落总数测定所用培养基及其配方平板计数琼脂(PCA)培养基胰蛋白胨5.0g 酵母浸膏2.5g 葡萄糖1.0g 琼脂15.0g 蒸馏水1000mL PH7.0±0.2 4、大肠菌群计数所用培养基及其配方4.1月桂基硫酸盐胰蛋白胨(LST)肉汤胰蛋白胨20.0g 氯化钠5.0g 乳糖5.0g 磷酸氢二钾(K2HPO4)2.75g磷酸二氢钾(KH2PO4)2.75g 月桂基硫酸钠0.1g 蒸馏水1000mL PH6.8±0.24.2煌绿乳糖胆盐(BGLB)肉汤蛋白胨10.0g 乳糖10.0g 牛胆粉(oxgall或oxbile)溶液200mL1%煌绿水溶液13.3mL 蒸馏水800mL PH7.2±0.1(二)实验方法(1)培养基、生理盐水的配制及灭菌1、生理盐水称取NaCl8g溶于1000mL蒸馏水中,配成0.8%的生理盐水,NaCl溶解完全后,取90ml 分装到250ml带玻璃珠的三角瓶中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
食品微生物(菌落总数、大肠菌群)的测定
一、灭菌前的准备
A、平板计数琼脂培养基的配制
用电子天平称取2.5g营养琼脂培养基于500ml三角烧瓶中,加入100ml蒸馏水,摇匀,塞好棉花塞,并包上一层牛皮纸,系上绳子扎紧。
B、月桂肉汤发酵管(双料)的配制
用电子天平称取7.2g月桂基硫酸盐胰蛋白胨(LST)发酵培养基于500ml 三角烧瓶中,加入100ml蒸馏水,用玻璃棒搅拌溶解均匀,用10ml吸量管吸取10ml放入18*18的试管中,每支试管装10ml,共10支试管,每支试管放入一个小倒管,倒摇排气后,塞好棉花塞。
C、取一支洁净的试管,用10ml吸量管吸取9ml无菌生理盐水放入其中,塞好棉花塞。
D、取洁净干燥的培养皿6套,用报纸包成一筒。
E、取洁净干燥的10ml吸量管5支,粗端塞入少量脱脂棉,每支吸量管用宽约4到5cm的纸条以45度左右的角度裹卷起来,包好。
F、取一个洁净的500ml三角烧瓶,用量筒取225ml无菌生理盐水,塞好棉花塞,并包上一层牛皮纸,系上绳子扎紧。
二、灭菌
1、加水:取出高压灭菌锅的内桶,再向外层锅内加入适量的蒸馏水,使水面与三角搁架相平为宜。
2、放灭菌物品:将内桶放回灭菌锅内,并将上述6项一起放入高压灭菌锅内桶。
3、加盖密封:将盖上的排气软管插入内层灭菌桶内的排气槽内,再以亮亮对称的方式同时旋紧相对的两个螺栓,使螺栓松紧一致,使器盖与主体密和。
4、加热:插入电源,关闭安全阀并同时打开放气阀,待到水沸腾后出气3到5min,以排尽锅内的冷空气,关闭放气阀,此时压力表指针朝顺时针方向缓动,显示灭菌锅的压力正在逐渐上升,同时温度随着升高。
5、灭菌:当锅内压力升到所需压力(0.15MPa)时,切断电源,待压力表指针缓缓降到0.1 Mpa时,再通上电源,待锅内压力上升到所需压力(0.15MPa)
时,切断电源,待压力表指针缓缓降到0.1 Mpa时,再通上电源,待锅内压力上升到所需压力,共重复三次。
最后一次切断电源后,等压力表指针降为0时,再打开排气阀,旋松螺栓,打开盖子,取出灭菌物品,及时放入无菌室。
三、接种
1、无菌室在使用之前,先开启紫外光15min,在进入无菌室之前要关闭紫外灯。
2、用沾有75%酒精的棉球擦洗双手。
3、注意控制操作温度:A项平板计数琼脂培养基要保温在46℃左右(可将平板计数琼脂培养基放在高压灭菌锅中,待要用时再取出。
),其余各样均要控制在室温。
4、接种:
(1)用电子天平取25g样品,用剪刀剪碎,放入装有225ml无菌生理盐水的三角烧瓶中,充分振摇成10-1(即1:10)的均匀稀释液。
(2)取3支10ml月桂基硫酸盐胰蛋白胨(LST)发酵培养基试管,各加入10ml10-1均匀稀释液,做好标记。
(3)另取3支10ml月桂基硫酸盐胰蛋白胨(LST)发酵培养基试管,各加入1ml10-1均匀稀释液,做好标记。
再取2个灭菌培养皿,各加入1ml10-1均匀稀释液,做好标。
(4)往装有9ml灭菌生理盐水的试管中加入1ml10-1均匀稀释液,充分振摇成10-2(即1:100)的均匀稀释液。
(5)取3支10ml月桂基硫酸盐胰蛋白胨(LST)发酵培养基试管,各加入1ml10-2均匀稀释液,做好标记。
再取2个灭菌培养皿,各加入1ml10-2均匀稀释液,做好标。
注:接种过程最好在酒精灯旁边操作;接种时培养皿只能打开一个小口,移液管能够伸进去或用三角烧瓶可以往里倒培养基即可;在每一次操作完时应及时将棉花塞塞好。
四、培养
待琼脂凝固后,将平板翻转,开启微生物培养箱,把接种好的培养皿、月桂基硫酸盐胰蛋白胨(LST)发酵管放入培养箱培养。
培养温度:36±1℃
培养时间:①菌落总数测定:48±2h(水产品:培养温度30±1℃,培养时间72±1h)。
②大肠菌群测定:24±2h,产气着进行复发酵试验;未产气着则继续培养至48±2h,产气着进行复发酵试验。
五、结果
1、菌落计数:可用肉眼观察,必要时用放大镜或菌落计数其,记录稀释倍数和相应的菌落数量。
选取菌落数在30CFU至300CFU之间、无蔓延菌落生长的平板计数菌落总数。
2、大肠菌群判断:观察是否有气泡产生,未产气者为大肠菌群阴性,产气着可认为该产品不合格。
大肠菌群最可能数按确认的达产菌群LST阳性管数,检索MPN表。
