小鼠(Mouse)肿瘤坏死因子β(TNF-β)-NEWA
小鼠肿瘤坏死因子α(TNF-α)说明书
200 ng/L
3 号标准品
150µl 的 4 号标准品加入 150µl 标准品稀释液
100 ng/L
2 号标准品
150µl 的 3 号标准品加入 150µl 标准品稀释液
50 ng/L
1 号标准品
150µl 的 2 号标准品加入 150µl 标准品稀释液
2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、
计算 以标准物的浓度为横坐标,OD 值为纵坐标,在坐标纸上绘出标准曲线,根据样品的
OD 值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与 OD 值计算出标
准曲线的直线回归方程式,将样品的 OD 值代入方程式,计算出样品浓度,再乘以稀释倍数, 即为样品的实际浓度。 注意事项 1.试剂盒从冷藏环境中取出应在室温平衡 15-30 分钟后方可使用,酶标包被板开封后如未
用完,板条应装入密封袋中保存。 2.浓洗涤液可能会有结晶析出,稀释时可在水浴中加温助溶,洗涤时不影响结果。 3.各步加样均应使用加样器,并经常校对其准确性,以避免试验误差。一次加样时间最好
控制在 5 分钟内,如标本数量多,推荐使用排枪加样。 4. 请每次测定的同时做标准曲线,最好做复孔。如标本中待测物质含量过高(样本 OD 值
大于标准品孔第一孔的 OD 值),请先用样品稀释液稀释一定倍数(n 倍)后再测定,计 算时请最后乘以总稀释倍数(×n×5)。 5. 封板膜只限一次性使用,以避免交叉污染。 6.底物请避光保存。 7.严格按照说明书的操作进行,试验结果判定必须以酶标仪读数为准. 8.所有样品,洗涤液和各种废弃物都应按传染物处理。 9.本试剂不同批号组分不得混用。 10. 如与英文说明书有异,以英文说明书为准。 保存条件及有效期 1.试剂盒保存:;2-8℃。 2.有效期:6 个月
肿瘤坏死因子TNF家族及其受体基础概述

肿瘤坏死因子TNF家族及其受体基础概述肿瘤坏死因子(Tumor Necrosis Factor, TNF)家族是一类重要的细胞因子,包含多种细胞因子及其对应的受体。
TNF家族在免疫应答、细胞凋亡、炎症反应等多个生理和病理过程中发挥重要作用。
本文将对TNF家族及其受体进行基础概述。
TNF家族是一类由细胞因子及其对应的受体组成的大家族,目前已鉴定出29个成员。
这些成员包括TNF-α、TNF-β、LT-α、LT-β、CD40L、FasL等细胞因子和TNFR1、TNFR2、LTβR、CD40、DR3、DR4、DR5等受体。
这些成员多为跨膜蛋白,其中有些成员具有多个结构域,如TNF-α和LT-α,有N-端内寡肽、C-端胞外结构域和一个胞内结构域。
TNF家族成员在不同细胞类型中表达,并且它们通常以多种形式表达,如细胞膜结合型、溶解型和可溶性形式。
这种多样性的表达方式进一步拓展了TNF家族成员的功能。
TNF家族成员通过与其对应的受体结合,触发一系列下游信号通路,从而调节多个生理和病理过程。
TNF受体家族包括两类受体:死亡受体(Death Receptors, DRs)和非死亡受体(Non-Death Receptors, NDRs)。
死亡受体包括TNFR1、DR3、DR4和DR5,它们的激活可通过配体结合介导的聚集形成受体复合物,进而激活下游信号通路,最终导致细胞凋亡。
非死亡受体包括TNFR2、CD40、LTβR等,它们在受体激活后会触发不同的信号通路,如NF-κB、MAPK和JNK等途径,从而参与调节免疫应答、炎症反应等。
TNF家族在免疫应答中发挥重要作用。
例如,TNF-α作为重要的炎症介质,可促进炎症反应的发生和维持,并激活吞噬细胞等免疫细胞;CD40L是活化T细胞表面的分子,与CD40结合后可激活B细胞、巨噬细胞等抗原呈递细胞,进而参与体液免疫和细胞免疫过程;LTα和LTβ在淋巴结器官的形成中起重要作用。
肿瘤坏死因子偏高的原因

肿瘤坏死因子偏高的原因引言肿瘤坏死因子(TNF)是一种重要的细胞因子,它在炎症、免疫和肿瘤发生中起着重要作用。
然而,当肿瘤坏死因子的水平异常增高时,可能会引发一系列健康问题。
本文将探讨肿瘤坏死因子偏高的原因,并对其影响进行全面、详细、完整且深入地分析。
肿瘤坏死因子的作用肿瘤坏死因子是一种由多种细胞产生的细胞因子,包括巨噬细胞、T细胞和B细胞等。
它在炎症反应、免疫应答和肿瘤发生中发挥重要作用。
肿瘤坏死因子主要有两种形式:TNF-α和TNF-β。
它们通过结合细胞表面的受体,如TNFR1和TNFR2,来发挥作用。
TNF-α主要由巨噬细胞和T细胞产生,而TNF-β则主要由淋巴细胞产生。
肿瘤坏死因子在炎症反应中起着重要作用。
它能够引起血管内皮细胞的活化,导致炎症细胞的浸润。
此外,肿瘤坏死因子还能够诱导一系列炎症相关的细胞因子的产生,如白细胞介素1(IL-1)和白细胞介素6(IL-6),从而加剧炎症反应。
肿瘤坏死因子在免疫应答中也起着重要作用。
它能够促进巨噬细胞和其他免疫细胞的活化,增强它们对病原体的杀伤作用。
此外,肿瘤坏死因子还能够促进T细胞和B细胞的增殖和分化,从而增强免疫应答。
肿瘤坏死因子在肿瘤发生中也发挥重要作用。
它能够直接杀伤肿瘤细胞,并通过诱导细胞凋亡的方式抑制肿瘤生长。
此外,肿瘤坏死因子还能够诱导血管生成,从而促进肿瘤的生长和转移。
肿瘤坏死因子偏高的原因肿瘤坏死因子的水平异常增高可能是由多种原因引起的。
下面将对其中几个常见的原因进行详细探讨。
1. 炎症反应炎症反应是肿瘤坏死因子水平增高的常见原因之一。
当机体受到感染或损伤时,免疫系统会释放大量的肿瘤坏死因子来应对炎症刺激。
这种情况下,肿瘤坏死因子的产生增加,从而导致其水平升高。
2. 自身免疫性疾病自身免疫性疾病是指机体的免疫系统错误地攻击自身组织和器官。
在自身免疫性疾病中,免疫系统会释放过多的肿瘤坏死因子,导致其水平升高。
例如,类风湿性关节炎和系统性红斑狼疮等疾病都与肿瘤坏死因子的水平升高相关。
小鼠肿瘤坏死因子αTNF-α酶联免疫分析ELISA

小鼠肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测小鼠血清,血浆及相关液体样本中肿瘤坏死因子α(TNF-α)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中小鼠肿瘤坏死因子α(TNF-α)水平。
用纯化的小鼠肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α(TNF-α),再与HRP标记的肿瘤坏死因子α(TNF-α)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的肿瘤坏死因子α(TNF-α)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中小鼠肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成:注意事项:1.试剂盒从冷藏环境中取出应在室温平衡15-30分钟后方可使用,酶标包被板开封后如未用完,板条应装入密封袋中保存。
2.浓洗涤液可能会有结晶析出,稀释时可在水浴中加温助溶,洗涤时不影响结果。
3.各步加样均应使用加样器,并经常校对其准确性,以避免试验误差。
一次加样时间最好控制在5分钟内,如标本数量多,推荐使用排枪加样。
4.请每次测定的同时做标准曲线,最好做复孔。
如标本中待测物质含量过高(样本OD值大于标准品孔第一孔的OD值),请先用样品稀释液稀释一定倍数(n倍)后再测定,计算时请最后乘以总稀释倍数(×n×5)。
5.封板膜只限一次性使用,以避免交叉污染。
6.底物请避光保存。
7.严格按照说明书的操作进行,试验结果判定必须以酶标仪读数为准.8.所有样品,洗涤液和各种废弃物都应按传染物处理。
9.本试剂不同批号组分不得混用。
10. 如与英文说明书有异,以英文说明书为准。
操作步骤1.标准品的稀释与加样:在酶标包被板上设标准品孔10孔,在第一、第二孔中分别加标准品100μl,然后在第一、第二孔中加标准品稀释液50μl,混匀;然后从第一孔、第二孔中各取100μl分别加到第三孔和第四孔,再在第三、第四孔分别加标准品稀释液50μl,混匀;然后在第三孔和第四孔中先各取50μl弃掉,再各取50μl分别加到第五、第六孔中,再在第五、第六孔中分别加标准品稀释液50ul,混匀;混匀后从第五、第六孔中各取50μl分别加到第七、第八孔中,再在第七、第八孔中分别加标准品稀释液50μl,混匀后从第七、第八孔中分别取50μl加到第九、第十孔中,再在第九第十孔分别加标准品稀释液50μl,混匀后从第九第十孔中各取50μl弃掉。
碧云天Mouse TNF-α ELISA Kit (小鼠TNF-α酶联免疫吸附检测试剂盒)说明书

Mouse TNF-α ELISA Kit产品编号 产品名称包装 PT512Mouse TNF-α ELISA Kit96次产品简介:碧云天的Mouse TNF-α ELISA Kit (Mouse Tumor Necrosis Factor-α Enzyme-Linked ImmunoSorbent Assay Kit),即小鼠肿瘤坏死因子-α酶联免疫吸附检测试剂盒,是一种用于特异性地高灵敏地定量检测小鼠血清、血浆、细胞或组织裂解液、或细胞培养上清液中的TNF-α的试剂盒。
本产品检测灵敏度高,特异性强,重复性好。
多次重复检测结果表明,最小检出量为30.8pg/ml ,与人TNF-α、sTNF RIs 、TNF RII 等均没有交叉反应,板内、板间变异系数均小于10%。
TNF-α,即TNF 、TNF α或TNFalpha ,也称cachectin 、cachexin 或TNFSF1A 。
TNF-α由巨噬细胞、上皮细胞等多种细胞在细菌感染、内毒素刺激、病毒或寄生虫感染时产生。
肿瘤坏死因子超家族(Tumor necrosis factor superfamily)共约19个成员,包含由巨噬细胞等产生的TNF-α和T 淋巴细胞产生的TNF-β(也称Lymphotoxin-alpha),以及FASL 、TRAIL 、CD40L 、CD27L 、CD30L 等。
TNF-α与TNF-β在结构上有一定的相似性,并且在氨基酸水平有28%的同源性,它们拥有共同的受体TNFR1和TNFR2。
由于TNF-α的生物学活性占TNF 总活性的70%~95%,因此目前常说的TNF 多指TNF-α。
TNF (Tumor Necrosis Factor)因为能诱导细胞死亡而得名,实际上其很多时候诱导的细胞死亡为细胞凋亡。
人TNF-α有两种形式,一种是由233个氨基酸组成的跨膜蛋白同源三聚体(homotrimers),另外一种是该跨膜蛋白在TNF-α转化酶TACE(TNF-α converting enzyme)的作用下切除信号肽,形成成熟的157个氨基酸的可溶性TNF-α单体(分子量为17KDa)的同源三聚体。
肿瘤坏死因子

肿瘤坏死因⼦基本简介肿瘤坏死因⼦(TNF)是⼀种由巨噬细胞对细菌感染或其他免疫源反应⾃然产⽣的细胞因⼦。
是由巨噬细胞分泌的⼀种⼩分⼦蛋⽩。
是⼀类能直接造成肿瘤细胞死亡的细胞因⼦。
肿瘤坏死因⼦与⼲扰素协同作⽤可杀死肿瘤细胞。
根据其来源和结构不同分为两种类型,即TNF-α和TNF-β。
前者主要由巨噬细胞产⽣,LPS是诱导其产⽣的较强刺激剂,T细胞和NK细胞在某些刺激因⼦(如PMA)作⽤下也可分泌TNF-α;后者主要由活化T细胞产⽣,T细胞在抗原、丝裂原等刺激下可产⽣⾼⽔平的TNF-β。
TNF-β原称淋巴毒素(1ymphotox-in,LT)。
肿瘤坏死因⼦TNF-α主要由单核-巨噬细胞分泌;TNF-β主要由活化的T淋巴细胞分泌,两者有相似致热性。
⼩剂量呈单峰热,⼤剂量呈双峰热;TNF在体内外均能刺激IL-1的产⽣。
不耐热,70℃30min失活。
1975年Carswell等发现接种BCG的⼩⿏注射LPS后,⾎清中含有⼀种能杀伤某些肿瘤细胞或使体内肿瘤组织发⽣⾎坏死的因⼦,称为肿瘤坏死因⼦。
1985年Shalaby把巨噬细胞产⽣的TNF 命名为TNF-α,把T淋巴细胞产⽣的淋巴毒素(lymphotoxin,LT)命名为TNF-β。
TNF-α⼜称恶质素。
基本信息药物类别:抗肿瘤药所属类别:⽣物反应调节剂药物名称:肿瘤坏死因⼦产⽣过程⼤量蛋⽩质本质的肿瘤坏死因⼦(1)TNF-α是⼀种单核因⼦,主要由单核细胞和巨噬细胞产⽣,LPS是较强的刺激剂。
IFN-γ、M-CSF、GM-CSF对单核细胞/巨噬细胞产⽣TNF-α有刺激作⽤,⽽PGE则有抑制作⽤。
前单核细胞系U937、前髓细胞系HL-60在PMA刺激下可产⽣较⾼⽔平的TNF-α。
T淋巴细胞、T细胞杂交瘤、T淋巴样细胞系以NK细胞等在PMA刺激下也可分泌TNF-α。
SAC、PMA、抗IgM可刺激正常B细胞产⽣TNF-α。
此外,中性粒细胞、LAK、星状细胞、内⽪细胞、平滑肌细胞亦可产⽣TNF-α。
肿瘤坏死因子正常参考范围

肿瘤坏死因子正常参考范围全文共四篇示例,供读者参考第一篇示例:肿瘤坏死因子(TNF)是一种由免疫细胞产生的蛋白质,是机体的重要炎症介质之一。
TNF存在于体内的主要两个亚型为TNF-α和TNF-β,其中TNF-α是最为广泛研究的亚型。
TNF-α主要由巨噬细胞、淋巴细胞、树突细胞等免疫细胞分泌,以及一些非免疫细胞如肿瘤细胞、血管内皮细胞等也可产生TNF-α。
TNF-α的主要作用是发挥促炎效应,同时也具有调节免疫反应、调节细胞增殖凋亡等功能。
肿瘤坏死因子的异常水平与多种疾病的发生、发展密切相关。
TNF-α过高或过低的表达都可能导致机体的免疫应答紊乱,从而引起免疫性疾病、感染性疾病、肿瘤等多种疾病的发生。
监测肿瘤坏死因子的水平是临床诊断和治疗重要的一环。
肿瘤坏死因子正常参考范围则是指肿瘤坏死因子在健康人群中的典型范围。
由于不同的实验室、不同的测量方法可能有所不同,因此肿瘤坏死因子的正常参考范围会存在一定的差异。
一般来说,正常人群中肿瘤坏死因子的水平较低,在健康成年人血清中,TNF-α的正常水平一般在2-20pg/mL之间。
在特定疾病状态下,肿瘤坏死因子的水平可能出现异常。
在炎症性疾病如类风湿关节炎、炎症性肠病等中,TNF-α的水平常常明显升高;而在某些感染性疾病、免疫相关性疾病、恶性肿瘤等中,TNF-α的水平也可能发生变化。
对于某些疾病的诊断和疗效监测,监测肿瘤坏死因子的水平具有一定的临床意义。
肿瘤坏死因子在体内的浓度受到多种因素的影响。
除了疾病状态外,情绪、环境、生活方式、饮食等也可能对肿瘤坏死因子的水平产生影响。
在进行肿瘤坏死因子水平检测时,需要综合考虑患者的临床情况和全面评估。
肿瘤坏死因子正常参考范围是指在一般健康人群中,肿瘤坏死因子的典型水平范围。
监测肿瘤坏死因子的水平对于一些炎症性疾病、感染性疾病、免疫相关性疾病的诊断和治疗具有一定的帮助。
了解肿瘤坏死因子的正常参考范围,在临床实践中也能为医生提供参考,有助于更准确地评估患者的健康状况和疾病状态。
肿瘤坏死因子-α

蛋白质的一级结构特点
蛋白质的一级结构特点
二级结构预测
三级结构预测
蛋白(TNFR-1) (p60) 在所 有细胞类型上表达,是启动 TNF-α 大部分生物活性的关键。
➢ 而TNF受体2 (TNFR-2) (p80) 只 在免疫细胞中表达。
➢ 只有TNFR-1即具有转导细胞 存活信号的能力亦有诱导细胞 凋亡能力,但这种生死信号调 节的作用机制至今也未被透彻 理解。
TNFR2复合物,从而促进细胞的存活。 ➢ 筛选TNFR2的拮抗剂,可以抑制Treg,可以被开发为抗肿瘤药物。
感谢聆听!
武汉轻工大学
肿瘤坏死因子-α
主讲:XXX
专业:
时间:
概述
肿瘤坏死因子(tumor necrosis factor,TNF),又称恶液质素。TNF主要由活化的巨 噬细胞,NK细胞及T淋巴细胞产生,其中,巨噬细胞产生的TNF命名为TNF-α,T淋巴细 胞产生的淋巴毒素(lymphotoxin,LT)命名为TNF-β。TNFα的生物学活性占TNF总活性 的70%~95%,因此目前常说的TNF多指TNF-α。TNF-α作为主要的炎性介质在多种肿瘤 中表达。TNF-α一方面可以通过诱导癌细胞凋亡去抑制肿瘤细胞生长,另一方面也刺激大 多数对TNF诱导的细胞毒性具有抗性的癌细胞的增殖、存活、迁移和血管生成,从而导致 肿瘤的发展发生。
潜在价值
在关节炎或炎症性肠道疾病中,需要增强TNF-α合成来达到抗炎治疗目的;在自 身免疫病中,需要抑制TNF-α的作用,以便减轻炎症因子对自身细胞的攻击。
值得注意的是,TNF-α是人体正常的免疫分子之一。因此,未来的研究可能会开 发出一种保护细胞免疫系统但选择性阻断TNF-α作用的药物组合,以便在长期内克 服抗TNF-α治疗的副作用。
小鼠肿瘤组织中tnfa含量 -回复

小鼠肿瘤组织中tnfa含量-回复小鼠肿瘤组织中的TNF-α含量是指小鼠体内的肿瘤块组织中是否存在或者表达着一种名为肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)的蛋白质。
TNF-α是一种重要的炎症介质,参与了许多炎症反应和免疫调节过程。
研究小鼠肿瘤组织中的TNF-α含量可以帮助我们了解其在肿瘤生长和免疫反应中的作用机制。
第一步:什么是肿瘤坏死因子-α(TNF-α)肿瘤坏死因子-α是一种由免疫细胞(如白细胞和巨噬细胞)合成并释放的蛋白质,可以分泌到体内循环系统中或局部组织中。
TNF-α对细胞具有多种作用,例如促进免疫细胞的活化、诱导炎症反应、调节细胞生长和凋亡等。
在炎症反应中,TNF-α可以招募免疫细胞到达炎症部位,促进炎症反应的发生和发展。
除了免疫调节作用外,TNF-α还被发现在肿瘤发生、生长和转移过程中发挥了重要作用。
第二步:研究小鼠肿瘤组织中TNF-α含量的意义研究小鼠肿瘤组织中的TNF-α含量可以帮助我们了解其在肿瘤生长和免疫反应中的作用机制。
首先,肿瘤细胞可以释放TNF-α来引起炎症反应,进而招募免疫细胞到达肿瘤组织中,形成细胞浸润。
这些免疫细胞可以通过吞噬肿瘤细胞或者释放细胞毒素的方式来抑制肿瘤的生长。
因此,肿瘤组织中TNF-α的含量可能与肿瘤的体积、生长速度以及预后等有关。
其次,肿瘤组织中的TNF-α还可以直接作用于肿瘤细胞,影响其增殖、凋亡和迁移等生物学过程。
一些研究发现,TNF-α可以通过激活其受体信号通路,诱导肿瘤细胞凋亡,从而抑制肿瘤的生长。
然而,TNF-α过度的表达也可能导致肿瘤细胞产生更多的炎症因子,形成更多的血管和免疫逃逸机制,促进肿瘤的生长和转移。
第三步:如何研究小鼠肿瘤组织中TNF-α含量研究小鼠肿瘤组织中TNF-α含量一般可以通过以下实验方法来进行:1.酶联免疫吸附实验(ELISA):ELISA是一种常用的实验方法,可以定量测定细胞培养上清液或动物体内液体中的目标蛋白质。
肿瘤坏死因子正常参考范围-概述说明以及解释

肿瘤坏死因子正常参考范围-概述说明以及解释1.引言1.1 概述肿瘤坏死因子(Tumor Necrosis Factor, TNF) 是一种由人体细胞产生的细胞因子,它在免疫系统中发挥着重要的调节作用。
TNF 是一种既能够促进炎症反应,又能够调节细胞生命周期和信号转导途径的多功能蛋白质。
近年来,研究表明TNF在许多重要疾病的发展中起着关键作用,如癌症、自身免疫性疾病和炎症性疾病等。
TNF的产生受到多种因素的调控,包括免疫细胞的激活、细胞凋亡和炎症反应等。
在正常情况下,TNF的水平是细致平衡的,对机体的正常生理过程起到重要作用。
然而,在某些疾病状态下,TNF的水平可出现异常升高或降低,从而导致疾病的发生和发展。
因此,对于肿瘤坏死因子正常参考范围的研究具有重要意义。
了解TNF 的正常水平范围,可以为临床医生提供参考依据,帮助他们准确判断患者是否存在TNF的异常水平,进一步评估疾病的严重程度,制定个体化的治疗方案。
未来的研究方向可以进一步深入探究TNF与其他细胞因子之间的相互作用关系,进一步探索TNF在不同疾病中的作用机制。
此外,我们还可以开展更多的临床研究,探索TNF在特定疾病中的临床应用潜力,以便为患者提供更好的治疗方案。
综上所述,肿瘤坏死因子正常参考范围的研究对于深入了解TNF的生理作用和相关疾病的发展具有重要意义。
通过进一步的研究和探索,我们有望为临床医生提供更准确、更有效的诊断和治疗策略,从而提高患者的生存质量和生活水平。
文章结构部分的内容可以写成以下形式:1.2 文章结构本文将分为三个主要部分进行描述,具体如下:第一部分为引言部分,主要包括概述、文章结构和目的等内容。
在概述中,将对肿瘤坏死因子进行简要介绍,引发读者的兴趣。
接着,详细阐述文章的结构,说明各部分的内容和组织安排。
最后,明确本文的目的,即探讨肿瘤坏死因子正常参考范围的意义以及未来的研究方向。
第二部分是正文部分,主要包括肿瘤坏死因子的定义和功能、以及肿瘤坏死因子的生理作用。
小鼠肿瘤坏死因子αTNFα酶联免疫分析ELISA

小鼠肿瘤坏死因子αTNFα酶联免疫分析ELISA小鼠肿瘤坏死因子α(TNFα)是一种重要的炎症细胞因子,参与了多种生物学过程,包括免疫应答、炎症反应和细胞凋亡。
因此,检测和量化小鼠体内TNFα浓度对于研究炎症性疾病、免疫反应以及药物开发等方面具有重要意义。
TNFα的酶联免疫分析(ELISA)是一种常用的测量方法。
它基于抗体的特异性结合能力,能够定量检测样品中的TNFα浓度。
下面将介绍ELISA的基本原理、步骤以及实验注意事项。
ELISA的基本原理如下:1.酶标记体制造:选择特异性抗体对TNFα进行捕获,并与酶(如辣根过氧化物酶-HRP)结合,形成酶标记的抗体。
2.样品制备:样品可以是小鼠外周血、血清、组织提取物等。
样品需要经过预处理,如稀释、处理以去除干扰物质。
3.包被阶段:将TNFα特异性的捕获抗体稀释在特定的固相免疫板上,使其吸附在孔底。
然后通过洗涤去除未结合的抗体。
4.结合阶段:将处理过的样品和酶标记的抗体加入到包被的固相免疫板中,使其与TNFα结合。
经过一段时间的孵育,将未结合物洗涤干净。
5.检测阶段:加入底物溶液(一般是含有染色物质的底物)。
当TNFα与抗体结合的复合物与底物结合时,酶催化会引起颜色的变化。
反应停止后,测定吸光度,与TNFα的浓度成正比。
实验步骤:1.准备工作:将所需试剂和材料准备好,包括免疫板、稀释液、洗涤缓冲液、抗体和底物。
2.包被阶段:将包被抗体稀释在稀释液中,然后加入到免疫板的孔中,孵育一段时间(通常为1-2小时),去除未结合的抗体。
3.样品处理:将样品预处理,如稀释或加入处理溶液以去除干扰物质。
4.结合阶段:将样品加入到包被的免疫板孔中,孵育一段时间(通常为1-2小时),使其与捕获抗体结合。
然后进行洗涤,以去除未结合的物质。
5.检测阶段:加入酶标记的抗体,与TNFα结合。
经过孵育和洗涤,加入底物溶液,孵育一段时间后,停止反应。
6.测定吸光度:使用酶标仪测定底物产生的吸光度,与TNFα浓度成正比。
肿瘤坏死因子α的生物学作用

肿瘤坏死因子α的生物学作用作者:金叶秦丽娟来源:《科技视界》2017年第05期肿瘤坏死因子是由巨噬细胞产生的,具有免疫应答、炎症反应以及修复细胞等生物学意义的细胞因子[1]。
Carswell等研究发现,接种卡介苗后的小鼠,其血清中含有一种高活性的细胞因子,这种因子可引起肿瘤细胞出血坏死,后来将其命名为肿瘤坏死因子。
肿瘤坏死因子一方面具有调节机体的免疫功能,使某些肿瘤细胞坏死的作用;另一方面又可介导炎症过程、组织损伤、休克等病理生理反应。
LPS是诱导肿瘤坏死因子产生的较强刺激剂,此外,T细胞和NK细胞在某些刺激因子的作用下也可分泌肿瘤坏死因子。
肿瘤坏死因子包括TNF-α和TNF-β两种。
其中,TNF-β由活化的淋巴细胞产生,又称淋巴毒素;TNF-α由活化的单核巨噬细胞产生,又称恶液素,二者有相似的活性。
1 TNF-α的分类和蛋白质结构TNF-α分为17kDa的可溶性TNF-α(sTNF-α)和26kDa膜结合的TNF-α(tmTNF-α)[2-3]。
tmTNF-α的一级结构有233个氨基酸残基,在金属蛋白酶TACE的作用下,tmTNF-α的胞外段1-157位可被水解,脱落为sTNF-α[4]。
2 TNF-α表达巨噬细胞和T细胞是TNF-α的主要生产者,其它细胞也可产生TNF-α,例如B细胞、NK 细胞、嗜中性粒细胞、肥大细胞、内皮细胞、平滑肌细胞、心肌细胞、成纤维细胞、破骨细胞、成骨细胞、星形胶质细胞、树突状细胞、小胶质细胞、角质形成细胞、脂肪细胞、肾上腺皮质细胞和肾小球系膜细胞等[5-7]。
3 TNF-α受体TNF-α的生物学作用通过两种不同的细胞表面受体传递信号,这两种受体分别命名为TNFR1和TNFR2,分子量分别为55kD和75kD,各含有455和461个氨基酸。
人类TNFR1和TNFR2的细胞外结构域有28%的同源性,但两者胞内结构域的一级氨基酸序列不同。
TNFR1是大多数细胞TNF-α作用的关键受体,而TNFR2仅在淋巴系统的细胞中起主要作用以及通过增强或协同TNFR1起辅助作用[8-10]。
TNF肿瘤坏死因子的介绍

肿瘤坏死因子(TNF)1975年carswell等发现接种bcg的小鼠注射lps后,血清中含有一种能杀伤某些肿瘤细胞或使体内肿瘤组织发生血坏死的因子,称为肿瘤坏死因子(tumor necrosis factor,tnf)。
1985年shalaby把巨噬细胞产生的tnf命名为tnf-α ,把t淋巴细胞产生的淋巴毒素(lymphotoxin,lt)命名为tnf-β。
tnf-α又称恶质素。
1.tnf的产生(1)tnf-α是一种单核因子,主要由单核细胞和巨噬细胞产生,lps是较强的刺激剂。
ifn-γ、m-csf、gm-csf对单核细胞/巨噬细胞产生tnf-α有刺激作用,而pge则有抑制作用。
前单核细胞系u937、前髓细胞系hl-60在pma刺激下可产生较高水平的tnf-α。
t淋巴细胞、t细胞杂交瘤、t淋巴样细胞系以nk细胞等在pma刺激下也可分泌tnf-α。
sac、pma、抗igm可刺激正常b细胞产生tnf-α。
此外,中性粒细胞、lak、星状细胞、内皮细胞、平滑肌细胞亦可产生tnf-α。
(2)tnf-β是一种淋巴因子,抗原和丝裂原均可刺激t淋巴细胞分泌tnf-β。
pma刺激rpmi1788b 淋巴母细胞可分泌高水平tnf-β。
2.tnf的分子结构和基因(1)人的tnf-α基因长约2.76kb,小鼠为2.78kb,结构非常相似,均由4个外显子和3个内含子组成,与mhc基因群密切连锁,分别定位于第6对和第17对染色体上。
1984年从hl-60、u937等细胞中克隆成功rhu tnf-α cdna,并在大肠杆菌中获得高表达。
人tnf-α前体由233个氨基酸残基组成,含76个氨基酸残基的信号肽,切除信号肽后成熟型tnf-α为157氨基酸残基,非糖基化,第69位和101位两个半胱氨酸形成分子内二硫键。
rhu tnf-α分子量为17kda。
小鼠tnf-α前体为235氨基酸残基,信号肽79氨基酸残基,成熟的小鼠tnf-α(rmutnf-α)分子量为17kda,由156个氨基酸残基组成,第69位和100位两个半胱氨酸形成分子内二硫键,有一个糖基化点,但糖基化不影响其生物学功能。
肿瘤坏死因子(TNF-α):自身免疫系统疾病关键靶点

肿瘤坏死因⼦(TNF-α):⾃⾝免疫系统疾病关键靶点导语:⽬前,⽆论是传统的化药龙头,⾎制品公司还是很多初创的创新性药企,越来越多的公司致⼒于抗体类药物的研发。
⼀夜之间,似乎变成了不研究⼏个单抗产品,出去都不好意思打招呼的局⾯:)但是⽬前全球抗体类药物的市场还是集中在⼏家巨头⼿中,我国的抗体类药物更是⾯临着起步晚,⼤规模制备技术较落后,医保不能覆盖等很多问题,但随着研发技术的提⾼,制备⼯艺的优化,以及医保⽬录的调整等,相信我国的抗体类药物会迎来发展的春天。
民⽣证券医药⾏业研究团队负责⼈吴汉靓将通过⼀系列的报告来研究说明整个抗体药物领域,⽬前的主题包括:靶点的选择,⼯艺的优化,双抗产品的研发等。
下⾯是第⼀篇:肿瘤坏死因⼦(TNF-α):⾃⾝免疫系统疾病关键靶点。
主要涉及阿达⽊单抗,英夫利昔单抗,依那西普以及我国⾃主研发的益赛普,安佰诺等TNF抑制剂的现状和未来前景。
⼀、单克隆抗体:⽣物药领域最⼤的⼦⾏业,2016年全球市场900亿美⾦1)单克隆抗体:⽣物药领域最⼤的⼦⾏业,占据⽣物药市场的43%根据Transparency Market Research预测,全球⽣物药市场将从2016年的2098亿美⾦增长到2024年的4798亿美⾦,复合增长率11%。
图1:全球⽣物药市场⽣物药可以细分为单克隆抗体、⽣长激素、融合蛋⽩、疫苗等⼦⾏业,其中单克隆抗体是⽣物药领域最⼤的⼦⾏业,2016年占据⽣物药市场的43%,预计从2016年的900亿美⾦增长到2024年的2217亿美⾦,复合增长率11.9%。
单克隆抗体(Monoclonal Antibody, mAb),简称单抗,是由⼀种类型的B细胞分泌产⽣的,具有和特定抗原发⽣特异性结合的免疫球蛋⽩。
单抗药物针对的靶点包括细胞表⾯分化抗原、细胞⽣长因⼦、⾎管内⽪⽣长因⼦等。
其中临床获批和临床研究最多的四个靶点是CD20、TNF-α、EGFR和HER2。
图2:临床研发和上市的⽣物药靶点2)肿瘤坏死因⼦-α(TNF-α):细胞信号通路中重要⼀环,药物研发的热门靶点肿瘤坏死因⼦-α(Tumor Necrosis Factor-α, TNF-α)是⼀种涉及到系统性炎症的细胞因⼦,主要由巨噬细胞分泌。
肿瘤坏死因子参考范围

肿瘤坏死因子参考范围
肿瘤坏死因子(TNF)是一种重要的细胞因子,它在调节免疫反应和肿瘤发展中起着重要作用。
TNF的参考范围是指正常人体内TNF 的浓度范围,它可以作为诊断和治疗肿瘤等疾病的参考标准。
TNF是由免疫细胞和肿瘤细胞产生的一种蛋白质分子,它在机体的免疫过程中发挥着重要的调节作用。
在免疫应答中,TNF能够调节炎症反应,并参与免疫细胞的活化和增殖过程。
此外,TNF还具有直接抗肿瘤作用,它能够诱导肿瘤细胞的凋亡和坏死,从而抑制肿瘤的生长和扩散。
正常人体内的TNF浓度通常在一个相对稳定的范围内波动。
这个参考范围根据不同的研究和实验得出,一般认为血清中的TNF浓度在0.1-10 ng/mL之间为正常范围。
当TNF的浓度超过这个范围时,可能会出现免疫系统失调或肿瘤等疾病的发生。
TNF的参考范围是临床医学中非常重要的参考标准之一。
通过检测血清中TNF的浓度,医生可以评估患者的免疫状态和炎症程度,进而指导治疗方案的制定。
例如,在某些肿瘤治疗中,可以利用TNF 的抗肿瘤作用,通过给予患者TNF来抑制肿瘤的生长和扩散。
然而,需要注意的是,TNF的参考范围并不是绝对的,它还受到多种因素的影响。
例如,年龄、性别、疾病状态、个体差异等都可能导致TNF的浓度有所变化。
因此,在临床实践中,医生需要综合考
虑患者的具体情况,结合其他临床指标和病史来评估TNF的意义。
肿瘤坏死因子参考范围是指正常人体内TNF的浓度范围,它在诊断和治疗肿瘤等疾病中具有重要意义。
了解和正确应用TNF的参考范围,可以帮助医生更准确地评估患者的免疫状态和疾病进展情况,从而指导合理的治疗决策。
肿瘤坏死因子TNF家族及其受体基础概述
肿瘤坏死因子TNF家族及其受体基础概述肿瘤坏死因子(TNF)是在能够杀死小鼠中的癌细胞的血清中发现的细胞因子。
现在已经发现的肿瘤坏死因子超家族包括19个配体和29个不同的受体。
TNF超家族的配体成员主要要NF-kB配体的TNF-α、TNF-β、淋巴毒素-β、CD40L、FasL、CD30L、4-1BBL、CD27L 和OX40L,TNF相关凋亡诱导配体(TRAIL),LIGHT受体激活剂(RANKL),TNF相关的凋亡诱导因子(TWEAK),增殖诱导配体(APRIL),B细胞激活因子(BAFF),血管内皮细胞生长抑制剂(VEGI),胞质胞质素A(EDA-A1,EDA-A2)和GITRL。
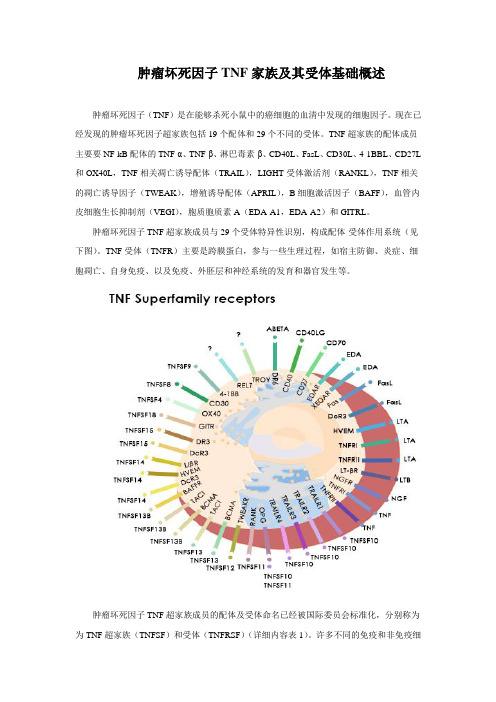
肿瘤坏死因子TNF超家族成员与29个受体特异性识别,构成配体-受体作用系统(见下图)。
TNF受体(TNFR)主要是跨膜蛋白,参与一些生理过程,如宿主防御、炎症、细胞凋亡、自身免疫、以及免疫、外胚层和神经系统的发育和器官发生等。
肿瘤坏死因子TNF超家族成员的配体及受体命名已经被国际委员会标准化,分别称为为TNF超家族(TNFSF)和受体(TNFRSF)(详细内容表1)。
许多不同的免疫和非免疫细胞类型均可产生TNF,包括巨噬细胞、T细胞、肥大细胞、粒细胞、天然杀伤(NK)细胞和非造血细胞,如成纤维细胞、神经元、角质形成细胞和平滑肌细胞。
表达每个配体或受体的细胞类型可以查看表1。
表1:人肿瘤坏死因子TNF家族受体及其配体表达图谱官方名配体表达细胞官方名受体表达细胞TNFSF1 TNF-β、LT-αNK、T、B TNFRSF1ATNFR1(DR1)造血和免疫细胞TNFRSF1B TNFR2 免疫和内皮细胞TNFSF2 TNF-α巨噬细胞、NK、T、BTNFRSF1A/B TNFR1/2 免疫和内皮细胞TNFSF3 LT-β活化的CD4+T细胞、T、DC、NKTNFRSF3 LT-βRNK、CD4+和CD8+ T细胞TNFSF4 OX40L(CD252)B、T、DC、内皮细胞、平滑肌细胞TNFRSF4OX40(CD134)活化的CD4+T细胞、中性粒细胞TNFSF5 CD40L(CD154)活化的CD4+T细胞、肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞、NKTNFRSF5 CD40B、DC、单核细胞、胸腺上皮、Reed-Sternberg细胞TNFSF6 FasL(CD95L、Apo1L)活化的脾细胞、胸腺细胞、非淋巴组织、NKTNFRSF6Fas(CD95、Apo1、DR2)上皮细胞、肝细胞、活化的成熟淋巴细胞和转化细胞TNFRSF6B DcR3 肺和结肠细胞TNFSF7 CD27L(CD70)NK、T、B、肥大细胞、平滑肌细胞、胸腺上皮细胞TNFRSF7 CD27造血祖细胞、CD4+和CD8+T细胞TNFSF8 CD30L(CD153)活化的T、B、单核细胞、粒细胞、髓质胸腺上皮细胞TNFRSF8 CD30 Reed-Sternberg细胞TNFSF9 4-1BBL APC细胞(B、DC、巨噬)、肥大细胞TNFRSF94-1BB(CD137、ILA)T、NK、肥大细胞、嗜中性粒细胞TNFSF10 TRAIL(Apo2L)DC、NK、TTNFRSF10ATRAILR1(DR4、Apo2)大多数正常和转化的细胞TNFRSF10BTRAILR2(DR5)大多数正常和转化的细胞TNFRSF10CTRAILR3(DcR1)大多数正常和转化的细胞TNFRSF10DTRAILR3(DcR2)大多数正常和转化的细胞TNFRSF11BOPG(OCIF)破骨细胞前体,内皮细胞等TNFSF11 RANKL(TRANCE、OPGL、ODF)T、胸腺、淋巴结TNFRSF11ARANK(TRANCER)破骨细胞、成骨细胞、活化的T细胞TNFRSF11BOPG(OCIF)破骨细胞前体,内皮细胞等TNFSF12 TWEAK(Apo3L)单核细胞TNFRSF12ATWEAKR(FN14)内皮细胞和成纤维细胞TNFSF13 APRIL(TALL-2、TRDL-1)巨噬细胞、淋巴细胞、肿瘤细胞TNFRSF13A/17BCMAB、PBL、脾、胸腺、淋巴结、肝脏、肾上腺TNFRSF13B TACIB、活化的T、PBL、脾、胸腺、小肠TNFSF13B BAFF单核细胞、巨噬细TNFRSF13B TACI B、活化的T、PBL、脾、(BLYS、THANK)胞、DC、T 胸腺、小肠TNFRSF13C BAFFRB、T、PBLs、脾脏、淋巴结TNFRSF17 BCMAB、T、PBLs、脾脏、淋巴结TNFSF14 LIGHT(HVEML,LT-γ)粒细胞、单核细胞、DC、TTNFRSF14LIGHTR(HVEM)T、B、单核细胞、淋巴样细胞TNFRSF3 LT-βR非淋巴结造血和基质细胞TNFSF15 VEGI(TL1A)内皮细胞、APC细胞(B、DC、巨噬)TNFRSF25 DR3 NK、TNFRSF6B DcR3 活化的T细胞TNFSF18 GITRL 人脐静脉内皮细胞TNFRSF18GITR(AITR)CD4+ CD25+ T细胞EDA-A1 皮肤EDAR 外胚层衍生物EDA-A2 皮肤XEDAR 外胚层衍生物、胚胎毛囊未识别TNFRSF19 TROY(TAJ)胚胎皮肤、上皮、毛囊、脑未识别TNFRSF19L RELT 淋巴组织、造血组织未识别TNFRSF21 DR6 T未识别TNFRSF16 NGFR(CD271)神经元轴突、雪旺氏细胞、神经细胞肿瘤坏死因子TNF超家族各成员在细胞生物学中重要作用。
小鼠肿瘤坏死因子α(TNF-α)ELISA 实验说明书

小鼠肿瘤坏死因子α (TNF-α)酶联免疫试剂盒使用说明书【预期应用】ELISA法定量测定小鼠血清、血浆、细胞培养物上清、组织裂解液中TNF-α含量。
【产品性能指标】1、检测范围:15.6 pg/ml-1000 pg/ml2、灵敏度:3.9 pg/ml3、精密度:批内差CV%<8%,批间差CV%<10%4、特异性:本试剂盒特异性检测小鼠TNF-α,且与其他相关蛋白无交叉反应。
【实验原理】用纯化的抗体包被微孔板,制成固相载体,往包被抗TNF-α抗体的微孔中依次加入标本或标准品、生物素化的抗TNF-α抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB 在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样本中的TNF-α呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样本浓度。
【试剂盒组成成分】组份96T酶标板(Assay plate) 12条×8孔标准品(Standard) 2瓶(冻干品)生物素标记抗体(Biotin-antibody) 1 x 120 μl/瓶(100×)辣根过氧化物酶标记亲和素(HRP-avidin) 1 x 120 μl/瓶(100×)生物素标记抗体稀释液(Biotin-antibody Diluent) 1 x 15 ml/瓶辣根过氧化物酶标记亲和素稀释液(HRP-avidin Diluent) 1 x 15 ml/瓶样本稀释液(Sample Diluent) 1 x 50 ml/瓶浓洗涤液(Wash Buffer) 1 x 20 ml/瓶(25×)底物溶液(TMB Substrate) 1 x 10 ml/瓶终止液(Stop Solution) 1 x 10 ml/瓶板贴 4【存储条件及有效期】未开封试剂盒试剂盒避光保存于2-8℃。
有效期为六个月。
请在试剂盒标注的有效日期内使用。
TNF肿瘤坏死因子的介绍

TNF肿瘤坏死因子的介绍TNF-α(肿瘤坏死因子-α)是一种重要的细胞生物活性因子,是免疫系统中的关键分子之一、它起源于巨噬细胞、单核细胞、淋巴细胞、T细胞等,并且在感染、炎症和免疫反应中起着重要的调节作用。
TNF-α在炎症反应和组织修复过程中发挥着重要的作用。
TNF-α主要由活化的巨噬细胞和T细胞分泌,它的分泌受到多种刺激因素的调控。
在感染时,病原体成分经过细胞感应机制激活细胞表面的受体,这些受体激活之后会引起下游信号通路的激活,最终导致TNF-α的产生和释放。
TNF-α的产生和作用具有很强的时效性,可以迅速对炎症反应作出反应,并诱导其他炎性细胞的积聚和活化。
TNF-α的生物活性非常广泛,它可以通过多种机制参与免疫调节。
首先,TNF-α可以增加细胞表面黏附分子的表达,这些黏附分子对炎症细胞的黏附和集聚起着重要作用。
其次,TNF-α可以增强血管的渗透性,使白细胞更容易穿过血管壁进入炎症区域。
此外,TNF-α还可以促进细胞的凋亡,即程序性细胞死亡,从而清除病原体和受损细胞。
尽管TNF-α在炎症反应和免疫调节中扮演重要角色,但过度产生TNF-α也可能引起炎症反应失控,导致严重的炎症性疾病。
例如,关节炎、炎性肠病、系统性红斑狼疮和肺部感染等疾病的发展与TNF-α的过度产生密切相关。
因此,抑制TNF-α的作用已成为许多药物研发的重要目标之一在临床治疗中,针对TNF-α的治疗策略已被广泛采用。
针对TNF-α的免疫抑制药物已被用于治疗类风湿性关节炎、银屑病和炎性肠病等疾病。
这些药物可以通过结合TNF-α并中和其生物活性来达到治疗的效果。
此外,利用基因工程技术生产的可溶性TNF-α受体融合蛋白也作为治疗TNF-α相关疾病的一种手段。
总之,TNF-α作为一种免疫系统中的重要调节因子,参与多个疾病的发生和发展过程中,具有广泛的生物活性和调节作用。
深入研究TNF-α的分子机制和功能,不仅有助于揭示炎症反应和免疫调节的机制,还为相关疾病的治疗提供了重要的思路和方法。
小鼠胚胎成纤维细胞成熟化过程中肿瘤坏死因子α的作用

小鼠胚胎成纤维细胞成熟化过程中肿瘤坏死因子α的作用杨文玖;邹云雯;王志杰【期刊名称】《中国组织工程研究》【年(卷),期】2010(014)011【摘要】背景:近年的研究表明,肿瘤坏死因子α对不同组织成纤维细胞的作用具有组织特异性及浓度依赖性.目的:观察肿瘤坏死因子α及其信号传导途径中特异性激酶抑制剂对小鼠胚胎成纤维细胞成熟化所起的作用.方法:体外培养小鼠胚胎成纤维细胞,将细胞分为3组:第1组用含体积分数2%血清的DMEM高糖培养基培养作为空白对照组;第2组用含100 μg/L肿瘤坏死因子α的培养基培养;第3组先加入质量浓度为50 μg/L的Anti-TNFRSF1B作用1 h后,倒出培养基再加入含有肿瘤坏死因子α的培养基继续培养.采用RT-PCR法测定各组Ⅰ型胶原蛋白和基质金属蛋白酶3 mRNA表达、Western Blot法测定各组Ⅰ型胶原蛋白和基质金属蛋白酶3蛋白表达.结果与结论:小鼠胚胎成纤维细胞在一定质量浓度肿瘤坏死因子α作用下,其信号传导途径特异性激酶发生磷酸化或蛋白被激活,信号通路被激活,促进基质金属蛋白酶3的活化,明显降低Ⅰ型胶原的表达.加入其信号传导途径的抑制剂Anti-TNFRSF1B后,肿瘤坏死因子α的效应得到了一定的抑制,但并未完全消除,这更进一步证明肿瘤坏死因子α对小鼠胚胎成纤维细胞活化的作用.【总页数】4页(P2072-2075)【作者】杨文玖;邹云雯;王志杰【作者单位】青岛大学医学院附属医院脊柱外科,山东省青岛市,266003;青岛大学医学院附属医院脊柱外科,山东省青岛市,266003;青岛大学医学院附属医院脊柱外科,山东省青岛市,266003【正文语种】中文【中图分类】R318【相关文献】1.肿瘤坏死因子-α在缓激肽开放血肿瘤屏障过程中的作用 [J], 秦丽娟;薛一雪;谷艳婷;王东春;张志勇;张田;孙娜2.球形Ni(OH)2生长过程中的Ostwald熟化作用 [J], 彭美勋;沈湘黔;危亚辉3.肿瘤坏死因子α在抗鼠衣原体生殖道感染过程中的作用 [J], 陈曦; 刘璐瑶; 张旭; 陆春雪; 陈利; 全淑芬; 陈丽丽4.肿瘤坏死因子-α对NIH3T3细胞成熟化作用的影响 [J], 杨文玖;邹云雯;王志杰;褚言琛5.白细胞介素-1β、白细胞介素-6与肿瘤坏死因子-α在非酒精性脂肪性肝病发展过程中的作用 [J], 赵鹏;金海;朱加兴(综述);庹必光(审校)因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本试剂盒只能用于科学研究,不得用于医学诊断小鼠(Mouse)肿瘤坏死因子β(TNF-β)ELISA检测试剂盒使用说明书检测原理试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被肿瘤坏死因子β(TNF-β)抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的肿瘤坏死因子β(TNF-β)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
样品收集、处理及保存方法1.血清:使用不含热原和内毒素的试管,操作过程中避免任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞迅速小心地分离。
2.血浆:EDTA、柠檬酸盐或肝素抗凝。
3000转离心30分钟取上清。
3.细胞上清液:3000转离心10分钟去除颗粒和聚合物。
4.组织匀浆:将组织加入适量生理盐水捣碎。
3000转离心10分钟取上清。
5.保存:如果样本收集后不及时检测,请按一次用量分装,冻存于-20℃,避免反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品1.酶标仪(450nm)2.高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL3.37℃恒温箱操作注意事项1.试剂盒保存在2-8℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶完全溶解后再使用。
2.实验中不用的板条应立即放回自封袋中,密封(低温干燥)保存。
3.浓度为0的S0号标准品即可视为阴性对照或者空白;按照说明书操作时样本已经稀释5倍,最终结果乘以5才是样本实际浓度。
4.严格按照说明书中标明的时间、加液量及顺序进行温育操作。
5.所有液体组分使用前充分摇匀。
试剂盒组成名称96孔配置48孔配置备注微孔酶标板12孔×8条12孔×4条无标准品0.3mL*6管0.3mL*6管无样本稀释液6mL3mL无检测抗体-HRP10mL5mL无20×洗涤缓冲液25mL15mL按说明书进行稀释底物A6mL3mL无底物B6mL3mL无终止液6mL3mL无封板膜2张2张无说明书1份1份无自封袋1个1个无注:标准品(S0-S5)浓度依次为:0、15、30、60、120、240pg/mL试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。
洗板方法1.手工洗板:甩尽孔内液体,每孔加满洗涤液,静置1min后甩尽孔内液体,在吸水纸上拍干,如此洗板5次。
2.自动洗板机:每孔注入洗液350μL,浸泡1min,洗板5次。
操作步骤1.从室温平衡20min后的铝箔袋中取出所需板条,剩余板条用自封袋密封放回4℃。
2.设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50μL;3.样本孔先加待测样本10μL,再加样本稀释液40μL;空白孔不加。
4.除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体100μL,用封板膜封住反应孔,37℃水浴锅或恒温箱温育60min。
5.弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次(也可用洗板机洗板)。
6.每孔加入底物A、B各50μL,37℃避光孵育15min。
7.每孔加入终止液50μL,15min内,在450nm波长处测定各孔的OD值。
结果判断绘制标准曲线:在Excel工作表中,以标准品浓度作横坐标,对应OD值作纵坐标,绘制出标准品线性回归曲线,按曲线方程计算各样本浓度值。
试剂盒性能1.准确性:标准品线性回归与预期浓度相关系数R值,大于等于0.9900。
2.灵敏度:最低检测浓度小于1.0pg/mL。
3.特异性:不与其它可溶性结构类似物交叉反应。
4.重复性:板内、板间变异系数均小于15%。
5.贮藏:2-8℃,避光防潮保存。
6.有效期:6个月免责声明1.试剂盒仅供研究使用,不得用于临床实验或人体实验,否则所产生的一切后果,由实验者承担,本公司概不负责。
2.严格按照说明书操作,实验者违反说明书操作,后果由实验者承担。
FOR RESEARCH USE ONLY.NOT FOR USE IN DIAGNOSTIC PROCEDURES.Mouse Tumor necrosis factorβ(TNF-β)ELISA KitinstructionIntended useThis TNF-βELISA kit is intended Laboratory for Research use only and is not for use in diagnostic or therapeutic procedures.The Stop Solution changes the color from blue to yellow and the intensity of the color is measured at450nm using a spectrophotometer.In order to measure the concentration of TNF-βin the sample, this TNF-βELISA Kit includes a set of calibration standards.The calibration standards are assayed at the same time as the samples and allow the operator to produce a standard curve of Optical Density versus TNF-βconcentration.The concentration of TNF-βin the samples is then determined by comparing the O.D.of the samples to the standard curve.Sample collection and storagesSerum-Use a serum separator tube and allow samples to clot for30minutes before centrifugation for10minutes at approximately3000×g.Remove serum and assay immediately or aliquot and store samples at-20℃or-80℃.Avoid repeated freeze-thaw cyclesPlasma-Collect plasma using EDTA or heparin as an anticoagulant.Centrifuge samples for30minutes at3000×g at2-8℃within30minutes of collection.Store samples at-20℃or-80℃.Avoid repeated freeze-thaw cycles.Cell culture supernates and other biological fluids-Remove particulates by centrifugation and assay immediately or aliquot and store samples at-20℃or -80℃.Avoid repeated freeze-thaw cycles.Note:The samples shoule be centrifugated dequately and no hemolysis or granule was allowed.Materials required but not supplied1.Standard microplate reader(450nm)2.Precision pipettes and Disposable pipette tips.3.37℃incubatorPrecautions1.Do not substitute reagents from one kit to another.Standard,conjugate and microplates are matched for optimal e only the reagents supplied by manufacturer.2.Do not remove microplate from the storage bag until needed.Unused strips should be stored at2-8°C in their pouch with the desiccant provided.3.Mix all reagents before using.Remove all kit reagents from refrigerator and allow them to reach room temperature (20-25°C)Materials suppliedName 96determinations48determinations Microelisa stripplate12*8strips12*4stripsStandard0.3ml*6tubes0.3ml*6tubesSample Diluent 6.0ml 3.0mlHRP-Conjugate reagent10.0ml 5.0ml20X Wash solution25ml15mlChromogen Solution A 6.0ml 3.0mlChromogen Solution B 6.0ml 3.0mlStop Solution 6.0ml 3.0mlClosure plate membrane22User manual11Sealed bags11Note:Standard(S0→S5)concentration was followed by:0,15,30,60,120,240 pg/ml.Reagent preparation20×wash solution:Dilute with Distilled or deionized water1:20.Assay procedure1.Prepare all re a g e n t s before starting assay procedure.It is recommended that all Standards and Samples be added in duplicate to the Microelisa Stripplate.2.Add standard:Set Standard wells,testing sample wells.Add standard50μl to standard well.3.Add Sample:Add testing sample10μl then add Sample Diluent40μl to testing sample well;Blank well doesn’t add anyting.4.Add100μl of HRP-conjugate reagent to each well,c over with an adhesive strip and incubate for60minutes at37°C.5.Aspirate each well and wash,repeating the process four times for a total of five washes.Wash by filling each well with Wash Solution(400μl)using a squirt bottle, manifold dispenser or plete removal of liquid at each step is essential to good performance.After the last wash,remove any remaining Wash Solution by aspirating or decanting.Invert the plate and blot it against clean paper towels.6.Add chromogen solution A50μl and chromogen solution B50μl to each well. Gently mix and incubate for15minutes at37°C.Protect from light.7.Add50μl Stop Solution to each well.The color in the wells should change from blue to yellow.If the color in the wells is green or the color change does not appear uniform,gently tap the plate to ensure thorough mixing.8.Read the Optical Density(O.D.)at450nm using a microtiter plate reader within15minutes.Calculation of results1.This standard curve is used to determine the amount in an unknown sample.The standard curve is generated by plotting the average O.D.(450nm) obtained for each of the six standard concentrations on the vertical(Y)axis versus the corresponding concentration on the horizontal(X)axis.2.First,calculate the mean O.D.value for each standard and sample.All O.D.values,are subtracted by the mean value of the zero standard before result interpretation.Construct the standard curve using graph paper or statistical software.3.To determine the amount in each sample,first locate the O.D.value on theY-axis and extend a horizontal line to the standard curve.At the point of intersection,draw a vertical line to the X-axis and read the corresponding concentration.4.Any variation in operator,pipetting and washing technique,incubation time ortemperature,and kit age can cause variation in result.Each user should obtain their own standard curve.5.The sensitivity by this assay is1.0pg/ml6.Standard curveStorage:2-8℃.validity:six months.FOR RESEARCH USE ONLY;NOT FOR THERAPEUTIC OR DIAGNOSTIC APPLICATIONS!PLEASE READ THROUGH ENTIRE PROCEDURE BEFORE BEGINNING!。
