注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(强克)说明书(完整版)
重组人2型肿瘤坏死因子受体抗体融合蛋白

重组人2型肿瘤坏死因子受体抗体融合蛋白重组人2型肿瘤坏死因子受体抗体融合蛋白(Recombinant Human Tumor Necrosis Factor Receptor 2 Antibody Fusion Protein)是一种由受体抗体融合而成的蛋白质,其定义为以特定的抗体作为载体,将TNF-R2(Tumor Necrosis Factor Receptor 2)受体抗体融合在一起形成的蛋白质。
TNF-R2(Tumor Necrosis Factor Receptor 2)是细胞表面上的一种膜蛋白,它可以通过结合外源性的肿瘤坏死因子(TNF)来调控多种炎症反应,并有助于细胞转录、凋亡和免疫反应相关的信号传导通路。
重组人2型肿瘤坏死因子受体抗体融合蛋白的制备过程主要包括TNF-R2受体抗体及其载体蛋白的表达、纯化和融合等步骤。
首先,需要使用DNA质粒引物来克隆TNF-R2受体抗体的cDNA片段,然后将其表达在大肠杆菌中,并将所生产的TNF-R2受体抗体与载体蛋白(如IgG)进行融合。
其次,TNF-R2受体抗体和载体蛋白经过细胞悬液处理、浓缩和纯化后,即可得到目标蛋白,即重组人2型肿瘤坏死因子受体抗体融合蛋白。
重组人2型肿瘤坏死因子受体抗体融合蛋白具有多种应用,如在免疫学检测和研究中,可以用于对TNF-R2受体的抗原性进行定量。
此外,它还可以用于肿瘤治疗,如癌症疗法的新药开发,通过对TNF-R2受体进行抑制,从而达到抗肿瘤的效果。
此外,重组人2型肿瘤坏死因子受体抗体融合蛋白还可以用于炎症反应的研究,包括细胞受体的激活、细胞凋亡和免疫反应的调控。
从上述可以看出,重组人2型肿瘤坏死因子受体抗体融合蛋白具有重要的应用前景,它可以用于肿瘤治疗、炎症反应的研究和免疫学检测等方面,可以帮助人们更好地了解TNF-R2受体的特性,从而提高肿瘤治疗效果,促进炎症反应的治疗等。
益赛普0

中华风湿病学杂志;2008,12(5),314-320
益赛普治疗AS
192周疗效与安全性研究
Ann Rheum Dis 2008;67;346-352
益赛普持久维持疗效
100
依那西普/依那西普 安慰剂/依那西普
ASAS40
ASAS40达标率 (%)
80
60 40
20
24
48
72
96
120
144
168
192
周
J C Davis et al. Ann Rheum Dis 2008;67;346-352
益赛普持久改善脊柱关节功能
60
BASFI
安慰剂组开放期改用益赛普治疗 益赛普组开放期继续益赛普治疗
BASFI 平均值
50 40 30 20 10 0 0
24
48
72
96
120
144
168
192 周
J C Davis et al. Ann Rheum Dis 2008;67;346-352
禁忌症
对益赛普中任何成分过敏者
活动性结核病患者
败血症患者
孕妇和哺乳妇女
特
点
• 益赛普是最安全有效的TNF拮抗剂。
• 具有结核发生率最低,迅速抑制炎症,阻止病程 进展,改善关节功能等特点。
• 是中国第一个TNF拮抗剂,拥有最多中国循征医 学数据支持。 • 是治疗活动性RA、AS的首选。
益赛普 治疗类风湿关节炎
结构:Ⅱ型TNF受体P75的细胞外部分和 人IgG1的Fc段形成的融合蛋白
特征:肿瘤坏死因子(TNF)拮抗剂
◦ 可溶性TNF受体
生物制剂使用知情同意书

告知医师签字 患者本人签字
时间 患者监护人签字与患者的关系 Nhomakorabea时间
3、注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(强克):常见不良反应是注射部位局部反应,包括轻至中度红 斑、搔痒、疼痛和肿胀等,其它不良事件包括头痛、眩晕、皮疹、咳嗽、腹痛、淋巴细胞增多、白细胞减少、中性粒细胞减少、鼻炎、发热、 肌肉酸痛、困倦、面部肿胀、面部过敏等以及因个体差异存在的风险及不良反应。
5、阿达木单抗注射液(修美乐):感染、良性、恶性和不明类型的新生物包括囊肿和息肉、血液和淋巴系统紊乱、免疫 系统紊乱、代谢和营养紊乱、精神紊乱、神经系统紊乱、眼睛功能异常、耳部和迷路功能紊乱、心功能紊乱等以及因个体差异存在 的风险及不良反应。
6、注射用英夫利西单抗(类克):常见不良反应皮疹 瘙痒 荨麻疹、 出汗 皮肤干燥 真菌性皮炎 甲真菌病 湿疹 脂 溢性 皮炎 脱发、头痛、眩晕、恶心 腹泻 腹痛 消化不良 肠梗阻 呕吐 便秘、上呼吸道感染 下呼吸道感染及输液反应等以及因个体 差异存在的风险及不良反应。
生物制剂使用知情同意书
姓名:
性别:
年龄: 床号: 住院号:
门诊号
临床诊断:
1、注射用依那西普(恩利):常见不良反应注射部位局部反应,包括轻至中度红斑、瘙痒、疼痛和肿胀等,其他不良反 应包括头痛、眩晕、皮疹、咳嗽、腹痛、白细胞计数减少、中性粒细胞减少、鼻炎、发热、肌肉酸痛、困倦、面部肿胀、面部过敏 等以及因个体差异存在的风险及不良反应。
7、托珠单抗注射液(雅美罗):上呼吸道感染、蜂窝织炎、口唇单纯疱疹、带状疱疹,腹痛、口腔溃疡、胃炎,皮疹、 瘙痒、荨麻疹,头痛、眩晕,肝氨基转移酶升高、体重增加等以及因个体差异存在的风险及不良反应。
重组人二型肿瘤坏死因子受体抗体融合蛋白

重组人二型肿瘤坏死因子受体抗体融合蛋白《重组人二型肿瘤坏死因子受体抗体融合蛋白的全面评估与应用》一、引言重组人二型肿瘤坏死因子受体抗体融合蛋白是一种具有重要生物学功能和临床应用前景的蛋白质。
它能够调节免疫系统、抑制炎症反应、治疗自身免疫性疾病及恶性肿瘤等。
二、重组人二型肿瘤坏死因子受体抗体融合蛋白的基本概念1. 重组蛋白的定义和特点重组蛋白是指通过基因工程技术在细菌、酵母、哺乳动物细胞或植物等表达系统中合成的人工蛋白质。
重组蛋白具有高纯度、规模化制备和定制化修改等特点,可用于医疗、制药和科研领域。
2. 二型肿瘤坏死因子受体抗体及其生物学功能二型肿瘤坏死因子(TNF)是一种重要的炎症介质,在免疫应答和炎症过程中发挥重要作用。
抑制TNF的生物学效应对于治疗炎症性疾病具有重要意义。
二型肿瘤坏死因子受体抗体融合蛋白即是通过将TNF 受体与抗体片段融合而成的蛋白,能够充分发挥抗TNF生物活性。
三、重组人二型肿瘤坏死因子受体抗体融合蛋白的研究进展1. 临床应用进展通过对重组人二型肿瘤坏死因子受体抗体融合蛋白临床试验和治疗研究的回顾和总结,可以了解其在治疗类风湿性关节炎、克罗恩病和银屑病等疾病中的疗效和安全性。
2. 机制研究进展通过深入探讨重组人二型肿瘤坏死因子受体抗体融合蛋白对炎症反应的调节机制、信号转导途径和抗肿瘤作用等方面的研究,可以更好地理解其作用机制和生物学效应。
四、重组人二型肿瘤坏死因子受体抗体融合蛋白的应用前景在这一部分,我想结合重组人二型肿瘤坏死因子受体抗体融合蛋白的研究进展,对其在免疫调节、炎症治疗和抗肿瘤治疗等方面的应用前景进行探讨。
五、结语通过本文对重组人二型肿瘤坏死因子受体抗体融合蛋白的全面评估和应用前景的讨论,相信能够更好地促进其在临床医学和科研领域的应用,为疾病治疗和健康保障做出更大的贡献。
个人观点:重组人二型肿瘤坏死因子受体抗体融合蛋白作为一种新型生物药物,具有巨大的应用潜力和市场前景。
注射用重组人ⅱ型肿瘤坏死因子受体-抗体融合蛋白生产流程-概述说明以及解释

注射用重组人ⅱ型肿瘤坏死因子受体-抗体融合蛋白生产流程-概述说明以及解释1.引言1.1 概述概述部分的内容可以如下所写:注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白是一种新型生物药物,它是人工合成的蛋白质,结合了Ⅱ型肿瘤坏死因子受体和特定抗体的功能。
该融合蛋白具有双重作用机制,既能够诱导肿瘤细胞凋亡,又能够抑制炎症反应,因此具有广泛的应用前景。
本文将介绍注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的生产流程。
通过详细描述该生产流程,我们可以了解到如何在实验室中利用细胞工程技术和基因重组技术制备该融合蛋白。
这些技术的应用为注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的大规模生产提供了有力的支持。
在接下来的章节中,我们将详细介绍该蛋白的生产流程,并探讨其优势和应用前景。
通过阐明生产流程的具体步骤和技术要点,希望能够为相关领域的科研人员提供帮助和启示。
最后,我们将对注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的展望进行展开,探讨其未来的发展方向和潜在的临床应用前景。
总之,注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的生产流程是一个复杂且精密的过程,其中涉及到细胞培养、基因重组、蛋白纯化等多个环节。
对于了解该蛋白的生产方式和相关技术具有重要的意义,这也为该蛋白的研究和应用提供了一定的指导和依据。
希望本文的介绍能够为读者提供清晰的概述,引起广大科研人员对此领域的关注和兴趣。
1.2文章结构文章结构:本文将从以下几个方面介绍注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的生产流程。
首先,我们将简要概述本文的研究内容和目的。
接着,我们将详细介绍重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的基础知识和其在医学领域中的重要性。
随后,我们将着重介绍注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的生产流程,包括关键技术和操作步骤。
最后,我们将总结该生产流程的优势和应用前景,展望注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白在未来的发展方向和应用领域。
注射用重组人Ⅱ型肿瘤坏死因子受体—抗体融合蛋白辅助治疗类风湿关节炎的效果

注射用重组人Ⅱ型肿瘤坏死因子受体—抗体融合蛋白辅助治疗类风湿关节炎的效果齐潇蕾【期刊名称】《临床合理用药杂志》【年(卷),期】2022(15)10【摘要】目的观察注射用重组人Ⅱ型肿瘤坏死因子受体—抗体融合蛋白(益赛普)辅助治疗类风湿关节炎(RA)的效果。
方法选择2019年1月—2020年10月在北京市石景山医院风湿免疫科治疗RA患者108例,采用随机数字表法分为观察组和对照组,每组54例。
对照组常规抗风湿治疗,观察组在对照组的基础上使用益赛普辅助治疗,比较2组临床疗效、治疗前后C反应蛋白(CRP)、红细胞沉降率(ESR)、类风湿因子(RF)水平、晨僵时间、压痛指数评分、疼痛指数评分及肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、白介素-17(IL-17)水平。
结果观察组治疗总有效率为92.59%,高于对照组的74.07%(χ^(2)=6.667,P=0.010);治疗12周后,2组患者CRP、ESR、RF、压痛指数评分、疼痛指数评分及TNF-α、IL-1β、IL-17水平均低于治疗前,晨僵时间短于治疗前,且观察组低/短于对照组(P<0.01)。
结论益赛普辅助治疗RA的效果显著,可有效降低RF水平,抑制关节及全身炎性反应,改善临床症状,具有积极的临床意义。
【总页数】4页(P20-22)【作者】齐潇蕾【作者单位】首都医科大学石景山教学医院/北京市石景山医院风湿免疫科【正文语种】中文【中图分类】R59【相关文献】1.小剂量肾上腺糖皮质激素与注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白短期联合应用治疗类风湿关节炎临床效果观察2.注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗类风湿关节炎患者疗效评价3.注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白联合甲氨蝶呤治疗类风湿关节炎的临床效果4.类风湿关节炎应用注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗的效果研究5.注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白联合甲氨蝶呤治疗活动性类风湿关节炎的效果因版权原因,仅展示原文概要,查看原文内容请购买。
注射用重组人II型肿瘤坏死因子受体-抗体融合蛋白 说明书

注射用重组人II型肿瘤坏死因子受体-抗体融合蛋白商品名注射用重组人II型肿瘤坏死因子受体-抗体融合蛋白 25mg 通用名注射用重组人II型肿瘤坏死因子受体-抗体融合蛋白规格25mg批准文号S2*******成分每瓶含重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(rhTNFR:Fc)1 2.5毫克或25毫克,甘露醇40毫克,蔗糖10毫克,三羟甲基氨基甲烷1.2毫克。
用1毫升灭菌注射用水溶解。
性状本品为白色冻干粉针剂,加水溶解后溶液为无色或微带黄色的澄清、透明液体。
适应症用于治疗:1. 中度及重度活动性类风湿关节炎;2. 18岁及18岁以上成人中度至重度斑块状银屑病;3. 活动性强直性脊柱炎。
用法用量成人推荐剂量为每次25mg,皮下注射,每周二次。
注射前用1毫升注射用水溶解,溶解后可冷藏72小时。
不良反应常见不良反应是注射部位局部反应,包括轻至中度红斑、搔痒、疼痛和肿胀等,注射部位反应通常发生在开始治疗的第一个月内,在随后的治疗中发生频率降低。
注射部位反应平均持续3-5天。
在临床试验出现的其它不良事件包括头痛、眩晕、皮疹、咳嗽、腹痛、淋巴细胞增多白细胞减少、中性粒细胞减少、鼻炎、发热、关节酸痛、肌肉酸痛、困倦、面部肿胀、面部过敏、肝功能异常、肾结石、左肺纤维化等。
据国外文献报道,同类产品的不良反应还有如下报道,这些不良反应在本品的使用中也可能发生:感染最常见的感染是上呼吸道感染。
在安慰剂对照试验中,没有观察到严重感染的发生率有显著升高(安慰剂和重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白组的发生率都约为1%)。
在所有临床试验中,RA患者中发生的严重感染有:肾盂肾炎,支气管炎,化脓性关节炎,腹部脓肿,蜂窝组织炎,骨髓炎,伤口感染,肺炎,足脓肿,腿部溃疡,腹泻,鼻窦炎和败血症。
开放性试验中严重感染的发生率和对照试验中的发生率比较也基本相似。
在上市后的应用中,严重感染包括败血症和死亡都有报道。
有些发生在开始使用后几周内。
肿瘤坏死因子受体抗体融合蛋白说明书

肿瘤坏死因子受体抗体融合蛋白说明书一、产品概述肿瘤坏死因子受体抗体融合蛋白(Tumor Necrosis Factor Receptor Antibody Fusion Protein,简称TNFR-Ab)是一种由人源化的单克隆抗体和人TNF受体Ⅱ结合部分融合而成的重组蛋白。
该产品具有高亲和力、高特异性和高效力,可用于治疗多种炎症性疾病。
二、性能特点1. 高亲和力:TNFR-Ab与人TNF受体Ⅱ结合部分具有极高的亲和力,能够有效地中和TNF-α。
2. 高特异性:TNFR-Ab仅与人TNF受体Ⅱ结合部分相互作用,不与其他细胞或蛋白质发生反应。
3. 高效力:TNFR-Ab可迅速中和过量的TNF-α,从而减轻炎症反应并促进组织修复。
4. 安全性好:经过严格的质量控制和安全性评估,无明显毒副作用。
三、适用范围1. 适用于风湿性关节炎、强直性脊柱炎、系统性红斑狼疮等自身免疫性疾病的治疗。
2. 适用于严重感染、急性肝衰竭、急性胰腺炎等临床情况中的细胞因子风暴治疗。
3. 适用于肿瘤、心肌梗死、脑卒中等组织缺血再灌注损伤的治疗。
四、使用方法1. TNFR-Ab为注射剂,仅限医务人员使用。
2. 治疗剂量和时间应根据患者的具体情况和临床需要进行调整,建议在医生指导下使用。
3. TNFR-Ab可通过静脉注射或皮下注射进行给药,建议采用静脉注射方式。
4. TNFR-Ab应在无菌条件下制备和使用,避免受到污染和交叉感染。
五、注意事项1. 本品为生物制品,需存放在2-8℃的冰箱内保存,并避免震动和光线直接照射。
2. 使用前请检查包装是否完整,如有损坏请勿使用。
3. 使用过程中应注意消毒和防护措施,避免交叉感染。
4. TNFR-Ab可能会引起过敏反应,如出现过敏症状应立即停止使用并进行相应的处理。
5. TNFR-Ab可能会影响免疫系统的功能,使用前请咨询医生并进行必要的检查。
六、不良反应1. 可能引起过敏反应,表现为皮肤瘙痒、红斑、荨麻疹等。
重组改构肿瘤坏死因子 注射用重组改构人肿瘤坏死因子说明书

重组改构肿瘤坏死因子注射用重组改构人肿瘤坏死因子说明书注射用重组改构人肿瘤坏死因子治疗非小细胞肺癌患者下面是小编整理的注射用重组改构人肿瘤坏死因子说明书,欢迎阅读。
注射用重组改构人肿瘤坏死因子商品介绍通用名:注射用重组改构人肿瘤坏死因子生产厂家: 上海唯科生物制药有限公司批准文号:国药准字S2*******药品规格:50万IU*2支/盒药品价格:¥950元注射用重组改构人肿瘤坏死因子说明书【商品名称】天恩福【通用名称】注射用重组改构人肿瘤坏死因子【英文名】:InjectionofRecombinantMutantHumanTumorNecrosisFactor【汉语拼音】:ZhusheyongChongzuGaigouRenZhongliuhuaisiyinzi【主要成份】重组改构人肿瘤坏死因子【性状】白色或微黄色疏松体【适应症】天恩福与CAp化疗方案联合适用于经其他方法治疗无效或复发的晚期非小细胞肺癌患者。
【用法用量】仅可与CAp化疗方案使用。
每支用2ml注射用水溶解,肌肉注射,每次400万U/M2,第1-7天及第11-17天每天用药一次,21天为一个疗程,可试用两个疗程。
如无较明显效果,建议停止继续使用。
【不良反应】在天恩福的临床研究中,先后共有约450例受试者接受了天恩福的治疗,试验中,天恩福短疗程应用的近期不良反应主要表现为发热、感冒样症状,注射局部疼痛、局部红肿硬结、骨肌肉疼痛,发生率在80%左右。
4例受试者因发热不能耐受而中止治疗。
出现上述不良反应时,可采取相应的对症治疗措施。
天然肿瘤坏死因子为多效应细胞因子(见上述药理作用),改构后其性质和特点又可能会发生较复杂的变化,由此可能对造血系统、免疫系统及神经系统等产生不良反应和长期后续效应,特别是对某些肿瘤可能具有潜在的促进作用,以及发生与自身免疫性相关的疾病等,因此对天恩福可能发生的远期和潜在不良反应需给予密切关注。
【禁忌症】1.对天恩福所含成份过敏者禁用。
重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗难治性红皮病型银屑病
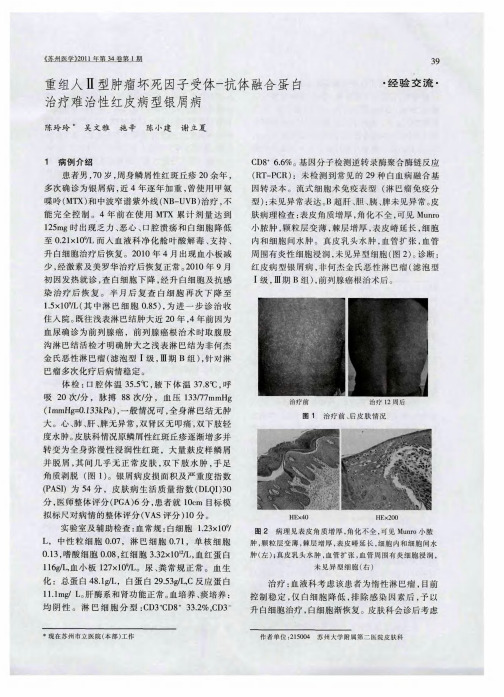
因子 受体 一 抗体 融 合 蛋 白( 品名 : 赛 普 )5 g 商 益 2r , a
Bw, 后皮 疹 明显 开 始 控 制 ,双下 肢 浮 肿 稍缓 i 2周
2 讨 论
ifxma ( nl i b 英利 昔单 抗 ) a a mu a ( i 、dl m b 阿达 利 姆 单 i 抗 ) 3种 N 一 这 F F 仪受 体 单 抗用 于治 疗银 屑病 关 节 炎 和严 重 的斑 块 型银 屑 病 。 已有不 少 的随机 对 照
本 例依 据银 屑病 病史 、 型 的临 床表 现 , 合 典 结 病理检 查结果 , 红皮 病型银 屑 病诊 断成立 。本例 之
银 屑病 , 占银 屑 病 患 者 的 1 22 % , 2 %的 约 %- . 5 约 0 红皮病 由银 屑病 导致 。尽 管银 屑病 ( 包括 红皮 病型 银 屑病 ) 的病 因和 发病 机理 尚未完 全 明 了 , T细 但 胞 及细 胞 因子在 银 屑病 发病 过 程 中 的作用 已经得
等同 所报 道 的结 果 相似 。考虑 到红皮 病型银 屑病 的 炎症 反 应较 重 , 重组 人 Ⅱ型肿 瘤坏 死 因子 受体 一 抗
L, 应 蛋 白 5 门 。第 l C反 m异L 3周 开 始 益 赛 普 改 为 2 m , 下注射 , w, 5 g皮 Q 现仍在 维持 治疗 中。
表 1 治 疗 前 后 各 项 指 数 及 评 分 对 比
为 ea ecp 能 够作 为 一个 高 效安 全 的替代 治 疗 。 t re t n 据我 们所 知 ,国 内 尚无 成 功 治疗 红 皮病 型银 屑病
注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗36例风湿免疫疾病患者的临床疗效研究

注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗36例风湿免疫疾病患者的临床疗效研究杨利娜【期刊名称】《中国继续医学教育》【年(卷),期】2016(000)003【摘要】Objective Clinical efficacy of recombinant human tumor necrosis factor-αreceptorⅡ: IgG Fc fusion protein for injection in the treatment of patients with rheumatic disease is evaluated.Methods72 cases of rheumatoid arthritis patients were taken as the research object, the control group was treated with conventional methods, the observation group was treated with recombinant human tumor necrosis factor-αreceptorⅡ: IgGFc fusion protein for injection.Results In the observation group,21 cases (58.33%) had good response, 10 cases had response (27.78%), 5 cases had no response (13.89%). In control group, there were 3 cases (22.22%), 8 cases (33.33%), 12 cases (44.44%) respectively . The difference between the two groups was statistically significant (P<0.05), and there was no signiifcant difference between the two groups in the incidence of adverse reactions (P>0.05).Conclusion Effect of patients with rheumatoid arthritis by recombinant human tumor necrosis factor-αreceptorⅡ: IgG Fc fusion protein for injection is signiifcant.%目的:评价风湿免疫疾病患者采取注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗的临床疗效。
益赛普的简介

益赛普1基本信息[通用名] 注射用重组人Ⅱ型肿瘤坏死因子受体一抗体融合蛋白[汉语拼音]Zhusheyong Chongzu Ren Erxing Zhongliuhuaisiyinzi Shouti-Kangti Ronghedanbai[英文名] Recombinant Human Tumor Necrosis Factor-a ReceptorⅡ:IgG Fc Fusion Protein forInjection商品名称:益赛普生产厂家:上海中信国健药业有限公司国药准字:S2*******药品规格:12.5mg/支2药品简介性状本品为白色冻干粉针剂,加水溶解后溶液为无色或微带黄色的澄清、透明液体。
【适应症】用于治疗:(1.)中度及重度活动性类风湿关节炎;(2.)18岁及18岁药理毒理个主要炎性介质,其参与调控的炎症反应可导致关节的病理改变。
本品的作用机制为竞争性地与血中TNF-a结合,阻断它和细胞表面TNF受体结合,降低其活性。
毒理研究:给予猴子4周的长期毒性试验结果显示,15mg/kg剂量的益赛普,无明显毒性反应。
药代动力学临床研究表明,重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白经皮下注射后,在注射部位缓慢吸收。
单次给药后,约48小时后可达血药浓度峰值。
绝对生物利用度约为76%。
每周给药2次,达稳态时的血药浓度约为单次给药峰浓度的2倍。
11名活动性类风湿关节炎患者皮下注射25mg/次,每周2次,连续给药6周后,rhTNFR:Fc达稳态的时间为408±20h,达稳态时峰浓度(Css)max为3.0±0.2mg/ml,达稳态时谷浓度(Css)min为2.6±0.2mg/ml,平均稳态浓度Css为2.8±0.3mg/ml,波动系数FI为12.8±3.3%。
最后一次给药后rhTNFR:Fc的半衰期T1/2为74±4h,Tmax为53±6h,CL为102.8±10.4ml/h。
几种特殊注射用制剂的配制及注射方法

几种特殊注射用制剂的配制及注射方法郝明非(北医三院门诊注射室)有些注射用制剂在配制和给药时有特殊要求,如操作不当,可对患者造成损害或导致经济损失(这些药物单价均较高)。
现将我院使用的几种特殊注射剂型的用法进行介绍,供参考。
1.注射用重组人II型肿瘤坏死因子受体抗体融合蛋白(益赛普)为白色冻干粉针剂,注射前用1ml灭菌注射用水溶解。
配制时药瓶放置于桌面,瓶口朝上。
使用1ml注射器,垂直于桌面进针,注入灭菌注射用水。
药瓶不离开桌面,轻轻地顺时针画圆(始终朝一个方向),不可以用力摇震药液。
待药粉全部溶解,瓶中为清亮溶液。
倒转瓶口向下,抽吸药液。
于上臂45°进针,皮下注射。
2. 注射用曲普瑞林(达菲林)白色冻干物或粉末。
本品仅可肌内注射,用药盒内提供的溶剂复溶药物粉末,复溶后立即注射。
复溶后得到的悬浮液不得与其它药品混合。
复溶操作:药瓶放置于桌面,瓶口始终朝上,垂直于桌面进针,注入药液,药瓶不离开桌面,轻轻地顺时针画圆(始终朝一个方向),不可以用力摇震药液(破坏颗粒,不能起到缓释作用),瓶口继续朝上,不可以反转药瓶抽吸药液(药液会剩余),针头向下垂直抽药,药物剂量要精确,不得有剩余药物,更换针头后,肌肉注射,快推药液。
药物剂量如不精确(未抽吸干净药液),要及时记录。
3. 那屈肝素钙注射液(速碧林)患者取卧位,注射部位为前外侧或后外侧腹壁的皮下脂肪组织内,左右侧交替。
注射时,不用排气,一手持续捏起皮肤形成皱褶,不要松手;另一手持针,注射针垂直刺入皮肤皱褶。
不用抽回血,直接推药。
注射结束后,方可松手。
4. 醋酸戈舍瑞林缓释植入剂(诺雷德)预充于一次性注射器中,脐下腹前壁皮下注射。
用时打开包装,将红色安全卡拉出,丢弃。
去除针帽。
不需排气,一手持续捏起皮肤,不要松手;另一手持针,针头斜面向上,30-45。
进针。
不用抽回血,直接推药,完全推入会听到“咔哒”一声,针头会自动弹出并进入防护套中。
压迫5分钟。
重组改构人肿瘤坏死因子说明书--天恩福

注射用重组改构人肿瘤坏死因子说明书【药品名称】通用名:注射用重组改构人肿瘤坏死因子商品名:天恩福英文名:Recombinant Human Tumor Necrosis Factor汉语拼音:Zhusheyong ChongzuGaigouRen Zhongliuhuaisiyinzi【成份】主要组成成份为重组改构人肿瘤坏死因子。
【性状】白色或微黄色疏松体【适应症】本品与NP、MVP化疗方案联合,可试用于经其他方法治疗无效或复发的晚期非小细胞肺癌患者。
本品与BACOP化疗方案联合,可试用于经化疗或其他方法治疗无效的晚期非霍奇金氏淋巴瘤患者。
【规格】50万IU/瓶【用法用量】与上述化疗方案联合使用,每周的第3-7天用药,剂量为60-90万单位/m2,用生理盐水稀释至20ml,5-8分钟内恒速静脉推注。
【不良反应】在本品的临床研究中,先后共有约500例受试者接受了本品的治疗,试验中,本品短疗程应用的近期不良反应主要表现为发热、寒战,发生率在50%左右。
其他不良反应包括血压变化、乏力、头晕头痛、关节酸痛、骨骼肌痛、恶心呕吐、白细胞减少、血小板下降、血红蛋白下降、肝功能异常等。
出现上述不良反应时,可采取相应的对症治疗措施。
如出现严重不良反应,应及时停药。
在同类产品的临床研究中,曾出现有呼吸困难的不良反应,应引起注意。
天然肿瘤坏死因子为多效应细胞因子(见上述药理作用)。
研究发现,TNF水平升高与许多疾病的病理过程密切相关,如类风湿性关节炎、成人呼吸窘迫综合症(ARDS)、肝肾功能紊乱等。
其中ARDS的病情与支气管肺泡液中TNF水平正相关,所以不能排除过量TNF可引起ARDS并促使病情进一步恶化的可能。
本品为改构的肿瘤坏死因子,改构后其性质和特点又可能会发生较复杂的变化,由此可能对造血系统、免疫系统、循环系统、呼吸系统、消化系统、神经系统等产生不良影响和长期后续效应,特别是对某些肿瘤可能具有潜在的促进作用,以及诱发与自身免疫性相关的疾病等,因此对本品可能发生的远期和潜在不良反应需给予密切关注。
注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白剂量递减方案治疗强直性脊柱炎的临床疗效观察要点

Natural Science Foundation of Shanghai of China(09ZRl417600)
AS是一种以中轴关节病变为主,可累及外周关 节、内脏及其他组织的慢性炎症性疾病,严重时可导 致患者躯体功能丧失和致残㈣。近年来,随着以抗 TNF为代表的生物制剂的广泛应用,彻底改变了既 往AS治疗药物有效率低、不良反应大的局面,大大 提高了AS临床症状的缓解率,减轻关节损害,显著 改善了疾病结局131。 虽然目前已有依那西普生物类似药(biosimi— lars)女fl益赛普、注射用重组人Ⅱ型肿瘤坏死因子受 体.抗体融合蛋白(强克)等上市并成功应用于临床, 使疾病成本费用较使用进口药大幅下降,但就中国 现有的国情来讲,多数患者仍然难以承担长期足量 使用生物制剂的费用141。另外,生物制剂长期使用的 风险仍未完全阐明,是否具有潜在的危害也让广大 医生和患者心存疑虑151。目前在公认的RA治疗指南 中,当疾病持续缓解时,可以考虑生物制剂的减量使 用[61。但是在AS的治疗中却未有广泛公认的指导原 则。因此,当AS临床症状得以缓解、疾病进入低活 动状态时,是否可以降低生物制剂使用剂量逐渐成 为国内外研究的热点刚。本文旨在比较注射用重组 人Ⅱ型肿瘤坏死因子受体一抗体融合蛋白(商品名强 克)治疗AS达低疾病活动度后,剂量递减方案与标 准剂量维持方案的疗效、复发率、安全性及相关花费 等结果。
益赛普

益赛普[商品名] 益赛普[通用名] 注射用重组人Ⅱ型肿瘤坏死因子受体一抗体融合蛋白[英文名] RecombinantHumanTumorNecrosisFactor-O Receptor[主要成分] 每瓶含重组人II型肿瘤坏死因子受体一抗体融合蛋白(rhTNFR:Fc)12.5毫克或25毫克,甘露醇40毫克,蔗糖10毫克,三羟甲基氨基甲烷1.2毫克。
用1毫升灭菌注射用水溶解。
[性状] 本品为白色冻干粉针剂。
[药理毒理] 已知TNF是类风湿性关节炎(PA)病理过程中的一种主要炎性介质,其参与调控的炎症反应可导致关节的病理改变。
本品的作用机制为竞争性地与血中肿瘤坏死因子(TNF)-。
结合,阻断它和细胞表面TNF受体结合,降低其活性。
急性毒性试验结果显示给予小鼠静脉注射160mg/kg的益赛普,未见毒性反应;给予猴4周的长期毒性试验结果显示,15mg/kg剂量的益赛普,无明显毒性反应。
[药代动力学] 临床研究表明,本品皮下注射后,在注射部位缓慢吸收。
单次给药后,约48/I、时后可达血药浓度峰值。
绝对生物利用度约为76%。
每周给药2次,达稳态时的血药浓度约为单次给药峰度的2倍。
11名活动性类风湿关节炎患者皮下注射25mg/次,每周2次,连续给药6周后,rhTNFR:Fc达稳态的时间为408i20h,达稳态时峰浓度(Css)max为3.0i0.2LJg/mi,达稳态时谷浓度(Css)min为2.610.2ug/mi,平均稳态浓度Css为2.810.3ug/mi,波动系数F●为12.8±3.3%。
最后一次给药后rhTNFR:Fc的半衰期T1/2为74i4h,Tmax为5316h,CL为102.8i10.4ml/h。
在健康人和急性肾脏或肝脏功能异常的病人中观察到的血药浓度没有十分显著的差别,因此,对于肾脏功能受损的病人无需调整剂量。
在研究中未观察到甲氨喋呤(MTX)对重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的药动学的影响。
注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗中重度强直性脊柱炎的护理

本组 3 2例 患 者 共 完 成 强 克 治 疗 皮 下 注 射 3 8 4次 , 应
用 2周 后 评 价 疗 效 : A S疗 效 评 估 采 用 A S A S 2 0制 定 的 标
准: 9 0 %患 者 取 得 了 明 显 的短 期 疗 效 。发 生 不 良反 应 3 例, 其 中注 射 局 部 红 肿 2例 , 转 氨 酶 轻 度 升 高 1例 。
2 护理
士嘱其不可搔抓 , 以免 皮 肤 破 溃 导 致 感 染 , 可 以在 皮 肤 局 部周边进行按 摩 , 热 敷并 且 每 次 更 换 注 射 部 位 , 减 轻 患 者 的 不 适 感 。1例 转 氨 酶 轻 度 升 高 且 呈 一 过 性 , 未 予 特 殊 处
( 2 ) 药物的保存 、 配制与使用 : 强克应贮 存在 2 ~ 8 ℃低 温处 , 避光 保 存 , 严禁冷冻。配制 : 使 用 前 待 药 物 自然 升 温 至室温后 . 每瓶 强 克 用 l m l 灭 菌 注 射 用 水 缓 慢 注 入 玻 璃 瓶 内与 白色 药 物 混 合 , 以水 平 画 圆圈 的方 式 旋 转 玻 璃 瓶 数 次 以溶 解 粉 末 , 药物溶解时不可震摇玻璃瓶 , 以免 产 生 泡 沫 。 配 制 好 的 药 液 应 立 即使 用 。皮 下 注 射 部 位 多 选 择 患 者 大 腿、 腹部和上臂 。 每 次 在 不 同 的部 位 注 射 , 与原 先 注 射 部 位
1 . 2 治 疗 方 法
5 0 mg / 次, 1次/ 周, 皮下注射 。 住 院 期 间 完 成 2周强 克
应 用 。 出院 后 继 续 应 用 , 每周 到医院随访并治疗 , 疗程 1 2 周。用药期 间动态监测血 、 尿常规 、 心 电图 、 肝肾功能 、 血 沉、 C 一 反应 蛋 白 、 关 节痛 情 况 。严 密 观 察 不 良反 应 , 详 细 记 录其发生时 间 、 严重程度 、 频度、 持 续时 间 、 采取 的措施 与
益赛普说明书

【益赛普药理作用】
已知TNF是类风湿性关节炎(RA)病理过程中的 一个主要炎性介质,其参与调控的炎症反应可导致 关节的病理改变。益赛普的作用机制为竞,降低其活性。
【益赛普药代动力学】 临床研究表明,重组人Ⅱ型肿瘤坏死因子受体-抗 体融合蛋白经皮下注射后,在注射部位缓慢吸收。 单次给药后,约48小时后可达血药浓度峰值。绝对 生物利用度约为76%。每周给药2次,达稳态时的 血药浓度约为单次给药峰度的2倍。
百济新特药房资深药师倾力制作千个药品专辑 安全、有效、合理用药之
益赛普篇
商品名:益赛普 厂家:上海中信国健药业有限 公司
【益赛普药品名称】 通用名:注射用重组人Ⅱ型肿瘤坏死因子受体- 抗体融合蛋白 商品名:益赛普 英文名:Recombinant Human Tumor Necrosis Factor-α ReceptorⅡ:IgG Fc Fusion Protein for Injection 汉语拼音:Zhusheyong Chongzu Ren Erxing Zhongliuhuaisiyinzi Shouti-Kangti Ronghedanbai
【益赛普适应症】 用于治疗:1. 中度及重度活动性类风湿关节炎;2. 18岁及18岁以上成人中度至重度斑块状银屑病;3. 活动性强直性脊柱炎。 【益赛普用法用量】 成人推荐剂量为每次25mg,皮下注射,每周二次。 注射前用1毫升注射用水溶解,溶 解后可冷藏72小时。
【益赛普不良反应】 常见不良反应是注射部位局部反应,包括轻至中度红 斑、搔痒、疼痛和肿胀等,注射部位反应通常发生在 开始治疗的第一个月内,在随后的治疗中发生频率降 低。注射部位反应平均持续3-5天。在临床试验出现 的其它不良事件包括头痛、眩晕、皮疹、咳嗽、腹痛、 淋巴细胞增多白细胞减少、中性粒细胞减少、鼻炎、 发热、关节酸痛、肌肉酸痛、困倦、 面部肿胀、面部过敏、肝功能异常、 肾结石、左肺纤维化等。
注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(强克)说明书

注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白使用说明书【药品名称】通用名:注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白商品名:强克英文名:Recombinant Human TNF Receptor-Ig Fusion Protein for Injection汉语拼音:Zhusheyong Chongzu Ren Erxing Zhongliuhuaisiyinzi Shouti -Kangti Ronghedanbai【性状】本品为无菌白色冻干粉针剂。
【主要成分】每瓶含重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白25毫克,甘露醇40毫克,蔗糖10毫克,三羟甲基氨基甲烷1.2毫克。
用1毫升灭菌注射用水溶解。
【药理毒理】1.药理重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白是一个二聚体的融合蛋白,包含人75KDa肿瘤坏死因子受体(TNFR)(p75)的细胞膜外配体结合部分与人IgG1的Fc片段,包含934个氨基酸,表观分子量约为150K道尔顿(KDa)。
TNF是机体自然产生的一种细胞因子,参与正常的炎症和免疫反应。
在强直性脊柱炎关节病变的炎症反应中,TNF起着重要的作用。
TNF存在55KDa蛋白(p55)和75KDa蛋白(p75)两类受体,它们均以单体的形式存在于细胞表面。
TNF的生物学活性取决于它与细胞表面两类受体分子的结合。
重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的作用机制是竞争性地与TNF 结合,阻止TNF与细胞表面TNF受体的结合,抑制TNF的生物学活性。
2.毒理小鼠急性毒性试验结果显示,静脉注射1.09g/kg剂量的重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,未见毒性反应。
猴长期毒性试验结果显示,每周2次连续皮下注射180天15.0 mg/kg剂量的重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,未见有明显的毒性。
【药代动力学】32名中国健康成年受试者单次皮下给予重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白后,血清浓度-时间曲线在12.5mg、25mg、37.5 mg、50mg剂量范围内与剂量呈正比例增高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白使用说明书【药品名称】通用名:注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白商品名:强克英文名:Recombinant Human TNF Receptor-Ig Fusion Protein for Injection汉语拼音:Zhusheyong Chongzu Ren Erxing Zhongliuhuaisiyinzi Shouti -Kangti Ronghedanbai【性状】本品为无菌白色冻干粉针剂。
【主要成分】每瓶含重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白25毫克,甘露醇40毫克,蔗糖10毫克,三羟甲基氨基甲烷1.2毫克。
用1毫升灭菌注射用水溶解。
【药理毒理】1.药理重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白是一个二聚体的融合蛋白,包含人75KDa肿瘤坏死因子受体(TNFR)(p75)的细胞膜外配体结合部分与人IgG1的Fc片段,包含934个氨基酸,表观分子量约为150K道尔顿(KDa)。
TNF是机体自然产生的一种细胞因子,参与正常的炎症和免疫反应。
在强直性脊柱炎关节病变的炎症反应中,TNF起着重要的作用。
TNF存在55KDa蛋白(p55)和75KDa蛋白(p75)两类受体,它们均以单体的形式存在于细胞表面。
TNF的生物学活性取决于它与细胞表面两类受体分子的结合。
重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的作用机制是竞争性地与TNF 结合,阻止TNF与细胞表面TNF受体的结合,抑制TNF的生物学活性。
2.毒理小鼠急性毒性试验结果显示,静脉注射1.09g/kg剂量的重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,未见毒性反应。
猴长期毒性试验结果显示,每周2次连续皮下注射180天15.0 mg/kg剂量的重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,未见有明显的毒性。
【药代动力学】32名中国健康成年受试者单次皮下给予重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白后,血清浓度-时间曲线在12.5mg、25mg、37.5 mg、50mg剂量范围内与剂量呈正比例增高。
推荐剂量25mg和50mg后,峰浓度(Cmax)分别为1.5 ±0.5和2.4 ± 0.88 μg/mL;达峰时间个体差异大波动于36-72小时间。
AUC分别为213 ± 46和362 ± 148 μg·h/mL;消除半衰期(t1/2)约为60-90小时;表观分布容积Vd/F约为15~30L/kg,表明主要分布于血液;清除率CL/(F)约为0.1~0.2 L/h。
在低剂量(12.5mg和25mg)时,男性的Cmax显著高于女性。
在19例中度活动性男性强直性脊柱炎患者中,研究了治疗拟采用两种给药方案进行多次皮下注射药代动力学研究。
两种给药方案分别为皮下注射25 mg/次,每隔3天1次(25mg/次/3日);和50 mg/次每隔7天1次(50mg/次/7日)。
两组均在连续给药第5次后接近稳态,稳态浓度无明显差异,CSSmax分别为2.2 ±0.5和2.5 ± 1.0 μg/mL;CSSmin分别为1.6 ± 0.3和0.7 ± 0.4 μg/mL。
25mg/次/3日组Cmax 和Cmin间差异较小。
两种给药方案的首次与末次给药后药代动力学参数均无统计学差异。
猕猴药代动力学研究表明:重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白进入体内后分布全身,不能穿透血脑屏障。
平均血清组织浓度在12-24小时达到峰值,随后缓慢下降,10天仍未恢复正常,推测肾脏、胆汁和肠道可能是代谢部位。
主要从尿中排泄,其次为粪排泄。
【适应症】本品适用于中度及重度强直性脊柱炎患者。
【用法和用量】本品应在医生指导下使用。
成人推荐剂量每次50mg,皮下注射,每周一次。
注射前每瓶用1毫升灭菌注射用水溶解。
【有效性】240名中度及重度活动性强直性脊柱炎患者参加了为期12周的随机、双盲、安慰剂平行对照、多中心的临床试验。
双盲期,2周时达到ASAS20的比例安慰剂组为15.5%,注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白组为58.3%,两组差异有统计学意义(P < 0.001),说明注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗起效迅速,对病情改善明显。
6周时达到ASAS20的比例安慰剂组为29.1%,注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白组为69.5%,两组差异有统计学意义(P < 0.001)。
注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白组在12周时达到ASAS20的比例是81.0%,疗效持久稳定。
对照组在开放期经过6周注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗,在12周时达到ASAS20的比例是83.6%,治疗效果明显。
双盲期,不良反应发生率在注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白组和安慰剂组中分别为55.8%和26.9%,有统计差异;开放治疗期,不良反应发生率为46.8%。
绝大部分为轻度注射部位反应和上呼吸道感染。
所以,患者对注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白都能很好的耐受,不良反应发生轻。
根据国外同类产品的临床研究结果,由277名强直性脊柱炎患者参加的为期6个月的随机双盲安慰剂对照的临床试验中,第十二周达到ASAS 20/50/70标准的患者比率,重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白组分别为60%, 45%, 29%;安慰剂组分别为27%, 13%, 7%(P≤ 0.0001)。
第二十四周时的结果与第十二周的相似。
该研究结果不仅与由40名患者参加的单实验中心、随机安慰剂对照试验结果相似,与由84名患者参加的多中心、随机安慰剂对照试验结果也相近。
【不良反应】常见的不良反应包括注射部位反应和上呼吸道感染。
注射部位反应表现为注射部位轻度到中度的红肿、疼痛、搔痒和肿胀等,一般不需停药。
注射部位反应通常发生在开始治疗的第1个月内,平均持续3-5天,以后逐渐消失。
其它不良反应包括皮疹、发热、白细胞减少、头痛、头晕、腹泻、恶心、乏力、面部肿胀等。
根据国外文献报道,同类产品治疗强直性脊柱炎、类风湿关节炎、银屑病关节炎及银屑病的不良反应相似,不良反应还有如下报道,在使用本品过程中也可能发生:严重感染在所有临床试验中,类风湿关节炎患者出现的严重感染有:肾盂肾炎、支气管炎、, 化脓性关节炎、腹部脓肿、蜂窝组织炎、骨髓炎、伤口感染、肺炎、足脓肿、腿部溃疡、腹泻、鼻窦炎和败血症。
同类产品上市后,严重感染包括败血症和死亡也有报道。
这些严重感染有些发生在开始使用后几周内,很多患者除患有类风湿关节炎外,同时还合并有如糖尿病、充血性心衰、慢性或活动性感染。
一项有关败血症临床试验提示,重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白可增加败血症患者的死亡率。
恶性肿瘤在重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白对照试验(时间3-6个月)中,治疗组3435名患者中有两例患淋巴瘤,而对照组1335名患者中无淋巴瘤发生。
在重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白开放对照临床试验中,4650名患者接受了约9062患者年的治疗,共出现7例淋巴瘤,发病率是正常人群的两倍。
在3389名类风湿关节炎患者接受重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗,平均治疗时间28个月(治疗总计时间为8000患者年)的临床试验中,观察到6例淋巴瘤,平均每100患者年发生0.07例。
除淋巴瘤外还发现55例其他癌变,其中多数为结肠癌、乳腺癌、肺癌和前列腺癌,发病率与常发癌种类与通常人群相似。
第六个月进行的肿瘤分析表明在长达三年的观察期内,癌症病发率一直稳定在某一水平。
重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗与恶性肿瘤发生的关系尚不清楚。
免疫原性在对接受重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗的类风湿关节炎、银屑病关节炎、强直性脊柱炎和银屑病患者进行的多个时间点重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白抗体的检测中,约6%的患者中,至少一次检测到针对TNF受体部分或其他部分的抗体,这些抗体均为非中和性的抗体,未观察到抗体产生与疗效或不事件有相关关系。
重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的长期免疫原性尚不清楚。
自身抗体对类风湿关节炎患者不同的时间点采集的血清进行自身抗体检测的结果显示,在试验Ⅰ和试验Ⅱ中,新发生抗核抗体(ANA)阳性(滴度>1:40)的患者比例,重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗组(11%)较安慰剂组(5%)高。
放免试验结果显示,新发生抗双链DNA抗体的患者比例(15%)也比安慰组(4%)高。
用人短膜虫法检测,重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白组为3%,安慰剂组为0。
抗心脂抗体的发生的比例,重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白组与安慰剂组相似。
在试验Ⅲ中,重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗组与MTX治疗组相比,自身抗体的产生无显著差异。
长期使用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗对自身免疫性疾病发生的影响尚不清楚。
神经系统用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗,会极偶然发生中枢神经系统脱髓鞘病变,但与重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的关系目前尚不清楚。
因此建议医生对既往有脱髓鞘病变的患者应慎用本品。
血液系统:用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗,会极偶然发生血细胞减少,包括发生再生障碍性贫血,但与重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的关系尚不清楚。
因此建议医生对有血液学异常史的患者慎用本品。
在治疗过程中,如果发生血液系统的异常或感染的症狀(如:持续高热、瘀斑、出血及面色苍白)应立即就医,并进行血常规检测。
如果有血液系统的不良反应,应中止本品的治疗。
【禁忌】本药品不得用于败血症、结核病患者、对本品或其组分过敏的患者禁用。
【注意事项】1.有反复发作感染史或患有易导致感染的潜在疾病时,应慎用本品;在使用本品时,如患者出现上呼吸道感染或有其他明显感染倾向时,应暂停使用本品,并及时到医院就诊,由医生根据具体情况指导治疗。
2.当发生严重感染如糖尿病继发感染、结核杆菌感染等时,患者应停止使用本品。
3.在使用本品时,如发生过敏反应或严重过敏反应,应立即停止使用本品,并给予相应治疗。
4.虽然没有数据证明本品对心脏有损害,但心衰患者需使用本品时,应极为慎重。
5.由于TNF可调节炎症和细胞免疫反应,使用本品治疗时,可能会影响机体抵抗感染和恶性肿瘤的防御机能,6.患者在使用本品治疗时,可同时接种疫苗,但不能接种活疫苗。
目前尚无使用本品的患者在接种活疫苗后造成传播感染的数据。
【孕妇及哺乳期妇女用药】孕妇及哺乳期妇女禁用。
【儿童用药】尚无明确的儿童用药资料。
