GMP认证全套文件资料44-QC-708
根据GMP认证需提供的相关资料

根据GMP认证需提供的相关资料=========================为了顺利完成GMP(良好生产规范)认证,以下是您需要提供的相关资料清单:1. 公司注册信息:您需要提供公司注册证明以及商业营业执照副本。
这些文件证明您的公司是合法注册并且具备营业资格。
2. 厂区布局图:提供您公司的生产厂区布局图,包括工作区域、货物存放区、办公区等。
这有助于评估您的生产场地是否符合GMP要求。
3. 生产设备清单:列出所有用于生产过程的设备和仪器清单。
包括设备型号、规格、数量和供应商信息。
这有助于确认您生产过程的设备是否符合GMP标准。
4. 生产工艺流程:提供您的产品生产工艺流程,包括原材料的采购、接收、生产、包装和质检流程。
这将帮助评估您的生产流程是否规范和符合GMP认证要求。
5. 质量管理文件:提供您的质量管理文件,如质量手册、质量程序和操作规范等。
这些文件描述了您的质量管理体系和质量控制措施。
6. 员工培训记录:提供员工培训记录,包括员工培训计划、培训内容、培训日期和培训结果。
这有助于评估您的员工是否接受了必要的培训。
7. 质量检验报告:提供产品的质量检验报告,包括原材料、中间产品和最终产品的检验结果。
这将提供您的产品质量可追溯性的证明。
8. 不合格品处理记录:提供不合格品处理记录,包括不合格品的处理流程、记录和处置方式。
这有助于评估您对不合格品的处理能力。
请确保提供的文件真实、准确,并按要求提供所需的GMP认证相关资料。
这将有助于您的公司顺利通过GMP认证,并提升产品质量和市场竞争力。
如需进一步了解GMP认证要求或有任何疑问,请随时与我们联系。
祝您成功完成GMP认证!。
GMP认证检查现场必备的文件、记录、档案、图纸等资料

一、文件管理档案⑴现行文件目录;⑵一套完整的存档受控文件并按文件编码分类排列;⑶文件发放记录、关键文件会审记录(如:文件管理程序、变更管理、偏差管理、物料管理、供应商管理、产品召回、退货等涉及部门多和规定范围广的文件);⑷文件变更台帐和变更记录;⑸过时、作废文件回收、销毁记录(过时、作废文件原件加盖过时或作废印章并与现行文件原件分开存放,以便专家追溯)。
二、质量档案:按《质量档案管理程序》执行,包括各品种生产批件三、印刷包材档案⑴印刷包材药监部门批件;⑵供应商印刷前彩稿(或墨稿)的QA签字审核件;⑶ 标准样张:① 包材实样经QA签字的盖章件和分发记录(旧版本留档一份并有回收和销毁记录);② 现行包材实样的分发:QA、QC、采购、库房、车间各一份,作为采购、验收、检验、使用的标准;四、机构职责⑴公司组织机构图、质量管理机构图、各部门/车间的组织机构图;⑵GMP认证领导小组、自检小组、供应商审计评估小组、药品质量风险管理小组、药品召回领导小组、变更控制小组、偏差处理领导小组、验证委员会组成人员名单及公司批准证明文件;⑶各级机构职能、岗位职责;员工花名册,可再细分管理人员列表、质量管理人员列表、⑷技术人员列表;内容包括编号、岗位、姓名、性别、出生年月、学历、毕业院校、专业、从药年限、职称、入司时间、备注;五、人事健康档案⑴ 人事档案:① 个人简历(包括毕业院校、专业和工作经验、从药年限)、毕业证、职称证;② 中层以上干部的任免文件,总经理授权副总主管产品放行人员的授权委托书,取样等指定人员的专项培训记录和授权书;③ 关键岗位外部资格证:化验员、锅炉工、电工、计量员、中药购销(验收)员;④ 主管质量的企业负责人、质量部门负责人、生产部门负责人的备案表等;⑵ 健康档案:①员工健康卡、历年县级以上单位健康体检证明(体检表、健康证等);②体检结果异常处理情况证明、复岗体检合格证明③注意:包括整个生产质量系统(生产、质量、库房、采购、动力、机修、行政后勤),容易漏掉清洁工、临时工、机修、厨师等;生产质量系统每年至少体检一次,其他建议两年一次;六、培训档案⑴公司培训档案:①公司培训规划、每年度培训计划、培训实施情况(培训记录)及培训效果评估表;②每次培训签到表和培训教材(若为书本或文件可不收集) ;③培训空白考卷(考试可为培训一次考一次,也可为培训一阶段考核一次,但文件培训必须在其生效日期前完成)⑵ 个人培训档案① 员工培训卡、考核试卷或其他方式的培训效果评价记录;② 外出培训总结、证明;③ 培训合格上岗证明、不合格调整工作岗位记录;④ 每人一档,企业分层次对全员培训。
GMP认证所需资料

GMP认证所需资料1企业的总体情况企业信息◆企业名称、注册地址;◆企业生产地址、邮政编码;◆联系人、传真、联系电话。
企业的药品生产情况◆简述企业获得药品监督管理部门批准的生产活动,包括进口分包装、出口以及获得国外许可的药品信息;◆营业执照、药品生产许可证,涉及出口的需附上境外机构颁发的相关证明文件的复印件;◆获得批准文号的所有品种;◆生产地址是否有处理高毒性、性激素类药物等高活性、高致敏性物料的操作,如有应当列出,并应在附件中予以标注。
本次药品GMP认证申请的范围◆列出本次申请药品GMP认证的生产线,生产剂型、品种并附相关产品的注册批准文件的复印件;◆最近一次药品监督管理部门对该生产线的检查情况。
如该生产线经过境外的药品GMP检查,需一并提供其检查情况。
上次药品GMP认证以来的主要变更情况◆简述上次认证检查后关键人员、设备设施、品种的变更情况。
2企业的质量管理体系企业质量管理体系的描述◆质量管理体系的相关管理责任,包括高层管理者、质量管理负责人、质量受权人和质量保证部门的职责;◆简要描述质量管理体系的要素,如组织机构、主要程序、过程等。
成品放行程序◆放行程序的总体描述以及负责放行人员的基本情况。
供应商管理及委托生产、委托检验的情况◆概述供应商管理的要求,以及在评估、考核中使用到的质量风险管理方法;◆简述委托生产的情况;◆简述委托检验的情况。
企业的质量风险管理措施◆简述企业的质量风险管理方针;◆质量风险管理活动的范围和重点,以及在质量风险管理体系下进行风险识别、评价、控制、沟通和审核的过程。
年度产品质量回顾分析◆企业进行年度产品质量回顾分析的情况以及考察的重点。
3人员包含质量保证、生产和质量控制的组织机构图,以及质量保证、生产和质量控制部门各自的组织机构图;企业关键人员及从事质量保证、生产、质量控制主要技术人员的资历;质量保证、生产、质量控制、贮存和发运等各部门的员工数。
4厂房、设施和设备厂房◆简要描述建筑物的建成和使用时间、类型、场地的面积;◆厂区总平面布局图、生产区域的平面布局图和流向图,标明比例。
GMP 认证所需资料1

GMP 认证所需资料: 1 .药品GMP 认证申请书(一式四份);2 .《药品生产企业许可证》和《营业执照》复印件;3 .药品生产管理和质量管理自查情况(包括企业概况及历史沿革情况、生产和质量管理情况、前次认证缺陷项目的改正情况); 4 .药品生产企业组织机构图(注明各部门名称、相互关系、部门负责人); 5 .药品生产企业负责人、部门负责人简历;依法经过资格认定的药学及相关专业技术人员、工程技术人员、技术工人登记表,并标明所在部门及岗位;高、中、初级技术人员占全体员工的比例情况表; 6 .药品生产企业生产范围全部剂型和品种表;申请认证范围剂和品种表(注明常年生产品种),包括依据标准、药品批准文号;新药证书及生产批件等有关文件资料的复印件;7 .药品生产企业周围环境图、总平面布置图、仓储平面布置图、质量检验场所平面布置图;8 .药品生产车间概况及工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,并标明人、物流向和空气洁净度等级);空气净化系统的送风、回风、排风平面布置图;工艺设备平面布置图;9 .申请认证型或品种的工艺流程图,并注明主要过程控制点及控制项目;10 .药品生产企业(车间的关键工序、主要设备、制水系统及空气净化系统的验证情况;检验仪器、仪表、衡器校验情况;11 .药品生产企业(车间)生产管理、质量管理文件目录。
编辑本段药品GMP 认证流程1、申报企业到省局受理大厅提交认证申请和申报材料2、省局药品安全监管处对申报材料形式审查(5个工作日)3、认证中心对申报材料进行技术审查(10个工作日)4、认证中心制定现场检查方案(10个工作日)5、省局审批方案(10个工作日)6、认证中心组织实施认证现场检查(10个工作日)7、认证中心对现场检查报告进行初审(10个工作日)8、省局对认证初审意见进行审批(10个工作日)9、报国家局发布审查公告(10个工作日)编辑本段药品GMP认证标准GMP标准(药品生产质量管理规范)是为保证药品在规定的质量下持续生产的体系。
[实用参考]药品GMP认证用的全套文件.doc
![[实用参考]药品GMP认证用的全套文件.doc](https://img.taocdn.com/s3/m/4631c355ba1aa8114531d93b.png)
1目的本厂对自行编制和有关“药品生产质量管理规范”文件实施编号管理规范,以明确文件的识别系统,以便正确编号和使用有明了。
2范围本文件适用于本厂自行编制的“药品生产质量管理规范”文件。
3责任所有承担“药品生产质量管理规范”文件编写的人员都必须按照本文的要求严格执行。
4定义4.1管理标准(制度):是在生产、经营管理过程中,为了行使管理职能,使管理过程标准化、规范化而制订管理制度的书面要求。
4.2操作标准:是以人的工作为对象,对工作范围、职责、权限、工作方法等内容和操作所制订的规定、标准的书面要求。
4.3技术标准:是指生产技术活动中,国家、地方、行业、企业颁布和制订的书面要求。
质量标准:是对产品的技术要求、试验方法、检验规则和标志、包装、运输和贮存的说明。
工艺规程:是对组织某种类产品生产基本条件及要求的描述。
4.4记录:是反映实际生产经营活动中执行标准情况结果的书面说明。
5内容5.1文件编号一般由文件种类代码、部门代码、分类代码、文件顺序号、文件版本顺序号组成。
5.2文件代码的设定5.2.1部门名文字代码英文字母代码办公室技术科质监科生产科设备科销售科固体制剂车间注射剂车间5.2.2文件种类代码管理标准操作标准技术标准记录记录表格标签、卡、凭证类账册5.2.3文件分类代码5.2.3.1管理标准分类、操作标准分类用两个阿拉伯数字组合而成人员01文件02设备03厂房生产物料质量卫生验证销售其它5.2.3.2技术标准分类用两个阿拉伯数字组合而成生产工艺规程质量标准其它标准5.2.3.3质量标准的细分类用一个阿拉伯数字表示成品原辅料包装材料中间产品5.2.3.4工艺规程、其它标准不设细分类,用一个阿拉伯数字0表示5.2.3.5记录表格种类记录表格分为生产记录、质量记录、其它记录。
其类别用两个阿拉伯数字组合而成生产记录细分为生产科仓库注射剂车间固体制剂车间其它质量记录细分为质量检验质量监控台综合质量管理其它记录不细分5.2.4文件顺序号的编排文件的顺序号以文件细分类(无细分类的按分类)类别编排顺序:一般文件顺序号用两位阿拉伯数字组成;记录文件顺序号用三位阿拉伯数字组成。
康之恒GMP认证申报材料GMP认证申报资料目录
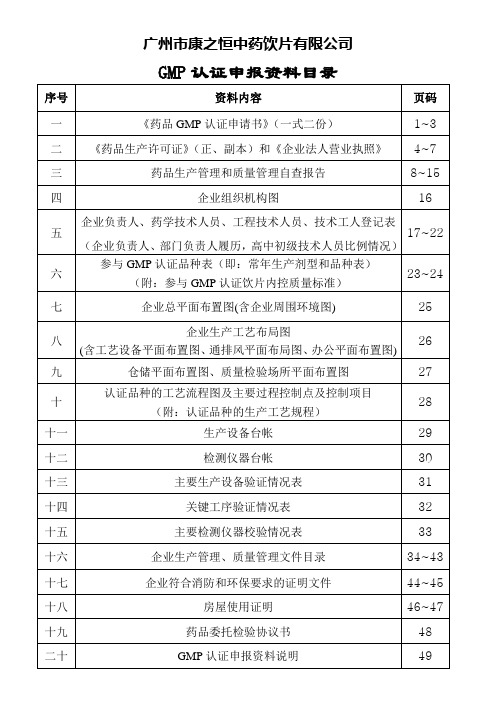
GMP认证申报资料目录
序号
资料内容
页码
一
《药品GMP认证申请书》(一式二份)
1~3
二
《药品生产许可证》(正、副本)和《企业法人营业执照》
4~7
三
药品生产管理和质量管理自查报告
8~15
四
企业组织机构图
16
五
企业负责人、药学技术人员、工程技术人员、技术工人登记表
(企业负责人、部门负责人履历,高中初级技术人员比例情况)
二十
GMP认证申报资料说明
49
17~22
六
参与GMP认证品种表(即:常年生产剂型和品种表)
(附:参与GMP认证饮片内控质量标准)
23~24
七
企业总平面布置图(含企业周围环境图)
25
八
企业生产工艺布局图
(含工艺设备平面布置图、通排风平面布局图、办公平面布置图)
26
九
仓储平面布置图、质量检验场所平面布置图
27十认证品ຫໍສະໝຸດ 的工艺流程图及主要过程控制点及控制项目
(附:认证品种的生产工艺规程)
28
十一
生产设备台帐
29
十二
检测仪器台帐
30
十三
主要生产设备验证情况表
31
十四
关键工序验证情况表
32
十五
主要检测仪器校验情况表
33
十六
企业生产管理、质量管理文件目录
34~43
十七
企业符合消防和环保要求的证明文件
44~45
十八
房屋使用证明
46~47
十九
药品委托检验协议书
48
GMP认证检查现场必备的文件、记录、档案、图纸等资料

一、文件管理档案⑴现行文件目录;⑵一套完整的存档受控文件并按文件编码分类排列;⑶文件发放记录、关键文件会审记录(如:文件管理程序、变更管理、偏差管理、物料管理、供应商管理、产品召回、退货等涉及部门多和规定范围广的文件);⑷文件变更台帐和变更记录;⑸过时、作废文件回收、销毁记录(过时、作废文件原件加盖过时或作废印章并与现行文件原件分开存放,以便专家追溯)。
二、质量档案:按《质量档案管理程序》执行,包括各品种生产批件三、印刷包材档案⑴印刷包材药监部门批件;⑵供应商印刷前彩稿(或墨稿)的QA签字审核件;⑶ 标准样张:① 包材实样经QA签字的盖章件和分发记录(旧版本留档一份并有回收和销毁记录);② 现行包材实样的分发:QA、QC、采购、库房、车间各一份,作为采购、验收、检验、使用的标准;四、机构职责⑴公司组织机构图、质量管理机构图、各部门/车间的组织机构图;⑵GMP认证领导小组、自检小组、供应商审计评估小组、药品质量风险管理小组、药品召回领导小组、变更控制小组、偏差处理领导小组、验证委员会组成人员名单及公司批准证明文件;⑶各级机构职能、岗位职责;员工花名册,可再细分管理人员列表、质量管理人员列表、⑷技术人员列表;内容包括编号、岗位、姓名、性别、出生年月、学历、毕业院校、专业、从药年限、职称、入司时间、备注;五、人事健康档案⑴ 人事档案:① 个人简历(包括毕业院校、专业和工作经验、从药年限)、毕业证、职称证;② 中层以上干部的任免文件,总经理授权副总主管产品放行人员的授权委托书,取样等指定人员的专项培训记录和授权书;③ 关键岗位外部资格证:化验员、锅炉工、电工、计量员、中药购销(验收)员;④ 主管质量的企业负责人、质量部门负责人、生产部门负责人的备案表等;⑵ 健康档案:①员工健康卡、历年县级以上单位健康体检证明(体检表、健康证等);②体检结果异常处理情况证明、复岗体检合格证明③注意:包括整个生产质量系统(生产、质量、库房、采购、动力、机修、行政后勤),容易漏掉清洁工、临时工、机修、厨师等;生产质量系统每年至少体检一次,其他建议两年一次;六、培训档案⑴公司培训档案:①公司培训规划、每年度培训计划、培训实施情况(培训记录)及培训效果评估表;②每次培训签到表和培训教材(若为书本或文件可不收集) ;③培训空白考卷(考试可为培训一次考一次,也可为培训一阶段考核一次,但文件培训必须在其生效日期前完成)⑵ 个人培训档案① 员工培训卡、考核试卷或其他方式的培训效果评价记录;② 外出培训总结、证明;③ 培训合格上岗证明、不合格调整工作岗位记录;④ 每人一档,企业分层次对全员培训。
(精品文档)GMP全套文件

第3页/共16页
******公司GMP全套文件目录
文件名称
009-罗茨真空泵使用、维护标准操作规程 010-循环水冷却塔使用、维护标准操作规程 011-储罐使用、维护标准操作规程 012-台秤使用、维护标准操作规程 013-电子秤使用、维护标准操作规程 014-DXK-5精密微孔过滤机使用、维护标准操作规程 015-螺杆式乙二醇机组使用、维护标准操作规程 016-盐水冷冻机组使用、维护标准操作规程 017-双级反渗透纯化水装置使用、维护标准操作规程 018-天然气锅炉使用、维护标准操作规程 019-精馏塔使用、维护标准操作规程 020-蒸馏釜使用、维护标准操作规程 021-真空包装机使用、维护标准操作规程 022-振荡筛使用、维护标准操作规程 023-纯化水系统使用、维护标准操作规程 024-空气净化系统标准操作规程 025-%%%%标准操作规程 03-管理记录 001-设备开箱验收记录 002-设备台帐 003-设备安装、调试记录 004-主要设备运行记录 005-设备改造、检修、保养记录 006-设备事故报告表 007-压力容器台账 008-设备档案卡 009-设备调拨、报废审批记录 010-设备巡回检查记录 011-设备润滑记录 012-锅炉安全运行记录 013-锅炉给水化验记录 014-冷冻机组运行记录 015-纯化水制备操作记录 016-纯化水系统维护保养记录 017-空气净化系统维护保养、清洗记录 018-设备年度检修计划表 019-仪器仪表使用登记表 020-仪器仪表校验、检定、维修记录卡 021-仪器仪表校验计划表 022-小容量玻璃仪器校验记录 023-计量器具明细目录 024-设备备件台账 025-模具使用台账
SBSMPSMP- SB- 001- 00 √ SMP- SB- 002- 00 √ SMP- SB- 003- 00 √ SMP- SB- 004- 00 √ SMP- SB- 005- 00 √ SMP- SB- 006- 00 √ SMP- SB- 007- 00 √ SMP- SB- 008- 00 √ SMP- SB- 009- 00 √ SMP- SB- 010- 00 √ SMP- SB- 011- 00 √ SMP- SB- 012- 00 √ SMP- SB- 013- 00 √ SMP- SB- 014- 00 √ SMP- SB- 015- 00 √ SMP- SB- 016- 00 √ SMP- SB- 017- 00 √ SMP- SB- 018- 00 √ SMP- SB- 019- 00 √ SMP- SB- 020- 00 √ SMP- SB- 021- 00 √ SMP- SB- 022- 00 √ SOPSOP- SB- 001- 00 SOP- SB- 002- 00 SOP- SB- 003- 00 SOP- SB- 004- 00 SOP- SB- 005- 00 SOP- SB- 006- 00 SOP- SB- 007- 00 SOP- SB- 008- 00
GMP文件总目录

文件编码1技术标准1.1工艺规程1.1.1片剂工艺规程1去痛片工艺规程J-GY-10012土霉素片工艺规程J-GY-10023维生素C 片工艺规程J-GY-10034盐酸小檗碱片工艺规程J-GY-10045异烟肼片工艺规程J-GY-10056吡哌酸片工艺规程J-GY-10067阿普唑仑片工艺规程J-GY-10078阿司匹林片工艺规程J-GY-10089氨茶碱片工艺规程J-GY-100910安乃近片工艺规程J-GY-101011对乙酰氨基酚片工艺规程J-GY-101112复方磺胺甲噁唑片工艺规程J-GY-101213复方乙酰水杨酸片工艺规程J-GY-101314甲硝唑片工艺规程J-GY-101415曲克芦丁片工艺规程J-GY-101516曲克芦丁羟丙茶碱片工艺规程J-GY-101617盐酸吗啉胍片工艺规程J-GY-101718氧氟沙星片工艺规程J-GY-101819乙酰螺旋霉素片工艺规程J-GY-101920醋酸泼尼松片工艺规程J-GY-10201.1.2胶囊剂工艺规程1盐酸雷尼替丁胶囊工艺规程J-GY-20012氯霉素胶囊工艺规程J-GY-20023诺氟沙星胶囊工艺规程J-GY-20034阿莫西林胶囊工艺规程J-GY-20045利福平胶囊工艺规程J-GY-20056氨咖黄敏胶囊工艺规程J-GY-20067氨苄西林胶囊工艺规程J-GY-20078头孢氨苄胶囊工艺规程J-GY-20081.1.3颗粒剂工艺规程1复方氨酚那敏颗粒工艺规程J-GY-30011.1.4注射剂工艺规程J-GY-40011.2原料质量标准1氨基比林质量标准J-YL-00012苯巴比妥质量标准J-YL-00023非那西丁质量标准J-YL-0003广生制药GMP文件总目录文件名称4咖啡因质量标准J-YL-0004 5土霉素质量标准J-YL-0005 6维生素C质量标准J-YL-0006 7盐酸小檗碱质量标准J-YL-0007 8异烟肼质量标准J-YL-0008 9吡哌酸质量标准J-YL-0009 10阿普唑仑质量标准J-YL-0010 11阿司匹林质量标准J-YL-0011 12氨茶碱质量标准J-YL-0012 13安乃近质量标准J-YL-0013 14对乙酰氨基酚质量标准J-YL-0014 15磺胺甲噁唑质量标准J-YL-0015 16甲氧苄啶质量标准J-YL-0016 17乙酰水杨酸质量标准J-YL-0017 18非那西丁质量标准J-YL-0018 19甲硝唑质量标准J-YL-0019 20曲克芦丁质量标准J-YL-0020 21二羟丙茶碱质量标准J-YL-0021 22香豆素质量标准J-YL-0022 23盐酸吗啉胍质量标准J-YL-0023 24氧氟沙星质量标准J-YL-0024 25乙酰螺旋霉素质量标准J-YL-0025 26醋酸泼尼松质量标准J-YL-0026 27人工牛黄质量标准J-YL-0027 28马来酸氯苯那敏质量标准J-YL-0028 29盐酸雷尼替丁质量标准J-YL-0029 30氯霉素质量标准J-YL-0030 31诺氟沙星质量标准J-YL-0031 32阿莫西林质量标准J-YL-0032 33利福平质量标准J-YL-0033 34氨苄西林质量标准J-YL-0034 35头孢氨苄质量标准J-YL-00351.3辅料质量标准1饮用水质量标准J-FL-0001 2纯化水质量标准J-FL-0002 3注射用水质量标准J-FL-0003 4羟丙甲纤维素质量标准J-FL-0004 5聚山梨脂80质量标准J-FL-0005 6淀粉质量标准J-FL-0006 7羧甲淀粉钠质量标准J-FL-0007 8糊精质量标准J-FL-0008 9硬脂酸镁质量标准J-FL-0009 10乙基纤维素质量标准J-FL-0010 11硬脂酸质量标准J-FL-0011 12预胶化淀粉质量标准J-FL-001213枸橼酸质量标准J-FL-0013 14微粉硅胶质量标准J-FL-0014 15乙醇质量标准J-FL-0015 16蔗糖质量标准J-FL-0016 17滑石粉质量标准J-FL-0017 18食用色素质量标准J-FL-0018 19硅油质量标准J-FL-0019 20虫白蜡质量标准J-FL-0020 21明胶质量标准J-FL-0021 22空心胶囊质量标准J-FL-0022 23红氧化铁质量标准J-FL-0023 24活性炭质量标准J-FL-00241.4中间产品质量标准1.4.1片剂中间产品质量标准1去痛片中间产品质量标准J-ZC-1001 2土霉素片中间产品质量标准J-ZC-1002 3维生素C片中间产品质量标准J-ZC-1003 4盐酸小檗碱片中间产品质量标准J-ZC-1004 5异烟肼片中间产品质量标准J-ZC-1005 6吡哌酸片中间产品质量标准J-ZC-1006 7阿普唑仑片中间产品质量标准J-ZC-1007 8阿司匹林片中间产品质量标准J-ZC-1008 9氨茶碱片中间产品质量标准J-ZC-1009 10安乃近片中间产品质量标准J-ZC-1010 11对乙酰氨基酚片中间产品质量标准J-ZC-1011 12复方磺胺甲噁唑片中间产品质量标准J-ZC-1012 13复方乙酰水杨酸片中间产品质量标准J-ZC-1013 14甲硝唑片中间产品质量标准J-ZC-1014 15曲克芦丁片中间产品质量标准J-ZC-1015 16曲克芦丁羟丙茶碱片中间产品质量标准J-ZC-1016 17盐酸吗啉胍片中间产品质量标准J-ZC-1017 18氧氟沙星片中间产品质量标准J-ZC-1018 19乙酰螺旋霉素片中间产品质量标准J-ZC-1019 20醋酸泼尼松片中间产品质量标准J-ZC-10201.4.2胶囊剂中间产品质量标准1盐酸雷尼替丁胶囊中间产品质量标准J-ZC-2001 2氯霉素胶囊中间产品质量标准J-ZC-2002 3诺氟沙星胶囊中间产品质量标准J-ZC-2003 4阿莫西林胶囊中间产品质量标准J-ZC-2004 5利福平胶囊中间产品质量标准J-ZC-2005 6氨咖黄敏胶囊中间产品质量标准J-ZC-2006 7氨苄西林胶囊中间产品质量标准J-ZC-2007 8头孢氨苄胶囊中间产品质量标准J-ZC-20081.4.3颗粒剂中间产品质量标准1复方氨酚那敏颗粒中间产品质量标准J-ZC-30011.4.4注射剂中间产品质量标准J-ZC-40011.5成品质量标准1.5.1片剂成品质量标准1去痛片质量标准J-CP-1001 2土霉素片质量标准J-CP-1002 3维生素C片质量标准J-CP-1003 4盐酸小檗碱片质量标准J-CP-1004 5异烟肼片质量标准J-CP-1005 6吡哌酸片质量标准J-CP-1006 7阿普唑仑片质量标准J-CP-1007 8阿司匹林片质量标准J-CP-1008 9氨茶碱片质量标准J-CP-1009 10安乃近片质量标准J-CP-1010 11对乙酰氨基酚片质量标准J-CP-1011 12复方磺胺甲噁唑片质量标准J-CP-1012 13复方乙酰水杨酸片质量标准J-CP-1013 14甲硝唑片质量标准J-CP-1014 15曲克芦丁片质量标准J-CP-1015 16曲克芦丁羟丙茶碱片质量标准J-CP-1016 17盐酸吗啉胍片质量标准J-CP-1017 18氧氟沙星片质量标准J-CP-1018 19乙酰螺旋霉素片质量标准J-CP-1019 20醋酸泼尼松片质量标准J-CP-10201.5.2胶囊剂成品质量标准1盐酸雷尼替丁胶囊质量标准J-CP-2001 2氯霉素胶囊质量标准J-CP-2002 3诺氟沙星胶囊质量标准J-CP-2003 4阿莫西林胶囊质量标准J-CP-2004 5利福平胶囊质量标准J-CP-2005 6氨咖黄敏胶囊质量标准J-CP-2006 7氨苄西林胶囊质量标准J-CP-2007 8头孢氨苄胶囊质量标准J-CP-20081.5.3颗粒剂成品质量标准1复方氨酚那敏颗粒质量标准J-CP-30011.5.4注射剂成品质量标准J-CP-40011.6包装材料质量标准1标签质量标准J-BC-0001 2说明书质量标准J-BC-0002 3塞纸质量标准J-BC-00034铝箔(PTP)质量标准J-BC-0004 5聚氯乙烯(PVC)硬片质量标准J-BC-0005 6纸盒质量标准J-BC-0006 7封口签质量标准J-BC-0007 8热合收缩膜质量标准J-BC-0008 9药用塑料瓶质量标准J-BC-0009 10纸箱垫片质量标准J-BC-0010 11纸箱质量标准J-BC-0011 12打包带质量标准J-BC-0012 13封口胶带质量标准J-BC-00131.7质量检验1.7.1原料质量检验1氨基比林检验标准操作规程J-ZJ-1001 2苯巴比妥检验标准操作规程J-ZJ-1002 3非那西丁检验标准操作规程J-ZJ-1003 4咖啡因检验标准操作规程J-ZJ-1004 5土霉素检验标准操作规程J-ZJ-1005 6维生素C检验标准操作规程J-ZJ-1006 7盐酸小檗碱检验标准操作规程J-ZJ-1007 8异烟肼检验标准操作规程J-ZJ-1008 9吡哌酸检验标准操作规程J-ZJ-1009 10阿普唑仑检验标准操作规程J-ZJ-1010 11阿司匹林检验标准操作规程J-ZJ-1011 12氨茶碱检验标准操作规程J-ZJ-1012 13安乃近检验标准操作规程J-ZJ-1013 14对乙酰氨基酚检验标准操作规程J-ZJ-1014 15磺胺甲噁唑检验标准操作规程J-ZJ-1015 16甲氧苄啶检验标准操作规程J-ZJ-1016 17乙酰水杨酸检验标准操作规程J-ZJ-1017 18非那西丁检验标准操作规程J-ZJ-1018 19甲硝唑检验标准操作规程J-ZJ-1019 20曲克芦丁检验标准操作规程J-ZJ-1020 21二羟丙茶碱检验标准操作规程J-ZJ-1021 22香豆素检验标准操作规程J-ZJ-1022 23盐酸吗啉胍检验标准操作规程J-ZJ-1023 24氧氟沙星检验标准操作规程J-ZJ-1024 25乙酰螺旋霉素检验标准操作规程J-ZJ-1025 26醋酸泼尼松检验标准操作规程J-ZJ-1026 27人工牛黄检验标准操作规程J-ZJ-1027 28马来酸氯苯那敏检验标准操作规程J-ZJ-1028 29盐酸雷尼替丁检验标准操作规程J-ZJ-1029 30氯霉素检验标准操作规程J-ZJ-1030 31诺氟沙星检验标准操作规程J-ZJ-1031 32阿莫西林检验标准操作规程J-ZJ-103233利福平检验标准操作规程J-ZJ-1033 34氨苄西林检验标准操作规程J-ZJ-1034 35头孢氨苄检验标准操作规程J-ZJ-10351.7.2辅料质量检验1饮用水检验标准操作规程J-ZJ-2001 2纯化水检验标准操作规程J-ZJ-2002 3注射用水检验标准操作规程J-ZJ-2003 4羟丙甲纤维素检验标准操作规程J-ZJ-2004 5淀粉检验标准操作规程J-ZJ-2005 6羧甲淀粉钠检验标准操作规程J-ZJ-2006 7糊精检验标准操作规程J-ZJ-2007 8硬脂酸镁检验标准操作规程J-ZJ-2008 9乙基纤维素检验标准操作规程J-ZJ-2009 10硬脂酸检验标准操作规程J-ZJ-2010 11预胶化淀粉检验标准操作规程J-ZJ-2011 12枸橼酸检验标准操作规程J-ZJ-2012 13微粉硅胶检验标准操作规程J-ZJ-2013 14乙醇检验标准操作规程J-ZJ-2014 15蔗糖检验标准操作规程J-ZJ-2015 16滑石粉检验标准操作规程J-ZJ-2016 17硅油检验标准操作规程J-ZJ-2017 18食用色素检验标准操作规程J-ZJ-2018 19虫白蜡检验标准操作规程J-ZJ-2019 20明胶检验标准操作规程J-ZJ-2020 21空心胶囊检验标准操作规程J-ZJ-2021 22聚山梨脂80检验标准操作规程J-ZJ-2022 23红氧化铁检验标准操作规程J-ZJ-20231.7.3包装材料质量检验1标签检验标准操作规程J-ZJ-3001 2说明书检验标准操作规程J-ZJ-3002 3复合膜检验标准操作规程J-ZJ-3003 4铝箔(PTP)检验标准操作规程J-ZJ-3004 5聚氯乙烯(PVC)硬片检验标准操作规程J-ZJ-3005 6药用塑料瓶检验标准操作规程J-ZJ-3006 7小盒检验标准操作规程J-ZJ-3007 8中盒检验标准操作规程J-ZJ-3008 9防伪签检验标准操作规程J-ZJ-3009 10热收缩膜检验标准操作规程J-ZJ-3010 11纸箱检验标准操作规程J-ZJ-3011 12打包带检验标准操作规程J-ZJ-3012 13封口胶带检验标准操作规程J-ZJ-30131.7.4中间产品质量检验1去痛片中间产品检验标准操作规程J-ZJ-4001 2土霉素片中间产品检验标准操作规程J-ZJ-40023维生素C片中间产品检验标准操作规程J-ZJ-40034盐酸小檗碱片中间产品检验标准操作规程J-ZJ-40045异烟肼片中间产品检验标准操作规程J-ZJ-40056吡哌酸片中间产品检验标准操作规程J-ZJ-40067阿普唑仑片中间产品检验标准操作规程J-ZJ-40078阿司匹林片中间产品检验标准操作规程J-ZJ-40089氨茶碱片中间产品检验标准操作规程J-ZJ-4009 10安乃近片中间产品检验标准操作规程J-ZJ-4010 11对乙酰氨基酚片中间产品检验标准操作规程J-ZJ-4011 12复方磺胺甲噁唑片中间产品检验标准操作规程J-ZJ-4012 13复方乙酰水杨酸片中间产品检验标准操作规程J-ZJ-4013 14甲硝唑片中间产品检验标准操作规程J-ZJ-4014 15曲克芦丁片中间产品检验标准操作规程J-ZJ-4015 16曲克芦丁羟丙茶碱片中间产品检验标准操作规程J-ZJ-4016 17盐酸吗啉胍片中间产品检验标准操作规程J-ZJ-4017 18氧氟沙星片中间产品检验标准操作规程J-ZJ-4018 19乙酰螺旋霉素片中间产品检验标准操作规程J-ZJ-4019 20醋酸泼尼松片中间产品检验标准操作规程J-ZJ-4020 21盐酸雷尼替丁胶囊中间产品检验标准操作规程J-ZJ-4021 22氯霉素胶囊中间产品检验标准操作规程J-ZJ-4022 23诺氟沙星胶囊中间产品检验标准操作规程J-ZJ-4023 24阿莫西林胶囊中间产品检验标准操作规程J-ZJ-4024 25利福平胶囊中间产品检验标准操作规程J-ZJ-4025 26氨咖黄敏胶囊中间产品检验标准操作规程J-ZJ-4026 27氨苄西林胶囊中间产品检验标准操作规程J-ZJ-4027 28头孢氨苄胶囊中间产品检验标准操作规程J-ZJ-4028 29复方氨酚那敏颗粒中间产品检验标准操作规程J-ZJ-40291.7.5成品质量检验1.7.5.1片剂成品质量检验1去痛片检验标准操作规程J-ZJ-50012土霉素片检验标准操作规程J-ZJ-50023维生素C片检验标准操作规程J-ZJ-50034盐酸小檗碱片检验标准操作规程J-ZJ-50045异烟肼片检验标准操作规程J-ZJ-50056吡哌酸片检验标准操作规程J-ZJ-50067阿普唑仑片检验标准操作规程J-ZJ-50078阿司匹林片检验标准操作规程J-ZJ-50089氨茶碱片检验标准操作规程J-ZJ-5009 10安乃近片检验标准操作规程J-ZJ-5010 11对乙酰氨基酚片检验标准操作规程J-ZJ-5011 12复方磺胺甲噁唑片检验标准操作规程J-ZJ-5012 13复方乙酰水杨酸片检验标准操作规程J-ZJ-5013 14甲硝唑片检验标准操作规程J-ZJ-501415曲克芦丁片检验标准操作规程J-ZJ-5015 16曲克芦丁羟丙茶碱片检验标准操作规程J-ZJ-5016 17盐酸吗啉胍片检验标准操作规程J-ZJ-5017 18氧氟沙星片检验标准操作规程J-ZJ-5018 19乙酰螺旋霉素片检验标准操作规程J-ZJ-5019 20醋酸泼尼松片检验标准操作规程J-ZJ-50201.7.4.2胶囊剂成品质量检验1盐酸雷尼替丁胶囊检验标准操作规程J-ZJ-60012氯霉素胶囊检验标准操作规程J-ZJ-60023诺氟沙星胶囊检验标准操作规程J-ZJ-60034阿莫西林胶囊检验标准操作规程J-ZJ-60045利福平胶囊检验标准操作规程J-ZJ-60056氨咖黄敏胶囊检验标准操作规程J-ZJ-60067氨苄西林胶囊检验标准操作规程J-ZJ-60078头孢氨苄胶囊检验标准操作规程J-ZJ-60081.7.4.3颗粒剂成品质量检验1复方氨酚那敏颗粒检验标准操作规程J-ZJ-70011.7.4.4注射剂成品质量检验J-ZJ-80011.8通用检查法1洁净区沉降菌测试标准操作规程J-ZJ-90012洁净区尘粒数测试标准操作规程J-ZJ-90023装量差异检查法J-ZJ-90034含量均匀度检查法J-ZJ-90045黏度检查法J-ZJ-90056红外分光光度法J-ZJ-90067紫外分光光度法J-ZJ-90078高效液相色谱法J-ZJ-90089旋光度测定法J-ZJ-9009 10PH值测定法J-ZJ-9010 11电位滴定法J-ZJ-9011 12乙醇量测定法J-ZJ-9012 13氯化物检查法J-ZJ-9013 14硫酸盐检查法J-ZJ-9014 15铁盐检查法J-ZJ-9015 16重金属检查法J-ZJ-9016 17砷盐检查法J-ZJ-9017 18干燥失重测定法J-ZJ-9018 19炽灼残渣检查法J-ZJ-9019 20易碳化物检查法J-ZJ-9020 21溶液颜色检查法J-ZJ-9021 22澄清度检查法J-ZJ-9022 23粒度测定法J-ZJ-9023 24崩解时限检查法J-ZJ-902425溶出度测定法J-ZJ-9025 26片剂脆碎度检查法J-ZJ-9026 27抗生素微生物检定法J-ZJ-9027 28微生物限度检查法J-ZJ-9028 29薄层色谱法J-ZJ-9029 30熔点测定法J-ZJ-9030 31钠盐鉴别法J-ZJ-9031 32水分测定法J-ZJ-9032 33镁盐检查法J-ZJ-90331.9验证1.9.1工艺验证阿莫西林胶囊工艺验证方案J-YZ-1001头孢氨苄胶囊工艺验证方案J-YZ-10021.9.2设备验证HV-200型V型混合机验证方案J-YZ-2001NJP-400型全自动胶囊填充机验证方案J-YZ-2002DPB-140型多功能自动泡罩机验证方案J-YZ-2003PG-7000A型抛光机(青霉素车间)验证方案J-YZ-2004HV-100型V型混合机验证方案J-YZ-2005NJP-1200型全自动胶囊填充机验证方案J-YZ-2006DPT-140型自动铝塑包装机验证方案J-YZ-2007PG-7000A型抛光机(头孢氨苄车间)验证方案J-YZ-2008 1.9.3清洁验证HV-200型V型混合机清洁验证方案J-YZ-3001NJP-400型全自动胶囊填充机清洁验证方案J-YZ-3002DPB-140型多功能自动泡罩机清洁验证方案J-YZ-3003PG-7000A型抛光机(青霉素车间)清洁验证方案J-YZ-3004HV-100型V型混合机清洁验证方案J-YZ-3005NJP-1200型全自动胶囊填充机清洁验证方案J-YZ-3006DPT-140型自动铝塑包装机清洁验证方案J-YZ-3007PG-7000A型抛光机(头孢氨苄车间)清洁验证方案J-YZ-3008 1.9.4公用系统验证组合式空气处理机组验证方案J-YZ-4001纯化水系统验证方案J-YZ-4002压缩空气系统验证方案J-YZ-4003储水罐、管道清洗及消毒验证方案J-YZ-4004 2管理标准2.1人员管理1组织机构定岗定编管理规程G-RY-0001 2人员考核聘用管理规程G-RY-0002 3人员定期体检管理规程G-RY-0003 4人员培训教育管理规程G-RY-00045人事劳资管理规程G-RY-0005 6档案管理规程G-RY-0006 7员工主动报告管理规程G-RY-0007 2.2厂房设施管理1厂房设计管理规程G-CF-0001 2厂房施工管理规程G-CF-0002 3厂房验收管理规程G-CF-0003 4洁净厂房管理规程G-CF-0004 5厂房保养、维修管理规程G-CF-0005 6洁净厂房灭菌管理规程G-CF-0006 7一般生产区防火安全管理规程G-CF-0007 8洁净区防火安全管理规程G-CF-0008 9行政管理区防火管理规程G-CF-0009 2.3设备管理1设备选型验收管理规程G-SB-0001 2设备安装运行管理规程G-SB-0002 3设备维护保养管理规程G-SB-0003 4设备计划检修管理规程G-SB-0004 5设备封存管理规程G-SB-0005 6设备更新报废管理规程G-SB-0006 7设备调拨管理规程G-SB-0007 8设备事故管理规程G-SB-0008 9五金工具与备品备件管理规程G-SB-0009 10计量器具管理规程G-SB-0010 11设备使用管理规程G-SB-0011 12设备润滑管理规程G-SB-0012 13压力容器管理规程G-SB-0013 14锅炉管理规程G-SB-0014 15动火管理规程G-SB-0015 16照明设施管理规程G-SB-0016 17动力管理规程G-SB-0017 18设备管理规程G-SB-0018 19设备日常巡回检查管理规程G-SB-0019 20设备档案管理规程G-SB-0020 21灭火器材存放及使用管理规程G-SB-0021 22设备编号管理规程G-SB-0022 23设备管道状态标志管理规程G-SB-0023 24电器设备管理规程G-SB-0024 25计量器具周期检定管理规程G-SB-0025 26计量器具抽检管理规程G-SB-0026 27计量器具使用维护保养管理规程G-SB-0027 28计量单位管理规程G-SB-0028 29计量器具分类编码管理规程G-SB-0029 30计量器具分类管理规程G-SB-00302.4物料管理1物料验收管理规程G-WL-0001 2物料分类编码管理规程G-WL-0002 3包装破损物料管理规程G-WL-0003 4物料入库前清洁管理规程G-WL-0004 5物料入库管理规程G-WL-0005 6标签及类标签管理规程G-WL-0006 7仓储物料状态标志管理规程G-WL-0007 8物料贮存管理规程G-WL-0008 9拆零物料管理规程G-WL-0009 10空心胶囊贮存管理规程G-WL-0010 11物料发放管理规程G-WL-0011 12物料超额发放管理规程G-WL-0012 13退料管理规程G-WL-0013 14物料采购管理规程G-WL-0014 15仓库定置管理规程G-WL-0015 16不合格物料贮存管理规程G-WL-0016 17原辅料称量管理规程G-WL-0017 18仓库安全防火管理规程G-WL-0018 19库存物料盘存管理规程G-WL-0019 20仓库取样室管理规程G-WL-0020 21成品出入库管理规程G-WL-0021 22易燃易爆及危险品管理规程G-WL-0022 23仓库啮齿类、昆虫类动物控制管理规程G-WL-0023 24退回产品接收管理规程G-WL-0024 25库区清洁管理规程G-WL-0025 26特殊药品管理规程G-WL-0026 2.5卫生管理1人员健康管理规程G-WS-0001 2卫生管理规程G-WS-0002 3厂区环境卫生管理规程G-WS-0003 4生产区环境卫生管理规程G-WS-0004 5个人卫生管理规程G-WS-0005 6洁净区工艺卫生管理规程G-WS-0006 7一般生产区工艺卫生管理规程G-WS-0007 8工作服管理规程G-WS-0008 9清洁工具管理规程G-WS-0009 10容器清洁管理规程G-WS-0010 11卫生状态标志管理规程G-WS-0011 12特殊清洁管理规程G-WS-0012 13洁净区管理规程G-WS-0013 2.6文件管理1文件编制标准化管理规程G-WJ-0001 2文件起草审核印制保管管理规程G-WJ-00023标准文件颁布与回收管理规程G-WJ-0003 4质量标准编制管理规程G-WJ-0004 5工艺规程编制管理规程G-WJ-0005 6标准操作规程编制管理规程G-WJ-0006 7管理标准编制管理规程G-WJ-0007 8岗位责任制编制管理规程G-WJ-0008 9批记录编制管理规程G-WJ-0009 10状态标志编制管理规程G-WJ-0010 11记录凭证编制管理规程G-WJ-0011 12技术标准编制管理规程G-WJ-0012 2.7生产管理1生产过程管理规程G-SC-0001 2生产、包装指令流转管理规程G-SC-0002 3领料管理规程G-SC-0003 4配料管理规程G-SC-0004 5批号管理规程G-SC-0005 6物料平衡管理规程G-SC-0006 7生产试验管理规程G-SC-0007 8生产过程偏差处理管理规程G-SC-0008 9灭菌管理规程G-SC-0009 10工艺用水管理规程G-SC-0010 11生产车间结料、退料管理规程G-SC-0011 12产品重新加工管理规程G-SC-0012 13包装材料退库或销毁管理规程G-SC-0013 14批记录管理规程G-SC-0014 15工具柜及工具管理规程G-SC-0015 16工序残料管理规程G-SC-0016 17生产交接班管理规程G-SC-0017 18紧急情况处理管理规程G-SC-0018 19现场试验管理规程G-SC-0019 20中间站管理规程G-SC-0020 21模具管理规程G-SC-0021 22清场管理规程G-SC-0022 23物料进出生产区管理规程G-SC-0023 24工艺查证管理规程G-SC-0024 25车间不合格品管理规程G-SC-0025 26车间包材与类标签管理规程G-SC-0026 27清洁剂、消毒剂管理规程G-SC-0027 28区域状态标志管理规程G-SC-0028 29人员进出一般生产区管理规程G-SC-0029 30人员进出洁净区管理规程G-SC-0030 31生产事故管理规程G-SC-0031 32安全生产管理规程G-SC-0032 33生产废弃物管理规程G-SC-0033 34生产统计报表管理规程G-SC-003435生产分析会管理规程G-SC-0035 36包装过程管理规程G-SC-0036 37合箱管理规程G-SC-0037 38周转容器管理规程G-SC-0038 39生产原始记录填写管理规程G-SC-0039 40生产用乙醇管理规程G-SC-0040 41生产过程复核管理规程G-SC-0041 42生产定额管理规程G-SC-0042 43精神药品生产复核管理规程G-SC-0043 2.8质量管理1原辅料取样管理规程G-ZL-0001 2包装材料取样管理规程G-ZL-0002 3中间产品取样管理规程G-ZL-0003 4成品取样管理规程G-ZL-0004 5工艺用水取样管理规程G-ZL-0005 6精神药品取样管理规程G-ZL-0006 7产品质量台帐管理规程G-ZL-0007 8包装材料样板管理规程G-ZL-0008 9原辅料、内包装材料超期复验管理规程G-ZL-0009 10物料检验合格放行管理规程G-ZL-0010 11成品放行管理规程G-ZL-0011 12质量责任制管理规程G-ZL-0012 13质量否决权管理规程G-ZL-0013 14质量事故管理规程G-ZL-0014 15产品质量档案管理规程G-ZL-0015 16质量统计月报管理规程G-ZL-0016 17不合格品管理规程G-ZL-0017 18销毁工作管理规程G-ZL-0018 19精神药品销毁管理规程G-ZL-0019 20质量分析会管理规程G-ZL-0020 21成品有效期管理规程G-ZL-0021 22退货管理规程G-ZL-0022 23检验室管理规程G-ZL-0023 24仪器室管理规程G-ZL-0024 25微生物检查室管理规程G-ZL-0025 26取样室、移动取样车管理规程G-ZL-0026 27质量控制点管理规程G-ZL-0027 28留样观察室管理规程G-ZL-0028 29玻璃仪器与器具管理规程G-ZL-0029 30化验室废弃物管理规程G-ZL-0030 31检验管理规程G-ZL-0031 32留样管理规程G-ZL-0032 33检验原始记录和报告单复核管理规程G-ZL-0033 34检品复检管理规程G-ZL-0034 35检验文件管理规程G-ZL-003536标准品与对照品管理规程G-ZL-0036 37标准溶液(滴定液)管理规程G-ZL-0037 38检定菌管理规程G-ZL-0038 39培养基管理规程G-ZL-0039 40菌检室卫生管理规程G-ZL-0040 41化验试剂配制管理规程G-ZL-0041 42化学试剂使用管理规程G-ZL-0042 43化学试剂贮存发放管理规程G-ZL-0043 44化验室易燃易爆品管理规程G-ZL-0044 45剧毒物品管理规程G-ZL-0045 46检测仪器、设备管理规程G-ZL-0046 47化验室安全管理规程G-ZL-0047 48化验室防火防爆管理规程G-ZL-0048 49取样用具管理规程G-ZL-0049 50稳定性试验管理规程G-ZL-0050 51原辅料、包装材料部分项目免检管理规程G-ZL-0051 52玻璃仪器清洁管理规程G-ZL-0052 53玻璃量器校正管理规程G-ZL-0053 54生产过程监控管理规程G-ZL-0054 55仓库监控管理规程G-ZL-0055 56清场检查管理规程G-ZL-0056 57有效数字修约管理规程G-ZL-0057 58检验记录管理规程G-ZL-0058 59合格证发放粘贴管理规程G-ZL-0059 60物料供应商确认管理规程G-ZL-0060 61验证管理规程G-ZL-0061 62再验证管理规程G-ZL-0062 63验证文件管理规程G-ZL-0063 64《GMP规范》自检管理规程G-ZL-0064 65A类用户投诉处理标准工作程序G-ZL-0065 66B类用户投诉处理标准工作程序G-ZL-0066 67C类用户投诉处理标准工作程序G-ZL-0067 68用户投诉管理规程G-ZL-0068 69药品不良反应监察管理规程G-ZL-0069 70向药监机构报告公司质量情况管理规程G-ZL-0070 2.9销售管理1销售记录管理规程G-XS-0001 2产品销售管理规程G-XS-0002 3用户意见报告管理规程G-XS-0003 4产品召回管理规程G-XS-0004 5经济合同管理规程G-XS-0005 6产品退货管理规程G-XS-0006 7精神药品销售商审核管理规程G-XS-0007 8精神药品销售管理规程G-XS-00083工作标准3.1岗位责任制1总经理岗位责任制Z-GW-0001 2生产副总经理岗位责任制Z-GW-0002 3总工程师岗位责任制Z-GW-0003 4办公室职责Z-GW-0004 5办公室主任岗位责任制Z-GW-0005 6人事劳资管理员岗位责任制Z-GW-0006 7档案管理员岗位责任制Z-GW-0007 8保安负责人岗位责任制Z-GW-0008 9保卫人员岗位责任制Z-GW-0009 10厂区清洁工岗位责任制Z-GW-0010 11炊事员岗位责任制Z-GW-0011 12质量保证部职责Z-GW-0012 13质量保证部部长岗位责任制Z-GW-0013 14生产质量监督员岗位责任制Z-GW-0014 15物料质量监督员岗位责任制Z-GW-0015 16用户投诉管理员岗位责任制Z-GW-0016 17GMP文件管理员岗位责任制Z-GW-0017 18销售质量监督员岗位责任制Z-GW-0018 19中心化验室职责Z-GW-0019 20中心化验室主任岗位责任制Z-GW-0020 21质量检验员岗位责任制Z-GW-0021 22微生物测定员岗位责任制Z-GW-0022 23仪器管理员岗位责任制Z-GW-0023 24留样观察员岗位责任制Z-GW-0024 25标化员岗位责任制Z-GW-0025 26试剂管理员岗位责任制Z-GW-0026 27计划财务部职责Z-GW-0027 28计划财务部部长岗位责任制Z-GW-0028 29主办会计岗位责任制Z-GW-0029 30财务出纳岗位责任制Z-GW-0030 31材料会计岗位责任制Z-GW-0031 32营销副总经理岗位责任制Z-GW-0032 33供应销售部职责Z-GW-0033 34供应销售部部长岗位责任制Z-GW-0034 35销售员岗位责任制Z-GW-0035 36销售内勤员岗位责任制Z-GW-0036 37采购员岗位责任制Z-GW-0037 38库房管理员岗位责任制Z-GW-0038 39设备动力部职责Z-GW-0039 40设备动力部部长岗位责任制Z-GW-0040 41设备管理员岗位责任制Z-GW-0041 42设备维修员岗位责任制Z-GW-0042。
GMP认证文件总目录

GMP认证文件总目录一、引言GMP(Good Manufacturing Practices)是一种国际通用的药品生产质量管理体系,旨在确保药品的安全性、质量和有效性。
本文档是针对GMP认证所需的文件总目录,旨在提供一个清晰的文件分类和组织结构,以便于GMP认证的准备和实施。
二、质量管理体系文件1. 质量手册- 范围:描述质量管理体系的适用范围和目标- 质量政策:明确公司对质量的承诺和目标- 质量目标:具体的质量目标和指标- 质量管理体系的组织结构:包括质量管理职责和责任分工2. 质量手册相关程序文件- 文件控制程序:描述文件控制的流程和要求- 标准操作程序(SOP):具体的工作指导文件,涵盖各个生产环节和质量控制要求- 培训程序:描述员工培训的计划和要求- 内部审核程序:内部审核的计划和执行要求- 不合格品处理程序:不合格品的处理流程和要求- 变更控制程序:变更管理的流程和要求三、质量记录文件1. 记录管理程序- 记录的定义和分类- 记录的保留期限和存档要求- 记录的索引和检索要求2. 生产记录- 原料采购记录:原料的采购订单、检验报告和接收记录- 生产计划和生产指令- 生产过程记录:包括生产操作、设备状态、环境条件等记录 - 检验记录:包括原料、中间品和成品的检验记录- 清洁记录:生产设备和场地的清洁记录3. 质量控制记录- 校准记录:对仪器设备进行校准的记录- 样品检验记录:对产品进行各项质量检验的记录- 环境监测记录:对生产环境进行监测的记录- 不合格品记录:对不合格品进行记录和处理的记录四、质量验证文件1. 验证计划和方案- 验证的目标和范围- 验证的方法和步骤- 验证的计划和时间安排2. 验证报告- 验证结果的总结和评价- 验证过程中的问题和改进措施- 验证结论和建议五、供应商管理文件1. 供应商评估和选择程序- 供应商评估的标准和方法- 供应商选择的流程和要求2. 供应商审查和监督程序- 供应商审查的流程和要求- 供应商监督的方法和要求3. 供应商评估和监督记录- 供应商评估的记录和结果- 供应商监督的记录和结果六、变更管理文件1. 变更管理程序- 变更管理的流程和要求- 变更的分类和评估方法2. 变更申请和评估记录- 变更申请的记录和审批流程- 变更评估的记录和结果七、培训文件1. 培训计划和需求分析- 培训计划的制定和执行要求- 培训需求的分析和评估方法2. 培训记录- 培训课程和内容的记录- 培训参与人员的记录八、风险管理文件1. 风险评估程序和方法- 风险评估的流程和要求- 风险评估的方法和工具2. 风险评估报告和控制措施- 风险评估结果的记录和分析- 风险控制措施的制定和执行要求以上是GMP认证文件总目录的详细内容,包括质量管理体系文件、质量记录文件、质量验证文件、供应商管理文件、变更管理文件、培训文件和风险管理文件等。
GMP认证流程及资料

GMP认证流程及资料GMP(Good Manufacturing Practice)认证是一种全球通用的药品生产质量管理体系认证,其目的是确保药品的质量和安全。
下面将详细介绍GMP认证的流程及所需资料。
1.确定GMP认证的范围和目标:首先,企业需要明确希望获得GMP认证的范围,例如是针对其中一种药品的生产,还是整个生产过程。
同时,企业需要设定自己想要达到的GMP认证标准。
2.建立质量保证体系:企业需要建立一套符合GMP要求的质量保证体系,包括质量方针、质量目标和质量手册等文档。
4.提交申请:企业需要向认证机构提交申请,申请进行GMP认证。
同时,需要向认证机构提供一些基本信息,如企业的名称、地址、法定代表人等。
5.认证机构评估:认证机构将会进行现场评估,此评估过程主要包括文件审核和实地考察企业的生产设施、设备、操作规程等。
评估过程中,认证机构将检查企业是否符合GMP标准的要求。
6.发布评估结果:认证机构将根据评估结果来决定是否颁发GMP认证证书。
如果评估结果符合GMP标准的要求,认证机构将颁发GMP认证证书。
7.跟踪评估:获得GMP认证后,企业还需要接受认证机构的定期跟踪评估,以确保企业持续符合GMP标准的要求。
除了上述流程,GMP认证还需要提交一系列的资料。
以下是一些常见的GMP认证所需资料:1.组织机构和人员资质文件:企业需要提供组织机构的相关文件,如企业章程、注册证明等。
同时,还需要提供员工的相关资质文件,如教育背景、培训记录等。
2.生产设施和设备资料:企业需要提供生产设施和设备的相关文件,如设施和设备规格、设备维护记录等。
3.质量管理文件:企业需要提供质量管理文件,包括质量方针、质量手册、质量目标等。
4.原材料和产品质量控制文件:企业需要提供原材料和产品的质量控制文件,包括原材料的供应商评估报告、产品的检验报告等。
5.生产操作规程和记录:企业需要提供生产操作规程和相关记录,以证明生产过程符合GMP标准的要求。
GMP文件范本

G M P文件范本(共40页) -本页仅作为预览文档封面,使用时请删除本页-药品生产企业 GMP 认证申报材料XXX 公司文件目录第一部分文件(一)管理规程(二)记录表格第二部分机构与人员(一)组织管理(二)记录表格(三)职责药品生产企业 GMP 认证申报材料药品生产企业 GMP 认证申报材料药品生产企业 GMP 认证申报材料第三部分厂房与设施(一)厂房与设施管理(二) 操作程序药品生产企业 GMP 认证申报材料药品生产企业 GMP 认证申报材料(三)记录表格药品生产企业 GMP 认证申报材料药品生产企业 GMP 认证申报材料第四部分设备管理(一)设备管理(二)设备操作药品生产企业 GMP 认证申报材料药品生产企业 GMP 认证申报材料药品生产企业 GMP 认证申报材料(三)记录表格第五部分物料管理 (一)仓库、采购管理(二)记录表格(一)管理规程第六部分卫生(二)操作规程(三)记录表格第七部分验证管理(一)验证管理(二)验证项目秦脉样本秦脉样本秦脉样本第八部分生产管理(一)工艺规程(二)生产管理秦脉样本(三)岗位操作(四)记录表格秦脉样本秦脉样本第九部分质量管理(一)质量管理秦脉样本(二)质量监控(三)检验管理(四)质量标准(五)检验操作秦脉样本秦脉样本秦脉样本秦脉样本(六)质量监测记录秦脉样本(七)质量检验记录秦脉样本(一)管理规程第十部分产品销售与回收(二)记录表格十部分产品销售与回收(一)管理规程(二)记录表格十一部分投诉与不良反应(一)管理规程(二)记录表秦脉样本第十二部分自检(一)管理规程(二)记录表(十一)文件目录 4041。
GMP认证全套文件资料70- 批生产指令
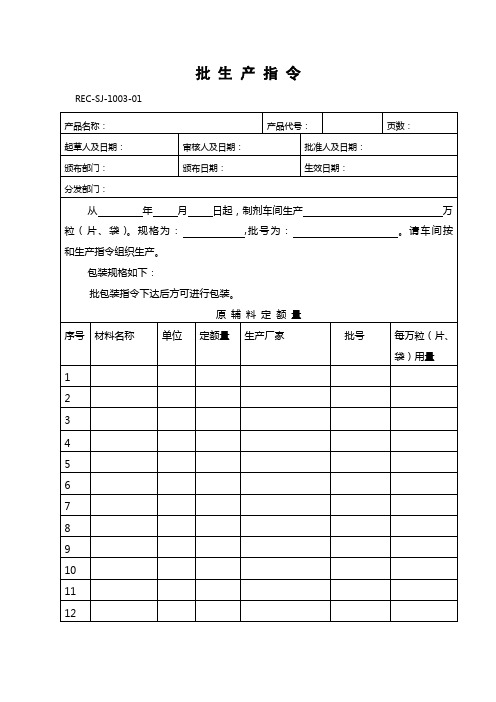
REC-SJ-1003-01
产品名称:
产品代号:
页数:
起草人及日期:
审核人及日期:
批准人及日期:
颁布部门:
颁布日期:
生效日期:
分发部门:
从年月日起,制剂车间生产万粒(片、袋)。规格为:,批号为:。请车间按和生产指令组织生产。
包装规格如下:
批包装指令下达后方可进行包装。
原 辅 料 定 额 量
备
注
序号
材料名称
单位
定额量
生产厂家
批号
每万粒(片、袋)用量
1
2
3
4
5
6
7
89Leabharlann 101112
备注
批包装指令附件:
年 月 日包装材料清单
产品名称
规格
产品代号
批号
批 次 量
颁 发 人
序号
材料代号
单位
定额量
生产厂家
批号
每万粒(片、袋)
用 量
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
STANDARD OPERATING PROCERE
1.目的:阐述参考标准品的管理,滴定液的制备和标定,批示剂的配制。
限度试验标准贮备液的制备。
以及月存目录,标定文件和实验数据的保存规则。
2.范围:应用相应的职称分析人员担任全部工作,并由质管量理部负责人授权负责实施SOP的条款、内容。
3.参考准品/对照品,并以下述各项作为标题。
——其他进口标准品。
——中国药典参考标准品。
——卫生部部颁参考准品。
——滴定液参考标准品(基准试剂)。
——限度度验参考品。
用日记本记录参考标准品有关数据以控制和掌握每一批标准品的使用情况。
随时计算其库存量。
必须考虑每种标准品的有效期。
标准品的容品一经打开即应标签上注明打开的日期。
4.滴定液:
4.1 滴定淮配制:将配制滴定液或标滴定淮的基准试剂放入称量瓶中,并按要求干燥(附件1)至恒重,干燥后的基准试剂应贮存于干燥器中。
按书面规程(附件2)配制滴定液。
在标有“滴定液”的文件来内同时保存滴定液配制规程和标定规程。
4.2 滴定液标定:根据规定的标定规程(附件3.4)标定滴定液至少称3份基准物质,将原始称重数所有相应的称量数据(如有的话)记录标定记录上(附件3),并记录。
STANDARD OPERATING PROCERE
得到的标定浓度和校正因子。
把由此获得的校正因子的平均值校正因子,在标定记录上签名,注上日期。
标定后的滴定液应进行复标,并签名。
滴定液标签内容有:
——名称。
——浓度(mo1/。
L)
——制备日期。
——校正因子。
——标定或重新标定的日期。
按规定的日程期进行重新标定,并填写标定记录,签名并复标会签。
标定的复标明的称量、标定、计算等数据应附在标定记录页的后面。
5.按书面规程(附件6)制备并试验指示液。
在书面规程配制记录中记录试剂名称、厂商、批号、称重、配制体积、配制日期、有效期并签名。
如有要求的话,进行指示液的录敏度试验。
指示液标签上应注明“
——名称。
——浓度(如的必要的话)。
——制备日期。
——的效期。
STANDARD OPERATING PROCERE
标有(指示液)的文件内保存指示剂配制规程。
6.限度试验用标准溶液:按书面规程(附件7)制备限度试验用标准贮备液。
在书面规程配制记录上记录试剂名称、厂商、批号、称重、配制体积、配制日期和有效期,并签名。
每一标准贮备贴签:
——名称、浓度。
——所有参考标准品的厂商及生产批号。
——存贮条件。
——有效期。
——日期和签名。
在标有“限度试验标准溶液”的文件夹内保存限度试验村准贮备液配制规程。
基准试剂干燥温度
SOPAC-708(附件1)
名称分子式干燥温度(℃)
苯甲酸C7H602 在地二氧化二磷干燥
器中室温减压干燥
邻苯二甲酸氢钾KHC
6H
4
COO
2
105
碘酸钾KIO
1
105
重铬酸钾K
2C
12
O
2
120
氧化锌ZnO 约800
氧化钾(分析纯)KCI 150
氧化钠Na
2
CI 110
无水碳酸钠Na
2
CO1 270-300
草酸钠Na
2
CO1 105
三氧化二砷As
2
O3 105
滴定液配制规程举例
滴定液配制规程举例
滴定液及其标化物
复标计划
SOPQC-708 附件5 一月复标二次的滴定液
0.1mo/L.高氯酸
0.1mo/L.硫代硫酸钠
0.1mo/L.硫酸亚铁铵
一月复标一次的滴定液
0.1mo/L.硫酯钠
0.1mo/L.碘液
0.1mo/L.硫代硫酸钠
0.1mo/L.氯氧化钠
0.1mo/L.硫酸
0.1mo/L.硫酯锌
0.1mo/L.EDTA-2Nn
必要时复标滴定液
0.1mo/L.盐酸
0.1mo/L.硝酸钠
0.1mo/L.亚硝酸钠
0.1mo/L.醇制氢氧化钾
0.1mo/L.盐酸
指示剂配制规程举例
6
限度试验标准贮备液配制规程举例。
