2019高考化学总复习 优编增分练:高考必考重要填空逐空特训 题型二填空特训
全国通用版2019高考化学总复习优编增分练:高考必考重要填空逐空特训题型四滴定应用填空特训(精编)

(四) 滴定应用填空特训1.测定某产品中V 2O 5的纯度:称取a g 产品,先用硫酸溶解,得到(VO 2)2SO 4溶液。
再加入b 1 mL c 1 mol·L -1(NH 4)2Fe(SO 4)2溶液(VO +2+2H ++Fe 2+===VO 2++Fe 3++H 2O),最后用c 2 mol·L -1 KMnO 4溶液滴定过量的(NH 4)2Fe(SO 4)2至终点,消耗KMnO 4溶液的体积为b 2 mL 。
已知MnO -4被还原为Mn 2+,假设杂质不参与反应。
则产品中V 2O 5的质量分数是________________(V 2O 5的摩尔质量:182 g·mol -1)。
答案 91(c 1b 1-5c 2b 2)/(1 000a )解析 高锰酸钾氧化亚铁离子变为铁离子,根据反应规律:MnO -4~5Fe 2+,消耗KMnO 4的物质的量b 2×10-3×c 2 mol ,则消耗亚铁离子的物质的量为5b 2×10-3×c 2 mol ,再根据VO +2~Fe 2+关系可知,用来还原VO +2的亚铁离子的量为(b 1×c 1×10-3-5b 2×10-3×c 2) mol ,因此VO +2的量为(b 1×c 1×10-3-5b 2×10-3×c 2) mol ,产品中V 2O 5的量为1/2(b 1×c 1×10-3-5b 2×10-3×c 2) mol ,产品中V 2O 5的质量为1/2(b 1×c 1×10-3-5b 2×10-3×c 2)×182 g=91(c 1b 1-5c 2b 2) ×10-3 g ,则产品中V 2O 5的质量分数是91(c 1b 1-5c 2b 2)/(1 000a )。
全国通用版19高考化学总复习优编增分练:选择题热点题型特训题型二STSE知识辨析型

题型二STSE知识辨析型1.(2018·新余市高三二模)化学与生产、生活密切相关。
下列说法中不正确的是( )A.海水提镁、炼铁、制造玻璃等工业都用到石灰石B.将煤液化、气化,能减少二氧化碳的排放C.雾霾是一种分散系,N95活性炭口罩可用于防霾,其原理是吸附作用D.晶体硅制得的光电池,能直接将光能转化为电能答案 B解析A项,海水提镁是用氢氧化钙沉淀镁离子,要用到石灰石来制取氢氧化钙,工业炼铁需要加入石灰石用来造渣,工业玻璃是用石灰石、纯碱和二氧化硅为原料制取的,正确;B 项,从质量守恒的角度分析,反应前后碳的质量不变,则使用煤的液化、气化技术,不能改变生成二氧化碳的量,错误;C项,活性炭具有吸附作用,可用于吸附雾霾,正确;D项,晶体硅可导电,光电池可将光能转化为电能,正确。
2.(2018·XX省重点高中高三三模)化学与生产生活密切相关。
下列说法正确的是( )A.阻燃剂Al(OH)3受热分解时放出能量B.蚕丝、涤纶、棉花的主要成分均为蛋白质C.油脂在长期贮存过程中与微生物、酶和空气中的氧气作用会发生酸败D.硅太阳能电池与铜锌原电池工作时均由化学能转变为电能答案 C解析阻燃剂Al(OH)3受热分解时吸收能量,使周围环境温度降低,A错误;蚕丝主要成分为蛋白质,棉花的主要成分为纤维素,B错误;油脂中不饱和脂肪酸在酶和空气中的氧气作用下,氧化分解,酸败变质,C正确;硅太阳能电池是将太阳能转化为电能,铜锌原电池工作时,将化学能转变为电能,D错误。
3.(2018·莆田市高三下学期第二次质量测试)化学与社会、科学、技术、环境密切相关。
下列说法不正确的是( )A.T-碳是一种新型三维碳结构晶体,与C60互为同素异形体B.推广利用CO2合成聚碳酸酯可降解塑料符合低碳经济理念C.将金属钛、铝混合后在空气中熔化可制得强度较大的钛合金材料D.为汽车安装尾气催化转化装置,可将尾气中的部分CO和NO转化为无毒气体答案 C解析A项,T-碳是一种新型三维碳结构晶体,与C60是同种元素组成的物理性质不同的单质,互为同素异形体,正确;B项,利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用,减少二氧化碳的排放,正确;C项,在空气中加热熔化,金属易与氧气发生反应,所以不能直接在空气中制备钛铝合金,错误;D项,汽车安装尾气催化转化装置,可将尾气中的部分CO和NO转化为无毒气体氮气和二氧化碳,正确。
全国通用版2019高考化学总复习优编增分练:高考必考重要填空逐空特训题型三电化学填空特训

(三) 电化学填空特训1.含SO 2的烟气可用Na 2SO 3溶液吸收。
可将吸收液送至电解槽再生后循环使用。
再生电解槽如图所示。
a 电极上含硫微粒放电的反应式为_________________________________(任写一个)。
离子交换膜________(填标号)为阴离子交换膜。
答案 HSO -3+H 2O -2e -===SO 2-4+3H +(或SO 2-3+H 2O -2e -===SO 2-4+2H +) c解析 用亚硫酸钠溶液吸收二氧化硫应该得到亚硫酸氢钠溶液,将亚硫酸氢钠溶液(pH =6的吸收液)加入电解槽中。
右侧是电极的阴极,可以认为是水电离的氢离子得电子转化为氢气,剩余的氢氧根离子与亚硫酸氢根离子反应得到亚硫酸根离子。
左侧是电极的阳极,c 为阴离子交换膜,亚硫酸氢根离子透过交换膜进入阳极,在阳极上失电子转化为硫酸根,副产物甲为硫酸。
所以阳极反应为:HSO -3+H 2O -2e -===SO 2-4+3H +或SO 2-3+H 2O -2e -===SO 2-4+2H +(溶液中也有一定量的亚硫酸根)。
2.干燥的甲醇可用于制造燃料电池。
(1)研究人员发现利用NaOH 干燥甲醇时,温度控制不当会有甲酸钠和H 2生成,其反应方程式为________________________________________________________________________ ________________________________________________________________________。
(2)某高校提出用CH 3OH —O 2燃料电池作电源电解处理水泥厂产生的CO 2(以熔融碳酸盐为介质),产物为C 和O 2。
其阳极电极反应式为_________________________________。
答案 (1)CH 3OH +NaOH =====某温度HCOONa +2H 2↑(2)2CO 2-3-4e -===2CO 2+O 23.NO 可用间接电化学法除去,其原理如图所示:(1)阴极的电极反应式为____________________________________________________。
2019届高考化学二轮专题攻略热点题型练: 高考主观题热点题型 高考填空题逐空特训 带答案

高考填空题逐空特训题组一无机物的化学式、电子式、命名及化合价专练1.写出下列含氯化合物的名称及氯元素的化合价:(1)ClO2(2)HClO4(3)KClO3(4)NaClO2(5)NaClO2.关于下列含氮化合物,根据题目要求填空:(1)硝酸酸酐的化学式为,其中氮的化合价为。
(2)N2O4中氮的化合价为,将N2O4通入足量水中产物的化学式分别为、。
(3)NaNO2是一种食品防腐剂,其名称为。
(4)KCN的名称,电子式,碳的化合价。
(5)联氨(N2H4)的电子式,氮的化合价。
3.磷有多种化合物,按要求对下列含磷化合物填空:(1)H3PO4是三元中强酸,磷酸钙是磷矿石的成分之一,其化学式为。
(2)H3PO3是二元弱酸,其化学名称为,Na2HPO3属于(填“正”“酸式”或“碱式”)盐,其中磷的化合价为,Na2HPO3溶于水显(填“中”“酸”或“碱”)性,用离子方程式表示原因:。
(3)H3PO2是一元弱酸,其在水溶液中的电离方程式:;NaH2PO2的化学名称,其水溶液显(填“酸”“碱”或“中”)性。
4.锰有多种化合物,按要求填空:(1)写出下列化合物的化学式。
①高锰酸钾;②锰酸钾;③软锰矿的主要成分。
(2)实验室可用高锰酸钾制取氧气和氯气,分别写出化学方程式: ;。
5.分别写出下列几种物质的电子式:(1)Na2O2;(2)NaH ;(3)NaBH4;(4)NH4H 。
题组二常见方程式书写专练1.钠及其化合物(1)Na、Na2O2分别溶于水的离子方程式:;。
(2)有关Na2CO3①纯碱溶液显碱性原因的离子方程式:;②Na2CO3溶液中逐滴加入稀盐酸过程中的离子方程式:;③将Na2CO3溶液加入足量稀硫酸中的离子方程式:。
(3)电解饱和食盐水制烧碱的化学方程式:。
2.铝及其化合物(1)Al片溶于烧碱溶液的化学方程式:。
(2)明矾具有净水作用的原理的离子方程式:。
(3)泡沫灭火器的原理离子方程式:。
(4)①明矾溶液中加入Ba(OH)2,恰好使硫酸根离子完全沉淀的离子方程式: ,此时溶液的pH (填“>”“<”或“=”)7。
(全国通用版)2019高考化学总复习 优编增分练:选择题热点题型特训 题型八 框图、结构分析判断型

题型八框图、结构分析判断型1.(2018·日照市高三5月校际联考)前20号元素W、X、Y、Z的原子序数依次增大,且分列四个不同周期和四个不同主族。
其中A为Y元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物;常温下乙为液体。
下列说法正确的是( )A.简单离子半径:Z>YB.反应①为吸热反应C.反应②为工业上制备漂白粉的反应原理D.X、Y分别与Z形成的化合物中,化学键类型一定相同答案 C解析根据题给信息分析可知,常温下乙为液体,乙为水,W为氢元素,Y为氯元素,A为氯气;甲为钙,与水反应生成氢氧化钙,X为氧,Z为钙;化合物丁和化合物戊可能为氯化钙或次氯酸钙。
A项,核外电子排布相同的离子,核电荷数越大,离子半径越小,所以Ca2+<Cl-,错误;B项,钙与水剧烈反应,放出大量的热,反应为放热反应,错误;C项,钙与水反应生成氢氧化钙,氢氧化钙与氯气反应生成氯化钙和次氯酸钙,为工业上制备漂白粉的反应原理,正确;D项,过氧化钙中含有离子键和非极性共价键,而氯化钙只有离子键,错误。
2.(2018·聊城市高三三模)短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常作引发剂;e、f为常见气体单质。
下列有关说法正确的是( )A.简单离子的半径:Y>Z>XB.简单氢化物的沸点:Y>XC.最高价氧化物对应水化物的碱性:Z>YD.W、Y的氧化物所含化学键类型相同答案 B解析短周期元素W、X、Y、Z的原子序数依次增加,其中a、b、d、g为化合物,a为淡黄色固体,则a 为过氧化钠;c是Z的单质,在铝热反应中常作引发剂,c为金属镁;e、f为常见气体单质,根据框图,镁与化合物b反应生成气体单质f,则f为氢气;过氧化钠与化合物b反应生成气体单质e,则e为氧气,则b为水,d为氢氧化钠,g为氢氧化镁。
2019高考化学总复习 优编增分练:高考必考重要填空逐空特训 题型五 仪器连接应用填空特训
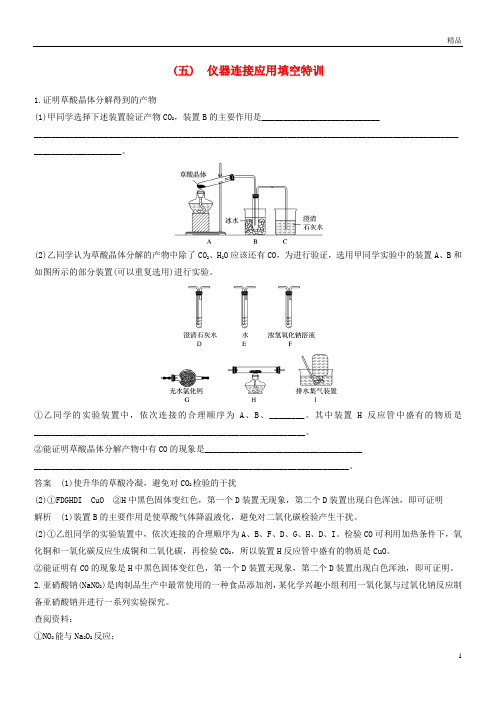
(五) 仪器连接应用填空特训1.证明草酸晶体分解得到的产物(1)甲同学选择下述装置验证产物CO2,装置B的主要作用是____________________________________________________________________________________________________________________________ ____________________。
(2)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
①乙同学的实验装置中,依次连接的合理顺序为A、B、________。
其中装置H反应管中盛有的物质是______________________________________________________________。
②能证明草酸晶体分解产物中有CO的现象是____________________________________________________________________________________________________________。
答案(1)使升华的草酸冷凝,避免对CO2检验的干扰(2)①FDGHDI CuO ②H中黑色固体变红色,第一个D装置无现象,第二个D装置出现白色浑浊,即可证明解析(1)装置B的主要作用是使草酸气体降温液化,避免对二氧化碳检验产生干扰。
(2)①乙组同学的实验装置中,依次连接的合理顺序为A、B、F、D、G、H、D、I。
检验CO可利用加热条件下,氧化铜和一氧化碳反应生成铜和二氧化碳,再检验CO2,所以装置H反应管中盛有的物质是CuO。
②能证明有CO的现象是H中黑色固体变红色,第一个D装置无现象,第二个D装置出现白色浑浊,即可证明。
2.亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂,某化学兴趣小组利用一氧化氮与过氧化钠反应制备亚硝酸钠并进行一系列实验探究。
2019届高考化学二轮专题攻略热点题型练: 高考主观题热点题型 高考填空题逐空特训 带答案

高考填空题逐空特训题组一无机物的化学式、电子式、命名及化合价专练1.写出下列含氯化合物的名称及氯元素的化合价:(1)ClO2(2)HClO4(3)KClO3(4)NaClO2(5)NaClO2.关于下列含氮化合物,根据题目要求填空:(1)硝酸酸酐的化学式为,其中氮的化合价为。
(2)N2O4中氮的化合价为,将N2O4通入足量水中产物的化学式分别为、。
(3)NaNO2是一种食品防腐剂,其名称为。
(4)KCN的名称,电子式,碳的化合价。
(5)联氨(N2H4)的电子式,氮的化合价。
3.磷有多种化合物,按要求对下列含磷化合物填空:(1)H3PO4是三元中强酸,磷酸钙是磷矿石的成分之一,其化学式为。
(2)H3PO3是二元弱酸,其化学名称为,Na2HPO3属于(填“正”“酸式”或“碱式”)盐,其中磷的化合价为,Na2HPO3溶于水显(填“中”“酸”或“碱”)性,用离子方程式表示原因:。
(3)H3PO2是一元弱酸,其在水溶液中的电离方程式:;NaH2PO2的化学名称,其水溶液显(填“酸”“碱”或“中”)性。
4.锰有多种化合物,按要求填空:(1)写出下列化合物的化学式。
①高锰酸钾;②锰酸钾;③软锰矿的主要成分。
(2)实验室可用高锰酸钾制取氧气和氯气,分别写出化学方程式: ;。
5.分别写出下列几种物质的电子式:(1)Na2O2;(2)NaH ;(3)NaBH4;(4)NH4H 。
题组二常见方程式书写专练1.钠及其化合物(1)Na、Na2O2分别溶于水的离子方程式:;。
(2)有关Na2CO3①纯碱溶液显碱性原因的离子方程式:;②Na2CO3溶液中逐滴加入稀盐酸过程中的离子方程式:③将Na2CO3溶液加入足量稀硫酸中的离子方程式:。
(3)电解饱和食盐水制烧碱的化学方程式:。
2.铝及其化合物(1)Al片溶于烧碱溶液的化学方程式:。
(2)明矾具有净水作用的原理的离子方程式:。
(3)泡沫灭火器的原理离子方程式:。
(4)①明矾溶液中加入Ba(OH)2,恰好使硫酸根离子完全沉淀的离子方程式: ,此时溶液的pH (填“>”“<”或“=”)7。
高中化学二轮复习高考重要填空逐空特训四和Ksp应用有关的填空特训
(四)和K sp应用有关的填空特训1某温度下,Ca(0H)2、CaWO勺相关数据见下表将钨酸钠溶液加入石灰乳中,发生反应的离子方程式为wO f (aq) + Ca(OH)2(s) CaWOs) + 2OH(aq)该温度下此反应的平衡常数为__________ 。
答案100解析已知CaWOs) WO T (aq) + CsT(aq),K Sp(CaWO) = c(wOj x c(Ca2+) = 1x 10f4x i x 10f6= i x 10—2+Ca(OH)2(s) 2OH (aq) + Ca (aq),K sp[(Ca(OH) 2)] = C2(OH「) x c(Ca2+) = (1 x 10 —2)2x 1x 10 —4= 1x 10 —8;则WO—(aq) + Ca(OH)2(s) CaWQs) + 2OH (aq)该温度下此反应的平衡常数—8 一10=K sp[(Ca(OH) 2)] - K sp(CaWO) = (1 x 10 j - (1 x 10 一) = 100。
2.已知常温下,H2S的电离常数:K= 1.3 x 10 , K2= 7.1 x 10 ,贝U 0.1 mol •L HS溶液的pH约为__________________ (取近似整数值);向浓度均为0.001 mol •L —1的AgNO和Hg(NO) 2混合溶液中通入H b S气体,开始生成沉淀的c(S2—)为___________ 。
(已知:K sp(Ag 2S) = 6.3 x 10 一50, Kp(HgS) = 1.6 x 10 —52)答案 4 1.6 x 10 —49 mol •L 一1解析已知常温下,HS 的电离常数:K= 1.3 x 10一了,K2= 7.1 x 10 一15,则0.1 mol •L —1 H2S—1— 49— 1mol •L = 1.6 x 10 mol •L 。
3•用惰性电极电解浓度较大的CuCL 溶液,阳极的电极反应式为 ____________________ ,当电解到一定程度,阴极附近出现蓝色 Cu(OH )2絮状物。
高考化学总复习 优编增分练:高考必考重要填空逐空特训 题型二填空特训

(二) 和电离平衡、溶度积有关的填空特训1.已知常温下:K sp [Cu(OH)2]=2.2×10-20,K sp [Fe(OH)3]=4.0×10-38,K sp [Mn(OH)2]=2.1×10-13,某溶液中含c (Cu 2+)=2.2 mol·L -1、c (Fe 3+)=0.008 mol·L -1、c (Mn 2+)=0.01 mol·L -1,逐滴加入稀氨水调节pH 可依次分离,首先沉淀的是________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH 值大于________。
答案 Fe 3+4解析 三种金属阳离子出现沉淀,根据浓度商与K sp 的关系;Cu 2+转化成沉淀,c (OH -)=K sp [Cu (OH )2]c (Cu 2+)=2.2×10-202.2mol·L -1=1×10-10mol·L -1;Fe 3+转化成沉淀,c (OH -)=3K sp [Fe (OH )3]c (Fe 3+)=34.0×10-380.008mol·L -1=35×10-12mol·L -1;Mn 2+转化成沉淀,c (OH -)= 2.1×10-130.01mol·L= 2.1×10-5.5mol·L -1;因此首先沉淀的是Fe 3+,为使Cu 2+沉淀,此时c (OH -)=1×10-10mol·L -1,c (H +)=10-1410-10 mol·L -1=10-4 mol·L -1,即pH =4,当pH>4时,Cu 2+出现沉淀。
2.若K sp (ZnCO 3)=1.5×10-10,溶液中离子浓度≤1.0×10-5 mol·L -1时,认为该离子沉淀完全。
全国通用版2019高考化学总复习优编增分练:高考必考重要填空逐空特训题型六信息型方程式书写特训

(六) 信息型方程式书写特训1.常温下,将NO 和H 2的混合气体通入Ce(SO 4)2与Ce 2(SO 4)3的混合溶液中,其物质转化过程如图所示:(1)反应Ⅰ中氧化剂与还原剂的物质的量之比为___________________________________。
(2)写出该过程的总化学反应方程式:____________________________________________ ________________________________________________________________________。
答案 (1)2∶1(2)2H 2+2NO =====催化剂N 2+2H 2O解析 (1)根据图示,反应Ⅰ为Ce 4++H 2―→Ce 3++H +,反应中Ce 元素的化合价由+4价降至+3价,Ce 4+为氧化剂,H 元素的化合价由0价升至+1价,H 2为还原剂,根据得失电子守恒,n (Ce 4+)=2n (H 2),n (Ce 4+)∶n (H 2)=2∶1,反应Ⅰ中氧化剂与还原剂的物质的量之比为2∶1。
(2)根据图示反应Ⅰ为:2Ce 4++H 2===2Ce 3++2H +,反应Ⅱ为:4Ce 3++2NO +4H +===4Ce 4++N 2+2H 2O ,将反应Ⅰ×2+反应Ⅱ消去Ce 4+、Ce 3+,总反应为2H 2+2NO =====催化剂2H 2O +N 2。
2.已知SOCl 2能与水反应生成SO 2和HCl 。
写出NiCl 2·6H 2O 在亚硫酰氯(SOCl 2)中加热脱水制无水NiCl 2的化学方程式:____________________________________________________。
答案 NiCl 2·6H 2O +6SOCl 2=====△NiCl 2+6SO 2↑+12HCl↑3.辉铜矿石主要含有硫化亚铜(Cu 2S)及少量脉石(SiO 2)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(二) 和电离平衡、溶度积有关的填空特训1.已知常温下:K sp [Cu(OH)2]=2.2×10-20,K sp [Fe(OH)3]=4.0×10-38,K sp [Mn(OH)2]=2.1×10-13,某溶液中含c (Cu 2+)=2.2 mol·L -1、c (Fe 3+)=0.008 mol·L -1、c (Mn 2+)=0.01 mol·L -1,逐滴加入稀氨水调节pH 可依次分离,首先沉淀的是________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH 值大于________。
答案 Fe 3+4解析 三种金属阳离子出现沉淀,根据浓度商与K sp 的关系;Cu 2+转化成沉淀,c (OH -)=K sp [Cu (OH )2]c (Cu 2+)=2.2×10-202.2mol·L -1=1×10-10mol·L -1;Fe 3+转化成沉淀,c (OH -)=3K sp [Fe (OH )3]c (Fe 3+)=34.0×10-380.008mol·L -1=35×10-12mol·L -1;Mn 2+转化成沉淀,c (OH -)= 2.1×10-130.01mol·L= 2.1×10-5.5mol·L -1;因此首先沉淀的是Fe 3+,为使Cu 2+沉淀,此时c (OH -)=1×10-10mol·L -1,c (H +)=10-1410-10 mol·L -1=10-4 mol·L -1,即pH =4,当pH>4时,Cu 2+出现沉淀。
2.若K sp (ZnCO 3)=1.5×10-10,溶液中离子浓度≤1.0×10-5 mol·L -1时,认为该离子沉淀完全。
则欲使1 L c (Zn 2+)=1.5 mol·L -1溶液中Zn 2+沉淀完全,需加入等体积的Na 2CO 3溶液的物质的量浓度至少为________________mol·L -1(写出精确计算结果,溶液混合时体积变化忽略不计)。
答案 (1.5+3×10-5)mol·L -1解析 c (Zn 2+)=1.0×10-5mol·L -1,K sp (ZnCO 3)=c (Zn 2+)·c (CO 2-3)=1.5×10-10,带入数据,可得c (CO 2-3)=1.5×10-5mol·L -1,由于是等体积混合,所以原碳酸钠溶液中,CO 2-3物质的量为3×10-5mol,1 L c (Zn 2+)=1.5 mol·L -1溶液中,使CO 2-3发生沉淀,需要CO 2-3物质的量为1.5 mol ,所以Na 2CO 3溶液的物质的量浓度至少为(3×10-5+1.5)/1 mol·L -1=(1.5+3×10-5)mol·L -1。
3.已知:HCN 的电离常数K a =4.9×10-10,H 2S 的电离常数K a1=1.3×10-7,K a2=7.0×10-15。
向NaCN 溶液中通入少量的H 2S 气体,反应的化学方程式为___________________________ ____________________________________________________________________________________________________________________。
在废水处理领域中常用H 2S 将Mn 2+转化为MnS 除去,向含Mn 2+为0.002 0 mol·L -1的废水中通入一定量的H 2S 气体,调节溶液的pH =a ,当HS -浓度为1.0×10-4mol·L -1时,Mn 2+开始沉淀,则a =________[已知:K sp (MnS)=1.4×10-15]。
答案 NaCN +H 2S===HCN +NaHS 6解析 向NaCN 溶液中通入少量的H 2S 气体,反应的化学方程式为NaCN +H 2S===HCN +NaHS 。
因为MnS===Mn 2++S 2-,K sp (MnS)=1.4×10-15,所以当Mn 2+为0.002 0 mol·L -1开始沉淀时c (S 2-)=7×10-13 mol·L -1,根据K a2=7.0×10-15,HS -浓度为1.0×10-4 mol·L -1时,c (H +)=1.0×10-6 mol·L -1,所以pH =-lg c (H +)=-lg (1.0×10-6)=6。
4.将CuCl 水解再热分解可得到纳米Cu 2O 。
CuCl 水解的反应为CuCl(s)+H 2O(l)CuOH(s)+Cl -(aq)+H +(aq)。
该反应的平衡常数K 与此温度下K w 、K sp (CuOH)、K sp (CuCl)的关系为K =________________________________________________________________________。
答案K w ·K sp (CuCl )K sp (CuOH )解析 CuCl(s)+H 2O(l)CuOH(s)+Cl -(aq)+H +(aq),平衡常数K =c (H +)·c (Cl -)=c (H +)·c (OH -)c (OH -)×c (Cu +)·c (Cl -)c (Cu +)=K w ·K sp (CuCl )K sp (CuOH )。
5.在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr 3+(aq)+3OH -(aq),常温下,Cr(OH)3的溶度积K sp =1.0×10-32,当c (Cr 3+)降至1.0×10-5mol·L -1,认为Cr 3+已经完全沉淀。
现将还原后溶液的pH 值调至4,此时Cr 3+是否沉淀完全(列式计算)?答案 当pH 调到4时,c (OH -)=1.0×10-141.0×10-4 mol·L-1=1.0×10-10 mol·L -1,c (Cr 3+)=1.0×10-32(1.0×10-10)3 mol·L-1=1.0×10-2 mol·L -1>1.0×10-5 mol·L -1,因此Cr 3+没有沉淀完全。
6.若仅从沉淀转化角度考虑,能否利用反应CoCO 3+C 2O 2-4===CoC 2O 4+CO 2-3 将CoCO 3转化为CoC 2O 4?________(填“能”或“不能”),说明理由:____________________________ ________________________________________________________________________。
[已知K sp (CoCO 3)=1.4×10-13,K sp (CoC 2O 4)=6.3×10-8]答案 不能 该反应的平衡常数为K ≈2.22×10-6,转化程度极小解析 从沉淀转化角度考虑,若实现CoCO 3+C 2O 2-4===CoC 2O 4+CO 2-3,该反应的平衡常数为K =c (CO 2-3)c (C 2O 2-4)=K sp (CoCO 3)K sp (CoC 2O 4)=1.4×10-136.3×10-8≈2.22×10-6,转化程度极小,所以不能实现转化。
7.工厂排出的废水中含有的NO -3对人类健康造成危害。
科技人员在碱性条件下用Al 粉将NO -3还原成N 2。
缺点是处理后的水中生成了AlO -2,仍然对人类健康有害。
已知25 ℃,K sp [(Al(OH)3]=1.3×10-33,Al(OH)3H ++H 2O +AlO -2,K =1.0×10-13。
(1)25 ℃时,欲将上述处理过的水中的AlO -2降到1.0×10-6mol·L -1,需调节溶液的pH =________,此时水中c (Al 3+)=________mol·L -1。
(2)25 ℃时,Al(OH)3溶于NaOH 溶液反应的平衡常数K =________。
答案 (1)7 1.3×10-12(2)10解析 (1)25 ℃时,Al(OH)3H ++H 2O +AlO -2,K =1.0×10-13,故c (H +)=1.0×10-131.0×10-6 mol·L-1=1.0×10-7mol·L -1,需调节溶液的pH =7,K sp [(Al(OH)3]=c 3(OH -)·c (Al 3+)= (10-7)3×c (Al 3+)=1.3×10-33,c (Al 3+)=1.3×10-12mol·L -1。
(2)25 ℃时,Al(OH)3溶于NaOH 溶液:Al(OH)3+OH -=== AlO -2+2H 2O ,反应的平衡常数K =c (AlO -2)c (OH -)=1.0×10-610-7=10。
8.可以用K 2CO 3溶液吸收H 2S ,其原理为K 2CO 3+H 2S===KHS +KHCO 3,该反应的平衡常数为________(已知H 2CO 3 的K a1=4.2×10-7,K a2=5.6×10-11;H 2S 的K a1=5.6×10-8,K a2=1.2×10-15)。
答案 1.0×103解析 反应K 2CO 3+H 2S===KHS +KHCO 3的离子方程式为CO 2-3+H 2S===HS -+HCO -3,该反应的平衡常数K =c (HS -)·c (HCO -3)c (CO 2-3)·c (H 2S )=c (HS -)·c (HCO -3)·c (H +)c (CO 2-3)·c (H 2S )·c (H +)=K a1(H 2S )K a2(H 2CO 3)=5.6×10-85.6×10-11=1×103。
