第十六章 糖类化合物
16第十六章 糖 类

CHO OH
CHO
CH2OH
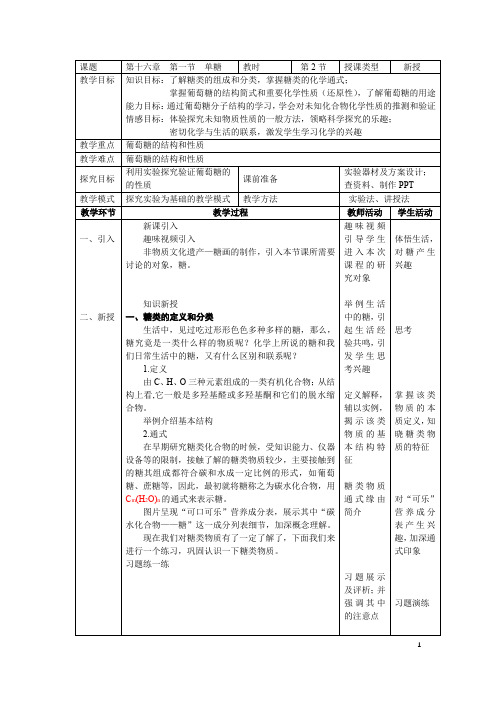
葡萄糖的费歇尔投影式
广东药学院 主讲人: 申东升
单糖命名常用俗名。一对对映体有同一名称;非对映 体有不同名称。 差向异构体:彼此间仅有一个手性碳原子的构型不同,其余
的都相同的非对映异构体。如葡萄糖的C2-位的差向异构体是甘露糖, C3-位的差向异构体是阿洛糖,C4-位的差向异构体是半乳糖。
用虚线将C1与-OH相连或将C1上的H和 -OH并列写出,表示两种端基异构体 的混合物。
广东药学院
主讲人: 申东升
由哈沃斯式判断吡喃糖的构型: 己醛糖:C5-OH已参与成环,以C5-羟甲基的位置来判断: 处环平面上的为D-系,处环平面下的为L-系。且D系中C1位 羟基与C5羟甲基处环平面同侧的称为β-体;异侧的称为α体。
单糖中最重要、分布最广的是己醛糖中的葡萄糖和 己酮糖中的果糖。
广东药学院 主讲人: 申东升
15.1.1
糖的开链结构及构型
己醛糖
O CH2-CH-CH-CH-CH-C OH OH OH OH OH
葡萄糖: C6H12O6 其构造式是:
H
1 CHO
H 2C OH HO 3C H HO H 4C OH OH H 5C OH OH 6 CH2OH CH2OH
糖苷: 半缩醛羟基(比其它羟基活泼)上的氢原子被其它基 团取代后的产物。也有α-和β-两种构型。 苷的非糖部分(聚糖中均为糖)叫苷元,也叫配基。 糖苷的命名: 通常称为某配基某糖苷,同时还必须指出它们 的构型和旋光方向。
广东药学院 主讲人: 申东升
CHO
CH2OH HO HO
H
OH OH
OH H OH OH CH2OH
H2 O
+ H
有机化学《单糖》教案
基于选项C提示注意点:注意:1、有些糖不符合通式,如:鼠李糖(C6H12O5);2、有些符合通式的却不属于糖类,例如:甲醛(CH2O)、乙酸(C2H4O2)基于选项D,那该类物质如何分类呢?3.分类下面我们进入本次课的重点,认识并学习一下最简单的糖。
二、单糖(一)重要的单糖自然界分布最广的单糖:葡萄糖和果糖,存在来源简介;●物理性质(样品呈现,认识葡萄糖)观察样品,归纳葡萄糖物理性质,呈现糖类相对甜度表,了解单糖的甜度。
●分子结构分子式:C6H12O6结构简式:(葡萄糖结构简式略)乙醛糖(果糖结构简式略)己酮糖两种单糖,葡萄糖的性质更为丰富和重要,因此本节单糖我们以葡萄糖的学习为主,那葡萄糖的结构中都有哪些基团呢?可能的性质有哪些呢?(二)葡萄糖的化学性质1.氧化反应有机物多数可以燃烧,葡萄糖也是可以的,完全燃烧可转化为CO2和H2O,化学方程式展示。
C6H12O6 + 6O2→6CO2 + 6H2O葡萄糖注意:书写化学方程式时,若以分子式表示糖类物质,需在糖分子下标注糖的名称,以免混淆。
生命体内,1mol葡萄糖约可以释放出2804kJ的能量2.与碱性弱氧化剂的反应(1)与银氨溶液反应呈现实验步骤,提问过程中银氨溶液配制时的现象变化。
观察实验现象,记录反应方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH→CH2OH(CHOH)4COONH4+2Ag↓+3NH3 +H2O(2)与新制Cu(OH)2反应呈现实验步骤,观察实验现象CH2OH(CHOH)4CHO+2Cu(OH)2+ NaOH→CH2OH(CHOH)4COONa + Cu2O↓ + 3H2O还原糖定义:可以被碱性弱氧化剂氧化的糖。
注意:果糖虽然是酮糖,但也可以被碱性弱氧化剂氧化,也是还原糖。
上述均是发生的氧化反应,那和氧化相对应的是什么反应呢?葡萄糖可以被还原吗?3.加成反应葡萄糖分子在一定条件下,可以被还原为己六醇。
那么果糖可以被还原吗?习题练一练练习2对应的是醛基的性质,练习3对应的是羟基和羧基的性质,因为葡萄糖结构中存在羟基,同样可以发生酯化反应。
第一章 糖类化合物

第一节 概述
一、糖类化合物的概念:
1、糖类化合物的元素组成:C 、H 、O。
分子通式表示为:Cn(H2O)n
不符合通式的糖类,如: 鼠李糖:C6H12O5 脱氧核糖:C5H10O4
符合通式的非糖化合物,如:
甲醛 HCHO 乙酸 C2H4O2 乳酸 C3H6O3
2、糖类的化学本质:(糖类化合物的概念)
(1)作为生物能源 (2)作为其它物质生物合成的碳源 (3)作为生物体的结构物质 (4)作为细胞识别的信息分子
二、糖的种类(根据聚合度分)
1、单糖:不能再水解。 2、寡糖:聚合度2~20 3、多糖:聚合度≧20 (1)均质多糖(同多糖):如淀粉 纤维素 糖原 (2)非均质多糖(杂多糖):完全水解产物都有两种以上 的单糖或单糖衍生物及某些非糖物质参加组成的生物大分 子。如:透明质酸 果胶物质 半纤维素等 4 * 、复合糖:糖与非糖物质的结合物。
α-萘酚
用于鉴定 糖类物质 的存在 (果糖) 酮糖灵敏
戊糖
鉴别 鉴别 戊糖 戊糖
不同糖, 颜色不 同
蒽酮
用于总糖 量测定
6、碱性条件下的异构化反应 7、发酵作用
CHO HCOH HOCH CH2OH C=O HOCH CHO HOCH HOCH HCOH HCOH CH2OH
成环 转折 旋转 -D-吡喃葡萄糖
成环
-D-吡喃葡萄糖
6 5 4 3
O
2
CH2OH
O
1
1、写吡喃环, 顺时针编号。 H C HCOH HOCH HCOH HC CH2OH O OH
2、确定D- 型 3、确定“异头物” 4、确定其它羟 基的位置 CH2OH O OH HO CH2OH
糖类药物

硫酸软骨素(CS)-生产工艺 稀碱-酶解法
工艺过程 ①提取; ②酶解,控制温度在53-54℃ ,既是酶反应的需要,而且能阻 止微生物的生长。应注意避免局部过热影响酶活力; ③吸附,活性白土能除去剩余的蛋白质和多肽,活性炭则可脱 色、去热原; ④沉淀、干燥 .
硫酸软骨素(CS)-作用与用途
新的用途,重新引起国内外学者的浓厚兴趣和广泛深
入的研究。
FDP既有冻干粉剂,供静脉注射,国外还开发了片剂、
胶囊、冲剂等口服剂型。也可用于制备营养口服液、
牙膏和护肤护发化妆品等。
肝素-结构与性质
肝素是天然抗凝剂,是一种含有硫酸基的酸性粘多糖, 由六糖或八糖重复单位组成链状结构,三硫酸双糖与 二硫酸双糖以2:1比例在分子中交替联结。整个分子
糖类药物的生理功能
(一)低聚糖的生理功能
1.低热值、防肥胖;
2.抑制腐败菌生长繁殖; 3.增殖作用; 4.抗龋齿、抗肿瘤。
糖类药物的生理功能
(二)多糖类的生理功能
1.调节免疫功能和抗肿瘤作用; 2.抗感染作用; 3.促进细胞DNA、蛋白质的合成; 4.抗幅射损伤作用;
低分子肝素的制备:包括亚硝酸降解、肝素酶降解、
过氧化物降解和有机溶剂分级沉淀、凝胶层析分离、 亲和层析分离、超滤等。
低分子肝素—工艺路线
肝素钠
降解 (NaNO2)
降解液
沉淀 乙醇
还原 (NaBH4)
反应液
沉淀)
小分子肝素粗品
沉淀 乙醇
小分子肝素精品
低分子肝素(LMWH)
与普通肝素相比,LMWH具有抗血栓作用强,抗凝活 性低、体内半衰期长、皮下注射生物利用度高、副作 用小以及使用安全等优点。主要用于预防、治疗冠状 血管成形术时血管再狭窄,心肌梗死的形成、并降低 死亡率、抑制动脉硬化。 肝素能激活抗凝血酶Ⅲ ,实现抗凝; LMWH则分子 量小,不足以抗凝血酶Ⅲ结合,但对Xa因子抑制作 用强,抗血栓作用好。 应用LMWH不容易发生血小 板减少和出血。
第十六章 糖类

能被银氨溶液等碱性弱氧化剂氧化的糖
二、单糖
(二)葡萄糖的化学性质
3.加成反应 葡萄糖分子中含有醛基,故在一定条件下,可
以被H2还原,生成己六醇
CH2OH(CHOH)4CHO + H2
一定条件
CH2OH(CHOH)4 CH2OH
练一练
2、下列物质中,既能发生氧化反应,又能发生还原
反应的是( AB )
5%CuSO4溶液4~5滴;向该试管中加入几滴10%葡 萄糖溶液,并在酒精灯上加热
实验现象:
产生砖红色的氧化亚铜沉淀
CH2OH(CHOH)4CHO+2Cu(OH)2+ NaOH CH2OH(CHOH)4COONa + Cu2O↓ + 3H2O
二、单糖
• 注意
果糖
果糖虽然是酮糖,但在碱性介质中,可以 部分发生异构化形成醛基,从而也可以被弱碱 性氧化剂所氧化
二、单糖
• 物理性质 纯净的葡萄糖是白色晶体,易溶于水,
微溶于醇,不溶于醚、氯仿和苯等有机溶剂。 纯净的果糖是无色晶体,易溶于水。
糖的相对甜度
蔗糖
100
果糖
175
葡萄糖
74
麦芽糖
32
葡萄糖和果糖均有甜 味,葡萄糖的甜味低于蔗 糖,而果糖为自然界中最 甜的糖
二、单糖
• 分子结构 分子式:C6H12O6 结构简式:
第十六章 糖类
第一节 单糖
一、糖类的定义、通式和分类
1、定义:
由C、H、O三种元素组成的一类有机化合物; 从结构上看,它一般是多羟基醛或多羟基酮和它们的 脱水缩合物。
醛 酮
羟基
一、糖的定义、通式和分类 2、糖的通式:
糖类

单糖的构型及开链结构
以葡萄糖为例: (C6H12O6)
CHO
H OH HO H
H OH H OH
CH2OH
单糖的构型仍沿用D/L 构型标记法,这种方法只考 虑与羰基相距最远的一个手 性碳原子的构型。
根据与羰基相距最远的 那个手性碳原子上的羟基在
2,3,4,5,6-五羟基己醛 右边的为D-构型;羟基在左
CH2OH
HH
O
OH H
H O
CH2OH
O
H OH H
苷羟基 CH-OH
HO H
H OH
H OH
纤维二糖
HO HO
OH O
OH
O HO
OH O OH OH
(+)-纤维二糖
以-1,4-糖苷键组成的双糖,全名 为4-O-(-吡喃葡萄糖基)-D-吡喃葡萄 糖。
成苷反应只能发生在糖的半缩醛 (酮)羟基,所以半缩醛(酮)羟基也 称苷羟基。
糖苷中无半缩醛(酮)羟基,在溶 液中不能转变为开链结构,即不可能有 醛(酮)基,所以糖苷无还原性,也不 能通过开链发生、两种结构的互变, 即没有变旋光现象。
2、单糖在弱碱溶液中的互变异构反 应——差向异构化
在弱碱作用下,D-葡萄糖、D-果糖、 D-甘露糖三者可通过烯醇式相互转化。
核苷酸(成苷、成酯后)为核酸的单体。
N
OOO
NOH
HO-P~HO-P~HO-PH-O CH2 O
OH OH OH H H
H
H
OH OH
NH2 N
N
第二节
双糖和多糖
disaccharide and polysaccharide
双糖(disaccharide)
糖类化合物ppt(完整版)

较快
酮糖 Br2,H2O X
CH2OH HO
HOH H O OH
H OH
葡萄糖酸--内酯
CH2OH
HO H O OH H O
H H OH
较稳定
酮糖不发生此反应,因此可作为区分两类糖的鉴别反应。
与HNO3的反应
CHO
COOH
稀 HNO3 100℃
氧化酶
CHO
COOH
O HOH
CH2OH
D-葡萄糖
COOH
果糖脎
葡萄糖脎
麦芽糖脎
乳糖脎
用作糖的定性鉴定
(四) 成苷反应 (缩醛)
OH 半缩醛羟基(苷羟基) O
HOH + CH3OH 干HCl
1分子?
OH OOCH3
+
OH O 氧苷键
糖苷
OCH3
β-D-吡喃
α-D-吡喃
葡萄糖甲苷
葡萄糖甲苷
CH2OH
OO
OH
OH
HO
OH
熊果苷(在梨树叶中)
水解 酸或酶
CH2OH O
对映体
CHO
HO H H OH
HO H HO H
CH2OH
L-葡萄糖
要求掌握的几种单糖:
CHO
CHO
CHO
HCOH
HOCH
HCOH
HOCH
HOCH
HOCH
HCOH
D-葡萄糖
HCOH
CH2OH
HCOH
D-甘露糖
HCOH
CH2OH
HOCH HCOH CH2OH
D-半乳糖
D-核糖 戊醛糖
己醛糖
CHO CH2 HCOH HCOH CH2OH
实验一糖类的颜色反应

实验⼀糖类的颜⾊反应第⼗六章实验技术实验⼀糖类的颜⾊反应⼀、实验⽬的1.了解糖类某些颜⾊反应的原理。
2.学习应⽤糖的颜⾊反应鉴别糖类的⽅法。
⼆、实验原理1.α-萘酚反应(Molisch反应)原理糖在浓⽆机酸(硫酸、盐酸)作⽤下,脱⽔⽣成糠醛及糠醛衍⽣物,后者能与α-萘酚⽣成紫红⾊物质。
因为糠醛及糠醛衍⽣物对此反应均呈阳性,故此反应不是糖类的特异反应。
2.间苯⼆酚反应(Seliwanoff反应)原理在酸作⽤下,酮糖脱⽔⽣成羟甲基糠醛,后者再与间苯⼆酚作⽤⽣成红⾊物质。
此反应是酮糖的特异反应。
醛糖在同样条件下呈⾊反应缓慢,只有在糖浓度较⾼或煮沸时间较长时,才呈微弱的阳性反应。
在实验条件下蔗糖有可能⽔解⽽呈阳性反应。
三、器材1.试管及试管架2.滴管3.⽔浴锅四、试剂1.莫⽒(Molisch)试剂:5% α-萘酚的酒精溶液,称取α-萘酚5g,溶于95%酒精中,并⽤此酒精使总体积达100mL,贮于棕⾊瓶内。
此试剂需新鲜配制。
2.塞⽒(Seliwanoff)试剂:称取间苯⼆酚0.05g溶于30 mL浓盐酸中,再⽤蒸馏⽔稀释⾄100 mL,此试剂需新鲜配制。
3.1%葡萄糖溶液:称取葡萄糖1g,溶于100mL蒸馏⽔中。
4.1%果糖溶液:称取果糖1g,溶于100mL蒸馏⽔中。
5.1%蔗糖溶液:称取蔗糖1g,溶于100mL蒸馏⽔中。
6.1%淀粉溶液:称取可溶性淀粉1g与少量冷蒸馏⽔混合成薄浆状物,然后缓缓倾⼊沸蒸馏⽔中,边加边搅,最后以沸蒸馏⽔稀释⾄100mL。
7.0.1%糠醛溶液:称取糠醛0.1g,溶于100mL蒸馏⽔中。
8.浓硫酸500mL五、操作1.α-萘酚反应(Molisch反应)取5⽀试管,分别加⼊1%葡萄糖溶液、1%果糖溶液、1%蔗糖溶液、1%淀粉溶液、0.1%糠醛溶液各1.5mL。
再向5⽀试管中各加⼊2滴莫⽒试剂,充分混合。
斜执试管,沿管壁慢慢加⼊浓硫酸约1mL,慢慢⽴起试管,切勿摇动。
浓硫酸在试液下形成两层。
生物化学糖类

1893年,Fischer. E提出了葡萄糖分子环状结构学说 。葡萄糖分子中的羟基能与醛基可逆缩合成环状的 半缩醛。
环化后,羰基碳上形成的差向异构体称为异头物。半 缩醛碳原子也称为异头碳原子或者异头中心。
异头碳的羟基与最末的手性碳原子的羟基具有相同取 向的称为α异头物,具有相反取向的称为β异头物。
半缩醛部分是葡萄糖,称葡糖苷。半缩醛部分是果 糖,称果糖苷。 也可根据糖苷键的类型来命名,如O-苷、N-苷、S苷或C-苷。
由于单糖有α-和β-两种型式,生成的糖苷也有α和β-型之分。天然存在的糖苷多为β-型。
糖苷与糖的性质很不相同:
•
糖是半缩醛,容易变成游离醛,从而给出醛的各种 反应。
糖苷属于缩醛,一般不显示醛的性质,例如无变旋 现象,不能还原Fehling试剂等。 糖苷对碱溶液稳定,但易被酸水解成原来的糖和配 基。
变旋现象:一种新配制的溶液旋光度改变的现象。 其本质是由于分子立体结构发生了变化。 单糖溶液产生变旋现象的原因:单糖溶于水后,即 产生环式与链式异构体间的互变,所以新配成的单 糖溶液在放置的过程中其旋光度会逐渐改变,但经 过一定时间,几种异构体达成平衡后,旋光度就不 再变化。
(2) 甜度
各种糖的甜度不一,常以蔗糖甜度为标准进行比较 。设蔗糖甜度为 100 ,则果糖、葡萄糖、麦芽糖、 半乳糖和乳糖甜度分别为175,70,35,30和16。
氧化成糖醛酸
有些醛糖如葡萄糖、半乳糖等在生物体内特定脱氢 酶的作用下可以只氧化伯醇基而保留醛基,生成糖 醛酸。
氧化成醛糖二酸
在较强的氧化剂如稀硝酸的作用下,醛糖醛基和伯 醇基均被氧化成羧基,形成的二羧酸称为醛糖二酸
(3) 单糖的还原
有机化学(2)教学大纲

《有机化学(二)》课程简介/教学大纲课程编号:040061中文名称:《有机化学》(二)英文名称:Organic chemistry授课专业:化工、轻工及临床医学各专业总学时:99 理论课 57学时实验课 42 学时学分: 5.5 上机课时:预修课程:无机化学课程内容:有机化学是研究有机物的组成、结构、性质、合成、应用,以及有关问题的学科。
工科类有机化学(包含有机化学实验)是化工、轻工类各专业必修的一门专业基础课。
通过本课程的学习,使学生对有机化学内容有比较系统和比较全面的了解,为后继课程的学习和进一步掌握新的科学技术成就打下必要的基础。
有机化学理论教学内容包括:1.有机化合物的分类和命名。
2.各类有机化合物的主要合成方法。
3.各类有机物的主要性质和用途。
4.有机化合物的结构与性能之间的关系及其初步理论基础,有机化学基本反应类型和重要的反应历程。
5.各种功能团的特性和一定条件下相互转变的规律。
———————————————————————————————————————————————《有机化学》(二)课程教学大纲授课专业:化工、轻工及临床医学各专业总学时数:99 理论课 57 学时,实验课 42 学时总学分:5.5一、课程的性质和目的有机化学是化工、轻工类及临床医学各专业一门必修的化学基础课程。
本课程研究有机化合物的组成、结构、性质、合成以及与此相关的理论问题。
本课程的教学目的是使学生在学习无机化学的基础上,比较系统地获得有机化学的基本理论、基本知识、基本实验技能及学习有机化学的基本思想和方法,为进一步学好后续专业课程打下坚实基础,也使学生能根据今后工作的需要,进一步学习和钻研与本专业发展密切相关的有机化学方面知识。
二、理论课教学内容及学时安排第一章有机化合物的结构和性质(2学时)要求深刻理解和熟练掌握的重点内容有:有机化合物的结构特征;有机化合物中的共价键;有机化合物的酸碱概念。
要求一般理解和掌握的内容有:有机化合物的分类;有机化合物在国民经济中的地位和作用。
糖类化合物

第十六章 糖类化合物1.写出D-(+)-甘露糖与下列物质的反应、产物及其名称:(1)羟胺 (2)苯肼 (3)溴水 (4)HNO 3 (5)HIO 4 (6)乙酐(7)苯甲酰氯、吡啶 (8)CH 3OH 、HCl (9)CH 3OH 、HCl ,然后(CH 3)2SO 4、NaOH (10)上述反应后再用稀HCl 处理 (11)(10)反应后再强氧化 解:α- β-+NH 2OH(1)D-(+)-甘露糖肟(2)+PhNH 2D-(+)-甘露糖脎(3)+Br 2/H 2OD-(+)-甘露糖酸(4)+HNO3D-(+)-甘露糖二酸2OH CHO 2OH CH NOH 2OHCHO2OH COOH2OH CHO2OH NPh 2OHCHOCOOH2OHCHO(6)(7)(8)(9)(5)+HIO 45HCOOH HCHO +2OH CHO2OCH3PhCOCl C 5H 5NCH 3OH HCl3OCH3CH 3OH/HCl (CH 3)2SO 4/NaOH (1)(2)(10)(11)33HCl3OHOH CH 2OCH 3OH OCH 3CH 3OCH 3O CHOCOOHOCH 3CH 3OCH 3O COOH2.D-(+)-半乳糖怎样转化成下列化合物的?写出其反应式。
(1) 甲基β–D-半乳糖苷(2) 甲基β–2,3,4,6-四-O-甲基-D-半乳糖苷 (3) 2,3,4,6-四-O-甲基-D-半乳糖(4) D-酒石酸 解:CH 2OHCHO(2)(1)CH 3OH HClCH 2OHCHO3(4)(3)3(CH 3)2SO 4/NaOH(2)33333溴水2O 2Fe 3+CH 2OHCOOH2OHOCOOH 2OHCHO溴水2OHCOOH22Fe 3+2OHOCOOH2OHCHO3COOH3.有一戊糖C 5H 10O 4与羟胺反应生成肟,与硼氢化钠反应生成C 5H 12O 4。
后者有光学活性,与乙酐反应得四乙酸酯。
糖类化合物的分类与性质

糖类化合物的分类与性质糖类化合物是一类在生命活动中起着重要作用的有机化合物,广泛存在于自然界中,与我们的日常生活息息相关。
从我们日常饮食中的主食,如米饭、面包中的淀粉,到水果中的果糖,再到人体细胞中的葡萄糖,糖类化合物无处不在。
糖类化合物可以根据其结构和性质的不同进行分类。
首先,单糖是不能再水解为更小分子的糖类,如葡萄糖、果糖和半乳糖。
葡萄糖是细胞能量代谢的重要物质,在血液中循环,为身体各个组织和器官提供能量。
果糖常见于水果中,甜度较高。
半乳糖通常与葡萄糖结合形成乳糖,存在于乳制品中。
二糖是由两个单糖分子通过糖苷键连接而成的糖类。
常见的二糖有蔗糖、麦芽糖和乳糖。
蔗糖就是我们平常所说的白糖或红糖,由葡萄糖和果糖组成,广泛用于食品加工和烹饪。
麦芽糖则由两个葡萄糖分子组成,在麦芽中含量较高。
乳糖如前文所述,由葡萄糖和半乳糖组成。
多糖是由多个单糖分子通过糖苷键连接而成的高分子化合物。
淀粉是植物中最常见的多糖,分为直链淀粉和支链淀粉。
直链淀粉是由数百个葡萄糖分子通过α-1,4 糖苷键连接而成的线性分子,遇碘显蓝色。
支链淀粉则具有分支结构,遇碘显紫红色。
淀粉在人体消化道中被淀粉酶逐步水解为葡萄糖,从而被吸收利用。
糖原是动物体内储存能量的多糖,类似于植物中的淀粉。
它主要存在于肝脏和肌肉中,当身体需要能量时,可以迅速分解为葡萄糖。
纤维素是植物细胞壁的主要成分,由大量的葡萄糖分子通过β-1,4糖苷键连接而成。
由于人体缺乏能够水解β-1,4 糖苷键的酶,所以纤维素不能被人体消化吸收,但它在促进肠道蠕动、预防便秘等方面起着重要作用。
糖类化合物具有许多重要的性质。
首先是甜味,这是我们最直观能感受到的性质。
不同的糖类化合物甜度不同,一般来说,果糖的甜度最高,其次是蔗糖,然后是葡萄糖。
糖类化合物还具有还原性和非还原性之分。
具有还原性的糖类称为还原糖,能够与某些试剂发生反应,如斐林试剂或班氏试剂。
常见的还原糖有葡萄糖、果糖和麦芽糖等。
有机化学精品教学课件:第十六章糖类

• 糖类的定义和分类 • 糖类的结构和性质 • 糖类的合成和降解 • 糖类在生物体内的功能和作用 • 糖类的应用和发展前景
01
糖类的定义和分类
单糖
单糖是指不能再被简单水解成 更小的糖类的最小单位,通常 由含有五个或更多碳原子的链 状或环状结构组成。
单糖根据碳原子的排列方式可 以分为醛糖和酮糖两大类。
结构组成
糖类是生物体的重要结构组成成分,如脱氧核糖和核糖分 别是DNA和RNA的组成成分。
03
细胞识别
糖链参与细胞识别,细胞表面的糖蛋白通过糖链识别其他 细胞,在细胞间的信息交流中起重要作用。
糖类在生物体内的作用
代谢中间物
糖类在生物体内作为其他物质的 代谢中间物,如葡萄糖可以转化
为氨基酸或脂肪等物质。
THANKS
感谢观看
淀粉是由葡萄糖聚合而成,广泛存在于植物种子和根茎中, 是植物的主要储能物质。纤维素则是由葡萄糖聚合而成,是 植物细胞壁的主要成分,具有很好的生物相容性和生物可降 解性。
02
糖类的结构和性质
糖类的结构特点
糖类是含有醛基、酮基、醇基和羰基等杂环的有机化合物,其基本结构单元是单糖。
单糖根据碳原子数目可分为三碳糖、四碳糖、五碳糖、六碳糖等,其中六碳糖是最 常见的。
罗汉果等天然甜味剂,以及人工合成的低热量、高强度甜味剂。
02 03
糖类在生物医学领域的应用
随着生物技术的发展,糖类在生物医学领域的应用越来越广泛,如糖类 在药物传递系统、糖蛋白和糖肽的合成与分离、糖类在细胞识别和细胞 信号转导中的作用等方面的研究。
糖类与疾病预防和治疗
糖类与许多疾病的发生和发展密切相关,因此,研究糖类的结构和功能 对于预防和治疗疾病具有重要意义,如糖尿病、癌症等。
有机化学 糖类化合物

第十六章糖类化合物Carbohydrates糖类化合物的分类1.单糖(monosaccharides):不能再水解为更小分子的多羟基醛和多羟基酮。
如:葡萄糖、果糖等。
2.低聚糖(Oligosaccharides):能水解为二、三个或几个单糖的碳水化合物。
如:蔗糖、麦芽糖、棉子糖等。
3.多糖(polysaccharides):水解后能生成若干分子单糖的碳水化合物。
如:淀粉、纤维素。
在这方面的研究,德国化学家Fischer最为突出,为此曾获1902年Nobel化学奖。
经研究确定,葡萄糖具有下面的构型:那么,若用D/L标记法又如何进行标记呢?1、相对构型(D系列和L系列)相对构型(即D,L购型;D:手性碳原子上的羟基是投影在右边,L手性碳原子上的羟基是投影在左边)D-甘油醛为标准最简单的单糖是2,3-二羟基丙醛(甘油醛)。
甘油醛有一个手性碳原子,有一对对映体,其费歇尔投COOH OHCH HCOOHOHCH H2、构型的标记和表示方法三、单糖的反应、构型的测定(1)、生成糖脎该反应实际上是生成果糖腙后,用一分子具有氧化能力的苯肼将C1的伯醇基氧化成-CHO后,再与另一分子苯肼作用而成脎的。
上述反应即为成脎反应(iii)和硝酸反应通常可以用来推测单糖的结构(iv)HIO4氧化当单糖为游离分子时,被高碘酸氧化后均生成一个碳原子的小分子。
如果单糖已经生成糖苷,均可以生成D-(+)-甘油醛:四、单糖的环状构型葡萄糖的开链式结构固然可以清楚地表明分子中各原子的结合次序、解释某些化学性质,然而它无法解释下面的事实:A、不发生某些醛的典型反应:如:与Tollen试剂作用而不与Schiff试剂作用(显色);加成;不与饱和NaHSO3只能与一分子CHOH发生缩合;3B、红外光谱中无C=O吸收;C、具有变旋现象。
在D–(+)–葡萄糖中可分离出两种结晶形式,其物理性质如下:HH OHOH3.单糖的椅式构象第二节双糖一分子单糖的半缩醛和另一分子单糖的羟基形成的糖苷,分为还原性双糖和非还原性双糖非还原性双糖一、蔗糖(Sucrose)蔗糖结构的确定:1.将蔗糖水解,得到两分子单糖——一分子葡萄糖和一分子果糖。
第十六章糖类化合物

第十六章 糖类化合物一、本章的要点碳水化合物指多羟基醛或多羟基酮,以及它们的脱水缩合物和衍生物。
1、单糖单糖是最重要的糖,也是其他糖的基本结构单位。
根据分子中碳原子数目分为:丙糖、丁糖、戊糖、己糖等。
根据羰基的位置不同分为:醛糖、酮糖。
单糖的构型和标记法相对构型:规定了以甘油醛为标准,其他的单糖与甘油醛比较,如编号最大的手性碳原子的构型与D-甘油醛相同,就属D 型,反之为L 型。
个人收集整理 勿做商业用途CHOCH 2OH OH HO OH OH H H HH CH 2OHCH 2OH O HO OHOH H H HD-(+)-葡萄糖D-(-)-果糖CHO CH 2OHOHH D-(+)-甘油醛CHOCH 2OHHO OH HO HOH H H H CH 2OHCHO OHHO HO HH HL-(-)-葡萄糖L-(+)-树胶糖CHO CH 2OHHO HL-(-)-甘油醛注意:① D 、L 只表示单糖的相对构型与甘油醛的关系,与旋光方向无关。
②自然界中存在的糖都是D 型,L 型多为人工合成的。
构型的表示和标记方法构型的表示:常用费歇尔投影式表示糖的构型,可以做一些简化。
CHOCH 2OHOH HO OH OH H HH H CHOCH 2OHOH HOOH OH CHOCH 2OHD-葡萄糖构型的绝对标记:用R/S 标记出每一个手性碳原子的构型,但较为复杂。
(2)单糖的氧环式结构单糖溶液存在变旋现象。
糖的结构不是开链式的,而是形成环状半缩醛结构,且都是以五元或六元环的形式存在。
用Haworth 透视式能比较真实的表现糖的氧环式结构。
CHOCH 2OHOH HOOH OH CHOHOH 2CHO OHOHOH CHO HOOH OHCH 2OHOHH CHOHOOH OHCH 2OHOHOOH HOOH OHCH 2OHO OHHOOHOHCH 2OH+α-型β-型注意:①α型—生成的半缩醛羟基与C5上的羟甲基处于环的两侧; β构型—生成的半缩醛羟基与C5上的羟甲基处于环的同侧。
有机化学第16章糖类资料

5
CHO CHOH CH2OH
丙醛糖(甘油醛)
CH2OH CO CH2OH
丙酮糖
CHO CHOH CHOH CHOH CH2OH 戊醛糖
CH2OH CO CHOH CHOH CH2OH 戊酮糖
CHO CHOH CHOH CH2OH
15
β - D-吡喃-果糖
链状费歇尔投影式转变成哈沃斯式 通用写法:
a. 吡喃型
O
O
呋喃型
氧在右上角 碳原子顺时针排列
b.将标准费歇尔式碳键右侧基团或原子写在哈沃斯式环
平面的下方;左侧基团或原子写在环平面上方。
c. D-型糖 ,-CH2OH 环上;半缩醛羟基在环下α,环上β d. L-型糖 ,-CH2OH 环下;半缩醛羟基在环上α,环下β
6
CH2OH O
OH
1
CH2OH
H H
H6
H
5
H
1
O CH2OH
OH 2
5H
OH 2
H4
3 OH
OH
H
α - D-呋喃-果糖
6
CH2OH O
OH
5H
OH 2
H4 OH
3 C1H2OH H
β -D-呋喃-果糖
OH
4
OH
3
OH H
α - D-吡喃-果糖
H
H6
H
5
H
1
O CH2OH
OH 2
OH
4
OH
3
OH H
丁醛糖 CHO CHOH CHOH CHOH CHOH CH2OH 已醛糖
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十六章 糖类化合物一、本章的要点碳水化合物指多羟基醛或多羟基酮,以及它们的脱水缩合物和衍生物。
1、单糖单糖是最重要的糖,也是其他糖的基本结构单位。
根据分子中碳原子数目分为:丙糖、丁糖、戊糖、己糖等。
根据羰基的位置不同分为:醛糖、酮糖。
单糖的构型和标记法相对构型:规定了以甘油醛为标准,其他的单糖与甘油醛比较,如编号最大的手性碳原子的构型与D-甘油醛相同,就属D 型,反之为L 型。
C H OC H 2O HO H H O O H O H H H HH C H 2O HC H 2O HO H O O H O H H H HD-(+)-葡萄糖D-(-)-果糖C H OC H 2O HO H HD-(+)-甘油醛C H OC H 2O HH O O H H O H OH H HH C H 2O HC H OO H H O H OH H H L-(-)-葡萄糖L-(+)-树胶糖CH OCH 2O HH OH L-(-)-甘油醛注意:① D 、L 只表示单糖的相对构型与甘油醛的关系,与旋光方向无关。
②自然界中存在的糖都是D 型,L 型多为人工合成的。
构型的表示和标记方法构型的表示:常用费歇尔投影式表示糖的构型,可以做一些简化。
C H O C H 2O HO HH OO H O HH H H H CH OC H 2O HO H H OO H O H C H OC H 2O HD-葡萄糖构型的绝对标记:用R/S 标记出每一个手性碳原子的构型,但较为复杂。
(2)单糖的氧环式结构单糖溶液存在变旋现象。
糖的结构不是开链式的,而是形成环状半缩醛结构,且都是以五元或六元环的形式存在。
用Haworth 透视式能比较真实的表现糖的氧环式结构。
C H OC H 2O HOH H OO H O H C H O H O H 2CH O O HO HO HC H OH OO H O HC H 2O HO HHC H OH OO H O HC H 2O HO H OO H H OO H O HC H 2O HO O HH O O H O HC H 2O H+α-型β-型注意:①α型—生成的半缩醛羟基与C5上的羟甲基处于环的两侧; β构型—生成的半缩醛羟基与C5上的羟甲基处于环的同侧。
②α-型糖与β-型糖是一对非对映体,α-型与β-型的不同在C1的构型上故有称为端基异构体和异头物。
③六元环的又称为吡喃糖,五元环的又称为呋喃糖。
(3)单糖的构象吡喃型葡萄糖的半缩醛环具有椅式构象。
在溶液中α-型和β-型可以通过开链式相互转化。
OO HO H H OC H 2O HH O OO HO HH OC H 2O HH O α-D-(+)-吡喃葡萄糖β-D-(+)-吡喃葡萄糖C H OC H 2O HO H H OO H O H [α] = +112°[α] = +19°37%~ 0.1%63%β-葡萄糖的构象中,所有大基团都处于e 键,所以比α-葡萄糖稳定。
(4)单糖的化学性质 氧化Tolling 试剂、Fehling 试剂和Benedict 试剂CHOCH 2OHOHHOOH OHCOOHCH 2OHOHHOOH OH +Tollen 试剂Ag (银镜)Cu 2O (砖红色)D-葡萄糖D-葡萄糖酸Fehling or 试剂 Benedict 试剂能被这些氧化剂氧化的糖称为还原糖,否则为非还原糖。
酮糖也能被Tolling 试剂、Fehling 试剂或Benedict 试剂氧化。
酮糖如果糖在稀碱溶液中可发生酮式-烯醇式互变,酮基不断地变成醛基(Tolling 试剂、Fehling 试剂和Benedict 试剂都是碱性试剂)—差向异构化作用,所以酮糖也能被氧化。
溴水C H OC H 2O HO H H OO H O H B r 2,H 2OC O O HC H 2O HO H H OO H O H D-葡萄糖D-葡萄糖酸 C C H 2O HO HH OO H O O D-葡萄糖酸-δ-内酯 溴水能氧化醛糖,但不能氧化酮糖,因为酸性条件下,不会引起糖分子的异构化作用。
可用此反应来区别醛糖和酮糖。
硝酸稀硝酸的氧化作用比溴水强,能使醛糖氧化成糖二酸。
C H OC H 2O HO H H OO H O H C O O HC O O HO H H OO H O H HN O 3D-葡萄糖D-葡萄糖二酸稀硝酸氧化酮糖时导致C1-C2键断裂。
D-果糖D-树胶糖二酸C H 2O HC H 2O HO H OO H O H H N O 3C O O HC O O H O H H OO H高碘酸高碘酸氧化,碳碳键发生断裂。
反应是定量的,每破裂一个碳碳键消耗一摩尔高碘酸。
因此,此反应是研究糖类结构的重要手段之一。
C H OCH 2O HO HO H +3H IO 4H CO O HH CO O H H CO O H H CH OD-赤藓糖还原C H OC H 2O HO H H OO H C H 2O HC H 2O H O H H OO H N aBH 4H 2 , N ior D-木糖(旋光)D-木糖醇(不旋光)脎的生成一分子糖和三分子苯肼反应,在糖的1,2-位形成二苯腙(称为脎)的反应称为成脎反应。
C H OC H 2O HO H H OO H O H C H 2O HC H N N H C 6H 5N N H C 6H 5H O O H O H 3C 6H 5N HN H 2C 6H 5N H 2+D-葡萄糖D-葡萄糖脎注意: ①生成糖脎的反应是发生在C1和C2上,不涉及其它碳原子,对于差向异构体,则生成同一个脎。
例如,D-葡萄糖、D-甘露糖、D-果糖的C3、C4、C5的构型都相同,它们生成同一个糖脎。
不同。
因此,可根据糖脎的晶型和生成的时间来鉴别糖。
苷的生成单糖的半缩醛羟基与另一分子中的羟基、氨基或硫羟基等失水而产生的化合物称糖苷,也称配糖物。
(用甲醇的干燥盐酸反应发生缩醛反应,生成缩醛)O O HH OO H O HC H 2O H+C H 3O H HC l(g)O O C H 3H OO HO HC H 2O Hβ-D-葡萄糖β-D-葡萄糖甲苷配基糖苷基糖苷是缩醛或缩酮,在水溶液中不再能转变为开链式。
在碱性条件下是稳定的,但在温和的酸性条件下水解。
酶也能促使糖苷水解,而且是立体专一的。
醚的生成在酸催化下,只有糖的半缩醛羟基能与另一分子醇反应形成苷键。
但用Williamson 反应可使糖上所有的羟基(包括半缩醛的羟基)形成醚。
最常用的甲基化试剂是:30% NaOH+(CH 3)2SO 4或Ag 2O+CH 3I 。
OOHOH HOCH 2OHHO CH 3I Ag 2OOCH 2OCH 3OCH 3OCH 3CH 3O CH 3O醇羟基形成的醚键在温和的酸性条件下是稳定的,只有在强的HX 作用下才分解。
酯的生成OHO OHOH(CH 3CO)2O 吡啶OHOCH 2OHCH 3COO CH 3COOCH 2OCOCH 3OOCCH 3CH 3COO(5)脱氧糖单糖分子中的羟基脱去氧原子后的多羟基醛或多羟基酮。
C H OCH 2OHOH OH OH D-核糖C H O CH 2OHOH OH D-2-脱氧核糖(6)氨基糖氨基代替糖分子中的羟基而成的。
广泛存在于自然界中。
OO HN H 2H OC H 2O HH O O O HN H 2H OC H 2O HO H β-D-2-氨基葡萄糖β-D-2-氨基半乳糖2、二糖水解后产生两分子单糖的低聚糖称为双糖。
双糖中两个单糖分子有两种可能的连接方式: ①一分子单糖以半缩醛羟基和另一分子单糖的其他羟基缩合。
OCH 2O HOO CH 2O HO H此种双糖有半缩醛羟基,具有还原性、变旋现象等。
②两个半缩醛羟基相互结合生成缩醛。
OC H 2O HOOH O H 2C此种双糖没有半缩醛羟基,不具有还原性、变旋现象等。
(1)蔗糖OOO H H OCH 2O H H O O O HH O H 2CCH 2O HH O123456123456D -果糖D -葡萄糖α-1,2-苷键β-2,1-苷键蔗糖是非还原性双糖。
(2)麦芽糖OOO HH OC H 2O HH O OO HO H H OC H 2O Hα-1,4-苷键D -葡萄糖麦芽糖是还原性双糖。
(3)纤维二糖OOO HH OC H 2O HH O OO HO HH OC H 2O Hβ-1,4-苷键D-葡萄糖D-葡萄糖纤维二糖是还原性双糖。
3、多糖多糖是重要的天然高分子化合物,是由单糖通过苷键连接而成的高聚体。
多糖无还原性,无变旋光现象,无甜味,大多难溶于水,有的能和水形成胶体溶液。
(1)淀粉 淀粉的改性 环糊精(2)纤维素 粘胶纤维 纤维素酯 纤维素醚二、例题例1、①下列糖类物质不能发生银镜反应的是( )A. D-葡萄糖B. D-果糖C. 麦芽糖D. 蔗糖CHOH OH HO H H OH H OHCH2OHCOOH H OH HO H H OH H OHCOOH②分析:①只有蔗糖是非还原性糖。
②硝酸可把醛糖氧化成二酸。
解答:① D ② HNO3例2、写出D-(+)-甘露糖与下列物质的反应。
(1)羟胺(2)苯肼(3)溴水(4)HNO3(5)HIO4(6)NaBH4(7)CH3OH/HCl(生成缩醛),然后(CH3)2SO4/NaOH (8)苯甲酰氯/吡啶解答:HO CHOHHO HH OH H OHCH2OH NH2OH(1)HO CH=NOHHHO HH OH H OHCH2OHHO CHOHHO HH OH H OHCH2OHNNHPhHOCH=NNHPhHHH OHCH2OHOH PhNHNH2(2)HO CHOHHO HH OH H OHCH2OH Br2 H2O(3)HOCOOHH HO H H OHH OHCH2OHHO CHOHHO HH OH H OHCH2OH HNO3(4)HOCOOHHHO HH OHH OHCOOH HOCHOHHO HH OHH OHCH2OHHIO4(5)5HCOOH + HCHOHO CHOHHO HH OH H OHCH2OH NaBH4(6)HOCH2OHHHO HH OHH OHCH2OHCH3OHHCl(CH3)2SO4NaOH(7)OHHOHHOOHHHHOHOHOHHOHHOOHHHHOCH3OHOHH3COHH3COOCH3HHHOCH3OCH3CH 3COCl 吡啶(8)OH HOHHOOH HHHOHOHOH H 3COCOHH 3COCO OCOCH 3HHHOCOCH 3OCOCH 3例3、三个单糖和过量苯肼作用后,得到同样晶形的脎,其中一个单糖的投影式为HO CHO H HO H H HOHCH 2OH OH ,写出其它两个异构体的投影式。
