来那度胺联合美罗华治疗MCL
MCL化疗方案

MCL化疗方案恶性淋巴瘤(MCL)是一种罕见但恶性度较高的淋巴系统肿瘤。
针对MCL的治疗方案通常包括化疗、放疗和免疫治疗等多种手段。
本文将重点介绍MCL化疗方案,旨在为医生和患者提供相关信息以选择最佳治疗。
一、化疗方案的选择针对MCL的化疗方案取决于患者的年龄、身体状态、疾病分期和遗传学特征等因素。
通常,化疗方案可以分为传统化疗、高剂量化疗和靶向治疗三类。
以下将对这三种类型进行阐述。
1. 传统化疗传统化疗方案采用多种药物联合使用,旨在抑制淋巴瘤细胞的增殖和扩散。
在MCL的治疗中,常用的化疗方案包括CHOP方案(环磷酰胺+多柔比星+长春新碱+泼尼松)和Hyper-CVAD方案(环磷酰胺+长春新碱+长春霉素+地塞米松)等。
这些方案可通过静脉注射或口服给药进行。
2. 高剂量化疗高剂量化疗方案是通过使用更高剂量的化疗药物来治疗MCL。
这种治疗方法常与造血干细胞移植联合使用,旨在消除患者体内残留的恶性细胞。
常见的高剂量化疗方案包括BEAM方案(替硝唑+依托泊苷+阿霉素+亚胺培南+长春新碱)和MEC方案(米托蒽醇+依托泊苷+环磷酰胺)等。
3. 靶向治疗靶向治疗方案是近年来新发展起来的一种治疗方式,通过针对淋巴瘤细胞的特定分子或信号通路进行干预来达到治疗效果。
例如,Ibrutinib就是一种口服的靶向药物,可抑制B细胞受体信号通路,用于治疗难治性或复发性MCL。
二、化疗药物的作用机制化疗药物对MCL起到抑制细胞增殖、诱导细胞凋亡和阻断DNA合成等作用。
以下将对常用的化疗药物及其作用机制进行介绍。
1. 环磷酰胺环磷酰胺是一种碱化剂,可通过与DNA发生交联,引起DNA断裂从而抑制细胞增殖。
2. 多柔比星多柔比星是一种拓扑异构酶Ⅱ抑制剂,可干扰DNA的超螺旋结构,从而抑制DNA合成和细胞增殖。
3. 长春新碱长春新碱是一种抗代谢药物,可抑制核酸的合成,阻断细胞增殖。
4. 泼尼松泼尼松是一种糖皮质激素,可抑制炎症反应,并诱导淋巴瘤细胞凋亡。
第55届美国血液学年会研究热点报道——MYC基因异常的侵袭性B细胞淋巴瘤论文

of Science and Technology,Wuhan 430030,China.Email:jfzhou@咖.tjmu.edu.cn MYC基因是定位于染色体8q24上的一种癌基因,在多 种类型淋巴瘤中MYC基因可与IGH、IGL及非IG位点的基 因如Bcl.6、BCLlIA、PAX5或ICAROS49融合,MYC基 因异常表达的淋巴瘤患者多呈现侵袭性临床进程。在正常 人外周血和骨髓中存在低水平的染色体t(8;14),即MYC基 因的异常,提示单独MYC基因异常并不能启动淋巴瘤的发 生。侵袭性淋巴瘤是第55届美国血液学年会(ASH)讨论 热点之一,本文我们就MYC在侵袭性B细胞淋巴瘤中的发 病机制及对预后的影响进行简要报道。 一、MYC基因在生发中心细胞中的调节作用 MYC最初在启动生发中心形成的成熟B细胞及生发 中心明区表达,在高度增殖活性的暗区不表达。上调的 Bcl.6可通过与MYC启动子区结合抑制MYC表达;继之生 发中心明区部分激活的细胞NF.KB与IRF4表达上调、 Bcl.6表达下调,从而使MYC在明区内重新表达。生发中 心明区MYC蛋白阳性B细胞可重新进入暗区进入下一轮增
维持其高增殖活性是个令人费解的问题。最近的基因表达 谱研究结果显示生发中心明区与暗区细胞具有不同的转录 程序。转录因子TCF3在生发中心暗区高表达,它是维持生 发中心功能所必需的基因,除此之外,尚有CCND3和 E2F2基因,可促使生发中心细胞增殖。有趣的是,TCF3的 负性调控因子ID3也是MYC的一个靶基因,MYC可诱导 ID3表达,从而驱使细胞从暗区进入明区。这些元件相互作 用形成一个自主调节环,控制着细胞在生发中心明区与暗区 的移动。 二、MYC基因异常在侵袭性B细胞淋巴瘤中的作用 近几年,随着MYC基因FISH探针及识别MYC蛋白 的单克隆抗体出现,使得在大样本淋巴瘤中检测MYC成为 可能。有趣的是,大部分侵袭性B细胞淋巴瘤患者并不表 达MYC蛋白,MYC基因的高表达似乎只是生发中心细胞 Bcl一6及终末期分化B细胞BLIMPl基因不能有效抑制 MYC表达所致;另外,MYC与其他异常基因的异常表达协 同作用使细胞免于凋亡。MYC基因表达异常的侵袭性B细 胞淋巴瘤包括伯基特淋巴瘤(BL)、弥漫性大B细胞淋巴瘤 (DLBCL)、介于DLBCL和BL特征之间不能分类的B细胞 淋巴瘤(BCLU)、浆母细胞淋巴瘤(PBL)、转化型淋巴瘤;仅 有MYC蛋白过表达,没有MYC基因异常的侵袭性B细胞 淋巴瘤包括DLBCL、ALK阳性大B细胞淋巴瘤。 1.BL:BL是一种高度侵袭性的B淋巴细胞肿瘤,可分 为在发达国家诊断出的散发亚型、EB病毒相关地方性亚型
复发难治套细胞淋巴瘤的治疗

㊃专题㊃基金项目:江苏省盐城市科技局项目地西他滨对耐伊马替尼的慢性髓系白血病的作用和机制(Y K 2017004);江苏省卫计委 科教强卫工程青年医学人才 计划项目通信作者:徐浩,E m a i l :x h x u h a o 2008@163.c o m 复发难治套细胞淋巴瘤的治疗苗雨青,徐 浩(盐城市第一人民医院血液科,江苏盐城224000) 摘 要:套细胞淋巴瘤(M C L )是一类以老年发病㊁临床表现多样化的侵袭性的B 细胞非霍奇金淋巴瘤,一旦复发无标准治疗可参考㊂许多新型药物使复发难治的M C L 的预后得到改善㊂本文对近几年的新药作一综述,供临床参考㊂关键词:淋巴瘤,膜细胞;B 细胞受体;新型药物;预后中图分类号:R 733.4 文献标志码:A 文章编号:1004-583X (2019)06-0514-05d o i :10.3969/j.i s s n .1004-583X.2019.06.006T r e a t m e n t o f r e l a p s e do r r e f r a c t o r y m a n t l e c e l l l y m ph o m a M i a oY u q i n g,X uH a o D e p a r t m e n t o f H e m a t o l o g y ,T h eF i r s tR e n M i n H o s p i t a l o f Y a n c h e n g ,Y a n c h e n g 224000,C h i n a C o r r e s p o n d i n g au t h o r :X u H a o ,E m a i l :x h x u h a o 2008@163.c o m A B S T R A C T :M a n t l e c e l l l y m p h o m a (M C L )i sa na g g r e s s i v eB -c e l ln o n -H o d g k i n 'sl y m p h o m a w i t hav a r i e t y o f c l i n i c a lm a n i f e s t a t i o n s i nt h ee l d e r l y .A t p r e s e n t ,t h e r e i sn os t a n d a r ds p e c i f i ct r e a t m e n t f o rt h er e l a ps e d p a t i e n t s .R e c e n t l y ,s e v e r a l n e wd r u g sh a v eb e e nd e v e l o p e d ,w h i c hc a n i m p r o v e t h e p r o g n o s i so f r e l a p s e da n dr e f r a c t o r y M CL .T h i s a r t i c l e r e v i e w s t h en e wd r u gs t h a t h a v eb e e n i n t r o d u c e d t o t h e t r e a t m e n t o f t h e s e p a t i e n t s i n r e c e n t y e a r s .K E Y W O R D S :m a n t l e c e l l l y m p h o m a ;Bc e l l r e c e p t o r ;n e wd r u g s ;p r o gn o s is 徐浩,主任医师,科主任㊂江苏省医学会血液学分会委员,江苏省医师协会血液科医师分会委员,江苏省抗癌协会小儿肿瘤专业委员会委员,江苏省研究型医院协会C A R T 专委会委员,盐城市医学会内科学分会委员,盐城市医学会血液学分会主任委员,南通大学兼职教授㊂获盐城市科技进步奖4项㊁新技术引进奖4项㊂擅长造血系统肿瘤(白血病㊁骨髓增生异常综合征㊁淋巴瘤㊁多发性骨髓瘤)㊁再生障碍性贫血㊁免疫性血小板减少症等的现代诊断和治疗及造血干细胞移植技术,在血液病诊疗方面有较高的专业技术水平和丰富的临床经验㊂目前研究方向:血液肿瘤靶向治疗及造血干细胞移植治疗恶性血液病㊂参编专著2部㊁在核心期刊上发表论文30余篇㊂套细胞淋巴瘤(M C L )是一种进展迅速的侵袭性非霍奇金淋巴瘤(N H L ),在西方国家发病率为2%~6%,亚洲国家发病率低于西方国家,该病以细胞周期蛋白D 1的过度表达为特征,预后不佳[1]㊂M C L 总体预后不佳,尚无治愈性治疗方案,也无明确的后续治疗方案㊂目前临床上对于年轻患者,最常用的治疗方法是使用含利妥昔单抗和阿糖胞苷的强化学免疫治疗方案,如R -h y p e r -C V A D /MA 方案(美罗华联合环磷酰胺㊁长春地辛㊁阿霉素及地塞米松与大剂量阿糖胞苷+甲氨喋呤)等,随后是自体造血干细胞移植和维持利妥昔单抗的巩固疗法;对于老年或者体弱患者,使用化学免疫治疗诱导和利妥昔单抗维持疗法[2]㊂M C L 是所有N H L 中预后最差的亚型之一,目前尚不能治愈,一线治疗缓解维持时间短,复发率高,中位生存期仅3~4年,部分患者在诊断后6个月之内死亡,M C L 患者总体预后差,仅8%左右的患者可生存10年以上[1]㊂复发/难治性M C L (R R -M C L )仍是治疗难题,复发是指经过正规治疗病情得到缓解,一段时间后病情再次进展㊂难治是指对初始治疗反应差或无反应㊂M C L 患者年龄较大,一旦复发,难以忍受强的化疗,治疗复发患者通常比一线治疗缓解率低,二线治疗后缓解持续时间(D O R )比初始治疗更短,中位生存期1~2年[3]㊂近年来随着伊布替尼㊁来那度胺等靶向治疗药物的应用,M C L 患者在D O R 和生存期上有所改善,但患者仍旧不可避免复发㊂许多靶向药物被美国食品与药品管理局(F D A )批准用于R R -M C L 患者的治疗[4],M C L 患者预后相对之前有所改善,并且从强化疗向无化疗时代转变㊂本文就近几年在国内可采取的新治疗作一综述㊂见表1㊂㊃415㊃‘临床荟萃“ 2019年6月20日第34卷第6期 C l i n i c a l F o c u s ,J u n e 20,2019,V o l 34,N o .6Copyright ©博看网. All Rights Reserved.表1 复发难治的套细胞淋巴瘤的治疗方案方案文献年限入组数量(例)O R R (%)C R (%)硼替佐米(1.3m g /m 2,第1㊁4㊁8㊁11天);每21天1周期2009年(B e r n s t e i n 等[5-6])141338硼替佐米(1.6m g/m 2d 1/d 8)+C H O P ;每21天1周期2015年(F u r t a d o 等[8])238335利妥昔单抗(375m g /m 2,d 1)+硼替佐米(1.3m g/m 2,第1㊁4㊁8㊁11天)+地塞米松(40m g 第1至4天);每21天1周期2011年(L a mm 等[9])1681.343.8来那度胺(25m g /d ,1~21天);每28天1周期2017年(W i t z i g 等[14])2063311利妥昔单抗(375m g /m 2,d 1)+来那度胺((20m g/m 2,d 1~21));28天1周期2012年(W a n g等[16])44 57 36 伊布替尼(560m g/d );一直到病情进展2017年(R u l e 等[19])3706620伊布替尼(560m g /d )+苯达莫司汀(90m g/m 2,d 1/d 2)+利妥昔单抗(375m g/m 2,d 1);28天1周期;6周期后伊布替尼维持到进展2015年(M a d d o c k s 等[23]) 17 9476伊布替尼(560m g /d )加利妥昔单抗(375m g /m 2,第1疗程每周1次;第3~8疗程第1天;后每2疗程用1次,共2年)2016年(W a n g 等[24])50 88 44 伊布替尼(560m g /d )㊁来那度胺(15m g/d )和利妥昔单抗(第一疗程静脉滴注375m g /m 2每周1次或皮下注射1400m g,然后每8周注射1次);每28天1周期2018年(J e r k e m a n 等[25])5076 56 A c a l a b r u t i n i b (100m g 每日2次)2018年(W a n g 等[26])1248140V e n e t o c l a x (800m g;每日1次)2017年(D a v i d s等[27])287521V e n e t o c l a x +伊布替尼(伊布替尼560m g/d ,4周后加用v e n e t o c l a x ,剂量从50m g /日增至400m g/日)2018年(T a m 等[28])23例R R -M C L ;1例初诊M C L71(16周)62 注:C H O P 方案(环磷酰胺+阿霉素+长春新碱+强的松)1 硼替佐米为主的方案硼替佐米是一种蛋白酶体抑制剂,它选择性作用于泛素蛋白酶体途径,从而使许多细胞内蛋白质降解,从而具有抗增殖和抗肿瘤活性㊂2006年,硼替佐米被批准用于治疗R R -M C L ,并且在2014年被批准用于治疗初诊M C L ㊂1.1 单用硼替佐米 一项2期临床研究评估了硼替佐米治疗R R -M C L 患者的总体反应率(O R R )㊁D O R ㊁疾病进展时间(T T P )㊁总生存率(O S )和安全性[5-6]㊂共入组155例患者,先前治疗的中位数是1(1~3)个疗程㊂141名可评估患者的O R R 为33%,其中完全缓解(C R )/未确认的C R (u C R )为8%,中位无进展生存期(P F S )为6.5个月,中位O S 为23.5个月㊂整个治疗过程中,最常见的3级或更高的不良事件是周围神经病变(13%)㊁疲劳(12%)和血小板减少(11%)㊂其中12例死于使用最后一剂硼替佐米的28天内,其中4例考虑与硼替佐米相关,3例为非中性粒细胞减少性败血症,1例为呼吸衰竭㊂1.2 硼替佐米联合治疗 由于硼替佐米在M C L 一线治疗中疗效确切[7],一项多中心㊁二期研究[8],将复发的M C L 患者随机分组,一组接受C HO P 方案(环磷酰胺+阿霉素+长春新碱+强的松),另一组接受硼替佐米(第1天和第8天)加C HO P ㊂研究发现加入硼替佐米相对于单纯C HO P 组,可改善O R R(83%v s48%)㊁C R 率(35%v s22%)㊁中位P F S (16.5个月v s8.1个月)和中位O S (35.6个月v s 11.8个月)㊂尽管硼替佐米的加入改善了患者的O S(P <0.01),但发生3/4级中性粒细胞减少患者增多(30%v s 20%),发热性中性粒细胞减少症也明显增多(39%v s17%)㊂L a mm 等[9]联合使用硼替佐米㊁利妥昔单抗及地塞米松治疗16例R R -M C L ,结果显示O R R 为81.3%,C R 为43.8%,中位P F S 和O S 分别为12.1和38.6个月,大于2级的不良事件包括血小板减少(37.5%)㊁疲劳(18.8%)和周围神经病变(12.5%)㊂2例患者因3级神经病变而停用了硼替佐米㊂硼替佐米联合利妥昔单抗和地塞米松治疗R R -M C L 具有良好疗效并且毒性可控,可作为临床治疗方案选择之一㊂2 苯达莫司汀为主的方案苯达莫司汀是一种新型的烷基化剂,与美罗华具有协同作用,已被列入美国国家综合癌症网络(N C C N )指南M C L 的一线治疗方案㊂一项3期临床试验[10],比较了苯达莫司汀联合利妥昔单抗(B R )(n =274;其中261例可评估)和C HO P 联合利妥昔单抗(R -C HO P )(n =275;其中253例可评估)作为治疗懒惰N H L 和M C L 的一线药物,中位随访时间为45个月,两组中位P F S 分别为69.5个月与31.2个月㊂随后F l i n n 等[11]在B R I G H T 研究中,随机比较了B R (n =224)与R -C HO P /C V P (环磷酰胺+长春新碱+强的松)(n =223)治疗惰性N H L 或M C L 的疗效和安全性,O R R 分别为97%和91%,C R 分别为31%和25%㊂接受B R 治疗的患者呕吐㊁药物超㊃515㊃‘临床荟萃“2019年6月20日第34卷第6期 C l i n i c a l F o c u s ,J u n e 20,2019,V o l 34,N o .6Copyright ©博看网. All Rights Reserved.敏反应㊁周围神经病变/感觉异常和脱发的发生率显著高于接受R-C HO P/C V P治疗的患者(P< 0.05),但是均可耐受㊂这些数据表明,B R在临床反应方面不劣于标准治疗,且具有可接受的安全性㊂C h e n等[12]研究发现与R-h y p p r-H C V A D/MA方案相比,B R对年轻患者的移植前诱导方案具有相似的疗效,可获得较好的缓解,动员成功率较高㊂在R R-M C L中,M a d d o c k s等[13]研究伊布替尼联合B R的治疗方案,其O R R率为94%,C R率为76%㊂以上研究均证明B R方案是一个高疗效㊁不良反应可接受的治疗方案,值得临床广泛应用,但是国内苯达莫司汀尚未上市㊂3来那度胺为主的方案来那度胺系免疫调节药物,具有抗细胞增殖活性㊁直接细胞毒性及免疫调节等作用,已广泛应用于恶性血液病的治疗㊂近几年来,来那度胺单药或联合应用于M C L,均取得了明显的临床疗效㊂见表1㊂3.1来那度胺单独用药 W i t z i g等[14]报道,使用来那度胺单药治疗(25m g/d,1~21天,28天1个周期)206例中位年龄为67岁(63%ȡ65岁)的R R-M C L患者,91%为Ⅲ/Ⅳ期,50%之前使用过4种治疗方案,O R R为33%,其中11%达C R㊂来那度胺治疗反应快(平均反应时间为2.2个月),疗效持久(平均D O R为16.6个月);其主要不良反应为骨髓抑制,但是具备可控性㊂E v e等[15]使用同等剂量的来那度胺治疗26例R R-M C L,结果显示O R R为31%,并提出女性M C L患者对来那度胺的敏感性高于男性(P=0.02)㊂3.2来那度胺联合其他药物治疗利妥昔单抗和来那度胺联合治疗M C L显示了较好的应用前景㊂W a n g等[16]报道了44名R R-M C L患者接受利妥昔单抗(375m g/m2,第1天,28天1个周期)和来那度胺(20m g/d,1~21天,28天1个周期)的联合治疗,其中25名(57%)患者取得O R R,16名(36%)C R,9名(20%)达部分缓解(P R),D O R为18.9个月,中位P F S为11.1个月,中位O S为24.3个月㊂该研究证明口服来那度胺联合利妥昔单抗对R R-M C L患者具有良好的耐受性和有效性㊂M C L-004研究[17]报道了使用来那度胺治疗伊布替尼失败或不耐受的R R-M C L患者的预后㊂该研究共入组58名患者,中位年龄为71岁(50~89岁),13名接受了来那度胺单药治疗,11名接受了来那度胺加利妥昔单抗治疗,34名接受了来那度胺加其他治疗㊂88%的患者接受过3次以上其他方案治疗㊂使用2周期来那度胺后,17名(29%)患者获得O R R,其中8例达C R,9例达P R,平均D O R为20周㊂该研究提示以来那度胺为基础的方案治疗既往伊布替尼治疗失败的R R-M C L 患者,有效且不良反应可耐受㊂4B T K抑制剂B细胞受体信号通路的持续激活对M C L的发病至关重要㊂伊布替尼与B T K活性位点A T P结合域中的半胱氨酸残基(c y s-481)以有效的共价方式结合㊂这种结合抑制恶性B细胞内的B细胞受体信号通路,进而导致细胞的生长㊁增殖㊁存活㊁黏附和迁移能力减弱,为伊布替尼用于M C L打下基础[18]㊂4.1单用伊布替尼R u l e等[19]汇集了P C Y C-1104[20](n=111),S P A R K[21](n=120)和R A Y[22](n=139)3项关于单用伊布替尼治疗R R-M C L的研究数据,中位年龄为67.5岁㊂研究发现P C Y C-1104㊁S P A R K和R A Y的试验结果相似: O R R分别为68%㊁63%和72%;中位P F S分别为13.9个月㊁10.5个月和14.6个月;中位O S分别为22.5个月㊁25.4个月和未达到;18个月时的估计O S 分别为58%㊁61%和58%㊂P C Y C-1104㊁S P A R K和R A Y的平均随访时间分别为15.5个月㊁14.9个月和20个月㊂3项研究汇总显示,370例患者的O R R为66%,其中C R20%,P R46%,P F S为12.8个月,平均O S为25.0个月㊂该研究提示伊布替尼对于R R-M C L是一个不良反应可控的有效治疗方案㊂4.2伊布替尼联合其他药物治疗 R u l e等[19]汇总分析发现,使用伊布替尼时,D O R与其治疗后患者病情获得缓解的程度密切相关㊂如果患者能获得C R,随访2年,70%患者为P F S,O S为90%㊂因此,为获得更深的缓解率,支持伊布替尼联合其他方案治疗㊂在R R-M C L中,M a d d o c k s等[23]研究伊布替尼联合B R的治疗方案,其O R R为94%,C R为76%;W a n g等[24]报道伊布替尼加利妥昔单抗治疗R R-M C L的O R R为88%,C R为44%㊂一项2期临床试验研究显示[25],伊布替尼㊁来那度胺和利妥昔单抗三药联合方案在50例R R-M C L患者表现出高效性㊂该研究中位随访时间17.8个月,38例(76%)患者获得缓解,其中包括28例(56%)达C R,10例(20%)达P R㊂因此,临床上如果患者能够耐受,建议伊布替尼联合其他药物治疗,以获得更深的缓解,延长无病生存期㊂4.3第二代B T K抑制剂-A c a l a b r u t i n i b虽然伊布替尼已被证明是治疗R R-M C L患者的有效药物,且耐受性良好,但部分患者因为心脏毒性和出血等,需要中断治疗㊂第二代B T K抑制剂具有类似的疗效,但毒性轻微,为R R-M C L患者提供了一个可行的治㊃615㊃‘临床荟萃“2019年6月20日第34卷第6期 C l i n i c a l F o c u s,J u n e20,2019,V o l34,N o.6Copyright©博看网. All Rights Reserved.疗方案㊂一项2期临床试验研究显示[26]口服A c a l a b r u t i n i b(100m g,每日2次)治疗124例R R-M C L,81%的患者获得反应,其中40%患者获得C R,不良反应轻微㊂5V e n e t o c l a x5.1单用V e n e t o c l a x B细胞淋巴瘤因子-2(B C L-2)在细胞凋亡(程序性细胞死亡)中发挥重要作用,可阻止一些细胞(包括淋巴细胞)凋亡,并且在某些类型癌症中过度表达,与耐药性形成相关㊂V e n e t o c l a x是靶向B C L-2的抑制剂㊂D a v i d s等[27]使用V e n e t o c l a x治疗28例R R-M C L,结果显示最佳剂量为每日口服800m g,直到病情进展,O R R为75%,其中21%达C R,中位P F S为14个月,不良反应轻微,均能耐受㊂V e n e t o c l a x作用独特,不良反应轻微,这为V e n e t o c l a x与其他方案联合使用奠定了基础㊂5.2 V e n e t o c l a x+伊布替尼 B T K抑制剂(伊布替尼)和B C L-2抑制剂(v e n e t o c l a x)单药在治疗M C L 中均具有明显疗效,C R为21%左右㊂由于两者作用机制不同,T a m等[28]使用伊布替尼联合v e n e t o c l a x (伊布替尼560m g/d,4周后加用v e n e t o c l a x,剂量从50m g/d增至400m g/d)治疗23例R R-M C L和1例初诊M C L,一直服用到病情进展或者患者不能耐受为止㊂入组患者中,一半的患者有T P53的异常, 75%的患者有高风险的预后评分㊂服药16周时,使用P E T-C T评估,O R R为71%,C R为62%,D O R 为15个月㊂2例患者发生肿瘤细胞溶解综合征㊂常见的不良反应为低级别,包括腹泻(83%)㊁疲劳(75%)和恶心或呕吐(71%)㊂因此,对于R R-M C L,联合使用伊布替尼与v e n e t o c l a x为不错的选择,值得临床推广㊂6嵌合抗原受体T细胞(C A R-T)治疗尽管硼替佐米㊁来那度胺和伊布替尼等新药在M C L治疗中得到成功的应用,但持续反应时间有限,患者最终仍会走向难治或者复发,且预后极差[1]㊂这些新药的发现和应用告诉我们,R R-M C L 治疗效果的进一步改善是可能的,而且迫切需要更为有效的新疗法㊂虽然异基因造血干细胞移植(a l l o-S C T)具有治愈淋巴瘤不同亚型患者的潜力,但移植相关的死亡率仍然很高,长期后遗症如慢性移植物抗宿主病(G V H D)可能对生活质量产生实质性的负面影响㊂C A R-T疗法的出现为复发难治的恶性血液病患者带来生机㊂研究者通过提取患者的一些T 细胞,用基因工程技术给T细胞加入一个能识别肿瘤细胞的特异性抗原,体外培养并激活C A R-T细胞,经过提纯㊁大量扩增后回输给患者㊂这些基因修饰的C A R识别特定的肿瘤相关抗原,摧毁靶细胞,从而达到治疗淋巴瘤的效果㊂针对C D19抗原C A R-T细胞疗法的出现为该类患者提供了新的治疗方法㊂据报道[29-30],C D19-C A R T细胞治疗复发难治B细胞淋巴瘤O R R可达5%~83%,C R可达40%~58%㊂W a n g等[31]在2019美国临床肿瘤学会年会上报道,使用C A R-T细胞免疫治疗9例R R-M C L,中位年龄66岁,4例为母细胞/多形性M C L,8例K i67>30%,1例T P53突变,所有患者之前使用过中位5种治疗方案,并且都接受过伊布替尼治疗, O R R为78%㊂该研究虽然入组例数少,但疗效显著,值得临床推广,44%患者治疗后出现严重的不良事件,33%发生1级细胞因子风暴(C R S),没有发生神经毒性不良反应㊂随着新的治疗方案不断出现,R R-M C L患者的治疗应答以及预后在一定程度上得到改善,但是仍有部分患者在缓解后复发㊂伊布替尼治疗后的复发与不良预后有关,需要联合治疗以提高反应的深度和持续时间,对伊布替尼治疗后进展的患者也需要有效的治疗㊂C A R-T细胞免疫治疗为M C L提供了一个潜在的治疗方案,但是在R R-M C L中的数据有限,而且因其治疗毒性,大多数复发患者可能不是这种方法的候选者㊂因此,我们需要进一步根据M C L 患者的分子生物学特性发现更多有效的治疗方案,诱导更深的缓解,并利用风险分层工具定制个体化的治疗方法,最终不断使M C L患者获益㊂参考文献:[1]J a i nP,W a n g M.M a n t l e c e l l l y m p h o m a:2019u p d a t eo n t h ed i a g n o s i s,p a t h o ge n e s i s,p r o g n o s t i c a t i o n,a n d m a n a g e m e n t[J].A mJH e m a t o l,2019,94(6):710-725.[2] M a d d o c k sK.U p d a t eo n m a n t l ec e l l l y m p h o m a[J].B l o o d,2018,132(16):1647-1656.[3] N j u eA,C o l o s i a A,T r a s k P C,e ta l.C l i n i c a le f f i c a c y a n ds a f e t y i n r e l a p s e d/r e f r a c t o r y m a n t l e c e l l l y m p h o m a:as y s t e m a t i cl i t e r a t u r er e v i e w[J].C l i n L y m p h o m a M y e l o m aL e u k,2015,15(1):1-12.e7.[4] P a r r o t t M,R u l e S,K e l l e h e r M,W i l s o n J.A s y s t e m a t i cr e v i e w o f t r e a t m e n t s o f r e l a p s e d/r e f r a c t o r y m a n t l e c e l ll y m p h o m a[J].C l i nL y m p h o m aM y e l o m aL e u k,2018,18(1):13-25.e6.[5] F i s h e rR I,B e r n s t e i nS H,K a h l B S,e t a l.M u l t i c e n t e r.p h a s eⅡs t u d y o f b o r t e z o m i b i n p a t i e n t sw i t hr e l a p s e do r r e f r a c t o r ym a n t l e c e l l l y m p h o m a[J].JC l i nO n c o l,2006,24(30):4867-4874.[6] G o y A,B e r n s t e i nS H,K a h l B S,e t a l.B o r t e z o m i b i n p a t i e n t sw i t hr e l a p s e d o rr e f r a c t o r y m a n t l ec e l ll y m p h o m a:u p d a t e dt i m e-t o-e v e n t a n a l y s e so f t h em u l t i c e n t e r p h a s e2P I N N A C L E㊃715㊃‘临床荟萃“2019年6月20日第34卷第6期 C l i n i c a l F o c u s,J u n e20,2019,V o l34,N o.6Copyright©博看网. All Rights Reserved.s t u d y[J].A n nO n c o l,2009,20(3):520-525.[7] R o b a kT,H u a n g H,J i nJ,e ta l.B o r t e z o m i b-b a s e dt h e r a p yf o r n e w l y d i ag n o s e dm a n t l e-c e l l l y m ph o m a[J].NE n g l JM e d,2015,372(10):944-953.[8] F u r t a d o M,J o h n s o n R,K r u g e r A,e t a l.A d d i t i o n o fb o r t e z o m i bt o s t a n d a r d d o s ec h o p c h e m o t h e r a p y i m p r o v e sr e s p o n s e a n d s u r v i v a l i n r e l a p s e dm a n t l e c e l l l y m p h o m a[J].B r JH a e m a t o l,2015,168(1):55-62.[9] L a mm W,K a u f m a n n H,R a d e r e r M,e t a l.B o r t e z o m i bc o m b i n ed w i t h r i t u x i m a b a n d de x a m e t h a s o n ei s a n a c t i v er e g i m e n f o r p a t i e n t s w i t h r e l a p s e d a n d c h e m o t h e r a p y-r e f r a c t o r y m a n t l ec e l l l y m p h o m a[J].H a e m a t o l o g i c a,2011, 96(7):1008-1014.[10] R u mm e l M J,N i e d e r l e N,M a s c h m e y e r G,e t a l.B e n d a m u s t i n e p l u s r i t u x i m a bv e r s u sC H O P p l u s r i t u x i m a ba sf i r s t-l i n e t r e a t m e n t f o r p a t i e n t sw i t hi n d o l e n ta n d m a n t l e-c e l ll y m p h o m a s:a no p e n-l a b e l,m u l t i c e n t r e,r a n d o m i s e d,p h a s e3n o n-i n f e r i o r i t y t r i a l[J].L a n c e t,2013,381(9873):1203-1210.[11] F l i n nI W,V a n dJ R,K a h lB S,e ta l.R a n d o m i z e dt r i a lo fb e n d a m u s t i n e-r i t u x i m a b o r R-C HO P/R-C V P i n f i r s t-l i n et r e a t m e n t o f i n d o l e n tN H Lo rM C L:t h eB R I G H Ts t u d y[J].B l o o d,2014,123(19):2944-2952.[12] C h e nRW,L iH,B e r n s t e i nS H,e t a l.R Bb u t n o tR-H C V A Di s a f e a s i b l e i n d u c t i o nr e g i m e n p r i o r t oa u t o-H C Ti nf r o n t l i n eM C L:r e s u l t so fS WO G S t u d y S1106[J].B rJ H a e m a t o l, 2017,176(5):759-769.[13] M a d d o c k sK,C h r i s t i a nB,J a g l o w s k i S,e t a l.A p h a s e1/1bs t u d y o fr i t u x i m a b,b e n d a m u s t i n e,a n di b r u t i n i bi n p a t i e n t sw i t h u n t r e a t e d a n d r e l a p s e d/r e f r a c t o r y n o n-H o d g k i n l y m p h o m a[J].B l o o d,2015,125(2):242-248. [14] W i t z i g T E,L u i g iZ i n z a n iP,H a b e r m a n n TM,e ta l.L o n g-t e r ma n a l y s i s o f p h a s e I I s t u d i e s o f s i n g l e-a g e n t l e n a l i d o m i d e i n r e l a p s e d/r e f r a c t o r y m a n t l e c e l l l y m p h o m a[J].A mJH e m a t o l, 2017,92(10):E575-E583.[15] E v e H E,C a r e y S,R i c h a r d s o n S J,e t a l.S i n g l e-a g e n tl e n a l i d o m i d ei n r e l a p s e d/r e f r a c t o r y m a n t l e c e l ll y m p h o m a: r e s u l t s f r o maU K p h a s e I I s t u d y s u g g e s t a c t i v i t y a n d p o s s i b l eg e n d e r d i f f e r e n c e s[J].B r JH a e m a t o l,2012,159(2):154-163.[16] W a n g M,F a y a dL,W a g n e r-B a r t a kN,e t a l.L e n a l i d o m i d e i nc o m b i n a t i o n w i t h r i t u x i m a b f o r p a t i e n t s w i t h r e l a p s ed o rr e f r a c t o r y m a n t l e-c e l l l y m p h o m a:a p h a s e1/2c l i n i c a l t r i a l[J].L a n c e tO n c o l,2012,13(7):716-723.[17] W a n g M,S c h u s t e rS J,P h i l l i p s T,O b s e r v a t i o n a ls t u d y o fl e n a l i d o m i d ei n p a t i e n t s w i t h m a n t l e c e l ll y m p h o m a w h o r e l a p s e d/p r o g r e s s e d a f t e r o r w e r e r e f r a c t o r y/i n t o l e r a n t t oi b r u t i n i b(M C L-004)[J].J H e m a t o lO n c o l,2017,10(1):171.[18] O w e nC,B e r i n s t e i n N L,C h r i s t o f i d e s A,e ta l.R e v i e w o fB r u t o n t y r o s i n ek i n a s e i n h i b i t o r s f o r t h e t r e a t m e n t o f r e l a p s e do r r e f r a c t o r y m a n t l e c e l l l y m p h o m a[J].C u r rO n c o l,2019,26(2):e233-e240.[19] R u l eS,D r e y l i n g M,G o y A,e t a l.O u t c o m e s i n370p a t i e n t sw i t h m a n t l ec e l l l y m p h o m at r e a t e d w i t hi b r u t i n i b:a p o o l e da n a l y s i sf r o m t h r e eo p e n-l ab e ls t u d i e s[J].B rJ H a e m a t o l,2017,179(3):430-438.[20] W a n g M L,R u l eS,M a r t i n P,e ta l.T a r g e t i n g B T K w i t hi b r u t i n i b i n r e l a p s e d o r r e f r a c t o r y m a n t l e-c e l l l y m p h o m a[J].NE n g l JM e d,2013,369(6):507-516.[21] W a n g M,G o y A,M a r t i n P,e ta l.E f f i c a c y a n ds a f e t y o fs i n g l e-a g e n t i b r u t i n i bi n p a t i e n t s w i t h m a n t l ec e l l l y m p h o m aw h o p r o g r e s s e da f t e rb o r t e z o m i dt h e r a p y[J].B l o o d,2014, 124:4471.[22] D r e y l i n g M,J u r c z a k W,J e r k e m a n M,e t a l.I b r u t i n i bv e r s u st e m s i r o l i m u s i n p a t i e n t sw i t h r e l a p s e d o r r e f r a c t o r y m a n t l e-c e l l l y m p h o m a:a n i n t e r n a t i o n a l,r a n d o m i s e d,o p e n-l a b e l,p h a s e3s t u d y[J].L a n c e t,2016,387(10020):770-778. [23] M a d d o c k sK,C h r i s t i a nB,J a g l o w s k i S,e ta l.A p h a s e1/1bs t u d y o fr i t u x i m a b,b e n d a m u s t i n e,a n di b r u t i n i bi n p a t i e n t sw i t h u n t r e a t e d a n d r e l a p s e d/r e f r a c t o r y n o n-H o d g k i n l y m p h o m a[J].B l o o d,2015,125(2):242-248.[24] W a n g M L,L e e H,C h u a n g H,W a g n e r-B a r t a k N,e ta l.I b r u t i n i b i n c o m b i n a t i o n w i t h r i t u x i m a b i n r e l a p s e d o rr e f r a c t o r y m a n t l e c e l l l y m p h o m a:a s i n g l e-c e n t r e,o p e n-l a b e l, p h a s e2t r i a l[J].L a n c e tO n c o l,2016,17(1):48-56. [25]J e r k e m a n M,E s k e l u n dC W,H u t c h i n g s M,e ta l.I b r u t i n i b,l e n a l i d o m i d e,a n dr i t u x i m a bi nr e l a p s e do rr e f r a c t o r y m a n t l ec e l ll y m p h o m a(P H I L E MO N):a m u l t i c e n t r e,o p e n-l a b e l,s i n g l e-a r m,p h a s e2t r i a l[J].L a n c e tH a e m a t o l,2018,5(3): e109-e116.[26] W a n g M,R u l eS,Z i n z a n i P L,e t a l.A c a l a b r u t i n i b i n r e l a p s e do r r e f r a c t o r y m a n t l e c e l l l y m p h o m a(A C E-L Y-004):a s i n g l e-a r m,m u l t i c e n t r e,p h a s e2t r i a l[J].L a n c e t,2018,391(10121):659-667.[27] D a v i d sM S,R o b e r t sAW,S e y m o u r J F,e t a l.P h a s e I f i r s t-i n-h u m a n s t u d y o f v e n e t o c l a x i n p a t i e n t s w i t h r e l a p s e d o rr e f r a c t o r y n o n-H o d g k i n l y m p h o m a[J].J C l i nO n c o l,2017,35(8):826-833.[28] T a m C,A n d e r s o n M,P o t t C,e t a l.I b r u t i n i b p l u s v e n e t o c l a xf o r t h e t r e a t m e n t o fm a n t l e-c e l l l y m p h o m a[J].NE ng l JM e d,2018,378(13):1211-1223.[29]J u n eC H,S a d e l a i n M.C h i m e r i c a n t i g e nr e c e p t o r t h e r a p y[J].NE n g l JM e d,2018,379(1):64-73.[30] P a r kJ H,G e y e r M B,B r e n t j e n sR J.C D19-t a r g e t e dC A R T-c e l lt h e r a p e u t i c sf o r h e m a t o l o g i c m a l i g n a n c i e s:i n t e r p r e t i n gc l i n i c a l o u t c o m e s t od a t e[J].B l o o d,2016,127(26):3312-3320.[31] W a n g M,G o r d o n L I,P a l o m b a M L,e t a l.S a f e t y a n dp r e l i m i n a r y e f f i c a c y i n p a t i e n t s(p t s)w i t hr e l a p s e d/r e f r a c t o r y(R/R)m a n t l ec e l l l y m p h o m a(M C L)r e c e i v i n g l i s o c a b t a g e n em a r a l e u c e l(L i s o-c e l)i n T R A N S C E N D N H L001[J].JC l i nO n c o l37,2019(s u p p l;a b s t r7516).收稿日期:2019-06-19编辑:张卫国㊃815㊃‘临床荟萃“2019年6月20日第34卷第6期 C l i n i c a l F o c u s,J u n e20,2019,V o l34,N o.6Copyright©博看网. All Rights Reserved.。
来那度胺——精选推荐

来那度胺来那度胺是由美国新基⽣物制药公司开发的抗肿瘤药物,2006年获FDA批准上市,商品名为Revlimid(瑞复美)。
⽤于治疗⾻髓增⽣异常综合症(MDS)、多发性⾻髓瘤(MM),并扩展⽤于淋巴瘤的治疗。
瑞复美是新基公司的拳头产品,已在全世界70个国家获批。
2013年 6 ⽉22 ⽇新基公司宣布瑞复美正式在中国上市。
临床研究证实,瑞复美在多发性⾻髓瘤患者治疗中展⽰了⾼有效性和⾼安全性,可有效延长中国多发性⾻髓瘤患者的⽣存期,并提⾼患者的⽣活质量。
最新数据显⽰,2012年全球瑞复美销售⾦额已达到了37亿美元的市场规模,同⽐上⼀年增长了15.34%(见附图);成为与瑞⼠诺华的治疗慢性粒细胞⽩⾎病药物伊马替尼的同类品种。
2012年6⽉,北京双鹭药业⾸仿的来那度胺已获得CFDA的3.1类新药⼀期临床试验批件。
临床试验结果已展现出它是⼀个众望所期的药物,其双重作⽤机制和⼝服制剂的优势,提⾼了患者的依从性,有较⾼的性价⽐,改善⾻髓增⽣异常综合症和多发性⾻髓瘤患者的⽣存状况。
双鹭的美国同⾏新基公司-----10⼏年间上涨百倍的顶级⽜股是美国最顶级的⽜股,10⼏年上涨超百倍。
市值正在向千亿美元进军。
赛尔也叫新基或者细胞基因,是10⼏年间上百倍的顶级⽜股,新基主打药品是来那度胺,是孤品化学类药。
现今市值是714亿⼑,⽬前⽆量新⾼,将维持⼀波新的可观⾏情。
国内最与之相似或关联的就是双鹭(002038),市值才30亿⼑。
不过,002038上市以来已经涨了⼗倍多,再涨⼀个⼗倍也是百倍双鹭的美国同⾏新基公司-----10⼏年间上涨百倍的顶级⽜股奇迹会出现吗?来那度胺⼀、药物基本信息【通⽤名】来那度胺【英⽂名】Lenalidomide【商品名】Revlimid化学名:3-(7-氨基-3-氧代-1H-异吲哚-2-基)哌啶-2,6-⼆酮分⼦式:C13H13N3O3分⼦量:259.26结构式:CAS:191732-72-6剂型:胶囊规格:5mg,10mg,15mg,25mg。
套细胞淋巴瘤诊断与治疗中国专家共识(完整版)

套细胞淋巴瘤诊断与治疗中国专家共识(完整版)套细胞淋巴瘤(mantle cell lymphoma, MCL)是一种B细胞淋巴瘤亚类,占非霍奇金淋巴瘤(NHL)的6%~8%[1]。
由于其独特的组织形态学、免疫表型及细胞遗传学特征而广受关注。
随着研究的深入,MCL 的生物学行为、诊断标准、治疗原则等均已较成熟。
由于临床少见,国内对MCL的研究尚处于初期阶段,对其诊断和治疗存在认识的不统一性和不规范性,中国抗癌协会血液肿瘤专业委员会、中华医学会血液学分会以及中国抗淋巴瘤联盟组织国内相关的血液肿瘤与血液病理学专家经过多次讨论,制订本版中国MCL诊断与治疗专家共识,供相关医务工作者临床应用参考。
一、定义MCL是起源于淋巴结套区的B细胞淋巴瘤,细胞遗传学t (11;14)(q13;q32)异常导致Cyclin D1核内高表达是其特征性标志;患者以老年男性为主,结外侵犯常见,兼具侵袭性淋巴瘤的侵袭性和惰性淋巴瘤的不可治愈性特点。
二、诊断、鉴别诊断、分期和预后(一)诊断1.MCL的临床特征:中位发病年龄约60岁,男、女比例为2~4∶1。
80%以上的患者诊断时处于疾病晚期(Ann Arbor Ⅲ~Ⅳ期),表现为淋巴结肿大、肝脾肿大及骨髓受累,其他常见的结外受累部位为胃肠道和韦氏环,部分患者有明显的淋巴细胞增多,类似于慢性(或幼)淋巴细胞白血病。
应用流式细胞术检测则几乎所有患者均有外周血/骨髓受累。
2.组织形态学特征:MCL主要发生于淋巴结或脾脏滤泡的套细胞区。
典型的MCL常由形态单一、小到中等大小淋巴细胞构成,核不规则,染色质浓聚、核仁不明显,胞质较少。
10%~15%的MCL细胞形态呈"母细胞样变" ,母细胞变异型又可分为经典性母细胞变异型和多形性母细胞变异型,这些患者临床侵袭性较高,预后差。
组织病理学表现为淋巴结呈弥漫性、结节状、套区型或少数的滤泡性生长模式。
少部分患者仅仅侵犯淋巴结套区的内套层内或仅表现为套区变窄,称之为原位套细胞肿瘤(ISMCN)。
老年套细胞淋巴瘤患者的治疗进展

老年套细胞淋巴瘤患者的治疗进展摘要:套细胞淋巴瘤(MCL)是一种罕见的B细胞淋巴瘤,发病率约占非霍奇金淋巴瘤(NHL)的3%~10%,愈后不良。
MCL患者的治疗需综合考虑,主要以药物联合化疗为主。
奥布替尼作为一种新药,是新型高选择性的不可逆布鲁顿酪氨酸激酶(BTK)抑制剂,BTK靶标占有率高,为患者的治疗提供了便利。
本文就奥布替尼在治疗MCL的临床研究进展作一综述。
关键词:套细胞淋巴瘤;治疗;进展引言近年来,关于MCL治疗方面的研究取得了较大进展,CD20单抗作为诱导缓解的药物被纳入一线治疗方案,以伊布替尼为代表的Bruton酪氨酸激酶(BTK)抑制剂也被证实在MCL中有良好的效果。
对于年龄﹤65岁的患者,基础健康水平相对较好,推荐的标准治疗方案包括高剂量阿糖胞苷、CD20单抗为基础的诱导缓解治疗,以及随后的自体造血干细胞移植。
但对于﹥65岁的老年MCL患者,通常基础健康水平欠佳,合并症多,预后不良,并不能良好地耐受上述方案,因此老年MCL患者的治疗依然是一个巨大的挑战。
1MCL发病机制及治疗MCL起源于淋巴结套区。
MCL占所有淋巴瘤的5%。
中老年人易发,男性多见,中位发病年龄60~65岁,目前仍无法治愈。
80%~90%的MCL患者诊断时大多已处于Ⅲ~Ⅳ期,骨髓浸润为60%~70%,消化道浸润为15%~40%,结外病变多见。
经过一线治疗后复发的患者仍需治疗,复发后无病生存期逐渐缩短。
MCL的细胞遗传学异常为t(11,14)(q13,q32),致使核内高表达细胞周期蛋白D1,这种高增殖率可能与MCL侵袭性和不良的临床预后有关。
最近的MCL生物学研究表明,B细胞受体(BCR)、核因子κB、磷酸肌醇3-激酶(PI3K)和BCL2信号通路在MCL的分子发病机制中至关重要。
MCL的诊断可通过典型的细胞形态及免疫表型,但是部分MCL患者CD5、周期蛋白D1的免疫组织化学未见阳性表达,因此还需增加其他细胞学及组织学证据来辅助诊断。
探讨来那度胺联合低剂量地塞米松治疗初诊多发性骨髓瘤的临床效果

探讨来那度胺联合低剂量地塞米松治疗初诊多发性骨髓瘤的临床效果徐孙秋 (南充市中心医院,四川南充 637000)摘要:目的 探讨来那度胺联合低剂量地塞米松对初诊多发性骨髓瘤(Multiple Myeloma,MM)的临床疗效。
方法 以2020年2月~2022年3月医院收治的60例初诊多发性骨髓瘤患者为研究对象,随机分为对照组和研究组各30例。
对照组给予来那度胺联合大剂量地塞米松进行治疗,研究组给予来那度胺联合低剂量地塞米松进行治疗,比较两组治疗效果和不良反应发生情况。
结果 两组治疗总有效率比较无显著性差异(P>0.05);研究组不良反应发生率显著低于对照组(P<0.05)。
结论 来那度胺联合低剂量地塞米松不会影响多发性骨髓瘤患者的治疗效果,且用药后的不良反应发生率较低,更具安全性。
关键词:多发性骨髓瘤;那度胺;低剂量;地塞米松;临床疗效多发性骨髓瘤(Multiple Myeloma,MM)是一种恶性浆细胞病,其肿瘤细胞起源于骨髓中的浆细胞,而浆细胞是B淋巴细胞发育到最终功能阶段的细胞[1]。
MM的发病率约为1/5万~3/10万,男女比例为1.6:1,大多患者年龄>40岁,黑人患者是白人的2倍。
MM患者的特征为骨髓浆细胞异常增生伴单克隆免疫球蛋白或轻链(M蛋白)过度生成,少数患者为不产生M蛋白的未分泌型MM[2]。
MM治疗多以药物为主,主要的药物包括免疫调节剂和蛋白酶体抑制剂。
免疫调节剂包括沙利度胺和来那度胺,沙利度胺容易导致血栓等并发症,来那度胺容易导致免疫力下降,易出现病毒性的感染;蛋白酶体抑制剂包括硼替佐米、伊沙佐米、卡非佐米,易造成消化道反应、神经毒性以及疱疹病毒感染,需联合使用抗病毒的药物[3]。
本研究以2020年2月~2022年3月医院收治的60例初诊多发性骨髓瘤患者为研究对象,探讨来那度胺联合低剂量地塞米松对初诊MM患者的临床疗效。
1资料与方法1.1 一般资料以2020年2月~2022年3月医院收治的60例初诊多发性骨髓瘤患者为研究对象,随机分为对照组和研究组:各30例。
来那度胺联合环磷酰胺低剂量地塞米松治疗多发性骨髓瘤临床观察

来那度胺联合环磷酰胺低剂量地塞米松治疗多发性骨髓瘤临床观察【摘要】这项研究旨在评估来那度胺联合环磷酰胺低剂量地塞米松治疗多发性骨髓瘤的临床疗效和安全性。
研究采用了XX名多发性骨髓瘤患者,进行了XX个周期的治疗,并进行了详细的临床观察和评估。
结果显示,该治疗方案在多发性骨髓瘤患者中取得了显著的效果,疗效评价良好且安全性较高。
结论部分对来那度胺联合环磷酰胺低剂量地塞米松治疗多发性骨髓瘤的效果进行了评价,并展望了未来的研究方向。
这项研究为多发性骨髓瘤的治疗提供了重要的参考价值,有望为该疾病的临床治疗提供新的思路和方向。
【关键词】来那度胺、环磷酰胺、地塞米松、多发性骨髓瘤、联合治疗、临床观察、疗效评价、安全性评价、效果评价、未来展望1. 引言1.1 研究背景多发性骨髓瘤是一种常见的血液系统恶性肿瘤,通常发生在骨髓中的浆细胞,严重影响患者的生活质量。
目前治疗多发性骨髓瘤的方法主要包括化疗、放疗、干细胞移植、靶向治疗等,然而这些治疗方法常常无法完全根除肿瘤细胞,且容易引起耐药性和毒副作用。
来那度胺、环磷酰胺和地塞米松作为目前治疗多发性骨髓瘤的常用药物,各自具有一定的抗肿瘤作用,但单独应用效果有限。
本研究旨在探讨来那度胺联合环磷酰胺低剂量地塞米松在治疗多发性骨髓瘤中的临床疗效和安全性,为临床提供更有效的治疗方案。
通过研究这一联合治疗方案的作用机制,可以为多发性骨髓瘤的治疗提供新的思路和方法,提高患者的生存质量和生存率。
1.2 研究目的本研究旨在评估来那度胺联合环磷酰胺低剂量地塞米松治疗多发性骨髓瘤的临床疗效和安全性。
具体目的包括:1. 观察来那度胺联合环磷酰胺低剂量地塞米松对多发性骨髓瘤患者的总体生存率、无进展生存率、疾病缓解率等临床疗效指标的影响。
2. 比较来那度胺联合环磷酰胺低剂量地塞米松与传统治疗方案在多发性骨髓瘤患者中的疗效差异,验证联合治疗的优势。
2. 正文2.1 研究方法研究方法主要包括研究设计、入选标准、排除标准、对照组设置、药物给药方案、随访方法等内容。
多发性骨髓瘤疾病实施来那度胺联合环磷酰胺和低剂量地塞米松治疗的效果分析

DOI:10.19368/ki.2096-1782.2023.24.161多发性骨髓瘤疾病实施来那度胺联合环磷酰胺和低剂量地塞米松治疗的效果分析丁静,孙杉杉,张学瑞寿光市人民医院血液科,山东潍坊262700[摘要]目的探究来那度胺+环磷酰胺+低剂量地塞米松对多发性骨髓瘤的效果。
方法选取2022年10月—2023年10月寿光市人民医院收治的68例多发性骨髓瘤患者为研究对象,按照随机数表法分为比照组和实践组,各34例,比照组行常规治疗,实践组行来那度胺+环磷酰胺+低剂量地塞米松治疗,对比两组临床指标、缓解率、免疫功能、不良反应发生情况。
结果治疗后,实践组的M-蛋白、β2-微球蛋白以及髓浆细胞比例均低于比照组,差异有统计学意义(P均<0.05)。
实践组缓解率(94.12%)高于比照组(73.53%),差异有统计学意义(χ2=5.314,P<0.05)。
治疗后,实践组检测CD3+、CD4+高于比照组,差异有统计学意义(P均<0.05)。
实践组消化道反应率、血小板下降率、嗜睡率均低于比照组,差异有统计学意义(P均<0.05)。
结论来那度胺+环磷酰胺+低剂量地塞米松的方案能提升免疫反应,降低骨髓浆细胞比例,有效提升缓解率,且其不良反应少,能维持高抗肿瘤安全性,恢复代谢状态,改善多发性骨髓瘤预后。
[关键词]来那度胺;缓解率;地塞米松;不良反应;环磷酰胺;临床指标;多发性骨髓瘤[中图分类号]R733.3 [文献标识码]A [文章编号]2096-1782(2023)12(b)-0161-04Analysis of the Effect of Implementing Lenalidomide Combined with Cy⁃clophosphamide and Low-dose Dexamethasone Therapy in Multiple My⁃eloma DiseaseDING Jing, SUN Shanshan, ZHANG XueruiDepartment of Hematology, Shouguang People's Hospital, Weifang, Shandong Province, 262700 China[Abstract] Objective To investigate the effect of lenalidomide + cyclophosphamide + low-dose dexamethasone on multiple myeloma. Methods 68 patients with multiple myeloma admitted to Shouguang People's Hospital from Octo⁃ber 2022 to October 2023 were selected as the study objects, and they were divided into comparison group and prac⁃tice group according to random number table method, with 34 cases in each group. The comparison group received conventional treatment, and the practice group received treatment with lanalidomide + cyclophosphanide + low-dose dexamethasone. Clinical indicators, remission rate, immune function and occurrence of adverse reactions were com⁃pared between the two groups. Results After treatment, the proportions of M-protein, β2-microglobulin and pulp cells in practice group were lower than those in comparison group, and the difference were statistically significant (all P< 0.05). The remission rate in the practice group (94.12%) was higher than that in the comparison (73.53%), and the dif⁃ference was statistically significant (χ2=5.314, P<0.05). After treatment, the detection of CD3+and CD4+in practice group were higher than those in comparison group, and the differences were statistically significant (both P<0.05). The digestive tract reaction rate, platelet decline rate and lethargy rate of the practice group were lower than those of the comparison group, and the differences were statistically significant (all P<0.05). Conclusion The regimen of lenalido⁃mide + cyclophosphamide + low-dose dexamethasone can enhance the immune response, reduce the proportion of bone marrow plasma cells, and effectively enhance the remission rate, and it has few adverse reactions, which main⁃[作者简介] 丁静(1986-),女,硕士,主治医师,研究方向为血液病。
2020-2021高危MCL的诊断及治疗(完整版)

2020-2021高危MCL的诊断及治疗(完整版)套细胞淋巴瘤(mantle cell lymphoma, MCL)是B细胞淋巴瘤亚类,占非霍奇金淋巴瘤(NHL)的6%-8%。
由于其独特的组织形态学、免疫表型及细胞遗传学特征而广受关注。
随着研究的深入,MCL的生物学行为、诊断标准、治疗原则等均已较成熟,其治疗正从完全依赖免疫化疗发展为靶向药物单药或联合用药的治疗模式转变,这些发展为合理制定可能实现MCL治愈的策略提供重要基础。
然而,高危MCL患者对实现这一目标提出重大挑战。
MCL发病中位年龄为68岁,由于这种固有的病程异质性,MCL患者的危险因素对于预测预后和指导治疗至关重要。
大约65%的患者属于简易套细胞淋巴瘤国际预后评分系统(MIPI)中的低危组和中危组,其5年总生存(OS)率分别83%和63%,而高危组5年OS率只有34%。
随着时间发展,从低危组开始的疾病可能会变成高危组疾病,疾病危险因素对患者的病程及OS意义重大。
此外,服用BTK抑制剂进展的患者同样是临床的一大挑战。
本文旨在讨论2020年高危MCL的临床管理。
高危因素01一般状况差临床试验入组的患者通常一般状况良好,而真实世界的研究数据表明,一般状况差或者合并多种基础病的患者生存率较差。
一项针对1385例MCL患者的研究数据显示,中位年龄71岁,一般体能状况差的患者淋巴瘤相关中位生存期为4年,明显低于无基础疾病及体能状况好的患者。
并且这些因素也限制了自体造血干细胞移植(ASCT)的应用。
在病理类型为侵袭性MCL的患者中,体能状况差的患者预后也差。
02中枢神经系统侵犯中枢神经系统侵犯MCL(CNS MCL)患者预后较差,多项回顾性研究数据表明,该部分患者的中位生存期约为3-8个月。
最近的一项回顾性研究数据显示,与常规免疫化疗相比,接受伊布替尼治疗的患者生存率较高,1年无进展生存(PFS)率分别为49%和6%。
目前尚无治疗手段可以有效预防中枢神经系统复发。
来那度胺联合化疗治疗多发性骨髓瘤护理干预效果

来那度胺联合化疗治疗多发性骨髓瘤护理干预效果摘要:目的:研究分析来那度胺联合化疗治疗多发性骨髓瘤护理干预效果。
方法:病例筛选时间2016年10月份-2018年1月份,收治多发性骨髓瘤实施来那度胺联合化疗治疗的患者54例为本次研究对象,对照组患者实施优质护理,研究中患者在此基础上实施心理护理,比较两组患者护理前后心理情绪变化。
结果:两组SAS,SDS评分经护理干预后均不同程度的降低,研究组下降幅度更大,组间比较有差异,P<0.05,有统计学意义。
结论:来那度胺联合化疗治疗多发性骨髓瘤在优质护理的基础上开展心理护理,有效疏导患者的不良情绪,积极配合治疗护理,值得临床推广。
关键词:来那度胺;化疗;多发性骨髓瘤;护理;效果多发性骨髓瘤是一种浆细胞恶性增生性的血液肿瘤,目前治疗该病的主要方式采用化疗的方式;化疗在一定程度上对患者病情进行控制,延长患者的生存时间,但是化疗产生的毒副作用对患者的躯体的影响也导致患者心理情绪的变化。
本文主要研究分析来那度胺联合化疗治疗多发性骨髓瘤护理干预效果,病例筛选时间2016年10月份-2018年1月份,收治多发性骨髓瘤实施来那度胺联合化疗治疗的患者54例为本次研究对象,现将研究资料整理并作如下报道。
1资料与方法1.1基本资料病例筛选时间2016年10月份-2018年1月份,收治多发性骨髓瘤实施来那度胺联合化疗治疗的患者54例为本次研究对象,所有患者均知情且同意。
按照数字随机法将患者分成两组,每组27例,收集两组患者的基本资料比较无明显差异,P>0.05,无统计学意义。
1.2方法对照组患者实施优质护理,研究中患者在此基础上实施心理护理,具体如下:在术前多和患者交流,多站在患者的角度进行工作,从护理细节出发,在眼神、话语、动作等方面充分表达对患者的关心;鼓励患者表达自己的想法,尽量满足其合理的需求,传授给患者进行心理调节、身体放松的正确方法,鼓励患者进行正确的自我调节。
来那度胺在复发难治性非霍奇金B细胞淋巴瘤治疗中的应用

来那度胺在复发难治性非霍奇金B细胞淋巴瘤治疗中的应用贝丽叶;史玉叶;王春玲【摘要】复发难治性非霍奇金淋巴瘤(RR-NHL)患者总体预后不佳.越来越多的新药与靶向药应用于临床以改善RR-NHL的生存.来那度胺因具有免疫调节、抑制血管生成、直接抗肿瘤活性等作用,被用于NHL多种亚型的治疗,无论是初诊或难治复发,均取得了较好的疗效,尤其在B细胞淋巴瘤中.本文就来那度胺在复发难治性非霍奇金B细胞淋巴瘤(RR B-NHL)中的应用进展进行综述.【期刊名称】《临床荟萃》【年(卷),期】2019(034)006【总页数】6页(P508-513)【关键词】淋巴瘤,非霍奇金;来那度胺;预后;药物疗法【作者】贝丽叶;史玉叶;王春玲【作者单位】南京医科大学附属淮安第一医院血液科,江苏淮安 223300;南京医科大学血液病研究重点实验室,江苏淮安 223300;南京医科大学附属淮安第一医院血液科,江苏淮安 223300;南京医科大学血液病研究重点实验室,江苏淮安 223300;南京医科大学附属淮安第一医院血液科,江苏淮安 223300;南京医科大学血液病研究重点实验室,江苏淮安 223300【正文语种】中文【中图分类】R551.2王春玲,医学博士,主任医师,副教授,硕士研究生导师,淮安市第一人民医院血液科科主任。
江苏省血液学会骨髓瘤、淋巴瘤学组委员,淮安市血液学会副主任委员,江苏省研究型医院学会白血病和骨髓增生异常综合征专业委员会委员,江苏省“333”工程第三层次人才,江苏省六大高峰人才。
曾于意大利锡耶纳大学综合医院、美国约翰霍普金斯大学医院研修。
近年发表论文20余篇,其中SCI论文7篇。
主持省市课题7项,获省市级奖项5项。
研究方向:恶性血液病的发病机制及靶向治疗。
非霍奇金淋巴瘤(NHL)约85%的病例起源于B细胞,B细胞中常见的类型是弥漫性大B细胞淋巴瘤(DLBCL),占25%~35%,滤泡性淋巴瘤(FL)约20%,及套细胞淋巴瘤(MCL)6%~8%[1- 2]。
来那度胺(国产来那度胺效果怎样)

原创不容易,【关注】店铺,不迷路!
来那度胺可以治疗哪些癌症?
赖利多胺,又名纳丁,又名瑞酰亚胺,是美国Celgene生物制药公司开发的抗肿瘤药物。
2006年经FDA正式批准,具有抗肿瘤、免疫调节、抗血管生成等多种功能。
利奈度胺可以治疗多种癌症:
2005年12月,FDA批准来那度胺用于骨髓异常增生综合征(MDS)的治疗。
2006年6月,FDA批准来那度胺应用于多发性骨髓瘤(MM)的治疗。
2008年,FDA批准瑞多米特联合地塞米松治疗至少接受过一次治疗的多发性骨髓瘤患者。
2013年3月批准其用于套细胞淋巴瘤(MCL)的治疗。
2015年批准地塞米松一线治疗多发性骨髓瘤。
2017年02月雷利度胺(Revlimid)10mg胶囊被批准用于多发性骨髓瘤患者接受自体同源干细胞移植(auto-HSCT)后的维持治疗。
从以上申请批准,我们可以看出瑞多米特被广泛使用的原因。
可治疗多种血
液疾病,并可搭配丰富的治疗方案。
注意:地图来源于网络,被入侵和删除
江苏大学
【素材积累】
阿达尔切夫说过:“生活如同一根燃烧的火柴,当你四处巡视以确定自己的位置时,它已经燃完了。
”有选择就会有错误,有错误就会有遗恨,但即使第一步错了,只要及时地发现并纠正,未必步步都错下去。
峰回路转,柳暗花明,路断尘埃的时候,自己给自己一双翅膀;厄运突降的时候,自己给自己一个微笑;雨雪连绵的时候,自己给自己一份责任和梦想。
天下路都是相连的,沿着心中的路坚定地走下去,同样能抵达你想要去的地方。
FDA批准来那度胺治疗复发性套细胞淋巴瘤

FDA批准来那度胺治疗复发性套细胞淋巴瘤
佚名
【期刊名称】《国际药学研究杂志》
【年(卷),期】2013(40)4
【摘要】细胞基因公司宣布FDA已批准其来那度胺(1enalidomide)的补充新药申请用于治疗先前已经2次治疗,包括波替单抗(硼替佐米,bortezomib)治疗而复发的套细胞淋巴瘤(MCL)。
批准根据Ⅱ期临床MCL-00I试验结果,此试验是多中心、单一组、开放研究,
【总页数】1页(P414-414)
【关键词】套细胞淋巴瘤;FDA批准;来那度胺;复发性;治疗;新药申请;细胞基因;硼替佐米
【正文语种】中文
【中图分类】R733.4
【相关文献】
1.FDA批准首例用于治疗巨细胞动脉炎药物Actemra/FDA批准首个治疗ADHD 仿制药/FDA批准Ceritinib用于一线治疗ALK阳性的转移性非小细胞肺癌 [J],
2.艾地利西获FDA批准用于治疗白血病复发、滤泡B细胞非霍奇金淋巴瘤和小淋巴细胞淋巴瘤 [J], 赵文丽
3.FDA批准来那度胺治疗套细胞淋巴瘤 [J], 张翼译
4.美国FDA批准Brukinsa(zanubrutinib/泽布替尼)用于治疗套细胞淋巴瘤 [J], 夏训明(编译)
5.来那度胺联合利妥昔单抗及地塞米松方案治疗难治复发性套细胞淋巴瘤的临床疗效观察 [J], 刘锋;杜明珠;高飞;戴进前;杨锦才;宋艳萍
因版权原因,仅展示原文概要,查看原文内容请购买。
来那度胺联合环磷酰胺低剂量地塞米松治疗多发性骨髓瘤临床观察

来那度胺联合环磷酰胺低剂量地塞米松治疗多发性骨髓瘤临床观察多发性骨髓瘤是一种常见的恶性肿瘤,治疗多发性骨髓瘤的方法多种多样。
来那度胺联合环磷酰胺低剂量地塞米松治疗多发性骨髓瘤的疗效如何呢?下面我们将进行一项关于该治疗方案的临床观察。
1. 研究目的2. 研究方法选取了来自我院的60例多发性骨髓瘤患者,均符合国际多发性骨髓瘤工作组(IMWG)的诊断标准,并且未接受过治疗。
患者年龄范围为45~75岁,其中男性34例,女性26例。
所有患者均接受了来那度胺联合环磷酰胺低剂量地塞米松的治疗方案,治疗周期为6个月。
3. 研究结果经过6个月的治疗后,所有患者的血清蛋白电泳检测显示,白蛋白、球蛋白和γ球蛋白水平均有不同程度的下降,其中γ球蛋白平均下降率达到65%。
骨髓穿刺检查显示,多数患者的骨髓浆细胞比例下降明显,少数患者骨髓浆细胞得到完全清除。
临床症状方面,所有患者的骨痛、贫血、骨折等症状得到明显缓解。
4. 治疗安全性在本研究中,来那度胺联合环磷酰胺低剂量地塞米松治疗多发性骨髓瘤的不良事件较少且轻微,主要包括恶心、呕吐、腹泻、贫血等,均可通过对症处理缓解。
没有发生严重的药物相关性的心血管、消化道及神经系统不良事件。
5. 结论本研究表明,来那度胺联合环磷酰胺低剂量地塞米松治疗多发性骨髓瘤具有较好的疗效和安全性。
该治疗方案可有效降低患者的γ球蛋白水平,缓解临床症状,提高生活质量,且不良事件较少。
来那度胺联合环磷酰胺低剂量地塞米松可作为治疗多发性骨髓瘤的一线方案。
但由于本研究的样本量较少,仍需要进行大规模的临床研究来进一步验证其疗效和安全性。
来那度胺联合环磷酰胺低剂量地塞米松治疗多发性骨髓瘤的临床观察结果是积极的。
希望这一疗法能够为多发性骨髓瘤患者的治疗提供更多的选择,为他们带来更好的治疗效果。
也呼吁更多的医学研究者参与到多发性骨髓瘤治疗方案的研究中,共同为患者的健康贡献力量。
肿瘤微环境与非霍奇金淋巴瘤的发病与耐药
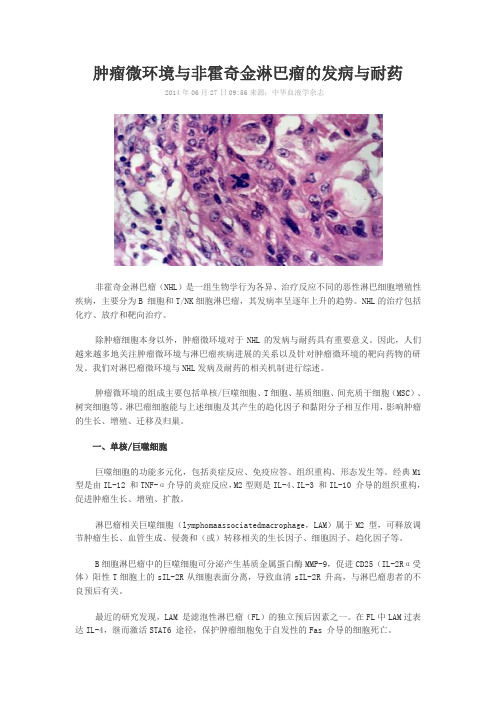
肿瘤微环境与非霍奇金淋巴瘤的发病与耐药2014年06月27日09:56来源:中华血液学杂志非霍奇金淋巴瘤(NHL)是一组生物学行为各异、治疗反应不同的恶性淋巴细胞增殖性疾病,主要分为B 细胞和T/NK细胞淋巴瘤,其发病率呈逐年上升的趋势。
NHL的治疗包括化疗、放疗和靶向治疗。
除肿瘤细胞本身以外,肿瘤微环境对于NHL的发病与耐药具有重要意义。
因此,人们越来越多地关注肿瘤微环境与淋巴瘤疾病进展的关系以及针对肿瘤微环境的靶向药物的研发。
我们对淋巴瘤微环境与NHL发病及耐药的相关机制进行综述。
肿瘤微环境的组成主要包括单核/巨噬细胞、T细胞、基质细胞、间充质干细胞(MSC)、树突细胞等。
淋巴瘤细胞能与上述细胞及其产生的趋化因子和黏附分子相互作用,影响肿瘤的生长、增殖、迁移及归巢。
一、单核/巨噬细胞巨噬细胞的功能多元化,包括炎症反应、免疫应答、组织重构、形态发生等。
经典M1型是由IL-12 和TNF-α介导的炎症反应,M2型则是IL-4、IL-3 和IL-10 介导的组织重构,促进肿瘤生长、增殖、扩散。
淋巴瘤相关巨噬细胞(lymphomaassociatedmacrophage,LAM)属于M2 型,可释放调节肿瘤生长、血管生成、侵袭和(或)转移相关的生长因子、细胞因子、趋化因子等。
B细胞淋巴瘤中的巨噬细胞可分泌产生基质金属蛋白酶MMP-9,促进CD25(IL-2Rα受体)阳性T细胞上的sIL-2R从细胞表面分离,导致血清sIL-2R 升高,与淋巴瘤患者的不良预后有关。
最近的研究发现,LAM 是滤泡性淋巴瘤(FL)的独立预后因素之一。
在FL中LAM过表达IL-4,继而激活STAT6 途径,保护肿瘤细胞免于自发性的Fas 介导的细胞死亡。
FL 巨噬细胞还能释放免疫抑制分子IL4I1,抑制T 细胞的增殖与应答,引起局部免疫逃逸。
同时LAM 分泌IFN-γ,通过上调STAT1 表达增加巨噬细胞的迁移。
套细胞淋巴瘤(MCL)中亦常伴大量巨噬细胞,高水平巨噬细胞的患者中肿瘤细胞有丝分裂和原始淋巴样细胞比例更多。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Combined Lenalidomide,Low-Dose Dexamethasone,and Rituximab Achieves Durable Responses in Rituximab-Resistant Indolent and Mantle Cell Lymphomas T ahamtan Ahmadi,MD,PhD1;Elise A.Chong,MD1;Amanda Gordon,BSN,CRNP1;Nicole A.Aqui,MD1;Sunita D.Nasta,MD1;Jakub Svoboda,MD1;Anthony R.Mato,MD,MSCE2;and Stephen J.Schuster,MD1BACKGROUND:Lenalidomide is an immunomodulatory drug with effects on the immune system that may enhance antibody-dependent cell-mediated cytotoxicity and reverse tumor-induced immune suppression.Furthermore,single-agent lenalidomide has therapeutic activity in relapsed/refractory B-cell lymphomas.These immunologic effects potentially may enhance the action of rituxi-mab.METHODS:T o test the efficacy of lenalidomide combined with rituximab,the authors conducted a phase2trial of lenalidomide, low-dose dexamethasone,and rituximab in patients who had rituximab-resistant,relapsed/refractory,indolent B-cell or mantle cell lymphomas.Patients received two28-day treatment cycles of lenalidomide10mg daily and dexamethasone8mg once weekly(partI).During cycle3,4weekly doses of rituximab375mg/m2were administered with lenalidomide-dexamethasone(part II).After thepart II response assessment,stable or responding patients continued to receive lenalidomide-dexamethasone.RESULTS:Twenty-seven patients with follicular(n518),mantle cell(n55),small lymphocytic(n53),and marginal zone(n51)lymphomas started ther-apy;3of27patients discontinued therapy because of adverse events and were not evaluable for response.For24patients,the over-all response rate after part I was29%(4patients had a complete response[CR]or CR unconfirmed,and3patients had a partial response),and the overall response rate after part II was58%(8patients had a CR,and6patients had a partial response).For27 patients,at a median follow-up of12.2months,the median progression-free survival was23.7months.CONCLUSIONS:The combina-tion of lenalidomide,low-dose dexamethasone,and rituximab achieved high response rates with durable responses in patients with rituximab-resistant,indolent B-cell and mantle cell lymphomas.Overall response rate increased from29%after two28-day cycles of lenalidomide and low-dose dexamethasone to58%after the addition of rituximab,suggesting that lenalidomide can overcome resist-ance to rituximab.Cancer2014;120:222–8.V C2013American Cancer Society.KEYWORDS:non-Hodgkin lymphoma,lymphoma,low-grade,lenalidomide,rituximab,follicular lymphoma,immunomodulation,immu-nomodulatory therapy.INTRODUCTIONThe addition of rituximab to chemotherapy improves clinical outcomes for patients with low-grade B-cell lymphomas, and the inclusion of rituximab in treatment regimens is considered the standard of care for B-cell non-Hodgkin lympho-mas.1,2Unfortunately,many patients who receive rituximab-chemotherapy or rituximab monotherapy eventually relapse and develop resistance to rituximab or to rituximab-containing combination therapies.In our experience,the5-year over-all survival(OS)for patients with low-grade follicular lymphoma who fail to respond to or develop resistance to rituximab or a rituximab-containing treatment regimen is58%,3which is markedly decreased compared with the reported survival for all patients with follicular lymphoma.4Thus,there is considerable incentive to overcome resistance to rituximab.Lenalidomide is an immunomodulatory drug with effects on the immune system that may enhance antibody-dependent cell-mediated cytotoxicity and reverse tumor-induced immune suppression.5,6These immunologic effects could potentially enhance the action of rituximab.Furthermore,single-agent lenalidomide has demonstrated therapeutic activity in relapsed or refractory B-cell lymphomas,7,8including follicular lymphoma and mantle cell lymphoma.9,10 Corresponding author:Stephen J.Schuster,MD,Perelman Center for Advanced Medicine,2West Pavilion,Room2-393S,3400Civic Center Boulevard,Philadel-phia,PA19104;Fax:(215)662-4064;stephen.schuster@1Lymphoma Program,Abramson Cancer Center of the University of Pennsylvania,Philadelphia,Pennsylvania;2Chronic Lymphocytic Leukemia Program,John The-urer Cancer Center,Hackensack University Medical Center,Hackensack,New Jersey.The first two authors contributed equally to this work.The authors thank Frannie and Jim Maguire and Margarita Louis-Dreyfus for their support of the Lymphoma Program at the Abramson Cancer Center of the Uni-versity of Pennsylvania.DOI:10.1002/cncr.28405,Received:July8,2013;Revised:August11,2013;Accepted:August26,2013,Published online October7,2013in Wiley Online Library()Preclinical studies have demonstrated the potential for synergy between lenalidomide and rituximab,both in vitro and in murine B-cell lymphoma models.5,11–13In vitro,after pretreatment with lenalidomide,rituximab produced more growth inhibition11and greater apoptosis compared with rituximab alone.11,12This combination also demonstrably enhanced the natural killer cell, antibody-dependent cellular cytotoxicity of rituximab.12,13 To test the efficacy of lenalidomide combined with rituximab,we conducted a phase2clinical trial in patients with indolent B-cell or mantle cell lymphomas who were previously resistant or refractory to rituximab or rituximab-based therapy.Low-dose,weekly dexametha-sone was added to the regimen based on anecdotal clinical experience suggesting the amelioration of lenalidomide side effects,especially rash and tumor flare,as well as the known synergy between corticosteroids and immunomo-dulatory drugs.14MATERIALS AND METHODSThis was a single-center,prospective,open-label,phase2 study examining the combination of lenalidomide,low-dose dexamethasone,and rituximab in patients with previously treated,rituximab-refractory or resistant,in-dolent B-cell or mantle cell lymphomas.The study was conducted in accordance with the Declaration of Helsinki and was approved by the institutional review board of the University of Pennsylvania.All patients provided written informed consent before study entry.The clinical trial registration number was NCT00783367(available at:)under the approved registry name“Combination Therapy Using Lenalidomide(Revlimid)–Low-Dose Dexamethasone and Rituximab for Treatment of Rituximab-Resistant, Nonaggressive B-Cell Lymphomas.”Adults(aged 18years)with histologically con-firmed,CD20antigen-expressing follicular(grades1,2, and3a),marginal zone,small lymphocytic,lymphoplas-macytic,or mantle cell lymphomas were eligible.Tissue blocks were reviewed to confirm each diagnosis using the 2008World Health Organization classification criteria.15 Patients were required to have progressive lymphoma requiring therapy,a life expectancy>3months,and at least1measurable lesion( 2cm in greatest dimension). The criteria to initiate treatment on protocol required patients to have refractory or progressive lymphoma (defined as new lesions or enlargement 50%of existing lesions)within6months of rituximab monotherapy or a rituximab-chemotherapy combination.All images and response assessments were reviewed by the principal inves-tigator and a board-certified radiologist.Patients were withdrawn from the study if they experienced relapse or disease progression after having received rituximab or at the discretion of the treating physician or patient.In part I of protocol therapy,patients received oral lenalidomide10mg daily and oral dexamethasone8mg once weekly for two28-day cycles.Response evaluation (computed tomography[CT]or positron emission to-mography/CT imaging)was performed at the end of the second cycle(part I response).Patients then initiated part II of protocol therapy—cycles3through5—regardless of their response status after part I.During cycle3,in addi-tion to continuous daily lenalidomide and weekly dexa-methasone,patients received rituximab375mg/m2once weekly for4weeks.Radiologic response was reassessed2 months after completing rituximab at the end of cycle5 (part II response).Patients who demonstrated either a response or stable disease were permitted to continue receiving lenalidomide with or without dexamethasone until they developed disease progression or withdrew,but patients were not permitted to receive additional rituxi-mab while on study(Fig.1).Patients who continued receiving lenalidomide had CT or PET/CT imaging at12 months,18months,and24months after enrollment and then yearly for a maximum of5years from study entry. Lenalidomide was held for toxicity grade 3based on ver-sion3of the National Cancer Institute Common Termi-nology Criteria for Adverse Events,and it was restarted at a lower dose(either5mg daily or every other day)upon the resolution of toxicity( grade2)within28days.At the discretion of the treating physician,the dose of oral lenalidomide could also be decreased to5mg daily or5 mg every other day for lower grade symptoms possibly related to lenalidomide.All patients received either aspirin 81mg daily or warfarin for antithrombotic prophylaxis. Contraceptive counseling was performed according to the RevAssist program(Celgene Corporation,Summit,NJ).The primary study endpoint was the overall response rate(ORR)after cycle5(part II response)using interna-tional workshop response criteria for non-Hodgkin lym-phoma.16For25evaluable patients,using an a value of .05,we estimated80%power to detect an ORR of at least 50%.Secondary clinical endpoints included progression-free survival(PFS),16response duration(RD)16/time to progression(TTP),17OS,16and a detailed toxicity assess-ment using version3of the National Cancer Institute Common Terminology Criteria for Adverse Events.The Kaplan-Meier method was used to estimate PFS,RD/TTP, and OS.Statistical analyses were performed using STATA version9.2(Stata Corporation,College Station,Tex).RESULTSPatient CharacteristicsTwenty-seven patients were enrolled between July 2008and May 2010.Prior to enrollment,19patients had dis-ease progression after or during rituximab,6patients had stable disease after rituximab,and 2patients relapsed within 6months of responding to rituximab.The median time from diagnosis was 6.77years (range,0.89-26.12years).Additional characteristics of the study cohort at enrollment are presented in Table 1.Response Assessment and Survival AnalysisFor any patient who received at least 1dose of lenalido-mide (N 527),the ORR after part I was 26%,and the ORR after part II for all 27patients who started protocol therapy,even if they did not receive rituximab,was 52%.There was no difference in the response rate between patients whose rituximab resistance-defining therapy was a rituximab-chemotherapy combination,rituximab monotherapy,or rituximab maintenance (P 5.4).Twenty-four of 27patients received rituximab dur-ing cycle 3and were evaluable for response to part I (2cycles of lenalidomide and low-dose dexamethasone)and part 2(lenalidomide and low-dose dexamethasone incycles 3-5with rituximab during cycle 3).After part I,the ORR for these 24patients was 29%(complete response [CR]/CR unconfirmed [CRu]rate,17%);the ORRs were 20%for follicular lymphoma (3of 15patients),60%for mantle cell lymphoma (3of 5patients),33%for small lymphocytic lymphoma (1of 3patients),and 0%for marginal zone lymphoma (0of 1patient).After part II,the ORR for these 24patients was 58%(CR rate,33%);the ORRs were 53%for follicular lymphoma (8of 15patients),60%for mantle cell lymphoma (3of 5patients),67%for small lymphocytic lymphoma (2of 3patients),and 100%for marginal zone lymphoma (1of 1patient).Nine of 24patients (38%)demonstrated an improvement in protocol-defined response after receiving rituximab.Nineteen of 24patients (75%)continued to receive lenali-domide and weekly dexamethasone after the completion of cycle 5.Of 14patients who had stable disease or a par-tial response (PR)after completing 4weekly doses of rit-uximab (part II response assessment),only 1patient had a further improvement in response status during follow-up.As of November 10,2012,the median follow-up was 12.2months (range,0.9-52.7months),and the estimatedTABLE 1.Patient CharacteristicsCharacteristicNo.of Patients/Total No.(%)Sex Men 15(55.5)Women12(44.5)Age:Median [range],y 60[35-85]Bulky adenopathy, 5cm 10/27(37)HistologyFollicular lymphoma,grade 1or 218/27(66)Mantle cell lymphoma5/27(19)Small lymphocytic lymphoma 3/27(11)Marginal zone lymphoma 1/27(4)Bone marrow involvement 5/27(18.5)Elevated LDH6/27(22.2)No.of prior therapies:Median [range]3[1-7]Underwent prior autologous stem cell transplantation 3/27(11.1)ECOG performance status 0-126/27(96)21/27(4)Regimen-defining rituximab resistance Rituximab maintenance 10Rituximab monotherapy 10Rituximab-CHOP2Rituximab-ibritumomab tiuxetan 1Rituximab-ICE1Rituximab-hyper CVAD 1Rituximab-gemcitabine 1Rituximab-epratuzumab1Abbreviations:CHOP ,cyclophosphamide,vincristine,doxorubicin,and prednisone;hyper CVAD,cyclophosphamide,vincristine,doxorubicin,and dexamethasone alternating with high-dose methotrexate and high-dose cytarabine;ECOG,Eastern Cooperative Oncology Group;ICE,ifosfamide,carboplatin,and etoposide;LDH,lactatedehydrogenase.Figure 1.The protocol schema is illustrated.Each cycle was 28days in duration.median PFS and OS were 23.7months and not reached,respectively (Fig.2A).The RD/TTP for responding patients was 26.6months (Fig.2B).The percentage change in the sum of the products of the maximum per-pendicular,cross-sectional dimensions of target lesions in individual patients after part I (lenalidomide-dexametha-sone)and part II (lenalidomide-dexamethasone-rituxi-mab)are illustrated shown in Figure 3A through C.SafetyThe most common adverse event attributed to lenalido-mide was a mild change in bowel habits,usually increased frequency,which did not warrant discontinuation of ther-apy (grade 1).The reported grade 3or 4treatment-related adverse events were neutropenia (8of 27patients;30%),leukopenia (4of 27patients;15%),hypokalemia (4of 27patients;15%),anemia (2of 27patients;7%),hypophos-phatemia (2of 27patients;7%),thrombocytopenia (2of 27patients;7%),transaminase elevation (1of 27patients;4%),pneumonia (1of 27patients;4%),diarrhea (1of 27patients;4%),fatigue (1of 27patients;4%),rash (1of 27patients;4%),tumor flare (1of 27patients;4%),pulmo-nary embolism (1of 27patients;4%),and hyperuricemia (1of 27patients;4%).Four patients (15%)had adverse events that led to discontinuation of therapy,including 3who discontinued before part I response assessment (myo-carditis,rash,thrombocytopenia)and 1patient who dis-continued after the part II response assessment (second malignancy).Four patients (15%)had treatment inter-ruptions and dose reductions secondary to toxicity (thrombocytopenia,transaminase elevation,neutropenia,and tumor flare).One death from myocarditis occurred shortly after initiation of lenalidomide,low-dose dexamethasone.18DISCUSSIONIn this study,patients with indolent B-cell or mantle cell lymphomas who were previously resistant to rituximab-based therapy received combined lenalidomide,low-dose dexamethasone,and rituximab.The ORR and the CR rate,as well as the TTP,were superior to the results reported for retreatment with single-agent rituximab in patients who were not selected for rituximab resistance.17Although the ORR increased from 29%after 2cycles of lenalidomide plus low-dose dexamethasone to 58%after the addition of rituximab,based on the design of this single-arm trial,it was not possible to determine with certainty whether rituximab improved what would have been the response to further continuation of lenali-domide plus low-dose dexamethasone alone.However,of 20patients who ultimately had reductions in tumor vol-ume on this regimen,7patients initially had increases in their tumor volumes before the addition of rituximab (Fig.3A).This suggests a response to rituximab in these patients.In addition,of the other 13patients who ulti-mately had a reduction in tumor volume on this regimen,12had further reductions in tumor volume after receiving rituximab,which also suggests enhanced efficacy for the rituximab combination over lenalidomide plus low-dose dexamethasone alone (Fig.3A).Although a few patients had CRs after receiving lenalidomide alone,both the tim-ing and the magnitude of responses after the addition of rituximab in these previously rituximab-resistantpatientsFigure 2.Progression-free survival and response duration are illustrated.(A)This Kaplan-Meier curve illustrates progression-free survival for all enrolled patients (n 527).(B)This Kaplan-Meier curve illustrates response duration (or time to progression as defined by Davis et al 17)for all responding patients measured from the first observation of response (CR,CRu,or PR)after either part I or part II of treatment until progression (n 514).suggest that the addition of rituximab to lenalidomide improved responses over lenalidomide plus low-dose dexamethasone alone.To our,knowledge,this study is the first to describe the efficacy of combination lenalidomide,low-dose dexa-methasone,and rituximab both in patients who were uni-formly documented as resistant to rituximab and in patients with low-grade follicular lymphoma.Rituximabis a cornerstone of treatment for low-grade follicular lym-phoma,and patients with rituximab-refractory,low-grade follicular lymphoma have poorer OS compared with all patients diagnosed with follicular lymphoma.3,4Treat-ment with lenalidomide plus rituximab appears to be well tolerated and effective in patients with indolent B-cell and mantle cell lymphomas and may offer another therapeutic option for previously treated patients who have apoorFigure 3.Percentage changes in tumor measurements are illustrated for (A)all evaluable patients (n 524),(B)all evaluable patients with follicular lymphoma (n 515),and (C)all evaluable patients with mantle cell lymphoma (n 55).Asterisks in A indi-cate patients who were continuing therapy.prognosis.Lenalidomide also has the advantage of being an oral formulation.In addition,lenalidomide can be continued for years in the absence of cytopenias;the lon-gest patient we report on has received lenalidomide for over4years.Moreover,in our experience,combination lenalidomide plus low-dose dexamethasone and rituxi-mab did not interfere with the ability to administer subse-quent chemotherapy.The combination of lenalidomide and rituximab reportedly is effective in relapsed or refractory,aggressive B-cell lymphomas,including mantle cell lymphoma (ORR,57%)19;relapsed or refractory diffuse large B-cell, follicular grade3,and transformed lymphomas(ORR, 33%)20;and de novo diffuse large B-cell lymphoma (ORR,35%).21These trials differ from our study,in that they used a different dose and schedule of lenalidomide (oral lenalidomide20mg daily on days1-21of a28-day cycle19–21)as well as different schedules for rituximab administration(rituximab weekly for cycle119,20or ritux-imab every other week for4cycles21);thus,those response rates are not directly comparable to our results.In conclusion,we report the first clinical trial of combined lenalidomide,low-dose dexamethasone,and rituximab in patients with rituximab-resistant,indolent B-cell lymphoma or mantle cell lymphoma.Our data sup-port other reports of efficacy for rituximab-lenalidomide in relapsed19–23and previously untreated,indolent B-cell lymphoma24and,in part,are the basis for an ongoing multicenter,randomized trial comparing lenalidomide-rituximab with rituximab-chemotherapy as first-line ther-apy of follicular lymphoma(NCT01476787). FUNDING SUPPORTTahamtan Ahmadi received a grant from the Leukemia and Lym-phoma Society for the conduct of this study.Stephen J.Schuster and Nicole A.Aqui received research support from Celgene Corpo-ration for this clinical trial.CONFLICT OF INTEREST DISCLOSURES Jakub Svoboda received a grant from Celgene Corporation for an investigator-initiated clinical trial.Anthony R.Mato has received compensation as a member of the Speakers Bureau of Celgene Corporation.REFERENCES1.Marcus R,Imrie K,Belch A,et al.CVP chemotherapy plus rituxi-mab compared with CVP as first-line treatment for advanced follicu-lar lymphoma.Blood.2005;105:1417-1423.2.Hochster H,Weller E,Gascoyne RD,et al.Maintenance rituximabafter cyclophosphamide,vincristine,and prednisone prolongs progression-free survival in advanced indolent lymphoma:results of the randomized phase III ECOG1496study.J Clin Oncol.2009;27: 1607-1614.3.Abdollahi S,Chong EA,Olin RL,et al.The impact of rituximab re-sistance on overall survival rate in low-grade follicular lymphoma [abstract].Blood(ASH Annual Meeting Abstracts).2008;112.Abstract 3783.4.Howlader N,Noone AM,Krapcho M,et al.SEER cancer statisticsreview,1975-2009(vintage2009populations).National Cancer Institute.Bethesda,MD:National Cancer Institute;2012(based on the November2011SEER data submission,posted to the SEER web site April2012).Available at:/csr/ 1975_2009_pops09/.Accessed June6,2012.5.Reddy N,Hernandez-Ilizaliturri FJ,Deeb G,et al.Immunomodula-tory drugs stimulate natural killer-cell function,alter cytokine produc-tion by dendritic cells,and inhibit angiogenesis enhancing the anti-tumour activity of rituximab in vivo.Br J Haematol.2008;140:36-45.6.Ramsay AG,Clear AJ,Kelly G,et al.Follicular lymphoma cellsinduce T-cell immunologic synapse dysfunction that can be repaired with lenalidomide:implications for the tumor microenvironment and immunotherapy.Blood.2009;114:4713-4720.7.Wiernik PH,Lossos IS,Tuscano JM,et al.Lenalidomide monother-apy in relapsed or refractory aggressive non-Hodgkin’s lymphoma.J Clin Oncol.2008;26:4952-4957.8.Witzig TE,Vose JM,Zinzani PL,et al.An international phase IItrial of single-agent lenalidomide for relapsed or refractory aggressive B-cell non-Hodgkin’s lymphoma.Ann Oncol.2011;22: 1622-1627.9.Witzig TE,Wiernik PH,Moore T,et al.Lenalidomide oral mono-therapy produces durable responses in relapsed or refractory indolent non-Hodgkin’s lymphoma.J Clin Oncol.2009;27:5404-5409.10.Habermann TM,Lossos IS,Justice G,et al.Lenalidomide oralmonotherapy produces a high response rate in patients with relapsed or refractory mantle cell lymphoma.Br J Haematol.2009;145:344-349.11.Hernandez-Ilizaliturri FJ,Reddy N,Holkova B,Ottman E,Czuczman MS.Immunomodulatory drug CC-5013or CC-4047 and rituximab enhance antitumor activity in a severe combined immunodeficient mouse lymphoma model.Clin Cancer Res.2005;11:5984-5992.12.Zhang L,Qian Z,Cai Z,et al.Synergistic antitumor effects of lena-lidomide and rituximab on mantle cell lymphoma in vitro and in vivo.Am J Hematol.2009;84:553-559.13.Wu L,Adams M,Carter T,et al.Lenalidomide enhances naturalkiller cell and monocyte-mediated antibody-dependent cellular cyto-toxicity of rituximab-treated CD201tumor cells.Clin Cancer Res.2008;14:4650-4657.14.Qian Z,Zhang L,Cai Z,et al.Lenalidomide synergies with dexa-methasone to induce growth arrest and apoptosis of mantle cell lym-phoma cells in vitro and in vivo.Leuk Res.2011;35:380-386.15.Swerdlow SH,Campo E,Harris NL,et al.eds.WHO Classificationof Tumours of Haematopoietic and Lymphoid Tissues.4th ed.Lyon,France:IARC;2008.16.Cheson BD,Horning SJ,Coiffier B,et al.Report of an interna-tional workshop to standardize response criteria for non-Hodgkin’s lymphomas.NCI Sponsored International Working Group.J Clin Oncol.1999;17:1244-1244.17.Davis TA,Grillo-Lopez AJ,White CA,et al.Rituximab anti-CD20monoclonal antibody therapy in non-Hodgkin’s lymphoma:safety and efficacy of re-treatment.J Clin Oncol.2000;18:3135-3143. 18.Carver JR,Nasta S,Chong EA,et al.Myocarditis during lenalido-mide therapy.Ann Pharmacother.2010;44:1840-1843.19.Wang M,Fayad L,Wagner-Bartak N,et al.Lenalidomide in combi-nation with rituximab for patients with relapsed or refractory mantle-cell lymphoma:a phase1/2clinical ncet Oncol.2012;13:716-723.20.Wang M,Fowler N,Wagner-Bartak N,et al.Oral lenalidomidewith rituximab in relapsed or refractory diffuse large cell,follicular, and transformed lymphoma:a phase II clinical trial.Leukemia.2013;27:1902-1909.21.Zinzani PL,Pellegrini C,Gandolfi L,et bination of lenali-domide and rituximab in elderly patients with relapsed or refractory diffuse large B-cell lymphoma:a phase2trial.Clin Lymphoma My-eloma Leuk.2011;11:462-466.22.DeRook I,Odonnell RT,Noble B,Quirch C,Tuscano J.R2:pre-liminary results of a phase II study of lenalidomide and rituximab in relapsed/refractory indolent non-Hodgkin’s lymphoma(NHL) [abstract].Blood(ASH Annual Meeting Abstracts).2008;112.Abstract 3060.23.Dutia M,Deroock I,Reed-Pease C,Tuscano J.Lenalidomideplus rituximab leads to a high rate of durable responses inpatients with relapsed/refractory indolent non-Hodgkin’s lym-phoma[abstract].Ann Oncol.2011;22(suppl4).Abstract iv186.24.Fowler NH,Neelapu SS,Hagemeister FB,et al.Lenalidomide andrituximab for untreated follicular lymphoma:final results of a phase II study[abstract].Blood(ASH Annual Meeting Abstracts).2012;120.Abstract901.。
