第十七章 重排反应
重排反应——精选推荐

重排反应有机化学中重排反应很早就被⼈们发现,研究并加以利⽤。
第⼀次被Wohler 发现的,由⽆机化合物合成有机化合物,从⽽掀开有机化学神秘⾯纱的反应—加热氰酸铵⽽得到尿素,今天也被化学家归⼊重排反应的范畴。
⼀般地,在进攻试剂作⽤或者介质的影响下,有机分⼦发⽣原⼦或原⼦团的转移和电⼦云密度重新分布,或者重键位置改变,环的扩⼤或缩⼩,碳架发⽣了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、⾃由基反应和周环反应四⼤类。
也有按照不同的标准,分成分⼦内重排和分⼦间重排,光学活性改变和不改变的重排反应,等等。
⼀、亲核重排重排反应中以亲核重排为最多,⽽亲核重排中⼜以1,2重排为最常见。
(⼀)亲核1,2重排的⼀般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发⽣亲核1,2重排的条件(1)转变成更稳定的正离⼦(在⾮环系统中,有时也从较稳定的离⼦重排成较不稳定的离⼦)(2)转变成稳定的中性化合物(3)减⼩基团间的拥挤程度,减⼩环的张⼒等⽴体因素。
(4)进⾏重排的⽴体化学条件:带正电荷碳的空p轨道和相邻的C-Z 键以及α碳和β碳应共平⾯或接近共平⾯(5)重排产物在产物中所占的⽐例不仅和正电荷的结果有关,⽽且和反应介质中存在的亲核试剂的亲核能⼒有关3.迁移基团的迁移能⼒(1)多由试验⽅法来确定基团的固有迁移能⼒(2)与迁移后正离⼦的稳定性有关(3)邻位协助作⽤(4)⽴体因素4.亲核1,2重排的⽴体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进⾏迁移的相对时机5.记忆效应:后⼀次重排好像和第⼀次重排有关,中间体似乎记住了前⼀次重排过程(⼆) 亲核重排主要包括基团向碳正离⼦迁移,基团向羰基碳原⼦迁移,基团向碳烯碳原⼦迁移,基团向缺电⼦氮原⼦转移,基团向缺电氧原⼦的迁移,芳⾹族亲核重排,下⾯就这六种迁移作简要介绍:1.基团向碳正离⼦迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)⽚那醇重排:邻⼆醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)⼆烯酮-酚重排:4,4-⼆取代环⼰⼆烯酮经酸处理重排成3,4-⼆取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作⽤⽣成⾼⼀级的同系物(6)烯丙基重排:烯丙基系统中双键发⽣位移的反应2.基团向羰基碳原⼦迁移:(1) Benzil-Benzilic Acid重排:α-⼆酮经强碱处理会发⽣重排,⽣成α-羟基⼄酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另⼀种酮3.基团向碳烯碳原⼦迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成⾼⼀级同系物的⽅法(2) 其他的碳烯重排反应,主要是1,2氢迁移⽣成烯4.基团向缺电⼦氮原⼦转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上⽆取代基酰胺经溴及碱处理,脱羰⽣成伯胺(3)Curtius重排:酰基叠氮热分解⽣成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,⽣成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍⽣物经类似Hoffmann的重排⽣成少⼀个碳的胺(6)Neber重排:肟酮的磺酸酯在⼄醇钾处理后⽔解⽣成α-氨基酮5.基团向缺电氧原⼦的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原⼦迁移到氧原⼦上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作⽤,在分⼦中插⼊氧⽣成酯的反应6.芳⾹族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺⼆、⾃由基重排反应1.1,2迁移:⽐正离⼦重排反应少得多,主要发⽣在:(1)某些双⾃由基的1,2-烷基和氢(2)烯基(迁移的⼄烯基若是环的⼀部分,则发⽣重排)2.⾮1,2迁移:多发⽣1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4.Hofmann-loffler-freytag反应:质⼦化N-卤化胺经热分解或光解形成六氢吡啶等的反应。
有机化学重排反应讲解
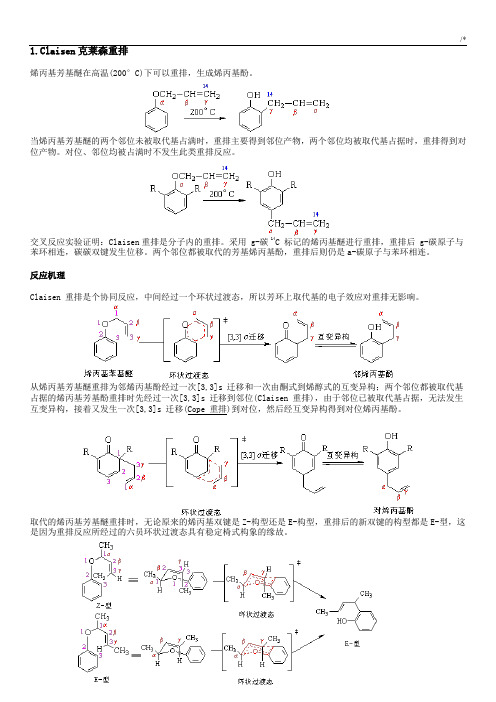
1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
高等有机化学重排反应公开课获奖课件

Me Me C CMe2
OH
H Me C CMe3 O
Me C CMe3 OH
第33页
脂环族氨基醇和脂环族卤代醇则发 生扩环或缩环反应
CH2NH2 HNO2
OH
-N2
CH2 OH
OH CH3 Ag AgI
I
OH
CH3 or
OH CH3
O-H CH3
OH H
O
OH CH3
H C CH3 OH
C CH3 O
机理:
(NH3存在时生成酰胺):
(EtO-)
R
H2 O CC
H C
R' EtONa
O
R
H C
C
H C
R ' -X
R
HH CC
C
'R E t O N a
HH RCC
aC
R'
b
X
a) R
H C
H C
R'
X
O
O
O Et
b) R
H C
H C
R'
COOEt
H
R
H2 H CC
R'
COOEt
E tO O C H
R
第46页
CH2 C CH2Cl
OH
O
OH
CH C CH3 Cl O
OH
O
CH2 CH2COOH ( A 比 B 稳定 )
CH CH2COOH A
CH CH2 COOH B
O
O
Cl C CH3
EtONa
O EtO
EtONa
C 所连接的取代基越少越稳定
COOEt CH2
重排反应总结

重排反应总结1、什么叫重排反应?一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳骨架发生了改变等等,这样的反应称为重排反应。
简单的理解:重排反应是指反应中烃基或氢原子或别的取代基从分子中的一个原子迁移到该分子中的另一个原子上的变化。
(指分子内重排)2、重排的分类按反应机理 ,重排反应可分为:基团迁移重排反应和周环反应中的重排。
基团迁移重排反应 即反应物分子中的一个基团在分子范围内从某位置迁移到另一位置的反应。
常见的迁移基团是烃基。
基团迁移重排反应又包括缺电子重排(亲核重排),富电子重排(亲电重排)和自由基重排.。
周环反应中的重排包括电环反应、σ键迁移。
也可按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应等等。
本讲义把重排分为以下几类:a.从碳原子到碳原子的重排 b.从碳原子到杂原子的重排 c.从杂原子到碳原子的重排 d.其它重排一、从碳原子到碳原子的重排反应1、Wangner-Meerwein 重排(瓦格纳尔—米尔外英重排,简称瓦—米重排)两个相邻原子之间发生的重排叫1,2重排,也叫Wangner-Meerwein 重排。
如:醇或卤代烃在酸催化下进行亲核取代或消除反应时,烯烃进行亲电加成时发生的重排。
例如:a.亲电加成时发生的重排如果反应液中同时存在两种或是两种以上的亲核试剂,则通过中间体碳正离子,能够生成混合加成产物。
R 2C R 3R 1C OHR 4R 5R 2C R 3R 1CR 4R 5R 1CR 2C R 3R4R 5R1CR 2CR 3R 4R 5OH H +(-H O)重排H O(-H +)b.醇进行亲核取代和消除时的重排亲核取代时,除大多数伯醇难以形成正碳离子而按S N 2反应外,仲醇或叔醇反应常伴随着重排产物的产生。
(S N 1)消去时(S N 1):c.卤代烃进行亲核取代和消除时的重排亲核取代按S N 1机理反应时伴随着碳正离子的重排 消去时注意:有碳正离子形成时,就有可能伴随着重排反应 形成C +的方式总结: (a)卤代烃 (AgNO 3醇溶液) (b)含-NH 2,重氮化放氮气(c)-OH ,加 H + (失H 2O),烯烃加H +基团迁移顺序:对迁移顺序的理解:迁移基团的电子云密度越大越容易迁移(但具体情况下,要具体分析)(CH 3)3C-CH 2Cl(CH 3)32Ag (AgNO 3(CH 3)3C-CH 2N 2Cl-N 2(CH 3)3C-CH 2(CH 3)3C-CH 3NH 2NaNO 2△(CH 3)3C-CH 2OH (CH 3)3C-CH 2=CH 2(CH 3)32(CH 3)33H +2H +ClR 3C-R 2CH-RCH 3-CH 3-H->>>>>>OCH 3>反应举例:2、Pinacol (频哪醇)重排(邻二醇重排)当起始物的脱水产物能产生两种不同的正离子时,总是生成更稳定的正碳离子为主,有不同迁移基团时,按迁移的难易程度进行。
Beckmann重排反应

Beckmann重排反应展开全文肟在酸催化下重排得到酰胺的反应。
各种强质子酸,路易斯酸和各种能与肟羟基形成好的离去基团的化合物(如TsCl,PCl5,TCT等)都可以引发反应。
此反应与Hofmann重排,Schmidt反应和Curtius重排类似,反应中会形成带正电的氮原子, 会发生烷基迁移。
反应机理一、质子酸催化机理肟顺反异构的互变有很高的能垒,反应中首先肟的氧原子质子化,处在反位的烷基迁移到氮原子上,与此同时N-O键断裂,脱水,进而形成氮正离子中间体,加一分子水,脱质子,异构化得到酰胺。
二、PCl5催化机理类似,磷氧化物作为离去基团,引发重排。
底物的离去基团都是反式迁移。
反应实例【Synth. Commun. 2000, 30, 2105-2011】【Synth. Commun. 2001, 31, 2047-2050】【Synthesis, 2002, 1057-1059】【J. Org. Chem., 2002, 67, 6272-6274】【Tetrahedron Lett., 2003, 44, 755-756】【Org. Lett. 2005, 7, 2067-2069】【Synthesis 2006, 2319-2322】【J. Org. Chem., 2007, 72, 4536-4538】【J. Org. Chem., 2008, 73, 2894-2897】【Synthesis, 2010, 3705-3709】【Synthesis, 2010, 1771-1776】【J. Org. Chem., 2010, 75, 1197-1202】【Synlett, 2014, 25, 665-670】【J. Org. Chem., 2018, 83, 2040-2049】【J. Am. Chem. Soc., 2018, 140, 5264-5271】【Synlett, 2018, 29, 1465-1468】【J. Org. Chem., 2018, 83, 13080-13087】【Synthesis, 2019, 51, 3709-3714】【Org. Lett., 2019, 21, 2818-2822】另外有一些非常规的Beckmann重排反应,迁移片段迁移后,可以得到稳定的腈类化合物和稳定的碳正离子,相当于Ritter反应的逆反应。
药物合成教学资料 重排反应课件

41
2. 反应机理
药物合成教学资料 重排反应
42
4. 应用特点
(1) 制备二芳基乙醇酸
药物合成教学资料 重排反应
43
药物合成教学资料 重排反应
44
(2) 制备环状酮
缩小一个碳
药物合成教学资料 重排反应
45
四、Favorskii重排
-卤代酮在亲核碱(NaOH,RONa等)存在的条 件下,发生重排得到羧酸盐、酯或酰胺的反 应称为Favorski重排
1. 反应通式
药物合成教学资料 重排反应
46
2. 反应机理
药物合成教学资料 重排反应
47
3. 影响因素
(1) 反应物α-卤代酮的影响 重排产物的羧羰基保留在哪个α碳上?
PK稳定性
药物合成教学资料 重排反应
48
中间体环丙酮开环后形成的负碳离 子稳定性较高的,导向重排产物
共轭结构有利于碳负离子的稳定
药物合成教学资料 重排反应
54
(2) 由α, α’-二卤代酮制备α, β-不 饱和羧酸衍生物
药物合成教学资料 重排反应
55
药物合成教学资料 重排反应
56
药物合成教学资料 重排反应
57
(3) 由α-卤代环酮制备少一个碳原子 的环状羧酸衍生物
药物合成教学资料 重排反应
21
药物合成教学资料 重排反应
22
二、Pinacol重排
连二醇类化合物用酸处理时重排生成醛或 酮的反应,称为Pinacol重排反应。 1. 反应通式
R = 烷基、芳基或氢 药物合成教学资料 重排反应
23
2. 反应机理
药物合成教学资料 重排反应
24
3. 影响因素
克莱森重排

CH 2 CH CH 2 CH 2 CH CH 2
1' 2'
1 2
CH 2 CH CH 2 CH 2 CH CH 2
1'
3
3'
2'
1 2
3'
CH 3 CH 3
CH CH
1'
CH CH 2 CH CH 2
2' 3'
CH 3 CH 3
CH CH
1'
CH
3
CH 2 CH 2
3'
CH
2'
* Bπ
LUNO HOMO (原 LUNO ) 光反应(对称性允许)
Aπ
*
[ 2+2 ]环加成是光作用下允许的反应。
与乙烯结构相似的化合物的环加成方式与依稀的相同。
hυ Me Me Me Me Me
Me
Me
+ Me
二、[ 4+2 ]环加成 以乙烯与丁二烯为例讨论 从前线轨道(FMO)来看,乙烯与丁二烯HOMO和LUMO如下图:
hυ CH 3 H H CH 3 顺旋 H3C HH CH 3 对旋 H H
25 ℃ 顺旋
CH 3 Ph CH 3
CH 3 CH 3
二、4n+2个π电子体系的电环化
以己三烯为例讨论,处理方式同丁二烯。先看按线性组合的己三烯的六个分子轨道。
ψ6 ψ5 ψ4 E ψ3 ψ2 ψ1 E3 E2 E1 基态 激发态 E6 E5 E4
LUMO π * 3 (丁二烯) HOMO π (乙烯)
HOMO π
2
LUMO π *
对称性允许的 乙烯和丁二烯的环加成(热反应)图
有机化学所有的重排反应(详细的PPT)~~~~~~~~考研用得着的43页PPT

谢谢!
36、自己的鞋子,自己知道紧在哪里。——西班牙
37、我们唯一不会改正的缺点是软弱。——拉罗什福科
xiexie! 38、我这个人走得很慢,但是我从不后退。——亚伯拉罕·林肯
39、勿问成功的秘诀为何,且尽全力做你应该做的事吧。——美华纳
有机化学所有的重排反应(详细的 PPT)~~~~~~~~考研用得着的
51、没有哪个社会可以制订一部永远 适用的 宪法, 甚至一 条永远 适用的 法律。 ——杰 斐逊 52、法律源于人的自卫本能。——英 格索尔
53、人们通常会发现,法律就是这样 一种的 网,触 犯法律 的人, 小的可 以穿网 而过, 大的可 以破网 而出, 只有中 等的才 会坠入 网中。 ——申 斯通 54、法律就是法律它是一座雄伟的大 夏,庇 护着我 们大家 ;它的 每一块 砖石都 垒在另 一块砖 石上。 ——高 尔斯华 绥 55、今天的法律未必明天仍是法律。 ——罗·伯顿
40、学而不思则罔,思而不学则殆。——孔子
Chapter17__酚___醌

HO
CH 2-OH 2
-H2O
HO -H+
CH 2 HO
+
OH HO
CH 2
H
+
OH
CH2
OH
苯酚和甲醛在碱性条件的缩合
OH + -OH
-
O- + H2O
O H CH 2-OO-
O
+ CH2=O
-
O
CH 2-OH H CH 2
-OH -
O
CH 2
O
O-
HO
CH 2 H 2O
O R-C
OAlCl 2 H2O
O R-C
OH
碱催化(碱有利于酚氧负离子形成)
O O- + O O
O
OO O
O O OCCH 2CH2CO
H2O
O O OCCH 2CH2COH
质子酸催化:(质子酸有利于增强羰基活性)
OH OH + O O
OH O OCCH 2CH2COH
+
+
H O +
OH O O
O
OH OH
+
H+~
O
O O OCCH 2CH2COH
-H+
苯酚的一个特殊反应是:在浓 硫酸或无水氯化锌的作用下, 与邻苯二甲酸酐不发生傅氏反 应,而发生缩合反应生成酚酞。
HO
OH
C O O
生成酚酞的反应机理
HO
O + OH O O
(浓)H2SO4 亲核加成
OH O O
H+ -H2O
OH
芳香亲电取代
*2,4,6-三硝基苯酚的制备
有机化学重排反应汇总
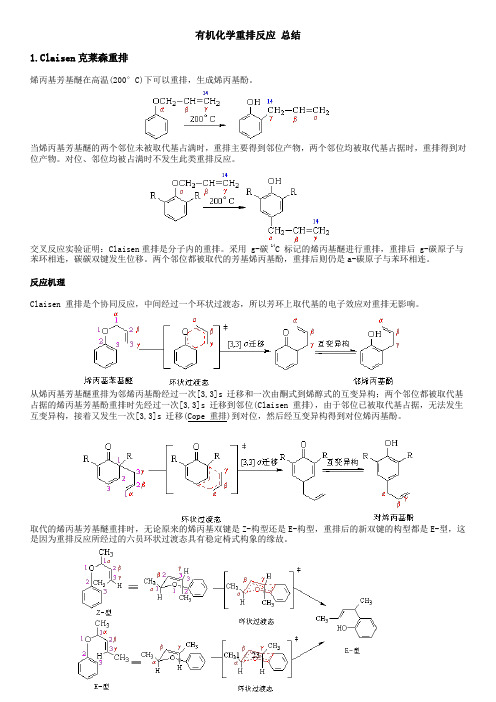
有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
《有机化学反应类型》重排反应的类型

《有机化学反应类型》重排反应的类型有机化学反应类型——重排反应的类型在有机化学的广袤领域中,重排反应是一类引人入胜且具有重要意义的反应类型。
重排反应指的是分子中的某些原子或基团发生重新排列,从而生成结构不同的产物。
这类反应在有机合成中常常被巧妙运用,为合成具有特定结构和功能的有机化合物提供了独特的途径。
重排反应的类型丰富多样,其中较为常见的包括 WagnerMeerwein重排、Pinacol 重排、Beckmann 重排、Hofmann 重排以及 Claisen 重排等。
WagnerMeerwein 重排通常发生在碳正离子的环境中。
当一个碳正离子形成后,如果其相邻的碳原子上存在更能稳定正电荷的基团,那么这个基团就会带着它的电子迁移到带正电荷的碳原子上,从而导致碳骨架的重排。
比如说,在萜类化合物的生物合成过程中,这种重排反应就发挥着关键作用。
Pinacol 重排则是 1,2-二醇在酸性条件下发生的重排反应。
在这个过程中,首先羟基被质子化,然后脱水形成碳正离子。
接着,相邻的基团迁移到碳正离子上,得到酮类化合物。
这一重排反应在合成一些复杂的酮类化合物时具有重要价值。
Beckmann 重排是肟在酸性条件下发生分子内重排生成酰胺的反应。
肟中的羟基与酸作用形成酯,接着发生重排,烷基带着电子转移到氮原子上,同时生成碳正离子,最后水解得到酰胺。
它在有机合成中是制备酰胺的一种有效方法。
Hofmann 重排是酰胺在碱性条件下与卤素作用,失去羰基生成伯胺的反应。
反应中酰胺首先与碱作用生成氮负离子,然后与卤素反应生成 N卤代酰胺。
接着,经过一系列重排和水解步骤,最终得到伯胺。
Claisen 重排是烯丙基芳基醚在高温下发生的重排反应。
反应中,烯丙基从氧原子迁移到芳环的邻位,生成邻烯丙基酚。
这一重排反应在天然产物的合成以及复杂分子的构建中经常被运用。
除了上述这些经典的重排反应类型,还有一些其他的重排反应也值得关注。
比如Fries 重排,它是酚酯在路易斯酸催化下发生的重排反应,生成邻位或对位的酚酮化合物。
有机化学中的重排反应(上课使用)

C H 3
C H 3
C H 3
C H 3 H
Ph C C O Ts
△
C H 3C H 3
H H 3C C C Ph
C H 3C H 3
苯的迁移速度为甲基的3000倍
⑶.反应实例
H 3 C C H 2 C H 2 B rA g N O 3 H 3 C C H 2 C H 2
B r
H
H 3 C C H C H 3
6. Baeyer—Villger重排(缺电 子氧的重排)
二、 富电子重排(亲电重排)
1. Steven重排 2. 邻二酮重排 3. Sommelet重排 4. Wittig重排 5. Favorski重排
三、 芳环上的重排反应 1. 联苯胺重排 2. Fries重排 3. Claisen重排
多数的有机化学反应是官能团的反应,碳胳一般保持不 变;但在有一些反应中,烃基或别的基团从一个原子迁移 到另一个原子上,碳胳或官能团的位置发生了变化,这类 反应称为分子重排。
NH2 HNO2
+NN -N2
OH +
+CH2
CH2OH +
CH2
而下例是环的扩大:
CH2NH2 HNO2 -N2
+CH2
CH2OH +
CH2
OH +
丙胺与亚硝酸作用的主产物为异丙醇, 说明H-原子也可迁移:
C H 3 C H H C H 2 N H 2 H N O 2 C H 3 C H H C H 2 N 2 +
有机化学中的 重排反应
目录
一、缺电子重排(亲核重排) 1. Wagner—Meerwein重排 (Demyanov重排)
重排反应总结

不过,后来Schleyer与Brown完成的工作也确信 了phenonium ion的存在。他们测定了一系列化 合物的乙酸解反应速率.
OBs H H CH 3 CH 3 H CH3 OAc H CH3 H H3C CH3 X X Solvent-assisted erythro OAc
Aryl Participation---The Phenonium Ion Controversy
有关芳基能否进行和如何进行邻基参与,一直 存在争论. 1949年,Cram发现3-phenyl-2-butyl tosylate, 在HOAc中的溶剂解反应中,L-Threo-tosylate 生成了96%的外消旋产物,而L-erythro-tosylate 则生成了98%的光学活性的L-erythro-acetate。 由此,他提出了phenonium中间体的存在.
H
X Aryl-assisted threo
logkt -2.0 -3.0 -4.0
P-MeO
P-Me m-Me H P-Cl
m-Cl
M-CF3
P-CF3
-5.0
P-NO2
m,m’-(CF3)2
-0.4
0
0.4
0.8
s
如果没有邻基参与,那么反应速率logkt (产物生成 速率) 应与取代基X的s值有线性相关关系。 事实上,当X为强拉电子取代基时, log kt-s符 合linear free-energy relationship;但X为给电子 取代基时,则出现很大偏差。
Z A X B Gauche B Z A + A Z +
有机化学中的重排反应

关键词:有机化学 重排ห้องสมุดไป่ตู้应 贝克曼重排 Hofmann重排
一:贝克曼重排反应:
反应机理:
有机化学中几个重点重排反应的总结
-------贝克曼重排、Hofmann重排等
摘要:重排反应(rearrangement reaction)是分子的碳骨架发生重排生成结构异构体的化学反应,是有机反应中的一大类。重排反应通常涉及取代基由一个原子转移到同一个分子中的另一个原子上的过程。
贝克曼重排反应(Beckmann重排反应)是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。若起始物为环肟,产物则为内酰胺。此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名
试例反应的反应物为环己酮并生成己内酰胺。因为己内酰胺是制造尼龙6的重要原料,所以此反应也是贝克曼重排的一个很重要的应用。
贝克曼溶剂被广泛用来催化重排反应,其实际成分为乙酸,盐酸和乙酸酐。也可以其他种类的酸催化,例如硫酸和多磷酸。在实际工业制造酰胺的流程中,通常使用的是硫酸,因为用氨进行中和处理后可以得到硫酸铵,后者是一种重要的化肥,能为土壤提供氮和硫。
肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:
霍夫曼重排Hofmann rearrangement
霍夫曼降解反应指的是酰胺与次氯酸钠或次溴酸钠的碱溶液作用时,脱去羰基生成少一个碳的伯胺反应:R-CONH₂+ NaOX + 2NaOH——→R-NH₂+Na2CO₃+ NaX + H2O
有机重排反应详尽总结

有机重排反应详尽总结重排反应(rearrangement reaction)是分⼦的碳⾻架发⽣重排⽣成结构异构体的化学反应,是有机反应中的⼀⼤类。
重排反应通常涉及取代基由⼀个原⼦转移到同⼀个分⼦中的另⼀个原⼦上的过程,现将有机重排反应进⾏⼀个详尽的总结。
(1)Amadori重排反应酸或碱催化下醛糖的N-糖苷(糖胺,glycosylamines)异构化⽣成1-胺基-1-脱氧酮糖的反应被称为Amadori重排反应。
此反应的底物和产物都称为“Amadori化合物”。
各种Lewis酸都已应⽤于此反应:CuCl2 , MgCl2 , HgBr2 , CdCl2 , AlCl3 , SnCl4 , etc。
此反应中只需催化量的酸就可以催化胺和醛糖反应,进⽽重排。
伯胺,仲胺,脂肪胺或芳⾹胺都可以发⽣此反应。
糖胺类化合物会发⽣复杂的美拉德反应(⾷物在烹饪或储藏过程中糖,胺,氨基酸和蛋⽩质等进⾏重排和降解)。
此反应中⽣成的⿊⾊产物是由于发⽣了此类⾮酶褐变反应。
(2)Baker-Venkataraman重排贝克-⽂卡塔拉曼重排反应(Baker-Venkataraman重排)是2-⼄酰氧基苯⼄酮衍⽣物在碱作为催化剂之下⽣成1,3-⼆酮的反应。
这个反应常⽤于制造⾊酮和黄酮类化合物。
(3)Bamberger RearrangementN-芳基羟胺在强酸⽔溶液作⽤下重排为氨基苯酚的反应。
(4)Beckmann Rearrangement贝克曼重排反应(Beckman rearrangement)指醛肟或酮肟在酸催化下⽣成N-取代酰胺的亲核重排反应,反应中起催化作⽤的酸常⽤五氯化磷。
此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名。
(5)Brook RearrangementC-Si→O-Si的离⼦性重排反应,从羟基硅烷到硅醚的转化。
Brook 重排反应的推动⼒是产物中键能较⾼的 Si-O 键的⽣成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+
B r + B r
B r B r B r B r
+
B r B r
苯 基 迁 移
B r B r ( 1 0 0 % )
衢州学院化学与材料工程学院
9
用该重排可制备有张力的脂环化合物,如可用甾体化合物16-氨基-D (环)-失碳甾体,经亚硝化、重排,同时使C、D环扩环和缩环。
' R 'R
' R ' R
' R ' R
O H O H
R '
+ O H O H
O H
R '
+ H
H
RC C R O H R '
+
R ' R ' C C R O R
RC C R O H R '
+
衢州学院化学与材料工程学院
11
从重排产物可知,迁移基团是R’不是R,则说明R’优先迁移。但产物往 往是个混合物,从产物的比例便可以预测何种基团优先迁移,即基团的 迁移能力。 根据邻二叔醇类化合物的结构特点,可分为四取代、三取代、羟基位于 脂环上的邻二叔醇重排及Semipinacol重排。 1.四取代邻二叔醇的重排
衢州学院化学与材料工程学院
2
按反应机理,重排反应可分为亲核重排、亲电重排及自由 基重排。
(1)亲核重排
迁移基带着一对成键电子向缺电子的原子进行迁移。
C H 3 C H H C H 2 N 2 3 C C H 3
H O 2 H
+
C H 3 H N O / H 2 N 2
+ +
+ 亲 核 重 排 C H C H C H C H 2 2 3 C 3 C
+ 1 , 2 烷 基 迁 移 H C H C H C 3 2C C H 3 C H 2 3 C +
C H 3
C H 3 Br
CH 3 C CH 3 H
+
C H 3
CH 2 CH 3
AlBr 4
CH 3
C CH 3
CH
CH 3
转变成更稳定的正离子是重排的一个动力,另外,转变成中性化合物也是 重排的一种动力,有时为促进重排,常在离去基或其β-位上引入活性基团。 如庚醇(heptanol)在三苯基膦的作用下,经重排、水解得双环[2.2.1] 庚醇:
+
R ' ' R C CR O R
R , R ' 可 以 为 烃 基 、 芳 基 或 氢
反应机理:在H+作用下失去一分子水,生成碳正离子,R’作1,2-迁移, 最后失去质子,得到醛或酮。
+ R ' r e a r r a n g e m e n t H O H 2 R R R R C C C C R R C C +
衢州学院化学与材料工程学院
7
一、Wagner-Meerwein 重排
在质子酸或Lewis酸催化下生成的碳正离子中,烷基、芳基或氢从一个 原子通过过渡态,迁移至相邻带正电荷碳原子的反应称WagnerMeerwein重排。
C H 3 l B r 3 C H B r A C H 2 3 C A l B r 4 C H 3
第十七章 重排反应
衢州学院化学与材料工程学院
1
所谓重排反应,是指在同一分子内,某一原子或基团从一 个原子迁移至另一个原子而形成新分子的反应。
W A B W A B
其中W表示迁移基团,A、B分别表示迁移的起点和终点原子, 根据A、B之间的位置,可分为1,2迁移及非1,2迁移;非1,2迁 移是指迁移起点和终点之间相隔一个或几个原子的重排,如 1,3; 1,4;1,5 ……迁移等重排反应。
夺 取 氢 P C H h C C H 3 2 C H 3 重 排 产 物 5 0 %
衢州学院化学与材料工程学院
5
另外,还有一种重排反应不受催化剂的影响,其重排过程 不存在离子型或自由基型中间体,W-A原子间σ键的断裂 与W- B原子间新σ键的形成为一协同过程,这种重排成 为σ迁移重排。
衢州学院化学与材料工程学院
C D A B M e O
N H 2 N a N O / H O A c 2
C H 3 O H H H M e O
衢重排(频哪醇重排)
在酸催化下,邻二叔醇失去一分子水,重排成醛或酮的反应称Pinacol 重排。
' R 'R R CC R O H O H H
迁移甲基以+CH3形式向碳负离子迁移,在此过程中,可以看 作是亲电试剂。
衢州学院化学与材料工程学院
4
(3)自由基重排 在该重排中,首先形成自由基,然后迁移基团带着一个电子 进行迁移,生成新的自由基。
W A B
.
A B
.
W
例如,PhC(CH3)2CH2CHO在二叔丁基过氧化物引发下,经脱酸后,反 应产物中重排产物占50%。
衢州学院化学与材料工程学院 8
O H N H T sP h P / D E A D
3
O P P h 3 N H T sP h P = O
3 +
N H T s H
A r C O 2
A r O O
N H T s ( 8 0 % )
除此之外,碳正离子也可通过其他方式形成,如烯烃的卤加成,氨基的重 氮化等形式。
6
第一节 从碳原子到碳原子的重排
从碳原子到碳原子的重排主要包括:亲核1,2-重排及亲电 1,2-重排。前者主要包括Pinacol(邻二叔醇或频哪醇)重排 及Wag ner-Meerwein重排;后者可以包括Wolff重排和 Arndt-Eistert反应;benzil-benzilic acid(二苯基乙二酮-二苯 基乙醇酸)重排虽属于亲核1,2-重排的范畴,但羰基只有部 分正电荷,基团向羰基迁移的情况与向正碳离子迁移有所不 同。
( t B u O ) 2 C H O P hCC H 2 C H 3 C H 3 C H 3 P hC
. 夺 取 氢 C H P h
2
C H 3 C H C 3
C H 3
C H 3 5 0 % 正 常 产 物
P h C C H 2 C H 3
.
r e a r r a n g e m e n t
H C H 3
C H 3
C H 3
C H 3
O H C H 3 H H C C 2 C 3 C H 3
甲基带着一对成键电子向伯碳正离子迁移, 生成新的仲碳正离子,在此过程中,可以 将迁移甲基看作是亲核试剂。
衢州学院化学与材料工程学院
3
(2)亲电重排 在该重排中,带着正电荷的迁移基团向富电子原子进行迁移。
C H C H 3 3 C H 3 H O 2 亲 电 重 排 P h L i P h C H O H L i + P h C H O H P h C H O C H P h C H O 2 3
