λ噬菌体切除酶基因Xis在大肠杆菌中的可溶性融合表达
λ噬菌体的裂解性和溶原性的基因调控机制

λ噬菌体的裂解性和溶原性的基因调控机制摘要:λ噬菌体(phage)有两种生存策略,一种通过感染宿主细胞,产生大量的子代噬菌体,同时宿主细胞裂解死亡,这种方式称为裂解性感染。
另一种是噬菌体的基因组以一种原噬菌体的方式潜伏于细菌中,这种增值方式称为溶原态(lysogeny)。
λ噬菌体的裂解发育、溶原发育和溶原发育到裂解发育的诱导是研究生物分子调节优异的模型。
经过四十多年的研究,在这个模型中已经发现了众多的正调节因子和负调节因子在转录水平或转录后调节基因的表达。
关键词:λ噬菌体、裂解性、溶原性1951年J. Lederberg的妻子Esther Lederberg证明了J. Lederberg和Tatum用来杂交的K12中有原噬菌体,并命名为λ,经10年的研究搞清了溶原化的实质。
λ噬菌体的基因组长达50 Kb,共61个基因,其中38个较为重要。
其生活史如图8-15所示,可分为裂解周期和溶原周期。
细菌处于溶原化状态时,细胞质中有一些λ CⅠ基因的产物CⅠ蛋白,这是一种阻遏蛋白,可以阻止λ左、右两个早期起动子的转录,使之不能产生一些复制及细胞裂解的蛋白。
λ的DNA随着宿主的染色体复制而复制。
但在UV诱导下Rec蛋白可降解CⅠ蛋白(见第17章),诱导90%的细胞裂解。
有时λ也可自发地(10-5)从宿主的染色体上游离出来,进行复制,最终导致宿主细胞的裂解,此称为治愈(curing)。
游离在细胞质中的λ可以进行滚环复制,产生多个拷贝,并合成头部和尾部蛋白,包装成完整的λ噬菌体,使细胞裂解,释放出λ噬菌体再感染新的细胞。
(图8-19)。
因为λ噬菌体的DNA也有整合在染色体上和游离于细胞质中两种状态,所以也称做附加体。
但和F因子不同,λ噬菌体有细胞外形式,而F因子无细胞外形式。
在E.coli K12中是有原噬菌体的存在。
Jacob和Wollman(1956年)发现了合子诱导(zygotic induction)现象,并利用合子诱导确定了几个E.coli染色体上原噬菌体的整合位点。
λ噬菌体的裂解性和溶原性

生命科学学院λ噬菌体的裂解性和溶原性的基因调控机制姓名:学号:班级:专业:摘要λ噬菌体(phage)有两种生存策略,一种通过感染宿主细胞,产生大量的子代噬菌体,同时宿主细胞裂解死亡,这种方式称为裂解性感染。
另一种是噬菌体的基因组以一种原噬菌体的方式潜伏于细菌中,这种增值方式称为溶原态(lysogeny)。
λ噬菌体的裂解发育、溶原发育和溶原发育到裂解发育的诱导是研究生物分子调节优异的模型。
经过四十多年的研究,在这个模型中已经发现了众多的正调节因子和负调节因子在转录水平或转录后调节基因的表达。
关键词:λ噬菌体、裂解性、溶原性目录1.摘要 (2)2.λ噬菌体的结构组成 (3)2.1壳体结构 (3)2.2λ噬菌体的核心 (3)3.λ噬菌体的生活周期 (6)3.1 λ噬菌体DNA复制 (6)3.2λ噬菌体的转录调控 (7)3.3λ噬菌体的溶原性感染 (9)3.3.1λ噬菌体溶原化状态的建立 (9)3.3.2λ噬菌体基因组的整合 (11)3.3.3原噬菌体的割离 (12)3.3.4裂解性-溶原性选择决定 (15)4.参考文献 (16)1951年 Esther Lederberg 发现E.coli K12菌株经UV诱发或偶尔自发放出噬菌体。
E.coli K12中有潜伏的、无感染能力状态的噬菌体,称原噬菌体。
将这种噬菌体命名为λ。
λ侵染E.coli后可进入裂解周期(lytic cycle)或溶原周期(lysogeny)。
2.λ噬菌体的结构组成2.1壳体结构λ噬菌体是有尾噬菌体,壳体由头部和尾部组成,头部和尾部通过颈部相连。
头部通常呈二十面体对称,直径为60nm左右;尾部呈螺旋对称,无收缩性。
λ噬菌体头部蛋白主要有gpE(38kD)和gpD(12kD),他们以非二硫键进行共价连接。
2.2λ噬菌体的核心λ噬菌体核心包含线状dsDNA,分子量为30.8MD,含有48502bp,其双链DNA的两5′端叫做m端, 末端碱基为G,为左向或反时针方向转录的链。
λ噬菌体的裂解性和溶原性

生命科学学院λ噬菌体的裂解性和溶原性的基因调控机制姓名:学号:班级:专业:摘要λ噬菌体(phage)有两种生存策略,一种通过感染宿主细胞,产生大量的子代噬菌体,同时宿主细胞裂解死亡,这种方式称为裂解性感染。
另一种是噬菌体的基因组以一种原噬菌体的方式潜伏于细菌中,这种增值方式称为溶原态(lysogeny)。
λ噬菌体的裂解发育、溶原发育和溶原发育到裂解发育的诱导是研究生物分子调节优异的模型。
经过四十多年的研究,在这个模型中已经发现了众多的正调节因子和负调节因子在转录水平或转录后调节基因的表达。
关键词:λ噬菌体、裂解性、溶原性目录1.摘要 (2)2.λ噬菌体的结构组成 (3)2.1壳体结构 (3)2.2λ噬菌体的核心 (3)3.λ噬菌体的生活周期 (6)3.1 λ噬菌体DNA复制 (6)3.2λ噬菌体的转录调控 (7)3.3λ噬菌体的溶原性感染 (9)3.3.1λ噬菌体溶原化状态的建立 (9)3.3.2λ噬菌体基因组的整合 (11)3.3.3原噬菌体的割离 (12)3.3.4裂解性-溶原性选择决定 (15)4.参考文献 (16)1951年Esther Lederberg 发现E.coli K12菌株经UV诱发或偶尔自发放出噬菌体。
E.coli K12中有潜伏的、无感染能力状态的噬菌体,称原噬菌体。
将这种噬菌体命名为λ。
λ侵染E.coli后可进入裂解周期(lytic cycle)或溶原周期(lysogeny)。
2.λ噬菌体的结构组成2.1壳体结构λ噬菌体是有尾噬菌体,壳体由头部和尾部组成,头部和尾部通过颈部相连。
头部通常呈二十面体对称,直径为60nm左右;尾部呈螺旋对称,无收缩性。
λ噬菌体头部蛋白主要有gpE(38kD)和gpD(12kD),他们以非二硫键进行共价连接。
2.2λ噬菌体的核心λ噬菌体核心包含线状dsDNA,分子量为30.8MD,含有48502bp,其双链DNA的两5′端叫做m端, 末端碱基为G,为左向或反时针方向转录的链。
λ噬菌体的综述

生命科学学院病毒生物学λ噬菌体综述摘要:噬菌体是一类温和噬菌体,它们感染大肠杆菌后能进行溶菌性生长(Lytic growth)和溶源性生长(Lysogenic growth)。
其溶源特性对基因重组与遗传工程研究有很大帮助。
本文就λ噬菌体的基因组结构、溶关键词:λ噬菌体溶原性溶菌性基因克隆引言:大肠杆菌噬菌体λ为长尾噬菌体科,是一类中等大小的大肠杆菌病毒,其基因组为双链线状DNA,由48502对碱基组成,分子量3.2×107 ,约50个基因,特点是相关基因成簇排列,形成若干个操纵子。
基因组两端为粘性末端,中间有相当长的DNA片段是裂解生长非必需的,这就为其作为外源基因的克隆载体提供了方便。
λ噬菌体由头和尾构成,其基因组组装在头部蛋白质外壳内部,其序列已被全部测出。
感染时吸附位点为细胞壁。
属温和性感染;感染的DNA环化并整合于宿主基因组中。
以θ环双向复制,然后通过滚环机制单向复制。
用于感染大肠杆菌的λ噬菌体改造成的载体应用最为广泛。
1、The discovery of bacteriophage lambda1951年J. Lederberg的妻子Esther Lederberg第一个证明了 J. Lederberg和Tatum用来杂交的K-12中有原噬菌体,并命名为λ,经10年的研究搞清了溶原化的实质。
从此之后,λ噬菌体被广泛用于模式物种;1962年Esther Lederberg的同事并且还是她最好的朋友Allan Campbell首次发现了λDNA整合到细菌DN A的机制;之后由λ噬菌体改造后的载体广泛的用于基因工程。
2、The characteristics of bacteriophage lambda2.1、结构特点:λ为大肠杆菌温和性噬菌体,属长尾噬菌体科,头壳为直径约50nm的二十面体,其内包裹一长线状双链DNA分子(46500bp),因分子两端各有一含12个核苷酸的黏性末端,故又可黏合成环状分子。
一种改善外源基因在大肠杆菌中可溶性表达的方法[发明专利]
![一种改善外源基因在大肠杆菌中可溶性表达的方法[发明专利]](https://img.taocdn.com/s3/m/c1bec906aeaad1f347933f50.png)
专利名称:一种改善外源基因在大肠杆菌中可溶性表达的方法专利类型:发明专利
发明人:华子春,张红霞
申请号:CN01127171.X
申请日:20010905
公开号:CN1336436A
公开日:
20020220
专利内容由知识产权出版社提供
摘要:本发明属生物工程技术领域,所述利用烟草花叶病毒Ω前导序列改善外源基因在大肠杆菌中可溶性表达的方法,其特点在于:1.将烟草花叶病毒Ω前导序列添加到大肠杆菌表达载体中;2.含有烟草花叶病毒Ω前导序列的表达载体能和现有的其它改善表达的方法混合使用;3.该方法适用于生物工程制药业及基因工程、生物化学、分子生物学等研究;4.表达载体pTORG,是能有效提高具有生物活性的重组表达产物得率的GST高效融合表达载体。
申请人:南京大学
地址:210093 江苏省南京市汉口路22号
国籍:CN
代理机构:南京知识律师事务所
代理人:胡锡瑜
更多信息请下载全文后查看。
《λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究》范文

《λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究》篇一λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究λ噬菌体溶源/裂解转变的动力学研究与细胞壁裂解酶的信息学研究摘要:本文旨在探讨λ噬菌体在溶源与裂解转变过程中的动力学研究,以及与细胞壁裂解酶相关的信息学研究。
首先,我们详细分析了λ噬菌体生命周期的两种状态,包括溶源状态和裂解状态。
随后,通过动力学模型对这一过程进行量化研究,探讨了不同条件下λ噬菌体的转变机制。
最后,本文对细胞壁裂解酶的分子结构和功能进行了信息学分析,为理解噬菌体与宿主细胞的相互作用提供了新的视角。
一、引言λ噬菌体是一种常见的细菌病毒,其生命周期包括溶源和裂解两种状态。
这两种状态之间的转变是λ噬菌体感染和繁殖的关键过程。
近年来,随着分子生物学和信息学的发展,对λ噬菌体及其与宿主细胞相互作用的研究逐渐深入。
本文将重点探讨λ噬菌体在溶源与裂解转变过程中的动力学研究,以及与细胞壁裂解酶相关的信息学研究。
二、λ噬菌体的溶源与裂解状态1. 溶源状态:在此状态下,λ噬菌体基因组整合到宿主菌的染色体中,不产生新的病毒粒子。
宿主菌呈现出稳定、可遗传的特性,噬菌体的遗传信息与宿主基因组共同表达。
2. 裂解状态:当条件适宜时,λ噬菌体从溶源状态转变为裂解状态,开始大量复制并产生新的病毒粒子。
这一过程导致宿主细胞裂解并释放大量子代噬菌体。
三、λ噬菌体溶源/裂解转变的动力学研究1. 动力学模型:我们建立了一个描述λ噬菌体溶源/裂解转变过程的数学模型。
该模型考虑了环境因素、宿主细胞状态以及噬菌体的复制速率等因素。
2. 参数分析:通过实验数据和模拟结果,我们分析了不同参数对溶源/裂解转变的影响。
结果表明,环境因素如营养条件和温度等对噬菌体的转变过程具有重要影响。
3. 结果解读:通过动力学模型的分析,我们可以更好地理解λ噬菌体在溶源和裂解状态之间的转变机制,为进一步研究噬菌体的生命周期和感染过程提供理论支持。
《λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究》范文

《λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究》篇一λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究λ噬菌体溶源/裂解转变的动力学研究与细胞壁裂解酶的信息学研究摘要:本文旨在探讨λ噬菌体在溶源与裂解转变过程中的动力学研究,以及细胞壁裂解酶在其中的作用。
通过结合生物学实验与信息学分析,本文揭示了λ噬菌体生命周期中的关键阶段,以及裂解酶对这一过程的影响。
本研究对于理解噬菌体感染机制及细菌的抗性研究具有重要的理论和实践意义。
一、引言λ噬菌体是细菌病毒中一种常见的噬菌体,它通过宿主细胞的生命周期,展现出溶源与裂解两种不同的生活方式。
在溶源状态下,噬菌体基因组与宿主细胞染色体整合,而当特定条件触发时,可发生裂解转变,导致大量子代噬菌体的释放。
在这一过程中,细胞壁裂解酶扮演着关键角色。
本文将通过动力学研究和信息学分析,探讨这一过程的机制和影响因素。
二、λ噬菌体溶源/裂解转变的动力学研究1. 动力学模型构建通过建立数学模型,我们能够更好地理解λ噬菌体在溶源与裂解转变过程中的动态变化。
模型考虑了噬菌体的复制速率、宿主细胞的生长速率以及裂解转变的触发机制等因素。
通过模拟实验数据,我们能够预测不同条件下的噬菌体生命周期变化。
2. 动力学参数分析通过实验数据和模型分析,我们确定了影响λ噬菌体溶源/裂解转变的关键参数,如噬菌体的复制速度、宿主细胞的代谢状态等。
这些参数的变化对噬菌体的生命周期有着重要影响。
三、细胞壁裂解酶的信息学研究1. 裂解酶的结构与功能分析细胞壁裂解酶在λ噬菌体的裂解转变过程中发挥着重要作用。
通过生物信息学方法,我们分析了裂解酶的结构和功能,包括其催化机制、底物特异性等。
这些信息对于理解裂解酶在噬菌体生命周期中的作用至关重要。
2. 裂解酶与宿主细胞的相互作用研究通过分析裂解酶与宿主细胞的相互作用,我们揭示了裂解酶如何影响宿主细胞的代谢和生长。
此外,我们还研究了裂解酶的抗性机制,为开发针对噬菌体的抗性策略提供了理论依据。
《λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究》范文

《λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究》篇一λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究λ噬菌体溶源/裂解转变的动力学研究与细胞壁裂解酶的信息学研究一、引言λ噬菌体是一种广泛存在于大肠杆菌中的病毒,其生命周期中存在两种状态:溶源状态和裂解状态。
这两种状态之间的转变是生物学中一个重要的研究领域,对于理解病毒与宿主细胞之间的相互作用机制具有重要意义。
同时,细胞壁裂解酶作为裂解过程中的关键酶,也引起了研究者的广泛关注。
本文将重点探讨λ噬菌体溶源/裂解转变的动力学研究以及细胞壁裂解酶的信息学研究。
二、λ噬菌体溶源/裂解转变的动力学研究1. 研究背景λ噬菌体的溶源/裂解转变是一个复杂的生物学过程,涉及到多种基因的调控和蛋白质的相互作用。
这一过程的动力学研究对于理解λ噬菌体的生命周期和病毒与宿主细胞的相互作用具有重要意义。
2. 研究方法动力学研究主要采用实验方法和数学建模相结合的方式。
通过实验测定不同时间点λ噬菌体的数量、宿主细胞的状态等参数,建立数学模型描述这一过程的动态变化。
3. 研究结果研究表明,λ噬菌体的溶源/裂解转变是一个受多种因素调控的复杂过程。
其中,cI蛋白和cII蛋白等调控蛋白起着关键作用。
通过数学建模,可以揭示这一过程中各因素之间的相互作用关系,为进一步的研究提供理论依据。
三、细胞壁裂解酶的信息学研究1. 研究背景细胞壁裂解酶是裂解过程中的关键酶,对于理解裂解机制的深入研究具有重要意义。
信息学研究方法可以用于分析细胞壁裂解酶的序列、结构、功能等信息,为进一步的研究提供支持。
2. 研究方法信息学研究主要采用生物信息学方法,包括序列分析、结构预测、功能注释等。
通过分析细胞壁裂解酶的基因序列、蛋白质结构等信息,揭示其功能和作用机制。
3. 研究结果研究发现,细胞壁裂解酶具有高度的序列保守性和结构相似性,这表明其在进化过程中具有重要功能。
通过功能注释,可以了解细胞壁裂解酶在裂解过程中的具体作用。
《2024年λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究》范文

《λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究》篇一λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究λ噬菌体溶源/裂解转变的动力学研究与细胞壁裂解酶的信息学研究摘要:本文旨在探讨λ噬菌体在溶源与裂解转变过程中的动力学研究,以及与细胞壁裂解酶相关的信息学分析。
通过实验方法对λ噬菌体的溶源和裂解周期进行深入分析,并结合生物信息学技术对细胞壁裂解酶进行序列分析和功能研究。
此研究不仅有助于理解λ噬菌体的生命活动规律,还为进一步开发抗病毒药物和治疗手段提供理论依据。
一、引言λ噬菌体作为一种常见的细菌病毒,其溶源与裂解的转变过程在生物学上具有重要研究价值。
在病毒生命周期中,溶源和裂解两种状态之间的转换涉及到复杂的分子机制和动力学过程。
此外,细胞壁裂解酶作为噬菌体裂解过程中的关键酶,其结构和功能的研究对于理解噬菌体的感染机制具有重要意义。
二、λ噬菌体溶源/裂解转变的动力学研究1. 实验方法采用实时荧光定量PCR技术,对λ噬菌体在溶源和裂解状态下的基因表达水平进行监测,并利用流式细胞术观察细胞内噬菌体的动态变化。
2. 结果与讨论实验结果显示,在溶源状态下,λ噬菌体的基因表达相对稳定;而在裂解状态下,基因表达显著增加。
通过动力学模型分析,发现裂解过程中存在一个明显的激活阈值,当达到一定数量的噬菌体复制时,将触发裂解过程。
这一过程涉及多种调控因子和信号通路,共同维持噬菌体的生命周期。
三、细胞壁裂解酶的信息学研究1. 生物信息学分析利用生物信息学软件对细胞壁裂解酶的基因序列进行注释和结构预测。
通过多序列比对和进化树分析,探讨裂解酶的进化关系和功能多样性。
2. 结果与讨论通过对细胞壁裂解酶的基因序列分析,发现其具有典型的酶切位点和保守结构域。
这些结构特征与已知的裂解酶功能相吻合,表明其在噬菌体裂解过程中发挥关键作用。
此外,通过进化树分析,发现不同来源的裂解酶具有相似的进化路径和功能特点,这为进一步研究其功能和作用机制提供了重要线索。
《2024年λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究》范文

《λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究》篇一λ噬菌体溶源-裂解转变的动力学研究和细胞壁裂解酶的信息学研究λ噬菌体溶源/裂解转变的动力学研究与细胞壁裂解酶的信息学研究摘要:本文旨在探讨λ噬菌体在溶源与裂解转变过程中的动力学研究,以及细胞壁裂解酶在其中的作用。
通过结合生物学、物理学及信息学的研究方法,本文将深入分析λ噬菌体的生命周期及其与宿主细胞之间的相互作用机制。
一、引言λ噬菌体是一种典型的细菌病毒,其生命周期包括溶源和裂解两个阶段。
这一过程涉及到多种生物化学反应及基因表达调控,对理解病毒与宿主细胞的相互作用机制具有重要意义。
而细胞壁裂解酶作为噬菌体裂解阶段的关键酶,在病毒释放和新的感染循环中发挥着重要作用。
二、λ噬菌体溶源/裂解转变的动力学研究1. 溶源阶段与裂解阶段的转换λ噬菌体的生命周期中,溶源阶段与裂解阶段的转换受到严格调控。
这一过程涉及到噬菌体基因的表达、宿主细胞的反应等多个方面。
通过动力学模型,可以研究这一转换过程的速率、影响因素及调控机制。
2. 动力学模型的建立与应用建立动力学模型是研究λ噬菌体溶源/裂解转变的重要手段。
通过数学方程描述噬菌体复制、宿主细胞裂解等过程,可以更好地理解这一过程的细节和机理。
同时,动力学模型还可以用于预测不同条件下的噬菌体生命周期变化,为实验研究提供指导。
三、细胞壁裂解酶的信息学研究1. 细胞壁裂解酶的结构与功能细胞壁裂解酶是噬菌体裂解阶段的关键酶,具有水解细胞壁的作用。
通过生物信息学方法,可以分析其结构、功能及其与宿主细胞的相互作用。
这有助于理解细胞壁裂解酶在噬菌体释放和新的感染循环中的作用。
2. 细胞壁裂解酶的基因表达与调控基因表达与调控是细胞壁裂解酶发挥作用的关键。
通过转录组学、蛋白质组学等方法,可以研究细胞壁裂解酶的基因表达模式及调控机制。
这有助于理解噬菌体如何通过调控基因表达来控制其生命周期。
四、结论通过对λ噬菌体溶源/裂解转变的动力学研究和细胞壁裂解酶的信息学研究,我们可以更深入地理解噬菌体的生命周期及其与宿主细胞的相互作用机制。
λ噬菌体的裂解性和溶原性

生命科学学院λ噬菌体的裂解性和溶原性的基因调控机制姓名:学号:班级:专业:摘要λ噬菌体(phage)有两种生存策略,一种通过感染宿主细胞,产生大量的子代噬菌体,同时宿主细胞裂解死亡,这种方式称为裂解性感染。
另一种是噬菌体的基因组以一种原噬菌体的方式潜伏于细菌中,这种增值方式称为溶原态(lysogeny)。
λ噬菌体的裂解发育、溶原发育和溶原发育到裂解发育的诱导是研究生物分子调节优异的模型。
经过四十多年的研究,在这个模型中已经发现了众多的正调节因子和负调节因子在转录水平或转录后调节基因的表达。
关键词:λ噬菌体、裂解性、溶原性目录1.摘要22.λ噬菌体的结构组成 32.1壳体结构 32.2λ噬菌体的核心33.λ噬菌体的生活周期 63.1 λ噬菌体DNA复制 63.2λ噬菌体的转录调控73.3λ噬菌体的溶原性感染93.3.1λ噬菌体溶原化状态的建立93.3.2λ噬菌体基因组的整合113.3.3原噬菌体的割离123.3.4裂解性-溶原性选择决定154.参考文献161951年 Esther Lederberg 发现E.coli K12菌株经UV诱发或偶尔自发放出噬菌体。
E.coli K12中有潜伏的、无感染能力状态的噬菌体,称原噬菌体。
将这种噬菌体命名为λ。
λ侵染 E.coli后可进入裂解周期(lytic cycle)或溶原周期(lysogeny)。
2.λ噬菌体的结构组成2.1壳体结构λ噬菌体是有尾噬菌体,壳体由头部和尾部组成,头部和尾部通过颈部相连。
头部通常呈二十面体对称,直径为60nm左右;尾部呈螺旋对称,无收缩性。
λ噬菌体头部蛋白主要有gpE(38kD)和gpD(12kD),他们以非二硫键进行共价连接。
2.2λ噬菌体的核心λ噬菌体核心包含线状dsDNA,分子量为30.8MD,含有48502bp,其双链DNA的两5′端叫做m端, 末端碱基为G,为左向或反时针方向转录的链。
R链或右链5′端称为m′端,末端碱基为A。
植物基因工程中的λ噬菌体载体
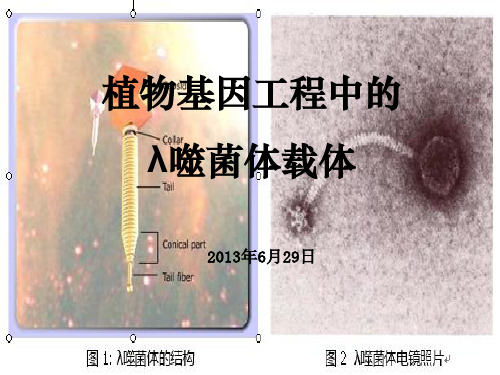
中段:从J到N长约 20kb,是λDNA整合 和切出,溶原生长所 需的序列 ,但非溶菌 生长所必需
右臂:长约10kb,控 制溶菌和溶原生长最重 要的调控基因和序列、 以及λDNA复制起始均 在这区域内。
➢ 基因组长约50kb ,至少包括61个基因,除少数例外,大多数编码基因均是按功噬菌体结构蛋白合成、组装成熟噬菌体、溶菌生 长所需全部序列;对溶菌生长来说,中段是非必需的。
(4)重组噬菌体的体外包装,形成有感染力 的噬菌体颗粒
• 利用特殊材料,制备噬菌体包装蛋白
• 连接产物与包装蛋白混合时,就可完成包 装反应,形成有感染力的噬菌体颗粒
• 包装蛋白对所包装的DNA大小有高度选择 性, 范围:λDNA分子的75%-105%
λ噬菌体的改造
• 设计去除λDNA上的多余序列和一些限制性酶切点:因为 λDNA较大,序列中的限制性酶切点过多,妨碍其应用。
•
相信相信得力量。20.12.272020年12月 27日星 期日4时26分33秒20.12.27
谢谢大家!
•
生活中的辛苦阻挠不了我对生活的热 爱。20.12.2720.12.27Sunday, December 27, 2020
•
人生得意须尽欢,莫使金樽空对月。04:26:3304:26:3304:2612/27/2020 4:26:33 AM
植物基因工程中的 λ噬菌体载体
2013年6月29日
载体(vector)是把一个有用的目的DNA片段通过重 组DNA技术,送进受体细胞中去进行繁殖和表达的工 具。 植物基因工程技术中尤为重要的是载体,不同目的 基因需要采用不同的载体。 组成植物基因工程载体系统常见的几种载体有:
质粒 λ噬菌体 柯斯质粒(cosmid) m13单链噬菌体。
漆酶N端融合His-tag或S-tag标签促进其在大肠杆菌中可溶性表达

漆酶N端融合His-tag或S-tag标签促进其在大肠杆菌中可溶性表达岳青霞;张丽洁;田健;伍宁丰;姚冬生【摘要】Laccase fromBacillus licheniformis has the advantages of high catalytic efficiency,wide range of substrates,etc.,thus it owns the broad application prospect in industrial and agricultural fields. However,the expression level of the enzyme in the foreign gene expression system is low,which greatly limits its application in the agricultural and industrial fields. His-tag or S-tag is the small peptide with low molecular weight and usually can not affect the characteristics of heterologous fusion protein,and they are beneficial to be applied in the purification and detection of heterologous proteins. In this study,fusion of His-tag and/or S-tag on the N-terminal of the laccase CotA fromB. licheniformiswas constructed into pET-22b vector,and the vector was transferred intoEscherichia coliBL(DE3),then we found that the soluble expression level of laccase significantly increased inE. coliBL(DE3). Compared with the construction without no fusion of any tags on N-terminal,the expression level with His-tag was about 37 folds,20 folds with S-tag,and 28 folds with both His-tag and S-tag,respectively.%来源于地衣芽孢杆菌的漆酶具有催效率高,底物范围广等优点在工农业等领域具有重要的应用前景,但该酶在外源基因表达系统中的表达量低,影响了其在工农业等领域的应用。
λ噬菌体溶源途径和裂解途径的基因调控

λ噬菌体溶源途径和裂解途径的基因调控摘要λ噬菌体侵染细胞后,大多数情况下进入裂解循环,λDNA复制,产生较多的噬菌体粒子。
而在以对数期以后的细菌和培养在缺乏碳源物质的培养基中的细菌作为寄主时进入溶源化途径,只有与溶源化有关的少数基因如cI才被表达。
另外溶源性细菌受到UV照射等因子诱导时,原噬菌体可以脱离细菌染色体而进行自我复制,最终导致细菌裂解,游离出大量噬菌体。
噬菌体是进入裂解循环还是整合到寄主染色体上形成溶源态,这主要取决于CI蛋白和Cro蛋白的合成及它们的调控作用。
关键词λ噬菌体,溶源化,裂解,基因调控,CⅠ蛋白,Cro蛋白一.λ噬菌体基因组和调控区λDNA分子总长度为48.5kb,编码66个基因(如下图所示),可分为三个区域:1.左臂区,自基因A到基因J,包括参与噬菌体头部蛋白质和尾部蛋白质合成所必需的全部基因。
2.中间区,介于基因J和基因N之间,这个区又称为非必需区,包含了与重组有关的基因(如基因gam)以及使噬菌体整合到大肠杆菌染色体中去的int基因和把原噬菌体从寄主染色体上切除下来的xis基因。
3.右臂区,位于N基因的右侧,包括全部主要的调控基因(cⅠ,c Ⅱ和cro),噬菌体的复制基因(O和P)以及溶菌基因(S和R)。
λ噬菌体主要的调节元件及调节基因产物的功能调节元件或调节基因产物及功能P L,O L, P R,O R左右向转录的启动子和操纵子t R(1,2,3,4,5)右向转录的终止子t L(1,2)左向转录的终止子P RE CⅠ蛋白建立启动子,受CⅡ蛋白调控P I int基因启动子,受CⅡ蛋白调控P aQ Q蛋白反义RNA启动子,受CⅡ蛋白调控P RM CⅠ蛋白基因维持启动子,受CⅠ浓度调控P R′晚期转录的启动子nut L, nut R N蛋白左右两个反终止结合位点qut Q蛋白反终止结合位点cro P L和P R的阻遏蛋白,并可阻遏P E,抑制 CI 表达c I P L和P R的主要的阻遏物,并可自主调控P RMcⅡ可以启动P RE、P I和P AQ,使λ进入溶原化途径cⅢ和CⅡ组成复合物,启动P E产生cⅠ及cro的反义RNA N t R1, t R2及t L1的反终止蛋白Q t R4的反终止蛋白.二.λ噬菌体转录调控λ噬菌体的调控有多种形式,有正调节、负调节、自主性的反馈调节、抗终止调节、反义调节及反向调节等。
λ噬菌体的裂解性和溶原性的基因调控机制

λ噬菌体的裂解性和溶原性的基因调控机制摘要:λ噬菌体(phage)有两种生存策略,一种通过感染宿主细胞,产生大量的子代噬菌体,同时宿主细胞裂解死亡,这种方式称为裂解性感染。
另一种是噬菌体的基因组以一种原噬菌体的方式潜伏于细菌中,这种增值方式称为溶原态(lysogeny)。
λ噬菌体的裂解发育、溶原发育和溶原发育到裂解发育的诱导是研究生物分子调节优异的模型。
经过四十多年的研究,在这个模型中已经发现了众多的正调节因子和负调节因子在转录水平或转录后调节基因的表达。
关键词:λ噬菌体、裂解性、溶原性1951年J. Lederberg的妻子Esther Lederberg证明了J. Lederberg和Tatum用来杂交的K12中有原噬菌体,并命名为λ,经10年的研究搞清了溶原化的实质。
λ噬菌体的基因组长达50 Kb,共61个基因,其中38个较为重要。
其生活史如图8-15所示,可分为裂解周期和溶原周期。
细菌处于溶原化状态时,细胞质中有一些λ CⅠ基因的产物CⅠ蛋白,这是一种阻遏蛋白,可以阻止λ左、右两个早期起动子的转录,使之不能产生一些复制及细胞裂解的蛋白。
λ的DNA随着宿主的染色体复制而复制。
但在UV诱导下Rec蛋白可降解CⅠ蛋白(见第17章),诱导90%的细胞裂解。
有时λ也可自发地(10-5)从宿主的染色体上游离出来,进行复制,最终导致宿主细胞的裂解,此称为治愈(curing)。
游离在细胞质中的λ可以进行滚环复制,产生多个拷贝,并合成头部和尾部蛋白,包装成完整的λ噬菌体,使细胞裂解,释放出λ噬菌体再感染新的细胞。
(图8-19)。
因为λ噬菌体的DNA也有整合在染色体上和游离于细胞质中两种状态,所以也称做附加体。
但和F因子不同,λ噬菌体有细胞外形式,而F因子无细胞外形式。
在E.coli K12中是有原噬菌体的存在。
Jacob和Wollman(1956年)发现了合子诱导(zygotic induction)现象,并利用合子诱导确定了几个E.coli染色体上原噬菌体的整合位点。
解毒酶基因的克隆及在大肠杆菌中的融合表达

解毒酶基因的克隆及在大肠杆菌中的融合表达黄菁;乔传令;李瑄;邢建民【期刊名称】《遗传学报:英文版》【年(卷),期】2001(28)6【摘要】用RT-PCR克隆了酯酶B15’端B1(a),并对其进行了序列测定,将其与3’端B1(b)一起连接到pET-28a中,构建了完整融合表达载体pET-ESTB1。
转化大肠杆菌BL21,在IPTG诱导下,经过12小时,酯酶B1在大肠杆菌内的融合表达达到27%。
通过纯化获得1条带的重组蛋白。
用粗酶对马拉硫磷的降解显示,该解毒酶在15分钟即降解22.1%,具有较高降解有机磷酸酯类农药的能力。
为利用真核生物的自然资源进行农药污染的生物治理等提供了新途径。
【总页数】6页(P583-588)【关键词】酯酶B1;克隆;表达;解毒酶;农药;昆虫;融合表达【作者】黄菁;乔传令;李瑄;邢建民【作者单位】中国科学院动物研究所农业虫鼠害综合治理国家重点实验室【正文语种】中文【中图分类】S481.4;S433【相关文献】1.Sulfolobus tokodaii strain 7高温酸性α-淀粉酶基因在大肠杆菌中克隆表达及其酶学性质 [J], 魏涛;孙浩;申玉龙;毛多斌2.大肠杆菌NADP特异性谷氨酸脱氢酶基因的克隆及其在大肠杆菌中的高效表达与纯化 [J], 李永海;徐燕;席慧;刘凤华;周霞;高音3.尿酸氧化酶与肌酐水解酶融合基因的克隆及其在大肠杆菌中的表达 [J], 程新;刘芳;张彦新;蒋云生4.产β-淀粉酶菌株的筛选及β-淀粉酶基因在大肠杆菌中的克隆与表达 [J], 李猛;陈利飞;杨建楼;马春玲5.黄曲霉毒素分解酶基因克隆及其在\r大肠杆菌中的融合表达 [J], 李旺;史敦胜;丁轲;曹平华;赵龙妹因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第38卷第2期2016年3月湖北大学学报(自然科学版)JournalofHubeiUniversity(NaturalScience)Vol.38㊀No.2㊀Mar.,2016㊀收稿日期:20151021基金项目:国家高技术研究发展计划(014AA021303⁃04)资助作者简介:陈晚苹(1987⁃),女,助理实验师;马立新,通信作者,教授,E⁃mail:malixing@hubu.edu.cn文章编号:10002375(2016)02011604λ噬菌体切除酶基因Xis在大肠杆菌中的可溶性融合表达陈晚苹,周玉玲,马立新(工业生物技术湖北省重点实验室(湖北大学),湖北武汉430062)摘要:λ噬菌体切除酶Xis(excisionase)是调控λ噬菌体溶源裂解转换过程中的一种重要蛋白质.通过密码子优化及两步法将来自λ噬菌体切除酶基因Xis在体外合成,然后克隆到带有类泛素蛋白SUMO标签的定向原核表达载体SUMO⁃pETG上,测序正确后,然后转化至E.coliBL21(DE3)细胞可溶性表达.经SDS⁃PAGE及质谱检测证实表达蛋白确实为目的蛋白.该研究通过融合表达λ噬菌体切除酶Xis不仅解除了Xis对E.coli宿主细胞的毒害作用,而且实现在E.coli中的高水平可溶性表达.因此,Xis的大量制备,将会促进Gateway克隆技术的广泛应用.关键词:λ噬菌体切除酶Xis;大肠杆菌;融合表达;鉴定中图分类号:Q786㊀㊀文献标志码:A㊀㊀DOI:10.3969/j.issn.1000⁃2375.2016.02.006Soluble⁃fusionexpressionofλphageexcisionenzymeXisgeneinEscherichiacoliCHENWanping,ZHOUYuling,MALixin(HubeiKeyLaboratoryofIndustrialBiotechnology(HubeiUniversity),Wuhan430062,China)Abstract:ExcisionenzymeXisfromλphageisanimportantproteinintheprocessofLysogeniccrackingconversion.TheopenreadingframecodingexcisionaseXiswasoptimizedbasedonthepreferenceofE.colicodonusageandsynthesizedinvitro.ThenovelgenewasclonedintoE.coliexpressionvectorSUMO⁃pETGandthesequencecodingSUMOtagwasfusedwiththeORFofXisgene.ThecorrectrecombinantplasmidsbysequencingweretransformedintoE.coliBL21(DE3).SupernatantwasdetectedbySDS⁃PAGEandMassspectrometry.TheresultsshowedthatXiswassuccessfullyexpressed.ThisresearchnotonlyrelievedthetoxiceffectsfromXistoE.colihostcells,butalsoachievedthehighlevelofsolubleexpressionofXisinE.coli.Therefore,itslarge⁃scalepreparationmaypromotetheextensiveapplicationofGatewaycloningtechnologyinfuture.Keywords:excisionaseXis;Escherichiacoli;fusionexpression;identification0㊀引言Gateway基因克隆是由Invitrogen公司在20世纪90年代末发明并应用于分子生物学基因克隆的一项技术,它的原理是建立在λ噬菌体DNA定点整合到细菌宿主基因组上[1],在噬菌体和细菌的整合因子(IHF(integrationhostfactor)㊁Int(integrase))的作用下,λ的attP位点和大肠杆菌基因组的attB位点可以发生定点重组[2],λ噬菌体DNA整合到大肠杆菌的基因组DNA中.这是一个可逆的过程,在λ噬菌第2期陈晚苹,等:λ噬菌体切除酶基因Xis在大肠杆菌中的可溶性融合表达117㊀体编码蛋白Xis和IHF㊁Int的共同介导下这两个位点再次发生重组,从而导致噬菌体从细菌基因组上裂解下来.目前Gateway克隆技术是亚克隆DNA序列的一项新颖的通用系统,便于功能基因的分析和蛋白质的表达,一旦进入这个多功能的操作系统,DNA片段可以通过位点特异的重组在载体之间转移.Gateway克隆技术在研究植物转基因[3]㊁植物功能基因组学和蛋白质组学[4],在高通量克隆技术㊁定点突变㊁基因插入和缺失[5]等方面有广泛的应用.Gateway克隆除受控于重组位点外,还受控于GatewayClonase酶[6],如Xis和IHF㊁Int.由于GatewayClonase酶具有介导DNA重组的作用,对目的宿主有潜在的毒性和伤害.因此,这些蛋白都是通过λ噬菌体中提取分离得到,由于提取纯化步骤复杂且含量低,成本很高[7],这就限制了Gateway技术的大规模应用.λ噬菌体基因组基因Xis编码的切除酶是调控λ噬菌体溶源裂解转换过程中一种重要的蛋白质[8].由于切除酶Xis蛋白存在潜在的细胞毒性,从而限制了其在宿主中的高水平表达.因此,目前国内外少有文献报道有关该蛋白的原核表达以及纯化.本研究通过基因优化和两步法基因合成,然后将该基因克隆到带有SUMO标签[9]的原核表达载体上,一方面实现了Xis在大肠杆菌中高水平的可溶性表达,解决Xis对宿主细胞的毒害作用;另一方面利用融合蛋白所携带的6ˑHis组氨酸标签,成功纯化目的蛋白.Xis的大量制备,解除了Gateway的限制因素,将会促进Gateway克隆技术的广泛应用.1㊀实验部分1.1㊀实验材料㊀表达载体SUMO⁃pETG㊁用于表达的大肠杆菌BL21(DE3)㊁用于克隆的大肠杆菌DH10β为本实验室保存.1.2㊀主要试剂㊀DNAMarkers㊁SolutionⅠ连接试剂盒㊁LATaq聚合酶购自TaKaRa公司;SUMO蛋白酶购置上海索莱宝生物科技有限公司;蛋白质分子量标准和限制性内切酶BfuⅠ购于Fermentas公司;质粒抽提试剂盒㊁琼脂糖凝胶回收试剂盒购至Axygene公司,Ni⁃NTA试剂盒购置于Invitrogen公司.引物均在上海桑尼生物科技有限公司合成.所有的分子克隆操作都按照Sambrook等[9]提供的方法进行.1.3㊀主要仪器㊀干式恒温器㊁梯度PCR仪来自TaKaRa公司;蓝盾621型蓝光仪购置于Bio⁃V(百唯信公司生物公司);24孔高速离心机购自Eppendorf公司;冷冻离心机,Biochemistry成像系统购自UVP公司;层析柜购置于北极光博士德医学实验中心.1.4㊀实验方法1.4.1㊀SUMO⁃pETG⁃Xis载体的构建㊀在GenBank中找到λ噬菌体切除酶Xis基因的编号为:KT232076.1,根据基因序列翻译成氨基酸序列,利用DNAWorks3.2[10]根据E.coli密码子偏爱性进行优化设计需要的引物(未列出),采用两步法合成全基因[11]合成上述基因,利用实验室的高效T载体,在下游引物5 端额外添加7bp部分LacO序列(5⁃CACAATT⁃3)[12].质粒载体sumo⁃pETG用BfuⅠ进行双切,分别回收载体和目的基因的PCR产物,用SolutionⅠ连接试剂盒连接回收的片段和载体,连接反应参见试剂盒说明,连接产物转化大肠杆菌DH10β感受态细胞,涂布含有50μg/mL氨苄西林钠和25μg/mLX⁃gal的LB平板.在37ħ培养箱中避光培养10h后,挑取蓝色转化子,抽提质粒进行PCR检测,初步鉴定为重组子的质粒由上海桑尼生物工程公司测序并进行序列分析.1.4.2㊀SUMO⁃Xis融合蛋白的表达和SDS⁃PAGE检测㊀将测序正确的SUMO⁃pETG⁃Xis质粒转化大肠杆菌BL21(DE3)感受态细胞,蛋白质表达和SDS⁃PAGE检测方法参见分子克隆手册[9].1.4.3㊀融合蛋白的镍柱纯化以及SDS⁃PAGE检测㊀经诱导表达后的菌体收集后,破菌离心后收集上清,根据融合蛋白带的组氨酸标签进行纯化,纯化方法见镍柱纯化试剂盒说明.1.4.4㊀目的蛋白质质谱鉴定㊀将融合的目的蛋白质用SUMO蛋白酶处理后,SDS⁃PAGE检测,将目的条带从SDS⁃PAGE胶上割下,按文献[13]进行胶内消化与质谱鉴定分析.118㊀湖北大学学报(自然科学版)第38卷2㊀结果部分2.1㊀SUMO⁃pETG⁃Xis载体的构建图谱及鉴定㊀根据上述构建方法,得到SUMO⁃pETG⁃Xis重组质粒载体,其载体图谱和PCR鉴定结果如图1⁃2.用实验室构建的SUMO⁃pETG,利用LacO重构的原理,筛选不发光的蓝色菌落抽提质粒做PCR初步鉴定重组子[12],Xis基因片段大小为219bp,与理论预测的一致(如图2).图1㊀载体SUMO⁃pETG⁃Xis的构建过程㊀㊀㊀㊀图2㊀SUMO⁃pETG⁃Xis重组质粒PCR结果M:DL2000marker;1㊁2㊁3㊁4㊁5㊁6㊁7:为不同的重组质粒模板;正对照:加λ噬菌体DNA模板;负对照:不加模板.㊀2.2㊀SUMO⁃Xis融合蛋白的表达㊀将测序正确的SUMO⁃pETG⁃Xis重组质粒转化大肠杆菌BL21(DE3),IPTG诱导蛋白质表达,破菌,上清SDS⁃PAGE分析如图3所示.SUMO⁃Xis融合蛋白的理论分子量为18.8kDa,SDS⁃PAGE结果显示目标蛋白在18.4kDa和25kDa之间,和预期大小一致,且在破菌上清中,证明目的蛋白成功可溶性表达.2.3㊀SUMO⁃Xis融合蛋白的纯化及SDS⁃PAGE检测㊀根据融合蛋白N端所带的6ˑHIS标签,用镍柱纯化试剂盒纯化,该蛋白在咪唑浓度为100mmol/L或150mmol/L时洗脱下来.SDS⁃PAGE检测,如图4所示.纯化后只有一条目蛋白,且该蛋白大小与目的蛋白大小一致,证明此蛋白就是需要的目标蛋白.图3㊀融合蛋白SDS⁃PAGE检测图M为蛋白质marker,C为转入的空载体诱导后的破菌上清做对照,1㊁2㊁3为随机挑取的3个转化子诱导后的样品.㊀㊀㊀图4㊀融合蛋白纯化后SDS⁃PAGE检测图图中M为蛋白质marker,1㊁2分别为目的蛋白在咪唑浓度为100㊁150mmol/L洗脱的样品,3为150mmol/L第二次洗脱的样品.㊀2.4㊀Xis蛋白的质谱鉴定㊀纯化后的重组蛋白质通过SUMO蛋白酶处理后,SDS⁃PAGE条带割胶处理后,经串联飞行质谱鉴定,在质谱数据(MATRIXSCIENCE)分析网站(http://www.matrixscience.com)上分析质谱数据,如图5所示,根据网站在数据库里分析的数据得出重组蛋白为λ噬菌体切除酶.第2期陈晚苹,等:λ噬菌体切除酶基因Xis在大肠杆菌中的可溶性融合表达119㊀图5㊀重组蛋白质谱鉴定结果3㊀讨论λ噬菌体基因组编码的切除酶Xis是调控λ噬菌体溶源裂解途径中的一种重要的蛋白质,也是Gateway克隆技术中起催化作用的酶的关键组成成分之一.目前Xis主要是通过提取λ噬菌体分离得到,提取分离成本高.目前Xis的重组表达在国内外报道很少,导致Gateway克隆技术的大规模应用受到限制.本研究利用促溶标签sumo,在大肠杆菌中成功表达噬菌体内切酶Xis,且成功纯化并鉴定.该重组蛋白的高效表达解决了Xis毒性蛋白在原核表达时出现的不可溶或可溶性表达量偏低的问题,也进一步证实了sumo蛋白的促溶特性,为今后表达不可溶蛋白提供了一种思路.由于Xis只是GatewayLRClonase酶中其中一种组成成分,我们需要进一步验证该蛋白的活性,将GatewayLRClonase的成本降低,从而方便科学研究者能够更加广泛地运用Gateway克隆技术.4㊀参考文献[1]PapagiannisCV,SamMD,AbbaniMA,etal.FistargetsassemblyoftheXisnucleoproteinfilamenttopromoteexcisiverecombinationbyphagelambda[J].JMolBiol,2007,367(2):328⁃343.[2]LiuQH,LiMZ,LeibhamD,etal.Theunivectorplasmid⁃fusionsystem,amethodforrapidconstructionofrecombinantDNAwithoutrestrictionenzymes[J].CurrBiol,1998,8(24):1300⁃1309.[3]CurtisMD,GrossniklausU.Agatewaycloningvectorsetforhigh⁃throughputfunctionalanalysisofgenesinplanta[J].PlantPhysiol,2003,133(2):462⁃469.[4]DubinMJ,BowlerC,BenvenutoG.Amodifiedgatewaycloningstrategyforoverexpressingtaggedproteinsinplants[J].PlantMethods,2008,4:(1):1⁃11.[5]AtanassovII,AtanassovII,EtchellsJP,etal.Asimple,flexibleandefficientPCR⁃fusion/Gatewaycloningprocedureforgenefusion,site⁃directedmutagenesis,shortsequenceinsertionanddomaindeletionsandswaps[J].PlantMethods,2009,5(14):1746⁃1748.[6]Invitrogen:Gateway TechnologyManual[EB/OL].[http://tools.invitrogen.com/content/sfs/manuals/gatewaymanpdf].[7]JohnsonES.Proteinmodificationbysumo[J].AnnuRevBiochem,2004,73:355⁃82.[8]ChoEH,GumportRI,GardnerJF.Interactionsbetweenintegraseandexcisionaseinthephagelambdaexcisivenucleoproteincomplex[J].Bacteriol,2002,184:5200⁃5203.[9]SambrookJ,RussellDW.Molecularcloning:alaboratorymanual[M].3rded.NewYork:ColdspringHarborLaboratoryPress,2002.[10]HooverDM,LubkowskiJ.DNAWorks:anautomatedmethodfordesigningoligonucleotidesPCR⁃basedgenesynthesis[J].NucleicAcidsRes,2002,30(10):e43.[11]YoungL,DongQ.Two⁃steptotalgenesynthesismethod[J].NucleicAcidsRes,2004,32(7):e59.[12]ZhongX,ZhaiC,ChenL,etal.ConstructionofdirectionalTvectorforgenecloningandexpression(inChinese)[J].ChineseJournalofBiotechnology,2013,29(4):510⁃519.[13]ChenXM,ZhaiC,KangLX,etal.High⁃levelexpressionandcharacterizationofahighlythermostablechitosanasefromAspergillusfumigatusinPichiapastoris[J].BiotechnolLett,2012,34(4):689⁃694.(责任编辑㊀游俊)。
