化学反应中的热量变化
化学反应中的热量变化

写出下列反应的热化学方程式。 (1)1mol硫粉完全燃烧生成二氧化硫气体,放出296kJ 热量 (2)9g铝与足量氯气化合生成固体氯化铝,放出热量 274.2kJ (3)10g CaCO3分解吸收热量17.56kJ (4) 4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热 量
3、下列说法正确的是(
你见过化学反应中伴随着的 能量转化吗?能举例说明吗?
镁条的燃烧
闪电时产生氮氧化物
专题2 化学反应与能量转化
第二单元 化学反应中的热量
学习目标
•了解放热反应、吸热反应的定义及判断 •掌握热化学方程式的书写 •能够从宏观和微观两个角度分析化学反 应中的能量变化并能够进行计算
所有化学反应均伴随着热量变化 A + B = C
如何用化学用语表示放热反应和 吸热反应?
二、热化学方程式
1.定义:表明反应放出或吸收的热量的化学 方程式叫热化学方程式。
观察与比较
氢气燃烧的化学方程式:2H2 + O2 == 2H2O
氢气燃烧的热化学方程式
① 2H2(g) + O2(g) = 2H2O(l) ② H2(g) + 1/2O2(g) = H2O(l) △H =-571.6 kJ •mol- 1 △H =-285.8 kJ •mol- 1
C.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mol
D.C(s) + O2(g) === CO2(g) △H= + 393.5 kJ/mol
3、热化学方程式C(s)+H2O(g) = CO(g)+H2(g); △H =+131.3kJ/mol表示( C)
A.碳和水反应吸收131.3kJ能量 B.1mol碳和1mol水反应生成一氧化碳和氢 气,并吸收131.3kJ热量 C.1mol固态碳和1mol水蒸气反应生成一氧化 碳气体和氢气,并吸热131.3kJ D.1个固态碳原子和1分子水蒸气反应吸热 131.1kJ
化学反应的能量变化

化学反应的能量变化化学反应是指化学物质之间的转化过程。
在化学反应中,物质的组成和性质发生了变化,伴随着能量的转化。
能量变化是指反应过程中吸收或释放的能量。
本文将探讨化学反应的能量变化以及其影响因素。
一、能量变化的类型化学反应的能量变化可以分为两种类型:放热反应和吸热反应。
1. 放热反应放热反应是指在反应过程中释放热量的反应。
在这种反应中,反应物中的化学键被破坏,新的化学键形成,释放出来的能量以热的形式释放出来。
典型的放热反应是燃烧反应,如燃料与氧气反应生成二氧化碳和水,同时产生大量热能。
2. 吸热反应吸热反应是指在反应过程中吸收热量的反应。
在这种反应中,反应物吸收外界热量,以满足反应进行所需的能量。
典型的吸热反应是化学合成反应,如氨合成反应中,氢气和氮气反应生成氨气,需要吸收大量的热量。
二、能量变化的计量化学反应的能量变化可以通过测定反应物和生成物的焓变来计量。
焓变(ΔH)是指反应过程中系统吸热或放热的能量变化。
1. 焓变的计量方法焓变可以通过实验测定或计算获得。
实验测定常用的方法是在恒定压力下测量反应物和生成物之间的温度变化,利用热容和温度变化计算焓变。
计算方法包括熔化热、汽化热、反应热等。
2. 焓变的表示方法焓变的表示方法有两种:ΔH>0表示吸热反应,ΔH<0表示放热反应。
焓变也可以表示为定压下的焓变(ΔH)和定容下的焓变(ΔU)。
三、能量变化的影响因素化学反应的能量变化受多种因素影响,包括温度、压力、浓度和催化剂等。
1. 温度的影响温度是影响化学反应速率和能量变化的重要因素。
在放热反应中,温度上升可以增加反应速率,并提高能量释放的程度。
在吸热反应中,温度上升可以加速反应进行,并增加吸热量。
2. 压力的影响压力对大部分化学反应的能量变化没有显著的影响。
但对于气相反应,增加压力会使反应物分子之间更密集,碰撞频率增加,从而增加反应速率和能量变化。
3. 浓度的影响浓度的变化对反应的能量变化有一定的影响。
化学反应中的焓变和能量变化

化学反应中的焓变和能量变化化学反应是物质之间发生的变化过程,其中伴随着焓变和能量变化。
焓变是指化学反应中发生的能量变化,它可以使系统释放或吸收能量。
本文将深入探讨化学反应中的焓变和能量变化。
1. 焓变的定义及计算方法焓变(ΔH)可以理解为热变化,是指在等温条件下,系统在化学反应中吸热或放热的量。
焓变可以通过测量反应前后物质的热容和温度变化来计算,计算公式如下:ΔH = ∑(n_i*H_i)其中,ΔH为焓变,n为反应物或生成物的摩尔数,H为摩尔焓。
2. 焓变的正负及其含义焓变的正负表明了化学反应释放热量还是吸收热量。
当焓变为正值时,表示反应吸热,即从周围环境中吸收热量;当焓变为负值时,表示反应放热,即向周围环境释放热量。
3. 焓变和反应热的关系焓变与反应热之间存在着一定的关系。
反应热是指摩尔焓变,表示单位摩尔反应物完全参与反应时放出或吸收的热量。
反应热与化学方程式中的摩尔系数有关,可以通过实验测量得到。
4. 焓变和能量变化的关系焓变是化学反应中的能量变化方式之一,化学反应的焓变可以分为两部分:化学焓变和物理焓变。
化学焓变是指化学反应发生时,分子之间的键能发生变化,从而产生能量变化。
物理焓变是指由于温度或压力的变化导致的热量变化。
5. 焓变与律动性原理的应用焓变的概念与热力学中的律动性原理密切相关。
律动性原理认为,一个断裂的分子键在合成时需要吸收一定量的能量,而在分解时则放出一定量的能量。
利用焓变和律动性原理,可以推断化学反应的倾向性和方向性。
6. 焓变与化学反应速率的关系化学反应速率受到焓变的影响。
一般来说,焓变越大,反应速率越快。
这是因为焓变较大的反应需要较少的能量激活,因此反应速率较快。
7. 焓变与燃烧反应的关系焓变在燃烧反应中起着重要的作用。
燃烧反应是一种放热反应,因此焓变为负值。
燃烧反应中的焓变可以用来计算可燃物质的热值,即燃烧单位质量可得到的能量。
综上所述,焓变是化学反应中的重要概念,用于描述系统吸热或放热的能力。
化学反应中的热量变化

一、化学反应中的热量变化放热反应:有热量放出的化学反应。
吸热反应:要吸收热量的化学反应。
1.常见放热与吸热反应放热反应:①酸碱中和②所有燃烧反应③金属与酸反应④大多数的化合反应⑤(浓硫酸)CaO等溶解吸热反应:①CO2+C==2CO ②H2O+C==CO+H2 ③Ba(OH)2晶体与NH4Cl(铵盐)反应④大部分的分解反应(⑤硝酸铵的溶解)…需要加热进行的反应是不一定就是吸热反应;需要持续加热才能进行的反应是吸热反应。
2.为什么化学反应有放热或吸热的现象呢?化学反应为旧物质的消亡、新物质的生成(宏观),即原子的重新组合(微观)。
新旧物质结构不同,本身具有的能量也不同,而反应中能量是守恒的。
过程中反应体系的能量变化曲线图:四、热值热值:在一定条件下单位质量的物质完全燃烧所放出的热量。
燃料的充分燃烧1.燃烧时要有适当过量的氧气。
2.燃料与空气要有足够大的接触面积练习1.下列各图中表示热化学方程式A(g)+B(g)===C(g)+D(l)ΔH<0的是(E表示能量)()2.下列说法中正确的是()A.物质发生化学反应都伴随能量变化B.伴有能量变化的物质变化都是化学变化C .断开HCl 放出能量D .在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量3.下列反应属于吸热反应的是( )A .木炭在氧气中燃烧B .锌与盐酸的反应C .盐酸与氢氧化钠溶液的反应D .石灰石在高温下的分解反应4.下列热化学方程式书写正确的是( )A .2SO 2+O 22SO 3 ΔH =-196.6 kJ·mol -1 B .H 2(g)+12O 2(g)===H 2O(l)ΔH =+241.8 kJ·mol -1C .2H 2(g)+O 2(g)===2H 2O(l)ΔH =-571.6 kJ·mol -1D .C(s)+O 2(g)===CO 2(g)ΔH =+393.5 kJ·mol -15.下列对热化学方程式1/2H 2(g)+1/2I 2(g)===HI(g) ΔH =+26 kJ·mol-1的叙述中,正确的是( )A .1 mol 氢气和1 mol 碘蒸气完全反应需要吸收26 kJ 的热量B .1个氢分子和1个碘分子完全反应需要吸收52 kJ 的热量C .1 mol H 2(g)与1 mol I 2(g)完全反应生成2 mol 的HI 气体需吸收52 kJ 的热量D .1 mol H 2(g)与1 mol I 2(g)完全反应放出26 kJ 的热量提高1.下列说法不正确的是 ( )A .任何化学反应都伴随有能量变化B .化学反应中的能量变化都表现为热量的变化C .反应物的总能量高于生成物的总能量时,发生放热反应D .反应物的总能量低于生成物的总能量时,发生吸热反应2.已知化学反应2C(s)+O 2(g)=2CO 、2CO(g)+O 2(g)=2CO 2(g)都是放热反应,下列说法不正确的是 ( )A .12gC 所具有的能量一定高于28gCO 所具有的能量B .56gCO 和32gO 2所具有的总能量大于大于88gCO 2所具有的总能量C .12gC 和32gO 2所具有的总能量大于44gCO 2所具有的总能量D .将一定量的C 燃烧,生成CO 2比生成CO 时放出的热量多3.下列反应过程中的能量变化情况符合右图的是 ( )A .酸与碱的中和反应B .镁和盐酸的反应C .氧化钙和水反应D .水发生分解反应4.下列热化学方程式书写正确的是 ( )A .2SO 2+O 22SO 3 ΔH =-196.6kJ·mol -1 B .H 2(g)+ 21O 2(g)==H 2O(l) ΔH =-285.8kJ·mol -1 C .2H 2(g)+O 2(g)==2H 2O(l) ΔH =+571.6kJ·mol -1D .C(s)+O 2(g)==CO 2(g) ΔH =+395.9kJ·mol -15(双选).下列说法正确的是 ( )A .需要加热的化学反应都是吸热反应B .中和反应都是放热反应C .由C(石墨,s)==C(金刚石,s) ΔH =+1.9kJ·mol -1可知,金刚石比石墨稳定D .等量的硫蒸气和硫固体分别燃烧,前者放出热量多6.沼气是一种能源,它的主要成分是CH 4。
化学反应中的热效应与焓变

化学反应中的热效应与焓变化学反应中的热效应与焓变是化学领域中非常重要的概念。
热效应是指化学反应过程中放出或吸收的热量,而焓变则表示在常压下化学反应中热量的变化情况。
本文将详细介绍热效应与焓变的相关概念、计算方法以及其在化学领域的应用。
一、热效应的概念热效应是指在化学反应中放出或吸收的热量。
化学反应可以放热,也可以吸热。
当反应过程中放出的热量大于吸收的热量时,称为放热反应;相反,当反应过程中吸收的热量大于放出的热量时,称为吸热反应。
热效应的单位为焦耳(J)或千焦(kJ)。
二、焓变的概念在常压下,化学反应的热量变化可以用焓变来表示。
焓变是指化学反应过程中系统的焓的变化。
系统的焓变可以表示为反应物的焓与生成物的焓之差。
当焓变为负值时,表示反应是放热的;当焓变为正值时,表示反应是吸热的。
焓变的单位通常使用焦耳(J)或千焦(kJ)。
三、计算热效应与焓变的方法计算热效应和焓变的方法主要有两种:热量计法和热化学方程法。
1. 热量计法热量计法是通过测量反应过程中系统和周围的热量变化来计算热效应或焓变。
在实验室中,可以使用量热器进行实验测定。
首先,在量热器中放入适量的反应物,观察反应过程中的温度变化,通过测量温度的升降,可以计算出反应过程中系统的热效应或焓变。
2. 热化学方程法热化学方程法是通过已知反应的热效应或焓变,推导出其他反应的热效应或焓变。
利用已知的热化学方程式,通过系数的变化来计算所需化学反应的热效应或焓变。
通过已知的焓变值和平衡的热化学方程,可以使用化学计量学原理进行计算,得到所需的热效应或焓变。
四、热效应与焓变的应用热效应和焓变在化学领域中有着广泛的应用。
以下是其中几个重要的应用:1. 燃烧热燃烧反应是一种非常常见的化学反应,通过燃烧反应可以释放出大量热能。
通过计算燃烧反应的热效应或焓变,可以了解燃料的热值,并且可以比较不同燃料之间的热效应大小,从而评估其适用性和能量质量。
2. 化学反应的热力学分析热效应和焓变的计算可以帮助研究人员对化学反应的热力学进行分析。
化学反应中热量变化

二、反应热
1、定义:化学反应过程中放出或吸收 的热量 2、符号:△H
3、放热反应:△H为“-”或△H<0
吸热反应:△H为“+” 或△H>0 4、单位:kJ/mol
?
疑问
为什么有的反应放出热量,而有的 反应吸收热量?
水能、化学能变化对比示意图
• 图1将水由低处抽向高处需提供能量
都需要。 它与只消只放需耗由热略的反、微能应吸 加量物热用的无就于总关能断能,引量
⑤ 怎样高效、清洁地体利燃用料煤以炭雾?状喷出,以增 ⑥ 怎样提高固体和液大体燃燃料料与的空燃气烧的效接率触?面
高效清洁利用煤炭的重要途径 煤的气化(水煤气或干馏煤气)
将焦炭在高温下与水蒸气反应,则得到CO和H2
C(s) + H2O(g)
高温 CO(g) +
H煤2(g的) 液化
练习:简要说明使煤炉中的煤充
分燃烧所应采取的措施。
打打打开开炉炉门
燃烧时要有足 够多的空气
门
在在开煤煤炉饼门饼上上打打孔孔或或将将煤做煤成做煤成块煤块
燃料与空气 要有足够大
巩固练习
1、下列燃料中不属于化石燃料的是 ( ) A、煤 B、石油 C、水煤气 D、天然气
2、下列燃料的燃烧,不会污染空气的是 ( ) A、无铅汽油 B、含铅汽油 C、煤 D、氢气
△H:表示反应体系所含化学能的变化量
化 反应物 学 能
高
放出能量 放热反应
△H为“”
生成物 低
反应过程
△H:表示反应体系所含化学能的变化量
化 学 能
反应物
生成物 高 吸收能量 吸热反应
△H为“+” 低
反应过程
化学键与化学反应中的能量变化
化学反应中的热量变化

CaCO3(s)==CaO(s) + CO2(g) △H= + 178.5kJ/mol
【例】 250C ,1.01×105Pa下,1g 硫粉在氧气中充分 燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
写化学方程式:S + O2 = SO2 标聚集状态:S (s) + O2 (g) = SO2 ( g ) 计算热量:1 mol 硫粉在氧气中充分燃烧放出热量 299.52 kJ
实验现象
试管外壁 发热
实验结论
镁与盐酸反应 有热量放出
冰凉
氢氧化钡与氯 化铵反应需要 吸收热量
化学反应中的能量变化,通常表现为 热量 的变化
一、化学反应中的热量变化
1、放热反应: 有热量放出的化学反应 2、吸热反应: 吸收热量的化学反应
请结合所学的知识,请举出一些 放热反应和吸热反应的例子?
3、常见的放热反应、吸热反应
第二单元
化学反应中的热量
钻木取火
“神七”升天
庆典烟火
电池
火苗
化学能
热能、光能、电能等
【活动与探究】
实验操作
【实验1】向试管中放入用砂纸 打磨光亮的镁条,加入5mL 2mol/L 盐酸,用手触摸试管外 壁,有什么感觉? 【实验2】向塑料薄膜袋中加入 约2g 氢氧化钡,再加入约1g NH4Cl晶体,排出袋内空气,扎 紧袋口,将固体混匀。用手触摸 塑料袋感受一下
1、定义:表明反应所放出或吸收的热量的化 学方程式,叫做热化学方程式 不仅表明了化学反应中的物质变化,也表明 了化学反应中的热量变化
【观察与思考】化学方程式与热化学方程式有什么不同 ? 化学方程式 CaCO3===CaO + CO2
高温
化学反应中的热量变化
,
(2)1.00 L 1.00 mol/L H2SO4溶液与2.00 L 1.00 mol/L NaOH溶 液完全反应,放出114.6 kJ的热量,该反应的中和热为 表示其中和热的热化学方程式为 答案 (1)-285.8 kJ/mol H2(g)+ 1/2O2(g) =H2O(l) ΔH=-285.8 kJ/mol 。 ,
否可逆无关。
盖斯定律
1.内容:不管化学反应是一步完成还是分几步完成, 其反应热是 相同 的。 即:化学反应的反应热只与反应体系的 始态和终态 有关,而与 反应的途径 无关。 2.意义:间接计算某些反应的反应热。
3.应用:
方程式 aA A 反应热间的关系
ΔH1
B
ΔH2 1 B a
ΔH1=aΔH2
A
ΔH1 ΔH2
B
ΔH1=-ΔH2 ___________
ΔH=ΔH _____________ 1+ΔH2
特别提醒 在应用盖斯定律时,应注意区分在热化学 方程式中哪些物质需要保留,哪些物质需要约减,可
用不同符号作好标记,然后进行加减。
典型例题
已知:(1)胆矾失水的热化学方程式为 CuSO4· 5H2O(s) CuSO4(s) CuSO4(s)+5H2O(l) ΔH=+Q1 kJ/mol Cu2+(aq)+SO42- (aq) ( A) ΔH=-Q2 kJ/mol (2)室温下,无水硫酸铜溶于水的热化学方程式为
1. 化学反应过程中存在的变化 化学反应过程中同时存在物质和能量的变化。
2. 反应热、焓变 当反应物和生成物具有相同温度时,化学反应 过程中放出或吸收的热量,叫做反应热,
化学反应中的能量变化知识点及例题解析

考点3化学反应中的能量变化一、反应热1、化学反应过程中放出或吸收的热量,通常叫做反应热。
反应热用符号ΔH表示,单位一般采用kJ/mol。
当ΔH为负值为放热反应;当ΔH为正值为吸热反应。
测量反应热的仪器叫做量热计。
2、燃烧热:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时放出的热量,叫做该物质的燃烧热。
3、中和热:在稀溶液中,酸跟碱发生中和反应生成1molH2O,这时的反应热叫做中和热。
中学阶段主要讨论强酸和强碱的反应。
二、热化学方程式1、书写热反应方程式应注意的问题:(1)由于反应热的数值与反应的温度和压强有关,因此必须注明,不注明的是指101kPa和25℃时的数据。
(2)物质的聚集状态不同,反应热的数值不同,因此要注明物质的聚集状态。
(3)热化学方程式中的化学计量数为相应物质的物质的量,它可以是整数,也可以是分数。
2、书写热化学方程式的一般步骤(1)依据有关信息写出注明聚集状态的化学方程式,并配平。
(2)根据化学方程式中各物质的化学计量数计算相应的反应热的数值。
(3)如果为放热反应ΔH为负值,如果为吸热反应则ΔH为正值。
并写在第一步所得方程式的后面,中间用“;”隔开。
(4)如果题目另有要求,如反应燃料燃烧热的热化学方程式和有关中和热的热化学方程式,可将热化学方程式的化学计量数变换成分数。
三、中和热的测定1、测定前的准备工作(1)选择精密温度计(精确到0.10C),并进行校对(本实验温度要求精确到0.10C)。
(2)使用温度计要轻拿轻声放。
刚刚测量高温的温度计不可立即用水冲洗,以免破裂。
(3)测量溶液的温度应将温度计悬挂起来,使水银球处于溶液中间,不要靠在烧杯壁上或插到烧杯底部。
不可将温度计当搅拌棒使用。
2、要想提高中和热测定的准确性,实验时应注意的问题(1)作为量热器的仪器装置,其保温隔热的效果一定要好。
因此可用保温杯来做。
如果按教材中的方法做,一定要使小烧杯杯口与大烧杯杯口相平,这样可以减少热量损失。
化学反应中的能量变化

化学反应中的能量变化化学反应是物质转化的过程,其中涉及了能量的变化。
在化学反应中,分子之间的键能会断裂或形成,从而引起能量的变化。
能量在化学反应中的变化可以以热量的形式表现出来,即放热反应或吸热反应。
本文将探讨化学反应中的能量变化以及其对反应的影响。
一、放热反应放热反应是指在化学反应中释放出热量的过程。
这种反应通常伴随着能量的释放和物质温度的升高。
例如,燃烧反应是一种典型的放热反应,其中有机物与氧气反应生成二氧化碳和水,同时释放出大量的热量。
这种热量释放可以用于加热、发电等实际应用中。
在放热反应中,反应物的化学键能较高,反应产物的化学键能较低。
在反应过程中,反应物的键能被破坏,而反应产物的键能则重新组合。
这个过程中释放出的能量差就是反应放出的热量。
放热反应的热量变化可以用反应热(ΔH)来表示,ΔH为负值。
二、吸热反应吸热反应是指在化学反应中吸收外界热量的过程。
这种反应通常伴随着能量的吸收和物质温度的降低。
例如,溶解氨氯化物的过程是一种吸热反应,需要吸收热量才能使固体氨氯化物溶解于水中,而水的温度会因为吸热反应而下降。
在吸热反应中,反应物的化学键能较低,而反应产物的化学键能较高。
在反应过程中,反应物的键能被破坏,而反应产物的键能则重新组合,这个过程中吸收的能量差就是反应吸收的热量。
吸热反应的热量变化同样可以用反应热(ΔH)来表示,ΔH为正值。
三、能量守恒定律在化学反应中,能量守恒定律始终成立。
能量守恒定律是指能量既不能被创造也不能被销毁,只能从一种形式转化为另一种形式。
因此,在化学反应中,能量的总量在反应前后保持不变。
根据能量守恒定律和化学反应中的能量变化特点,可以得出以下结论:- 放热反应中,反应物的能量高于产物的能量。
- 吸热反应中,反应物的能量低于产物的能量。
- 同一化学反应,在不同条件下可能具有放热或吸热的特性。
能量变化在化学反应中发挥着重要的作用。
它不仅影响着反应的速率和方向,还与反应的热力学特性密切相关。
化学反应中的热量

反应物的总能量高
放 热 反 应
生成物的总能量低
生成物的总能量高
吸 热 反 应
反应物的总能量低
化学反应的过程,可以看成是能 量的“贮存”或“释放”的过程
常见的放热反应和吸热反应
放热反应
吸热反应
燃料的燃烧 中和反应 金属与酸
门
开炉门
在在煤煤饼饼上上打打孔孔或或将煤将做煤成做煤成块煤块
燃料与空气 要有足够大 的接触面
; 整木定制 djm831zbg 妻子随后来到我面前,“苏林,有话不是好好说吗,怎么跟天栓哥使脾气。”妻子给我使了个眼色,意思是叫我回家。 这时,荷花和小荷跑了进来,荷花一个劲地问:“六叔,明天我也能跟小荷一同去上学吗?”
化学反应中的热量
一.化学反应中的热量变化
化学化学变化中除有新物质生成外,必然 伴随有能量(热能、光能、电能)的变化。
的二一利 能是是用 量利制化
用取学 反物反 应质应 中、:
思考:请同学们列举你了解的在生活中应用到 的化学反应中的能量
实验方案
实验现象
实验一:镁条与盐酸
反应,用手触摸试管, 试管外壁
将焦炭在高温下与水蒸气反应,则得到CO和H2
C(s) + H2O(g)
高温
CO(g) + H2(g)
煤的液化
美国通用汽车公司氢燃料电池 车“氢动一号”日前走出实验 室,标志着以零尾气排放为目 标的清洁汽车距其实用阶段又 近了一步。测试表明,“氢动 一号”原型车时速从0—100公 里的加速时间只需16秒,最高 时速达140公里,可持续行驶 400公里。
感受温度。
化学反应与能量变化

一、化学反应中的能量变化
放热反应: 放热反应: 反应过程中放出热量 放出热量的化学反应 反应过程中放出热量的化学反应
典 型 放 热 反 应 C + O2
点燃
CH4+ 2O2 CO2 + 2H2O 物质的燃烧 H2 +Cl2 点燃 2HCl NaOH + HCl = NaCl + H2O 中和反应 CaO+H2O=Ca(OH)2 化合反应 2Al+6HCl=2AlCl3+3H2↑ 金属与酸反应
2.单位: 单位: 单位 3.注意: 注意: 注意
kJ/mol
(1)燃烧的物质必须为 1mol 燃烧的物质必须为: 燃烧的物质必须为 (2)完全燃烧 是指物质中下列元素完 完全燃烧是指物质中下列元素完 完全燃烧 全 转 变 成 对 应 的 物 质 : C→CO2 , H→H2O(l),S→SO2等。 , (3)燃烧热通常由实验测得 燃烧热通常由实验测得
应用: 应用:间接计算一些无法直接测定的反应热
例
题
剖 析
已知: =-393.5kJ/mol 已知:C(s)+O2(g)=CO2;△H=- =- CO(g)+1/2O2(g)=CO2(g); △H=- =-283.0kJ/mol ; =- 计算反应: 计算反应: C(s)+1/2O2(g)=CO的△H=? 的 =?
3.书写热化学方程式注意事项 书写热化学方程式注意事项
注明各物质的聚集状态 聚集状态。 (1) 注明各物质的聚集状态。(气:g,液:l,固:s 溶液: 溶液:aq ) (2) △H“-”,为放热反应,△H“+”为吸热反应 - 为放热反应, + 为吸热反应 需注明反应的温度和压强 若不注明温度和压强, 温度和压强, (3) 需注明反应的温度和压强,若不注明温度和压强,一 ,1.01× 般指25 般指250C ,1.01×105Pa (4)系数只表示物质的量,可以是整数 小数或分数。 系数只表示物质的量 整数、 (4)系数只表示物质的量,可以是整数、小数或分数。 系数必须与反应热△ 相对应 相对应。 (5) 系数必须与反应热△H相对应。
化学反应中的热量变化

表2-3 某些共价键的键能
共价键 键能/kJ·mol-1 共价键 键能/kJ·mol-1
专题2 化学反应与能量变化
第二单元 化学反应中的热量 化学反应中的热量变化
你知道吗?归纳
化学反应
能量转化方式
镁条的燃烧
化学能转化为光能和热能
石油气的燃烧
化学能转化为光能和热能
闪电时产生氮氧化物 电能转化为化学能
原电池放电
化学能转化为电能
高温冶炼铁
热能转化为化学能
实验1. 镁条和盐酸反应
现象: 试管内有气泡产生, 镁条逐渐溶解, 试管 外壁温度升高.
含义:1molC(固体)与 1molO2(气体)完全反应,生成 1molCO2气体,放出393.6kJ热量。
书写热化学方程式注意事项:
(1)反应物和生成物要标明其聚集状态,用g、l、s分 别代表气态、液态、固态。
(2)用△H注明反应热(△H>0表示吸热, △H<0表示放 热,单位:KJ·mol-1)
化学计量数只表示物质的量,可用分数
思考: 同一反应的△H与哪些因素有关?
反应物系数和各物质的聚集状态
C、CO、CH4完全燃烧的热化学方程式可以分别 表示为
C(s) + O2(g) 2CO(g) + O2(g)
CO2(g) △H=- 393.6 KJ •mol-1 2CO2(g) △H=- 565.2 KJ •mol-1
反应方程式: Mg + 2H+ === Mg2+ + H2↑ 结论: 该反应是放热反应.
化学反应中的热力学变化与热量变化

化学反应中的热力学变化与热量变化一、热力学基本概念1.温度:表示物体冷热程度的物理量,单位为摄氏度(°C)。
2.热量:在热传递过程中,能量从高温物体传递到低温物体的过程,单位为焦耳(J)。
3.内能:物体内部所有分子无规则运动的动能和分子势能的总和,单位为焦耳(J)。
4.热力学第一定律:能量守恒定律,即一个系统的内能变化等于外界对系统做的功加上系统吸收的热量。
5.热力学第二定律:熵增原理,即在一个封闭系统中,熵总是趋向于增加,表示为自发过程中熵的总量增加。
二、化学反应的热力学变化1.反应热:化学反应过程中放出或吸收的热量,分为放热反应和吸热反应。
2.反应焓变:化学反应过程中系统的焓变化,用ΔH表示,单位为焦耳(J)。
3.标准摩尔焓:在标准状态下(25°C,101KPa),1摩尔物质所具有的焓,单位为焦耳/摩尔(J/mol)。
4.反应的熵变:化学反应过程中系统的熵变化,用ΔS表示,单位为焦耳/开尔文(J/K)。
5.吉布斯自由能:表示在恒温恒压条件下,系统进行自发变化的能力,用ΔG表示,单位为焦耳(J)。
6.化学反应的平衡常数:表示在一定温度下,可逆反应达到平衡时各生成物和反应物的浓度比值的乘积,用K表示。
三、热量变化与化学反应1.放热反应:化学反应过程中释放热量的现象,如燃烧、金属与酸反应等。
2.吸热反应:化学反应过程中吸收热量的现象,如分解反应、碳与二氧化碳反应等。
3.热效应:化学反应过程中放热或吸热的现象,分为酸碱中和热、氧化还原热等。
4.热量计算:根据化学反应的化学方程式,计算反应物和生成物的焓变,从而确定反应的热量变化。
5.热量测定:利用量热计等实验装置,测定化学反应过程中的热量变化。
四、应用与实践1.热能转换:化学反应中的热量变化可用于热能转换,如热机、热水器等。
2.化学工业:化学反应的热量变化在化工生产中具有重要意义,如聚合反应、炼油等。
3.节能减排:通过研究化学反应的热量变化,实现能源的高效利用,降低环境污染。
化学反应中的热量变化

一.反应热
在化学反应过程中放出或吸收的热量, 通常叫做反应热,用符号H表示,单位: kJ/mol,测量的仪器叫做量热器
研究方法:在一定压强下,在敞开容器 中发生的反应所放出或吸收的热量。 H为“—”或H<0时,为放热反应 H为“+”或H>0时,为吸热反应
生成物所具有的总能量—反应物具有的总能量=H
化学反应中的热量
化学反应中的热量变化
化学能与热能的相互转化
化学反应中的能量变化,通常表现为热量 的变化-吸热或放热。
化学能与热能
化学镁与盐酸反应,放出大量气泡, 温度升高
结论
该反应是放热 反应
化学能与热能
化学能与热能的相互转化 实验2
现象:1、温度下降 2、有少许刺激性气味气体产生 3、有水生成 Ca(OH)2 + 2NH4Cl=CaCl2 +2NH3 +2H2O
C. Q1
+ Q2 < Q3
D. Q1 + Q2 = Q3
想一想:
1.化学反应的本质是什么?
2 .在化学反应中,既发生了 ___________ ,又 发生了 ____________ ,通常以 ____________ 的 形式表现出来。 3.什么叫做放热反应?什么叫做吸热反应?为 什么有的化学反应会放出热量,而有的化学反 应却需要吸收能量?
断开化学键 吸收的能量
吸收能量
练习:
(1)、甲烷燃烧要放出热量,水的分解要吸收能量, 试从化学键变化的角度分析其原因? 解析: 形成4molH-O键和2molC=O键释放的能量 比断裂4molC-H键和2molO=O键所吸 收的能量高,因此放出热量。 断裂4molH-O键所吸收的能量比形成2mol H-H键和1molO=O键放出的能量高,因此 要吸收能量。
化学反应中的热量变化
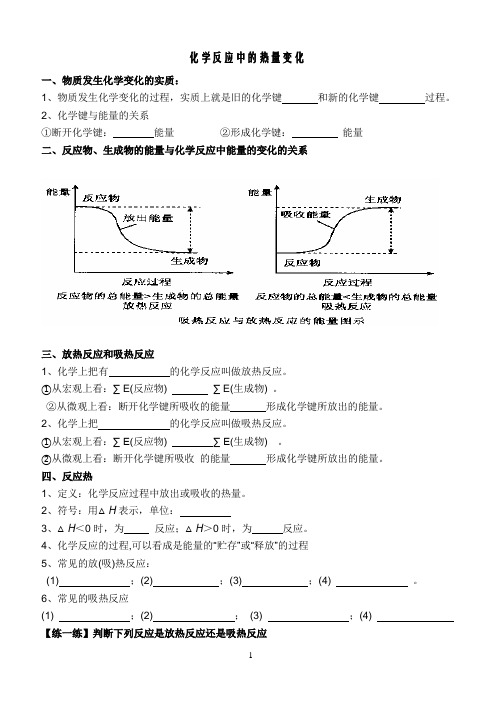
化学反应中的热量变化一、物质发生化学变化的实质:1、物质发生化学变化的过程,实质上就是旧的化学键和新的化学键过程。
2、化学键与能量的关系①断开化学键:能量②形成化学键:能量二、反应物、生成物的能量与化学反应中能量的变化的关系三、放热反应和吸热反应1、化学上把有的化学反应叫做放热反应。
①从宏观上看:∑ E(反应物) ∑ E(生成物) 。
②从微观上看:断开化学键所吸收的能量形成化学键所放出的能量。
2、化学上把的化学反应叫做吸热反应。
①从宏观上看:∑ E(反应物) ∑ E(生成物) 。
②从微观上看:断开化学键所吸收的能量形成化学键所放出的能量。
四、反应热1、定义:化学反应过程中放出或吸收的热量。
2、符号:用△H表示,单位:3、△H<0时,为反应;△H>0时,为反应。
4、化学反应的过程,可以看成是能量的“贮存”或“释放”的过程5、常见的放(吸)热反应:(1) ;(2) ;(3) ;(4) 。
6、常见的吸热反应(1) ;(2) ;(3) ;(4)【练一练】判断下列反应是放热反应还是吸热反应1.镁条的燃烧。
2.高温煅烧石灰石。
3.氧化钙与水的反应。
4.盐酸与氢氧化钠溶液反应。
5.高温下木炭与二氧化碳反应生成一氧化碳。
6.炸药爆炸。
7.Ca(OH)2和NH4Cl的反应。
8.炽热的碳与H2O的反应。
9.甲烷在氧气中的燃烧。
五、热化学方程式1、定义:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。
2、热化学方程式书写原则①标明物质的状态,用g、l、s分别代表气态(gas)、液态(liquid)、固态(solid)。
②用△H 标明反应放出或吸收的热量,放热为负值,吸热为正值, 数值与测定条件有关。
③热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量,因此可以是整数或简单分数。
④对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比。
3、书写热化学方程式的注意事项:①不需注明反应条件,但要注明反应物和生成物的状态。
化学反应过程中的热量变化计算

化学反应过程中的热量变化计算一、热量变化的概念1.放热反应:在化学反应过程中,系统向周围环境释放热量的现象。
2.吸热反应:在化学反应过程中,系统从周围环境吸收热量的现象。
3.热量变化:反应物和生成物之间的能量差,用ΔH表示。
二、热量变化的计算方法1.标准生成焓:在标准状态下,1mol物质生成时的热量变化,用ΔH°表示。
2.反应焓变:反应物和生成物焓变的差值,ΔH = ΣΔH°(生成物) -ΣΔH°(反应物)。
3.热量变化计算公式:ΔH = q(products) - q(reactants),其中q表示反应物和生成物的热量。
三、热量变化的单位1.焦耳(J):国际单位制中能量和热量的单位。
2.千卡(kcal):常用单位,1kcal = 4184J。
3.兆焦(MJ):大型能源单位,1MJ = 10^6J。
四、热量变化的实际应用1.燃烧反应:燃料燃烧时,放出的热量可用于发电、供暖等。
2.化学动力学:反应速率与温度、浓度等条件有关,热量变化是影响因素之一。
3.热力学循环:如卡诺循环、布伦塔诺循环等,热量变化是循环效率的关键因素。
五、注意事项1.热量变化与反应物和生成物的状态有关,要考虑温度、压力等因素。
2.在计算热量变化时,要注意反应物和生成物的化学计量数。
3.热量变化具有方向性,放热反应不能转化为吸热反应,反之亦然。
化学反应过程中的热量变化计算是化学热力学的基本内容,掌握热量变化的概念、计算方法和实际应用对于中学生来说至关重要。
通过学习热量变化,我们可以更好地理解化学反应的本质,以及能量在化学反应中的转换和传递。
习题及方法:1.习题:某放热反应的热量变化为-5.4kJ/mol,若2.8g的该反应物完全反应,释放出多少热量?解题思路:首先计算反应物的物质的量,然后根据热量变化和物质的量关系计算释放的热量。
n(反应物) = m/M = 2.8g / (反应物的摩尔质量)释放的热量 = n(反应物) × ΔH = 2.8g / (反应物的摩尔质量) × (-5.4kJ/mol)2.习题:在标准状态下,1mol氧气生成时放热285.8kJ,求1mol臭氧在标准状态下生成时的热量变化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(5)同种物质聚集状态不同,能量不同
2H2(g) + O2(g)== 2H2O(l) H2(g) +1/2O2(g)== H2O(l)
△H=-571.6 kJ/mol △H=-285.8 kJ/mol
(6)△H 的值与计量数成正比。
练习:写出热反应方程式
在一定温度下,1molCO气体与1mol 水蒸气在催化剂存在下完全反应,生成 CO2气体和氢气,放出41kJ。
(1)金属与酸的反应
2.常见的放(吸)热反应 放热反应
(2)所有的燃烧反应 (3)酸碱中和反应 (4)大多数化合反应 (1)氢氧化钡与氯化铵晶体的反应
高温
吸热反应
(2) C(s) + CO2(g)== 2CO(g)
(3) C(s) + H2O(g) ==CO(g) + H2(g)
高温
(4)大多数分解反应
如何表示反应中 放出或者吸收的 热量呢?
热化学方程式
(一)反应热
(1)定义:在化学反应中放出或吸收的热量叫 反应热。 (2)符号: △H (3)单位:kJ •mol-1 放热反应:△H取负值(△H<0) 吸热反应:△H取正值( △H>0)
(二)热化学方程式
1.定义:表明反应放出或吸收的热量的化学 方程式叫热化学方程式。
意义: 不仅表明了化学反应中物质变化,也表明 了化学反应中的能量变化
CaCO3(S) =CaO(S) +CO2(g)
△H = +178.5kJ/mol
表示:1molCaCO3完全分解生成CaO和CO2气 体,吸收的热量为178.5kJ。
1/2C(S) +1/2O2(S) =1/2CO2(g) △H = -ห้องสมุดไป่ตู้96.8kJ/mol
交流与讨论
• 判断下列反应是放热反应还是吸热反应:
1.镁条的燃烧。 2.高温煅烧石灰石。 3.氧化钙与水的反应。 4.盐酸与氢氧化钠溶液反应
放热 吸热 放热 放热
5.高温下木炭与二氧化碳反应生成一氧化碳。 吸热 6.炸药爆炸 放热 7.Ca(OH)2和NH4Cl的反应 吸热 8.炽热的碳与H2O的反应 吸热 9.甲烷在氧气中的燃烧 放热
表示的是什么呢?
表示:0.5molC与0.5molO2完全反应生成 0.5molCO2气体,放出的热量为196.8kJ。
观察以下热化学反应方程式,你发现了什么?
2H2(g) + O2(g)==2H2O(g) △H=-483.6 kJ/mol 2H2(g) + O2(g)== 2H2O(l) △H=-571.6 kJ/mol
H- O- H
△H =-484 kJ •mol-1
从宏观角度分析
吸热反应:
所有反应物 的总能量
< 所有生成物的总能量
放热反应:
所有反应物 的总能量
>所有生成物的总能量
反应物的总能量高
生成物的总能量高
放 热 反 应
生成物的总能量低
因为能量降 低,所以用 “—”表示
吸 热 反 应
反应物的总能量低
因为能量升 放热反应 高,所以用 生成物的总能量=反应物的总能量 +吸收的热量 “+”表示
反应 放热反应:放出热量的化学反应 吸热反应:吸收热量的化学反应 2.常见的放(吸)热反应 3.放(吸)热反应中的能量变化 放热反应: ∑ E(反应物) > ∑ E(生成物)
吸热反应:
4.热化学方程式
∑ E(反应物) < ∑ E(生成物)
5.从宏观和微观角度理解化学反应中的能量变化
实验方案
实验一:镁条与盐酸反 应,用手触摸试管,感 受温度。 实验二:氢氧化钡固体 与氯化铵固体反应,用 手触摸塑料袋,感受温 度。
实验现象
结论
试管外壁 镁与盐酸反应 有热量放出 发热
氢氧化钡固体 温度降低 与氯化铵固体 反应需要吸收 热量
一. 化学反应中的热量变化
1. 化学按能量变化
反应 放热反应:放出热量的化学反应 吸热反应:吸收热量的化学反应
E
吸收436.4 kJ (H2) 2H + 2Cl 吸收242.7 kJ(Cl2)
放出2×431.8 kJ = 863.6 kJ
H2 + Cl2
放出 热量
2HCl △H =184.5 kJ
?
(注:1mol H2和1mol Cl2反应) 反应热与键能
反应历程
△H =反应物键能总和-生成物键能总和
已知拆开1molH2需要消耗436kJ能量, 拆开1molO2需要消耗496kJ能量,形成 水分子中的1molH-O能够释放463kJ能 量。 你能根据以上所给的数据判断反应: 2H2(g)+O2(g)=2H2O(g) 是放热反应吗?并通过计算得出 △H =?
CO(g)+H2O(g) =CO2(g)+H2(g) △H = -41 kJ· mol-1
为什么有的化学反应放热,有的却吸热?
能量
能量 H2 O
H2
O2
旧分子
拆开 (吸收能量)
原子
结合 (放出能量)
新分子
决定
吸收能量<放出能量
放热反应
吸收能量>放出能量
吸热反应
从微观角度分析
吸热反应:
断开化学键所吸收 的能量
>形成化学键所放出的能量
放热反应:
断开化学键所吸收 的能量
<形成化学键所放出的能量
键能
问题解决
已知:断开1mol H2中的H-H键需要吸收 436.4kJ的能量,断开1molCl2中的Cl-Cl 键需要吸收242.7kJ的能量,生成
1molHCl中的H-Cl键需要放出431.8kJ的
能量。试说明H2 +Cl2 = 2HCl是吸热反应 还是放热反应?
如:C(s)+O2(g)==CO2(g) △H=-393.5kJ •mol-1
2.书写原则:
(1)写符合质量守恒的化学方程式
(2)注明反应物,生成物聚集状态(s,l,g)
(3)用△H<0表明化学反应放出或吸收的热量
(4)热化学方程式中各物质前的化学计量数可以是 整数或分数,不表示分子个数,只表示物质的量。
反应物的总能量=生成物的总能量+放出的热量
吸热反应
化学反应的过程,也可以看成是能量的“释放” 或“贮存”的过程。
练习
• 关于吸热反应和放热反应,下列说法错误 的是( ABF) A.需要加热才能进行的化学反应一定是吸热 反应 B.放热反应在常温下一定能发生 C.吸热反应在常温下不一定不能发生 D.反应物的总能量高于生成物的总能量时, 发生放热反应 E.吸热反应中的反应热(△H )为正值 F. C(s)+O2(g)==CO2(g) △H = 393.6kJ
化学反应中的 热量变化
实验1 镁条与盐酸反应 向一支试管
中放入用砂纸打磨光亮的镁条,加入5 mL 2 mol/L盐酸,用手触摸试管外壁,有什么感觉?
实验2 氢氧化钡晶体与氯化铵反应
向烧杯中加入约7g氢氧化钙,再加入约10g氯化铵晶 体,再将固体混匀,使之充分反应。反应混合物的 温度有什么变化?
演示实验
二、燃料燃烧释放的热量
1. 燃料充分燃烧的条件是什么? 足够多的空气和足够大的接触面积。 2.燃料不充分燃烧会造成怎样的结果? 3. 为使燃料充分燃烧,要通入足够多的空气, 空气过多行吗? 4. 增大燃料与空气接触面积,可采取哪些措 施?
20
课堂小结
一. 化学反应中的热量变化
1. 化学按能量变化
