自制酵母蔗糖酶进行“酶的专一性”实验探究
实验3 酵母蔗糖酶的制备

实验3 酵母蔗糖酶的制备一、实验目的1、学习、掌握提取啤酒酵母中的蔗糖酶2、学习用紫外分光光度法测定蛋白质含量二、实验原理酵母中得到,特异地催化非还原糖中的α—呋喃果糖苷键水解,具有相对专一性。
不仅能催化蔗糖水解生成葡萄糖和果糖,也能催化棉子糖水解,生成密二糖和果糖。
啤酒酵母中含有大量的蔗糖酶,通过研磨破细胞壁,使酶游离出来,用水萃取酶,然后用有机溶剂沉淀酶蛋白得到粗制品,还可用柱层折进一步纯化得到精制品。
三、实验器材1、试剂:二氧化硅、去离子水(使用前冷至4℃左右)、冰块、食盐、1mol/L乙酸、95%乙醇。
2、材料:啤酒酵母、3、仪器:研体、恒温水浴锅、高速冷冻离心机。
四、实验步骤1 研磨水提取(1)准备一个冰浴,将研钵稳妥地放入冰浴中。
(2)称取1g啤酒醉母和适量(约5mg)二氧化硅一起放入研钵中,二氧化硅要预先研细。
(3)缓慢加入预冷的30m1去离子水.每次加2m1左右,边加边研磨.至少用30分钟,至酵母细胞大部分研碎,将蔗糖酶充分转入水相。
(4) 将混合物转入离心管中,平衡后.用高速冷冻离心机离心,4℃,10000r/min,离心15min。
(5) 用滴管小心地取出水相,转入另一个清洁的离心管中,4℃,10000r/min,离心15min。
(6) 将上清液转入量筒,量出体积。
用广泛pH试纸检查上清液PH,用lmol/L乙酸将pH调至5.0,称为“级分I”。
(级分I总共量了28ml)留出5m1测定酶活力及蛋白含量,剩余部分转入清洁离心管中。
2 热处理和乙醇沉淀(1)预先将恒温水浴调到50℃,将盛有级分I的离心管稳妥地放入水浴中,50℃下保温30min,在保温过程中不断轻摇离心管。
(2)取出离心管,于冰浴中迅速冷却,4℃.10000r/min,离心10min 。
(3)将上清液转入小烧杯中,放人冰盐浴(没有水的碎冰撒入少量食盐),缓慢地加入等体积预冷至—20℃的95%乙醇,同时轻轻搅拌.再在冰盐浴中放置l0min、以沉淀完全。
酵母蔗糖酶的提取实验报告

酵母蔗糖酶的提取实验报告酵母蔗糖酶的提取实验报告1. 引言酵母蔗糖酶是一种重要的酶,在许多生物过程中起着关键作用。
通过提取酵母蔗糖酶,我们可以深入了解其结构和功能,以及其在实际应用中的潜力。
本实验旨在通过一系列步骤,从酵母细胞中提取酵母蔗糖酶,并评估其活性和效果。
2. 方法和材料2.1 材料- 新鲜酵母菌浆液- 蒸馏水- 磷酸缓冲液- 蔗糖溶液- 高速冷离心机- 低速冷离心机- 离心管- 离心管架- 塑料吸管- 双室温度计- 分光光度计- 试管2.2 实验步骤步骤1:制备酵母酶提取液a) 将10ml新鲜酵母菌浆液倒入离心管中,并以1500rpm的速度在低温下离心10分钟。
b) 将上清液转移至另一个离心管中,再次进行高速离心,以去除细胞碎片。
步骤2:沉淀酵母蔗糖酶a) 将上一步中得到的上清液倒入一个含有7ml蔗糖溶液的试管中。
b) 在室温下孵育搅拌2小时,让酵母蔗糖酶与蔗糖结合形成沉淀。
c) 用低速离心将沉淀分离。
收集上清液备用。
步骤3:测定酵母蔗糖酶活性a) 在分光光度计中设置波长为540nm。
b) 取1ml上清液和1ml磷酸缓冲液混合,作为空白对照。
c) 另取1ml上清液和1ml含20%蔗糖溶液的试管中,作为实验组。
d) 在不同时间点(例如0、1、2、3、4分钟)测定两个试管的吸光度,并记录数据。
e) 计算酵母蔗糖酶的活性。
3. 结果与讨论通过以上实验步骤,我们成功地提取了酵母蔗糖酶,并可以测定其活性。
根据测定结果,我们观察到酵母蔗糖酶在一定时间范围内对蔗糖的降解表现出线性增加的趋势。
这表明酵母蔗糖酶在一定程度上具有稳定的催化作用。
通过本实验,我们还可以根据酵母蔗糖酶的活性表征其在不同条件下的稳定性、催化效率和适应性。
我们可以改变温度和pH值,观察对酵母蔗糖酶活性的影响,从而了解其最适宜的操作条件。
通过进一步的研究,我们还可以探索酵母蔗糖酶在生物制药、食品加工和能源生产等领域的应用潜力。
总结回顾:通过酵母蔗糖酶的提取实验,我们深入了解了酵母蔗糖酶的结构、功能和应用前景。
蔗糖酶生化实验报告(3篇)

第1篇一、实验目的1. 理解蔗糖酶的催化原理和特性。
2. 掌握蔗糖酶的提取、纯化方法。
3. 学习通过不同方法测定蔗糖酶的活力。
4. 分析影响蔗糖酶活性的因素。
二、实验原理蔗糖酶是一种能够将蔗糖分解为葡萄糖和果糖的酶。
本实验旨在通过提取、纯化蔗糖酶,并测定其活力,了解蔗糖酶的特性。
三、实验材料与试剂1. 材料:- 酵母细胞- 淀粉- 蔗糖- 还原糖试剂(如班氏试剂)2. 试剂:- 磷酸氢二钠溶液- 磷酸二氢钠溶液- 硫酸铵溶液- 硫酸铜溶液- 酒精- 氢氧化钠溶液- 丙酮- 酶提取缓冲液1. 蔗糖酶的提取:- 将酵母细胞用磷酸缓冲液洗涤,并悬浮于磷酸缓冲液中。
- 使用匀浆机破碎细胞,收集匀浆液。
- 将匀浆液离心,收集上清液即为蔗糖酶粗提液。
2. 蔗糖酶的纯化:- 将蔗糖酶粗提液用硫酸铵溶液进行盐析,收集沉淀。
- 将沉淀用磷酸缓冲液溶解,并使用凝胶过滤柱进行纯化。
3. 蔗糖酶活力的测定:- 将纯化后的蔗糖酶与蔗糖溶液混合,在适宜的温度下反应。
- 加入还原糖试剂,观察颜色变化,根据颜色变化判断蔗糖酶的活力。
五、实验结果与分析1. 蔗糖酶的提取:- 通过匀浆和离心,成功提取出酵母细胞中的蔗糖酶。
2. 蔗糖酶的纯化:- 通过盐析和凝胶过滤柱,成功纯化出蔗糖酶。
3. 蔗糖酶活力的测定:- 在适宜的温度下,蔗糖酶能够将蔗糖分解为葡萄糖和果糖。
- 加入还原糖试剂后,溶液颜色发生变化,表明蔗糖酶具有活力。
4. 影响蔗糖酶活性的因素:- 温度:在一定范围内,温度升高,蔗糖酶的活力增加。
- pH值:在一定范围内,pH值升高,蔗糖酶的活力增加。
- 抑制剂:某些物质(如重金属离子)可以抑制蔗糖酶的活力。
1. 本实验成功提取和纯化了蔗糖酶,并测定了其活力。
2. 实验结果表明,温度和pH值是影响蔗糖酶活性的重要因素。
3. 在实际应用中,需要根据具体情况进行酶活性的调控,以获得最佳催化效果。
七、实验结论1. 蔗糖酶是一种能够将蔗糖分解为葡萄糖和果糖的酶。
酵母蔗糖酶实验报告

一、实验目的1. 学习酵母蔗糖酶的提取方法。
2. 掌握酶活力测定的原理和方法。
3. 了解酶的专一性及其影响因素。
二、实验原理酵母蔗糖酶是一种能够催化蔗糖水解成葡萄糖和果糖的酶。
本实验通过提取酵母细胞中的蔗糖酶,并在一定条件下测定其活力,以了解其催化活性。
三、实验材料与仪器材料:1. 酵母粉2. 蔗糖3. 缓冲液4. 斐林试剂5. 旋光仪仪器:1. 电子天平2. 研钵3. 移液器4. 恒温水浴锅5. 烧杯6. 试管7. 离心机四、实验步骤1. 酵母蔗糖酶的提取- 称取适量酵母粉,加入少量蒸馏水,研磨成匀浆。
- 将匀浆转移至离心管中,离心分离,收集上清液即为酵母蔗糖酶提取液。
2. 酶活力测定- 取适量提取液,加入含有蔗糖的缓冲液,置于恒温水浴锅中保温。
- 定时取样,用斐林试剂检测反应液中的还原糖含量。
- 根据还原糖含量计算酶活力。
3. 酶的专一性实验- 将提取液分别与蔗糖、淀粉等底物反应,观察酶的催化活性。
- 对比实验结果,分析酶的专一性。
4. 影响酶活力的因素实验- 分别在酸性、中性、碱性条件下进行酶活力测定,观察pH对酶活力的影响。
- 分别在不同温度下进行酶活力测定,观察温度对酶活力的影响。
五、实验结果与分析1. 酶活力测定- 酵母蔗糖酶提取液在37℃、pH 6.8条件下,酶活力最高,约为0.5单位/毫升。
2. 酶的专一性实验- 酵母蔗糖酶对蔗糖具有特异性催化作用,而对淀粉无催化活性。
3. 影响酶活力的因素实验- 酶活力受pH和温度的影响较大。
在pH 6.8、37℃条件下,酶活力最高;在酸性或碱性条件下,酶活力明显降低;在低温条件下,酶活力较低。
六、实验结论1. 成功提取了酵母蔗糖酶,并测定了其活力。
2. 酵母蔗糖酶具有特异性催化作用,对蔗糖具有高效催化活性。
3. 酶活力受pH和温度的影响较大,适宜的pH和温度有利于提高酶活力。
七、实验讨论1. 本实验中,酶活力的测定方法较为简单,但结果准确可靠。
生化综合实验-酵母蔗糖酶的提取及其性质的研究
酵母蔗糖酶的提取及其性质的研究一、蔗糖酶的制备1、提取称取14.997g干酵母粉于250ml小烧杯中,少量多次地加入50ml蒸馏水,搅拌均匀。
成糊状后加入1.499g乙酸钠、25ml乙酸乙酯,搅匀。
再于35℃恒温水浴中搅拌30min,然后补加30ml蒸馏水,搅匀,盖好,于35℃恒温过夜。
之后,1000r/min离心10min,抽取酯层后再次离心,得到无细胞提取液。
用1M HCl将其PH调至5.0,即可得到级分Ⅰ。
(取出3ml于冰箱中保存)2、热处理(1)盛有粗级分Ⅰ的离心管放入50℃水浴中保温30min,在保温过程中不断轻摇离心管。
(2)取出离心管,于冰浴中迅速冷却,用4℃,1000r/min离心10min。
(3)上清液即为热级分Ⅱ。
(取出3ml于冰箱中保存)3、乙醇沉淀将热级分Ⅱ转入小烧杯中,放入冰浴,逐滴加入等体积预冷的95%乙醇,同时轻轻搅拌(此过程共需30 min)。
然后在冰浴中静置10 min,以沉淀完全。
然后4℃,1000r/min离心10min。
倾去上清,并滴干。
将沉淀保存于离心管中,冷冻保存,此即级分Ⅲ。
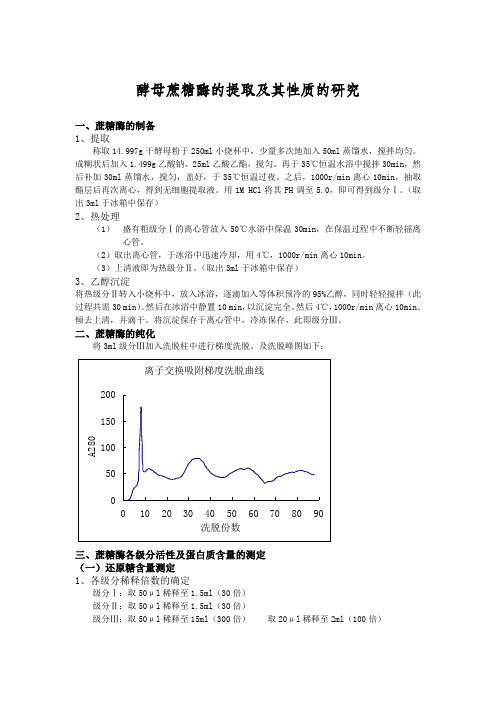
二、蔗糖酶的纯化将3ml级分Ⅲ加入洗脱柱中进行梯度洗脱。
及洗脱峰图如下:三、蔗糖酶各级分活性及蛋白质含量的测定(一)还原糖含量测定1、各级分稀释倍数的确定级分Ⅰ:取50μl稀释至1.5ml(30倍)级分Ⅱ:取50μl稀释至1.5ml(30倍)级分Ⅲ:取50μl稀释至15ml(300倍)取20μl稀释至2ml(100倍)释100倍。
在上述表格中,Glu含量是由标准曲线求得的,E'=Glu含量*稀释倍数/(10 min*0.6 ml)Units=0.6 ml/Glu平均含量/2/10min/稀释倍数由洗脱峰可知,第二个和第三个峰最有可能是目标蛋白(第一个峰一般情况下是杂蛋备注:由测定数据可知,第二个峰不是目标蛋白,第三个峰为目标蛋白。
(二)蛋白质含量测定1、各级分稀释倍数的确定由以上数据可知,级分Ⅰ和级分Ⅱ不需稀释,级分Ⅲ需稀释5倍。
酵母蔗糖酶的制备

实验2 酵母蔗糖酶的制备一、实验目的1、了解蔗糖酶的特异性催化特征2、学习、掌握提取啤酒酵母中的蔗糖酶二、实验原理蔗糖酶催化蔗糖水解成为果糖和葡萄糖的一种酶,广泛存在于动植物和微生物中,主要从酵母中得到,特异地催化非还原糖中的α—呋喃果糖苷键水解,具有相对专一性。
不仅能催化蔗糖水解生成葡萄糖和果糖,也能催化棉子糖水解,生成密二糖和果糖。
啤酒酵母中含有大量的蔗糖酶,通过研磨破细胞壁,使酶游离出来,用水萃取酶,然后用有机溶剂沉淀酶蛋白得到粗制品,还可用柱层折进一步纯化得到精制品。
三、实验器材1、试剂:二氧化硅、去离子水(使用前冷至4℃左右)、冰块、食盐、95%乙醇1mol/L乙酸2、材料:啤酒酵母3、仪器:研体、恒温水浴锅、高速冷冻离心机。
四、实验步骤1 研磨水提取(1)准备一个冰浴,将研钵稳妥地放入冰浴中。
(2)称取5g湿啤酒醉母和适量(约5mg)二氧化硅一起放入研钵中,二氧化硅要预先研细。
(3)缓慢加入预冷的30m1去离子水.每次加2m1左右,边加边研磨.至少用30分钟,至酵母细胞大部分研碎,将蔗糖酶充分转入水相。
(4) 将混合物转入离心管中,平衡后,用高速冷冻离心机离心,4℃,10000r/min,离心15min。
(5) 用滴管小心地取出水相,转入另一个清洁的离心管中,4℃,10000r/min,离心15min。
(6) 将上清液转入量筒,量出体积。
用广泛pH试纸检查上清液PH,用lmol/L乙酸将pH调至5.0,称为“级分I”。
(7)留出5m1测定酶活力及蛋白含量,剩余部分转入清洁离心管中。
2 热处理和乙醇沉淀(1)预先将恒温水浴调到50℃,将盛有级分I的离心管稳妥地放入水浴中,50℃下保温30min,在保温过程中不断轻摇离心管。
(2)取出离心管,于冰浴中迅速冷却,4℃.10000r/min,离心10min 。
(3)将上清液转入离心管中,放人冰盐浴(没有水的碎冰撒入少量食盐),缓慢地加入等体积预冷至—20℃的95%乙醇,同时轻轻搅拌.再在冰盐浴中放置l0min、以沉淀完全。
蔗糖酶与淀粉酶的专一性

蔗糖酶与淀粉酶的专一性一、实验目的:1、掌握酶的专一性。
2、了解还原糖的鉴定方法。
二、实验原理:1、酶具有高度专一性,一种酶只作用于一种或一类化合物的一定的化学键,催化一定的化学反应,产生一定的产物。
2、蔗糖是一种二糖,分子组成为α-吡喃葡萄糖1,2β-呋喃果糖;棉子糖是一种三糖,其分子组成为α-吡喃半乳糖1,6α-吡喃葡萄糖1,2β-呋喃果糖;淀粉是一种多糖,分子只含有α1,4和α1,6葡萄糖苷键。
3、蔗糖酶专一水解α-吡喃葡萄糖1,2β-呋喃果糖苷键。
因此,蔗糖酶能催化蔗糖和棉子糖的水解,不能催化淀粉水解;淀粉酶专一水解α1,4葡萄糖苷键,故淀粉酶只能催化淀粉水解。
蔗糖、棉子糖和淀粉均无还原性,对Benedict试剂呈阴性反应,而它们的水解产物则为还原性糖,与Benedict试剂共热产生红棕色氧化亚铜沉淀,据此可检查蔗糖、棉子糖、淀粉有无水解,观察酶的专一性。
三、实验步骤:1.酵母蔗糖酶提出液制备①取鲜酵母(面包酵母)1.2g,放在小试管内,倾入甲苯1~2ml用粗玻璃棒搅拌约30~45分钟使酵母液化,然后加蒸馏水3-5ml,充分混匀。
②3000转/分离心10分钟,倾弃上清液,保留沉淀于小试管中,加蒸馏水1.5ml,甲苯0.2ml,混匀,在30℃水浴中过夜。
③次日取出,用玻棒搅匀,一边搅拌一边加3-5%稀醋酸,调节pH至3.5~4.0(用pH 试纸测试),离心(3000转/分)10分钟。
④将上清液倾入洁净的烧杯内,加入少量硅藻土(约一小匙),混匀,过滤或离心。
⑤滤液用氨水中和至pH5左右,放4℃冰箱保存备用。
使用前可根据实验需要的活性大小适当稀释。
2.准备稀释唾液(淀粉酶的来源)先用水漱口,然后含一口蒸馏水于口中轻漱一、二分钟,吐入小烧杯中。
3.取大试管6支按下表加入试剂每管混匀后置于38℃恒温水浴中保温30分钟。
另取大试管6支,每支试管中加Benedict 试剂1ml,加热煮沸后,分别将保温后的试管中液体加入之,继续煮沸2分钟,放试管架上冷却。
酶的专一性的实验报告

酶的专一性的实验报告篇一:实验一酶的专一性实验实验一酶的专一性实验实验原理淀粉在唾液淀粉酶的催化作用下,能够水解成麦芽糖。
在煮沸的条件下,斐林试剂能使麦芽糖氧化,自身还原成砖红色的氧化亚铜沉淀。
因此,斐林试剂可以用来鉴定溶液中是否有麦芽糖,进而可以看出唾液淀粉酶是否只能催化淀粉水解,不能催化其他糖类(如蔗糖)水解。
目的要求1(初步学会做酶的专一性实验的方法。
2(理解酶具有专一性的特点。
材料用具新鲜的唾液。
消过毒的脱脂棉,镊子,试管,小烧杯,量简,玻璃棒,酒精灯,火柴。
可溶性淀粉的质量分数为州的溶液?,蔗糖的质量浓度为3g,InL(克每毫升的溶液,斐林试剂,清水。
方法步骤1(用清水将口漱净,口内含一块消过毒的脱脂棉。
用镊子取出脱脂棉,使其中的唾液收集到小烧杯中。
2(取3mL唾液,注入另一个小烧杯中,加入30mL蒸馏水,用玻璃棒搅匀,制成稀释的唾液备用。
1( 取两支洁净的试管,编号,按下表加入试剂:1 23%淀粉溶液 2mL —3%蔗糖溶液— 2mL2%淀粉酶溶液 2mL 2mL摇匀,37?保温5 min斐林试剂 2mL 2mL摇匀,100?保温3 min现象砖红蓝色现象分析结论讨论:l、两次保温的目的各是什么,2、你认为这样设计检测酶专一性的实验完善了吗,还应有哪些改进才能使之更完善,3、设计一个鉴定蔗糖酶专一性的实验。
结论篇二:10探究酶的专一性探究酶的专一性一、教学目标比较唾液淀粉酶和蔗糖酶对淀粉和蔗糖的作用。
二、实验原理含有自由醛基或酮基的单糖和双糖叫还原性糖。
在碱性溶液中,还原糖能将金属离子(铜、铋、汞、银等)还原,糖本身被氧化成酸性化合物。
此性质常用于检验糖的还原性,并且常称为测定还原糖含量的各种方法的依据。
还原糖与碱性硫酸铜可生成砖红色沉淀物。
本尼迪特试剂内含有硫酸铜,因此淀粉水解生成的麦芽糖和蔗糖水解生成的葡萄糖、果糖等还原糖在煮沸的条件下,与本尼迪特试剂会有砖红色沉淀物产生,淀粉和蔗糖(非还原糖)无此反应。
蔗糖酶与淀粉酶的专一性实验报告

蔗糖酶与淀粉酶的专一性实验报告蔗糖酶与淀粉酶的专一性实验报告引言:酶是一类生物催化剂,能够促进化学反应的进行,而不参与反应本身。
酶在生物体内起着至关重要的作用,其中蔗糖酶和淀粉酶是两种常见的酶。
本实验旨在探究蔗糖酶和淀粉酶的专一性,以及它们在不同条件下的活性表现。
材料与方法:1. 实验所需材料:蔗糖酶、淀粉酶、蔗糖溶液、淀粉溶液、酵母浸膏、试管、试管架、显色液(碘液和淀粉溶液的复合液)等。
2. 实验步骤:a. 准备两个试管,分别加入适量的蔗糖溶液和淀粉溶液。
b. 在每个试管中加入适量的蔗糖酶和淀粉酶。
c. 将试管放置在恒温水浴中,分别设定不同的温度,如25°C、37°C和50°C。
d. 在一定时间间隔内,取出试管中的溶液,加入显色液,观察颜色变化。
e. 记录每个试管中溶液的颜色和时间。
结果与讨论:在实验过程中,观察到蔗糖酶和淀粉酶在不同条件下的活性表现存在一定的差异。
首先,我们观察到蔗糖酶对蔗糖的专一性。
在试管中加入蔗糖酶后,蔗糖溶液逐渐变为无色,说明蔗糖酶能够催化蔗糖分解为葡萄糖和果糖。
而在淀粉溶液中加入蔗糖酶后,并未观察到类似的反应,说明蔗糖酶对淀粉的降解作用较弱。
其次,我们观察到淀粉酶对淀粉的专一性。
在试管中加入淀粉酶后,淀粉溶液逐渐变为蓝黑色,说明淀粉酶能够催化淀粉分解为葡萄糖单元。
而在蔗糖溶液中加入淀粉酶后,并未观察到类似的反应,说明淀粉酶对蔗糖的降解作用较弱。
此外,我们还观察到温度对酶的活性有一定影响。
在较低的温度下(如25°C),酶的活性较低,反应速率较慢。
而在较高的温度下(如50°C),酶的活性较高,反应速率较快。
这是因为温度能够影响酶的构象和振动,进而影响其活性中心的空间结构和催化效率。
结论:通过本实验,我们得出了以下结论:1. 蔗糖酶具有对蔗糖的专一性,而淀粉酶具有对淀粉的专一性。
2. 酶的活性受温度影响,较高温度下酶的活性较高。
蔗糖酶综合性实验报告

一、实验目的1. 了解蔗糖酶的特性和功能;2. 掌握蔗糖酶提取和纯化的方法;3. 学习测定蔗糖酶活力和专一性的实验技术;4. 分析影响蔗糖酶活性的因素。
二、实验原理蔗糖酶是一种水解酶,可以将蔗糖分解为葡萄糖和果糖。
本实验通过提取和纯化蔗糖酶,测定其活力和专一性,并分析影响其活性的因素。
三、实验材料与试剂1. 实验材料:酵母菌、蔗糖、葡萄糖、果糖、淀粉、纤维素、麦芽糖等;2. 实验试剂:氯化钠、磷酸氢二钠、磷酸二氢钠、硫酸铜、硫酸锌、碘液、斐林试剂等;3. 实验仪器:旋光仪、离心机、恒温水浴锅、紫外可见分光光度计、移液器、容量瓶、烧杯、试管等。
四、实验步骤1. 蔗糖酶提取(1)将酵母菌接种于含有葡萄糖的培养基中,37℃培养24小时;(2)收集培养液,离心分离菌体;(3)将菌体悬浮于磷酸缓冲溶液中,加入一定量的氯化钠和磷酸氢二钠,超声波破碎菌体;(4)离心分离酶液,得到粗提蔗糖酶。
2. 蔗糖酶纯化(1)将粗提蔗糖酶溶液通过硫酸铵分级沉淀法进行纯化;(2)收集沉淀,用磷酸缓冲溶液溶解,透析去除小分子物质;(3)通过凝胶过滤色谱法进一步纯化蔗糖酶。
3. 蔗糖酶活力测定(1)采用硫酸铜法测定蔗糖酶活力,以葡萄糖生成量为指标;(2)设置不同浓度的蔗糖溶液,在特定条件下测定酶活力;(3)绘制酶活力曲线,确定最适酶浓度和反应时间。
4. 蔗糖酶专一性实验(1)将蔗糖酶分别作用于蔗糖、葡萄糖、果糖、淀粉、纤维素、麦芽糖等底物;(2)通过比色法测定反应产物的生成量;(3)分析酶对不同底物的催化效率,确定蔗糖酶的专一性。
5. 影响蔗糖酶活性的因素实验(1)考察pH、温度、离子强度等因素对蔗糖酶活性的影响;(2)设置不同pH、温度、离子强度等条件,测定酶活力;(3)分析影响蔗糖酶活性的因素。
五、实验结果与分析1. 蔗糖酶提取和纯化通过超声波破碎菌体和离心分离,成功提取出粗提蔗糖酶。
经过硫酸铵分级沉淀、透析和凝胶过滤色谱法,纯化得到较高纯度的蔗糖酶。
蔗糖酶的专一性实验

实验材料
• 器材:50和1000μL可调移液枪、试管、水浴锅等。 • 试剂:(略,见教材)
操作步骤 (1)蔗糖酶液的制备:秤取1g干酵母粉,分次加入 7ml水,研磨5min,过滤后,滤液用水稀释三倍(蔗 糖酶液),待用。 (2)取7支大试管,标号,按下列表格操作:
混匀后,40ºC温育30min,再加入2ml班氏试剂, 沸水浴中作用3min,观察各管颜色变化,并作记录。
蔗病糖原酶菌的多专基一因调性控研机究制研究 (P69)
实验目的
• 通过对酵母蔗糖酶专一性的研究,加深对酶专一 性的理解
• 了解酵母蔗糖酶催化水解何种糖苷键
实验原理
• 1、酶的专一性 酶的专一性是指一种酶只能对一种底物或一类底物
起催化作用,并生成具有确定结构的产物,而对其他底 物无催化作用。酶的专一性可分为: 键的专一性:只作用与一定类型的化学键,对键两端的 集团无严格要求。如核酶、酯酶等 基团专一性:对键两端或一段的基团具有严格要求,如 β-葡萄糖苷酶、转移酶等 绝对专一性:只作用于一种底物 立体异构专一性:旋光异构专一性和几何异构专一性
注意事项:
(1)充分研磨酵母 (2)脱脂棉先用蒸馏水浸湿 (3)沸水时间不可过长
思考题: (1)试管5经长时间沸水浴后,颜色可能会变成黄 绿色,为什么? (2)按专一性分,蔗糖酶分类属于何种专一性? (3)蔗糖酶水解何种糖苷键?
2、葡萄糖、果糖和半乳糖
D/α L/β
• 3、淀粉的结构与其水解产物
6
5
4
1
32
直链淀粉:200~300个α-葡萄糖以α-1,4糖苷键相连 支链淀粉:由α-1,4糖苷键和α-1,6糖苷键在直链淀粉的基础上, 分支而成
还原性:无
酶的特异性(专一性)

酶的特异性(专一性)【实验目的】本实验以唾液淀粉酶和蔗糖酶对淀粉和蔗糖的作用为例,说明酶的特异性。
【实验材料及用具】1、2%蔗糖溶液:蔗糖是典型的非还原糖,若商品蔗糖中还原糖含量超过一定标准,则呈现还原性,这种蔗糖不能使用。
所以,实验前必须进行检查。
本实验用的蔗糖至少应是分析纯的试剂。
2、0.3%氯化钠的l%淀粉溶液(新鲜配制)3、稀释200倍的新鲜唾液。
4、蔗糖酶溶液:取干酵母100克,置于研钵内,添加适量蒸馏水及少量石英砂。
用力研磨提取约l小时,再加蒸馏水,使总体积约为500毫升,过滤。
将滤液保存于冰箱内备用。
5、本尼迪克特(Benedict)试剂:将硫酸铜17.3克溶解于100毫升热蒸馏水中。
冷后,稀释至150毫升。
取柠檬酸钠173克及碳酸钠(Na2CO3·H2O)100克,加水600毫升,加热使之溶解,冷后,稀释至850毫升。
最后,把硫酸铜溶液缓缓倾倒入柠檬酸钠–碳酸钠溶液中。
混匀后,用细口瓶贮存。
此试剂可保存很久。
【实验步骤】1、淀粉酶的特异性实验取2支试管,各加入本尼迪克特(Benedict)试剂2毫升,再分别加入l%淀粉溶液或2%蔗糖溶液各4滴。
混合均匀后,放在沸水浴中煮2分钟~3分钟。
观察有无红黄色沉淀产生,纯净的淀粉和蔗糖不呈阳性反应。
再取3支试管,每管各加入稀释200倍的新鲜唾液l毫升。
再分别加入l%淀粉溶液或2%蔗糖溶液各3毫升。
混匀,放入37℃恒温水浴中保温,15分钟后取出。
各加本尼迪克特试剂2毫升,摇匀,放在沸水浴中煮2分钟~3分钟。
观察有无红黄色沉淀产生。
新鲜唾液的稀释倍数,一般为200倍。
但是,由于不同人或同一人不同时间采收的唾液内淀粉酶的活性并不相同,有时差别很大,稀释倍数可以是50倍~300倍,甚至超出此范围。
因此,应事先确定稀释倍数。
另外,要注意除去唾液里的气泡,避免稀释倍数不准确而影响实验结果。
稀释好的新鲜唾液用滤纸过滤后待用。
2、蔗糖酶的特异性实验取2支试管,各加入蔗糖酶溶液l毫升,再分别加入l%淀粉溶液3毫升或2%蔗糖溶液3毫升。
酵母蔗糖酶的提取及其性质的研究

酵母蔗糖酶的提取及其性质的研究袁某某(西北农林科技大学陕西杨凌)[摘要]采用自溶法从酵母中提取蔗糖酶,即在一定PH和适当的温度下,利用组织细胞内自身的酶系统将细胞破碎再通过乙醇的分级与透析,得到纯化的酵母蔗糖酶。
本实验也通过考马斯亮蓝G250染色法,测定蔗糖酶的活力和蛋白质浓度,对蔗糖酶的性质进行了研究。
[关键词]蔗糖酶,分离提取,酶活力,蛋白质含量1 引言自1860年Bertholet从啤酒酵母(Sacchacomyces Cerevisiae)中发现了蔗糖酶以来,它已被广泛地进行了研究。
蔗糖酶(invertase)(β-D-呋喃果糖苷果糖水解酶)(EC.3.2.1.26)特异地催化非还原糖中的β-呋喃果糖苷键水解,具有相对专一性。
不仅能催化蔗糖水解生成葡萄糖和果糖,也能催化棉子糖水解,生成蜜二糖和果糖。
2 材料与方法2.1 实验材料高活性干酵母粉、DEAE纤维束DE-23、0.2mol/L Tris-HCL缓冲液、牛血清蛋白、考马斯亮蓝G-250、葡萄糖、水杨酸、0.4mol/L NaOH溶液2.2 实验方法2.2.1 蔗糖酶的提取与部分纯化将15g高活性干酵母粉倒入250ml烧杯中,少量多次地加入50ml蒸馏水,搅拌均匀,成糊状后加入1.5g乙酸钠、25ml乙酸乙酯,搅匀,再于35℃恒温水浴中搅拌30min。
抽提补加蒸馏水30ml,搅匀,盖好,于35℃恒温过夜,8000r/min离心10min,弃沉淀及脂层,的粗级分Ⅰ。
预先将恒温水浴调到50℃,将盛有粗体级分Ⅰ的离心管稳妥地放入水浴中,不断轻摇离心管保存30min。
取出离心管,于并于中迅速冷却,4℃,10000r/min, 离心10min。
取上清液,量出体积,留出1.5ml测定酶活力及蛋白质含量(称为热级分Ⅱ)。
将热级分Ⅱ转入小烧杯中,放入冰盐浴,逐滴加入等体积预冷至-20℃的95%乙醇,同时轻轻搅拌30min,再冰盐浴10min,以沉淀完全。
实验一酶的专一性实验
酶的专一性一、实验目的学习酶专一性的测定方法。
二、实验技能掌握移液管的规范操作。
三、实验原理酶与一般催化剂最主要的区别之一是酶具有高度的特异(专一)性,即一种酶只能对一种或一类化合物起催化作用。
例如,淀粉酶和蔗糖酶虽然都催化糖昔键的水解,但是淀粉酶只对淀粉起作用,蔗糖酶只水解蔗糖。
还原糖产物可用本乃狄试剂鉴定。
四、实验器材(1)唾液淀粉酶溶液:先用蒸馏水漱口,再含10ml左右蒸馏水,轻轻漱动,数分钟后吐出收集在烧杯中,用数层纱布或棉花过滤,即得清彻的唾液淀粉酶原液根据酶活高低稀释50~100倍,即为唾液淀粉酶溶液。
(2)蔗糖酶溶液:取1g鲜酵母或干酵母放入研钵中,加入少量石英砂和水研磨,加50ml 蒸馏水,静置片刻,过滤即得。
(3)2%蔗糖溶液:用分析纯蔗糖新鲜配制。
(4)1%淀粉溶液:1g淀粉和0.3g NaCI,用5ml蒸馏水悬浮,慢慢倒入60ml煮沸的蒸馏水中,煮沸lmin,冷却至室温,加水到100ml,冰箱贮存。
(5)0.1%淀粉溶液:0.1g淀粉,以5ml水悬浮,慢慢倒入60ml煮沸的蒸馏水中,煮沸lmin,冷却至室温,加水到100ml,冰箱贮存。
6)本乃狄(Benedict)试剂:17.3g CuSO4·5H2O,加100ml蒸馏水加热溶解,冷却;173g 柠檬酸钠和100g NaCO3·2H2O,以600ml蒸馏水加热溶解,冷却后将CuSO4溶液慢慢加到柠檬酸钠-碳酸钠溶液中,边加边搅匀,最后定容至1000ml。
如有沉淀可过滤除去,此试剂可长期保存。
五、实验步骤取6支干净试管,按下表操作:1,4号试管产生砖红色沉淀,其它试管不产生砖红色沉淀。
淀粉酶对淀粉有催化作用,对蔗糖没有催化作用,酶的催化具有专一性。
七、实验体会。
设计一个蔗糖酶专一性实验

设计一个蔗糖酶专一性实验
当设计一个蔗糖酶(也称为葡萄糖醛酸酶)的专一性实验时,可以遵循以下步骤:
1. 实验目的:确定蔗糖酶对于蔗糖的特异性反应,以此来评估其专一性。
2. 实验材料:
- 蔗糖酶溶液
- 蔗糖溶液
- 葡萄糖溶液
- 缓冲液(适量)
- 试管
- 称量器具
- 恒温水浴
- 吸光度计
3. 实验步骤:
a. 准备工作:
- 为蔗糖酶溶液和蔗糖溶液分别设置适当的浓度,根据实验需求调整。
- 准备缓冲液,以确保反应的pH值适合蔗糖酶的活性。
b. 实验操作:
- 取一组试管,每个试管中加入相同体积的蔗糖酶溶液和缓冲液。
- 将第一个试管中加入蔗糖溶液,作为正对照组。
- 将第二个试管中加入等体积的葡萄糖溶液,作为阴性对照组。
- 将其余的试管中添加其他碳水化合物(如淀粉酶、乳糖酶等)作为非特异性对照组。
- 将所有试管放置在恒温水浴中,使其保持在适宜的温度,维持一定的反应时间。
c. 反应结束后,使用吸光度计测量每个试管中的吸光度,并记录下来。
d. 分析结果:
- 与正对照组相比较,如果蔗糖酶溶液在蔗糖试管中显示出显著较高的吸光度,则表明蔗糖酶对蔗糖具有专一性。
- 与阴性对照组和非特异性对照组相比较,如果蔗糖酶溶液在这些试管中显示较低的或无显著差异的吸光度,则表明蔗糖酶对其他碳水化合物没有显著反应。
请注意,这只是一个示例实验设计,确保在实验过程中遵守实验室安全操作规范,并根据具体研究需求进行适当的修改和优化。
蔗糖酶-酶工程实验

y = 0.0061x + 0.0827 y——蛋白质含量(µg/ml) x——595nm 下光吸收 四、实验结果及计算
步骤
提取(I) 热处理 沉淀(II) 乙醇沉 淀(III)
总体积 单位体积活 总活力 (mL) 力(IU/mL) (IU)
总蛋白 (mg)
比活力
纯化 产率
(IU/mg 蛋白) 倍数 (%)
1.0
1.0
1.0
1.0
1.0
1.0
将各管溶液混匀后,在 100℃恒温水浴加热 5 分钟,取出立即用冷水冷却至室温
H2O
(ml)
7
7
7
7
7
7
将各管溶液混匀
7号 0...3.5. 0.70 1.30 1.0
7
A520nm 每步收集的酶液应进行一定倍数的稀释,先试做,选其吸光度值在 0.1-1.0 内,即还原糖含量应在 0.08~1.2
【实验一】蔗糖酶的提取(实验分组:4 人)
1.实验学时:6; 2.实验目的:掌握蔗糖酶提取的流程。 3.实验内容:沉淀、透析,及活性测定。计算酶的提取效率。 4.实验要求:理解影响酶提取的基本原理,掌握沉淀、透析等方法、影响实验结果的重要因素、掌握 数据的分析方法。 一、实验原理: 1、蔗糖酶 酵母细胞存在两种蔗糖酶,一种在细胞壁中,一种在细胞质内,前者活力较高,分子量较大(约 270KDa),后者活力较低,分子量约为 135KDa,两种酶的底物专一性和动力学性质十分相似,因此,本 实验未区分内酶与外酶。 2、蔗糖酶的初步分离纯化 本实验采用选择性变性(加热)、有机溶剂(乙醇)沉淀等方法对蔗糖酶进行初步的提纯。
【实验二】蔗糖酶的固定化及固定化酶性质的测定
1.实验学时:4 2.实验目的:掌握蔗糖酶固定化方法。 3.实验内容:采用包埋法固定蔗糖酶,并测定固定化效率。 4.实验要求:理解酶的固定化原理,掌握蔗糖酶固定化的方法、实验中影响实验结果的重要因素、掌 握数据的分析方法。
浙江大学生物化学实验甲 酵母蔗糖酶的制备及其动力学性质分析

酵母蔗糖酶的制备及其动力学性质分析一、蔗糖酶(invertase or sucrase)简介蔗糖酶(EC.3.2.1.26)为水解酶类,主要存在于植物和微生物体内,专一性地催化蔗糖水解为果糖和葡萄糖的反应。
酵母蔗糖酶分子量约270000D,pI约5.0,最适pH4.6,耐酸和热,50℃保温30min 仍具有相当的活力,最适温度37℃。
耐乙醇,因此可用乙醇沉淀进行分离纯化。
二、酵母蔗糖酶的分离纯化本试验分离纯化酵母蔗糖酶分四步:甲苯抽提。
加热纯化。
乙醇分级沉淀。
纤维素柱层析分离纯化。
㈠、前三步分离纯化的原理如下:甲苯石英砂离心上层(甲苯层):脂溶性物质酵母细胞破细胞中层(水层):蔗糖酶,可溶性糖等研磨下层(沉淀):细胞碎片、变性蛋白等取中层50水浴中使热不稳定蛋白变性上清:蔗糖酶、可溶性糖等(水层)保温30分钟沉淀:变性蛋白取上清加乙醇使蔗糖酶沉淀上清:杂蛋白及可溶性糖等冰浴中20分钟沉淀:蔗糖酶、杂蛋白等㈡、纤维素柱层析分离纯化的原理1、离子交换柱层析分离混合物的基本原理离子交换层析(Ion Exchange Chromatography)是一种根据待分离物质的阳或阴离子和相对应的离子交换剂间的静电结合,即根据物质酸碱性、极性等差异,通过离子间的吸附和脱吸附而将溶液中各组分分开的一种技术。
离子交换层析是一种液-固相层析技术。
其中,液相称洗脱液,固相的惰性支持介质称离子交换剂。
在离子交换剂上具有带电基团,不同的交换剂所具有的带电基团的电荷性质不同,如交换剂上的带电基团带正电荷,则可结合溶液(液相)中的阴离子,这样的交换剂称为阴离子交换剂,如DEAE纤维素、强碱型的离子交换树脂等。
反之,如交换剂上的带电基团带负电荷,则可结合溶液中的阳离子,这样的交换剂称为阳离子交换剂,如CM-纤维素、强酸性的离子交换树脂等。
离子与交换剂的静电结合作用具如下特点:选择性:离子所带的电荷越多,离子半径越小,越易结合。
遵循质量作用定理:对某一特定离子,随离子浓度的增大,则遵循质量作用定理向与交换剂结合方向进行可逆性:在一定条件下,结合在交换剂上的离子可被其它)离子取代而离开交换剂并随洗脱液流出层析柱。
酵母蔗糖酶的制备与活力测定

酵母中蔗糖酶的制备及活力测定一、目的要求1、学习一种酵母中蔗糖酶的制备方法。
2.掌握3,5-二硝基水杨酸试剂(DNS试剂)测定酶活力的原理和方法。
3. 掌握还原糖测定的基本原理和721分光光度计的操作。
二、实验原理蔗糖酶(invertase)(β—D—呋喃果糖苷果糖水解酶)(fructofuranoside fructohydrolase)(EC.3.2.1.26)特异地催化非还原糖中的α—呋喃果糖苷键水解,具有相对专一性。
不仅能催化蔗糖水解生成葡萄糖和果糖,也能催化棉子糖水解,生成密二糖和果糖。
每水解1mol蔗糖,就生成2mol还原糖。
还原糖在碱性条件下加热可被氧化成糖酸及其它产物,而氧化剂3,5-二硝基水杨酸(DNS)则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计在520nm波长下测定光密度(OD)值,查对标准曲线并计算,便可求出样品中还原糖的含量。
酶活力单位的定义:在一定条件下,反应5分钟每产生1mg还原糖所需的酶量为一个活力单位(U)。
三、仪器与试剂1. 仪器研钵,天平,离心机,721型分光光度计,恒温水浴,具塞试管25ml,沸水浴,移液器(1000ul、200 ul)2. 试剂市售酵母干粉,石英砂,丙酮(预冷), 1mg/ml葡萄糖溶液,pH4.5醋酸缓冲液, 10%蔗糖溶液,3,5-二硝基水杨酸溶液。
四、实验方法1. 蔗糖酶制备称取10g酵母干粉和少量石英砂放入研钵中,加适量蒸馏水,用力研磨30分钟成糊状,再加蒸馏水100ml,搅匀,6层纱布过滤,滤液加2倍体积冷丙酮搅匀,静置5分钟,离心管中,平衡后3000 rpm离心10 min,弃上清取沉淀。
沉淀用2倍体积丙酮重复操作一次。
沉淀真空干燥后称重。
再称取25mg酶粉加入少量蒸馏水研磨5分钟,用蒸馏水定容至40m l作为酶应用液备用。
2. 蔗糖酶活力测定(1)制作葡萄糖标准曲线取7支具塞刻度试管编号,按表1分别加入浓度为1mg/ml的葡萄糖标准溶液、蒸馏水和DNS试剂,配成不同浓度的葡萄糖反应液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
!!-探究酶的专一性.是浙科版高中生物学必修 % -酶.一节中的活动%%&# +浙江省普通高中学业水平考 试暨高考选考科目考试说明,对本实验要求为 2!应 用"%.&' 通过比较唾液淀粉酶和蔗糖酶对淀粉和蔗糖 的作用$分析酶的专一性$体验控制变量$并加深对对 照实验的理解# 然而$市售的蔗糖酶!蔗糖转化酶"大 多数为酸性蔗糖酶$最适 在 <Q 1N# 左右$最适温度在 #$m左右$与唾液淀粉酶的最适 温 <Q) 度等反应条件 差异大# 此外$酶的催化效果并不理想# 本实验从酵 母菌中提取蔗糖酶$结果表明$在与唾液淀粉酶一致的 实验条件下! 中 <Q 性$"Tm"$酵母蔗糖酶水解蔗糖能 力仍较好$实验现象明显# !"酶溶液和淀粉溶液的制备
%-淀粉溶液' 用质量分数为 的 $N"- 溶液 E9@3
配置淀粉溶液!可溶性淀粉含量 %-"$加热至略透明) 无沉淀$即制成淀粉胶体!液溶胶"# 为 @3X 唾液淀粉 酶的激活剂# #"实验方法与结果 .N%!实验过程!%取 V 支试管$分别编号 % 号 UV 号$ 按表% 所示添加试剂(充分混匀后$置于"Tm恒温水浴 中保温!可用恒温水浴锅(或用烧杯)石棉网)三脚架和 酒精灯等搭建简易水浴装置"$反应 %# >;,(&向 V 支 试管各加 . >L本尼迪特试剂!班氏试剂"$摇匀$热水 浴 " >;,!若现象不明显$可适当延长反应时间" 记 (' 录各试管的颜色#
实验酶促反应温度设置在 #$m# 要保证淀粉酶和蔗 转化为一个小课题去研究$制定实验方案$实施实
糖酶有活性$实验前需检验这两种酶是否有活性# 经 验$观察实验现象并得出结论# 通过探究实验$不仅
反复试验$蔗糖酶和淀粉酶的浓度为 %-较合适# 此 能让学生学会设置对照组$学会控制变量的科学方
外$淀粉溶液和蔗糖溶液要新鲜$现配现用$避免被微 法$学会使用对比分析的方法$还能培养学生科学研
表 !"酶促反应体系
试!剂
试!管
%."1#V
%-淀粉溶液!>L" "
"
"
.-蔗糖溶液! >L"
"
"
"
新鲜唾液!>L"
%%
蔗糖酶溶液!>L"
%%
蒸馏水! >L"
%%
..............................................
表 #"实验记录表
两种酶中混有还原性物质的可能$实验过程更加
生物分解产生还原性糖$会对实验结果产生干扰# 究的能力及应用生物学科知识解决生物学科问题的
!." 增加两组对照组!" 号和 1 号试管"$排除了 能力# "
生物学教学 .$%& 年!第 1" 卷"第 1 期
.N.!实验结果!实验结果见表 .# " 号试管呈红黄 色$V 号试管呈橙黄色!产生的还原糖量相对较少"$静 置后均沉淀# 其余试管均呈蓝色# 说明 " 号试管中淀 粉在唾液淀粉酶的作用下水解产生还原糖$V 号试管 中蔗糖在蔗糖酶的作用下水解产生还原糖$其余试管 由于未加酶或没有对应的酶$淀粉或蔗糖没有水解# 学生根据实验结果得出结论' 酶具有专一性#
表 #"探究酶的专一性实验结果
试管 % . "
1
#
V试处剂理淀粉Fra bibliotek蔗糖淀粉 h 蔗糖 h 淀粉 h 蔗糖 h 唾液 唾液 蔗糖酶 蔗糖酶
实结验果 蓝色 蓝色 红黄色 蓝色 蓝色 橙黄色
$"讨论 教师针对本实验进一步提问$引导学生讨论# 问
题一' 根据单一变量原则$找出作为对照实验的 . 支 试管# 学生会给出多种回答' % % 号和 " 号试管是对 照实验$. 号和 V 号试管是对照实验$其中 % 号试管) . 号试管是各自组中的空白对照$用以表明本实验所 用淀粉)蔗糖不与本尼迪特试剂反应$不是还原糖$ 或未混有还原糖!排除假阳性"# & " 号和 1 号试管 是对照实验$# 号和 V 号试管是对照实验$各组中酶 一致而底物不一致$相应的酶只能催化对应的底物 水解$说明酶具有专一性# ' " 号和# 号试管是对照 实验$1 号和 V 号试管是对照实验$各组中底物一致 而酶不一致$相应的底物只能被对应的酶水解$说明 酶具有专一性#
*11*
生物学教学 .$%& 年!第 1" 卷"第 1 期
自制酵母蔗糖酶进行酶的专一性实验探究
夏 天 李 晖 ! !!浙江省余姚市第四中学!"%#1$$"! ! !!浙江省余姚市教育局教研室!"%#1$$"
摘!要!通过从酵母菌中提取蔗糖酶$使-探究酶的专一性.的实验结果更加明显# 学生通过做实验)分析实验$进一步理解对照 实验$体会等量原则和单一变量原则# 关键词!中学生物学实验!酵母蔗糖酶!专一性
+"实验设计反思
力# 当学生有疑问时$先不要直接告诉结论$应引导
!%" 以市售 # 淀粉酶替代新鲜唾液$酶促反应时 学生进行实验探究$观察思考$最后通过分析实验结
间缩短为 # >;,(而市售的 # 淀粉酶的最适温度为 果$由学生自己总结出实验结论' 例如$为什么淀粉
#$m UV$m之间$蔗糖酶最适温度为 1#m U#$m$故本 要溶解在氯化钠溶液中呢0 这时要鼓励学生将问题
问题二' 教师向学生展示使用实验室中久置的 蔗糖进行实验的结果$. 号和 1 号试管呈绿色$其他 试管的现象与预期一致# . 号和 1 号试管实验结果 与预期结果的不一致会引起学生思考这种反常现象 的原因是什么# 首先$教师提问为什么 . 号和 1 号试 管会呈绿色$而不是蓝色或红黄色0 有学生提出可 能是蓝色的本尼迪特试剂和红黄色沉淀的混合色# 那么怎么去证明0 教师提示静置后观察# 静置一段 时间后$颜色区分明显$底部出现红黄色沉淀$而上 层清液呈蓝色# 接着$学生会进一步去分析实验结 果$在排除试管未洗净等可能性后$通过分析 . 号和 1 号试管都加入了蔗糖$确认实验用的蔗糖混有少量 还原糖#
新鲜唾液!含唾液淀粉酶"' 漱口$收集唾液$注意 除去唾液里的气泡!影响稀释倍数"$稀释 .$$ 倍!不同 人的唾液淀粉酶活性有差异$稀释倍数可适当调整" %"& #
蔗糖酶溶液' 取 . 8高活性干酵母置于研钵中$加 $N. 8石英砂和 # 蒸 >L 馏水$研磨 %# 取 >;,$ 出匀浆$ 稀释 %$ 倍# 置于 1#m水浴 # >;, 使杂蛋白失活# 过 滤$保存滤液%1& #
试管
%."1#VT&
实验结果 X X X X h X X h
严谨# !"" 如果是学生课下进行探究实验$可以采用唾
液淀粉酶作为实验材料$教材建议唾液稀释 .$$ 倍$为
!!!注'- h.代表有砖红色沉淀产生$- X.代表无砖红色沉淀 产生"
使实验现象更明显$稀释倍数可减少为 #$ 倍甚至更 少# 通过探究实验可以培养学生的理性思维和探究能
