戊地昔布对人食管癌Eca109细胞系的抑制作用及其调控
非甾体抗炎药物镇痛机制研究进展

非甾体抗炎药物镇痛机制研究进展【摘要】疼痛(Pain)不仅会在精神上给患者带来不愉快,还会给患者造成生理功能上的紊乱,被称为“第五生命体征”,每年都会造成巨大的经济和社会负担,因此对镇痛类药物的研究就显得格外重要。
目前在临床上人们普遍使的镇痛药物主要为用阿片类的镇痛药物和非甾体抗炎药。
其中,阿片类镇痛药物尽管具有强效的镇痛效果,但其呼吸抑制、恶心呕吐等副作用让人望而生畏。
非甾体类抗炎药物具有较好的抗炎镇痛效果,是目前应用最广泛的抗炎镇痛药物之一。
目前,对非甾体类抗炎药物镇痛机制的研究,多集中于对环氧化酶的抑制作用,对其机制的探讨仍需深入。
本文通过对非甾体类抗炎药物多种镇痛机制的整理及总结,为临床上更好地应用非甾体抗炎药物并开发出更多高效低毒的镇痛药物奠定良好的理论基础。
【关键词】非甾体类抗炎药物;镇痛机制;环氧合酶抑制剂;体液免疫Research Progress on analgesic mechanism of non steroidal anti-inflammatory drugs[Abstract]Pain, the fifth Vital Sign, brings unpleasure to patients as well as the disorders of physiological function, leading to a huge of burden on economy and society. Therefore, the research on Analgesic is crucial. At present, opioids and non-steroidal anti-inflammatory drugs are the most widely used analgesic drugs. Among them, opioids have excellent effects, however, the side effects such as respiratory depression, nausea and vomiting are daunting. NSAIDs have a better effect on analgesic, it’s the most widely used medicine on inflammation pain. At present, most of the researches on the analgesic mechanism of NSAIDs mainly focus on the inhibition of cyclooxygenase, and the study of the mechanism still needs to be further studied. In this review, various analgesic mechanisms of non-steroidal anti-inflammatory drugs were summarized to lay a good theoretical foundation for better clinical application of them and the development of more high-efficiency and low-toxicity analgesic drugs..[Key words] non steroidal anti-inflammatory drugs; Analgesic mechanism; Cyclooxygenase inhibitor; humoral immunity非甾体抗炎药(Non-steroidal Anti-inflammatory Drugs,NSAIDs)是一类不含有甾体结构的抗炎药,具有明确的抗炎、镇痛的作用。
乳源免疫调节肽诱导人食管癌Eca-109细胞凋亡的研究

P G P I P N能诱 导人 食道癌 E c a 一 1 0 9细
胞 凋亡 , 这 可 能与 s u r v i v i n蛋 白表达 下 降 , c a s p a s e 一 3蛋 白表
关键词 乳 源免疫调节肽 ; E c a 一 1 0 9细胞 ;细胞凋亡 R 7 3 5 . 1
亡, 用 免疫 组化 s P法检 测 P G P I P N诱导 E c a 一 1 0 9细胞 凋亡 过程 中 s u r v i v i n 、 c a s p a s e 一 3蛋 白的表 达变化情况 。结果 P G — P I P N对人 食管癌 E c a 一 1 0 9细胞 有 明显 的生 长抑制 作用 并有
3 7  ̄ C、 5 %C O 的恒温 培养 箱 中培养 2 4 h 。大部分
细胞 贴壁 后 , P G P I P N组 分 别 加 入 不 同 质 量 浓 度 的
道。该研究通过体外实验初步探讨 P G P I P N对人食
一
P G P I P N 1 0 0 l 使 其 终浓 度 分别 为 2 . 5 、 5 、 1 O 、 2 O m g / L , 每一个浓度设 8个复孔 ; 对照组加人等体 积
的培 养 液 ; 继续培养 4 8 h 。每 孔 加 入 M 1 T r液 ( 5 L ) 2 0 l , 继续 培养 4 h , 吸弃上清液 , 每孔加入 D M-
管癌细胞株 E c a . 1 0 9生长及凋亡 的作用 , 为其作 为 种抗癌药物或防癌保健药应用于食管癌的临床治
响
0 . 2 5 %胰 蛋 白酶 ( p H 7 . 4 ) 消 化 并 收 集 处 于 对
清开灵注射液对人食管癌 Ec-109细胞的体外抑制作用

d o i : 1 0 . 3 9 6 9 / j . i s s n . 1 0 0 3 . 8 9 1 4 . 2 0 1 4 . 1 0 . 0 2 1 文章 编 号 : 1 0 0 3 — 8 9 1 4 ( 2 0 1 4 ) . 1 0 - 2 0 6 5 - 0 2
Ke y w o r d s : Q i n g k a i l i n g I n j e c t i o n ; E c 一 1 0 9 ; E s o p h a g e a l c a n c e r ; I n h i b i t i o n
MT T a n d A O / E B s h o w e d Q i n g k a i l i n g I n j e c t i o n c a n s i g n i i f c a n t l y i n h i b i t t h e p r o l i f e r a t i o n o f E c - 1 0 9 c e l l s .C o n c l u s i o n Q i n g k a i l i n g I n j e c t i o n
i n t e r v e n t i o n .I n h i b i t i o n o f p r o l i f e r a t i o n w a s me a s u r e d Q i n g k a i l i n g I n j e c t i o n w i t h MT T m e t h o d , a n d a p o p t o s i s w a s d e t e c t e d b y A O / E B .R e s u l t s
塞来昔布抑制食管癌细胞系ECa109增殖
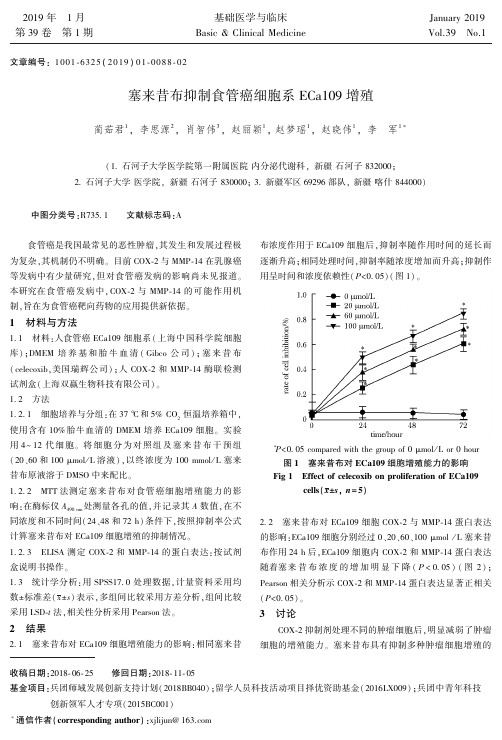
COX ̄2 抑制剂处理不同的肿瘤细胞后ꎬ明显减弱了肿瘤 细胞的增殖能力ꎮ 塞来昔布具有抑制多种肿瘤细胞增殖的
收稿日期:2018 ̄ 06 ̄ 25 修回日期:2018 ̄ 11 ̄ 05 基金项目:兵团师域发展创新支持计划(2018BB040) ꎻ留学人员科技活动项目择优资助基金( 2016LX009) ꎻ兵团中青年科技
作用[1 ̄2] ꎮ 本结果证明塞来昔布明显抑制 ECa109 细胞的增 殖ꎬ随着塞来昔布浓度的升高及作用时间的延长抑制率逐渐 升高ꎬ提示塞来昔布对食管癌细胞的抑制作用呈时间和浓度 依赖性ꎬ与文献报道相近[3] ꎮ
有报道 称 COX ̄2 和 MMP ̄14 蛋 白 可 能 通 过 NF ̄κB 及 JAK / STAT3 信号 通 路 相 互 联 系[ 4] ꎮ 本 结 果 还 表 明 COX ̄2 和 MMP ̄14 蛋白的表达随着塞来昔布浓度升高呈下降趋势ꎬ 具有浓度依赖性ꎮ COX ̄2 和 MMP ̄14 蛋白表达呈显著正相 关ꎬ提示塞来昔布抑制食管癌细胞 MMP ̄14 蛋白的表达ꎬ可
2019 年 1 月 第 39 卷 第 1 期
基础医学与临床 Basic & Clinical Medicine
文章编号: 1001  ̄6325 ( 2019 ) 01  ̄ 0088  ̄ 02
January 2019 Vol.39 No.1
塞来昔布抑制食管癌细胞系 ECa109 增殖
ቤተ መጻሕፍቲ ባይዱ
蔺茹君1ꎬ 李思源2ꎬ 肖智伟3ꎬ 赵丽颖1ꎬ 赵梦瑶1ꎬ 赵晓伟1ꎬ 李 军1∗
食管癌是我国最常见的恶性肿瘤ꎬ其发生和发展过程极 为复杂ꎬ其机制仍不明确ꎮ 目前 COX ̄2 与 MMP ̄14 在乳腺癌 等发病中有少量研究ꎬ但对食管癌发病的影响尚未见报道ꎮ 本研究在 食 管 癌 发 病 中ꎬ COX ̄2 与 MMP ̄14 的 可 能 作 用 机 制ꎬ旨在为食管癌靶向药物的应用提供新依据ꎮ
塞来昔布对食管癌细胞侵袭的抑制作用及机制

论著㊃基础研究塞来昔布对食管癌细胞侵袭的抑制作用及机制赵晓伟1,李思源2,肖智伟3,李 军1,赵梦瑶1,蔺茹君1,冀雪姣1 (1.石河子大学医学院第一附属医院内分泌代谢科,新疆 石河子 832000;2.石河子大学医学院,新疆 石河子 832000;3.中国人民解放军69296部队,新疆 喀什 844200)[摘 要] 目的:探讨选择性COX-2抑制剂塞来昔布对体外培养的人食管癌EC109细胞基质金属蛋白酶14(MMP-14)的蛋白表达水平和塞来昔布对食管癌EC109细胞侵袭力的影响及其可能机制㊂方法:COX-2抑制剂塞来昔布(0㊁20㊁60㊁100μmol /L )分别处理食管癌细胞株EC109细胞,酶联免疫吸附剂测定法(ELISA )测定EC109细胞内的MMP-14蛋白水平,用Transwell 侵袭实验中侵袭细胞的数目表示细胞的侵袭能力,检测不同浓度塞来昔布作用下食管癌癌细胞的侵袭能力㊂结果:EC109细胞被不同浓度(0㊁20㊁60㊁100μmol /L )塞来昔布处理24h 后,ELISA 测定结果显示EC109细胞内的MMP-14蛋白表达水平,与0μmol /L 塞来昔布组相比,20㊁60㊁100μmol /L 组逐渐降低,依次是11.517±0.881,7.905±0.724,5.788±0.750,3.663±0.601,差异有统计学意义(P <0.05);Transwell 侵袭实验结果显示,与0μmol /L 塞来昔布组相比,20㊁60㊁100μmol /L 组穿过基质胶的细胞个数逐渐下降,分别为:258.200±16.991;170.200±12.498㊁85.600±8.905和40.200±8.585,差异有统计学意义(F =237.182,P <0.05),呈浓度依赖性㊂结论:COX-2抑制剂塞来昔布可能是通过抑制MMP-14蛋白表达,起到抑制食管癌EC109细胞系的侵袭的作用,这为食管癌的防治及靶向药物的研制提供了依据㊂[关键词] 环氧合酶抑制剂;细胞基质金属蛋白酶14;食管癌;细胞侵袭;塞来昔布基金项目:兵团区域创新引导计划项目[项目编号:2018BB040];石河子大学成果转化与技术推广项目[项目编号:CGZH201911]通讯作者:李 军Inhibitory effect and mechanism of elecoxib on invasion of esophageal carcinoma cells ZHAO Xiao -wei 1,LI Si -yuan 2,XIAO Zhi -wei 3,et al (1.Department of Endocrinology ,The First Affiliated Hospital of the Medical College ,Shihezi University ,Shihezi 832000,China ;2.Medical College of Shihezi University ,Shihezi ,832000,China ;3.Chinese people 's Liberation Army 69296,Kashgar 844200,China )Abstract :Objective To investigate the effect of selective COX-2Inhibitor Celecoxib on the expression of matrix metallo⁃proteinase-14(MMP-14)in human esophageal cancer Ec109cells in vitro and its possible mechanism.Method Ec109cells were treated with celecoxib (0μmol /L,20μmol /L,60μmol /L,100μmol /L)respectively.The expression of MMP-14protein in Ec109cells was detected by enzyme-linked immunosorbent assay (ELISA).Results After Ec109cells were treatedwith different concentrations of celecoxib(0μmol /L,20μmol /L,60μmol /L,100μmol /L)for 24hours,the expression of MMP-14protein in Ec109cells was detected by pared with 0μmol /L celecoxib group,the expression of MMP -14protein in Ec109cells in 20μmol /L,60μmol /L,100μmol /L celecoxib groups decreased gradually,and the order was11.517±0.881,7.905±0.724,5.788±0.7500,3.663±0.601,the difference was statistically significant(P <0.05);Transwell:compared with 0μmol /L celecoxib group,the number of cells passing through the matrix glue in 20μmol /L,60μmol /L and 100μmol /L celecoxib groups decreased gradually,which were 258.200±16.991,170.200±12.498,85.600±8.905and 40.200±8.585,respectively,with statistical significance (F =237.182,P <0.05),which was concentration depend⁃ent.Conclusion Celecoxib can inhibit the invasion of esophageal cancer Ec109cell line by inhibiting the expression of MMP-14protein,which provides a basis for the prevention and treatment of esophageal cancer and the development of targeted drugs.Key Words :Cyclooxygenase inhibitor;Matrix metalloproteinase 14;Esophageal cancer;Cell invasion;Celecoxib 食管癌位居全世界常见恶性肿瘤的第8位[1]㊂食管癌疾病进展㊁术后复发㊁预后差的重要原因之一是食管癌侵袭及转移[2],探索抑制食管癌细胞侵袭转移的方法是目前食管癌研究的热点之一㊂COX-2在正常组织中表达几乎为零,而在促癌因素㊁癌基因等病理因素刺激作用下,在局部组织中可迅速高表达[3-4]㊂COX-2主要是通过促进细胞增殖和侵袭[5]发挥促进肿瘤生长作用㊂研究表明使用非甾体类消炎药或特异性COX-2抑制剂可抑制胃腺癌细胞的增殖㊁侵袭及生长活性[6]㊂MMP-14是基质金属蛋白酶(MMPs)中的一种,是以酶原形式由瘤细胞及间质细胞产生和分泌[7]的蛋白水解酶,经水解后激活㊂MMP-14的过度表达,利于癌细胞的转移,主要是通过破坏肿瘤细胞侵袭的组织学屏障发挥作用[7-10]㊂在肿瘤细胞中MMP-14高表达,且癌细胞侵袭和转移程度及肿瘤进展与MMP-14的高表达密切相关,是肿瘤患者预后的重要指标之一㊂本试验拟研究COX-2抑制剂塞来昔布对食管癌细胞系侵袭作用的影响及机制,为食管癌机制的研究及防治提供依据㊂1 材料与方法1.1 主要实验材料:购自上海中国科学院细胞库的人食管癌EC109细胞系㊂购自美国pfizer pharmaceuticals LLC公司的塞来昔布㊂购自美国GIBCO公司的胎牛血清(FBS)㊁细胞培养基(DMEM)㊂购自美国CORNING公司的Trans well小室(8μm)㊂购自美国Becton Dickinson公司的基质胶(Matri⁃gel)㊂购自美国SIGMA公司的二甲基亚砜(DMSO)㊂购自美国SIGMA公司的结晶紫㊂1.2 方法1.2.1 细胞培养:在5%二氧化碳恒温37℃培养箱环境中,将人食管癌EC109细胞加入培养基(含10%胎牛血清的DMEM)中培养,取其对数期细胞制备成105/ml的单细胞悬液进行实验㊂1.2.2 细胞分组处理;以塞来昔布终浓度分组,分别为0μmol/L㊁20μmol/L㊁60μmol/L㊁100μmol/L组㊂1.2.3 蛋白浓度测定:ELISA法测定塞来昔布(0μmol/L㊁20μmol/L㊁60μmol/L㊁100μmol/L)作用下EC109细胞胞内MMP-14蛋白的相对浓度㊂1.2.4 Transwell侵袭实验:每个小室镜下观察可随机选取5个视野计数,以穿过聚碳脂膜的细胞数目来评估食管癌EC109细胞侵袭能力㊂1.3 统计学方法:实验数据处理运用统计学软件SPSS17.0,计量资料采用均数±标准差(x±s)形式表示,两组间比较采用t 检验,采用方差分析比较多组间均数,P<0.05为差异有统计学意义㊂2 结果2.1 EC109细胞在各塞来昔布组作用下的MMP-14蛋白相对浓度:EC109细胞被四组塞来昔布处理24h后,ELISA测定EC109细胞内的MMP-14蛋白表达水平,0μmol/L塞来昔布组为11.517±0.881,20μmol/L塞来昔布组为7.905±0.724, 60μmol/L塞来昔布组为5.788±0.750,100μmol/L塞来昔布组为3.663±0.601,差异有统计学意义(P<0.05);可见在0~ 100μmol/L之间,随着塞来昔布药物浓度的递增,细胞内MMP-14蛋白表达逐渐降低,差异有统计学意义(P<0.05)㊂见表1㊁图1㊂表1 EC109细胞在各组塞来昔布作用下的MMP-14蛋白表达水平塞来昔布组MMP-14蛋白浓度(x±s)t值P值0μmol/L11.517±0.88120μmol/L7.905±0.7245.480.005①60μmol/L5.788±0.7508.820.001①100μmol/L3.663±0.60112.76<0.001① 注:①P<0.05,compared with controlgroup注:与0μmol/L塞来昔布组比较,*P<0.05图1 各组塞来昔布作用下EC109细胞内MMP-14的蛋白表达2.2 EC109细胞侵袭能力在各塞来昔布组作用下的变化:各组塞来昔布处理EC109细胞24h后,Transwell侵袭实验中,穿过小室基质胶的细胞数,0μmol/L组为258.200±16.991, 20μmol/L组为170.200±12.498,60μmol/L组为85.600±8.905,100μmol/L组为40.200±8.585,差异有统计学意义(F=309.910,P<0.05);可见随着塞来昔布药物浓度在0~ 100μmol/L之间递增,EC109细胞的侵袭能力逐渐降低㊂见图2㊁图3㊂注:A:对照组;B:20μmol/L塞来昔布组;C:60μmol/L塞来昔布组;D:100μmol/L塞来昔布组图2 EC109细胞侵袭能力在各塞来昔布组作用下的变化(200×) 3 讨论我国是食管癌新发病例数最多的国家[11]㊂侵袭和转移是导致食管癌恶化因素之一[2]㊂近来研究表明肿瘤细胞的生长㊁侵袭和转移与MMP-14在肿瘤组织中的高表达有相关性㊂MMP-14在多种肿瘤组织中,如胃癌[12-13]㊁结直肠癌[14-15]㊁原发性肝癌[16]㊁乳腺癌[17-18]㊁胰腺癌[19]等肿瘤组织均有过度表图3 各塞来昔布处理组侵袭细胞的个数比较(x±s,n=3)(*P<0.05)达,且MMP-14高表达的癌细胞侵袭能力与MMP-14非高表达相比增强㊂MMP-14是影响预后的重要因素[20]㊂COX-2是在炎性介质[21]㊁多种促癌因素[22-23]等因素作用下高表达的诱导型酶㊂其主要是通过降解细胞外基质,对肿瘤细胞增殖㊁侵袭及转移有促进作用,对凋亡[2]有抑制作用㊂肿瘤组织中COX-2,MMP-14不仅均有高表达且两者相关联[24],COX-2的高表达可同时伴有MMP-14蛋白表达的显著增高,COX-2表达下调可使MMP-14蛋白表达降低,且肿瘤细胞的增殖㊁侵袭能力明显降低[25-26]㊂刘卫梅等研究表明在甲状腺癌患者较甲状腺良性病变中COX-2和MMP-14阳性表达率高,而两者在甲状腺体正常组织中不表达[24]㊂易松等在肾癌中的研究表明,组织中MMP-14高表达可能是促进肾癌浸润和转移的因素之一[27]㊂食管癌组织中COX-2存在持续性高表达㊂塞来昔布是选择性COX-2抑制剂,其发挥抗炎和抗肿瘤作用[28],但具体的机制尚不清楚㊂本实验测定食管癌EC109细胞中MMP-14蛋白表达,结果显示,随着塞来昔布药物浓度递增(在0~ 100μmol/L之间),细胞内MMP-14蛋白相对浓度逐渐下降,说明COX-2可抑制MMP-14的表达㊂Transwell侵袭实验结果显示,EC109细胞侵袭能力与塞来昔布呈浓度依赖性㊂说明MMP-14蛋白的高表达和食管鳞癌的浸润转移有关,且呈负相关,MMP-14蛋白的高表达抑制食管鳞癌的浸润转移㊂因MMP-14和肿瘤细胞的转移密切相关,所以随着COX-2抑制剂浓度的增加,癌细胞侵袭能力下降,笔者的研究结果就验证了这一点㊂这与刘卫梅[24]㊁易松[27]随塞来昔布浓度增加MMP-14蛋白表达逐渐降低的结果相一致㊂本实验研究结果表明COX-2抑制剂塞来昔布通过抑制COX-2,降低EC109细胞内MMP-14蛋白的表达,抑制EC109细胞侵袭㊂综上所述,本研究表明COX-2抑制剂塞来昔布可能通过抑制MMP-14蛋白表达,抑制食管癌EC109细胞的侵袭,这为食管癌的防治及靶向药物的研制提供了依据㊂目前也有塞来昔布与常规化学治疗药物的联合治疗直肠癌[29]㊁口腔癌[30]㊁卵巢癌[31]㊁胃癌[32]等疾病在动物试验及临床试验中的研究,且目前可以被认为是增强抗癌药物的治疗功效的药物[33],但机制尚不明确,仍需要在Bax基因促进细胞凋亡,NF-κB信号通路的Cyclin D1靶基因,抑制肿瘤细胞增殖及肿瘤组织中血管形成及生长着过程等方面的研究㊂目前也有些合成的MMP抑制剂应用于临床试验,随着研究的不断深入,将会为肿瘤治疗提供更多方法㊂4 参考文献[1] Bray F,Ferlay J,Soerjomataram I,et al.Global cancer sta⁃tistics2018:GLOBOCAN estimates of incidence and mortality worldwide for36cancers in185countries[J].CACancer J Clin, 2018,68(6):394-424.[2] 文 卉,刘 涛,余宗涛,等.环氧合酶-2抑制剂NS398对食管癌细胞迁移的抑制作用及其机制[J].华中科技大学学报(医学版),2016,45(03):302-305.[3] 钟海莹,张广森.COX-2在恶性肿瘤发生发展中的作用和机制[J].国外医学.输血及血液学分册,2004(03):203-206.[4] 梁志海,唐国都,赖铭裕.环氧合酶-2与食管鳞癌新生血管的关系[J].山西医科大学学报,2009,40(02):120-122+ 193.[5] D.P.Toomey,J.F.Murphy,K.C.Conlon.COX-2,VEGF and tumour angiogenesis[J].The Surgeon,2009,7(3):174-80.[6] Cheng J,Fan X-M.Role of cyclooxygenase-2in gastric cancer development and progression.World Journal of Gastroenter⁃ology□:World J Gastroenterol.2013;19(42):7361-7368. [7] 郝 兴,刘建生,陈博艺,等.选择性环氧合酶-2抑制剂塞来昔布抗肿瘤作用机制的研究进展[J].中国现代医生, 2016,54(34):157-160.[8] 宋碧莹,于祥菊,孙玉鸿.胃癌新型肿瘤标记物研究进展[J].广东化工,2018,45(15):149-150.[9] Friedl P,Wolf K,Tumour-cell invasion and migration:di⁃versity and escape mechanisms[J].Nat Rev Cancer,2003,33 (5):362-374.[10] Zhao Y,Zhou S,Heng CK.Celecoxib inhibits serum amy⁃loid a-induced matrix metalloproteinase-10expression in human endothelial cells[J].J Vasc Res,2009,46:64-72 [11] 曹小琴,孙喜斌.食管癌发病水平及变化趋势[J].中国肿瘤临床,2016,43(21):932-936.[12] 张金玲,费 雁,陈 伟,等.MMP-2㊁MMP-14㊁TIMP-2在胃癌组织中的表达及意义[J].华中科技大学学报(医学),2013,42(2):227-230.DOI:10.3870/j.issn.1672-0741.2013.02.023.[13] Chung HW,Lim JB.Role of the tumor microenvironment in the pathogenesis of gastric carcinoma[J].World J Gastroen⁃terol,2014,20(7):1667-80.[14] 马晋疆,李志刚,侯吉学,等.MMP-14和CD31-MVD 在结直肠癌组织中的表达及临床意义[J].安徽医科大学学报,2017,52(11):1694-1698.DOI:10.19405/ki.issn1000 -1492.2017.11.025.[15] 鲍柏军,李 旭,肖明兵,等.MMP-14在结直肠癌中的表达及意义[J].江苏医药,2014,40(15):1766-1769. [16] 刘 敏,曾 霞,侯恩存,等.Glypican3㊁MMP-9和MMP-14在原发性肝癌中的表达与临床意义[J].重庆医学, 2014,(2):173-176.[17] Li Y,Kuscu C,Banach A,et al.miR-181a-5p Inhibits Cancer Cell Migration and Angiogenesis via Downregulation of Ma⁃trix Metalloproteinase-14[J].Cancer Res,2015,75(13):2674-85.[18] 朱玉红,张树华,吕增华.胃癌组织中COX-2㊁CD_ (44)v6和MMP-9蛋白表达及意义[J].山东医药,2009,49 (07):57-59.[19] 陈国胜,欧希龙,孙为豪.环氧化酶-2抑制剂治疗胰腺癌机制研究进展[J].国外医学(肿瘤学分册),2005(08): 618-621.[20] 张洋洋,任东红,公建庄.基质金属蛋白酶-14的表达对食管癌细胞迁移㊁侵袭能力的影响及其作用机制的研究[J].临床内科杂志,2018,35(3):189-191. [21] 吴 检,黄 键.环氧合酶-2及其在炎症痛中表达的调节[J].海峡药学,2010,22(09):205-208.[22] 梁志海,唐国都,赖铭裕.环氧合酶-2与食管鳞癌新生血管的关系[J].山西医科大学学报,2009,40(02):120-122 +193.[23] 钟海莹,张广森.COX-2在恶性肿瘤发生发展中的作用和机制[J].国外医学.输血及血液学分册,2004(03):203-206.[24] 刘卫梅,王 玉,王泽英.COX-2㊁MMP-14在甲状腺癌中的表达及其临床意义[J].实用癌症杂志,2018,33(06): 881-882+886.[25] Zhen Meng,Ye-Hua Gan.Activating PTEN by COX-2in⁃hibitors antagonizes radiation-induced AKT activation contribu⁃ting to radiosensitization[J].Biochemical and Biophysical Re⁃search Communications,2015,460(2):198-204. [26] 丰 安,周青山.熊果酸通过下调COX-2表达降低人胃癌HGC-27细胞侵袭能力研究[J].胃肠病学和肝病学杂志,2016,25(2):184-187.[27] 易 松,王翠苹,曾甫清.COX-2与MMP-14在肾癌组织中的表达水平及临床意义[J].现代医院,2017,17(01): 77-80.[28] HARA S.Prostaglandin terminal synthases as novel thera⁃peutic targets[J].Proceedings of the Japan Academy Series B, Physical and Biological Sciences,2017,93(9):703-723. [29] Han Yi,Chen Ping,Zhang Yanyu,et al.Synergy between Auranofin and Celecoxib against Colon Cancer In Vitro and In Vi⁃vo through a Novel Redox-Mediated Mechanism[J].Cancers, 2019,11(7):931.[30] Rohan Gupta,Mihaela Cristea,Paul Frankel,et al.Randomized trial of oral cyclophosphamide versus oral cyclo⁃phosphamide with celecoxib for recurrent epithelial ovarian,fallo⁃pian tube,and primary peritoneal cancer[J].Cancer Treatment and Research Communications,2019,21:100155. [31] Gupta Rohan,Cristea Mihaela,Frankel Paul,et al.Randomized trial of oral cyclophosphamide versus oral cyclo⁃phosphamide with celecoxib for recurrent epithelial ovarian,fallo⁃pian tube,and primary peritoneal cancer[J].Cancer treatment and research communications,2019,21:100155. [32] 韩晓鹏,刘宏斌,李洪涛,等.塞来昔布联合化疗对腹腔镜胃癌根治术患者的临床疗效[J].中国现代普通外科进展,2013,16(10):789-793.[33] Ahmed Kamel S,Changling Sun,Shan Xiaotian,et al.Liposome-based codelivery of celecoxib and doxorubicin hydro⁃chloride as a synergistic dual-drug delivery system for enhancing the anticancer effect[J].Journal of liposome research,2019,30 (3):1-34.[收稿日期:2020-11-01 编校:李晓飞]四氧嘧啶诱导兔妊娠期糖尿病模型的建立及相关研究董建中,杜 斌 (中国人民解放军第968医院,辽宁 锦州 121000)[摘 要] 目的:应用不同剂型四氧嘧啶(ALX)诱导孕兔糖尿病模型,探索一种安全㊁稳定的妊娠期糖尿病模型的建立方法㊂方法:健康新西兰孕兔54只随机分为三组,均禁食12h后,A组经耳缘静脉注射15ml生理盐水;B组㊁C 组分别按100mg/kg㊁130mg/kg体重经耳缘静脉注射5%的ALX,模型不成功者分别按该剂量重复给药㊂1周后经耳缘静脉抽血检测空腹血糖值,以空腹血>16.7mmol/L作为造模成功的标准㊂比较三组模型的成功率㊁流产率及死亡率㊂结果:A组对照组模型成功率㊁流产率及死亡率均为零;B组模型成功28只,流产8只,其中流产后因高血糖死亡1只,成功率77.8%,流产率22.2%,死亡率2.8%;C组模型成功4只,流产8只,其中流产后因高血糖死亡4只,成功率33.3%,流产率66.7%,死亡率33.3%㊂各组间相比诱导成功率㊁流产率及死亡率均差异具有统计学意义(P< 0.05)㊂结论:应用ALX制备孕兔糖尿病模型,是一种相对经济㊁安全㊁可靠的方法,用小剂型多次给药的方法优于一次性大剂量给药,降低了流产率㊁死亡率,提高了模型成功率㊂[关键词] 四氧嘧啶;孕兔;妊娠期糖尿病;动物模型。
沉默MDR1基因对人食管癌细胞Eca-109-VCR多药耐药的影响

沉默MDR1基因对人食管癌细胞Eca-109-VCR多药耐药的影响摘要:胃食管反流病与食管癌等消化道疾病的高发,使得人们对食管癌的研究越来越重视。
药物耐药是食管癌治疗的主要挑战之一,最近的研究表明,MDR1基因与药物耐药密切相关。
因此,本研究旨在探讨沉默MDR1基因对Eca-109/VCR多药耐药性的影响。
本研究利用慢病毒技术向Eca-109/VCR癌细胞中转载了shRNA-MDR1并建立了MDR1基因沉默的Eca-109/VCR细胞株。
通过三-(4,5-二甲基-2-噁唑基)-2,5-二苯三唑溴化物、顺铂和多柿烷的药敏试验和流式细胞术,我们发现沉默MDR1基因的Eca-109/VCR细胞株对多柿烷、顺铂和三-(4,5-二甲基-2- 噁唑基)-2,5-二苯三唑溴化物的敏感性均显著增加,并且增加了药物诱导的凋亡率。
这说明MDR1基因沉默可以有效减轻患有Eca-109/VCR多药耐药癌的病人所面临的困难。
关键词:沉默MDR1基因,Eca-109/VCR癌细胞,多药耐药,药物耐药,药物敏感性。
Abstract: With the high incidence of digestivediseases such as gastroesophageal reflux disease and esophageal cancer, research on esophageal cancer has become more and more important. Drug resistance is one of the main challenges in the treatment of esophageal cancer, and recent research has shown that MDR1 geneis closely related to drug resistance. Therefore, thisstudy aimed to investigate the effect of silencing MDR1 gene on Eca-109/VCR multidrug resistance. In this study, we used lentivirus technology to transduce shRNA-MDR1 into Eca-109/VCR cancer cells and established MDR1 gene silenced Eca-109/VCR cells. Through drug sensitivity assays with Triazolam, Cisplatin, and Doxorubicin and flow cytometry, we found that MDR1 gene silenced Eca-109/VCR cells showed significantly increased sensitivity to doxorubicin, cisplatin, and triazole and increased drug-induced apoptosis rate. This suggests that MDR1 gene silencing can effectively alleviate the difficulties faced by patients with Eca-109/VCR multidrug-resistant cancer.Keywords: Silencing MDR1 gene, Eca-109/VCR cancer cells, multidrug resistance, drug resistance, drug sensitivityMultidrug resistance (MDR) is a major obstacle in cancer chemotherapy. MDR1 gene encodes the P-glycoprotein (P-gp), which is a transmembrane protein responsible for effluxing a variety of anticancer drugs out of tumor cells. Overexpression of the MDR1 gene in cancer cells can lead to drug resistance and treatment failure. Therefore, silencing of the MDR1 gene may enhance the efficacy of chemotherapy.In this study, we investigated the effect of MDR1 gene silencing on drug resistance in Eca-109/VCR cancer cells. Using siRNA-mediated gene silencing technique, we successfully downregulated the expression of MDR1 gene in Eca-109/VCR cells. Then, we evaluated the drug sensitivity of these cells to several commonly used anticancer drugs.Our results demonstrated that MDR1 gene silenced Eca-109/VCR cells exhibited increased sensitivity to doxorubicin, cisplatin, and triazole. Moreover, we observed a significant increase in drug-induced apoptosis rate in MDR1 gene silenced cells compared to control cells. These findings suggest that silencing the MDR1 gene can effectively alleviate drug resistance in Eca-109/VCR cancer cells.In conclusion, our study provides evidence that MDR1 gene silencing may enhance the sensitivity of cancer cells to chemotherapy. This approach may havepotential clinical application in overcoming drug resistance in cancer patientsIn addition to MDR1 gene silencing, there are other approaches that have been explored to overcome drug resistance in cancer cells. One approach is the use of combination therapy, which involves administering twoor more drugs with different mechanisms of action simultaneously. This can help to circumvent drug resistance by targeting multiple pathways involved in cancer cell survival and proliferation. Combination therapy has been effective in the treatment of a variety of cancers, including breast cancer, lung cancer, and leukemia. However, care must be taken to select the appropriate drugs and doses to minimize side effects and ensure efficacy.Another approach is the use of nanoparticles to enhance drug delivery to cancer cells. Nanoparticles can improve drug bioavailability, increase drug uptake by cancer cells, and reduce drug clearance from the body. This can result in higher drug concentrations at the site of the tumor, which may improve therapeutic outcomes. Several types of nanoparticles, such as liposomes, polymeric nanoparticles, and metal nanoparticles, have been investigated for their potential in cancer therapy. However, the clinical applicability of nanoparticle-based drug delivery systems is still limited by issues such as toxicity, immunogenicity, and off-target effects.Immunotherapy is another promising approach to overcome drug resistance in cancer cells. Immunotherapy harnesses the power of the immune systemto fight cancer by targeting specific molecules or cells involved in cancer progression. Immunotherapy has shown remarkable success in the treatment of melanoma, lung cancer, and bladder cancer. However, not all patients respond to immunotherapy, and some may experience severe adverse effects.Finally, gene editing using CRISPR/Cas9 technology is emerging as a potential strategy to overcome drug resistance in cancer cells. CRISPR/Cas9 can be used to modify specific genes involved in drug resistance, thus restoring sensitivity to chemotherapy. This approach has shown promise in preclinical studies, but further research is needed to evaluate its safety and efficacy in clinical settings.In conclusion, drug resistance remains a major challenge in cancer therapy. However, the development of new approaches such as MDR1 gene silencing, combination therapy, nanoparticle-based drug delivery, immunotherapy, and gene editing offers hope for improving therapeutic outcomes for cancer patients. Further research is needed to optimize thesestrategies and identify more effective approaches to overcome drug resistance in cancer cellsIn addition to the strategies discussed above, there are other promising approaches being developed to overcome drug resistance. One such approach is the use of targeted therapies that specifically target the molecular drivers of cancer. For example, drugs such as imatinib and gefitinib have been developed for the treatment of cancers that express specific molecular targets, such as BCR-ABL and EGFR, respectively. These targeted therapies can be effective in overcoming drug resistance, as they avoid the need for traditional chemotherapy that indiscriminately targets alldividing cells.Another promising approach is the use of epigenetic therapies to reprogram cancer cells to become more sensitive to chemotherapy. Epigenetic modifications can alter the expression of genes that are involved in drug resistance, so targeting these modifications may help to overcome resistance. For example, histone deacetylase (HDAC) inhibitors have been shown to sensitize cancer cells to chemotherapy by increasing the expression of pro-apoptotic genes.Finally, advances in imaging technology such as PET and MRI are enabling researchers to better understand the mechanisms of drug resistance in cancer cells. By visualizing the behavior of cells in real-time,researchers can identify new targets for therapy and evaluate the effectiveness of different approaches.In summary, drug resistance remains a major challenge in cancer therapy, but there are a growing number of strategies being developed to overcome it. These include MDR1 gene silencing, combination therapy, nanoparticle-based drug delivery, immunotherapy, gene editing, targeted therapies, epigenetic therapies, and advances in imaging technology. Continued research in these areas will be critical to improving therapeutic outcomes for cancer patients and ultimately finding a cure for this devastating diseaseIn conclusion, drug resistance is a significant obstacle in the treatment of cancer. However, there are multiple approaches being explored to overcomethis challenge, including gene silencing, combination therapy, drug delivery using nanoparticles, immunotherapy, gene editing, targeted therapy, epigenetic therapy, and advanced imaging technology. Further research in these areas will be crucial to improving cancer treatment outcomes and ultimately finding a cure for this disease。
芬太尼对食管鳞癌细胞株Eca109侵袭和基质金属蛋白酶表达的影响

芬太尼对食管鳞癌细胞株Eca109侵袭和基质金属蛋白酶表达的影响张明鑫;何平;张灵敏;王景杰【摘要】Objective To investigate the effects of fentanyl on the invasion of esophageal squamous cell carcinoma cell line Eca109 and its possible mechanism. Methods Eca109 cells were treated with different concentrations of fentanyl(0. 5, 5, 50, 500 ng/ml), respectively, and the cells cultured with conventional medium were chosen as controls. Transwell assay was applied to test the cell in-vasion. RT-PCR and Western blot were used to detect the expression of matrix metalloproteinase 2 (MMP-2)and matrix metalloprotein-ase 9 (MMP-9) at mRNA and protein levels respectively. Results Transwell assay revealed that the fentanyl inhibited cell invasion at 48 h in a dose dependent manner(P<0. 05). RT-PCR and Western blot results showed that the fentanyl inhibited the mRNA and protein levels of MMP-2 and MMP-9 in a dose department manner(P<0. 05). Conclusion Fentanyl could inhibit the cell invasion of ESCC cell line Eca109 probably through down-regulating the expression of MMP-2 and MMP-9.%目的探讨不同浓度芬太尼对食管鳞癌细胞株Eca109侵袭能力的影响及可能机制. 方法选用不同浓度芬太尼(0. 5,5,50,500 ng/ml)干预食管鳞癌细胞株Eca109,以常规培养的Eca109作为对照,采用Transwell检测细胞侵袭能力,并应用RT-PCR和Western blot探讨芬太尼对 MMP-2 和 MMP-9 的 mRNA和蛋白表达的影响. 结果各浓度组芬太尼孵育Eca109细胞48 h,与对照组相比,均能显著抑制细胞的侵袭(P<0. 05),且抑制率随着浓度升高而升高,呈浓度依赖性. 芬太尼孵育Eca109细胞48 h,与对照组相比,各浓度组均能抑制MMP-2和MMP-9的mRNA 和蛋白的表达,同样呈浓度依赖性( P<0. 05). 结论芬太尼可抑制食管鳞癌细胞株Eca109的侵袭,这种作用可能是基于对MMP-2和MMP-9表达的抑制.【期刊名称】《山西医科大学学报》【年(卷),期】2015(046)010【总页数】4页(P961-964)【关键词】芬太尼;食管鳞癌;细胞侵袭;基质金属蛋白酶【作者】张明鑫;何平;张灵敏;王景杰【作者单位】第四军医大学唐都医院消化内科,西安 710038;西安交通大学第一附属医院麻醉科;西安交通大学第一附属医院麻醉科;第四军医大学唐都医院消化内科,西安 710038【正文语种】中文【中图分类】R735.1麻醉作为肿瘤外科手术必不可少的环节之一,在肿瘤手术治疗中发挥重要的作用,其对肿瘤治疗的影响受到越来越多的关注。
戊地昔布诱导人食管癌Eca109细胞凋亡的机制研究

戊地昔布诱导人食管癌Eca109细胞凋亡的机制研究张玉军;刘淑霞;齐凤英;左连富;郭建文【期刊名称】《中国药理学通报》【年(卷),期】2006(22)5【摘要】目的探讨特异选择性环氧化酶-2(COX-2)抑制剂戊地昔布诱导人食管癌Eca109细胞凋亡及其作用机制.方法流式细胞术检测细胞凋亡和细胞周期分布;电子显微镜进一步检测细胞凋亡;采用乳酸脱氢酶(LDH)试剂盒测定Eca109细胞的LDH含量;流式细胞术检测p-p38MAPK及凋亡基因Fas和FasL蛋白的表达.结果戊地昔布(25~400 μmol·L-1)可诱导人食管癌Eca109细胞发生凋亡,,凋亡率由(2.95±0.83)%增加到(48.46±0.73)%;50~400 μmol·L-1时增殖指数和S期的细胞比例则明显降低,G0/G1期的细胞比例增加;同时,流式细胞术显示,25 μmol·L-1戊地昔布即可上调人食管癌Eca109细胞p-p38MAPK蛋白的表达,并随剂量的增加而增强;50~400 μmol·L-1的戊地昔布可上调Eca109细胞Fas及FasL的表达.结论戊地昔布可诱导人Eca109细胞凋亡,其诱导凋亡的机制可能部分是通过激活p-p38MAPK/Fas、FasL途径实现的.【总页数】5页(P629-633)【作者】张玉军;刘淑霞;齐凤英;左连富;郭建文【作者单位】河北医科大学病理学教研室,河北,石家庄,050017;河北医科大学病理学教研室,河北,石家庄,050017;河北医科大学病理学教研室,河北,石家庄,050017;河北省肿瘤研究所流式细胞室,河北,石家庄,050011;河北省肿瘤研究所流式细胞室,河北,石家庄,050011【正文语种】中文【中图分类】R329.25;R73-351;R735.105.3;R977.3;R979.1【相关文献】1.戊地昔布通过上调ROS诱导人乳腺癌MCF-7细胞凋亡 [J], 张曼丽;王慧慈;柳金金;于丁;王紫微;吴佳昕;李军霞2.戊地昔布对人食管癌细胞凋亡及COX-2表达的影响 [J], 刘淑霞;张玉军;齐凤英;左连富;郭建文3.戊地昔布对人食管癌Eca109细胞系的抑制作用及其调控 [J], 张玉军;齐凤英;刘淑霞;左连富;郭建文;刘江惠4.p38MAPK在戊地昔布诱导Eca109细胞凋亡中的调控作用 [J], 张玉军;郝军;刘淑霞;左连富;刘俊茹;吴海江;郭建文5.p38/Fas/FasL在戊地昔布诱导食管癌裸鼠移植瘤细胞凋亡中的调控作用 [J], 张玉军;刘淑霞;刘青娟;左连富;刘俊茹;郭建文;吴海江;王晓月因版权原因,仅展示原文概要,查看原文内容请购买。
喜泊芬对人食管癌Eca-109细胞的光动力效应

喜泊芬对人食管癌Eca-109细胞的光动力效应黄维甄;谢剑明;陈锦章;李荣;张兰英;李黎波;罗荣城【摘要】目的:探讨不同孵育浓度和不同光照剂量密度喜泊芬介导的光动力治疗(photodynamic therapy, PDT)对人食管癌细胞Eca-109体外效应的影响.方法:以不同浓度喜泊芬孵育食管癌Eca-109细胞,并分别在不同光照剂量密度( 0、12、24、30 J/cm2)下行PDT,24 h后通过四甲基偶氮唑盐(MTT)法检测细胞生存率.结果:不同孵育浓度喜泊芬在4种不同光照剂量密度下食管癌Eca-109细胞生存率间均有显著差异(P<0.01).在同一光照剂量密度下,不同喜泊芬浓度的食管癌Eca-109细胞的生存率有显著差异( P<0.01),而同一喜泊芬孵育浓度下,不同光照剂量密度的食管癌Eca-109细胞的生存率有显著差异( P< 0.01).结论:喜泊芬的不同孵育浓度和不同光照剂量密度对人食管癌Eca-109细胞体外PDT效应有显著影响.【期刊名称】《中国临床医学》【年(卷),期】2010(017)006【总页数】3页(P880-882)【关键词】喜泊芬;孵育浓度;光照剂量密度;细胞生存率;光动力疗法【作者】黄维甄;谢剑明;陈锦章;李荣;张兰英;李黎波;罗荣城【作者单位】南方医科大学南方医院肿瘤中心,广东广州,510515;南方医科大学南方医院肿瘤中心,广东广州,510515;南方医科大学南方医院肿瘤中心,广东广州,510515;南方医科大学南方医院肿瘤中心,广东广州,510515;南方医科大学南方医院肿瘤中心,广东广州,510515;南方医科大学南方医院肿瘤中心,广东广州,510515;南方医科大学南方医院肿瘤中心,广东广州,510515【正文语种】中文【中图分类】R735.1自20世纪70年代光动力疗法进入临床研究以来,它不仅在各种良性疾病的治疗中取得了很好的疗效,并且在恶性肿瘤的治疗中取得了令人瞩目的成就[1]。
丹皮酚体内外抗人食管癌Eca-109细胞增殖及诱导凋亡的作用

丹皮酚体内外抗人食管癌Eca-109细胞增殖及诱导凋亡的作用杨震;孙国平;徐淑萍;宛新安;桂双英【期刊名称】《中国药理学通报》【年(卷),期】2007(23)5【摘要】目的研究丹皮酚(paeonol,Pae)在体内外对人食管癌细胞Eca-109的抑瘤作用及其对细胞凋亡的影响.方法采用噻唑蓝(MTF)体外试验法和灌胃给药体内抗肿瘤试验.光镜及电镜观察各组的肿瘤组织的形态学变化.应用末端脱氧核苷酸转移酶介导的缺口末端标记(TUNEL)法测定细胞凋亡指数.结果丹皮酚在体外对Eca-109细胞有明显的细胞毒作用,半数抑制浓度(IC50)为0.342 mmol·L-1;体内灌胃给予丹皮酚25、50、100和200 mg·kg-1对裸鼠移植人食管癌Eca-109的抑制率分别为10.67%、23.54%、27.91%和34.46%;顺铂5 mg·kg-1组抑瘤率为58.71%;丹皮酚在100 mg·kg-1剂量下与顺铂5 mg·kg-1联合用药抑制率为77.91%.光镜下用药组可见较多凋亡的肿瘤细胞.透射电镜下可见肿瘤细胞核染色质浓缩边聚、胞质浓缩、核碎裂以及凋亡小体形成等典型的凋亡表现.用药组凋亡指数较对照组明显增加.结论丹皮酚在体内外具有抑制人食管癌Eca-109细胞增殖及诱导其凋亡作用.【总页数】5页(P654-658)【作者】杨震;孙国平;徐淑萍;宛新安;桂双英【作者单位】安徽医科大学第一附属医院肿瘤科,安徽,合肥,230022;安徽医科大学第一附属医院肿瘤科,安徽,合肥,230022;安徽医科大学第一附属医院肿瘤科,安徽,合肥,230022;安徽医科大学第一附属医院肿瘤科,安徽,合肥,230022;安徽中医学院药学院药剂学教研室,安徽,合肥,230031【正文语种】中文【中图分类】R282.71;R329.24;R329.25;R735.102.2;R735.105.3【相关文献】1.苦参素诱导人食管癌Eca-109凋亡作用及机制的研究 [J], 朱艳琴2.表没食子儿茶素没食子酸酯与西妥昔单抗联用体内外抗食管癌细胞Eca-109的作用研究 [J], 商悦;刘旭杰;陈淑珍3.丹皮酚诱导人食管癌Eca-109裸鼠移植瘤凋亡的机制探讨 [J], 刘思涵;孙国平;杨震;宛新安;王章桂;吴红阳4.姜黄素抗食管癌Eca-109细胞增殖及诱导凋亡机制的研究 [J], 武欣;李坤;张林西5.熊果酸诱导人食管癌细胞Eca-109凋亡的作用及机制 [J], 陈国庆;沈宜;段红;汤为学;陈玉龙因版权原因,仅展示原文概要,查看原文内容请购买。
COX-2在食管上皮癌变中的作用及戊地昔布抗食管癌的机制研究

COX-2在食管上皮癌变中的作用及戊地昔布抗食管癌的机制研究目的:食管癌是我国最常见的消化道恶性肿瘤之一,其分布具有明显的地域性。
目前认为食管癌的发生是多种因素综合作用的结果,因此,寻找有效的化学预防药物应用于食管癌高发区,对于降低食管癌的发病率,提高生存质量具有十分重要的意义。
大量研究表明,环氧化酶-2(cyclooxygenase-2,COX-2)可在食管癌等多种肿瘤组织中表达,其表达增高可通过抑制细胞的凋亡、促进血管的形成等机制促进肿瘤的发生。
因此,人们针对COX-2这一靶点用选择性COX-2抑制剂来治疗肿瘤,动物实验也已证明选择性COX-2抑制剂可对肿瘤产生显著治疗作用。
长期使用COX-2抑制剂如阿司匹林或其他的非甾体类抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)可明显降低食管癌、胃癌、大肠癌和胰腺癌等消化道肿瘤的发病危险性,具有一定的化学预防作用。
由于传统的NSAIDs对COX-1和COX-2的抑制没有选择性,使用这些药物治疗可引起正常组织的损伤,尤其是对胃肠道的毒性。
因此,人们已关注于选用选择性COX-2抑制剂来治疗和预防肿瘤。
戊地昔布(Valdecoxib)是第二代COX-2选择性抑制剂,临床上多用于抗炎止痛,其胃肠道毒副作用小,但将其用于防治肿瘤及其抗肿瘤作用机制的研究报道甚少。
因此,本实验从食管癌手术切除标本、细胞培养和裸鼠移植瘤三个方面,采用多种实验技术研究COX-2在食管上皮癌变中的作用,观察戊地昔布对人食管癌Eca109细胞生长的抑制作用,通过观察p38MAPK及凋亡基因的表达变化,探讨其可能的抑瘤作用机制,为NSAIDs在食管癌高发区高危人群进行化学预防提供实验依据。
方法:1食管上皮癌变过程中COX-2的表达变化手术切除食管癌新鲜标本32例,术后立即取材,分别于4%多聚甲醛固定,常规脱水、浸蜡、包埋及切片,H.E染色,由两名有经验的病理医。
食管鳞癌ECA109细胞中Survivin通过ERK信号通路调控c-myc基因表达的机制

食管鳞癌ECA109细胞中Survivin通过ERK信号通路调控c-myc基因表达的机制闫冬;吴怡娴;董娟娟;李秀梅;封敏【期刊名称】《癌变·畸变·突变》【年(卷),期】2018(030)005【摘要】目的:探讨在食管鳞癌ECA109细胞中Survivin对c-myc基因的调控作用.方法:将食管鳞癌ECA109细胞分为Survivin shRNA干扰组、阴性质粒对照组(Control shRNA)和空白细胞株(未加任何处理的食管癌ECA109细胞),将2μg Survivin shRNA质粒、2μg Control shRNA质粒分别转染ECA109细胞,48 h后收集各组细胞,采用RT-PCR法检测各组Survivin、c-myc mRNA的表达,Western blot法检测Survivin、c-myc蛋白及p-ERK蛋白的表达;采用ERK、p38、JNK、JAK/STA3、PI3K/Akt信号传导通路的特异性抑制剂分别阻断ECA109细胞中关键激酶的表达,RT-PCR法检测c-myc mRNA的表达.结果:与阴性质粒对照组和空白细胞组比较,Survivin shRNA组Survivin表达下调,c-myc mRNA及蛋白的表达降低,差异均具有统计学意义(P均<0.05);采用ERK、p38、JNK、JAK/STA3、PI3K/Akt信号通路抑制剂分别作用于食管癌ECA109细胞,PD98059(ERK信号通路阻断剂)组c-myc mRNA及蛋白表达降低(P<0.05);Survivin shRNA干扰沉默Survivin基因后ERK磷酸化蛋白表达降低(P<0.05).结论:Survivin对c-myc具有正向调控作用,可能通过ERK信号传导通路调控c-myc的表达.【总页数】5页(P345-348,353)【作者】闫冬;吴怡娴;董娟娟;李秀梅;封敏【作者单位】新疆医科大学药学院,新疆乌鲁木齐830011;新疆医科大学基础医学院,新疆乌鲁木齐830011;新疆医科大学基础医学院,新疆乌鲁木齐830011;新疆医科大学基础医学院,新疆乌鲁木齐830011;新疆医科大学附属肿瘤医院,新疆乌鲁木齐830000【正文语种】中文【中图分类】R73-3【相关文献】1.MAPK-ERK1/2信号通路调控成骨性基因表达和细胞增殖 [J], 丁道芳;李玲慧;宋奕;杜国庆;卫晓恩;曹月龙2.食管鳞癌Eca109细胞中PI3K/AKT/mTOR信号通路对LSD1的调控作用 [J], 凡丞;鲁照明;张幸丽;田菲;白一汝;赵琦;彭柯峥;刘宏民;侯桂琴3.辐射表达载体Egr1-survivin shRNA联合放疗对食管鳞癌ECA109细胞放疗敏感性的影响 [J], 王海峰; 阿曼姑丽·艾合买提; 陆艳荣; 吕茵; 张瑾熔4.肿瘤特异性启动子Survivin调控shRNA腺病毒的构建及对HepG-2细胞中CD133基因表达的抑制 [J], 李芳;邹冬玲;曹姝;李少林5.干扰CLDN6基因表达通过调控MAPK/ERK信号通路对多囊卵巢综合征大鼠卵巢颗粒细胞凋亡的影响 [J], 孙彩萍;张丹;张珂因版权原因,仅展示原文概要,查看原文内容请购买。
戊地昔布抑制Lewis肿瘤生长的作用

戊地昔布抑制Lewis肿瘤生长的作用李军霞;杲海霞;陈雪彦;王永利【期刊名称】《中国药理学通报》【年(卷),期】2006(22)8【摘要】目的检测戊地昔布抑制肿瘤生长的作用并初步探讨其作用机制.方法流式细胞术检测戊地昔布对肿瘤细胞凋亡和细胞周期的影响,Western blot检测戊地昔布对肿瘤组织Bcl-2、Bax、Caspase-3,MMP-2和VEGF表达的影响,用MTT法检测脾淋巴细胞转化率.结果①戊地昔布抑制Lewis肿瘤的生长,提高荷瘤小鼠的存活率.②10~40 mg·kg-1·d-1戊地昔布增加肿瘤细胞的凋亡率,从对照组的19.1%增加到23.1%~29.1%.但对细胞周期分布没有影响.③戊地昔布对Caspase-3,Bax,MMP-2和VEGF的表达没有明显影响,但降低抗凋亡蛋白Bcl-2的表达.④戊地昔布对荷瘤小鼠体重,胸腺指数和脾脏指数,脾脏淋巴细胞增殖没有影响.结论戊地昔布抑制肿瘤细胞生长的作用与其诱导肿瘤细胞凋亡有关.【总页数】4页(P998-1001)【作者】李军霞;杲海霞;陈雪彦;王永利【作者单位】河北医科大学药理学教研室,河北,石家庄,050017;河北医科大学药理学教研室,河北,石家庄,050017;河北医科大学药理学教研室,河北,石家庄,050017;河北医科大学药理学教研室,河北,石家庄,050017【正文语种】中文【中图分类】R-332;R329.24;R329.25;R73-354;R977.3【相关文献】1.COX-2参与戊地昔布抑制Lewis肿瘤的生长 [J], 李军霞;齐亚娟;陈雪彦;王永利2.戊地昔布对人食管癌Eca109细胞系的抑制作用及其调控 [J], 张玉军;齐凤英;刘淑霞;左连富;郭建文;刘江惠3.戊地昔布对人胃癌细胞生长的抑制作用 [J], 李军霞;苏素文;梅和珊;王永利;王川4.理肺消积丸对Lewis肺癌小鼠肿瘤生长的抑制作用 [J], 刘素晓;何慧慧;贾瑞;杜娟;林珊珊;刘卫红;李亚5.尿胰蛋白酶抑制剂Ulinastatin对lewis肺癌小鼠肿瘤生长和转移的抑制作用 [J], 刘红光;李汉贤;康颖;赵晓春;徐刚;王章强因版权原因,仅展示原文概要,查看原文内容请购买。
苦马豆素对人食道癌Eca-109细胞体外生长的抑制试验

苦马豆素对人食道癌Eca-109细胞体外生长的抑制试验陈绍淑;赵宝玉;莫重辉;童德文;王立红;王凯;曹光荣【期刊名称】《动物医学进展》【年(卷),期】2003(024)003【摘要】探讨苦马豆素(SW)对人食道癌Eca-109细胞生长的抑制作用,以揭示SW 治疗食道癌的作用机制.选用不同剂量的SW与食道癌Eca-109细胞共同培养不同时间后,用MTT法观察SW对食道癌Eca-109细胞生长的抑制作用;细胞DNA经特异性荧光染色后,用流式细胞仪分析细胞周期变化.结果:SW对食道癌Eca-109细胞生长的半数抑制浓度IC50<2.5 μg/mL;细胞周期分析,Eca-109细胞G1期细胞增多,S期细胞减少.结果表明:SW可通过抑制人食道癌Eca-109细胞系生长达到抑制肿瘤的目的.【总页数】2页(P91-92)【作者】陈绍淑;赵宝玉;莫重辉;童德文;王立红;王凯;曹光荣【作者单位】西北农林科技大学动物科技学院,陕西,杨陵,712100;西北农林科技大学动物科技学院,陕西,杨陵,712100;青海大学农牧学院,青海,西宁,810003;西北农林科技大学动物科技学院,陕西,杨陵,712100;天津市奶牛发展中心,天津,300221;佛山科技学院动医系,广东,佛山,528231;西北农林科技大学动物科技学院,陕西,杨陵,712100【正文语种】中文【中图分类】Q946.88;R273【相关文献】1.苦马豆素诱导人胃癌细胞SGC-7901凋亡作用机制的实验研究 [J], 孙纪元;朱妙章;王四旺;谢艳华;缪珊;朱肖星;施新猷2.苦马豆素对小鼠肝癌Hepa1-6细胞体外生长的抑制作用 [J], 杨慈清;李小英;刘丽君;刘红梅3.苦马豆素诱导人喉癌Hep-2细胞凋亡研究 [J], 李莎;张思楠;杨军;伍春莲4.苦马豆素对肝癌细胞在体内外生长的抑制作用 [J], 孙纪元;朱妙章;王四旺;谢艳华;王剑波;缪珊5.苦马豆素对小白鼠移植性肿瘤S_(180)、ARS的抑制试验 [J], 杨鸣琦;曹光荣;李绍君;高峰;王安福因版权原因,仅展示原文概要,查看原文内容请购买。
山奈酚诱导人食管鳞癌Eca-109细胞凋亡及其机制

山奈酚诱导人食管鳞癌Eca-109细胞凋亡及其机制李瑞君;梅家转;刘桂举【期刊名称】《南方医科大学学报》【年(卷),期】2011(031)008【摘要】目的研究山奈酚对人食管鳞癌Eca- 109细胞增殖和凋亡的影响,并探讨其机制.方法山奈酚体外作用于Eca-109细胞后,用MTT法检测细胞增殖抑制作用;TUNEL染色测定细胞凋亡率;RT-PCR检测Bax、Bcl-2基因表达变化情况;分光光度法测定Caspase-3和Caspase-9活性.结果山奈酚显著抑制Eca- 109细胞增殖(P<0.01),呈剂量依赖关系.TUNEL染色结果表明山奈酚诱导Eca-109细胞发生凋亡,RT-PCR结果显示山奈酚作用后,肿瘤细胞Bax基因表达上调,Bcl-2基因表达下调,同时,Caspase-3和Caspase-9活性明显升高(P<0.01).结论山奈酚能抑制Eca- 109细胞增殖,诱导细胞凋亡.山奈酚可能通过线粒体途径诱导Eca- 109细胞凋亡.%Objective To evaluate the growth-inhibiting and pro-apoptotic effect of kaempferol in human esophageal squamous carcinoma Eca-109 cells and explore the mechanism. Method The effect of kaempferol on Eca-109 cell proliferation in vitro was measured by MTT assay. TUNEL staining was used to detect the cell apoptosis following kaempferol treatment. The changes in Bax and Bcl-2 mRNA expressions in response to kaempferol treatment were determined by RT-PCR, and the caspase-3 and caspase-9 activities were evaluated using colorimetric assay. Results Kaempferol significantly inhibited Eca-109 cell proliferation (P<0.05) in a concentration-dependent manner and induced obvious cell apoptosis. RT-PCR showed that after kaempferol treatment caused up-regulated Bax and down-regulated Bcl-2 mRNA expression. The colorimetric assay revealed significantly increased caspase-3 and caspase-9 activities in Eca-109 cells following kaempferol treatment (P<0.01). Conclusion Kaempferol can induce apoptosis of Eca-109 cells via a mitochondria-dependent pathway.【总页数】3页(P1440-1442)【作者】李瑞君;梅家转;刘桂举【作者单位】郑州人民医院肿瘤内科,河南郑州450003;郑州人民医院肿瘤内科,河南郑州450003;郑州人民医院肿瘤内科,河南郑州450003【正文语种】中文【中图分类】R735.1【相关文献】1.α-细辛醚诱导人食管癌细胞系 Eca-109细胞凋亡及机制的研究 [J], 周新强;韩倩倩;朱艳琴2.山奈酚致敏TRAIL诱导人卵巢癌细胞凋亡的相关机制及前景 [J], 简文文;鱼庆;王敏;赵柘;赵淑慧;汪宇佳;杨淑莉3.藤梨根诱导人食管癌Eca-109细胞凋亡的调节机制 [J], 国宏莉;李江华;李斌;度长海;张丽4.山奈酚诱导人小细胞肺癌H446细胞凋亡及机制 [J], 仇炜;赵娟;吕雨虹;赵俊霞;王彦玲;雷宇华5.星半通膈散诱导人食管癌Eca-109细胞凋亡及其机制研究 [J], 刘华东;王明艳;张民庆;黄仕文;梁枫因版权原因,仅展示原文概要,查看原文内容请购买。
槲皮素对人食管癌Eca-109细胞的分化诱导作用

槲皮素对人食管癌Eca-109细胞的分化诱导作用李士坤;陈克河;任庆梅【期刊名称】《中国实用医药》【年(卷),期】2007(002)036【摘要】目的探讨槲皮素对人食管癌Eca-109细胞的分化诱导作用.方法将培养的Eca-109细胞分为两组:①加槲皮素组(Q组);②不加药物对照组(C组).同时培养48 h,收集各组细胞制备成细胞硝酸纤维素膜(NCM)标本及提取RNA制备RNA硝酸纤维素膜标本.分别对细胞硝酸纤维素膜(NCM)标本进行PCNA,VEGF的免疫斑点印迹阵列;对RNA硝酸纤维素膜标本EGFR,c-myc及wtp53的RNA斑点印迹阵列.印迹阵列皆用岛津薄层色谱扫描仪(TLC)进行波长523 nm的扫描数值比较.结果①免疫斑点印迹显示:Q组的PCNA-IR,VEGF-IR的TLC扫描数值分别比C组低5.5倍,3.5倍;②RNA斑点印迹阵列显示,与C组相比:Q组的EGFR,c-myc的RNA斑点TLC扫描数值分别下调了7倍,2.2倍.而wtp53的RNA斑点TLC扫描数值则上调了2.2倍.结论槲皮素可下调作为肿瘤细胞恶性程度生物学指标的PCNA,EGFR,VEGF,c-myc等的表达,上调抑癌基因wtp53的表达,表明对人食管癌Eca-109细胞具有一定的诱导分化效应.【总页数】2页(P14-15)【作者】李士坤;陈克河;任庆梅【作者单位】464000,河南省信阳市中心医院消化内科;464000,河南省信阳市中心医院消化内科;464000,河南省信阳市中心医院消化内科【正文语种】中文【中图分类】R2【相关文献】1.人食管癌间充质干细胞对食管癌细胞株Eca-109侵袭性的影响 [J], 朱孝中;刘德森;俞力超;胡嘉波;王晓慧2.8-Br-cAMP对人食管癌Eca-109细胞增殖与分化的效应 [J], 陈奎生3.8-Br-cAMP联合槲皮素对人食管癌Eca-109细胞的逆转化作用 [J], 孟明利;宫璀璀;王文丽;吴景兰;刘影4.钼对人食管癌细胞ECA-109的化疗增敏作用及对食管癌干细胞p75^(NTR)的影响 [J], 李珂;龙辉;王洁莲;吴清明;吴银霞;程静5.槲皮素诱导人食管癌Eca-109细胞发生自噬及其作用的研究 [J], 方坤;刘金成;呼晓;范玉华;齐玉山因版权原因,仅展示原文概要,查看原文内容请购买。
miR-25对食管癌EC109细胞侵袭和迁移能力的影响及临床意义

细胞与分子生物学miR-25对食管癌EC109细胞侵袭和迁移能力的影响及临床意义李卿,李轶君,张国锐摘要:目的探索miR-25对食管癌侵袭和迁移能力的影响以及作为食管癌诊断生物标志物的潜力。
方法(1)荧光定量PCR(qPCR)检测54例早期食管癌患者癌组织和癌旁组织中miR-25表达水平。
(2)人食管癌细胞EC109分为miR-25mimic组、NC mimic组、miR-25inhibitor组和NC inhibitor组。
转染相应序列后,qPCR检测miR-25转染效率。
Transwell实验检测过表达或敲低miR-25对EC109细胞侵袭和迁移的影响。
Targetscan数据库预测miR-25的靶基因,选定靶基因盐诱导激酶1(SIK1)基因。
Western blot和双荧光素酶报告实验鉴定miR-25与SIK1的靶向关系。
(3)EC109细胞分为pcDNA3.1组、SIK1过表达组和miR-25+SIK1过表达组。
Transwell实验检测miR-25靶向SIK1对EC109细胞侵袭和迁移能力的影响。
(4)提取食管癌患者(54例)和健康对照者(54例)的血浆外泌体,比较2组血浆外泌体中miR-25的相对表达量,分析食管癌患者癌组织和血浆外泌体中miR-25的相关性。
结果(1)食管癌组织中miR-25相对表达水平高于癌旁组织。
(2)过表达miR-25后,EC109细胞侵袭和迁移能力增强,而敲低miR-25表达后,细胞侵袭和迁移能力下降。
Western blot结果显示,过表达miR-25后,SIK1蛋白表达下降;反之,敲低miR-25后SIK1蛋白表达升高。
(3)Transwell实验显示,与pcDNA3.1组相比,SIK1过表达组EC109细胞侵袭和迁移的细胞数量减少,而miR-25和SIK1联合作用后,EC109侵袭和迁移的细胞数量较SIK1过表达组增多。
(4)食管癌血浆外泌体样本中miR-25的表达量高于健康对照,且miR-25在食管癌组织中的表达与血浆外泌体中的相对表达量呈正相关。
香加皮宝霍甙-I诱导人食管癌细胞Eca-109凋亡的实验研究

香加皮宝霍甙-I诱导人食管癌细胞Eca-109凋亡的实验研究刘晓霞;单保恩;陈育民;任风芝;商晓辉【期刊名称】《癌变·畸变·突变》【年(卷),期】2008(020)006【摘要】背景与目的:研究香加皮宝霍甙-I诱导人食管癌细胞Eca-109的凋亡作用及其作用机制.材料与方法:采用MTY法分析不同浓度(12.5、25、50 μg/ml)宝霍甙-I分别作用Eca-109细胞24 h、48 h、72 h后,对细胞增殖的抑制作用;经不同浓度(12.5、25、50 μg/ml)宝霍甙-I作用Eea-109细胞48 h后,用流式细胞术分析细胞凋亡率及凋亡相关蛋白Survivin的表达;用透射电镜观察凋亡细胞的超微结构变化;用RT-PCR技术检测Survivin mRNA的表达.结果:不同浓度宝霍甙-I均可明显抑制Eca-109细胞的增殖(P均<O.05)且随浓度的增加和作用时间的延长抑制作用增强,作用48 h后的半数抑制浓度IC50为24.8 μg/ml.不同浓度宝霍甙-I作用48 h后,均可诱导Ecs109细胞凋亡,50 μg/ml时细胞凋亡率达55.26%,且导致Eca109细胞发生凋亡特征性超微结构改变,并使Eca109细胞Survivin mRNA和蛋白表达水平均明显降低(P<0.01).结论:香加皮宝霍甙-I可抑制Eca-109细胞增殖,诱导细胞凋亡,该作用可能与下调细胞Sundvin表达有关.【总页数】4页(P445-448)【作者】刘晓霞;单保恩;陈育民;任风芝;商晓辉【作者单位】河北工程大学医学院,河北,邯郸,056029;河北医科大学第四医院科研中心,河北,石家庄,050011;河北工程大学医学院,河北,邯郸,056029;华北制药集团新药研究开发有限责任公司,河北,石家庄,050015;河北工程大学医学院,河北,邯郸,056029【正文语种】中文【中图分类】R730.52;R735.1【相关文献】1.香加皮宝藿苷-I对人食管癌细胞Eca-109侵袭力的影响 [J], 刘晓霞;李菊梅;陈剑华;姚艳冰;王晓华;陈育民2.重组人血管内皮抑素与紫杉醇联合诱导人食管癌细胞Eca-109凋亡的实验研究[J], 孔霞;王秀美;隋爱华;刘圆圆3.香加皮水提取物诱导人食管癌细胞TE-13凋亡的实验研究 [J], 门金娥;张向阳;悦随士;郑海萍4.α-细辛醚诱导人食管癌细胞系Eca-109凋亡的实验研究 [J], 王甜甜;吴芳;朱艳琴;付强;高爱社5.香加皮宝霍甙-Ⅰ抑制人食管癌细胞增殖的机制 [J], 赵连梅;王晓华;颜晰;耿艺曼;王玲;刘丽华;单保恩因版权原因,仅展示原文概要,查看原文内容请购买。
2M3P灵菌红素粗提物对人食管癌Eca-109细胞抑制作用

2M3P灵菌红素粗提物对人食管癌Eca-109细胞抑制作用阿曼古力·海瓦尔;维尼拉·吾甫尔;帕孜来提·拜合提;布热比艳木·吾布力卡斯木;穆海热姆·艾则孜;吾甫尔·米吉提【期刊名称】《天然产物研究与开发》【年(卷),期】2016(028)005【摘要】采用MTT法考察了2M3P(2-甲基-3-戊基)灵菌红素粗提物对食管癌Eca-109细胞的增殖抑制作用,并通过Annexin V-FTTC/PI双染色、流式细胞仪检测细胞凋亡率.结果表明,2M3P灵菌红索粗提物对食管癌Eca-109细胞的增殖具有明显的抑制作用(P<0.05),并表现为浓度和时间依赖性;2M3P灵菌红素粗提物作用食管癌Eca-109细胞24、48、72和96 h后的IC50分别为1026.3180、435.2020、267.7096 μg/mL和64.0734 g/mL;粗提物对食管癌Eca-109细胞的诱导凋亡同样呈剂量依赖性,与顺铂(DDP)干预组相比其具有更显著的诱导凋亡作用.2M3P灵菌红素含量≥30%的粗提物对人食管癌Eca-109细胞具有较强的增殖抑制和诱导凋亡作用.【总页数】6页(P766-770,780)【作者】阿曼古力·海瓦尔;维尼拉·吾甫尔;帕孜来提·拜合提;布热比艳木·吾布力卡斯木;穆海热姆·艾则孜;吾甫尔·米吉提【作者单位】新疆大学生命科学与技术学院,乌鲁木齐 830046;新疆大学生命科学与技术学院,乌鲁木齐 830046;新疆大学生命科学与技术学院,乌鲁木齐 830046;新疆大学生命科学与技术学院,乌鲁木齐 830046;新疆大学生命科学与技术学院,乌鲁木齐 830046;新疆大学生命科学与技术学院,乌鲁木齐 830046【正文语种】中文【中图分类】R285.5【相关文献】1.柴胡对人食管癌细胞株Eca-109的抑制作用 [J], 黄种新;杜好信;姚成才2.裙带菜多糖对人食管癌Eca-109细胞抑制作用的实验研究 [J], 商晓丽;商晓辉3.内折香茶菜叶挥发油对人食管癌ECA-109细胞增殖抑制作用的初步研究 [J], 杨东娟;余柳琴;蔡梓华;邢智浩;陈映淑;林白鸿4.拉帕替尼联合顺铂对人食管癌细胞株Eca-109增殖的抑制作用 [J], 陈逢生;陈晓华;曹小龙;邬要芬;张晓娜;李黎波;罗荣城5.奈达铂联合顺铂对人食管癌细胞株(Eca-109)抑制作用机制的研究 [J], 苏翔宇;李苏宜;刘琳因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
周期分析的影响 峰位判定为凋亡细胞峰 + 对亚二倍体峰进行定量分 析 "可计算出细胞凋亡率 + 戊地昔布在给药 M! 小时 后 "可明显提高 ;$,2"< 细胞的凋亡率 + !8!C’&$D 戊 地昔布对增殖指数和细胞周期分布没有明显地影 响 "而当浓度增至 8"[:""!C’&$D 时增殖指数和 4 期 的 细 胞 比 例 则 明 显 降 低 "G" S G2 期 的 细 胞 比 例 增 加 !$2"B"8 或 "B"2*" 但对 G! S K 期细胞比例没有明显 影响 !图 2" 表 !*+
&:"8’
2O2"L 个 S C& " 加 入 鼠 抗 人 =1=#> 单 克 隆 或 兔 抗 人 $1?@+,$1A’- 多 克 隆 抗 体 "B2C& ! 浓 度 2 - !8*" 室 温 孵
育 #"CU+$ 加入2 - 8" 羊抗鼠或兔 E6F.16)G 避光室温 孵育 #"CU+"IQ4 洗涤后进行检测 + 同时设计阴性对 照和阳性对照 + 按照 K’TYZ* &L’的方法 " 以荧光指数 !E6 *表示 =1=#> ,$1?@+,$1A’- 的相对含量 "公式 -
$1?@+ ,$1A’- 的表达变化探讨其可能的作用机制 + ! 材料与方法 2B2 主要试剂
戊地昔布由河北医科大学药学院合成" 纯度
2BM 免 疫 细 胞 化 学 检 测 人 食 管 癌 ;$,2"< 细 胞 中 =1=#>K5IX,$1?@+ ,$1A’- 蛋白的表达 采用常规 4I 法 " 将 L 孔板培养 M!P 的细胞用 IQ4 洗 涤 后 ":9 多 聚 甲 醛 固 定 ""B29FTU+H’+ 012""
!8!C’&$D 的戊地昔布 + 同时设不含药物的阴性对照 和等体积 7K4/ 的溶剂对照组 "7K4/ 体积分数为 "B2L9 + 每浓度每时间点设 L 组 " 继续培养 + 2B: 戊地昔布对人食管癌 ;$,2"< 生长的影响 <L 孔 板 细 胞 于 培 养 !: ,:>,M!P 分 别 加 入 KFF
采用间接免疫荧光标记方法" 取单细胞悬液
林 等 非 甾 体 类 抗 炎 药 (34567- # 的 人 群 患 结 肠 癌 的 几 率 明 显 降 低 )8"9 以 上 * &!"#’" 这 提 示 ./01! 基 因 表达在肿瘤的发生中具有重要作用 + 因此 "人们用选 择性 ./01! 抑制剂来治疗肿瘤 "动物实验也已证明 选 择 性 ./01! 抑 制 剂 可 对 肿 瘤 产 生 显 著 治 疗 作 用
% 戊地昔布是第三代特异性 ./01! 抑制剂 " 其
对 ./01! 有很强的选择抑制性 "但对其抗肿瘤作用 及其机制的研究尚未见报道 % 本文研究了戊地昔布 对人食管癌 ;$,2"< 的作用 " 并通过观察 =1=#> 和
E6R! 样品蛋白表达的平均荧光强度 1 对照样品
平均荧光强度 * S 正常对照样品平均荧光强度 +
!8)$D " 用 "B"2C’&$D IQ4 配 制 *" 继 续 培 养 :P 后 " 弃 去 上 清 加 入 浓 度 为 2"")$D 474 2""!&"#MN 孵 育
!B!
戊地昔布对人食管癌 ;$,2"< 细胞凋亡和细胞 在二倍体细胞 !G" S G2* 峰 前 出 现 一 个 亚 二 倍 体
将人食管癌 ;$,2"< 细胞 ! 第四军医大学提供 * 分别加入含 2"9 胎牛血清的 JIK62L:" 培养液中 " 于 #MN"89./! 的培养箱中常规培养 +
$1?@+,$1A’- 抗体 !浓度为2 - 8"*":N过夜 "75Q 显色 + 2B> 统计学处理 采用 4I44 2!B" 统计软件进行方差分析 " 数据 均用 !!" 表示 + " 结果 !B2 戊地昔布对人食管癌 ;$,2"< 细胞增殖的影响 !8!C’&$D 戊 地 昔 布 即 可 明 显 抑 制 细 胞 生 长 " M!P 后抑制率可达 >8B<89 " 随着浓度的增加和作用 时 间 的 延 长 " 对 ;$,2"< 细 胞 的 抑 制 率 增 加 " :""!C’&$D 戊地昔布 M!P 的抑制率可达 >8B<89 " 大
打 孔 过 夜 " 羊 血 清 封 闭 后 滴 加 鼠 抗 =1=#> 或 兔 抗
<<9 " 浓 度 梯 度 为 :"" ,!"",2"" ,8",!8!C’&$D$ 鼠 抗 人 =1=#> 单克隆抗体 , 兔抗人 $1?@+,$1A’- 多克隆抗 体 , 羊抗兔或鼠 E6F.16)G 抗体均购自 4,+H, 公司 " 4I 试剂盒购自中山生物工程公司 + 2B! 细胞培养
加入碘化丙啶 !IT’=UVU@C 6’VUV* "I6 -8"C) S D"&’()*+)
,-.// .0/1 *":N避光染色 #"CU+" 用 ;=U$-10D" 型
流式细胞仪检测细胞凋亡率和细胞周期分布 + 以增 殖 指 数 !I6 * 表 示 细 胞 的 增 殖 活 性 " 公 式 -I6R!4 期 W
部分抑制细胞的生长 " 见表 2" 相关分析表明戊地昔 布对 ;$,2"< 细胞生长的抑制作用呈时间和浓度依 赖性 !#R"B<2["B<8"$2"B"8 或 $2"B"2 *+
2B#
戊地昔布对人食管癌 ;$,2"< 细胞的干预方案 取对数生长期的细胞 " 按 2O2": 个$ 孔接种于 <L
孔板 ,L 孔板和 2""C% 的培养瓶中 " 待细胞贴壁 LP 后 " 轻轻吸去上清 " 加入浓度为 :"" ,!"",2"",8",
! "
本文课题受河北省自然科学基金资助 ! 编号 #N’&N!Q " 河北省肿瘤研究所流式细胞室
!""! 年第 #" 卷第 # 期
戊地昔布对人食管癌 ;$,2"< 细胞系的抑制作用及其调控
. !/# .
环 氧 化 酶 !$%$&’’(%)*+,-*"./0# 是 花 生 四 烯 酸 转 化 为 前 列 腺 素 的 关 键 酶 "./0 有 两 种 同 工 酶 即
控机制 # 方法 ! 采用 /00 法检测戊地昔布对人食管癌 +,-%". 细胞生长的作用 $ 流式细胞术检测细胞凋亡和细胞周期 分布 $ 采用流式细胞术和免疫组织化学检测人食管癌 +,-%". 细胞中 1’1#2/345 %,’678 和 ,’9:; 的表达 # 结果 ! 戊地 昔布 !!$<=""!>:?$@ " 可按时间和浓度依赖性抑制人食管癌 +,-%". 细胞的生长 & 作用 &! 小时后 & 对细胞生长的抑制 率可达 2$A.$B & 凋亡率由 !!A#2C"A=! "D 增加 到 !=2A=EC"A&# "D $$"<=""!>:?$@ 时 增 殖 指 数 和 F 期 的 细 胞 比 例 则 明 显 降低 &G" H G% 期的细胞比例增加 # 戊地昔布在给药 &! 小时后 & 食管癌 +,-%". 细胞中 1’1#2/345 %,’9:; %,’678 蛋白表 达均增强 & 并且随浓度的增加而增强 # 结论 ! 戊地昔布可通过诱导细胞凋亡和细胞周期停滞而抑制人 +,-%". 细胞生 长 & 其诱导凋亡的机制可能部分是通过激活 1’1#2/345 %,’678 %,’9:; 途径实现的 # 关键词 戊地昔布 环氧化酶 ’! 人食管癌 +,-%". 细胞 凋亡
$ !’) $
中国肿瘤临床
!""! 年第 #" 卷第 # 期
戊地昔布对人食管癌 !"#$%& 细胞系的抑制作用及其调控 !
张玉军 齐凤英 刘淑霞 左连富! 郭建文! ! 石家庄市 刘江惠 !
河北医科大学病理教研室
"$""%&"
摘要
目的 !探讨特异选择性环氧化酶 ’! !()*’! " 抑制剂戊地昔布对人食管癌 +,-%". 细胞的抑制作用及其调
1’1#2/345
