高三一轮复习 物质的分类胶体电解质等
专题1:物质的简单分类【备考2020】高考一轮复习(解析版)

专题1:物质的简单分类一、单选题1.《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,每百引入粉面二三斤,久则凝淀如石,浣衣发面,甚获利也”。
这里的“石碱”是指()A.KOHB.KAl(SO4)2C.KHCO3D.K2CO32.胶体是日常生活中常见的分散系。
下列分散系属于胶体的是()A.矿泉水B.稀鸡蛋清水溶液C.生理盐水D.葡萄糖溶液3.下列说法正确的是()A.金属氧化物都是碱性氧化物B.盐中不一定有金属元素C.由同种元素组成的物质一定是单质D.非金属氧化物都是酸性氧化物4.下列属于电解质的是()A.氯化钠B.蔗糖C.氯气D.铁5.下列有关混合物、纯净物、电解质、非电解质的正确组合为()纯净物混合物电解质非电解质A.纯盐酸水煤气硫酸干冰B.蒸馏水蔗糖溶液氧化铝二氧化硫C.胆矾氢氧化铁胶体铁碳酸钙D.水银澄清石灰水氯化铜碳酸钠A.AB.BC.CD.D6.下列判断全部正确的一组是:()A B C D强电解质NaCl H2SO4CaF2石墨弱电解质HF BaSO4HClO NH-H2O非电解质Cl2CS2CCl4蔗糖A.AB.BC.CD.D7.秋冬季节往往会出现大雾天气。
雾属于下列分散系中的()A.溶液B.悬浊液C.乳浊液D.胶体8.下列关于分散系的叙述不正确的是()A.分散系的分类:B.用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分C.把FeCl3饱和溶液滴入到氢氧化钠溶液中,以制取Fe(OH)3胶体D.如图显示的是树林的晨曦,该现象与丁达尔效应有关9.下列说法正确的是()A.液态HCl、固体NaCl均不导电,所以HCl、NaCl均不是电解质B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质C.一束光线分别通过溶液和胶体时,前者会出现光亮的通路,后者则没有D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液10.下列有关物质分类的说法正确的是()A.二氧化碳、二氧化硅、一氧化碳均为酸性氧化物B.雾、稀豆浆、氯化铁溶液均为胶体C.烧碱、冰醋酸、稀硫酸均属于电解质D.分子中含有两个氢原子的酸不一定是二元酸11.化学与生活生产息息相关,下列说法错误的是()A.用可见光束照射能区别溶液和胶体B.小苏打可用作焙制糕点的发酵粉C.盐碱地(含较多Na2CO3,)不利于作物生长,可施加熟石灰进行改良D.将废铁屑加入FeCI,溶液中可用于除去工业废气中的Cl212.下列关于氧化物的叙述正确的是()A.金属氧化物一定是碱性氧化物B.CO2是碱性氧化物C.碱性氧化物都能与碱反应D.氧化铜是碱性氧化物,但不与水反应二、填空题13.下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上。
2021届高三化学大一轮知识对点练——物质的分类

2021届高三化学大一轮知识对点练——物质的分类一、单选题(本大题共19小题,共38分)1.我国晋代抱朴子中描述了“丹砂烧之成水银,积变又还成丹砂”。
下列有关叙述正确的是A. “丹砂”和“水银”都是化合物B. 该描述中的反应是可逆反应C. 水银有恒定的体积膨胀系数,被用于制作温度计D. “积变又还成丹砂”中的“还”可理解为“被还原”【答案】C【解析】解:水银是汞是单质,故A错误;B.可逆反应是在同一条件下,既能向正反应方向进行,同时又能向逆反应的方向进行的反应,丹砂烧之成水银,积变又还成丹砂,前者需要加热,后者常温下反应,不是同一条件,故不是可逆反应,故B错误;C.膨胀系数是表征物体热膨胀性质的物理量,水银有恒定的体积膨胀系数,受热时体积变化均匀,可用于制作温度计,故C正确;D.“积变又还成丹砂”,发生的反应是,Hg发生了氧化反应,“还”是指恢复原来的状态,故D错误;故选:C。
A.水银是汞是金属单质;B.可逆反应是在同一条件下,既能向正反应方向进行,同时又能向逆反应的方向进行的反应;C.膨胀系数是表征物体热膨胀性质的物理量,水银有恒定的体积膨胀系数;D.“积变又还成丹砂”,发生的反应是,Hg发生了氧化反应;本题考查了物质性质、物质组成和性质应用等知识点,掌握基础是解题关键,题目难度不大。
2.下列各项中所列物质与所属类别对应正确的是A. 电解质:氧化钠、石墨、硫酸B. 混合物:盐酸、冰水混合物、氢氧化铁胶体C. 共价晶体:金刚石、Na、D. 一元酸:醋酸、苯甲酸、高锰酸【答案】D【解析】解:石墨为单质,不是电解质,故A错误;B.冰水混合物,只含有水一种物质,属于纯净物,故B错误;C.钠为金属晶体,氧化铝为离子晶体,故C错误;D.醋酸、苯甲酸、高锰酸,1个酸分子都只能电离产生1个氢离子,属于一元酸,故D正确;故选:D。
A.电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等,电解质必须是化合物;B.有两种或者两种以上物质组成的为混合物;C.原子通过共价键结合而成的晶体为共价晶体;D.一根酸分子只能电离出1个氢离子的酸为一元酸;本题考查了物质的分类,熟悉电解质、混合物、共价晶体、一元酸概念是解题关键,题目难度不大。
2022届高考化学大一轮复习讲义:第2章 第1节 物质的组成、分类和性质 Word版含解析

其次章 化学物质及其变化 第一节 物质的组成、分类和性质考纲定位考情播报1.了解分子、原子、离子和原子团等概念的含义。
2.理解物理变化与化学变化的区分与联系。
3.理解混合物和纯洁物、单质和化合物、金属和非金属的概念。
4.理解酸、碱、盐、氧化物的概念及其相互联系。
5.了解胶体是一种常见的分散系。
了解溶液和胶体的区分。
2021·全国卷ⅠT 7/全国卷ⅡT 72022·全国卷ⅠT 8/全国卷ⅡT 72021·全国卷ⅠT 7/全国卷ⅡT 72012·全国卷T 8(C 、D)考点1| 物质的组成和分类 [基础学问自查] 1.物质的组成 (1)构成粒子(2)元素与物质的关系元素⎩⎨⎧单质:只有一种元素组成的纯洁物。
化合物:由多种元素组成的纯洁物。
(3)元素在物质中的存在形态①游离态:元素以单质形式存在的状态。
②化合态:元素以化合物形式存在的状态。
2.同素异形体(1)由同种元素形成的不同单质叫同素异形体。
同素异形体的形成有两种方式:①原子个数不同,如O 2和O 3;②原子排列方式不同,如金刚石和石墨。
(2)同素异形体之间的性质差异主要体现在物理性质上,同素异形体之间的转化属于化学变化。
3.物质的分类 (1)分类方法①交叉分类法——从不同角度对物质进行分类②树状分类法——按不同层次对物质进行逐级分类,各层之间属于包含关系。
(2)几类物质的概念①纯洁物:由同种单质或化合物组成的物质。
②混合物:由几种不同单质或化合物组成的物质。
③氧化物:由两种元素组成其中一种为氧元素的化合物。
④酸:电离出的阳离子全部是H +的化合物。
⑤碱:电离出的阴离子全部是OH -的化合物。
⑥盐:金属阳离子或铵根离子与酸根阴离子构成的化合物。
[应用体验]1.请依据交叉分类法说明NaHCO 3是哪类物质? [提示] 盐、酸式盐、钠盐、碳酸盐。
2.请把下列物质的序号填写到如图的括号中:①氯气 ②HClO ③苛性钠 ④铁 ⑤小苏打 ⑥过氧化钠 ⑦二氧化碳 ⑧氧化铝⑨氧化铜[提示](按从上到下,从左到右的挨次)②③⑤⑥⑧⑨⑦④①②③⑤⑦⑨⑧[考点多维探究]角度1物质的组成和构成粒子1.下列说法正确的是________(填序号)。
高三化学第一轮复习物质的分类

①焰色反响 ②发光发热 ③燃烧 ④爆炸
⑤盐析 ⑥O3变成O2
A.①②③
B.①④⑤
C.③⑥
D.①②③④⑤
2、用化学方法不能实现的是〔 C 〕
A、生成一种新分子 B、生成一种新离子
C、生成一种新原子 D、生成一种新单质
三、物质的简单分类及其应用
1、常用的分类方法: 〔1〕穿插分类法
是分别按照多种标准对某一事物进展分类的方法
学 按是否有电子转移 反 响 按是否有离子参加
复分解反响 氧化复原反响 非氧化复原反响 离子反响 非离子反响
按反响进展的程度 可逆反响
不可逆反响
按反响的热效应
放热反响 吸热反响
四种根本反响类型与氧化复原反响之间的关系
化合反响不一定是氧化复原反响,有单质参加的 化合反响一定是氧化复原反响。
分解反响不一定是氧化复原反响,有单质生成 的分解反响一定是氧化复原反响。
±ne±ne-
离子
由不同微粒构成的物质:
晶体类型 微粒 结合力 熔沸点 典型实例
离子晶体 离子 离子键 较高 NaCl、CsCl
分子晶体 分子 范德华力 较低 干冰
原子晶体 原子 共价键
金属晶体 阳离子
和电子
金属键
很高 金刚石
复杂
金属单质、 合金
注意离子晶体、原子晶体的化学式仅表示微粒个数的 最简比,并不能表示其真实组成。而分子晶体的化学 式就是其分子式,表示其真实的组成。
物
质
分子
微观角度 由微粒 原子 构成
离子
1、元素
(1)定义: 具有一样核电荷数(质子数)的同一类原子的 总称
(2)元素存在的状态:
①游离态:只存在单质中, 由同种元素组成的纯洁物 称为单质。
最新高考一轮总复习化学人教版《第1节 物质的分类及转化》

备考指导
高考中本节的考点主要有两个:一是以生产、生活、社会、科技中的物质 为载体或以传统文化、古籍中的描述等为素材,考查物质的组成、分类、 性质、用途及变化;二是以重要的新闻背景、新科技产品为题材考查胶体 的性质、制备及应用。
01 第一环节 必备知识落实
内
容
索
02 第二环节 关键能力形成
引
03 第三环节 核心素养提升
解析:NO不是酸性氧化物,A项错误。硝酸铵是易溶于水的盐,属于强电 解质,C项错误。磁性氧化铁是四氧化三铁的俗称,液氨是氨的液态存在形 式,均属于纯净物,D项错误。
知识点2 物质的性质与变化 知识筛查 1.物理变化与化学变化 (1)宏观角度。 物理变化没有新物质生成,化学变化有新物质生成。 (2)微观角度。 化学变化过程中同时伴随着旧化学键的断裂和新化学键的形成。只有
保持原有物质各自的性质
常见混合物:①分散系(如溶液、胶体、浊液等);②高分子(如蛋白质、纤 维素、聚合物、淀粉等);③常见特殊名称的混合物,如石油、石油的各种 馏分、煤、漂白粉、碱石灰、福尔马林、油脂、天然气、水煤气、铝热 剂、氨水、氯水、王水等。
(2)酸性氧化物和碱性氧化物。
①酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸或碱,如
SiO2、Fe2O3。②能与酸反应生成盐和水的氧化物不一定是碱性氧化物,如 Al2O3。③能与碱反应生成盐和水的氧化物不一定是酸性氧化物,如Al2O3。 ④碱性氧化物都是金属氧化物,但金属氧化物不一定都是碱性氧化物,如
Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物。⑤酸性氧化 物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物, 如CO、NO。
2024 高 中 总 复 习 优 化 设 计 GAO ZHONG ZONG FU XI YOU HUA SHE JI 第3章 第1节 物质的分类及转化
知识清单01 物质的分类及转化(学生版) 2025年高考化学一轮复习知识清单
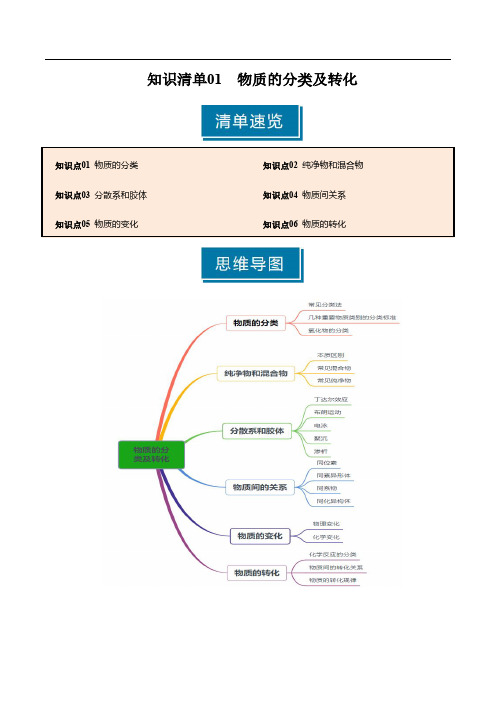
知识清单01物质的分类及转化知识点01物质的分类1.元素、物质及微粒(1)元素的存在形态:①游离态:元素以形式存在的状态。
②化合态:元素以形式存在的状态。
(2)元素、微粒及物质间的关系图①宏观上,物质由组成。
②微观上,物质由、或构成。
(3)同素异形体2.物质的分类(1)分类的定义:把事物按照进行归类分组的一种方法。
(2)物质的分类方法①交叉分类法。
根据不同的分类标准对同一事物进行分类的一种分类方法。
如:②树状分类法简单地说,是将被分类对象按照从属关系逐级进行(不同层次)分类的一种分类方法,其陈列式的形状像树。
A.明确分类标准是对物质正确树状分类的关键B .树状分类法在无机化合物分类中的应用氢化物:HCl 、H 2S 、H 2O 、NH 3等CO 、NO 等Na 2O 、CaO 等CO 2、P 2O 5等Al 2O 3等Na 2O 2、H2O 2等H +HCl 、HNO 3等H 2SO 4、H 2S 等H3PO 4等HCl 、H 2S 等HClO 4、H2SO 4等HCl 、H 2SO 4、HNO 3等CH 3COOH 、HF 、H 2SO 3等HNO 3、HCl 等H 2SO 4、H 3PO 4等NaOH 、KOH 、Ba (OH )2等Mg (OH )2、Cu (OH )2等NaOH 、Ba (OH )2、KOH 等NH 3·H 2O 、Fe (OH )3等BaSO 4KNO 3、NaCl 等NaHCO 3、KHSO 4等Cu 2(OH )2CO 3等KAl (SO 4)2·12H 2O 等3.几组重要物质类别的分类标准(1)三种分散系:(2)电解质和非电解质:(3)强电解质和弱电解质:(4)离子化合物和共价化合物①化学键标准:②实验标准:(5)氧化性酸和非氧化性酸:(6)酸(碱)的元数:4.氧化物的分类(1)非金属氧化物和氧化物性质的关系①大多数非金属氧化物是酸性氧化物,除外②非金属氧化物一定碱性氧化物(2)金属氧化物和氧化物性质的关系①大多数金属氧化物是碱性氧化物,除外②少数金属氧化物是酸性氧化物:如(HMnO4的酸酐)③少数金属氧化物是两性氧化物,如④碱性氧化物是金属氧化物5.含氧酸和含氧酸盐(1)含氧酸的结构含氧酸H2SO4H3PO4H2CO3HNO3结构简式酸的元数(2)含氧酸和其相应含氧酸盐种类的关系n元酸种正盐,种酸式盐1.把握物质分类的2个“误区”①误认为溶液呈酸性的物质一定是,溶液呈碱性的物质一定是。
高三化学一轮复习知识点第5讲物质的组成、性质和分类

精品基础教育教学资料,仅供参考,需要可下载使用!高三化学一轮复习知识点第5讲物质的组成、性质和分类【核心素养分析】宏观辨识与微观探析:能从不同层次、不同角度认识物质的多样性,能输对物质进行分类;能够运用物质分类的方法理解物质的性质。
变化观念与平衡思想:理解物理变化和化学变化的区别,明确化学变化的研究范围和遵循的规律。
科学态度与社会责任:要注意胶体的有关知识与实际生产,生活相联系,赞赏化学对社会发展的重大贡献,能对与化学有关的社会热点问题做出正确的价值判断。
【重点知识梳理】知识点一物质的组成1、元素、物质及微粒间的关系(1)宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
①分子:保持物质化学性质的最小微粒。
①原子:化学变化中的最小微粒。
①离子:带电荷的原子或原子团。
①原子团:在许多化学反应里,作为一个整体参加反应,如同一个原子一样的原子集团。
【特别提醒】“基”与“官能团”“原子团”的区别①基是指带有单电子的原子团。
如—CH3、—CH2—(亚甲基)、—CH2CH3。
①官能团是指决定有机物化学性质的原子或原子团。
如—OH、—CHO、—COOH、—X(卤素原子)等。
①“基”和“官能团”呈电中性,而CO2-3、NO-3、SO2-4、NH+4等原子团可带负电荷或正电荷。
(2)元素:具有相同核电荷数的一类原子的总称。
元素在自然界的存在形式有游离态和化合态。
①游离态:元素以单质形式存在的状态。
①化合态:元素以化合物形式存在的状态。
(3)元素与物质的关系元素――→组成⎩⎪⎨⎪⎧单质:只由一种元素组成的纯净物。
化合物:由多种元素组成的纯净物。
2、同素异形体3、混合物和纯净物(1)纯净物:由同种单质或化合物组成的物质。
(2)混合物:由几种不同的单质或化合物组成的物质。
纯净物和混合物的区别常见混合物:①分散系(如溶液、胶体、浊液等);①高分子(如蛋白质、纤维素、聚合物、淀粉等);①常见特殊名称的混合物:石油、石油的各种馏分、煤、漂白粉、碱石灰、福尔马林、油脂、天然气、水煤气、 铝热剂等。
高三一轮复习_物质的分类和胶体学案

高考化学一轮复习—化学物质及其变化【高考说明】1.理解分子、原子、离子的含义,理解相对原子质量相对分子质量的含义,并能进行有关计算。
2.理解物理变化与化学变化的区别和联系。
3.掌握根据物质组成对物质分类的方法,理解常见的不同类型物质的相互联系和转化关系。
4.能正确使用化学式(分子式)表示物质的组成,能根据化学式判断元素的化合价。
5.同位素、同素异形体、同系物、同分异构体的判断和比较。
6.知道胶体是常见的分散系,了解胶体与溶液的简单鉴别方法和胶体的重要应用。
(胶体的渗析、凝聚、布朗运动和电泳不做要求)课本重难考点梳理一、物质的组成(宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的)1.元素、物质及粒子间的关系【练习1】由同种元素的阳离子和另一种元素的阴离子组成的物质可能是__________。
(1)纯净物(2)混合物(3)单质2.同素异形体(1) 叫同素异形体。
同素异形体的形成有两种方式:①原子个数不同,如O2和O3;②原子排列方式不同,如金刚石和石墨、C60。
(2)同素异形体之间的性质差异主要体现在性质上,同素异形体之间的变化属于变化。
二、物质的分类1.简单分类法概述(1)分类是学习和研究化学物质及其变化的一种常用科学方法。
(2)分类应依据事先设定的“”进行,“”不同,分类方法也不相同。
常用的两种分类法是法和法。
2.常用分类方法(1)交叉分类法【练习2】将Na2CO3、Na2SO4、K2SO4、K2CO3按交叉分类法分类:(2)树状分类法[特别提醒] (1)由一种元素组成或一种原子构成的物质不一定是纯净物。
如O 2和O 3,红磷和白磷,金刚石和石墨、C 60等分别是同素异形体。
(2)高分子化合物不是纯净物,如聚乙烯,n 值不确定,是混合物。
(3)结晶水合物不是混合物,如CuSO 4·5H 2O 、KAl(SO 4)2·12H 2O 、Na 2CO 3·10H 2O 等只由一种成分组成,属纯净物。
高考化学物质分类最全汇总(附易错分类汇总)(理科生必收)

高考化学物质分类汇总一、混合物混合物是由两种或两种以上物质混合而成的物质。
下面列举常见的混合物:●分散系:溶液、胶体、浊液等●高分子化合物:蛋白质、纤维素、淀粉、塑料等●其他物质:石油及其各种馏分、天然气、油脂、福尔马林、氨水、王水、碱石灰等二、纯净物纯净物与混合物相对,是由一种物质组成,有固定的物理性质和化学性质的物质。
纯净物有专门的化学符号,能用一个化学式表示。
继续细化纯净物的组成可将其分为:1.单质单质是由同一种元素组成的纯净物。
●金属单质:例如:K、Ca、Na、Mg、Al 等●非金属单质:例如:S、Cl2、He 等注意:●只含一种元素的物质不一定是纯净物。
如氧气O2 和臭氧O3 混合得到的物质是混合物●同种元素的同位素单质混合得到的物质是纯净物。
如氢的同位素氕氘氚组成的双原子分子H2、D2、T2 混合在一起得到的是纯净物●含水的物质不一定是混合物。
如胆矾CuSO4 • 5H2O、绿矾FeSO4 • 7H2O、明矾KAl(SO4)2 • 12H2O 都是纯净物2.化合物化合物是由两种或两种以上的元素组成的纯净物。
A. 按化合物的性质分类①氧化物氧元素与另外一种化学元素组成的二元化合物叫做氧化物。
氧化物可分为:I.酸性氧化物酸性氧化物指与水反应生成相应价态的酸,或与碱反应只生成一种相应价态的盐和水的氧化物。
例如:SO2、SO3、P2O5、SiO2、Mn2O7 等注意:●酸性氧化物不一定是非金属氧化物。
如高锰酸酐Mn2O7 既是酸性氧化物,又是金属氧化物●非金属氧化物不一定是酸性氧化物。
如一氧化碳CO、一氧化氮NO、二氧化氮NO2 都是不成盐氧化物●酸性氧化物不一定能与水反应生成相应的酸。
如二氧化硅SiO2 不与水反应●能与碱反应生成盐和水的氧化物不一定是酸性氧化物。
如二氧化氮NO2 是不成盐氧化物,氧化铝Al2O3 是两性氧化物●酸性氧化物一定是酸酐,但酸酐不一定是酸性氧化物。
如乙酸酐CH3COOOCCH3 含有三种元素,不是氧化物,故不是酸性氧化物II.碱性氧化物碱性氧化物指与水反应生成相应价态的碱,或与酸反应只生成一种相应价态的盐和水的氧化物。
专题2.1 物质的组成、分类与性质(优质课件)-2021年高考化学大一轮复习紧跟教材

第一讲 物质的组成、分类与性质
2021年高三大一轮复习——物质的组成、分类与性质
【考纲要求】
1.理解物理变化与化学变化的区别与联系。 2.理解混合物和纯净物、单质和化合物、金属和非金属的概念。 3.理解酸、碱、盐、氧化物的概念及其相互联系。 4.了解胶体是一种常见的分散系,了解溶液和胶体的区别。
一种(或多种)物质(分散质)分散在另一种(或多种)物质 (分散剂)中所得到的体系,叫做分散系(混合物)。
2021年高三大一轮复习——物质的组成、分类与性质 要点三 分散系 胶体 1.分散系的概念及分类
2021年高三大一轮复习——物质的组成、分类与性质
要点三 分散系 胶体
2.三种常见分散系的对比
溶液
➢请对常见的酸进行分类。
类别(按性质)
挥发性酸 高沸点酸
强酸 弱酸
物质
H2SO4 HCl HNO3 H2CO3
类别(按组成)
含氧酸 无氧酸 一元酸 二元酸
➢请对常见的碱进行分类。
类别(按性质)
易溶 微溶 难溶 强碱 弱碱
物质
KOH NaOH Ba(OH)2 Ca(OH)2 NH3·H2O
类别(按组成)
➢ 胶体的净水原理
1.常见的净水剂:KAl(SO4)2·12H2O、FeCl3·6H2O 等,其净水原理是 Al3+、Fe3+ 水解分别生成 Al(OH)3 胶体、Fe(OH)3 胶体而起到净化水的目的。 2.胶体粒子的直径一般在 1~100 nm 之间,它决定了胶体粒子具有较大的表面积, 吸附力很强,能在水中吸附悬浮固体或毒素形成沉淀,从而达到净化水的目的,这 就是胶体净水的原理。
胶体
浊液
高考化学一轮复习 第二章 第一讲 物质的组成性质和分类试题

回夺市安然阳光实验学校第一讲物质的组成、性质和分类[考纲展示]1.了解分子、原子、离子等概念的含义。
了解原子团的定义。
2.理解物理变化与化学变化的区别与联系。
3.理解混合物和纯净物、单质和化合物、金属和非金属的概念。
4.理解酸、碱、盐、氧化物的概念及其相互联系。
5.了解胶体是一种常见的分散系。
考点一物质的组成与分类[学生用书P25]一、元素、物质及微粒间的关系二、物质的分类1.概述(1)分类是学习和研究化学物质及其变化的一种常用科学方法。
(2)分类应依据一定的进行,不同,分类方法也不相同。
2.分类法常用的两种分类法是交叉分类法和树状分类法。
由于物质分类可以有不同的,那么对某一物质而言就可以按不同的分类分属于不同的物质类别。
三、常见无机化合物的分类无机化合物⎩⎪⎪⎨⎪⎪⎧氢化物:HCl、H2S、H2O、NH3等氧化物⎩⎪⎨⎪⎧不成盐氧化物:CO、NO等成盐氧化物⎩⎪⎨⎪⎧碱性氧化物:Na2O、CaO等酸性氧化物:CO2、P2O5等氧化物:Al2O3等过氧化物:Na2O2、H2O2等无机化合物⎩⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎪⎧酸⎩⎪⎪⎪⎨⎪⎪⎪⎧按电离出的H+数⎩⎪⎨⎪⎧一元酸:HCl、HNO3等二元酸:H2SO4、H2S等三元酸:H3PO4等按酸根是否含氧⎩⎪⎨⎪⎧无氧酸:HCl、H2S等含氧酸:HClO4、H2SO4等按酸性强弱⎩⎪⎨⎪⎧强酸:HCl、H2SO4、HNO3等弱酸:CH3COOH、HF等按有无挥发性⎩⎪⎨⎪⎧挥发性酸:HNO3、HCl等难挥发性酸:H2SO4、H3PO4等碱⎩⎪⎨⎪⎧按水溶性⎩⎪⎨⎪⎧可溶性碱:NaOH、KOH、Ba(OH)2等难溶性碱:Mg(OH)2、Cu(OH)2等按碱性强弱⎩⎪⎨⎪⎧强碱:NaOH、Ba(OH)2、KOH等弱碱:NH3·H2O等盐⎩⎪⎨⎪⎧正盐:BaSO4、KNO3、NaCl等酸式盐:NaHCO3、KHSO4等碱式盐:Cu2(OH)2CO3等复盐:KAl(SO4)2·12H2O等正确理解“一定”、“不一定”,规避概念失分点(1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为氧化物、Na2O2为过氧化物)。
高考第一轮复习物质的分类

一、考纲要求1. 了解分子、原子、离子、原子团等概念的含义;了解物质的分类方法,能根据物质的组成和性质对物质进行分类;了解单质、氧化物、酸、碱和盐的相互关系;了解溶液、溶解度、饱和溶液的概念;了解胶体是一种常见的分散系,了解胶体的性质。
2. 理解混合物和纯净物、金属与非金属的概念;理解溶液中溶质的质量分数的概念,并能进行有关计算。
二、考题规律物质的组成、性质和分类是高考命题的重要素材。
在高考命题中,常常以生活中的化学知识或重大科技成果为背景,来考查概念的类比和辨析,其中混合物和纯净物、单质和化合物、金属和非金属三组概念是物质分类中的常考对象。
题型多以选择题为主,难度不大,注重考查学生运用基本概念分析问题,解决问题的能力。
同时还会以生产、生活中的实际现象、特殊事件、重大科技成果等为背景,以高科技和人们普遍关注的问题为切入口,将有关物质的组成、性质和分类的知识融合于试题中。
与本专题内容相关的题目约占4—6分。
三、考向预测物质分类中所涉及的物质变化、氧化物的判断及其他分类标准都属于中学化学的理论知识,在高考中常常出现;胶体的知识和运用作为一个较独立的知识点,在高考中的地位举足轻重,预计明年高考这部分内容还会继续出现。
一、元素与物质的关系1. 元素——元素是质子数相同的一类原子的统称。
注意:质子数相同的微粒不一定是同一种元素,因为微粒的含义要比原子广泛。
2. 元素的存在形态:游离态和化合态3. 元素与物质的关系:物质都是由元素组成的,每一种元素自身都能组成物质,即单质;绝大多数元素能与其他种类的元素组成物质,即化合物。
思考:由同种元素形成的物质一定是纯净物吗?二、物质的分类1. 物质的简单分类2. 纯净物和混合物3. 氧化物:由氧和另一种元素形成的化合物。
根据其性质可进一步分为:a. 碱性氧化物:与酸反应生成盐和水的氧化物。
一般来说,低价金属氧化物,特别是活泼金属氧化物(ⅠA 、ⅡA 族元素的氧化物)属于此类氧化物。
2025届高三化学一轮复习第1讲:物质的分类及转化

知识点二 分散系及其分类
对点练通
2.下列关于胶体的叙述不正确的是( B )
A.胶体区别于其他分散系的本质特征是分散质微粒的直径在10-9~10-7 m之 间 B.胶体具有杀菌消毒作用,所以可以用于净水 C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象不同 D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水的目的
实例 属类
__C__O_2___、SO3等 大多数___非__金__属____氧化物
____C_a_O____、Fe2O3等 大多数__金__属____氧化物
知识点一 根据物质的组成和性质分类
(2)氧化物的交叉分类
自主梳理
知识点一 根据物质的组成和性质分类
自主梳理
(1)非金属氧化物大多是酸性氧化物,但不一定都是酸性氧化物,如_N__O_、__C__O__ 不是酸性氧化物;酸性氧化物也不一定是非金属氧化物,如__M_n__2O__7_是酸性氧 化物,但却是金属氧化物。 (2) 碱 性 氧 化 物 一 定 是 金 属 氧 化 物 , 但 金 属 氧 化 物 不 一 定 是 碱 性 氧 化 物 , 如 __M__n_2_O_7___、___A__l2_O_3___、__F_e_3_O_4__、__N_a_2_O__2 _等。
对点练通
2.(2023·黄冈期中)下列各组物质,按化合物、单质、混合物、还原剂顺序排列
的是( A )
化合物
A
甲烷
B
生石灰
C
烧碱
D
稀豆浆
单质 氧气 臭氧 氮气 铜
混合物 98%的硫酸
胆矾 冰水混合物
盐酸
还原剂 锌 氢气 氮气
浓硫酸
知识点一 根据物质的组成和性质分类
[全]高中化学物质的分类与胶体性质必考知识点总结
![[全]高中化学物质的分类与胶体性质必考知识点总结](https://img.taocdn.com/s3/m/fd7a4b31856a561253d36f33.png)
高中化学物质的分类与胶体性质必考知识点总结(一)元素与物质的关系1. 元素是物质的基本组成成分,物质都是由元素组成的。
2. 每种元素在一定的条件下均可自身组成单质也可与其它元素形成化合物。
3. 元素在物质中以两种形态存在:一种是游离态,另一种是化合态。
(二)物质的分类1. 常见的物质分类方法(1)交叉分类法:由于一种分类方法所依据的标准有较大的局限性,所能提供的信息也比较少,故人们在认识事物时,往往采用不同的分类方法,通过从不同的角度对物质进行分类,来弥补单一分类方法的不足。
交叉分类法即是对同一事物从多个角度分类的一种方法。
示例如下图:(2)树状分类法:对同类事物还可以再分类,进行层层深入。
由粗及细的分类。
示例见下图:2. 物质的基本分类方法(1)根据物质的成分分类:混合物。
纯净物(2)根据元素组成的种类分:单质化合物,而单质又可分为金属单质。
非金属单质;化合物可分为无机物和有机物。
无机物可分为氧化物、酸、碱、盐等;有机物可分为烃。
烃的衍生物。
(3)根据官能团进行分类:有机物可分为脂肪烃、芳香烃、烷、烯、炔;卤代烃、醇、醛、酮、羧酸等。
根据研究要求不同可采用不同的方法进行分类。
3. 分散系及其分类(1)分散系的概念及其分类法分散系:一种(或多种)物质分散到另一种(或多种)物质里所得到的体系。
分散系的组成:分散质------被分散成粒子的物质分散剂------粒子分散在其中的物质(2)分散系的分类与比较分散系的比较(三):胶体的性质1. 丁达尔现象:可见光束通过胶体时,在入射光侧面可观察到明亮的光束。
注意:①丁达尔效应是物理变化②丁达尔效应可用来鉴别胶体和溶液③液溶胶和气溶胶、固溶胶均能发生丁达尔效应④丁达尔效应能说明胶粒的大小范围⑤丁达尔现象是胶粒对光的散射作用而形成的。
2. 电泳:胶粒细小而具有较大的表面积,能选择性的吸附胶体中的某种离子而带有一定电荷。
一般金属氧化物、氢氧化物胶体的微粒带正电荷,非金属氧化物胶体、金属硫化物胶体、硅酸胶体、土壤胶体的微粒带负电荷。
高三化学一轮复习【2、物质的分类、电解质】无答案

高中化学复习要点基本理论物质的分类物质的分类胶体一、胶体的性质1、区别其它分散系最本质的特征(定义):分散质粒径1-100nm。
2、鉴别胶体最简单的方法:丁达尔现象。
3、电泳:Fe(OH)3胶体,Al(OH)3胶体带正电;硅酸胶体,土壤胶体带负电。
、应用:电泳电镀就是利用电泳将油漆、乳胶、橡胶等微粒均匀的沉积在镀件之上。
4、聚沉:加热;加电解质;加电性相反的胶体【例题】向Fe(OH)3胶体中逐渐加入稀H2SO4的现象:先聚沉,后沉淀消失形成淡黄色溶液。
解释:硫酸是电解质,使胶体聚沉,过量的硫酸和氢氧化铁发生中和反应生成硫酸铁溶液。
5、提纯胶体最好的方法:渗析半透膜:牛皮纸、羊皮纸、鸡蛋壳膜、胶棉薄膜、动物肠衣、玻璃纸应用:生物工程、化学工程、环境工程、海水淡化二、常见的胶体气溶胶:烟、云、雾液溶胶:Fe(OH)3胶体、Al(OH)3胶体、硅酸胶体、血液、蛋白质溶液、淀粉溶液、肥皂水、豆浆固溶胶:有色玻璃、烟水晶三、与胶体性质相关的现象1、三角洲的形成(聚沉)2、FeCl3止血(聚沉)3、卤水点豆腐(聚沉)4、不同牌子的墨水不能混用(聚沉)5、高压除尘(电泳)6、土壤的保肥作用7、水泥的硬化8、净水(表面积大)【巩固练习】(1)Fe(OH)3胶体中滴入少量H2SO4有红褐色沉淀生成(2)白色胶体氢氧化铝可用于吸附色素(3)使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血(4)肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗(5) 手不慎被玻璃划破,可用FeCl3溶液应急止血(6)江河入海口易形成三角洲(7)在豆浆中加入盐卤做豆腐(8)一束平行光照射蛋白质溶液时从侧面可以看到光亮的通道(9)在FeCl3溶液中滴入NaOH溶液出现红褐色沉淀(10)用明矾净水;(11)一支钢笔使用不同牌号的蓝黑墨水易出现堵塞四、胶体制备【Fe(OH)3胶体的制备】向沸水中滴加FeCl3饱和溶液,继续加热至整个体系呈现均匀的红褐色为止。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高三总复习第二讲一.元素与物质的关系
1.元素(概念,分类,存在形式)
2.元素与物质的关系
二.物质的分类
三.分散系胶体
1.分散系定义?
3.胶体
4.胶体的性质?
一,电解质及其电离
1.电解质和非电解质
2.强电解质和弱电解质的比较
二,离子反应
1.离子反应的定义?
3.离子反应方程式?
①概念?
②书写?
③反应的条件?
【高频重点】
1.离子方程式的正误判断?
方法:1是否符合客观事实
2看参加反应的离子是否有遗漏
3看拆分是否正确
4看是否符合物质的固定组成比例
5看电荷是否守恒
6看反应条件
二,溶液中离子共存的判断(一色,二性,三特殊,四反应)一色:
二性:
三特殊:
①与酸不能共存的
②遇碱不能共存的
四反应:(复分解,氧化还原,双水解,络合反应)
复分解①
②
③
1.系列物质属于化合物的是?
A.石墨
B.干冰
C.盐酸
D.食盐水
(变式1)下列物质中属于纯净物、化合物、无机化合物、盐、钙盐的是()
A.石灰石
B.Ca(OH)2
C.CaCO3
D.CH4
2根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的()
A.溶液
B. 悬浊液
C.乳浊液
D.胶体
(变式3)胶体区别于其他分散系的本质特征是()
A.光束穿过胶体时形成一条光亮的“通路”
B.胶体粒子的大小在1~100nm之间
C.胶体粒子可以透过滤纸
D.胶体粒子不能透过半透膜
3下列关于电解质的判断中正确的是()
A. 在熔融状态下能够导电的物质
4.下列关于电解质的判断中正确的是()
A. 在熔融状态下能够导电的物质
B. 在熔融状态下或水溶液中能够导电的物质
C. 在熔融状态下或水溶液中能够导电的化合物
D. 在熔融状态下和水溶液中都能导电的化合物
( 变式4)下列物质中,属于电解质的是()
A.CO2 B.盐酸 C.BaSO4 D.C2H50H
(变式5)下列叙述正确的是()
A.NaCI溶液在电流作用下电离出来了Na+和CI-
B.NaCI是电解质,故NaCI晶体能导电
C.氯化氢溶于水能导电,但液态氯化氢不能导电
D.导电性强的溶液里自由移动的粒子数目一定比导电性弱的溶液里自由移动的粒子数目多
5.下列各组物质在水溶液中能够完全电离的是()
A.NaHSO4、H2SO4、H2S
B.Na2SO4、NaOH、SO2
C.H2SO3、Cu、CACO3
D.H2SO4、NaCI、NaOH
( 变式6) 写出下列物质在水溶液中的电离方程式
1.KOH
----------------------------------------------------------------------------------------
2 KHSO4
----------------------------------------------------------------------------------------
3 HCI
-----------------------------------------------------------------------------------------
4 NaCO3
-----------------------------------------------------------------------------------------
6加入氢氧化钾溶液之后,溶液中下列离子数目明显减少的是()A.硝酸根离子 B. 镁离子 C. 钡离子 D. 碳酸根离子
7下列离子方程式错误的是()A.钠和水的反应: 2Na + 2H2O = 2Na+ + 2OH-+ H2↑
B.铁和稀硫酸反应: 2Fe + 6H+ = 3Fe3+ +3H2↑
C.锌和硫酸铜反应: Zn + Cu2+ = Zn2+ + Cu
D.澄清石灰水中加入碳酸钠溶液: Ca2+ + CO32-= CaCO3↓
8下列各组离子中,能在溶液中大量共存的是()A.Na+H+NO3-OH-B.Ca2+ NO3-CO32-OH-
C.K+H+ Cl-SO42-D.Ba2+Cl-H+SO42-
9酸性溶液中能大量共存而且为无色透明的溶液是()A.NH4+、Al3+、SO42-、NO3-B.K+、Na+、NO3-、CO32-
C.K+、MnO4-、NH4+、NO3-D.Fe3+、K+、SO42-、NO3-
10知Br2在溶液中可将Fe2+氧化为Fe3+,若将1mol Cl2通入到含有1mol FeBr2的溶液中,所发生反应的离子方程式为()
A.、 Cl2+2Fe2+=2Fe3++2Cl— B 、Cl2+2Br-=Br2+2Cl—
C.、3Cl2+2Fe2+ +4Br-=2Fe3++6Cl—+2Br2 D、 2Cl2+2Fe2+ +2Br-=2Fe3++4Cl—+Br2
11列反应的离子方程式正确的是 ( )
A、锌片插入硝酸银溶液中 Zn+Ag+= Zn2++ Ag
B 、碳酸氢钙溶液加到醋酸中: Ca(HCO3)2+2CH3COOH= Ca2++2CH3COO-+2CO2↑+2H2O
C、少量金属钠加到冷水中: Na+2H2O= Na++OH-+H2↑
D、氢氧化铜加到盐酸中: Cu(OH)2+2H+= Cu2++2H2O。
