常用pH标准缓冲溶液
常用pH缓冲液 缓冲液缓冲范围

资料]常用pH缓冲溶液的配制和pH值常用pH缓冲溶液的配制和pH值一、常用溶液的配制(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
(三)0.15Mol/L PB 液 Na 2HPO 4·2H 2O 分子量=175.05 0.15Mol/L 溶液含26.7g/L 。
Na 2HPO 4·12H 2O 分子量=358.22 0.15Mol/L 溶液含53.7g/L 。
NaH 2PO 4·H 2O 分子量=138.00 0.15Mol/L 溶液含20.7g/L 。
pH标准缓冲溶液(pH=6.86)

pH标准缓冲溶液(pH=6.86)pH 标准缓冲溶液(pH=6.86)简介:pH 标准溶液的pH 值是已知的,并达到规定的准确度,其pH 值有良好的复现性和稳定性,具有较⼤的缓冲容量,较⼩的稀释值和较⼩的温度系数。
该pH 标准缓冲溶液常⽤于酸度计的定位和斜率校准,其准确度范围在±0.01pH 。
pH 标准缓冲溶液(pH=6.86)是特指在25℃下,pH=6.86。
组成:操作步骤(三点校准通⽤,仅供参考):1、将pH 电极在纯⽔中清洗⼲净并甩⼲。
2、⽤温度计测量pH 标准缓冲溶液的温度,并将pH 计的温度值调整准确。
⾃动温度pH 计⽆需该步骤。
3、定位校正:将pH 电极浸⼊pH 标准缓冲溶液(pH=6.86)中,稍微搅动后静⽌放置,待测量值稳定后,按校准键或参考仪器说明校准,⼀般会先显⽰闪烁的6.86,再显⽰pH 校准数值,表⽰pH6.86的校准完成。
4、斜率校准Ⅰ: 取出pH 电极,⽤纯⽔清洗⼲净并甩⼲。
将pH 电极浸⼊pH 标准缓冲溶液(pH=4.00)中,稍微搅动后静⽌放置,待测量值稳定后,按校准键或参考仪器说明校准,⼀般会先显⽰闪烁的4.00,再显⽰pH 校准数值,表⽰pH4.00的校准完成。
完成校准后会⾃动显⽰电极在该线性段的斜率百分⽐(如显⽰99%)。
5、斜率校准Ⅱ: 取出pH 电极,⽤纯⽔清洗⼲净并甩⼲。
将pH 电极浸⼊pH 标准缓冲溶液(pH=9.18)中,稍微搅动后静⽌放置,待测量值稳定后,按校准键或参考仪器说明校准,⼀般会先显⽰闪烁的9.18,再显⽰pH 校准数值,表⽰pH9.18的校准完成。
完成校准后会⾃动显⽰电极在该线性段的斜率百分⽐(如显⽰98%)。
注意事项:1、如果每次的使⽤量很⼩,可以适当分装后再使⽤,尤其以pH 标准缓冲溶液(pH=9.18)较易失效。
2、显⽰pH 校准数值时,pH 值会随温度不同⽽不同,例如在定位校正中,25℃时显⽰6.86,15℃时就显⽰6.90。
PH标准缓冲液配置

标准缓冲溶液(均用pH标准缓冲物质配制)1.1 苯二甲酸氢钾标准缓冲溶液:c(KHC8H4O4)=0.05 mol/L(25℃时,pHs=4.003)。
苯二甲酸氢钾的pH标准缓冲物质,有小塑料袋和瓶装两种,配制方法如下:a)袋装配制法:在250 mL(或500 mL)量瓶中(根据袋中标准缓冲物质量,选择量瓶大小),按袋上的说明配制成所需的浓度。
保存于聚乙烯瓶中。
b)瓶装配制法:称取5.10 g苯二甲酸氢钾(KHC8H4O4预先在115℃±5℃,烘2~3 h,于干燥器中冷却),溶于水并稀释至500 mL,混匀。
保存于聚乙烯瓶中。
1.2 0.025 mol/L磷酸二氢钾(KH2PO4)和0.025 mol/L磷酸氢二钠(Na2HPO4)混合标准缓冲溶液(25℃时,pHs=6.864):磷酸二氢钾和磷酸氢二钠的pH标准缓冲物质,有小塑料袋装(混合磷酸盐)和瓶装(两种pH标准缓冲物质分别包装)两种。
配制方法如下:a)袋装配制法:在量瓶(根据袋上说明确定量瓶大小)中按袋上说明配制成所需浓度后,保存于聚乙烯瓶中。
b)瓶装配制法:迅速称取3.40 g磷酸二氢钾(KH2PO4)和3.55 g磷酸氢二钠(Na2HPO4)(均预先在115±5℃烘2~3 h,于干燥器中冷却)溶于蒸馏水,转入1 000 mL量瓶中,加水至标线,混匀。
1.3 0.008 695 mol/L磷酸二氢钾(KH2PO4)和0.030 43 mol/L磷酸氢二钠(Na2HPO4)标准混合缓冲溶液(25℃时,pH=7.413):磷酸二氢钾和磷酸氢二钠两种pH标准缓冲物质分别用瓶包装,配制方法如下:迅速称取1.18 g磷酸二氢钾和4.31 g磷酸氢二钠(均预先在115℃±5℃烘2~3 h,于干燥器中冷却),溶于水,全量移入1 000 mL量瓶中,加水至标线,混匀。
保存于聚乙烯瓶中。
1.4 硼砂标准缓中溶液:c(Na2B4O7·10H2O)=0.010 mol/L(25℃时,pHs=9.182)。
常用pH缓冲溶液的配制和pH值
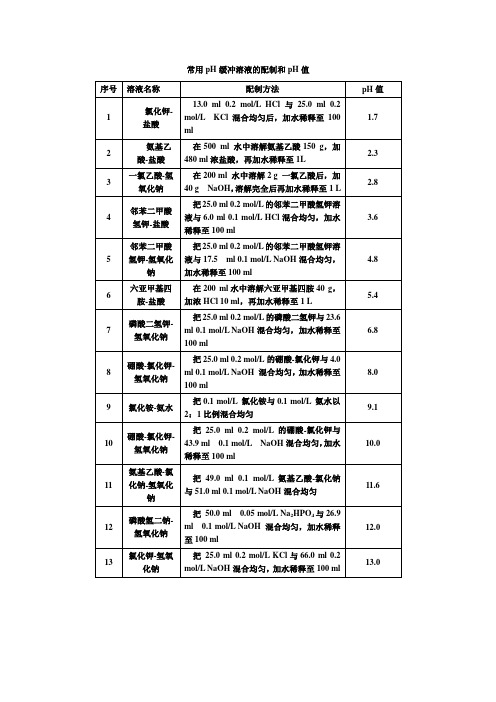
常用pH缓冲溶液的配制和pH值25℃下0.1mol/l磷酸钾缓冲液的配制来源:互联网作者:未知发布时间:2006-09-25你会看到这个提示,那是因为你的系统无法识别某栏目的模型信息,或者你新建模型后,没为这个模型设计单独的模板。
不同模型的文档浏览页的模板为:article_模型名字标识.htm 如“article_article.htm”,更多的信息你可以在频道模型管理的地方查看。
3.磷酸氢二钠-柠檬酸缓冲液pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml pH 0.2M Na2HPO4/ml 0.1M柠檬酸/ml2.2 0.40 19.6 5.2 10.72 9.282.4 1.24 18.76 5.4 11.15 8.852.6 2.18 17.82 5.6 11.60 8.402.83.17 16.83 5.8 12.09 7.913.04.11 15.896.0 12.637.373.24.94 15.066.2 13.22 6.783.4 5.70 14.30 6.4 13.85 6.153.6 6.44 13.56 6.6 14.555.453.8 7.10 12.90 6.8 15.454.554.0 7.71 12.29 7.0 16.47 3.534.2 8.28 11.72 7.2 17.39 2.614.4 8.82 11.18 7.4 18.17 1.834.6 9.35 10.65 7.6 18.73 1.274.8 9.86 10.14 7.8 19.15 0.855.0 10.30 9.70 8.0 19.45 0.55Na2HPO4分子量=141.98 0.2M溶液含28.40g/LNa2HPO4·2H2O分子量=178.05 0.2M溶液含35.61g/LC6H8O7·H2O分子量=210.14 0.1M溶液含21.01g/L4.柠檬酸-氢氧化钠-盐酸缓冲液回复人:leeping,▲(@ )时间:2006-3-292楼9:02:44 编辑pH 钠离子浓度/M 柠檬酸C6H8O7·H2O/g 氢氧化钠NaOH/g 浓盐酸HCl/ml 终体积/L2.2 0.20 210 84 160 103.1 0.20 210 83 116 103.3 0.20 210 83 106 104.3 0.20 210 83 45 105.3 0.35 245 144 68 105.8 0.45 285 186 105 106.5 0.38 266 156 126 10使用时可以每升中加入1g酚,若最后pH有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
常用缓冲溶液常用浓度及pH范围

磷酸氢两钠-磷酸两氢钠慢冲液(0.2mol/L)
磷酸氢两钠-磷酸两氢钾慢冲液(1/15 molL)
磷酸两氢钾-氢氧化钠慢冲液(0.05mol/L)
巴比妥钠-盐酸慢冲液(18℃)
25℃)
硼砂-盐酸慢冲液(0.05mol/L)
硼酸-硼砂慢冲液(0.2mol/L)
苦氨酸-氢氧化钠慢冲液(0.05mol/L)
硼砂-氢氧化钠慢冲液(0.05mol/L)
碳酸钠-碳酸氢钠慢冲液(0.1mol/L)
碳酸钠-氢氧化钠慢冲液(0.025mol/L)
磷酸氢两钠-氢氧化钠慢冲液
氯化钾-盐酸慢冲液(0.2mol/L)
氯化钾-氢氧化钠慢冲液(0.2mol/L)
时常使用慢冲溶液时常使用浓度及pH范畴之阳早格格创做
慢冲液称呼及时常使用浓度
配造pH范畴
主要物量分子量Mr
苦氨酸-盐酸慢冲液(0.05mol/L)
邻苯两甲酸-盐酸慢冲液(0.05mol/L)
磷酸氢两钠-柠檬酸慢冲液
柠檬酸-氢氧化钠-盐酸慢冲液
柠檬酸-柠檬酸钠慢冲液(0.1mol/L)
乙酸-乙酸钠慢冲液(0.2mol/L)
常用pH标准缓冲溶液

5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
6.98
6.95
6.92
6.90
6.88
6.86
6.85
6.84
6.84
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
6.83
6.83
6.83
6.84
6.85
6.86
6.88
6.89
-
硼酸盐标准缓冲溶液
c(Na2B4O7·10H2O)称取硼砂(Na2B4O7·10H2O)(3.80± 0.01)g(注意:不能烘!),溶于预先煮沸过 15~30min并迅速冷却的蒸馏水中,并稀释至1000ml。置聚乙烯塑料瓶中密闭保存。存放时要防止空气中的CO2的进入(注:可用于酸度计校准)
70℃
80℃
90℃
95℃
-
9.04
9.01
8.99
8.96
8.92
8.89
8.85
8.83
-
氢氧化钙标准缓冲溶液
在25℃,用无二氧化碳的蒸馏水制备氢氧化钙的饱和溶液。氢氧化钙溶液的浓度c[1/2Ca(OH)2]应在(0.0400~0.0412)mol/L。氢氧化钙溶液的浓度可以酚红为指示剂,用盐酸标准溶液[c(HCl)=0.1mol/L]滴定测出。存放时要防止空气中的二氧化碳的进入。出现混浊应弃去重新配制
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
常用缓冲溶液的配制和PH计校正溶液配置方法
3.5
6.5
7.6
1.5
8.5
8.4
4.5
5.5
7.8
2.0
8.0
8.7
6.0
4.0
8.0
3.0
7.0
9.0
8.0
2.0
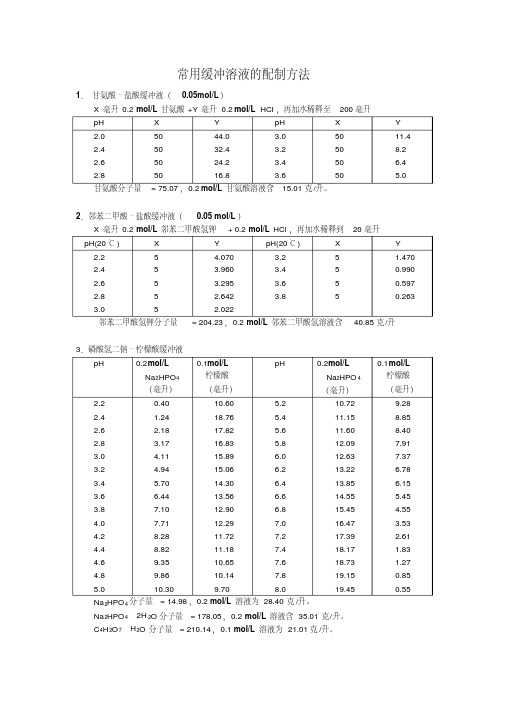
硼砂 Na2B4O7·H 2O,分子量 =381.43;0.05M 溶液( =0.2M 硼酸根)含 19.07 克 / 升。
硼酸 H 2BO 3,分子量 =61.84,0.2M 溶液为 12.37 克 /升。
5
2.365
8.0
5
Y (毫升) 2.963 3.500 3.950 4.280 4.520 4.680
9.巴比妥钠 - 盐酸缓冲液( 18℃)
pH
0.04M 巴比妥 0.2V 盐酸
pH
钠溶液
0.04M 巴 比 0.2N 盐酸 (毫 妥钠溶液 ( 毫 升 )
6.8
100
18.4
8.4
7.0
100
17.8
10.0
90.0
7.1
67.0
33.0
6.0
12.3
87.7
7.2
72.0
28.0
6.1
15.0
85.0
7.3
77.0
23.0
6.2
18.5
81.5
7.4
81.0
19.0
6.3
22.5
77.5
7.5
84.0
16.0
6.4
26.5
73.5
7.6
87.0
13.0
6.5
31.5
68.5
7.7
89.5
常见缓冲液的配制

常见缓冲液的配制附溶液配制方法:pH7.2 0.01mol/L PBSKH2PO40.38gNa2HPO4 1.02g(或Na2HPO4·12H2O2.58g) NaCl8.0g蒸馏水加至1000mLpH7.4 PBS/TNaCl8.0gKH2PO40.2gNa2HPO4·12H2O(或Na2HPO4·7H2O) 2.89g(或2.16g)KCl0.2g吐温200.5mL蒸馏水加至1000mLpH9.6碳酸盐缓冲液Na2CO3 1.59gNaHCO3 2.93g蒸馏水加至1000mL0.075mol/L氯化钾低渗液氯化钾0.559g,蒸馏水100ml甲醇冰醋酸(3:1)固定液甲醇3份冰醋(乙)酸1份姬姆萨染液Giemsa原液1ml1/15mol/L磷酸缓冲液(pH6.8或7.4)10ml2.3% 柠檬酸钠溶液柠檬酸钠(Na C H O ·2H O)2.3g蒸馏水100ml明胶显影液明胶粉0.2g三蒸水10ml甲酸0.1ml1% 醋酸冰醋(乙)酸1ml蒸馏水99mlH"o"33342-若丹明123染液H"o"33342(Hoechst 33342)0.25μg 若丹明123(Rhodamine 123)1.0μg PBS 1mlDPH贮备液DPH(1.6-Dipnenyl-1,3, 5hexatriene, 4.65mg)四氢呋喃10mlDPH工作液(2×10-6mol/L)DPH贮备液0.1mlPBS 100mlFDA贮备液二醋酸脂荧光素(Fluorescein diacetate,FDA) 5.0mg丙酮1mlFDA工作液FDA贮备液0.1mlPBS 100mlM-缓冲液(pH7.2)咪唑50mmol/L 3.404g氯化钾50mmol/L 3.7g氯化镁(MgCl ·6H O)0.5mol/L 101.65mgEGTA(乙二醇双(a-氨基乙基)醚四乙酸) 1mmol/L 380.35mg EDTA(乙二胺四乙酸) 0.1mmol/L 29.22mg疏基乙醇1mmol 0.07ml4mol/L甘油292ml蒸馏水加至1000ml1% TritonX-100液Triton X-100(聚乙二醇辛基苯基醚)1mlM-缓冲液99ml3% 戊二醛液戊二醛25% 3mlPBS 液(pH7.2)97ml0.2% 考马斯亮蓝R250染液考马斯亮蓝R250(Coomassie brilliant blue R250)0.2g 甲醇46.5ml冰醋(乙)酸7ml蒸馏水46.5ml生理盐水(0.85%氯化钠)氯化钠8.5g三蒸水1000ml0.25mol/L蔗糖水溶液(含0.003mol/L氯华钙)蔗糖85.5g无水氯华钙0.33g蒸馏水1000ml0.17mol/L氯化铵液氯化铵4.574g蒸馏水500ml0.17mol/L硝酸钠液硝酸钠7.224g 蒸馏水500ml0.12mol/L硫酸钠液硫酸钠(Na SO ·H O)19.333g蒸馏水500ml0.12mol/L草酸铵液草酸铵((NH )C o ·H O)8.527g蒸馏水500ml0.17mol/L醋酸铵液醋酸铵6.552g蒸馏水500ml0.32mol/L葡萄糖液葡萄糖28.83g蒸馏水500ml0.32mol/L甘油液甘油(C H (OH) ·1.26g/ml) 11.7ml蒸馏水500ml0.32mol/L乙醇液无水乙醇9.33ml蒸馏水500ml0.32mol/L丙醇液正丙醇(比重0.803)11.976ml蒸馏水500ml化学名:2-[4-(2-Hydroxyethyl)-1-piperazinyl]ethanesulfonic acid 中文名:羟乙基哌嗪乙硫磺酸分子式:C8H18N2O4SHEPES是一种非离子两性缓冲液,其在pH 7.2 - 7.4 范围内具有较好的缓冲能力。
常用pH缓冲液缓冲液缓冲范围
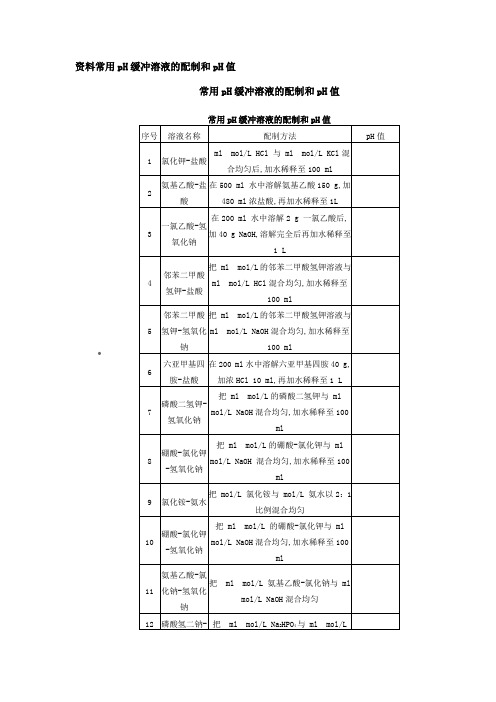
资料常用pH缓冲溶液的配制和pH值•常用pH缓冲溶液的配制和pH值一、常用溶液的配制一溶液配制注意事项1.药品要有较好的质量试剂分为优级纯保证试剂,Guaranteed reagent,G.R.、分析试剂Antalytical reagent,A.R.化学纯Chemical pure,C.P.和实验试剂Laboratory reagent,L.R.等等;工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等;2.药品称量要精确;3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH 在~之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水;4.配好后的溶液,应立即除菌处理如高压灭菌、抽滤或加抑菌物质,以防杂菌生长;二1/15Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾KH2PO4,A.R.,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度1 000ml;2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠Na2HPO4,.或者Na2HPO4·2H2O 用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度1 000ml;3.按附表的比例,配制成不同pH值的缓冲溶液;•三L PB液Na2HPO4·2H2O分子量= L溶液含L; Na2HPO4·12H2O分子量= L溶液含L; NaH2PO4·H2O分子量= L溶液含L; NaH2PO4·2H2O分子量= L溶液含L;四L PB缓冲液L Na2HPO4·2 H2O溶液LNa2HPO4·12 H2O溶液含LLNaH2PO4·H2O溶液含LNaH2PO4·2 H2O溶液含L欲配L PB缓冲液则在L PB缓冲液的基础上加H2O稀释1倍即可;欲配制PBS液时,则在溶液中加%的NaCl溶液即可;五无钙镁离子磷酸缓冲盐水PBSL PHNaClKClNa2HPO4如为Na2HPO4·12H2O,则为KH2PO4将上述试剂依次溶于1 000ml去离子水中,完全溶解后,115℃高压灭菌10min~15min,存在4℃冰箱中备用;此液可用于配制和稀释细胞分散剂以及洗涤细胞培养物;六硼酸盐缓冲液Borate saline buffer1.硼酸H3BO3L硼酸:硼酸加水至1 000ml;2.硼砂Na2B4O7L硼砂:硼砂加水至1 000ml;七巴比妥缓冲液1.离子强度L巴比妥缓冲液巴比妥钠蒸馏水 3 000mlHClN HCl=193ml浓HCl加1 807ml蒸馏水⑴ 将巴比妥钠溶于3 000ml蒸馏水;⑵ 加 N HCl 55ml;⑶ 用HCl调节pH到,并加蒸馏水至4 265ml;2. L巴比妥缓冲液巴比妥巴比妥钠加蒸馏水至 13. L巴比妥缓冲液巴比妥巴比妥钠加蒸馏水 1八L醋酸盐缓冲液见表附表5九三羟甲基甲烷—盐酸缓冲液Tris—HCl缓冲液不同pH,LL三羟甲基氨基甲烷加х,加水稀释至100ml见下表三羟甲基氨基甲烷Tris分子量=L三羟甲基氨基甲烷:,加水至1 000ml;:取,加水至1 000ml;•十L 碳酸盐缓冲液NaHCO3Na2CO3溶于蒸馏水中即得;不用时塞紧瓶塞,以免吸收空气中二氧化碳使PH下降;最好小量配制;十一甘油磷酸缓冲液1.配制磷酸缓冲液L Na2HPO4NaH2PO4混合即可2.9份甘油与1份磷酸缓冲液混合,即为甘油磷酸缓冲液;用途:用于免疫荧光试验;十二Hank’s液1.贮存液NaClKClNa2HPO4·12 H2OKH2PO4葡萄糖%酚红液双馏水加至115℃高压灭菌15min,冰冻保存;2.工作液贮存液 1份双馏水 9份115℃高压灭菌15min;临用时用灭菌的%NaHCO3液调pH值至左右溶液呈橙红色;十三萘钠氏试剂Nessler’s reagent配方1:氯化汞碘化钾20%NaOH 30ml加蒸馏水至 100ml配方2:碘化汞碘化钾 8g蒸馏水 50ml完全溶解后过滤,加20%NaOH 50ml;用途:检测溶液中氨离子;十四阿氏Alsever’s液葡萄糖柠檬酸钠氯化钠蒸馏水 100ml溶解后,以10%柠檬酸调节pH至,过滤,分装,10磅10min灭菌,4℃保存;十五青、链霉素混合液简称S.P.液或双抗液青霉素40万U 5支链霉素200万μg 1支分别溶于100ml灭菌无离子水中或共同溶于200ml灭菌无离子水中,混合后分装小瓶,置-10℃~-20℃冰箱保存备用1万单位μg/ml;临用时,按1%的量加入营养液或其他溶液中,最后浓度是青霉素100U/ml,链霉素100ug/ml;十六洗液清洁液配方1:重铬酸钾 150g蒸馏水 300ml浓硫酸 3 000ml将重铬酸钾加入蒸馏水中,使之自然溶解或水浴溶解,亦可在大坩埚中加热溶解,然后慢慢加入浓硫酸,边加边搅拌,见发热过剧则稍停,冷却后再继续加;此为强洗液;盛清洁液的容器要坚固,上加厚玻璃盖,操作时要穿橡皮围裙、长统胶靴、戴上眼镜和厚胶皮手套,以保安全;洗液一旦变绿,表示铬酸已经还原,失去了氧化能力,不宜再用;如将这样洗液加热,再加适量重铬酸钾,又可重新使用;配方2:浓硫酸 50%蒸馏水 50%重铬酸钾 5%此为中等强度洗液;配方3:重铬酸钾 100g蒸馏水 1 000ml加热溶解,冷却后缓慢加入工业硫酸 100ml此液为弱洗液,为棕红色;使用此液时,必须预先用热肥皂水将玻璃器皿洗净,经自来水冲洗,沥干然后才能浸入,否则该洗液很快失效;缓冲液名称及常用浓度缓冲pH范围主要物质分子量MES 2吗啉代乙磺酸Bis-TrisHEPESPIPESMOPSTricineTEA 三乙醇胺甘氨酸-盐酸缓冲液L 甘氨酸Mr=邻苯二甲酸-盐酸缓冲液L 邻苯二甲酸氢钾Mr=磷酸氢二钠-柠檬酸缓冲液磷酸氢二钠Mr=柠檬酸-氢氧化钠-盐酸缓冲液柠檬酸Mr=柠檬酸-柠檬酸钠缓冲液L 柠檬酸Mr= 柠檬酸钠Mr= 乙酸-乙酸钠缓冲液L 乙酸钠Mr= 乙酸Mr=邻苯二甲酸氢钾-氢氧化钠缓冲液邻苯二甲酸氢钾Mr= 磷酸氢二钠-磷酸二氢钠缓冲液L磷酸氢二钠-磷酸二氢钾缓冲液1/15 molL磷酸二氢钾-氢氧化钠缓冲液L巴比妥钠-盐酸缓冲液18℃巴比妥钠Mr=Tris-盐酸缓冲液L 25℃三羟甲基氨基甲烷TrisMr=甘氨酸-氢氧化钠缓冲液L 甘氨酸Mr=硼砂-氢氧化钠缓冲液L 硼砂Na2B4O710H2O Mr=碳酸钠-碳酸氢钠缓冲液L 碳酸钠Mr= 碳酸氢钠Mr= 碳酸钠-氢氧化钠缓冲液L磷酸氢二钠-氢氧化钠缓冲液氯化钾-盐酸缓冲液L 氯化钾Mr=氯化钾-氢氧化钠缓冲液L 氯化钾Mr=。
常用缓冲溶液常用浓度及pH范围

磷酸氢二钠-磷酸二氢钠缓冲液(0.2mol/L)
磷酸氢二钠-磷酸二氢钾缓冲液(1/15 molL)
磷酸二氢钾-氢氧化钠缓冲液(0.05mol/L)
巴比妥钠-盐酸缓冲液(18℃)
25℃)
硼砂-盐酸缓冲液(0.05mol/L)
硼酸-硼砂缓冲液(0.2mol/L)
甘氨酸-氢氧化钠缓冲液(mol/L)
经常使用缓冲溶液经常使用浓度及pH范围之迟辟智美创作
缓冲液名称及经常使用浓度
配制pH范围
主要物质分子量Mr
甘氨酸-盐酸缓冲液(0.05mol/L)
邻苯二甲酸-盐酸缓冲液(0.05mol/L)
磷酸氢二钠-柠檬酸缓冲液
柠檬酸-氢氧化钠-盐酸缓冲液
柠檬酸-柠檬酸钠缓冲液(0.1mol/L)
乙酸-乙酸钠缓冲液(0.2mol/L)
硼砂-氢氧化钠缓冲液(0.05mol/L)
碳酸钠-碳酸氢钠缓冲液(0.1mol/L)
碳酸钠-氢氧化钠缓冲液(0.025mol/L)
磷酸氢二钠-氢氧化钠缓冲液
氯化钾-盐酸缓冲液(0.2mol/L)
氯化钾-氢氧化钠缓冲液(0.2mol/L)
ph标准缓冲溶液配制

ph标准缓冲溶液配制PH标准缓冲溶液是实验室常用的一种溶液,它可以帮助实验人员在一定的PH范围内稳定样品的PH值。
在生物化学、分子生物学、生物工程等领域,PH标准缓冲溶液的配制和使用是非常重要的。
本文将介绍PH标准缓冲溶液的配制方法及注意事项,希望能为实验人员提供一些帮助。
首先,我们需要准备一些基本的试剂和设备,包括PH计、天平、磁力搅拌器、蒸馏水等。
在配制PH标准缓冲溶液之前,需要确保这些试剂和设备都是干净的,并且已经校准过。
接下来,我们需要选择合适的缓冲物质。
常用的缓冲物质有磷酸盐缓冲液、醋酸盐缓冲液、三羟甲基氨基甲烷缓冲液等。
选择缓冲物质时,需要考虑样品的PH范围和化学性质,选择最适合的缓冲物质。
在配制缓冲溶液时,需要按照一定的配比将缓冲物质和蒸馏水混合,直至溶解。
在这个过程中,可以使用PH计监测溶液的PH值,确保PH值在目标范围内。
如果PH值偏离目标范围,可以适当调整缓冲物质的用量,直至达到理想的PH值。
配制好的PH标准缓冲溶液需要进行标定。
标定的过程包括使用PH计测量溶液的PH值,并与已知PH值的标准溶液进行比较,调整PH值直至与标准溶液相符。
标定完成后,需要将溶液存储在密封的容器中,避免受到外界环境的影响。
在使用PH标准缓冲溶液时,需要注意以下几点。
首先,避免溶液受到污染,使用前需要确保溶液的清洁和透明度。
其次,在使用过程中需要严格按照实验方法操作,避免操作失误导致PH值的偏离。
最后,使用完毕后需要及时清洗使用的玻璃仪器,并将溶液妥善存放。
总的来说,PH标准缓冲溶液的配制和使用需要一定的技术和经验。
正确的配制方法和注意事项能够保证溶液的质量稳定性,为实验结果的准确性提供保障。
希望本文介绍的内容能够对实验人员有所帮助,谢谢阅读!。
常用pH缓冲液配置方法及注意事项
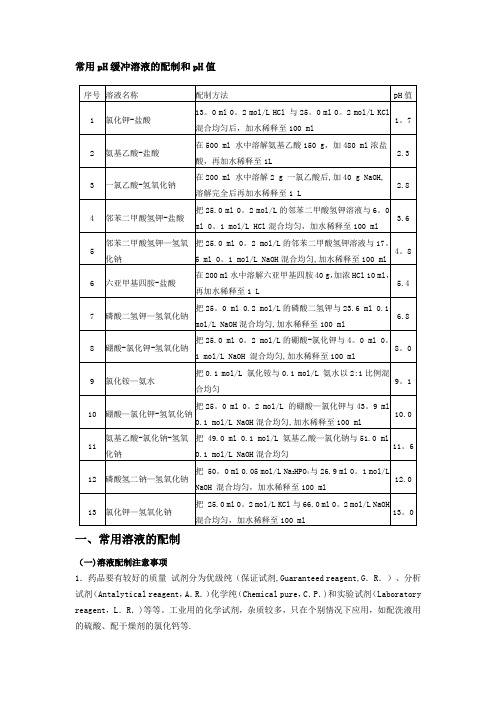
常用pH缓冲溶液的配制和pH值一、常用溶液的配制(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等.2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水.4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9。
08g,用蒸馏水溶解后,倾入1000ml容量瓶内,再稀释至刻度(1000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A。
R.)9。
47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1000ml容量瓶内,再加蒸馏水稀释至刻度(1000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
(三)0.15Mol/L PB液Na2HPO4·2H2O分子量=175.05 0.15Mol/L溶液含26.7g/L。
Na2HPO4·12H2O分子量=358。
22 0。
15Mol/L溶液含53。
7g/L。
NaH2PO4·H2O分子量=138.00 0.15Mol/L溶液含20。
7g/L.NaH2PO4·2H2O分子量=156.03 0.15Mol/L溶液含23。
4g/L。
常用缓冲溶液的配制和PH计校正溶液配置方法
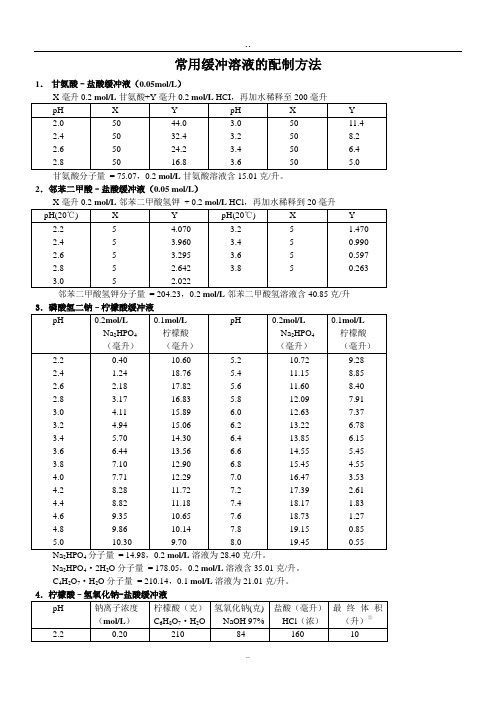
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)Na2HPO4分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
①???? 使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50%?氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
7.磷酸盐缓冲液Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。
Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
Na 2HPO 4·2H 2O 分子量 = 178.05,1/15M 溶液为11.876克/升。
KH 2PO4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )9.巴比妥钠-盐酸缓冲液(18℃)巴比妥钠盐分子量=206.18;0.04M 溶液为8.25克/升10.Tris –盐酸缓冲液(0.05M ,25℃)CHOCH2 NH2分子量=121.14;0. 1M 溶液为12.114克/升。
Tris 溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
常用PH缓冲溶液
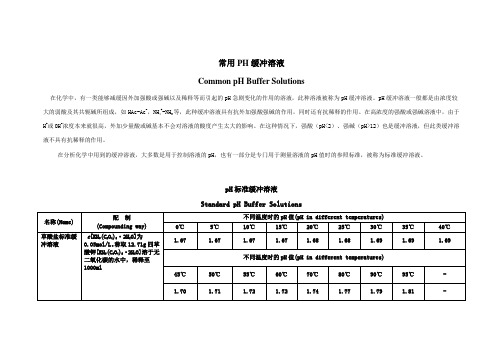
常用PH缓冲溶液
Common pH Buffer Solutions
在化学中,有一类能够减缓因外加强酸或强碱以及稀释等而引起的pH急剧变化的作用的溶液,此种溶液被称为pH缓冲溶液。
pH缓冲溶液一般都是由浓度较大的弱酸及其共轭碱所组成,如HAc-Ac-,NH4+-NH3等,此种缓冲溶液具有抗外加强酸强碱的作用,同时还有抗稀释的作用。
在高浓度的强酸或强碱溶液中,由于H+或OH-浓度本来就很高,外加少量酸或碱基本不会对溶液的酸度产生太大的影响。
在这种情况下,强酸(pH<2)、强碱(pH>12)也是缓冲溶液,但此类缓冲溶液不具有抗稀释的作用。
在分析化学中用到的缓冲溶液,大多数是用于控制溶液的pH,也有一部分是专门用于测量溶液的pH值时的参照标准,被称为标准缓冲溶液。
pH标准缓冲溶液
Standard pH Buffer Solutions
注:为保证pH值的准确度,上述标准缓冲溶液必须使用pH基准试剂配制。
常用pH缓冲溶液的配制和pH值
Preparation and pH Values of Common pH Buffer Solutions
B液:0.2mol/L碳酸钠溶液(21.2g无水碳酸钠,加水溶解,稀释至1L)以上两溶液按不同比例混合即可得到不同pH值的缓冲溶液
pH A的体积 B的体积水的体积
8.0 88.8 11.2mL 100
9.0 63.0 37.0mL 100
10.0 29.1 70.9mL 100
11.0 3.5 96.5mL 100。
常用pH缓冲溶液的配制和pH值

(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1000ml容量瓶内,再稀释至刻度(1000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O11.87g)用蒸馏水溶解后,放入1000ml容量瓶内,再加蒸馏水稀释至刻度(1000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
附表1磷酸盐缓冲液配制法(单位:毫升)pH1/15Mol/L Na2HPO41/15Mol/L KH2PO4pH1/15Mol /L Na2HPO41/15Mol/L KH2PO45.88.092.07.166.623.45.99.990.17.272.028.06.012.287.87.376.823.26.115.384.77.380.819.26.218.681.47.584.115.96.322.477.67.687.013.06.426.773.37.789.410.66.531.868.27.891.58.56.637.562.57.993.2 6.86.743.556.58.894.7 5.36.849.650.48.195.8 4.26.955.444.68.297.0 3.07.061.138.98.498.0 2.0(三)0.15Mol/L PB液附表20.15Mol/LPB液配制法pH0.15Mol/L Na2HPO4(ml)0.15Mol/L NaH2PO4(ml)6.426.573.56.637.562.57.061.039.07.272.028.07.481.019.07.687.013.0Na2HPO4·2H2O分子量=175.050.15Mol/L溶液含26.7g/L。
标准缓冲液的配制方法和PH计校正液(带目录)

标准缓冲液的配制⽅法和PH计校正液(带⽬录)标准缓冲液的配制及常⽤数据⼀、标准缓冲液pH值与温度对照表 (2)⼆、常⽤缓冲溶液的配制⽅法 (2)1.⽢氨酸–盐酸缓冲液(0.05mol/L) (2)2.邻苯⼆甲酸–盐酸缓冲液(0.05 mol/L) (2)3.磷酸氢⼆钠–柠檬酸缓冲液 (2)4.柠檬酸–氢氧化钠-盐酸缓冲液 (3)5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L) (3)6.⼄酸–⼄酸钠缓冲液(0.2 mol/L) (3)7.磷酸盐缓冲液 (3)8.磷酸⼆氢钾–氢氧化钠缓冲液(0.05M) (4)9.巴⽐妥钠-盐酸缓冲液(18℃) (4)10.Tris–盐酸缓冲液(0.05M,25℃) (4)1×TE Buffer (5)50×TAE Buffer 配制⽅法: (5)马来酸 M=116 (5)11.硼酸–硼砂缓冲液(0.2M硼酸根) (5)11.硼酸-硼砂缓冲液(0.2M硼酸根) (6)12.⽢氨酸–氢氧化钠缓冲液(0.05M) (6)13.硼砂-氢氧化钠缓冲液(0.05M硼酸根) (6)14.碳酸钠-碳酸氢钠缓冲液(0.1M) (6)15.“PBS”缓冲液 (6)三、实验室中常⽤酸碱的⽐重和浓度 (7)四、硫酸铵饱和度的常⽤表 (8)常见蛋⽩质分⼦量参考值(单位:dalton) (8)常见蛋⽩质等电点参考值(单位:pH) (9)元素的原⼦量表 (10)PH计校正溶液配置的标准⽅法 (13)⼀、标准缓冲液pH值与温度对照表⼆、常⽤缓冲溶液的配制⽅法1.⽢氨酸–盐酸缓冲液(0.05mol/L)⽢氨酸分⼦量= 75.07,0.2 mol/L⽢氨酸溶液含15.01克/升。
2.邻苯⼆甲酸–盐酸缓冲液(0.05 mol/L)X3.磷酸氢⼆钠–柠檬酸缓冲液Na 24Na 2HPO 4-2H 2O 分⼦量 = 178.05,0.2 mol/L 溶液含35.01克/升。
C 4H 2O 7·H 2O 分⼦量 = 210.14,0.1 mol/L 溶液为21.01克/升。
pH标准缓冲液的配制

pH标准缓冲液的配制
在使用PH酸度计时,我们需要定期对其进行计量检定,并符合国家有关规定。
测定前,应采用下列标准缓冲液校正仪器,也可用国家标准物质管理部门发放的标示pH 值准确至0.01pH 单位的各种标准缓冲液校正仪器。
下面简单介绍几种仪器校正用的标准缓冲液的配制方法:
1、草酸盐标准缓冲液:精密称取在54℃±3℃干燥4~5 小时的草酸三氢钾12.71g,加水使溶解并稀释至1000ml。
2、苯二甲酸盐标准缓冲液:精密称取在115℃±5℃干燥2~3 小时的邻苯二甲酸氢钾10.21g,加水使溶解并稀释至1000ml。
3、磷酸盐标准缓冲液:精密称取在115℃±5℃干燥2~3 小时的无水磷酸氢二钠3.55g 与磷酸二氢钾3.40g,加水使溶解并稀释至1000ml。
4、硼砂标准缓冲液:精密称取硼砂3.81g(注意避免风化),加水使溶解并稀释至1000ml,置聚乙烯塑料瓶中,密塞,避免空气中二氧化碳进入。
5、氢氧化钙:标准缓冲液于25℃,用无二氧化碳的水和过量氢氧化钙经充分振摇制成饱和溶液,取上清液使用。
因本缓冲液是25℃时的氢氧化钙饱和溶液,所以临用前需核对溶液的温度是否在25℃,否则需调温至25℃后再经溶解平衡后,方可取上清液使用。
存放时应防止空气中二氧化碳进入。
一旦出现浑浊,应弃去重配。
常用缓冲溶液配制方法

常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)X毫升0.2 mol/L甘氨酸+Y毫升0.2 mol/L HCI,再加水稀释至200毫升2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)X毫升0.2 mol/L邻苯二甲酸氢钾 + 0.2 mol/L HCl,再加水稀释到20毫升邻苯二甲酸氢钾分子量 = 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液24Na2HPO4·2H2O分子量 = 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量 = 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/毫升。
7.磷酸盐缓冲液Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液为85.61克/升。
Na 2HPO 4·12H 2O 分子量 = 358.14,0.2 mol/L 溶液为71.628克/升。
NaH 2PO 4·2H 2O 分子量 = 156.01,0.2 mol/L 溶液为31.202克/升。
磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH 2PO 4: pKa1=2.12,pKa2=7.21; Na 2HPO 4:pKa1=7.21,pKa2=12.32配酸性缓冲液:用NaH 2PO 4,pH =1~4,配中性缓冲液:用混合的两种磷酸盐,pH =6~8, 配碱性缓冲液:用Na 2HPO 4,pH =10~12。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
4.00
4.00
4.00
4.00
4.00
4.01
4.01
4.02
4.04
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
4.05
4.06
4.08
4.09
4.13
4.16
4.21
3.55
3.55
3.56
3.58
3.61
3.65
3.67
-
苯二甲酸氢盐标准缓冲溶液
c(C6H4CO2HCO2K)为0.05mol/L,称取于(115.0±5.0)℃干燥 2~3h的邻苯二甲酸氢钾(KHC8H4O4)10.21g,溶于无CO2的蒸馏水,并稀释至1000ml
(注:可用于酸度计校准)
不同温度时的pH值(pH in different temperatures)
6.89
-
硼酸盐标准缓冲溶液
c(Na2B4O7·10H2O)称取硼砂(Na2B4O7·10H2O)(3.80± 0.01)g(注意:不能烘!),溶于预先煮沸过 15~30min并迅速冷却的蒸馏水中,并稀释至1000ml。置聚乙烯塑料瓶中密闭保存。存放时要防止空气中的CO2的进入(注:可用于酸度计校准)
70℃
80℃
90℃
95℃
-
9.04
9.01
8.99
8.96
8.92
8.89
8.85
8.83
-
氢氧化钙标准缓冲溶液
在25℃,用无二氧化碳的蒸馏水制备氢氧化钙的饱和溶液。氢氧化钙溶液的浓度c[1/2Ca(OH)2]应在(0.0400~0.0412)mol/L。氢氧化钙溶液的浓度可以酚红为指示剂,用盐酸标准溶液[c(HCl)=0.1mol/L]滴定测出。存放时要防止空气中的二氧化碳的进入。出现混浊应弃去重新配制
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
11.84
11.71
11.57
11.45
-
-
-
-
-
注:为保证pH值的准确度,上述标准缓冲溶液必须使用pH基准试剂配制。
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
6.986.Biblioteka 56.926.90
6.88
6.86
6.85
6.84
6.84
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
6.83
6.83
6.83
6.84
6.85
6.86
6.88
pH标准缓冲溶液
Standard pH Buffer Solutions
名称(Name)
配 制
(Compounding way)
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
草酸盐标准缓冲溶液
c[KH3(C2O4)2·2H2O]为0.05mol/L。称取12.71g四草酸钾[KH3(C2O4)2·2H2O]溶于无二氧化碳的水中,稀释至1000ml
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
9.46
9.40
9.33
9.27
9.22
9.18
9.14
9.10
9.06
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
4.23
-
磷酸盐标准缓冲溶液
分别称取在(115.0±5.0)℃干燥2~3h的磷酸氢二钠(Na2HPO4)(3.53±0.01)g和磷酸二氢钾(KH2PO4) (3.39±0.01)g,溶于预先煮沸过15~30min并迅速冷却的蒸馏水中,并稀释至1000ml(注:可用于酸度计校准)
不同温度时的pH值(pH in different temperatures)
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
-
-
-
-
-
3.56
3.55
3.55
3.55
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
3.55
1.67
1.67
1.67
1.67
1.68
1.68
1.69
1.69
1.69
不同温度时的pH值(pH in different temperatures)
45℃
50℃
55℃
60℃
70℃
80℃
90℃
95℃
-
1.70
1.71
1.72
1.72
1.74
1.77
1.79
1.81
-
酒石酸盐标准缓冲溶液
在25℃时,用无二氧化碳的水溶解外消旋的酒石酸氢钾(KHC4H4O6),并剧烈振摇至成饱和溶液
不同温度时的pH值(pH in different temperatures)
0℃
5℃
10℃
15℃
20℃
25℃
30℃
35℃
40℃
13.42
13.21
13.00
12.81
12.63
12.45
12.30
12.14
11.98
不同温度时的pH值(pH in different temperatures)
45℃
