利用化学方程式的简单计算【最全】
根据化学方程式的简单计算

回 忆……
写出氢气在氧气中燃烧的化学方程式,并 标出各物质的质量比可表示为:
H—1 O--16
2H2 + O2 ====== 2 H2O 2×1×2 :16×2 : 2 ×(2+16) 4 : 32 : 36 若: 4 g : ( 32 )g : ( 36 )g 若: ( 2 ) g : ( 16 ) g : 若: ( 8 ) g : 64 g : 18 g ( 72 ) g
TiCl4 + Mg == Ti + 2MgCl2
24 x 48 24g
48 24 = 24g x 24 × 24g x= =12g 48
答:需要镁的质量为12g 。
根据化学方程式计算的注意事项:
(1)设的时候应该用: “设…的质量为x”,无单位 (2)化学方程式书写正确,一定要配 平!! (3)将已知量化成质量单位 (4)列比例式时,竖比=竖比
149 245 = 7.45g x 245 × 7.45g x= =12.25g 149
96 149 = y 7.45g y= 96×7.45g =4.8g 149
答:分解的氯酸钾的质量为12.25g ,放出氧气的质量为4.8g
3、在实验室里电解1.8g水,问要标准状况下可制得氢气多少升? (标准状况下氢气的密度为0.0899 g/L)(H 1 O 16)
例3:A+3B==2C+2D中,A与B的相对分子 质量之比为9:11,已知1.8gA与一定量 的B恰好完全反应生成5.1gD,
2:1 则此反应中B和C的质量比为_______
能力提升题:2.不纯物质的计算 例1:把氯酸钾和二氧化锰的混合物16克加热至 不再有气体放出,冷却后称得剩余固体质量为 11.2克。 求:(1)反应所生成的气体的质量; (2)混合物中二氧化锰的质量。 ★解题关键:
利用化学方程式的简单计算笔记

利用化学方程式的简单计算笔记
一、化学方程式计算的基本概念
化学方程式是一种表示化学反应的方式,其表达式由化学物质、化学键、反应条件和反应产物等元素组成。
在化学方程式中,我们可以看到反应物和生成物之间的质量关系。
因此,通过化学方程式,我们可以进行简单的化学计算。
二、利用化学方程式进行计算的步骤
1. 写出化学方程式:首先,我们需要写出与问题相关的化学方程式。
2. 找出已知量:在化学方程式中找出已知的物质和其质量。
3. 找出未知量:在化学方程式中找出未知的物质和其质量。
4. 利用化学计量数关系进行计算:根据化学方程式中的化学计量数和质量守恒定律,计算出未知物质的质量。
5. 写出答案:将计算结果写出,并给出单位。
三、例题解析
例如,我们有一个化学方程式:2H2 + O2 -> 2H2O。
已知氢气的质量为4克,求生成水的质量。
根据化学方程式,我们可以知道:
- 氢气的化学计量数是2,所以需要2份质量的氢气才能生成水。
- 已知氢气的质量为4克,所以生成水的质量 = 4克 2 = 8克。
因此,生成水的质量为8克。
四、练习题
1. C2H5OH + 3O2 -> 2CO2 + 3H2O,若已知乙醇的质量为克,则生成的二氧化碳的质量是多少?
2. Fe2O3 + 3CO -> 2Fe + 3CO2,若已知氧化铁的质量为80克,则生成的铁的质量是多少?。
利用化学方程式的简单计算最全

利用化学方程式的简单计算最全化学方程式是用化学符号和化学方程来描述化学反应的方式。
通过化学方程式,我们可以了解反应物与产物之间的物质的数量关系,从而进行计算。
下面将介绍几种常见的利用化学方程式进行简单计算的方法。
1.计算反应物与产物的物质的摩尔数关系:化学方程式中的化学式代表了物质里的原子或分子的数量。
根据方程式,可以计算反应物与产物的物质的摩尔数关系。
例如,对于反应式:2H2+O2->2H2O,可以得知每2摩尔的H2反应生成2摩尔的H2O。
2.计算反应物的摩尔数及质量:根据已知的反应物的摩尔数和化学式里的原子质量,可以计算反应物的质量。
例如,对于反应式:H2 + O2 -> H2O,已知2mol的H2,需要计算H2的质量。
根据氢气的摩尔质量(2g/mol),可以计算出质量为4g。
3.计算反应产物的摩尔数及质量:根据已知的反应物的摩尔数和化学式里的摩尔比,可以计算反应产物的摩尔数及质量。
例如,对于反应式:H2 + O2 -> H2O,已知4g的H2,需要计算产生的H2O的质量。
根据反应式的摩尔比为1:1,可以计算出摩尔数为2mol 的H2O,进而计算出质量为36g的H2O。
4.计算反应后剩余物质的摩尔数及质量:根据已知的反应物的摩尔数和化学式里的摩尔比,可以计算反应后剩余物质的摩尔数及质量。
例如,对于反应式:2H2 + O2 -> 2H2O,已知2mol的H2和2mol的O2,需要计算剩余的H2O的摩尔数和质量。
根据反应式的摩尔比为2:1,可以计算出剩余的摩尔数为1mol的H2O,进而计算出质量为18g的H2O。
5.计算反应过程中的气体的体积:对于气体反应,可以利用化学方程式计算反应过程中的气体的体积。
根据烧瓶法则(Avogadro's law),相同条件下,气体的体积与物质的摩尔数成正比。
例如,对于反应式:2H2 + O2 -> 2H2O,已知2mol的H2和1mol的O2,根据化学反应的摩尔比,可以计算出反应产生2mol的H2O。
教学案例:化学方程式的简单计算

化学方程式的简单计算在化学学科中,方程式是非常重要的概念,涉及到化学反应的基本过程。
化学方程式可以理解为化学反应过程的表达式,它表明了反应中各成分的摩尔比例和化学反应的程度。
化学方程式的表示有一定的规范,一般来说,它包括两部分:反应物和产物。
反应物通常写在左边,而产物则写在右边。
方程式中以箭头表示反应方向,箭头左侧表示反应物,箭头右侧表示产物。
然而,化学方程式的表达并不是简单的写出来,还需要进行一些简单计算。
以下是一些化学方程式的计算例子。
例1:氢气和氧气反应生成水的化学方程式是:H2 + O2 → H2O其中,H2和O2是反应物,H2O是产物。
根据方程式,可知一摩尔的H2和O2可以反应生成一摩尔的H2O。
问题: 20克的H2和20克的O2,可以反应生成多少克的H2O?解答:首先将质量转化为摩尔数。
根据元素的相对原子质量,可以计算出一摩尔的H2的质量为2g,一摩尔的O2的质量为32g。
因此,20克的H2相当于10摩尔,20克的O2相当于0.625摩尔。
根据化学方程式,可知一摩尔的H2可以生成一摩尔的H2O,因此10摩尔的H2可以生成10摩尔的H2O。
而一摩尔的O2可以生成一摩尔的H2O,因此0.625摩尔的O2可以生成0.625摩尔的H2O。
因此,总共可以生成10.625摩尔的H2O,相当于10.625 × (2+16) = 202.5克的H2O。
总结:在化学方程式的计算过程中,需要将质量转化为摩尔数,根据方程式中摩尔比例的关系,计算出反应物可以生成的产物的摩尔数,最后将摩尔数转化为质量即可。
例2:燃烧20克甲烷(CH4)需要多少克氧气(O2)才能完全燃烧?解答:首先可以写出甲烷燃烧的化学方程式:CH4 + 2O2 → CO2 + 2H2O其中,CH4是反应物,O2是反应物,CO2和H2O是产物。
根据化学方程式中的比例关系,一摩尔CH4需要两摩尔O2才能完全燃烧。
因此,20克的CH4相当于0.5摩尔。
【完整版】利用化学方程式的简单计算
(4)进行准确、熟练的数学运算(这是解题正确的保证)。
(5)要有完整的解题步骤和规范的书写格式。 (这是解题规范的必需)
2、根据化学方程式进行计算的步骤
(1)设未知数 ……………....…………设 (2)写出化学方程式 …...…… 写 (3) 写出有关物质的相对分子质量 (不忘乘以前面的化学计量数) 列 已知量和未知量 比 列比例式 (4) 求解 …...….…..………………… 解
↑
4.8克
练习三.实验室用13g锌粒与足量的稀硫酸反应制取氢气。 (已知:Zn+H2SO4===ZnSO4+H2↑) 计算:(1)生成氢气的质量为多少克?
(2)这些氢气在标准状况下的体积是多少升?
(标准状况下,氢气密度为0.0899g/L) 解: 设生成氢气的质量为X Zn+H2SO4===ZnSO4+H2↑ 2 65 13g X
第五章
化学方程式
课题三
利用化学方程式的简单计算
复习提问 以镁在空气中燃烧为例说明化学方程式的涵义之一。
镁在空气中燃烧反应中反应物与生成物之间的质量比
2Mg +
O2 ======
点燃
2 Mg O
2×24 :16×2 : (24+16)×2 48 : 32 : 80 若: 48克 :( )克 : ( ) 克 若:( )克 :( )克 : 40 克
(1) [解]:设可得到氧气的质量为X。 生成氯化钾的质量为Y MnO2 2 K C l O 3 ====== 2KCl +3O2 △ 245 149 96
↑
12.25克 245 12.25克 ------- = ------X 96
Y
X
245 12.25克 ------- = ---------149 Y
利用化学方程式的简单计算【最全】!

[知识要点梳理]知识点一:化学方程式的计算步骤实例:工业上,高温煅烧石灰石(主要成分是CaCO3)可制得生石灰(CaO)和二氧化碳.如果要制取1t氧化钙,需要碳酸钙多少吨?解:①根据题意设未知量设需要碳酸钙的质量为x。
②写出反应的化学方程式并配平CaCO3CaO+CO2↑③写出相关物质的相对分子质量10056和已知量、未知量x1t④列出比例式,求解=x==1.8t⑤简明地写出答案答:需要碳酸钙1。
8t。
【要点诠释】(1)化学方程式书写要正确,否则会一错全错;(2)化学方程式中体现的是各纯净物质间的质量关系,故只有纯净物的质量才能代入计算;(3)质量单位要统一,在解题过程中,已知量后一定要带单位,未知量求出后也要带单位;(4)解题要严格按照格式书写。
知识点二:利用化学方程式计算的规范格式及注意事项知识点一实例的规范解题格式如下:解:设需要碳酸钙的质量为x。
-—————-—-—-—————--——-—-—- 注意:未知数不能带单位CaCO3CaO+CO2↑—-—----—-—-—--———-——---化学方程式一定要配平10056x1t———-—----—--—---————----——已知量不要忘记带单位=x==1.8t------———----—————---——-- 计算结果要有单位答:需要碳酸钙1.8t。
【要点诠释】利用一种反应物或生成物的质量,计算出另一种反应物或生成物的质量的计算格式是本课题的重点:一解二设最后答,化学方程(式)不能差;准确寻找质量比,纯量代入不掺假;所有单位要一致,列式计算解决它。
知识点三:几种常见的计算类型1.常规题:已知反应物(或生成物)的质量,利用化学方程式求生成物(或反应物)的质量。
并且伴随着物质的体积、密度与质量间换算的有关计算。
(见经典例题透析类型一)2。
利用质量守恒定律来计算(见经典例题透析类型二)3。
巧解型:这类题主要是利用所给数据,找到已知量和未知量间的数量关系,间接解题(见经典例题透析类型三、四)【要点诠释】由于化学方程式体现的是各物质间的质量关系,若给定物质的体积、密度等条件,应把物质的体积转化为物质的质量.有些题目利用常规化学方程式不易解决的就要想办法看能否用差量法或者极值法等。
利用化学方程式的简单计算
根据化学方程式计算的注意事项:
1. 设未知量时一定要注意质量单位,已知量和未知量单 位不一致的,先换算成一致的再进行计算. 2. 化学方程式一定要注意配平,标明反应条件.气体.沉淀 符号,注意化学方程式的完整性. 3. 相关物质的相对分子质量写在相应的化学式下,一定 要注意用相对分子质量乘以化学式前的系数,已知量和 未知量写在相应相对分子质量的下边. 4. 计算结果的小数位保留按题中要求进行,若题中没有 要求,又得不到整数时,一般保留一位小数.
三、有关不纯反应物或生成物的计算。
1.化学反应方程式中不管是反应物还是生成 物,代入的都是纯物质的质量.如果遇到不纯 反应物或生成物,应将不纯物质换算成纯物质 的质量. 2.不纯物质和纯物质质量间的换算.
纯物质的质量 = 不纯物质的质量 ×纯度(质量分数)
四.关于质量和体积间的换算 足量的镁带在标准状况下与11.2升的氧气(密度 为1.43g/L) 充分燃烧,可以生成多少克氧化镁?
根据化学方程式计算的四种类型
1.已知反应物的质量求生成物的质量.
2.已知生成物的质量求反应物的质量
3.已知一种反应物的质量求另一种反 应物的质量. 4.已知一种生成物的质量求另一种生 成物的质量.
在进行化学方程式计算时常会出现以下一些错误:
①不认真审题,答非所问。
②元素符号或化学式写错。
③化学方程式写错或没配平。
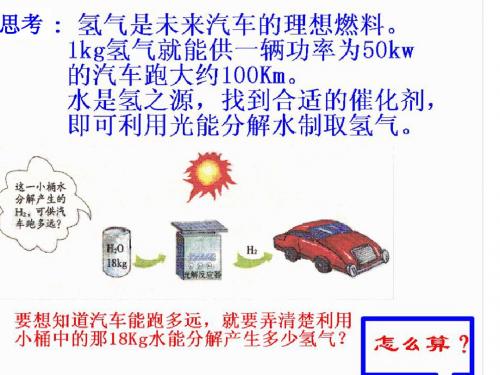
通电
2H2O 36
2H2↑+O2↑ 4 x x = 2Kg
18Kg
36 = 4 x 18Kg
18Kg水分解生成的氢气是2Kg。 所以,小桶中的水能使小汽车行驶: 2×100=200(Km)
一、已知反应物的质量求生成物的质量
例1:加热分解6 g高锰酸钾,可以得到多少克氧气? 解:设加热分解6 g高锰酸钾,可以得到氧气的质 量为x。 △ 2KMnO4 K2MnO4+MnO2+O2↑ 2×158 32 6g x
第五单元化学方程式课题3利用化学方程式的简单计算20232024九年级上化学人教知识必备典例解析课后

第五单元化学方程式(教用)课题3 利用化学方程式的简单计算一、知识必备知识点利用化学方程式进行简单计算1. 化学方程式的计算依据:(1)质量守恒定律;(2)化学方程式中各反应物、生成物之间的质量之比为一定值;(3)在化学方程式中,任意两种物质的质量变化量之比,等于这两种物质的质量份数之比,即等于这两种物质的相对分子质量(或相对原子质量)乘以其化学计量数的乘积之比。
2. 有关化学方程式的计算步骤:(1)设未知数(通常求谁设谁);(2)写出题目中相关的化学方程式;(3)写出相关物质的化学计量数与相对分子质量(或相对原子质量)的乘积以及已知量和未知量;(4)列出比例关系式(注意实际质量后面要带单位)并求解;(5)写出答案,答。
3. 计算时的常见错误:(1)未知数带有单位。
(2)所设物质的质量包含杂质的质量,或者包含未参加反应的物质的质量。
(3)已知物质的质量没有单位。
(4)化学方程式书写错误或者没有配平(这个错误会使计算题的得分降为1,甚至为0)。
(5)关系式中的数据没有与物质的化学式对齐。
(6)步骤不完整、数值计算错误、所答非所问等在其他学科也能犯的错误。
二、典例解析知识点利用化学方程式进行简单计算【典例解析】类型1 选填中利用化学方程式的计算例1 (2023•绥化)在化学反应A+2B=C+2D中,已知C和D的相对分子质量之比是22:9,当6.4gB与足量A完全反应后,生成3.6gD。
则在此反应中,B和C的质量比是()A.8:11B.2:11C.16:11D.16:9【答案】C【解析】解:设生成C的质量为x。
A+2B=C+2D22 2×9x=则生成C的质量为4.4g,所以在此反应中B和C的质量比是6.4g:4.4g=16:11。
例2 在A+B═C+2D的反应中,已知2.9g A跟4.9g B完全反应生成6g C,且D的相对分子质量为18,则生成的D的质量为 1.8g,A的相对分子质量为58。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
利用化学方程式的简单计算【最全】!work Information Technology Company.2020YEAR[知识要点梳理]知识点一:化学方程式的计算步骤实例:工业上,高温煅烧石灰石(主要成分是CaCO3)可制得生石灰(CaO)和二氧化碳。
如果要制取1t氧化钙,需要碳酸钙多少吨?解:①根据题意设未知量设需要碳酸钙的质量为x。
②写出反应的化学方程式并配平 CaCO3 CaO+CO2↑③写出相关物质的相对分子质量 100 56和已知量、未知量 x 1t④列出比例式,求解=x==1.8t⑤简明地写出答案答:需要碳酸钙1.8t。
【要点诠释】(1)化学方程式书写要正确,否则会一错全错;(2)化学方程式中体现的是各纯净物质间的质量关系,故只有纯净物的质量才能代入计算;(3)质量单位要统一,在解题过程中,已知量后一定要带单位,未知量求出后也要带单位;(4)解题要严格按照格式书写。
知识点二:利用化学方程式计算的规范格式及注意事项知识点一实例的规范解题格式如下:解:设需要碳酸钙的质量为x。
------------------------- 注意:未知数不能带单位CaCO3 CaO+CO2↑-----------------------化学方程式一定要配平100 56x1t --------------------------已知量不要忘记带单位=x==1.8t ------------------------- 计算结果要有单位答:需要碳酸钙1.8t。
【要点诠释】利用一种反应物或生成物的质量,计算出另一种反应物或生成物的质量的计算格式是本课题的重点:一解二设最后答,化学方程(式)不能差;准确寻找质量比,纯量代入不掺假;所有单位要一致,列式计算解决它。
知识点三:几种常见的计算类型1.常规题:已知反应物(或生成物)的质量,利用化学方程式求生成物(或反应物)的质量。
并且伴随着物质的体积、密度与质量间换算的有关计算。
(见经典例题透析类型一)2.利用质量守恒定律来计算(见经典例题透析类型二)3.巧解型:这类题主要是利用所给数据,找到已知量和未知量间的数量关系,间接解题(见经典例题透析类型三、四)【要点诠释】由于化学方程式体现的是各物质间的质量关系,若给定物质的体积、密度等条件,应把物质的体积转化为物质的质量。
有些题目利用常规化学方程式不易解决的就要想办法看能否用差量法或者极值法等。
实际解题没有固定的模式,还得具体问题具体分析。
[规律方法指导]本课题的主要内容就是有关化学方程式的计算,涉及到的题型有选择、计算等。
1.对于常规题就是根据化学方程式中各物质间的质量关系来计算。
a.计算中可能用到的公式有:(1)质量=密度×体积(2)分解率=已分解物质的质量/未分解物质的质量×100%(3)某物质的质量分数=某物质的质量/含该物质的总质量×100%(4)纯净物的质量=混合物的质量×纯度b.计算中易发生的错误:(1)题意理解不清,答非所问。
(2)化学方程式书写错误,使计算失去真正的依据。
(3)单位不统一,有时把体积直接代入计算。
(4)把不纯物质的量当作纯净物的量代入。
(5)粗心大意,求算物质的相对分子质量时出现错误。
解题时要注意认真分析题意然后仔细计算;对计算中易发生的错误要尽量避免。
2.有些题不需要写出化学方程式,直接利用质量守恒即可解决。
质量守恒法是利用变化前后物质质量保持不变这一原理进行求解。
运用守恒法的解题关键在于找出等量关系,往往从物质质量守恒或元素质量守恒着手。
[经典例题透析]类型一:基本计算题1、20g红磷完全燃烧可生成多少克五氧化二磷(精确到0.1g)同时消耗的氧气在标准状况下的体积是多少升(标准状况下,O2的密度是1.43g /L)(精确到0.01g/L)【思路点拨】在初中阶段,根据化学方程式计算的都是质量关系。
若要求出待求气体的体积数,则要将已求出的气体质量换算成体积;若有一定体积的气体参加反应,则先要换算成气体的质量。
【解析】首先正确写出反应的化学方程式,然后求出反应物、生成物之间的质量比,再把已知量、未知量写人相应物质的下面,然后列出比例式,求解。
所求的是气体的体积,得先求出质量,再换算成体积。
【答案】解:设可生成五氧化二磷的质量为x,消耗氧气的质量为y。
4P + 5O2 2P2O54×315×32 2×142=124=160=28420g y x= x==45.8g= y==25.8g在标准状况下,氧气的密度是1.43g/L,所以25.8g氧气的体积为18.04L。
答:20g红磷完全燃烧可生成45.8克五氧化二磷,消耗的氧气的体积是18.04L。
【总结升华】根据化学方程式计算时首先要注意解题格式和步骤一定要准确;另外注意根据化学方程式求出的是物质间的质量比,当涉及到气体体积时,应通过气体的密度进行计算;还有就是计算时要注意单位问题。
举一反三:【变式1】中国登山协会为纪念我国首次攀登珠穆朗玛峰成功50周年,再次组织攀登珠峰活动。
阿旺扎西等一些登山运动员成功登顶。
假如每名运动员冲顶时消耗自带的液氧4.8Kg。
求:(1)这些氧气在标准状况下的体积是多少升(标准状况下氧气密度为1.43g/L)(2)在实验室用高锰酸钾为原料,制取相同质量的氧气,需要多少千克高锰酸钾?(3)用这种方法给登山队员供氧,是否可行,简述理由。
【变式2】下面是某位同学做得一道计算题,请指出他的错误:题目:3.25gZn和足量的盐酸反应制取H2,问可制得H2的质量是多少?解:设可得H2为xg。
Zn+HCl==ZnCl+H2↑65 13.25g x65:1=x:3.25g x==211.25g答:可制得H2211.25g。
错误:(1)_______________________________________;(2)_______________________________________;(3)_______________________________________。
类型二:利用质量守恒法计算题2、在A+B=C+2D中,已知2.9gA跟4.9gB完全反应,生成6gC,又知道D的相对分子质量为18,则A的相对分子质量为多少?【思路点拨】本题可以利用质量守恒法解,质量守恒法是利用变化前后物质质量保持不变这一原理进行求解。
【解析】由题意得知2.9gA和4.9gB是完全反应的。
根据质量守恒定律可知,产物C和D的质量之和应等于反应物的总质量,因此生成D的质量为:(2.9g+4.9g)-6g=1.8g。
然后再根据AD反应的质量比等于其相对分子质量×分子个数之比,然后求出A的相对分子质量。
【答案】解:设A的相对分子质量为x,由题意得生成D的质量为:(2.9g+4.9g)-6g=1.8gA+B=C+2Dx 2×182.9g 1.8g= x==58答:A的相对分子质量为58。
【总结升华】运用守恒法的解题关键在于找出等量关系,往往从物质质量守恒或元素质量守恒着手。
举一反三:【变式3】将含有15gA,10gB,9gC的粉末状混合物充分加热,发生化学反应后,A剩余3g,B增加到25g,C已消耗完,并有气体D放出,反应过程中,各物质质量变化的比值A∶B∶C∶D为()A.5∶4∶3∶2 B.4∶5∶3∶2 C.3∶2∶4∶5 D.2∶3∶5∶4【变式4】A、B、C三种物质各15g,它们相互化合时,只生成30g新物质D,若再增加10gC,A与C正好完全反应,则A与B参加化学反应的质量比是_________________。
类型三:利用差量法计算题3、将若干克锌粒投入到50.6g稀硫酸中,称得反应完成后溶液的质量为63.2g。
求反应生成氢气多少克?【思路点拨】本题可以利用差量法来解决。
差量法是根据题中相关量或对应量的差值求解的方法,它把化学变化过程中引起的一些物理量的增加或减少的量放在化学方程式的右端,作为已知量或未知量,利用对应量的比例关系求解。
差量法解题关键是弄清这个“差”是谁与谁之间的差,如何与化学方程式联系起来。
【解析】从反应的化学方程式可知,若有65g的锌参加反应,可以生成2g 氢气,那么反应后溶液的质量就增加了(65-2)g。
现已知反应前后溶液的质量增加了(63.2-50.6)g。
若生成的氢气的质量为x,列比例式,x即可求出。
【答案】解:设反应生成氢气的质量为x。
Zn+H2SO4==ZnSO4+H2↑质量差652(65-2)=63x(63.2g-50.6g)=12.6g=x==0.4g答:反应生成氢气的质量为0.4g。
【总结升华】差量法是化学解题典型方法之一,最大优点是:化难为易,化繁为简。
差量法计算只是这一类计算题的一种解题方法,本题还有其它解法。
举一反三:【变式5】将一含杂质的铁粉10g投入足量100g稀盐酸中(杂质不与稀盐酸反应),反应后过滤得到滤液的质量为105.4g,求铁粉中铁的质量分数。
【变式6】将一根10g铁钉放入100g硫酸铜溶液中,过一段时间取出铁钉进行洗涤、干燥、称量,发现铁钉的质量为10.8g,求参加反应的铁的质量。
类型四:利用极值法计算题4、3g木炭和5gO2在密闭容器中完全反应,下列叙述正确的是()A.产物全是CO B.产物全是CO2C.产物是CO、CO2的混合物D.木炭过量,产物为CO【思路点拨】极植法解题就是先把思路引向极端状态,使问题简化从而顺利得出结论,然后再回头来认识现实问题,将计算结果和题意相比较得出结论。
【解析】考虑两个极端,若产物全部是CO,根据化学方程式2C+O22CO,反应中C与O2的质量比为3:4;若产物全部是CO2,根据化学方程式C+O2CO2,反应中C与O2的质量比为3:8;而题中C与O2的质量比为3:5,。
可见产物既不是纯CO也不是纯CO2,应是二者的混合物。
【答案】C【总结升华】极值法解题可培养学生严谨的逻辑推理能力和丰富的想象力,解题时注意思考寻找哪个量作为极值。
举一反三:【变式7】现在有含杂质的铁28g,加入足量的稀硫酸后产生0.9g氢气,则铁中所含杂质可能是( )A.Al B.Zn C.Mg D.Mg和Al【变式8】两种金属的混合物6g,加入到足量的稀硫酸中,共收集到0.2g 氢气(假设生成的氢气全被收集),则这种金属混合物可能是()A.锌、铜B.镁、铁C.铁、锌 D.镁、铝答案与解析:【变式1】【解析】本题主要通过化学计算灵活解决生产、生活和科研中的一些实际问题。
根据密度=质量/体积,求出氧气的体积;再根据化学方程式计算所需高锰酸钾的质量。
【答案】解:(1)4.8 Kg氧气在标准状况下的体积为:4.8 ×1000g/1.43g/L=3356.64L(2)设需要高锰酸钾的质量为x2KMnO4K2MnO4+MnO2+ O2↑31632x 4.8 kg316/32= x /4.8 Kg x =47.4 kg(3)不行。
