化学平衡图像分析
化学平衡特殊图像分析

• (2)加热到400℃~500℃?
• (3)压强采用?,原因是
。
• (4)常用浓来吸收而不用水,?
• 勒夏特列原理适用已达平衡体系,不仅适 用于化学平衡也适用其他平衡,判断下列 事实能用勒夏特列原理解释的
• 1)可逆 2)平衡 3)移动 4)符合事实
• 注意理解减弱不消除
NO2与N2O4的平衡体系,加压后颜色加深后变 浅最终比原来深
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
• 工业合成氨的条件
重点总结
• 20MPa-50MPa、500℃左右
• 工业制硫酸:
• 在硫酸工业中,通过下列反应使转化为, 已知常压下平衡混合气体中体积分数为 91%,(1)在生产中常用过量的空气是为 了?
新课导入
交点
最点
熟记T、P、C改变时对速率及平 衡的影响规律
2. 勒夏特列原理适用已达平衡体 系,不仅适用于化学平衡也适用 其他平衡
1、对议: 对议:在一定条件下,将X和Y两种物质按不同的比例放 入密闭容器中反应,平衡后测得X,Y的转化率与起始时 两物质的物质的量之比nx/ny的关系如图所示,则X,Y 的反应方程式可表示为( )
A. 2X+Y 3Z B. 3X+2Y 2Z C. X+3Y Z D. 3X+Y Z 组议:1)总结交点为平衡点,最点为平衡点时对横纵坐
标的要求
2)勒夏特列原理应用中的疑惑 ?
体积分数---温度图
图像意义:同样的反应物分别充入同样的容 器,控制不同的温度,经历相同时间,测 定某一组分的体积分数,关键找出平衡点
化学平衡图像3
看清楚横纵坐标
横坐标:t、T、P(影响因素)
化学平衡移动(图像)

实验数据作出下列关系图下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化
剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
√C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
√D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催
化剂效率较高
1.下列图象中,不能表示反应A2(g)+ 3B2(g) 2AB3(g)(△Q>0)平衡体系 的是…( D )
V(逆)
V(逆)
0 ⑤增大压强
t
0
⑥减小压强
t
增大压强时,正逆反应速率都
增大,但
增大程度相同 ,减小压强时,正逆反应速率都 减小 ,但 减小程度相同 ,故平衡 不 移动。
2、压强变化对化学平衡的影响
结论: mA(g)+nB(g) pC(g)+qD(g)
对于有气体参与的反应:
(1)若m+n==p+q : 增大压强,平衡往气体分子数减少的方向移动 ;
二、速率-时间图:可用于:
பைடு நூலகம்
1) 已知引起平衡移动的因素,判断反应是
吸热或放热,反应前后气体体积的变化。
2) (已知反应)判断引起平衡移动的因素。
v v正
•引起平衡移动的因素是
v逆
t1
t2
增大反应物浓度,平衡 t 将向 正 方向移动。
v v正
•引起平衡移动的因素是 减小生成物浓度,平衡
v逆
t1
t2
t 将向 正 方向移动。
1、以mA(g)+nB(g) 为例
qC (g);
若增大压强,或升高温度,重新达到平
衡v正、v逆变化如图,则△Q_<__0, m+n__>_q
常见化学平衡图像及分析

问题二:在t2时刻,其他条件不变,只增大压强,若m+n>p+q,:
1、条件改变的瞬时,正、逆反应速率如何变化?随后正、逆反应 速率如何变化? 2、画出改变条件后的v-t图像,并分析平衡如何移动?
问题三:在t3时刻,其他条件不变,
①只升高温度,若该反应△H>0,画出改变条件后的v-t图像。
0
时间
实用文档
练习2
2A(g) + B(g)
2C(g)
【看图技巧2】
C “定一议二”,
的 百
P1 < P2
T2 > T1
正反应是_吸_热反应.
分 含 量
T2 P1 T1 P2
T1 P1
0
t
实用文档
四、转化率—压强(或温度)图像分析
mA(g) + nB(g) pC(g) + qD(g)
等压线
A 的
常见化学平衡图像及分析
实用文档
历年高考查情况
实用文档
2017考试大纲
• 通过对自然界、生产和生活中的化学现象 的观察,以及实验现象、实物、模型的观 察,对图形、图表的阅读,获取有关的感 性知识和印象,并进行初步加工、吸收、 有序存储。
• 将分析和解决问题的过程及成果,能正确 地运用化学术语及文字、图表、模型、图 形等进行表达,并做出合理解释。
温度
p+q,
△H<
0
练习2: •对于反应mA(g)+nB(g)
等压线
A%
200℃
300℃
P
pC(g)+qD(g)
请根据图像求:m+n = p+q, △H >0
化学平衡图像
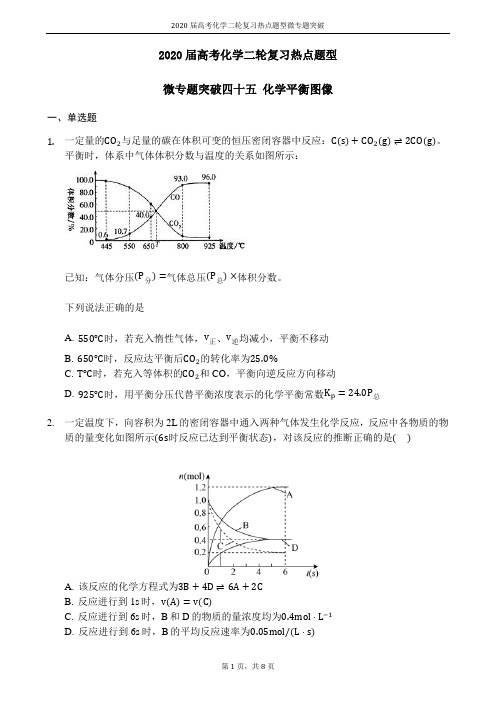
2020届高考化学二轮复习热点题型微专题突破2020届高考化学二轮复习热点题型微专题突破四十五化学平衡图像一、单选题1.一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)⇌2CO(g)。
平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。
下列说法正确的是A. 550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动B. 650℃时,反应达平衡后CO2的转化率为25.0%C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数K p=24.0P总2.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是()A. 该反应的化学方程式为3B+4D⇌6A+2CB. 反应进行到1s时,v(A)=v(C)C. 反应进行到6s时,B和D的物质的量浓度均为0.4mol⋅L−1D. 反应进行到6s时,B的平均反应速率为0.05mol/(L⋅s)3.在一定条件下,使10mol SO3在体积固定为2L的密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g),则下图中正确的是(M表示混合气体的平均相对分子质量)()A. B.C. D.4.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)()A. B.C. D.5.下列叙述与图象对应符合的是()A. 对于达到平衡状态的N2(g)+3H2(g)⇌2NH3(g)在t0时刻充入了一定量的NH3,平衡逆向移动B. 对于反应2A(g)+B(g)⇌C(g)+D(g)△H<0,p2>p1,T1>T2C. 该图象表示的化学方程式为:2A=B+3CD. 对于反应2X(g)+3Y(g)⇌2Z(g)△H<0,y可以表示Y的百分含量6.在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0达到甲平衡,仅改变某一条件后,达到乙平衡.对此过程的分析正确的是()A. 可能是减小了反应物的浓度,反应物X2转化率一定减小B. 可能是加入了催化剂,反应物X2百分含量(X2%)将增大2020届高考化学二轮复习热点题型微专题突破C. 可能是缩小了容器的体积,但该反应的平衡常数保持不变D. 可能是升高了温度,该反应的平衡常数一定减小7.反应:2X (g)+Y(g)⇌2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如下图所示,下列判断正确的是()A. P1>P2T1>T2△H<0B. P1>P2T1<T2△H<0C. P1<P2T1>T2△H>0D. P1<P2T1<T2△H>08.在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)⇌xC(g)△H=?,符合图(a)所示的关系,其中w(C)为C的质量分数,由此推断关于图(b)的说法正确的是()A. P3>P4,y轴表示A的转化率B. P3<P4,y轴表示B的体积分数C. P3<P4,y轴表示混合气体的平均相对分子质量D. P3>P4,y轴表示混合气体的密度9.图中表示2NO(g)+O2(g)⇌2NO2(g)△H<0,能正确反映该可逆反应变化的图象是()A. B.C. D.10.某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g)⇌pC(g)的速率和平衡的影响图像如下,下列判断正确的是()A. 由图1可知,T1<T2,该反应正反应为吸热反应B. 由图2可知,该反应m+n<pC. 图3中,表示反应速率v(正)>v(逆)的是点3D. 图4中,若m+n=p,则a曲线一定使用了催化剂11.在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)ΔH<0下列分析中正确的是()A. 图Ⅱ研究的只是t0时使用催化剂对反应速率的影响B. 图Ⅰ研究的是t0时缩小容器体积对反应速率的影响C. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高D. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂12.某密闭容器中发生如下反应:2X(g)+Y(g)⇌Z(g);△H<0如图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是()A. t3时降低了压强B. t5时提高了温度C. t1−t2时该反应的平衡常数小于t6时反应的平衡常数D. t6时刻后反应物的转化率最低二、填空题13.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)⇌2NO(g)△H>0,已知该反应在240℃,平衡常数K=64×10−4.请回答:(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字2020届高考化学二轮复习热点题型微专题突破母序号).14.元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4−(绿色)、Cr2O72−(橙红色)、CrO42−(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(2)CrO42−和Cr2O72−在溶液中可相互转化。
化学平衡图像分析课件

3.化学反应速率及化学平衡图像的分类及特点 一般来说,图像类型可分为单一函数图和复合函数图两 类,在每一类中如果根据横坐标的不同含义,可把图像分为两 大 类 : 时 间 (t) 类 和 压 强 (p) 类 或 温 度 (T) 类 。 以 mA(g) + nB(g) pC(g)+qD(g),ΔH 为例。
已知
编号 ① ② ③
起始状态物质的量 n/mol
N2
H2
NH3
1
4
0
平衡时 NH3 的物质 的量 n/mol a
1.5
6
0
1
0.5a
m gg≥4m
m
x 2
∶
g
3x 2
=1∶4,解之得
x=2(g-4m)。
设 n(NH3)平衡为 y mol,可得:
4∶a=
g
3x 2
∶y,所以
y=(g-3m)a。
答案:①1.5a ②0 0.5 ③2g-4m g-3ma
1.将 3 mol A 和 1 mol B 混合于一体积可变的密闭容器 P 中,以此时温度、压强和体积作为起始条件,发生如下反应:
3A(g)+B(g) 2C(g)+D(g),若反应过程中保持起始温度和 压强不变,达到平衡时 C 的浓度为 w mol/L,请回答:
如将②、③折算为①,因此三者为等效平衡.
2.等效平衡规律 1在定温、定容条件下,对于反应前后气体分子数改变的 可逆反应,只要改变起始时加入物质的物质的量,如通过可逆 反应的化学计量数之比换算后的物质的物质的量与原平衡相 同,则两平衡等效. 2在定温、定容条件下,对于反应前后气体分子数不变的 可逆反应,只要反应物或生成物的物质的量的比值与原平衡 相同,则两平衡等效. 3在定温、定压条件下,只要按化学计量数换算后的物质 的物质的量之比与原平衡相同,则两平衡等效.
人教选修4第二章第三节化学平衡(3)化学平衡图像分析

A、A点时混合物的V(正)> V(逆)
B、A点比B点反应速率快 C、n>p D、m+n>p
N%
A. C .B
压强
2、可逆反应2A+B
2C(g) △H<0 ,随温度变化气体平均摩尔质量
如图所示,则下列叙述正确的是 C A.A和B可能都是固体 B.A和B一定都是气体
六、几种特殊的图像 2.对于化学反应 mA(g)+nB(g) ⇌ pC(g)+qD(g),L 线上
所有的点都是平衡点(如下图)。L 线的左上方(E 点),A 的百分 含量大于此压强时平衡体系的 A 的百分含量,所以,E 点 v 正 >v 逆;则 L 线的右下方(F 点),v 正<v 逆。
练习:
1、mM(s)+ nN(g) pQ(g) △H<0 。在一定温度下平衡时N%与压强
m + n > p +q ( > = < )
三、百分含量(转化率)--时间--温度(压强)图象
可逆反应 mA(g) + nB(g)
pC(g) +qD(g)
C%
B%
A
T1
T1
B
T2
T2
t1
t2
1、T1 < T2 ( > = < ) 正反应是 放热 反应
(放热、吸热)
tБайду номын сангаас
t
2、T1 > T2 ( > = < ) 正反应是 放热反应 (放热、吸热)
t1是到达平衡状态的时间。试回答: (1)该反应的反应物是:
A; (2)反应物的转化率是:
浓度
化学平衡图像分析

a+b>c 正反应为放热反应
a+b>c 正反应为吸热反应
a+b<c 正反应为吸热反应
a+b=c 正反应为放热反应
5.速率—温度(压强)图
化学平衡的图像分析
对于反应 2SO2 + O2
SO3 △H<0 ,升温或增压时,
v(正)、v(逆)的变化如下图所示:
v
v
v(逆)
v(正)
v(正)
v(逆)
T
T升高,v(逆)加快程度大于v(正)
p
p升高,v(正)加快程度大于v(逆)
下列各图是温度或压强对反应2A(s)+2B(g) 应
化学平衡的图像分析 2C(g)+D(g)(正反
为吸热反应)的正逆反应速率的影响,其中正确的图象是( )
V V正
V
V逆
V正
V逆
A
T
v
V正
V逆
C
P
T
B
V
V逆 V正
P
D
6.平衡线 与 非平衡点
化学平衡的图像分析
α a
3.作出判断: 依题意仔细分析作出正确判断。
这样的图像!
添加标题
情况1:加入催化剂
添加标题
情况2:当a+b=c时, 采用改变压强的方法
添加标题
B%
可逆反应m A(s)+n B(g) e C(g)+f D(g),反应过程中,当 其它条件不变时,C的百分含量(C%) 与温度(T)和压强(P)的关系如下图, 下列叙述正确的是( )
达平衡后,加入催化剂则C%增大
如图所示,反应:X (g) + 3Y (g) 2Z (g)(正反应为放热反应),在不
2024届高中化学一轮复习课件:平衡思想——化学平衡图像的解读与分析

是提高转化率,原料利用率高,而影响速率与转化率的主要因素就是浓度、温
度、压强与催化剂,其中温度与压强是试题中经常考查的因素。
(2)从速率、转化率、产率、纯度等角度分析,选择最佳条件。如针对反应速率
时,思考方向为如何提高浸出速率,如何提高反应速率等;针对平衡转化率、产
的利用技术,将二氧化碳转化为能源是缓解环境和能源问题的方案之一。CO2耦合乙苯
(C6H5—C2H5,简称EB)脱氢制备苯乙烯(C6H5—C2H3,简称ST)是综合利用CO2的热点研究
领域。制备ST涉及的主要反应如下:
a.EB(g) ⇌ ST(g)+H2(g) ΔH1
b.CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
-1
kJ·mol 。回答下列问题:
(2)研究表明,SO2催化氧化的反应速率方程为v=k( -1)0.8(1-nα')。式中:k为反应速率常数,
′
随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2的转化率,n为常数。在α'=0.90时,
将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图所示。
1
的催化氧化:SO2(g)+ O2(g)
2
SO3(g) ΔH=-98 kJ·mol-1。回答下列问题:
(1)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,
在0.5 MPa、2.5 MPa 和5.0 MPa压强下,SO2平衡转化率α随温度的变化如图所
示。反应在5.0 MPa、550 ℃时的α= 0.975
化学平衡图像分析

【变式训练3】
C(SO23)
c
b
向绝热恒容密闭容器中通入SO2和NO2, a 一定条件下使反应
SO2(g)+NO2(g) SO3(g)+NO(g) 达到平衡, SO3的浓度随时间变化的示
Y、Z、W四种物质的聚集状态为( )A
A.Z、W均为气体,X、Y中有一种是气体 B.Z、W中有一种是气体,X、Y皆非气体 C .X、Y、Z、W皆非气体 D.X、Y均为气体,Z、W中有一种为气体
【变式训练2】
上图可以表示该反应吗?
A2(g)+3B2(g)
2AB3(g) △H<0,
走进高考1
(2011·天津,6)向绝热恒容密闭容器中通入SO2和NO2, 一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g) 达到平衡,正反应速率随时间变化的示意图如图所示。
(1)该反应的反应物是_____A_; (2)反应物的转化率是____4_0_%;
(3)该反应的化学方程式为______. 2A B+3C
【变式训练4】
反应X(g)+Y(g) 2Z(g)(正反应放热), 如图表示该反应在t1时达到平衡,在t2时因改变某个 条件而发生变化的曲线。则图中的
t2时改变的条件是( C)
Δt1 Δt2
t
意图如图所示。由图可得出的正确结论
是( abcd)。
a.反应在c点达到平衡状态 b.生成物的反应速率:ab段小于bc段
c.该反应为放热反应
d.Δt1=Δt2时,SO2的转化率:a~b段小于 b~c段
【例题2】
表示800℃时A、B、C三种气体物质的浓度随时间 的变化情况,t1是到达平衡状态的时间.试回答:
2.2 课时5 化学平衡图像分析(22张PPT) 课件 高二化学人教版(2019)选择性必修1

T3
放
<
5.几种特殊的图像
化学反应mA(g)+nB(g) ⇌pC(g)+qD(g),L线上所有的点都是平衡点。
1、L线的左上方(E点),A的百分含量大于此压强时平衡体系的Байду номын сангаас的百分含量,所以,E点v正>v逆;2、L线的右下方(F点),v正<v逆。
mM(s)+ nN(g) ⇌ pQ(g) △H<0 。在一定温度下平衡时N%与压强的关系如图,下列有关叙述正确的是 A、A点时混合物的V(正)> V(逆) B、A点比B点反应速率快 C、n>p D、m+n>p
三、做判断:先拐先平数值大,定一议二
B
1.可表示为可逆反应2A(g)+B(g) ⇌ 2C(g) △H < 0的图象是( )
2.化学反应mA(g)+nB(g) qC(g)+pD(g),l 线上所有的点都是平衡点,A的百分含量随压强的变化曲线图如下图所示,下列表述不正确的是(单选)( )
化学平衡图像分析
第二章 化学反应速率与化学平衡
1.掌握浓度-时间图(重点);2.理解某物质的转化率(或百分含量)-时间-温度(或压强)图;3.理解某物质的转化率(或百分含量)-温度(或压强)图(难点);4.了解其他特殊的平衡图像。
化学平衡图像题的解题方法
1.一看轴,即横坐标和纵坐标的意义。2.二看点,即一些特殊点如起点、拐点、交点、终点、最高点的意义。3.三看线即弄清图像中线的走向和变化趋势。4.四看辅助线弄清图像斜率的大小。 5.五看量的变化如浓度、温度、转化率、物质的量斜率的变化等。
t0~t1,t2~t3,t3~t4,t5~t6
增大反应物浓度
使用催化剂
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
D.若升高温度,X的体积分数增大,则该反应的H>0
走近高考
3、 (07年全国卷I)如图是恒温下某化学反应的反应速率随反应时间变化的 示意图,下列叙述与示意图不相符合的是(C )
反 v ′ 平衡态Ⅱ (正) 应 v (正) 速 平衡态Ⅰ v (逆) ′ 率
v (逆)
0
反应时间
A.反应达平衡时,正反应速率和逆反应速率相等 B.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II D.同一种反应物在平衡态I和平衡态II时浓度不相等
2 2
(3)达到平衡时,SO2的转化率为____________。
(4)平衡时容器内压强与起始时压强之比为___________。 答案:
(1)0.08mol/L· min ;0.04mol/L· min (2) 0.2mol/L; 0.1mol/L (3)80% (4)11:15
C2(SO3) —————— C2(SO2)C(O2) (5)①该反应平衡常数的表达式K=______________,数值为_______。 160 C(SO3) ——————) ②若反应方程为 达到平衡后,平衡常数K1=________ (O C(SO2)C0.5 2
走近高考
1、(06重庆)已知反应mX(g)+nY(g) qZ(g)的
△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下
列说法正确的是( B )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍 C.降低温度,混合气体的平均相对分子质量变小 D.增加X的物质的量,Y的转化率降低
走近高考
4.(08四川卷)在密闭的容器中进行如下的反应: H2(g)+I2(g) 的正确的判断是( D ) 2HI(g)
在温度T1和T2时,产物的量和时间的关系如下图所示,符合图象
碘 化 氢 的 量 T1 T2
时间
A.T1>T2,△H>0 C.T1<T2,△H>0
B.T1>T2,△H<0 D.T1<T2,△H<0
⒍等效平衡
⒎外界条件对化学平衡的影响 ⒏化学平衡常数及其简单应用 ⒐焓变、熵变与化学反应方向
⒊图象识别要联系外界条件对化 学反应速率、化学平衡的影响
命题情况
全国卷Ι和实施新课改地区高考情况分析
高考卷 全国卷 宁夏卷 2007年 选择题 6分 选择题 6分 填空题 4分 山东卷 填空题 4分 2008年 选择题 6分 选择题 6分 填空题 14分 选择题 6分
图像问题解题步骤 (1) 看懂图象: ①看面(即纵坐标与横坐标的意义) ②看线(即线的走向和变化趋势)
③看点(即起点、拐点、交点、终点)
④看要否要作辅助线(如等温线、等压线等) (2) 联想规律:研究方程式,联想外界条件对化学反应速 率和化学平衡的影响规律,得出结论 (3) 作出判断:根据图像表现出来的关系与方程式得出
(8)画出对应的v-t图象
⑴
⑵瞬间 V正、V逆
⑶比较 V正、V逆 <
⑷转化率 SO2 、 O2
⑸平衡浓度 SO2、O2、SO3
⑹密度 ρ
⑺
⑻图象 v-t
改变 条件
升温 降温 增压 减压
平衡 移动
M
↓ ↑ ↑ ↓
—
—
← → → ← → ←
↑ ↑ ↓ ↑ ↓ ↑ ↓ ↓ ↑ ↓ - -
↓ ↑
↓ ↑
↑ ↓ ↑ ↓ ↑ ↓
的结论相对比,作出正确判断
3、一定温度下,将2mol SO2和1mol O2置于一个2 L的密闭容器中,发生如下反应:
,达到平衡后,测得c(SO3)=0.8mol/L,完成下
列问题: 计算:
(1)若从开始到平衡,所需时间为10min,则用SO2、O2表示该反应的
平均速率分别为 V O )=_______ ; V (O2 )= ________。 (S 2 (2)达到平衡时 C O )=________; C(O )=__________。 (S
(a-aα)2 (b- aα/2) 后,SO2的转化率α为___________________。(列出含α的关系式即可)
(aα)2 ______________ =160
⑤若该温度下,某时刻测得c(SO2)=0.5mol/L ,c(O2)=0.25mol/L,
否 c(SO3)=0.5mol/L此时该反应是否处于平衡状态:_________。 (6)若一定条件下,反应 2A (g)
的正确图象是_____ C
2SO3(g)△H<0
横、纵坐标的意义 折点:达到平衡状态 平行线:P增大,SO3%降低
横、纵坐标的意义 交点:平衡状态 一条线:T升高, V加快 二条线:T升高,V正>V逆, 平衡正向移动
横、纵坐标的意义 一条线:P增大,SO2转化率增大 二条线:T升高,SO2转化率降低
知识构建
化学反应速率 (快慢)
表示方法、单位 公式法: 简单计算 化学计量数之比法: 内因: 影响反应速率的因素
化 学 反 应
化学平衡 (程度)
概念: 特征:动、等、定、变、逆 判断标志:
外因:
化学平衡常数: mA(g) + nB (g)
pC(g)+qD(g)
K=____________________ 影响平衡的因素:浓度 温度 压强
(2)右图中表示NO2的变化的曲线是______。 b 用O2表示从0~2s内该反应的平均速率v=______________。 0.0015mol/L· s (4)为使该反应的反应速率增大,且平衡向正反应方向移动
c 的是__________。
a、及时分离出NO2气体 b、适当升高温度 c、增大O2的浓度 d、选择高效的催化剂
海南卷
填空题 15分
填空题 8分
典型例题:
一定温度下,将2mol SO2和1mol O2置于一个2 L的密闭容器中,发生如下反应:
达到平衡后,测得 C 3= m -, (O0 o 1 S ) . lL 8
完成下列问题: 1.该反应达到平衡后,现改变条件,研究以下问题,并将所得结果填在表格中 相应位置: (1)判断平衡移动方向 (2)改变条件的瞬间,V正、V逆如何变化? (3)达到新平衡前,V正、V逆的大小关系? (4)达到新平衡时,SO2、O2的转化率如何变化? (5)达到新平衡时,SO2、O2、SO3的浓度如何变化? (6)达到新平衡时,混合气体密度如何变化? (7)达到平衡时,混合气体平均分子量如何变化?
热烈欢迎各位领导、老师光临指导
抚顺县高中化学组
刘俊丽
考纲分析
考点透析 ⒈化学反应速率的概念、表示方 法及简单计算 ⒉影响化学反应速率的因素 ⒊可逆反应的特点 ⒋化学平衡的概念、特征及标志 ⒌化学平衡与化学反应速率之间 的内在联系 ⒉平衡状态的判定要联系化学平 衡状态的五大特征理解掌握 能力解读
⒈有关化学反应速率及化学平衡 的概念要准确理解,计算要规范 仔细
m+n___p+q > 放热 正反应是___ 反应
08山东卷பைடு நூலகம்高温下,某反应达平衡,平衡常数
C(CO) C(H2O) K= C(CO )C(H ) 。恒容时,温度升高, H2 浓度减小。下列说 2 2
—————
)
法正确的是(
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小 D.该反应化学方程式为CO + H2催化剂高温 CO2 + H2
K=K12 则K1与K的关系为_________。
K2=K ③若增大压强后,平衡常数为K2,则K2和K的关系为__________;若升高温 K>K3 度后,平衡常数为K3,则K3和K的关系为_________。(填“>、=、<”)
④若维持温度不变,起始时SO2、O2的浓度分别为amol/L 、bmol/L,则平衡
(3)某温度下,平衡浓度符合下式:c(CO2)·(H2)=c(CO)·(H2O),试 c c
判断此时的温度为______℃。
练习:对于可逆反应mA(g) + nB (g)
,
pC(g)+qD(g)
有下列图象,填写下面空白:
> m+n___p+q
T1> ___T2
放热 正反应是___ 反应
< p1____p2 < m+n___p+q
↑ ↓ ↑ ↓ ↓ ↑
↓ ↑ ↑ ↓ ↑ ↓
-
—
> > < > <
↑ ↑ ↓ ↓
↑ ↓ ↑ ↓
增大 c(SO2)
减小 c(SO2)
↓ ↑ ↑ ↓
V
V(正)
V(逆)
V(正)
V
V(正)
V(正)
V(逆)
0
V(逆)
V(逆)
t
① 升高温度
0
t
② 降低温度
V
V(正) V(正)
V(逆)
V
V(正) V(逆)
V(逆)
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t ℃
K 700 0.6 800 0.9 830 1.0 1000 1.7 1200 2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K =______。 (2)该反应为______反应(选填吸热、放热)。
K=
B(s)+2C(g) 达到平衡后,该反应平衡
C2(C) 常数表达式为____________。若升温后K值增大,则该反应的△H_____0。 > C2(A)
——
