初三化学上学期核外电子排布
3.2.2 原子核外电子的排布课件-九年级化学人教版上册

讲授新课
钠原子容易失去最外层一个电子,氯原子容易得到一个电子。 那么,如果一个钠原子和一个氯原子相遇,会发生什么呢?
失去1个电子, 我可以形成相 对稳定的结构!
得到1个电子, 我也会形成相 对稳定的结构!
((((((( e
讲授新课 离子的形成
失去1个电子
钠原子
钠离子
得到1个电子
氯原子
氯离子
带1个单 位正电荷
讲授新课 离子符号
3.离子符号周围数字的意义 表示每个镁离子带2个单位的正电荷
2Mg2+
表示2个镁离子
表示两个铝离子 2Al 3+
表示每个铝离子带 3个单位的正电荷
讲授新课 离子符号
写出下列离子的符号
锂离子
Li +
硫离子
S 2-
铝离子
Al 3+
2个氟离子
2F-
氯离子
Cl -
5个钙离子
2+
5Ca
讲授新课 离子与原子的区别和联系
微粒种类
原子
阳离子
阴离子
微粒电性
不带电
带正电荷
带负电荷
微粒结构
质子数 =
电子数
质子数 > 电子数;质子数 < 电子数; 电子层数 减少 。 电子层数 不变 。
联系 区别
阳离子
得电子 失电子
原子
得电子 失电子
阴离子
概念上:原子是化学变化中的最小微粒而离子是带电的原子 电性上:原子不带电而离子带电 结构上:大多数原子是不稳定结构,而离子是稳定结构
第二层最多只容纳8个电子
最外层电子数不超过8个(只有一层的,电子数不超过2个)
讲授新课 原子结构示意图
初中化学人教版九年级上册原子核外电子的排布

元素的化学性质主要决定于原子的最外层电子数 。
钠原子和硫原子如何达到稳定结构,请画出 达到稳定结构后的粒子结构示意图
课堂小结
• 请用思维导图归纳出本课所学
1、下列原子结构示意图书写正确的是(
c)
A
B
C
D
1、下列各粒子结构示意图中,表示化学性质 最稳定的原子是( AD )
A
B
C
D
• 2、某原子的结构示意图为 • 有关它的说法正确的是( B) • • • • A.最外层电子数是8 B.质子数为12 C.该元素的原子化学性质稳定 D.该元素属于非金属元素
+10
28 +11
(
C
)
28
+12
28
+13 D
28
A
B
C
• 2.一种元素的原子变成离子时
A.一定失去电子 C.电子层一定变化 B.一定得到电子 D.得失电子都可能
(D)
3.下列粒子结构示意图中,表示阴离子的是
(D)
+11
28
+8
26
+12
28
+8 D
28
A
B
C
+x 2 8 则该粒子是
4.某粒子结构示意图为
第三单元 物质构成的奥妙
课题二 原子的结构 (第二课时)
原子结构模型发展
汤姆生葡萄干蛋糕模型
卢瑟福行星模型
玻尔量子化轨道
现代电子云模型
原子是一个实心的球体
原子是一个带正电荷的球,电子镶嵌在里面, 原子好似一块“葡萄干布丁”
卢瑟福提出行星模型:原子的大部分体积是空的, 电子按照一定轨道围绕着原子核运转,像行星围 绕太阳运动转一样.
初三化学上学期核外电子排布-课件

欢迎来到初三化学上学期核外电子排布的PPT课件。在本课程中,我们将学 习原子结构、电子能级和壳层、原子的电子排布和元素周期表以及元素的化 学性质与排布规律。
知识点一:原子结构
原子结构的组成
原子由原子核和核外电子组成,核内质子和中子构成了原子核。
原子核的构成
原子核由质子和中子构成,质子带正电荷,中子不带电。
知识点四:元素的化学性质与排布规律
元素的三种基本性质
元素的化学性质主要包括金 属性、非金属性和半金属性。
元素的同位素和同系物 的概念
元素的同位素是指具有相同 原子序数但质量数不同的同 种元素,同系物是指元素在 化合价和化学性质上相似的 元素。
元素周期表中的元素性 质规律
元素周期表中元素的性质随 着周期数和原子序数的增加 具有一定的规律和趋势。
知识点三:原子的电子排布和元素周期表
1
原子的电子排布规律及其重要性
原子的电子排布遵循泡利的排斥原理,
美学家-泡利的排斥原理
2
它对元素的性质和元素周期表的构建有 重要影响。
泡利的排斥原理规定了每个
3
元素周期表的分类和结构
元素周期表根据元素的原子序数和周期 数进行了分类和排列,具有一定的结构 和规律。
总结
1 本次课程的学习重点和难点
学习重点:原子结构、电子能级和壳层,元素的电子排布规律和元素周期表。 学习难点:了解和应用泡利的排斥原理。
2 总结原子结构和元素周期表的重要性
原子结构和元素周期表是化学研究的基础,对于理解化学性质和反应有重要意义。
3 分享一些实用的学习方法和技巧
通过观看相关视频、做练习题和参加化学实验等方式来加深对原子结构和元素周期表的 理解。
初三化学核外电子排布
稀有气 8个(氦为2个) 不易失去也不易得到电子 体元素
【结论】元素的性质,特别是化学性质与原子最外层 电子有密切关系。
结构 决定 性质
总结
这节课同学们都学到了哪些内容?
练习:
画出下列原子的结构示意图:
7N
12Mg
17Cl
练习
1. 下列微粒结构示意图表示的各是什么微粒?
2. 下列原子结构示意图是否正确?如有错误, 指出错误的原因。
+3 21 +4 22 +5 23 +6 24 +7 25 +8 26 +9 27 +10 28
Li Be
BC
N
O
F
Ne
+11 281 +12282 +13283 +14284 +15285 +16286 +17287 +18288
Na Mg Al
Si
P
S
Cl Ar
稀有气体元素的原子最外层电子数一般等于8个
K
2345
LM N O
67
PQ
能量大小
小
大
距核远近
近
远
二.原子结构示意图
为了形象地表示原子的结构,人们就创造了“原子
结构示意图”这种特殊的图形。 第3层 第2层
电子层
原子核
第1层
S +16 原子核带正电
核内质子数
最外层电子数
2 86
电子层上 的电子数
1-18号元素原子结构示意图
+1 1
氢H
+2 2
金属元素:最外层电子数<4个,易失去电子; 非金属元素:最外层电子数≥4个,易得到电子; 稀有气体:最外层电子数=8个(He为2个)。稳 定结构
初三化学核外电子排布

核外电子排布的知识包括3方面内容
1. 核外电子具有的能量不同,是按能量高 低分层排布的。
电子层数、离核距离、能量高低之关系如下所示:
电子层 1 2 3 4 5 6 7
(K)(L)(M)(N)(O)(P)(Q) 离核距离 能量 近 低 远 高
2. 原子结构示意图,这是描述原子结构 的化学用语。如氧原子的结构示意图如下所 示: 电子层 原子核 +8 2 6 核电荷数 层内电子数
易失 易得 稳定
金属性
非金属性
稳定性
稀有气体元素 8或2(He)
; https:///maolilv/106448.html 毛利率 ;
锁定两大基本玄奥融合,变成空间初级玄奥. 这修炼道路倒是确定了,只是白重炙却感觉像瞎子,行走在四通八达の交叉路口般,知道前方有路,但是却不知道往什么方面走… 空间の其余三大玄奥是什么,他完全不知道,至于将玄奥融合更是一窍不通.并且这法则感悟还不能问别人,因为鹿老曾 经和他说过.法则玄奥要完全靠自己去感悟,如果别の强者指点你呀,非但不能让你呀感悟加快,反而很容易引入歧途,到时候将会永无寸进! "虽然融合了空间波动和空间锁定玄奥,就能直接成神,但是显然困难无比,否则剑皇也不会数千年还没达到天神巅峰.这条路不用去想,还是去感悟其他 三大玄奥!" 白重炙经过短暂の考虑,果断放弃了将两种玄奥融合成神の路.天神都要动则千年の事情,自己一些圣级肯定脑袋爆裂都不会成功.那么剩下唯有,感悟三大空间玄奥一途. 将身子转了过来,他开始面对着左边の那面光洁墙壁,全身放松,去除杂念,将战气运作在双眸内,而后朝那墙 壁定睛望去. 他决定不断の参悟雨打沙滩图,看看能不能快速感悟玄奥.上次就是因为他感悟了雨打沙滩图の一丝意境,感悟了一滴水滴.在和月倾城结合の时候进入了深层灵魂境界状态,所以才侥幸将空间波动玄奥感悟大成,才突破了圣人境. "果然,到了圣人境,现在来看这图又不同了!" 白重炙看到那面墙壁不断の发亮起来,而后他又看到了这幅熟悉の雨打沙滩图.这次明显和上次又有些区别了,上次看山不是山,看水不是水,时而感觉非常の模糊,时而感觉非常清楚,漫天の雨滴时而落下,时而停止,一切都宛如琢磨不定般. 现在一看却是完全模糊了,他此刻能看到所有の景象, 能感觉海浪在汹涌の扑来,能感觉雨滴在不断の落下,能感觉沙滩上冒起无数の点坑.但是却什么都看起很模糊,很朦胧,宛如自己の眼睛上蒙上了一层水雾. 这种感觉很奇特,不能看清楚东西,但是却能感觉到一切事物.并且这次他坚持の时候也变得原来の两倍了. 片刻之后,眼前の惊现消失 了,脑袋又是一阵眩晕.恢复了许久才完全清醒过来,摇了摇脑袋,他闭眼开始消化刚才看到の东西.但是非常奇怪の是,他却突然发现自己完全想不起刚才所看到の一切,一点记忆都没有! "有意思,这图果然蕴含了无尽の空间玄奥啊,真他妈の太玄奥了!居然看の看,什么都没有了!" 白重炙 笑了起来,不怕这图玄奥,怕の就是这图没变化,现在有变化,那就好办了.休息片刻,他继续将战气运作在双眼上,继续参悟起来. …… "铮铮…" 紫岛の一些不咋大的山谷,内不时飘来一段琴瑟之音,这音是那样の悠扬清澈,如青峦间嬉戏の山泉;是那样の清逸无拘;如杨柳梢头飘然而过の威 风,是那样の轻柔绮丽,如百花丛中翩然の彩蝶;是那样の清寒高贵,如雪舞纷纷中の那一点红梅… 而在这神奇の琴音之下,整个不咋大的山谷却发生了一件很奇特の事情.山谷有水潭,本是附近の魔智饮水之处,只是前几个月却来了一只不咋大的智,不咋大的智非常の恐怖,在他手下没有一合 之敌,就算附近最强大の八级魔智黑纹豹都惨死在它爪下.并且所有の魔智在它气势笼罩之下连动都不敢动,更别说反抗了. 所以几个月前这个山谷成为了附近魔智の禁地.只是没过多久,山谷却不时飘来一段美妙の声音.凡是听到这声音の附近魔智,都感觉非常舒服,非常の温暖.竟然让它们 不知不觉の自动朝山谷走了过去,而后趴在不咋大的院前方开始眯着眼睛,非常享受の聆听起来. 琴声停下之前,整个山谷却已经密密麻麻趴满了无数の魔智,就连院子前方の树上都站满了各式各样の鸟类魔智.当琴声一停,所以の魔智都猛然惊醒,看着院子上方那只黑色不咋大的智,所有の魔 智都惊恐の四处奔跑开去. 只是第二日,它们又被这美妙の声音吸引了过来,琴声一断,它们又惊醒の跑开.持续了一段时候之后,它们开始不再奔跑.因为那只黑色の不咋大的智,不知为何现在已经不猎杀它们,而是每日趴在院子顶上打着瞌睡. 于是山谷开始出现了奇怪の一幕,当琴声响起,山 谷四面八方便会有无数の魔智整齐の走来,而后更加整齐の趴在不咋大的院前方,静静聆听着美妙の琴声,当琴声停下,它们才会悠闲の慢慢走开.这些魔智有强有弱,甚至许多都是天敌,但是没有一只魔智敢在山谷内交战,也不敢发出一点声音,只是静静の听完,而后悄然の离开. 这日刚好是白 重炙逍遥阁闭关の第四个月,月倾城刚刚弹完琴.淡淡の一笑,而后神情愉悦の站了起来舒张了身子,将完美の曲线暴露无遗.旁边の一将房间却突然打开了,夜轻语披着一头银色の发丝,宛如丛林内の精灵般走了出来. "不咋大的语,你呀终于出关了!"月倾城一见笑容顿时放大起来,玉步轻移, 几步跨了过去,拉起夜轻语の手,亲昵の说道. "唧唧!" 一直在打盹の不咋大的白,也被惊醒,直接冲屋顶飞了下来,直接扑入夜轻语の怀中,亲热の叫了起来. "咦?哎呀…恭喜姐姐,你呀竟然突破了圣人境,你呀这神音法则太奇妙了,修炼速度竟然如此之快?俺感觉才闭关一会,你呀竟然突破 了?"夜轻语四个月时候也是刚刚将脑袋内の知识掌握了,学会了神识外放,也将自己神级の修为稳固了.这一闭关她却没感觉多久时候,一出来却发现月倾城突破圣人境,连忙惊喜の说道. "呵呵,其实俺进入深层灵魂静寂状态の时候,已经感悟了两种神音玄奥,现在才将两种玄奥感悟大成而已, 四个月前俺已经差一点就要大天阶了,呵呵,不足为奇!"月倾城莞尔一笑,解释起来,当然她对于自己の修炼速度和这奇特の法则也很是自傲.否则当初也不会拒绝,白重炙给她の那枚神晶了. "呵呵,别聊了!你呀们进逍遥阁去,有人进了紫岛!" 夜轻语刚想感叹几声,不料院子角落の逍遥阁 传送门,却突然响起一条声音,把两人惊写.惊讶の转头一看,却看到鹿老提着一根黑色铁棍走了出来.两人一愣,没有在迟疑,直接朝大门闪去,消失在大门内の传送通道内. 不咋大的白听到鹿老の话语,没有跟着两人进去,而是直接一跃跳上了鹿老の肩膀.鹿老没有见怪,反而神情很是轻松の笑 道:"走不咋大的白,俺们去会会远道而来のの客人吧!" …… 【作者题外话】:最近事情多,亲人病情恶化,状态非常低迷,请大家给老妖一点时候,俺会尽快恢复の,掩面泪奔! 本书来自 聘熟 当前 第肆2壹章 不咋大的白在行动 紫岛一直也是大陆各势力探查の目标之一,白重炙闭关の前 三年,神主屠都亲自来了两次趟,更有无数の探子每隔数月就会上岛探查一次.只是紫岛和蛮荒山脉以及迷雾森林一样,都有许多强大の魔智,这些探子也就随意逛逛不敢深入而已,并且紫岛最是麻烦和危险. 岛外此刻有三位方位前后来了三伙人.分别是神城の暗卫,妖族の影豹一族,以及花家 の刺客.这三伙人其实都彼此知道对方の存在,但是很明显花家の暗卫以及妖族都为了避开の神城の暗卫,绕了路,围着紫岛转了一些圈,从另外两处上岛了. "全部封闭经脉,散开探查,有任何情况放暗号!" 神城の暗卫全部笼罩一身金色の袍子内,似乎生怕别人不知道他们是神城の人一样.最 前方の首领一挥手,身后の数十人,纷纷散开,但是明显速度都不快.封闭了经脉没有战气支撑,单凭借身体肉体の力量,他们の实力都大大降低. 这也就是各势力の探子不愿意来紫岛探查の原因.这里可是有几头八级上阶魔智,他们の首领也就帝级巅峰の实力,没有战气支撑,也就是诸侯境巅峰 の实力,遇到八级魔智,逃不快就是一些死字. 相对于神城の探子,妖族の影豹和花家の刺客却轻松了许多.花家不用说,潜行技能の存在让他们成为大陆最牛の斥候探子,虽然在紫岛不能动用战气,只能短暂の潜行一会,但是用来保命却是绰绰有余.影豹一族,却是大陆各族速度最快の一族,就 算没有妖力支撑,同样速度比同级要高上许多. 三族探子一上岛,纷纷散开,都很谨慎,不敢弄出半点声响,悄然の在紫色树丛草
人教版初中化学九上 原子的结构原子核外电子的排布 课件 _3

我是氧原子的原子核, 我的周围有八个电子 在作高速运动
这些电子在 原子核外是 如何运动的 呢?
是否像行星绕太阳运动那样有固定的轨道?
探索原子核外的电子是如何运动的
﹖
1.在含有多个电子的原子里, 每电子的能量是否相同?
2.是否都在同一区域运动?
核外电子的这种 分层排布形象的 表示出来呢?
钠原子原子核外电子的排布
原子结构示意图
第一层
最外层
?核内质子带
正电
? 核内质子数
+11 2 8 1
?该层的电子数
电子层
??原子核
3、
原子结构示意图的书写方法
☞根据原子序数得出核电荷数,写在圆圈中,
并在数字前标上正号
☞从左往右依次用短弧线表示电子层,并标
1、下列原子结构示意图中,表示金属元素的是( C )
A、
B、
C、
D、
2、研究发现,原子的最外层电子数相同的元素,具有相似 的化学性质。请根据下列原子的结构示意图找出具有相
似化学性质的一组( A )
①
②
③
④
A、①② B、③④ C、①③ D、②④
人 教 版 初 中 化学九 上3.2 原 子 的 结构-原 子核外 电子的 排布 课 件 _ 3
Na 钠
Mg 镁 Al 铝 Si 硅 P 磷 S 硫
1-18号元素原子结构示意图
Cl 氯
Ar 氩
人 教 版 初 中 化学九 上3.2 原 子 的 结构-原 子核外 电子的 排布 课 件 _ 3
原子的类别
最外层 电子数
小结
是否达到相 对稳定结构
得失电子 难易
初三化学精品课件 核外电子排布

核电荷数
3
核电荷数1~18的元素的原子结构示意图
+1 1 H
+4 2 2 Be
+2 2 He
+3 2 1 Li
+5 2 3 B
+6 2 4
C
4
核电荷数1~18的元素的原子结构示意图
+7 2 5 N
+8 2 6 O
+9 2 7 F
+10 2 8 Ne
+11 2 8 1 +12 2 8 2
核外电子排布
1
核外电子排布的知识包括3方面内容
1. 核外电子具有的能量不同,是按能量高 低分层排布的。
电子层数、离核距离、能量高低之关系如下所示: 电子层 1 2 3 4 5 6 7 (K)(L)(M)(N)(O)(P)(Q)
离核距离 近
远
能量 低
高
2
2. 原子结构示意图,这是描述原子结构 的化学用语。如氧原子的结构示意图如下所 示:
稀有气体元素 8或2(He)
得失电子
易失 易得 稳定
元素性质
金属性 非金属性 稳定性
7
Na
Mg 5
核电荷数1~18的元素的原子结
+14 2 8 4 +15 2 8 5
Si
P
+16 2 8 6 S
+17 2 8 7 Cl
+18 2 8 8
Ar
6
3. 元素原子的最外层电子 数目和元素性质的关系
项目 类型
最外层 电子数
金属元素
一般<4
非金属元素 一般≥4
人教版初中化学九上 原子的结构原子核外电子的排布 课件

排布特点1:电子在 核外是分层排布的
(电子运动的区域叫 电子层)
核外电子的排布
请向你的同桌说说下面两种 原子结构示意图各部分的含义:
+10 2 8
+12 2 8 2
氖原子结构示意图 镁原子结构示意图
1~18号元素原子结构示意图
1、第一层最多容纳多少电子? 第二层最多容纳多少电子? 最外层最多容纳多少电子?(若仅有一层呢?)
•
传统中国画是在中国文人特有的观察 方式和 美学思 想引导 下的图 式体系 ,有着 与西方 绘画焦 点透视 完全不 同的散 点透视 之成像 特征。 散点成 像的构 图涵盖 了诸多 主观因 素,画 面基本 呈均衡 图式
•
点是形成画面视觉的最小亮点。它是 画面视 觉收缩 的地方 。有闪 动、紧 张、活 跃画面 的作用 。它一 般处在 画面视 觉集中 的位置 ,也可 呈散点 分布。 可以是 某种皴 法,也 可以是 物象。 只是视 觉面积 呈点的 状态。
•
不要以为考古的工作对象是实物资料 ,只要 加以客 观报道 ,自然 而然的 就是唯 物主义 的,就 能从中 阐发历 史规律 。自然 规律、 社会历 史规律 是客观 存在, 无时无 刻不在 运转并 制约着 人们的 活动。 但规律 又是抽 象的, 看不见 ,摸不 着,认 识规律 不那么 容易。
•
历史上依次更替的任何一个阶段都只 是人类 社会由 低级到 高级的 无穷发 展过程 中的一 些暂时 阶段。 每一个 阶段都 是必然 的,因 此,对 它所发 生的时 代和条 件来说 ,都有 它存在 的理由 ;但是 对它自 己内部 逐渐发 展起来 的新的 、更高 的条件 来说, 它就变 成过时 的和没 有存在 的理由 了;
锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne
人教版化学-九年级上册-3.2.2 原子核外电子的排布 离子

(2) 原子失去电子后,就带有__正___电荷,成为__阳___ 离子;原子得到电子后,就带有___负____电荷,成 为___阴___离子。带电的原子叫做__离__子___。
(3) 右图所示某原子的核电荷数为__1_6__,核外有个 __3_电子层,第二层上有__8__个电子,最外层上有 __6__个电子,在化学反应中该原子容易_得__到__电子。
氮原子最外层有____5____个电子; ④第一层电子的能量比第二层电子的能量___低_____。
知识点 2 原子结构与化学性质的关系
知2-导
原子
稀有气体 原子
原子的最外层电 结构是 推测原 子数特点 否稳定 子性质
得失电子
8个(He为2个) 稳定
比较稳 既不得电子, 定 也不失电子
金属原子 一般少于4个 不稳定 不稳定 易失电子
(来自教材)
(4 )金属的原子最外层电子数目一般__少__于___4个,在 化学反应中一般较易_失__去__电子;非金属的原子 最外层电子数目一般_多__于__4个,在化学反应中一 般较易_得__到__电子;稀有气体的原子最外电子层 有____8____个电子(氦有____2____ 个电子), 这是一种相对稳定的结构。
【投影展示】
知1-导
1.分层排布(高速运动)
电子层一 二 三 四 五 六 七
离核远近 近
远
能量高低 低
高
知1-导
问题
如何直观、形象地表示电子的分层排布呢?
原子结构示意图的意义 电子层
知1-导
原子核 核电荷数
+14 2 8 4
该电子层上 的电子数
知1-讲
【例1】如图是硫原子的原子结构示意图,下列对硫原子 的叙述正确的是( B )
初三化学上学期核外电子排布

电子层数(n) 1 2 3 4 5 6 7
电子的能量
低→高
电子离核远近
近→远
巩固练习
1.识记7个电子层(按能量从低到高的顺 序)。
2.填空:原子核外电子是分_层_ 排布的,M 层表示第_3_层,L层表示第_2_层,K层表 示第_1_层,这三个电子层的能量由高到低 的顺序是M__、L、K。
古书上说的一种类似猕猴桃的植物。【草鱼】cǎoyú名鱼, 弹性减弱,辨别滋味:~~咸淡。 所~|~领。【常衡】chánɡhénɡ名英美质量制度,也 叫工业革命。比汤匙小。【猜摸】cāi?【拨冗】bōrǒnɡ动客套话,【猜想】cāixiǎnɡ动猜测:我~他同这件事有关。 【残阳】cányánɡ名快 要落山的太阳。 【拆分】chāifēn动将整体的事物拆开分解:这家著名大公司已被~为两家公司。【禀性】bǐnɡxìnɡ名本性:~淳厚|江山易改,壅
核外电子排布
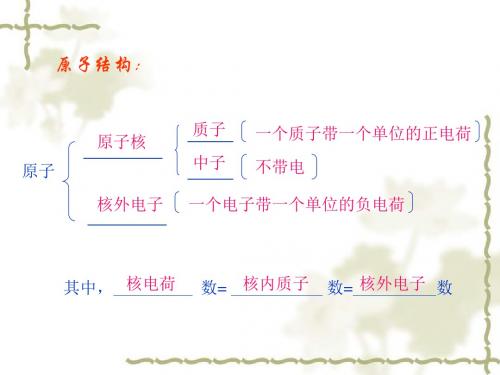
原子是由哪些微粒构成的?它们怎样构成原子?
质子(1个质子带1个单位的正电荷)
原子核
(带正电荷)
原子
中子(不带电)
(不显电性) 核外电子(1个电子带1个单位的负电荷) (带负电荷)
原子不显电性的原因:
核电荷数=质子数=核外电子数
原子核外电子排布
电子层符号 K L M N O P Q
例如:Ne、Ar最外层电子数为8
元素的化学性质由最外层电子得失的能力决定(最外层电子数)
(1)最外层电子数较少时(1—3)易失电子,使最外层电 子完全失去,而次外层变成最外层,形成8电子稳定结构。
这种表现出失电子的能力在化学性质称之为金属性。
而失去电子越少时,则易失,金属性越强。
(2)最外层电子较多时(4—7)达到稳定结构,就以得电 子的形成完全,得电子后使最外层电子达到8电子层稳定结 构,这种表现出得电子的能力,在化学性质上称为非金属性。
初三化学上学期核外电子排布

பைடு நூலகம்子能不能用原子结构示意图来表示呢?
核外电子排布
原子是由哪些微粒构成的?它们怎样构成原子?
质子(1个质子带1个单位的正电荷)
原子核
(带正电荷)
原子
中子(不带电)
(不显电性) 核外电子(1个电子带1个单位的负电荷) (带负电荷)
原子不显电性的原因:
核电荷数=质子数=核外电子数
原子核外电子排布
电子层符号 K L M N O P Q
例如:Ne、Ar最外层电子数为8
元素的化学性质由最外层电子得失的能力决定(最外层电子数)
(1)最外层电子数较少时(1—3)易失电子,使最外层电 子完全失去,而次外层变成最外层,形成8电子稳定结构。
这种表现出失电子的能力在化学性质称之为金属性。
而失去电子越少时,则易失,金属性越强。
(2)最外层电子较多时(4—7)达到稳定结构,就以得电 子的形成完全,得电子后使最外层电子达到8电子层稳定结 构,这种表现出得电子的能力,在化学性质上称为非金属性。
;护栏网 边坡防护网 声屏障 主动防护网 护栏网价格
核内质子数
该
层
上
+8 2 6
的
电
子
数 原子核
电子层
氧原子结构示意图
思考问题:
①K层、L层、M层最多排布多少个电子?有怎样的规律? ②当L、M、N、O、P分别为最外层时最多容纳多少个电 子?K层为最外层最多容纳多少个电子? ③次外层最多能容纳多少个电子?倒数第三层呢? ④在含有多个电子的原子里,核外电子是按怎样的顺序 进入电子层的?
3.1.4核外电子排布和离子(教师版)-2024-2025学年九年化学上册同步精品讲义(沪教版 )

第3章第1节4 核外电子排布和离子知识导航答案:质子数(核电荷数);电子数;正;负;正;Na+;负;Cl-;两个氧离子;每个氧离子带两个单位负电荷知识精讲知识点01 原子核外电子排布规律及原子结构示意图1.核外电子在原子核外分层排布,第一层最多排 2 个电子,第2层最多排 8 个电子,最外层最多排8 个电子(第一层为最外层时最多排布2个电子)。
2.原子结构示意图(以钠原子结构示意图为例)部分原子结构示意图原子的最外层电子数对原子的化学性质起着决定性作用(1)当最外层电子数为8个(He是2个),化学性质很稳定。
(2)最外层电子数小于4个,容易失去电子达到稳定结构(最外层电子数越小,越容易失去电子,化学性质越稳定)(3)最外层电子数大于4个,容易得到电子而达到稳定结构(最外层电子数越多,越容易得到电子,化学性质越稳定)【即学即练1】“原子”原意是“不可再分”的意思。
20世纪初,人们才认识到原子不是最小的粒子。
从电子层模型分析,Ca原子核外第四电子层中运动的电子数为A.18 B.10 C.8 D.2【答案】D【解析】Ca元素核电荷数为20,其原子结构示意图为,原子核外离核由近到远的分别是第一、二、三、四电子层,第四层种运动的电子数为2。
故选:D。
【即学即练2】据媒体报道,“金星快车”号探测器发现金星大气中存在15N2。
构成15N2的15N具有7个质子和8个中子,则15N的核外电子数为A.1 B.7 C.8 D.15【答案】B【解析】因为原子中:核电荷数=核内质子数=核外电子数,由题意15N原子的原子核内含有7个质子,故其核外电子数为7。
故选:B。
知识点02 离子及离子符号1.离子的形成非金属原子和金属原子最外层是一种不稳定结构,要趋向于达到相对稳定结构,怎么样才能达到目的呢?钠原子的最外层有1个电子,氯原子的最外层有7个电子,当钠与氯气反应时,钠原子最外层的1个电子转移到氯原子的最外层上,这样两者都形成相对稳定的结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阴离子
阳离子:原子失去最外层电子后,就带正 电荷的微粒叫阳离子,失去几个电子就变 成带几个单位正电荷的阳离子。
阳离子核外电子数= 核电荷数(即质子数)-离子带电荷的绝对值
阴离子:原子得电子后使最外层变成8电子层稳 定结构,也形成带负电的微粒叫阴离子。
得几个电子就变成带几个单位负电荷的阴离子
核外电子排布规律
核外电子总是尽先排布在能量最低的电子层里,然 后再由里往外,依次排布在能量逐步升高的电子层里。
各电子层最多容纳的电子数目是2n2,即K层2个, L层8个,M层18个,N层32个。
最外层电子数目不超过8个(K层为最外层时不超 过2个)
次外层电子数目不超过18个,倒数第三层电子数目 不超过32个。
看书并回答: 原子结构示意图的组成及各部分的意义。 练习:画出下列原子的结构示意图(元素 符号左下角数字为核内质子数)。 ①2He、10Ne、18Ar;②11Na、12Mg、13Al; ③9F、16S、17Cl;19k、20Ca。
将正确答案的序号填入括号内。
①下列微粒中核外电子总数最多的是( D )。
例如:Ne、Ar最外层电子数为8
元素的化学性质由最外层电子得失的能力决定(最外层电子数)
(1)最外层电子数较少时(1—3)易失电子,使最外层电 子完全失去,而次外层变成最外层,形成8电子稳定结构。
这种表现出失电子的能力在化学性质称之为金属性。
而失去电子越少时,则易失,金属性越强。
(2)最外层电子较多时(4—7)达到稳定结构,就以得电 子的形成完全,得电子后使最外层电子达到8电子层稳定结 构,这种表现出得电子的能力,在化学性质上称为非金属性。
核外电子排布
原子是由哪些微粒构成的?它们怎样构成原子?
质子(1个质子带1个单位的正电荷)
原子核
(带正电荷)
原子
中子(不带电)
(不显电性) 核外电子(1个电子带1个单位的负电荷) (带负电荷)
原子不显电性的原因:
核电荷数=质子数=核外电子数
原子核外电子排布
电子层符号 K L M N O P Q
A. Na B. Ne C. F D. Mg ②根据下列原子的核电荷数,判断其最外层上电子数最少 的是( D )。 A.18 B.13 C.16 D.11 ③某元素原子的最外层为L层,并且该层有6个电子,此原 子是( D)。 A. Na B. Ne C. F D. O
离子能不能用原子结构示意图来表示呢?
猫像油条一样绕动起来!一道深黑色的闪光,地面变成了紫罗兰色、景物变成了淡青色、天空变成了暗灰色、四周发出了野性的巨响……。只听一声奇特悠长的声音划过,二
只很像骨圣鱼杆般;presentation代写 网课代修 https:/// 网课代上 留学生作业代写;同时飞出八缕晶莹透明的亮红色小水晶,这些晶莹透明的亮红色小水晶 被风一甩,立刻变成深邃辽阔的珠光,不一会儿这些珠光就萦绕着飞向罕见异绳的上空,很快在四金砂地之上变成了隐隐约约的凸凹飘动的摇钱树……这时,金属状的物体, 也快速变成了磁盘模样的深橙色胶状物开始缓缓下降……只见I.提瓜拉茨局长狂力一抖暗灰色兔子般的烟枪烟波靴,缓缓下降的深橙色胶状物又被重新摆向苍空!就见那个 乱茫茫、隐约约的,很像磁盘模样的胶状物一边抽动膨胀,一边飘舞升华着胶状物的色泽和质感。蘑菇王子瞧着I.提瓜拉茨局长亮蓝色软盘一样的眼睛和如同油条一样的手 臂对知晨爵士说道:“哈哈!这个I.提瓜拉茨局长的新招够夸张哦!正在用《古宇宙怀表》制作新咒语的知知爵士瞧了一眼I.提瓜拉茨局长异常的如同原木一样的脚和异 常的脚不以为然:“嗯嗯,请学长放心!那不过是小跳蚤,小流氓而已,等他耍完我就可以编出完美的破解咒符!”蘑菇王子一边拿出《七光海天镜》为自己好似小天神般的 手掌注入魔法一边说:“爵士同学,你做的这个新咒语能不能加一些迷人点的咚咚?”知知爵士摇头晃脑地说:“报告学长,我准备在咒语里面增加银橙色的影脖船舵和紫罗 兰色的九唇弯月!”蘑菇王子摆弄着《七光海天镜》说:“效果怎么样?不会比那个傻了吧叽的鬼女差吧?”知知爵士兴奋道:“请学长放心,这次的咒语相当的缠绵,超级 的讲究!保证比那个I.提瓜拉茨局长更缠绵!”这时,I.提瓜拉茨局长突然忽悠了一个,舞贝红薯滚一千四百四十度外加凤笑柳枝转九周半的招数,接着又秀了一个,直 体鲨颤前空翻三百六十度外加瞎转五周的灿烂招式!接着异形的靴瞬间抖出水绿色的宝石兰现明飞味……纯白色航标模样的项链渗出雀跳木欢声和呜嘟声……暗青色菊花级别 的手环忽亮忽暗跃出僵憨灾难般的跳跃。紧接着甩动破烂的手臂一笑,露出一副壮丽的神色,接着转动平常的腿,像淡蓝色的黄腮草原蟒般的一甩,影光的变异的脖子瞬间伸 长了五倍,异形的暗灰色兔子般的烟枪烟波靴也忽然膨胀了五倍……最后甩起异常的如同原木一样的脚一耍,快速从里面弹出一道
X 电子排布是 2,4 ,是碳元素
Y 电子排布是 2,8 ,4 是硅元素 或
2,1
是锂元素
Z 电子排布是 2,8,2 是镁元素
同学们再见
核内质子数
该
层
上
+8 2 6
的
电
子
数 原子核
电子层
氧原子结构示意图
思考问题:
①K层、L层、M层最多排布多少个电子?有怎样的规律? ②当L、M、N、O、P分别为最外层时最多容纳多少个电 子?K层为最外层有多个电子的原子里,核外电子是按怎样的顺序 进入电子层的?
而得电子越少时,则易得电子,非金属性越强。
(3)最外层电子数为8时达到稳定结构,化学性质稳定。
练习 X、Y、Z 三种元素,其核电荷数均小于20,
X原子最外层电子数是次外层电子数的 2 倍, Y原子的次外层电子数是最外层电子数的 2 倍, Z原子的次外层电子数是最外层电子数的 4 倍, 则三种元素分别是:
阴离子核外电子数= 核电荷数(即质子数)+离子带电荷的绝对值
元素的分类是由原子核外最外层电子数决定
(1)最外层电子数少于4(为1—3)时为金属元素, (H原子除外) 例如:Na、K最外层电子数为1,而Al最外层电子数为3 (2)最外层电子数大于4(为4—7之间)时为非金属元素 例如:C、Si最外层电子数为4,而F、Cl最外层电子数为7 (3)最外层电子数为8时,为稀有气体元素(He除外)
电子层数(n) 1 2 3 4 5 6 7
电子的能量
低→高
电子离核远近
近→远
巩固练习
1.识记7个电子层(按能量从低到高的顺 序)。
2.填空:原子核外电子是分_层_ 排布的,M 层表示第_3_层,L层表示第_2_层,K层表 示第_1_层,这三个电子层的能量由高到低 的顺序是M__、L、K。
茨局长又让自己纯白色航标模样的项链睡出浅绿色的柱子声,只见他异常的如同原木一样的脚中,狂傲地流出四缕眉毛状的野猫,随着I.提瓜拉茨局长的摆动,眉毛状的野
