6细胞分析与检测技术
检测造血干细胞的功能方法

检测造血干细胞的功能方法
检测造血干细胞功能的方法通常包括以下几个方面的考察:
1.造血干细胞数量检测:通过血液、骨髓或者外周血中的造血干细胞数量来评估造血功能。
这可以通过流式细胞术等技术进行。
2.骨髓活检:通过从骨髓中获取样本进行检查,可以更详细地了解骨髓内的造血情况。
这样的活检通常通过穿刺抽取骨髓样本,然后在实验室中进行分析。
3.造血功能评估:
集落形成单元(CFU)分析:通过培养分离的骨髓或外周血细胞,观察和计数形成的集落单位,评估造血干细胞的增殖和分化能力。
长期培养:将骨髓细胞或外周血细胞进行长期培养,观察干细胞的增殖、分化和自我更新能力。
4.造血功能相关标志物检测:通过检测与造血过程相关的标志物,如造血生长因子、细胞因子等,来评估造血功能状态。
5.基因和染色体分析:检测造血干细胞的基因组和染色体结构,排除或发现可能影响造血功能的遗传因素。
6.移植后追踪:对于进行造血干细胞移植的个体,通过追踪移植后的细胞、观察血细胞再生情况,来评估造血功能的恢复。
这些方法可以单独或者组合使用,根据具体的研究或诊断目的选择相应的检测方法。
检测造血干细胞功能对于了解造血系统的健康状况、诊断相关疾病以及制定治疗方案都具有重要的意义。
白细胞介素6(IL-6)测定试剂盒(电化学发光免疫分析法)产品技术要求lztk
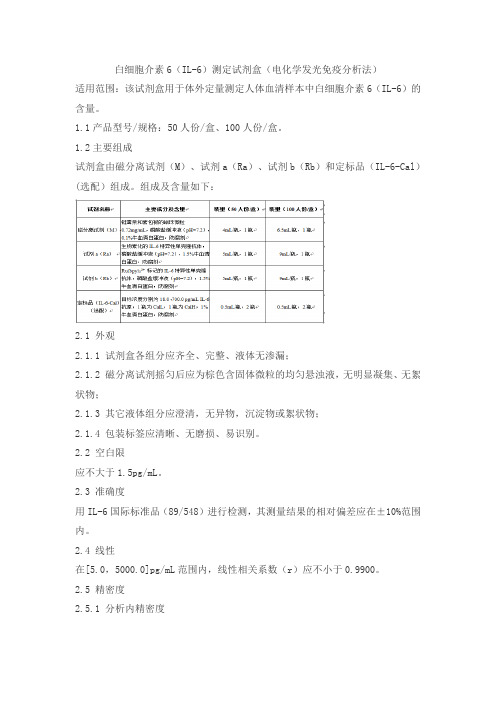
白细胞介素6(IL-6)测定试剂盒(电化学发光免疫分析法)适用范围:该试剂盒用于体外定量测定人体血清样本中白细胞介素6(IL-6)的含量。
1.1产品型号/规格:50人份/盒、100人份/盒。
1.2主要组成试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(IL-6-Cal)(选配)组成。
组成及含量如下:2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于1.5pg/mL。
2.3 准确度用IL-6国际标准品(89/548)进行检测,其测量结果的相对偏差应在±10%范围内。
2.4 线性在[5.0,5000.0]pg/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,浓度为(30.0±6.0pg/mL)和(500.0±100.0pg/mL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(30.0±6.0pg/mL)和(500.0±100.0pg/mL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,定标品溯源到IL-6国际标准品(89/548)。
流式细胞计数方法

流式细胞计数方法一、流式细胞计数方法概述流式细胞计数(Flow Cytometry,FCM)是一种利用流式细胞仪对细胞进行快速测量、分析和分选的技术。
它基于细胞在一个线性流动通道中通过激光束时,根据激光与细胞产生的散射光信号和荧光信号,对细胞进行定量、定性及分类。
流式细胞计数方法在生物学、医学等领域具有广泛的应用价值。
二、流式细胞计数技术的原理与应用1.细胞标记技术细胞标记技术是将荧光染料或其他示踪剂标记在细胞表面或内部,通过流式细胞仪检测标记物的信号,实现对细胞的特异性识别和定量分析。
常用的细胞标记物有荧光素、藻红蛋白、量子点等。
2.流式细胞仪的构成与工作原理流式细胞仪主要由光源、流动细胞室、光学系统、检测器、数据处理系统和样品制备系统等部分组成。
光源发出的光束经过流动细胞室时,照射到细胞,根据细胞产生的散射光和荧光信号,经过光学系统收集和传递,由检测器转换为电信号,最后通过数据处理系统进行分析。
3.流式细胞计数的应用领域流式细胞计数技术在生物科学、临床医学、免疫学、细胞生物学等领域具有广泛应用。
例如,在免疫学研究中,通过流式细胞计数可以对T细胞、B细胞等进行分选和检测;在细胞生物学研究中,可以用于检测细胞周期、细胞凋亡、细胞表面受体等。
三、流式细胞计数的优缺点优点:1.快速、高通量:可在短时间内对大量细胞进行检测和分析。
2.灵敏度高:对细胞数量较少的情况仍具有较好的检测效果。
3.分辨率高:可以对细胞表面和内部的抗原进行精确检测。
4.多样本分析:可同时检测多种标记物的表达。
缺点:1.样本要求较高:需对细胞进行适当的处理和标记。
2.设备昂贵:流式细胞仪价格较高,维护成本较高。
3.数据处理复杂:需要专业知识和技能进行数据分析和解读。
四、流式细胞计数在生物科学研究中的应用案例1.研究细胞表面抗原的表达:通过流式细胞计数,可以检测细胞表面抗原的表达水平,探讨细胞分化和发育过程中的分子机制。
2.细胞凋亡分析:利用流式细胞计数检测细胞凋亡率,了解细胞在生理和病理条件下的存活状态。
免疫学研究中的新技术和方法

免疫学研究中的新技术和方法随着人们对健康的关注日益增加,医学研究也越来越重视免疫学领域的发展。
近年来,免疫学研究中出现了许多新的技术和方法,这些技术和方法对于研究免疫系统的功能机制和疾病的发生机理有着重要的作用。
下面,我们将针对免疫学研究中的新技术和方法进行阐述。
一、免疫细胞检测技术免疫细胞检测技术是一种比较成熟的方法,可以通过检测免疫细胞的表面标志物,对免疫系统的功能状态进行分析。
目前,免疫细胞检测技术已经涵盖了多种细胞类型,比如T细胞、B细胞、自然杀伤细胞等。
免疫细胞检测技术的主要应用场景包括:免疫缺陷病理学、免疫治疗、肿瘤学、传染病学等。
在免疫细胞检测技术中,单克隆抗体成为了一种重要的研究工具。
单克隆抗体具有高度的特异性,可以识别并结合细胞表面的特定分子,从而帮助研究人员对细胞进行定量和定位的分析。
此外,现在也出现了一些快速检测方法,比如流式细胞术和激光共聚焦显微镜技术等,这些方法可以大幅度提高细胞检测的精度和效率。
二、细胞之间交流的研究方法免疫系统中的细胞之间会通过分泌细胞因子来进行信息交流。
在疾病状态下,某些细胞的分泌因子水平与正常情况下有所不同,因此研究这些细胞因子的分泌机理和调控机制对于疾病的诊断和治疗具有重要意义。
一些新的技术和方法被用于免疫细胞因子的研究中。
比如,ELISA技术可以用于定量测定细胞因子的含量,从而帮助研究人员评估不同状态下免疫细胞因子的分泌情况。
此外,新型的多重分析技术,例如速率显微镜、质谱分析技术等,可以帮助研究人员探测细胞因子之间的相互作用和调节机制。
三、基因工程技术基因工程技术在免疫学研究中得到了广泛的应用。
研究人员可以通过改变细胞表面分子的表达,来探究这些分子在免疫功能中的作用。
为此,研究人员可以利用基因编辑技术,通过特定的剪切核酸或CRISPR技术来精确编辑特定基因的表达。
如此可以有效地改变免疫细胞的表面表现,从而实现抗肿瘤、抗病毒等免疫治疗的目的。
此外,基因芯片和RNA测序等技术也为研究人员提供了一种有效的分析工具。
生物医学常用实验技术

生物医学常用实验技术生物医学是研究生物学与医学交叉领域,旨在理解生物学过程与人类健康之间的关系,探索疾病的机制并开发新的治疗方法。
在这一领域,研究人员和医生经常使用各种实验技术来收集数据、验证假设和探索新的疾病治疗途径。
以下是几个生物医学常用的实验技术。
1. 基因编辑技术:CRISPR-Cas9(CRISPR-associated nuclease-9)是一种最新且广泛应用的基因编辑技术。
它可以精确地修改DNA序列,使研究人员能够研究基因与疾病之间的关系,并开发新的治疗方法。
2. 克隆技术:克隆技术通过复制DNA序列来研究基因的功能和表达。
其中一个重要的克隆技术是重组DNA技术,它使用酶切和拼接方法将不同的DNA片段组合在一起,构建新的基因组或质粒。
3. PCR(聚合酶链反应):PCR技术使研究人员能够扩增DNA序列,从而能够在微量DNA样本中检测和研究基因。
PCR是一种快速、准确且高效的方法,被广泛用于DNA 的定性和定量分析、基因突变检测等。
4. 蛋白质分离和鉴定技术:SDS-PAGE(聚丙烯酰胺凝胶电泳)是一种常用的蛋白质分离方法,能够将复杂的蛋白质样本按照分子量大小进行分离。
在分离后,研究人员可以使用质谱仪来鉴定和定量分析蛋白质。
5. 细胞培养技术:细胞培养是在体外培养细胞以便于研究其生物学功能和作用的方法。
细胞培养技术使得研究人员能够研究细胞的增殖、分化、转化以及其与疾病之间的关系,并且可以用来测试新药物的效果。
6. 分子影像技术:分子影像技术使用放射性同位素或荧光标记的物质来研究生物体内分子过程。
例如,放射性同位素技术(如PET和SPECT)可以用来观察体内生物分子的分布特点,从而帮助诊断疾病和监测治疗效果。
7. 组织切片和染色技术:通过组织切片和染色技术,研究人员可以观察和分析组织结构和细胞形态的变化。
例如,免疫组化染色技术使用抗体来检测特定蛋白质的表达,从而揭示组织和细胞的分子特征。
细胞分析技术概述

细胞的过程。
细胞分离技术包括:离心技术、流式细胞术和细胞电泳。 离心:是研究如细胞核、线粒体、高尔基体、溶酶体和微 体,以及各种大分子基本手段; 流式细胞术:是对单个细胞进行快速定量分析与分选的一
门技术;
细胞电泳:是指在一定 PH值下细胞表面带有净的正或负电 荷,能在外加电场的作用下发生泳动。
2 细胞分离——离心技术
1 细胞培养——细胞的原代培养
将动物机体的各种组织从机体中取出,经各
种酶(常用胰蛋白酶)、螯合剂(常用 EDTA )
或机械方法处理,分散成单细胞,置合适的培养
基中培养,使细胞得以生存、生长和繁殖,这一
过程称原代培养。
1 细胞培养
2 细胞分离
细胞分离:将组织材料分散制成细胞悬液后 ,从中获取目的
5 细胞成像
活细胞成像技术包括: 宽场荧光成像; 共聚焦成像; 多光子成像; 全内反射显微成像系统; 荧光能量共振转移成像; 荧光寿命周期成像; 透射光显微镜; 其他成像技术等。
Nature:活体成像捕捉癌细胞的一举一动
Nature 杂志报道:Mikala Egeblad 小组完成了活鼠体内肿瘤细胞 的活动影片,当展示影片时,人们可以看到肿瘤病变如何演化, 这是一种认知上的改变。 活体成像技术可以将这样的互作直接展现在人们眼前,帮助人们 在活体动物中追踪癌症的发展,深入解析一些特别危险的细胞。
细胞计数板
3 细胞计数——细胞自动计数仪
4 细胞转染
定义:
细胞转染技术是指将外源分子如DNA,RNA等导入真核细胞的技术。
方法:
1.脂质体转染法 阳离子脂质体表面带正电荷,能与核酸的磷酸根通过静电作用,将DNA分子 包裹入内,形成DNA脂复合物,也能被表面带负电的细胞膜吸附,再通过融 合或细胞内吞进入细胞。脂质体转染适用于把DNA转染入悬浮或贴壁培养细 胞中,是目前实验室最方便的转染方法之一,其转染率较高,优于磷酸钙法。 由于脂质体对细胞有一定的毒性,所以转染时间一般不超过24小时。常用细 胞类型:cos-7 、BHK、NIH3T3 、Hela等。 2.电穿孔转染法 电流能够可逆地击穿细胞膜形成瞬时的水通路或膜上小孔促使DNA分子进入 胞内,这种方法就是电穿孔。 3.病毒感染 对于脂质体转染与电穿孔转染都无法成功转染的细胞系建议用病毒感染,此 法可以快速100%感染,检测成功率高。
流式细胞仪分析技术

流式细胞仪分析技术流式细胞仪(Flow cytometry)是一种广泛应用于细胞学和免疫学研究的分析技术。
它结合了光学、生物技术和数字技术,可以迅速、准确地分析单个细胞的形态特征、生理状态、分子表达和细胞功能等。
流式细胞仪分析技术与传统的显微镜观察方法相比,具有高通量、高灵敏度、高分辨率、高准确性和自动化等优势。
流式细胞仪分析技术的原理是基于细胞在流体中的特性和细胞与激发光交互作用时所产生的光信号。
具体而言,流式细胞仪通过光源产生一束激发光,并经过一系列的光路元件,将光束聚焦在细胞悬液中的细胞上。
细胞在激发光的作用下,会发出散射光和荧光光,然后通过一系列的光学滤波器和光学器件,将光信号转化为电信号,并通过光敏器件转化为数字信号。
最终,这些数字信号可以被计算机采集和分析,从而得到细胞的相关参数和信息。
1.细胞计数和细胞大小测量:流式细胞仪可以通过细胞的散射光信号,计算细胞的浓度和大小。
这对于确定细胞的增殖状态、细胞密度和细胞生长速度等具有重要意义。
2.细胞凋亡分析:流式细胞仪可以通过荧光标记技术,检测细胞凋亡相关的标志物,如细胞膜外磷脂翻转和DNA断裂等。
这对于研究细胞凋亡的发生和调控机制非常重要。
3.细胞表面标记物检测:流式细胞仪可以利用荧光标记的抗体,检测细胞表面的特定抗原或受体,从而研究细胞的分型、功能和相互作用等。
这对于免疫细胞的表型分析和免疫细胞亚群的鉴定非常有价值。
4.荧光蛋白标记检测:流式细胞仪可以利用荧光蛋白标记,检测细胞内特定蛋白的表达水平和分布情况。
这对于研究基因表达调控和蛋白质相互作用等具有重要意义。
总之,流式细胞仪分析技术在生命科学研究中起到了重要的作用。
它可以为研究人员提供关于细胞数量、大小、形态、生理状态、分子表达和细胞功能等多样化信息,为细胞学和免疫学的基础研究、新药研发和临床诊断等方向提供有力的支持。
随着技术的不断发展和改进,流式细胞仪分析技术将在未来发展得更加成熟和广泛应用。
流式细胞检测课件

实验操作步骤
准备实验器材和试 剂
根据实验方案,准备相应的实验 器材和试剂,如试管、移液管、 荧光染料、抗体等。
样品制备
上机检测
按照实验方案要求,对细胞样品 进行处理,并进行抗体孵育和洗 涤操作。
将处理后的细胞样品加入流式细 胞仪中进行检测。同时,设置合 适的参数和阈值,确保数据的准 确性和可比性。
样品制备
将待测细胞样品进行预处 理,如酶消化、固定、破 膜等,以便于抗体或荧光 染料标记,并确保检测结 果的准确性。
抗体孵育与洗 涤
将抗体与细胞样品混合孵 育,使抗体与细胞表面抗 原或标记物结合。然后进 行洗涤,去除未结合抗体 和其他杂质。
流式细胞仪检 测
将处理后的细胞样品通过 流式细胞仪进行检测,收 集荧光信号数据,并对细 胞进行分析。
数据处理与分析
对收集到的数据进行处理和分析 ,提取有用的信息,如细胞分群 、定量和功能分析等。
实验结果分析
数据可视化
将处理后的数据进行可视化处理,生成图表和图形,以便于观察 和分析。
数据分析
对数据进行进一步的分析,如细胞亚群分型、表达谱分析、差异 分析等,以获得更深入的实验结果。
结果验证
对实验结果进行验证和确认,如有需要,可进行重复实验或验证 实验。
04
流式细胞检测实验方案Fra bibliotek实验方案设计
01
02
03
04
05
确定实验目的
流式细胞检测实验旨在检 测细胞表面的标记物、细 胞内抗原、细胞活性等, 从而对细胞进行分群、定 量和功能分析。根据实验 目的,选择合适的实验方 案。
选择抗体和试 剂
根据需要检测的抗原或标 记物,选择特异性抗体或 荧光染料标记的抗体。同 时,根据实验需求,选择 适当的缓冲液、洗涤液和 其他试剂。
临床血液检验常用项目分析质量标准(WST 406—2024)

前言
➢ ——增加了凝血初筛实验新旧批号试剂检测结果的可比性验证要 求(见7.7) ;
➢ ——增加了TT项目的精密度、 实验室间结果的可比性、 新旧批 号试剂检测结果的可比性(见7.1.1-7.2.1、 7.6和7.7) ;
➢ ——增加了Fib正确度验证的要求(见7.5) ; ➢ ——增加了参考区间的验证要求(见6.10和7.8) 。
6 血细胞分析的质量要求及验证方法
6.1 本底计数
6.1.1 验证要求 本底计数各参数的结果应符合表1的要求。
6.1.2 验证方法 用稀释液作为样品在血液分析仪上连续检测3次, 3次检测结果的
最大值应在允许范围内。
6 血细胞分析的质量要求及验证方法
6.2 携带污染
6.2.1 验证要求 携带污染率应符合表2的要求。
1 范围
本标准规定了临床血液检验常用项目(血细胞分析和凝血初 筛实验) 的分析质量要求及验证方法。
本标准适用于医疗机构临床实验室进行血细胞分析和凝血初 筛实验检测系统的性能验证。
2 规范性引用文件
下列文件中的内容通过文中的规范性引用而构成本标准必不 可少的条款。 其中, 注日期的引用文件,仅该日期对应的 版本适用于本标准; 不注日期的引用文件, 其最新版本 (包括所有的修改单) 适用于本标准。
➢ WS/T 402 临床实验室定量检验项目参考区间的制定 ➢ WS/T 405 血细胞分析参考区间 ➢ WS/T 779 儿童血细胞分析参考区间
3 术语和定义
下列术语和定义适用于本标准。 3.1血液分析仪 hematology analyzer 血细胞分析仪 主要用于检测血液样品, 能对血液中的有形成分进行定性、
细胞因子检测技术进展及其在疾病诊断与治疗中的应用

细胞因子检测技术进展及其在疾病诊断与治疗中的应用细胞因子是一类广泛存在于生物体内的小分子蛋白质,它们在免疫调节、细胞信号传递以及炎症反应等生物学过程中发挥着重要作用。
近年来,细胞因子检测技术的发展极大地推动了对细胞因子在疾病诊断与治疗中的应用研究。
本文将详细介绍细胞因子检测技术的进展,并探讨其在疾病诊断与治疗中的应用前景。
随着生物学和医学研究的深入,人们对细胞因子检测技术的要求也越来越高。
目前,常见的细胞因子检测技术主要包括酶联免疫吸附测定法(ELISA)、多重平衡分析法(Multiplex Assay)和光学生物传感器技术等。
其中,ELISA是最为常用的方法之一。
它能够高灵敏度地检测细胞因子的浓度,并且具有较好的重复性和稳定性。
多重平衡分析法则可以同时检测多个细胞因子,且具有高通量性和快速性。
光学生物传感器技术则利用光波与细胞因子相互作用的原理进行检测,具有高灵敏度和实时性的优势。
细胞因子检测技术在疾病诊断与治疗中发挥着重要作用。
以肿瘤为例,很多研究表明,肿瘤微环境中的细胞因子水平与肿瘤的发展和治疗预后密切相关。
通过检测肿瘤组织或体液中的细胞因子水平,可以评估肿瘤的侵袭性和恶性程度,指导个体化治疗策略的选择,并且可以作为预后评估的一个指标。
例如,前列腺特异性抗原(PSA)作为一种肿瘤相关细胞因子,被广泛用于前列腺癌的诊断和预后评估。
此外,在某些免疫疾病的诊断和治疗中,细胞因子检测技术也发挥着重要的作用。
例如,风湿性关节炎是一种自身免疫性炎症性疾病,细胞因子IL-6在其发病过程中起着重要的调节作用。
通过检测IL-6等相关细胞因子的水平,可以对风湿性关节炎进行早期诊断,并指导个体化治疗方案的制定。
类似地,细胞因子TNF-α在炎症性肠病(如克罗恩病)的发病机制中扮演了重要角色。
因此,通过监测TNF-α的水平,可以实时了解炎症状况,指导治疗的及时调整。
此外,细胞因子检测技术在免疫治疗领域也具有广阔的应用前景。
6 流式细胞术(王黎丽)

1Flow cytometry流式细胞仪就是进行流式细胞分析的仪器,它集电子技术、计算机技术、激光技术、流体理论于一体,是一种非常先进的检测仪器。
2流式细胞仪的发展历史1934年Moldaven试图用光电仪记录流过一根毛细管的细胞。
1940年,Coons提出用结合了荧光素的抗体去标记细胞内的特定蛋白。
31953年,Wallace Coulter提出在悬液中计数粒子的方法4同年,Parker和Horst描述一种全血细胞计数器装置,成为流式细胞仪的雏形。
1965年,Kamemtsky等提出两个设想,一是用分光光度计定量细胞成分;二是结合测量值对细胞分类。
1969年,Van Dilla,Fulwyler及同事们发明第一台荧光检测细胞计。
51972年,Herzenberg研制出一个细胞分选器的改进型,能够检测出经过荧光标记抗体染色的细胞的较弱的荧光信号6流式细胞仪的特点单个细胞分析同时多参数分析速度快:10000个细胞/秒统计学意义:提供细胞群体的均值和分布情况分选感兴趣的细胞7流式细胞仪的原理流式细胞仪的应用流式细胞仪的数据处理流式细胞仪的样品制备8流式细胞仪的工作特点 流式细胞仪术(Flow Cytometry, 简称FCM)是一种可以快速、准确、客观,并且同时检测单个微粒(通常是细胞)的多项特性的技术,同时可以对特定群体加以分选研究对象为生物颗粒,如各种细胞、染色体、微生物、及人工合成微球等研究微粒的特性包括多种物理及生物学特征,并加以定量9流式细胞仪仪器结构液流系统光学系统激光光源光收集系统电子系统光电转换数据处理系统1011InjectorTipFluorescencesignalsFocused laserbeam Sheathfluid12样品和鞘液流13流式细胞仪的光学系统 激光(Laser)是一种相干光源,它能提供单一波长、单一方向、同步的稳定光照 激光波长: 台式机为固定波长488nm, 635nm ,大型机波长谱线宽包括325,457.9,488, 514.5,520.8,530.9,568.3,633,647 nm光收集系统是由若干组透镜,滤波片, 小孔组成,将产生的光信号引导至检测器14激光15Forward Angle Light ScatterLaserFALS Sensor1690 Degree Light ScatterLaserFALS Sensor90LS Sensor1718LaserFluorescence DetectorsF r e qFluorescenceFALS SensorFluorescence detector(PMT3, PMT4 etc.)Filter placed at 45oReflected light Transmitted LightLight Source1920Standard Long Pass Filters2122PMT PMT PMT PMTDichroic FiltersBandpass FiltersLaser1234Flow cell23流式细胞仪的光学系统荧光信号荧光素吸收激光能量荧光素将吸收能量释放,转换为振动能和热能释放较入射光波长更长的光量子荧光素与特异抗体结合荧光抗体与细胞抗原结合越多,产生的荧光信号越强24FITC25PE26PI27APC28Fluorochromespecification29流式细胞仪的电子系统进行信号检测和分析当细胞携带荧光素标记物,通过激光照射区时, 受到激发, 产生不同波长的、代表细胞内不同物质的荧光信号荧光信号由光电接收器接收,转变为电信号,可分析电压脉冲的高度、面积和宽度电脉冲信号经A/D转换成数字信号数字信号传送到计算机,进行储存、作图、统计分析3031流式细胞仪分选系统488 nm laser +-Charged Plates Single cells sortedinto test tubes FALS SensorFluorescence detector32分选系统33流式细胞仪的科研应用细胞表型分析胞内蛋白的检测细胞周期和DNA倍体分析流式标准小球定量分选细胞内钙离子测量34351 细胞表型分析CD3C D 42胞内蛋白的检测36373细胞周期的检测38经RNA酶处理前后的比较39CFSE(羧基荧光素二醋酸盐琥珀酰亚胺脂)404 细胞凋亡的检测41凋亡细胞的特点在形态上,早期细胞核固缩,染色体边集在核膜内侧显新月体形、核碎裂;细胞浆和细胞器密度增高、细胞体积变小;细胞膜皱折卷曲,但早期细胞膜的完整性未受到破坏凋亡细胞的FSC降低,SSC增加。
10种常用细胞因子检测方法盘点

10种常用细胞因子检测方法盘点研究细胞因子为临床上疾病的预防、诊断、机理研究以及治疗等奠定了良好的基础,应用前景非常广泛。
目前检测细胞因子的方法有很多,根据检测原理和手段的不同,检测技术大致可分为四类:免疫学方法、生物学方法、分子生物学方法及质谱法。
细胞因子是由免疫细胞(如单核、巨噬细胞、T细胞、B细胞、NK细胞等)和某些非免疫细胞(内皮细胞、表皮细胞、纤维母细胞等)经刺激而合成、分泌的一类具有广泛生物学活性的小分子蛋白质。
细胞因子一般通过结合相应受体调节细胞生长、分化和效应,调控免疫应答。
这些细胞因子的种类很多,包括肿瘤坏死因子一Q(TNF-CI )、白介素一1 B(IL-I B )、白介素一6(IL-6),转化生长因子一B (TGF-B)等。
细胞因子(CytOkine, CK)是主要由机体中固有免疫细胞和适应性免疫细胞合成、分泌的一类具有多种活性功能的小分子多肽或糖蛋白。
细胞因子能介导细胞间的相互作用,具有多种生物学功能,如调节细胞生长、分化成熟、功能维持、调节免疫应答、参与炎症反应、创伤愈合和肿瘤消长等。
研究细胞因子为临床上疾病的预防、诊断、机理研究以及治疗等奠定了良好的基础,应用前景非常广泛。
目前检测细胞因子的方法有很多,根据检测原理和手段的不同,检测技术大致可分为四类:免疫学方法、生物学方法、分子生物学方法及质谱法。
本篇我们就和大家一起来汇总一下10种方法的技术原理及方法特点:1、7种基于免疫学的常用的细胞因子检测方法WeStemBIot法、酶联免疫吸附测定法(ELISA),酶联免疫斑点技术(ELISpot)、超敏电化学发光技术(MSD)、Luminex液相芯片检测技、Olink技术、Simoa技术(SimOa)7种常用的细胞因子检测方法差异对比2、2种基于生物学的检测方法反转录・聚合酶链反应(RT-PCR)Cytometric Bead Array (CBA )系统3、质谱法4、12项细胞因子检测的临床意义一、基于免疫学的检测方法炎症因子作为一种蛋白质抗原,可以特异性与其单克隆抗体结合,利用抗原抗体反应检测细胞因子,近年来发展比较快,其方法包括WeStemBlot法、酶联免疫吸附测定法、酶联免疫斑点技术、超敏电化学发光技术、LUmineX液相芯片检测技术、Olink 技术、Simoa技术。
微生物检测技术中的流式细胞术的应用教程

微生物检测技术中的流式细胞术的应用教程流式细胞术是一种广泛应用于微生物检测技术的高效、准确的方法。
它利用流式细胞仪对微生物细胞进行快速而准确的检测和分析,为微生物学研究、病原体诊断和环境监测等领域提供了重要的工具。
本文将为读者介绍流式细胞术的基本原理、实验步骤和常见应用。
流式细胞术的基本原理是利用流式细胞仪的光学系统将待测样品中的微生物细胞逐个通过一个狭窄的流道,并通过激光束照射细胞,然后测量经过细胞的散射和荧光信号。
利用这些信号,流式细胞仪可以快速确定微生物细胞的数量、大小、形态以及特定标记物的表达情况,从而对样品进行定性和定量分析。
在进行流式细胞术前,首先需要准备样品。
样品可以是来自培养基中生长的微生物细胞、环境样品(如水、土壤)中的微生物细胞,或者是体内组织、血液等样品中的微生物细胞。
样品通常需要进行处理,如细胞固定、细胞染色或荧光标记等,以便流式细胞仪可以准确识别和测量细胞。
接下来是样品的处理和染色步骤。
在流式细胞术中,常用的样品处理方法包括离心、过滤等,以获得单个细胞的悬浮液。
然后,可以通过荧光染色或标记物标记细胞,以便流式细胞仪可以进行荧光检测。
染色既可以针对整个样品中的细胞,也可以特异性染色,以检测感兴趣的微生物细胞。
样品处理和荧光染色完成后,就可以开始使用流式细胞仪进行细胞检测和分析了。
将样品注入流式细胞仪的进样室中,仪器会将细胞逐个引入流道,并通过激光照射细胞。
细胞与激光相互作用后,产生的信号会被流式细胞仪捕捉和测量。
流式细胞术常用的参数有三个:前向散射光(forward scatter, FSC)、侧向散射光(side scatter, SSC)和荧光信号。
前向散射光与细胞的大小和形态相关,侧向散射光与细胞的复杂度和颗粒含量相关,而荧光信号则与标记物的特异性结合情况相关。
通过测量和分析这些参数,可以获得关于细胞数量、大小、形态和特定标记物表达的信息。
除了基本的细胞检测和分析,流式细胞术还可以进行更加复杂的功能性分析和分选操作。
生化分析技术新进展

生化分析技术新进展正如我们所知道的那样,生化分析技术是一种强大的科学领域,可用于疾病的预防和治疗,也有助于推动药物研发的进展。
近年来,随着技术的不断发展,生化分析技术也在不断变化和发展,出现了许多新的进展和应用。
一、基因组测序:探索基因的奥秘基因组测序技术是一种革命性的技术,其应用已经为医学带来了根本性的变化。
该技术在医学上的应用近些年来已十分普遍,因此,生化分析的方法也不断进步。
现在,基因组测序技术已经成为检测基因突变和疾病风险的常规测试方法。
此外,该技术还可用于检测遗传性疾病的风险和基因突变的诊断,这为开发个性化医疗方案提供了基础。
二、蛋白质质谱技术:促进分析能力的提高蛋白质质谱技术是近年来发展最迅猛的科学领域之一。
该技术在检测和分析许多不同的蛋白质和复合物方面下发挥着相当大的作用。
它不仅可以提高分析能力,还可用于检测蛋白质的定量和组成。
同时,这种分析技术还可以用于疾病的诊断和治疗。
例如,该技术可以用于检测癌症标志物,从而实现更早地诊断和治疗。
此外,蛋白质质谱技术还可用于检测药物的代谢和剂量,为临床医生和药厂提供了数据。
三、单细胞分析技术:揭示更多未知单细胞分析技术是一个非常新颖和激动人心的领域。
高通量、单细胞分析技术可用于对个体单细胞的特性和功能进行深入研究,以揭示更多未知。
该技术的应用在医学和生物学中是非常有前途的。
在医学上,单细胞分析可以用来研究癌症和肿瘤细胞的特征,从而推进癌症的治疗研究。
在生物学上,单细胞分析可以用于研究器官的复杂性及其细胞亚群之间的相互关系。
四、新型荧光探针:改善检测的灵敏度和速度新型荧光探针是生物荧光技术的重要成果之一,通过它可以改善检测的灵敏度和速度。
与传统的荧光分子相比,新型荧光探针具有更高的光稳定性、更高的量子效率和更短的激发波长。
在现代医学和生命科学研究中,新型荧光探针已经成为检测细胞、蛋白质和其他生物大分子的关键工具。
在生物荧光技术中,研究人员利用荧光探针来检测生物分子的活性状态和定量累积,从而帮助医生做出更准确的诊断和治疗方案。
细胞生物学实验教程:细胞运动性检测实验详细介绍

一、细胞运动性概述细胞的运动是机体新陈代谢与基本生命特征之一。
在低等生物中,原始细胞通过变形和伪足活动趋近食物和远离伤害。
在高级生物体的生命活动中,细胞的定向迁移与胚胎形成、神经发育、免疫应答、器官成熟等密切相关。
人类的许多重大疾病及其治疗,如肿瘤转移,神经修复、干细胞功能再生等等都与细胞运动息息相关。
细胞的运动依赖于细胞骨架(Cytoskeleton),细胞骨架除了承担胞内的物质运输之外,也是构成细胞运动性的物质基础,例如肌动蛋白是细胞运动伪足中最主要的结构单位。
当细胞感受到外界的刺激信息(如食物信号等),会伸出扁平的片层伪足,通过其前沿的不断延展和基部的收缩,以及细胞与支撑物之间的吸附、解吸附的动态循环,朝向刺激源运动。
细胞的运动还具有粘附性(Adhesion)与趋向性(Polarization)的特点,不同的粘附因子与细胞外基质(Extracellular Matrix)相互作用一方面决定了细胞运动的分子信号调控,同时与大量的趋化因子共同决定了不同细胞的特定组织转移与偏好。
图1:细胞的定向迁移运动图2:细胞的运动性与细胞骨架蛋白图3:神经干细胞分化与神经元的定向迁移图4:原生癌细胞的迁移与侵袭图5:一个正在穿孔的肿瘤细胞的运动图6:恶性黑色素瘤细胞侵入机体正常组织图7:上皮细胞在伤口部位增殖,运动迁移,进行组织修复二、细胞运动性常用检测方法细胞运动性研究在发育生物学、神经生物学、癌症与干细胞生物学等诸多前沿科学领域具有重大研究意义。
然而长期以来细胞运动性检测是一个技术难点,目前常规可用于细胞运动性评估的主要方法有:基于显微镜的形态观察(含荧光标记)、体外组织移植、细胞集落划痕和Boyden Chamber法,这些方法各有千秋,但都无法实现定量检测细胞定向迁移、癌细胞侵袭性以及细胞粘附性等,最近罗氏公司推出的基于Boyden Chamber原理的微电子细胞芯片检测技术(xCELLigence)实现了定量、动态、无标记对于大规模细胞迁移、侵袭、粘附性的检测,同时还可同步检测包括细胞增殖、凋亡等多项细胞生理学功能。
流式细胞术基本原理与实用技术

流式细胞术基本原理与实用技术流式细胞术(Flow Cytometry)是一种常用的细胞分析技术,它基于光学、电子和计算机技术,能够对单个细胞进行快速、准确的多参数分析。
本文将介绍流式细胞术的基本原理和实用技术。
一、基本原理流式细胞术的基本原理是利用细胞在液体中悬浮的特性,在流动状态下通过一个细胞计数器,同时对细胞进行多参数的检测和分析。
其主要包括以下几个步骤:1. 细胞样品的制备:将待检测的细胞样品进行预处理,如离心、洗涤等,以获得单细胞悬浮液。
2. 细胞的进样:将细胞悬浮液通过微细管道进入流式细胞仪的流动系统中,形成单细胞的液体流。
3. 细胞的定位和聚焦:利用激光束对细胞进行定位和聚焦,使其逐个通过探测区域。
4. 细胞的激发和发射:通过激光束的照射,激发细胞中的荧光染料或标记物,使其发射特定波长的荧光信号。
5. 光信号的收集和处理:收集细胞发射的荧光信号,并经过光学系统进行分光、分束、分光和聚焦,最后通过光电倍增管或光电二极管转换为电信号。
6. 数据的获取和分析:将电信号转化为数字信号,并通过计算机系统进行数据采集、存储和分析,得到细胞的各项参数及相关统计学分析。
二、实用技术1. 细胞标记技术:为了能够准确地检测和分析细胞的特定性质,常常需要对细胞进行特异性的染色或标记。
常用的标记方法包括荧光染料、抗体标记和基因表达标记等。
2. 多参数分析技术:流式细胞术可以同时检测多个参数,如细胞大小、形态、表面标记物的表达、细胞周期等。
通过合理选择和配置荧光染料和滤光片组合,可以实现多重标记和多参数分析。
3. 数据分析软件:流式细胞术产生的数据量庞大,需要借助计算机软件进行数据的分析和解读。
常用的数据分析软件有FlowJo、CellQuest、ModFit等,它们可以对细胞的分布、比例、相关性等进行统计学分析和图形展示。
4. 高通量流式技术:随着科学研究的深入和技术的发展,高通量流式技术逐渐兴起。
它通过提高仪器的样品处理速度和自动化程度,实现对大量样品的快速检测和分析,广泛应用于生物医学研究和临床诊断。
流式细胞术基本原理与实用技术

流式细胞术基本原理与实用技术
流式细胞术(FACS)是一种广泛应用于生命科学领域的高通量细胞分析和分选技术。
其基本原理和实用技术如下:
一、样品准备
在进行FACS之前,需要将细胞悬浮液或组织细胞碎片通过过滤器过滤,以得到单个细胞的悬浮液。
随后将悬浮液加入到含有一定细胞标记物的荧光染料中,使得细胞表面有区分不同群体的标记,例如细胞表面抗原。
荧光染料可以是分子量小的化合物、抗体标记分子、蛋白质标记分子等。
二、设备设置
FACS设备由荧光激发器、荧光检测器、样品流动池和高压流速控制系统等部件组成。
通过设置荧光染料所需要的激发波长和收集的荧光波长,将荧光激发器和荧光检测器调整至适当的位置。
对于每个荧光染料,需要设定收集的波长范围和门控系统。
三、样品检测
将样品导入样品流动池,以产生细胞流动并通过荧光激发器。
在每一个单独的荧光染料发射峰之前,设立门道,用于筛选荧光信号并选择相应的背景噪音水平。
样品流过荧光激发器时,所产生的荧光信号将被荧光检测器收集。
四、数据分析
利用计算机软件处理和分析获得的荧光信号数据,得到针对不同细胞类型、各种特征和功能的排序和分析。
通过流式细胞仪可以实现单个细胞的荧光测量和分类,将这些数据转化为数值和图像,并对细胞进行进一步的单个细胞功能、结构和组成分析等。
综上所述,流式细胞术已成为现代细胞学、免疫学、生物学等领域中的一种必不可少的技术。
其基本原理和实用技术结合起来,可以让科研工作者更深入地了解细胞的结构、功能、组成以及色素、蛋白
质等分子的表达规律,全面、准确地分析和研究生命体系,推进科学研究和医学进步。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原理
(六)偏光显微镜polarizing microscope
• 用于检测具有双折射性的物质,如纤维丝、纺锤体、胶 原、染色体等。
• 光源前有偏振片(起偏器),使进入显微镜的光线为偏 振光,镜筒中有检偏器 (与起偏器方向垂直的偏振 片)。
• 载物台是可以旋转。
• 物镜与照明系统颠倒; • 用于观察培养的活细胞,
通 常 具 有 相 差 或 DIC 物 镜,有的还具有荧光装 置。
(九)当代显微镜的发展趋势
• 采用组合方式,集普 通光镜、相差、荧光、 暗 视 野 、 DIC 、 摄 影 装置于一体。
• 自动化与电子化。
(二)电子显微镜
透射电子显微镜 transmission electron microscope, TEM
荧光显微镜 Fluorescent microscope
• 特点:光源为短波光; • 有两个特殊的滤光片; • 照明方式通常为落射式。
• 用于观察能激发出荧光的结构。用途:免疫荧光 观察、基因定位、疾病诊断。
Fluorescence image, DNA in blue and Microtubules in green
• 断面的三种处理方法: • 蚀刻( etching )、不蚀刻(no etching )、
深度蚀刻(deep etching )
an onion root tip cell with no etching.
培养细胞内面的深度蚀刻电镜照片,示 Clathrin衣被
网格蛋白(clathrin)是一种进化上高度保守的蛋白质,由分子量为 180kDa的重链和分子量为35~40kDa的轻链组成二聚体, 三个二聚体 形成包被的基本结构单位--三联体骨架(triskelion), 称为三腿蛋白 (three-legged protein)。
淀粉
(七)微分干涉差显微镜 Differential interference contrast microscope (DIC)
• 1952年Nomarski发明,利用 两组平面偏振光的干涉,加 强影像的明暗效果,能显示 结构的三维立体投影。标本 可略厚一点,折射率差别更 大,故影像的立体感更强。
0.1Kv 10Kv 波长(nm) 390~760 13~390 0.05~13 0.005~1 0.123 0.0122
TEM LIGHT PATHWAY
TRANSMISSION ELECTRON
透M射IC电RO子SC显OP微E,镜TEM
制样技术
• 1)超薄切片 • 用于电镜观察的标本须制成厚度仅50nm的超薄切片,用
激光共聚焦扫描 显微镜光路图
LCSM Image of a Xenopus Melanophore
microtubule cytoskeleton (green) and the nucleus (blue) /
暗视野显微镜 dark field microscope
• 聚光镜中央有挡光片,照明光 线不直接进人物镜,只允许被 标本反射和衍射的光线进入物 镜,因而视野背景是黑的,物 体边缘是亮的。
Light Pathway 。
• 光学显微镜的分辨力 R=0.61λ/N.A.
– 其中λ为入射光线波长;
– N.A.为镜口率 =nsinα/2,
– n=介质折射率; – α=镜口角(样品对物镜镜口的张角) 。
表一、几种介质的折射率
介质 折射率
空气 1
水 1.33
香柏油 1.515
α 溴萘 1.66
• 显微镜的几个光学特点:
– 介质折射率越接近镜头玻璃的( 1. 7 )越好。 – sin α /2的最大值小于1;油镜介质为香柏油,
镜口率可接近1.5。 – 普通光线的波长为400~700nm,光镜分辨力约
为0.2μm,人眼的分辨力为0.2mm,因此显微 镜的最大有效倍数为1000X。
内容提要
• 一、 细胞显微技术 • (一)光学显微镜 • (二)电子显微镜 • (三)显微操作技术 • 二、 细胞生物化学与分子生物学技术 • 三、 细胞分离技术
一. 显微技术
• 光学显微镜:以可见光(或紫外线)为光源。 • 电子显微镜:以电子束为光源。
(—)光学显微镜
普通光学显微镜
• 1. 构成: • ①照明系统 • ②光学放大系统 • ③机械装置 • 2. 原理:经物镜形成倒立实像,经目镜放大成虚像。
激光共聚焦扫描显微境 Laser confocal scanning microscope, LCSM
• 用激光作光源,逐点、逐行、逐面快速扫描。 • 能显示细胞样品的立体结构。 • 分辨力是普通光学显微镜的3倍。 • 用途类似荧光显微镜,但能扫描不同层次,形成
立体图像。
laser confocal scanning microscope, LCSM
• 可观察 4~200nm的微粒子, 分辨率比普通显微镜高50倍。
(五)相差显微镜
• 把透过标本的可见光的光程差变成振幅差,从而提高了各 种结构间的对比度,使各种结构变得清晰可见。在构造上, 相差显微镜有不同于普通光学显微镜两个特殊之处。
1. 环形光阑(annular diaphragm):位于光源与聚光器之间。 2. 相位板(annular phaseplate):物镜中加了涂有氟化镁的
原理
• 以电子束作光源,电磁场作透镜。电子束波长与加速电压 (通常50~120KV)的平方根成反比。
• 由电子照明系统、电磁透镜成像系统、真空系统、记录系 统、电源系统等5部分构成。
• 分辨力0.2nm,放大倍数可达百万倍。 • 用于观察超微结构(小于0.2µm)。
表二、不同光线的波长
电子束 名 称 可见光 紫外光 X 射线 α 射线
超薄切片机(ultramicrotome)制作。 • 通常以锇酸和戊二醛固定样品,丙酮逐级脱水,环氧树脂
包埋,以热膨胀或螺旋推进的方式切片,重金属(铀、铅) 盐染色。
2)负染技术
Negative Stained Archaebacteria
3)冰冻蚀刻 freeze-etching
• 亦称冰冻断裂。标本置于干冰或液氮中冰冻。然后 断开,升温后,冰升华,暴露断面结构。向断面喷 涂一层蒸汽碳和铂。然后将组织溶掉,把碳和铂的 膜剥下来,此膜即为复膜(replica)。
