二氧化氮的测定
实验-二氧化氮的测定

法灵敏度高、选择性好,但需要专业的发光测定仪器。
02 03
分光光度法
通过分光光度计测定二氧化氮与某些显色剂反应生成的有色物质的吸光 度,从而计算出二氧化氮的浓度。该方法操作简便、快速,但需要注意 显色剂的选择和反应条件的控制。
电化学法
利用二氧化氮在电极上发生氧化还原反应的原理进行测定。该方法具有 响应迅速、灵敏度高等优点,但需要定期更换电极并校准仪器。
采样
在采样点设置采样装置,以恒定 的流量抽取空气样品,并通过吸
收液将二氧化氮吸收下来。
样品处理
将采样后的吸收液进行适当处 理,如稀释、过滤等,以便于 后续分析。
测定
使用分析仪器对处理后的样品 进行测定,得到二氧化氮的含 量。
数据处理
根据测定结果和采样体积等信 息,计算出空气中二氧化氮的
浓度。
03 二氧化氮的测定步骤
结果的准确性。
严格遵守实验步骤和操 作规范,避免产生误差。
详细记录实验过程中的数 据,包括试剂用量、反应 时间等,以便后续分析。
安全措施与防护
个人防护
佩戴防护眼镜、防毒面具和实验服, 避免二氧化氮对皮肤和眼睛的刺激。
废气处理
使用废气处理装置,将实验过程中产 生的二氧化氮废气进行无害化处理。
急救措施
熟悉二氧化氮中毒的急救措施,如迅 速脱离现场至空气新鲜处、保持呼吸 道通畅等。
安全标识
在实验区域设置明显的安全标识,提 醒实验人员注意安全事项。
06 总结与展望
实验总结
• 实验目的:本次实验旨在通过测定大气中二氧化氮的含量,了解环境污 染状况,并为环境保护提供科学依据。
• 实验原理:采用盐酸萘乙二胺分光光度法,大气中的二氧化氮在采样吸 收过程中生成的亚硝酸,与对氨基苯磺酸进行重氮化反应,再与N-(1萘基)乙二胺盐酸盐作用,生成紫红色的偶氮染料。根据其颜色的深浅, 用分光光度法测定。
二氧化氮的测定
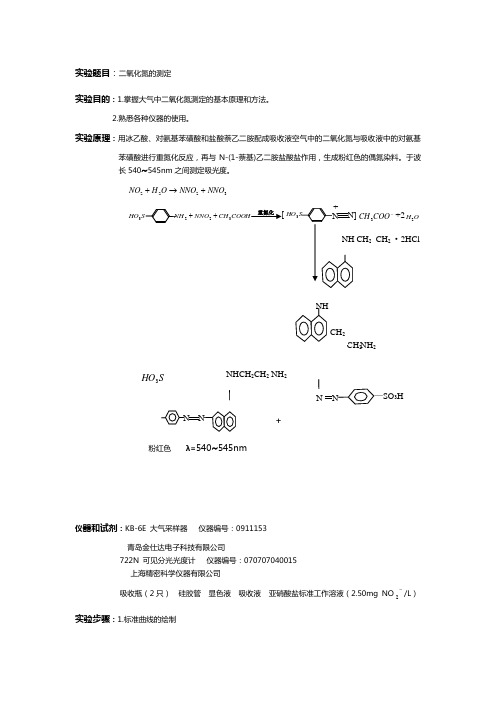
实验题目:二氧化氮的测定实验目的:1.掌握大气中二氧化氮测定的基本原理和方法。
2.熟悉各种仪器的使用。
实验原理:用冰乙酸、对氨基苯磺酸和盐酸萘乙二胺配成吸收液空气中的二氧化氮与吸收液中的对氨基苯磺酸进行重氮化反应,再与N-(1-萘基)乙二胺盐酸盐作用,生成粉红色的偶氮染料。
于波长540~545nm 之间测定吸光度。
3222NNO NNO O H NO +→+COOH CH NNO HO 3223++HO 3仪器和试剂:KB-6E 大气采样器 仪器编号:0911153 青岛金仕达电子科技有限公司722N 可见分光光度计 仪器编号:070707040015S HO 3[ 重氮化SO 3HNHCH 2CH 2 NH 2NH+上海精密科学仪器有限公司吸收瓶(2只)硅胶管显色液吸收液亚硝酸盐标准工作溶液(2.50mg NO 2/L)实验步骤:1.标准曲线的绘制取6支10ml具塞比色管,制备标准色列如下表所示(配制标准色列加入的水为高纯水)标准色列的配制备注:各管混合均匀,于暗处放置20min.用10mm比色皿以水为参比,在波长为542nm处测量吸光度,扣除空白实验的吸光度后对应NO2的浓度(ug/ml)做出标准曲线。
标准曲线2.采样取两支多孔玻璃板吸收瓶,装入10.00ml吸收液。
一支吸收瓶的入口段串接一段15~20cm长的硅胶管,以降低空气中O3对NO2的测定产生的负干扰,另一支吸收瓶的入口端串接一段三氧化铬-砂子氧化管和一段15~20cm长的硅胶管,将NO氧化成NO2后再通人吸收液进行吸收和显色,气样不通过氧化管测定的是NO2含量,通过氧化管测定的是NO2+NO的总量,二者之差为NO的含量。
采样、样品运输及存放过程中应避免阳光照射。
以0.4L/min流量采气。
气态污染物现场采样记录采样地点:沧州医专前三岔道口污染物名称:二氧化氮采样方法:溶液吸收法采样仪器型号:KB-6E 大气采样器采样者:程月张鹏程审核者:李红艳李针。
工作场所中有害物质二氧化氮的测定

工作场所中有害物质二氧化氮的测定
工作场所中存在的有害物质对员工的健康和安全构成潜在威胁。
二氧化氮是一种常见的有害气体,可导致呼吸系统问题和其他健康问题。
因此,测定工作场所中的二氧化氮浓度非常重要,以确保员工的健康和安全。
测定工作场所中的二氧化氮浓度需要使用专业的气体检测器和
监测设备。
这些设备可以检测空气中的二氧化氮浓度,并提供准确的数据。
在进行测定之前,必须确保所有设备都已校准并处于正常工作状态。
测定二氧化氮浓度的最佳时间是在工作期间。
这可以提供最准确的结果,因为员工在这段时间内呼吸和活动最多。
测定期间,必须确保空气循环正常,而且所有门窗都应该关闭,以确保测定的准确性。
在测定之后,必须将数据与有关健康和安全的法规进行比较,以确保测定结果在安全范围内。
如果测定结果高于安全标准,则必须采取适当的措施,例如增加通风或更换工作场所中的设备,以降低二氧化氮浓度。
在工作场所中测定二氧化氮浓度是保证员工健康和安全的重要
举措。
通过使用专业设备和遵循相关法规,可以确保测定结果的准确性并采取适当的措施来降低有害物质的浓度。
- 1 -。
环境空气二氧化氮的测定

环境空气二氧化氮的测定环境空气中含有许多污染物,其中二氧化氮(NO2)是一种常见的空气污染物。
二氧化氮主要是由燃烧过程中产生的,例如汽车、工厂和发电站等都是二氧化氮的主要来源。
高浓度的二氧化氮对人类健康和大气环境都有很大影响,因此需要对其进行测定和监测。
本文将介绍环境空气二氧化氮的测定方法。
一、原理二氧化氮的测定方法主要是基于其与硫化氢(H2S)在酸性条件下反应生成的硝酸盐(NO3^-),硝酸盐可通过光度法或电导法进行测定。
NO2 + H2S + H2O → NO3^- + 2H+ + 2S二、仪器和试剂1、醋酸镍催化氧化仪或相干光度计2、光电离子化甲烷基氮化物(NOx)分析仪3、硫酸反应器4、硫化氢(H2S)和丙酮5、硼酸缓冲液和硫酸6、环保部标准样品NO27、空气样品收集管和净化器三、实验步骤1、准备工作对于空气样品的收集,应先安装好收集管和净化器,并做好标识。
空气样品需要根据具体条件而定,如大气污染物一般采用24小时集中采样等。
2、收集及净化将空气进入净化器后,将二氧化氮经硝酸及亚硝酸处理后,吸在过滤膜上并送到实验室进行分析。
3、试剂的配制(1) 硼酸缓冲液的制备:分别称取2.26克硼酸和3.7毫升浓氢氧化钠(紫色试剂),溶于500毫升蒸馏水中,调pH值至9.0。
(2) 丙酮和硫酸的配制:将500毫升丙酮逐渐滴加入密闭瓶内的200毫升冷却的浓硫酸中,并搅拌均匀,冷却后即可储存。
(3) NO2/hopcalite接收层制备:将NO2接收层向上,俯卧于NO2吸附层上,即可制成NO2/hopcalite接收层。
4、实验操作(1) 生产硫化氢气体将50毫升30%氢氧化钠溶液放入一玻璃烧杯中,加入5.0克硫代硫酸钠,加热至100℃左右,出现气泡时立即进行反应。
(2) 测定NO2含量将收集到的样品在先的压缩空气中通过NO2/hopcalite接收层吸取,排除热性的异物对NO2浓度的影响,还可简单化解NO2的混合物中其他烷氧化物造氧物的影响,使用眼镜滴球呈瓶、视线观察颜色浓淡即为NO2浓度。
氮氧化物测定方法

氮氧化物测定方法
氮氧化物(NOx)是指包括一氧化氮(NO)和二氧化氮(NO2)在内的氮氧化合物的总称。
测定氮氧化物的方法主要有以下几种:
1. 化学法:这是一种常用的氮氧化物测定方法。
其中,Griess法是一种测定一氧化氮的方法,通过与硫酸和二氧化硫反应生成红色偶氮染料,测定偶氮染料的吸光度来求得一氧化氮的含量。
至于二氧化氮的测定,一般通过将样品中的NO 转化为NO2,再使用Griess法进行测定。
2. 光谱分析法:氮氧化物在紫外-可见光谱范围内有吸收特征,在特定的波长下可以吸收特定的光线。
因此,通过测量氮氧化物溶液在特定波长下的吸光度,可以推算出其浓度。
3. 电化学法:氮氧化物可以通过电化学方法测定,其中最常见的是使用电化学气体传感器或电极。
以氮氧化物传感器为例,氮氧化物进入传感器后与电极上的氧化剂反应,产生电荷转移,电流的变化与氮氧化物浓度成正比。
4. 质谱法:质谱法是通过将样品中的氮氧化物离子化,然后通过质谱仪进行离子分析。
这种方法通常适用于对氮氧化物浓度非常低的情况下的测定。
除了以上方法外,还有一些其他较少使用的方法,如化学发光法、比色法、荧光光谱法等。
选择合适的测定方法需要根据具体的测定要求、实验条件和预算等因
素进行综合考虑。
二氧化氮的测定演示文稿(精)

《环境监测》
项目六 空气质量监测
任务4 NO2的测定 主讲教师 马春香
4. NO2测定
内容
1 2 3 4
NO2来源及危害 样品现场采集 实验室操作程序 结果与空气质量判断
4. NO2测定
美国 环保局 1.移动源 2.燃料 3.工业 4.生物 5.火 6.其它
(3) 吸光度测定 (4) 标准曲线绘制
4. NO2测定
NO2测定标准曲线
0.600
y = 0.9771x - 0.001 吸光度
0.400
0.200 0
R = 0.9993
2
0
0.20 0.40 NO2 质量 结果与环境质量判断 GB 3095-2002:
发达的制造业、严重的工业污染 道路行驶数以百万计的汽车、卡车、船舶
4. NO2测定
NO2危害
NOx和VOC、CO、OH(自由基)形成O3、氧化有机物 如甲醛、丙烯醛、过氧乙酰硝酸酯等光化学烟雾主要成分 对人和植物具有
严重刺激性
NO2、臭氧生成过程(两种解释) N2+O2 → NO VOC + OH → HO2 + 其它 NO+O2→ NO2 (高温) HO2 + NO → OH + NO2 NO2+ hγ→NO+ O· , O 2+ O · → O3
资料:NO (包括NO和NO )来源如图
x 2
1955 Smog over Los Angeles-洛杉矶光化学烟雾事件
4. NO2测定
NO2危害
洛杉矶光化学烟雾事件
现象:晴朗夏日正午或至午后
漂浮浅蓝色烟雾
光度法测定二氧化氮含量试验报告

盐酸萘乙二胺分光光度法测定上岗考核样品中二氧化氮含量实验报告一、样品1、样品名称:上岗考核样2、样品编号:二氧化氮现场考样○一3、样品来源:省环境监测总站4、收样日期:2020年6月19 日5、测定地点:市环境监测站实验室6、测定日期:2020年6 月19 日7、报告日期:2020年6 月20日二、分析方法1、方法名称:环境空气氮氧化物(一氧化氮和二氧化氮)的测定盐酸萘乙二胺分光光度法。
2、方法来源:HJ 479-2009。
3、方法检出限:0.12µg/10ml吸收液。
4、方法原理:二氧化氮被吸收液吸收并反应生成粉红色偶氮染料。
生成的偶氮染料在波长540nm处的吸光度与二氧化氮的含量成正比。
三、主要仪器和试剂:1、仪器:①仪器型号:7230G可见分光光度计。
②仪器编号:WYJC2011N049。
2、试剂:①冰乙酸。
②N-(1-萘基)乙二胺盐酸盐贮备液,ρ(C10H7NH(CH2)2NH2·2HCl) =1.00g/L:称取0.50g N-(1-萘基)乙二胺盐酸盐于500ml容量瓶中,用水溶解稀释至刻度。
此溶液贮于密闭的棕色瓶中,在冰箱中冷藏。
③显色液:称取5.0g对氨基苯磺酸溶解于200ml 40~50℃热水中,将溶液冷却至室温,全部移入1000ml容量瓶中,加入50ml N-(1-萘基)乙二胺盐酸盐贮备液和50ml冰乙酸,用水稀释至刻度。
此溶液贮于密闭的棕色瓶中,在25℃以下暗处存放。
④亚硝酸盐标准贮备液,ρ(NO2-)=250 µg/ml:准确称取0.3750g 亚硝酸钠(NaNO2,优级纯,使用前在105℃±5℃干燥恒重)溶于水,移入1000ml棕色容量瓶中,用水稀释至标线。
此溶液贮于密闭的棕色瓶中于暗处存放。
⑤亚硝酸盐标准工作液,ρ(NO2-)=2.5 µg/ml:准确吸取亚硝酸盐标准贮备液1.00ml于100ml棕色容量瓶中,用水稀释至标线。
实验8 二氧化氮测定

实验8 二氧化氮测定实验8二氧化氮测定实验八二氧化氮的测定实验目的1、使学生掌握大气中二氧化氮测定的基本原理和方法;2、熟悉各种仪器的使用。
实验原理见到教材第四章第四节。
仪器和试剂1.吸收瓶内装10ml、25ml或50ml吸收液的多孔玻板吸收瓶。
2.便携式空气采样器流量范围0~1l/min。
采气流量为04l/min时,误差大于±5%。
3.分光光度计。
4.硅胶管内径约6mm。
5.n-(1-萘基)乙二胺盐酸盐贮备液称取0.50n-(1-萘基)乙二胺盐酸盐于500ml 容量瓶中,用水溶解稀释至刻度。
此溶液贮于密封的棕色瓶中,在冰箱中冷藏,可以稳定三个月。
6.呈色液称取5.0g[nh2c6h4so3h]对氨基苯磺酸溶约200ml热水中,将溶液加热至室温,全部迁入1000ml容量瓶,重新加入50ml冰乙酸和50.0mln-(1-萘基)乙二胺盐酸盐鞭叶液,用水吸收至刻度。
此溶液于密封的棕色瓶中,在25℃以下暗处放置,可以平衡三个月。
7.吸收液使用时将显色液和水按4+1(v/v)比例混合,即为吸收液。
此溶液于密闭的棕色瓶中,在25℃以下暗处存放,可稳定三个月。
若呈现淡红色,应弃之重配。
8.亚硝酸盐标准储备溶液250mgno2-/l,精确称取0.3750g亚硝酸钠(nano2-优级氢铵,预先在干燥器内置放24h),迁入1000ml容量瓶中,用水吸收至标线。
此溶液储于密封瓶中于暗处放置,可以平衡三个月。
9.亚硝酸盐标准工作溶液2.50mgno2-/l,用亚硝酸盐标准储备溶液稀释,临用前现配。
操作步骤1.取样取一支多孔玻板吸收瓶,装入10.0ml吸收液,以0.4l/min流量采气6~24l。
采样、样品运输及存放过程应避免阳光照射。
空气中臭氧浓度超过0.25mg/m3时,使吸收液略显红色,对二氧化氮的测定产生负干扰。
采样时在吸收瓶入口端串接一段15~20cm长的硅胶管,可以将臭氧浓度降低到不干扰二氧化氮测定的水平。
二氧化氮的测定

二氧化氮的测定:
环境监测(李广超)
常用测定方法:盐酸萘乙二胺分光光度法
用冰醋酸、对氨基苯磺酸和盐酸萘乙二胺配成吸收液。
空气中的二氧化氮溶于水后生成亚硝酸,亚硝酸与吸收液中的对氨基苯磺酸进行重氮化反应,再与N-(1-萘基)-乙二胺盐酸盐溶液,生成粉红色的偶氮染料,在波长540-545nm之间测定吸光度。
用亚硝酸钠标准溶液配制成标准色列,于波长540nm处测其吸光度及试剂空白溶液的吸光度,用标准色列的吸光度对亚硝酸跟含量绘制出标准曲线,并用最小二乘法计算标准曲线的回归方程y=a+bx.采样后,测定样品的吸光度,用下式计算空气中二氧化氮的浓度(mg/m3).
P(NO2)=(A-A0-a)/bfVs×Vt/Va
式中:A-样品溶液的吸光度
A0-空白试验溶液的吸光度;
b—标准曲线的斜率;
a---标准曲线的截距
Vt—采样用吸收液的总体积;ml
Va—测定时所取样品溶液的总体积,ml
Vs—换算成标准状态(273.15K,101.325KPa)下的采样体积,L;
f—Saltzman实验系数,0.88(当空气中二氧化氮浓度高于0.720mg/m3时,f值为0.77)
干扰:臭氧:采样时在吸收瓶入口端串接一段15-20cm长的硅胶管即可消除干扰。
土壤农化实验:实验八 大气中二氧化氮的测定

四、实验注意事项
1.吸收液必须无色,如呈微红色可能有亚硝酸根的 污染。日光照射也能引起吸收液显色,所以吸收管 在采样、运送和存放过程中都应采取避光措施。
2.在采样过程中,如吸收液体积缩小较显著,应用 水补充至原来体积(事先做好标线)。
3.氧化管适于在相对湿度30%-70%时使用,当大于 70%时,应勤换氧化管,小于30%时,则使用前, 用经过水潮湿空气通过氧化管,平衡1 h。
4.在交通要道采样时,在将采样点设在十字路口汽 车停车线旁人行道上,距离马路边1.5 10 ml比色管,按下表中要求加好试 剂后,摇匀,避开阳光直射,放置15 min,用1 cm比色皿于 540 nm下以水为参比测定吸光度。
• 3. 样品测定:采样后,将吸收液移入比色皿中,用校准曲 线的绘制方法测定吸光度。
氮氧化物的测定
标准曲线 1. 按下表配制NO2-标准溶液系列,摇匀,避光放置15min
实验八 大气中二氧化氮的测定
一、实验目的
掌握盐酸萘乙二胺光度法测定大气中二氧化氮 的含量并进行评价。
二、实验原理
二氧化氮经吸收,在水中形成亚硝酸盐,亚硝 酸与对氨基苯磺酸起重氮化反应,再与盐酸萘乙 二胺偶合,生成玫瑰红色偶氮染料,根据颜色深 浅,定量测定。
三、实验步骤
1.采样:将一个内装5 ml采样用吸收液的多孔玻璃吸收管的 出气口连接在便携式采样器上,以0.3 L/min的流量采气至吸 收液呈微红色为止,记录采样时间,算出采样体积,并记录 采样时的气温和气压。
编号
0 1 2 3 4 5 6
NO2-标准溶液(5 μg /mL)/mL 吸收原液/mL
0.00
4.00
0.10
4.00
0.20
4.00
二氧化氮的测定(精)

3
V0 K
式中: c——空气中二氧化氮浓度,mg/m3; K——NO2→NO2- 的经验转换系数,0.89; BS——由实验测得的计算因子,μg/(mL· 吸光度); A——样品溶液的吸光度; A0——试剂空白吸光度; V1——采样用的吸收液的体积; D——分析时样品溶液的稀释倍数。
总结:
恒温恒流采样器工作原理 氮氧化物样品的采集 氮氧化物样品的分析
开机,调节流量,开始采样
填写采样记录 采样时间到(或吸收液变粉红色)关机,完成采样记录
拆下吸收管,用橡胶管将吸收管的进口和出口相接
整理采样仪,将吸收管避光保存,送回实验室分析
分光光度计定量步骤
标准色列的配制 测定标准色列的吸光度 绘制工作曲线 样品吸光度的测定 样品中二氧化氮的含量
数据的处理
用最小二乘法计算标准曲线的回归方程,求计
算因子Bs。
采样体积要换算成标准状态下的体积。 计算公式为:
273 Pt V0 Vt 273 t P0
用亚硝酸钠标准溶液制备标准曲线时:
cNO2
A A0 BsV1D (m g / m )
3
V0 K
cNO2
A A0 BsV1D (m g / m )
2.3 二氧化氮的测定 —改进的saltzaman法
原理
空气中的二氧化氮,在采样吸收过程 中生成的亚硝酸,与对氨基苯磺酰胺进行重氮 化反应,再与N-(1-萘基)乙二胺盐酸盐作用, 生成紫红色的偶氮染料。根据其颜色的深浅, 比色定量。
分光光度法 定量
采样
数据处理
采样器的使用
仪器和附件的检查
把吸收液准确的移入吸收管 正确连接采样仪
检测二氧化氮的方法

检测二氧化氮的方法
《检测二氧化氮的方法》
二氧化氮是一种对人体健康有害的气体,因此对其进行有效的检测十分重要。
目前,有多种方法可以用来检测二氧化氮的浓度,以保障环境和人体健康。
传统的检测方法中,有一种是化学方法。
该方法利用化学试剂来与二氧化氮发生反应,生成有色产物或产生化学信息变化,通过测定产物的量来确定二氧化氮的浓度。
然而,这种方法存在着对化学试剂的需求量大、操作步骤繁琐等缺点。
近年来,随着科技的不断发展,一些新的检测方法也得到了广泛应用。
比如,光学方法可以利用特定波长的光束照射样品,通过检测光束经过后的光强变化来确定二氧化氮的浓度。
此外,电化学传感器也是一种常用的检测方法,利用电极材料与二氧化氮发生反应,通过测定产生的电信号来确定浓度。
除了以上的方法,还有一些先进的检测技术不断涌现,如纳米技术和光子学等,这些方法在提高检测的精度和灵敏度方面有着显著的优势。
总的来说,检测二氧化氮的方法多种多样,各有特点。
而未来随着技术的不断进步,相信有更多更先进的方法会被应用到日常的环境监测和人体健康保护中。
3-9 二氧化氮的测定

氮气是大气组成中占绝对多数的气体(78.06%), 它的主要氧化物有NO、NO2、NO3、N2O、N2O3、N3O4和N2O5,统称 为氮氧化物,占主要成分的是NO和NO2。一般以NOX表示NO和NO2 的总量。 NO为无色、无臭、微溶于水的气体,在空气中易被氧化成 NO2。 NO2为棕红色具有强刺激性臭味的气体,毒性比NO高4倍, 是引起支气管炎、肺损害等疾病的有害物质。 测定方法:盐酸萘乙二胺分光光度法。
二、二氧化氮的测定 2、二二氧化氮的测定方方法
样品的保存: 样品采集、运输及存放过程中避光保存,样品采集后 尽快分析。若不能及时测定,将样品于低温暗处存放,样 品在30℃暗处存放,可稳定8 h;在20℃暗处存放,可稳定 24 h;于0~4℃冷藏,至少可稳定3d。
校准曲线的绘制:
二、二氧化氮的测定 2、二二氧化氮的测定方方法 盐酸萘乙二胺分光光度法
取6支10 ml具塞比色管,按表1制备亚硝酸盐标准溶液系列。 根据表1分别移取相应体积的亚硝酸钠标准工作液,加水至 2.00 ml,加入显色液8.00 ml。
各管混匀,于暗处放置20 min(室温低于20℃时放置40 min以上)
二、二氧化氮的测定 2、二二氧化氮的测定方方法 盐酸萘乙二胺分光光度法
二、二氧化氮的测定 2、二二氧化氮的测定方方法
样品的采集:
现场空白
短时间采样(1 h以内) 取两支内装10.0 ml吸收液的多孔玻板吸收瓶和一支内装 5~10 ml酸性高锰酸钾溶液的氧化瓶(液柱高度不低于80 mm),用尽量短的硅橡胶管将氧化瓶串联在二支吸收瓶之间, 以0.4 L/min流量采气4~24 L。 长时间采样(24 h) 取两支大型多孔玻板吸收瓶,装入25.0 ml或50.0 ml吸收 液(液柱高度不低于80 mm),标记液面位置。取一支内装50 ml酸性高锰酸钾溶液的氧化瓶,将吸收液恒温在20℃±4℃, 以0.2 L/min流量采气288 L。
氮氧化物检测法

环境空气氮氧化物(一氧化氮和二氧化氮)的测定盐酸萘乙二胺分光光度法方法一:高锰酸钾氧化法1 适用范围本法规定了测定环境空气中氮氧化物的分光光度法,适用于环境空气中氮氧化物、二氧化氮、一氧化氮的测定。
本标准的方法检出限为0.12⑷/10 ml吸收液。
当吸收液总体积为10 ml,采样体积为24 L 时,空气中氮氧化物的检出限为0.005 mg/m 3。
当吸收液总体积为50 ml ,采样体积288 L时,空气中氮氧化物的检出限为0.003 mg/m 3。
当吸收液总体积为10 ml,采样体积为12〜24 L时,环境空气中氮氧化物的测定范围为0.020〜2.5 mg/m3。
2 方法原理空气中的二氧化氮被串联的第一支吸收瓶中的吸收液吸收并反应生成粉红色偶氮染料。
空气中的一氧化氮不与吸收液反应,通过氧化管时被酸性高锰酸钾溶液氧化为二氧化氮,被串联的第二支吸收瓶中的吸收液吸收并反应生成粉红色偶氮染料。
生成的偶氮染料在波长540 nm 处的吸光度与二氧化氮的含量成正比。
分别测定第一支和第二支吸收瓶中样品的吸光度,计算两支吸收瓶内二氧化氮和一氧化氮的质量浓度,二者之和即为氮氧化物的质量浓度(以NO 2计)3 试剂和材料除非另有说明,分析时均使用符合国家标准或专业标准的分析纯试剂和无亚硝酸根的蒸馏水、去离子水或相当纯度的水。
必要时,实验用水可在全玻璃蒸馏器中以每升水加入0.5g 高锰酸钾(KMnO 4)和0.5g 氢氧化钡[Ba(OH)2]重蒸。
3.2盐酸羟胺溶液,p=0.2〜0.5 g/L。
3.3 硫酸溶液,C(1/2H2SO4)=1 mol/L :取 15 ml 浓硫酸(p o=1.84 g/ml ),徐徐加到 500 ml 水中,搅拌均匀,冷却备用。
3.4酸性高锰酸钾溶液, p(KMnO 4)=25 g/L :称取25g高锰酸钾于1 000 ml烧杯中,加入 500 ml 水,稍微加热使其全部溶解,然后加入 1 mol/L 硫酸溶液(3.3) 500 ml ,搅拌均匀,贮于棕色试剂瓶中。
二氧化氮的测定

数据处理
采样器的使用
仪器和附件的检查 把吸收液准确的移入吸收管 正确连接采样仪 开机,调节流量,开始采样 填写采样记录 采样时间到(或吸收液变粉红色)关机,完成采样记录 拆下吸收管,用橡胶管将吸收管的进口和出口相接 整理采样仪,将吸收管避光保存,送回实验室分析
分光光度计定量步骤
标准色列的配制 测定标准色列的吸光度 绘制工作曲线 样品吸光度的测定 样品中二氧化氮的含量
数据的处理
用最小二乘法计算标准曲线的回归方程,求计
算因子Bs。
采样体积要换算成标准状态下的体积。
计算公式为:
V0 Vt 227733tPP0t
用亚硝酸钠标准溶液制备标准曲线时:
cN2O (m/g m 3)AV A 0 0K BsV 1D
cN2O (m/g m 3)AV A 0 0K BsV 1D
2020
演讲完毕 谢谢观看
式中: c——空气中二氧化氮浓度,mg/m3; K——NO2→NO2- 的经验转换系数,0.89; BS——由实验测得的计算因子,μg/(mL·吸光度); A——样品溶液的吸光度; A0——试剂空白吸光度; V1——采样用的吸收液的体积; D——分析时样品溶液的稀释倍数。
总结:
恒温恒流采样器工作原理 氮氧化物样品的采集 氮氧化物样品的分析
度的测定,也适用于室内和公共场所空气中 二氧化氮浓度的测定。
2.3 二氧化氮的测定 —改进的saltzaman法
原理
空气中的二氧化氮,在采样吸收过程中生 成的亚硝酸,与对氨基苯磺酰胺进行重氮化反 应,再与N-(1-萘基)乙二胺盐酸盐作用,生 成紫红色的偶氮染料。根据其颜色的深浅,比 色定量。
采样
分光光度法 定量
职业任务模块二
室内环境检测之二氧化氮测定

影响心血管系 统:可能导致 高血压、心脏 病等疾病
致癌作用:长 期暴露可能增 加患癌风险
对环境的影响
01
破坏臭氧层:二氧化氮是破坏臭氧层
的主要气体之一
02
温室效应:二氧化氮是一种温室气体,
会导致全球气候变暖
03
酸雨:二氧化氮在大气中与水蒸气反
应,形成酸雨,对环境造成破坏
室内环境检测之二氧化氮测定
演讲人
目录
01. 二氧化氮的危害 02. 二氧化氮的测定方法 03. 室内环境检测的注意事项 04. 室内环境检测结果的分析与
处理
二氧化氮的危害
对人体健康的影响
刺激呼吸道: 引起咳嗽、呼 吸困难等症状
影响神经系统: 可能导致头痛、 头晕、失眠等 症状
损害肺部:长 期暴露可能导 致肺气肿、肺 心病等疾病
便于理解和分析
数据处理:对数据进 行预处理,包括去除 异常值、填补缺失值
等
结果处理:根据分析 结果,提出改善室内 环境质量的建议和措
施
数据分析:采用统计分 析方法,如方差分析、 回归分析等,分析数据
之间的关系和规律
结果报告:撰写报告, 总结分析结果和处理 建议,供决策者参考
超标处理
通风换气:增加室内空气流 通,降低污染物浓度
室内空气质量达标
空气净化器:使用空 气净化器,去除室内
污染物
加强个人防护:佩戴 口罩、勤洗手,减少 污染物对人体的危害
谢谢
1
2
3
4
仪器法
01
化学发光法:利用化学 反应产生的光信号进行 测定
02
紫外可见分光光度法: 利用紫外可见光吸收原 理进行测定
二氧化氮标准气体的配制和转换系数的测定

二氧化氮标准气体的配制和转换系数的测定
二氧化氮被广泛应用于各种工程领域,为了更准确地测量二氧化氮的含量,我们必须使用标准气体进行检测。
二氧化氮标准气体的配制和转换系数的测定是一项重要的工作,这对于更准确地测量和监测二氧化氮十分关键。
1.准备标准气体:根据技术规范的要求,我们需要准备含有不同浓度的二氧化氮气体标准气体,用以测定配制和转换系数。
2.准备检测系统:根据规定的技术要求,一个用于测试及校准二氧化氮的检测系统需要准备就绪,并保证各项测试参数符合要求。
3.配制和转换系数测试:将不同浓度的二氧化氮同时注入检测系统,在不同温度和压力下进行测量,将其与标准物质相比较,从而得出转换系数和配制系数。
4.标定校准:完成上述配制和转换系数测试后,把计算得出的校准因数和其它参数通过对比调整,以达到更准确的结果。
使用标准气体测定二氧化氮的配制和转换系数尤为重要,因此需要仔细检查上述流程的步骤,以确保测试参数的准确性。
严格的控制流程,合格的测试设备和仪器,以及专业的操作者,都将有助于确保测量结果的准确性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二氧化氮的测定摘要中国是以燃煤为主的发展中国家,近20年来随着我国经济的快速发展,燃煤造成的环境污染日趋严重,特别是燃煤烟气中的NO2。
氮氧化物排放量的剧增使我国城市大气中的NO2污染程度加重,使NO2对大气的污染已成为一个不容忽视的问题。
目前对于大气中二氧化氮的含量尤为关注,为了方便监测,常用盐酸萘乙二胺分光光度法来测定大气中NO2的含量。
关键词:空气,二氧化氮,空气采样器,盐酸萘乙二胺分光光度法LUOYANG INSTITUER OF TECHNOLOGY CAMPUS INTHE DETERMINATION OF NITROGEN DIOXIDEABSTRACTChina is by burns coal the developing country primarily, in the recent 20 years along with our country economy's fast development, the environmental pollution which the coal-burning creates are day by day serious, specially burn coal in haze NO2. Because the NO2withdrawal's sharp increase makes in our country city atmosphere the NO2 pollution degree to aggravate, causes NO2 to become a not allow to neglect question to the atmospheric pollution. At present the nitrogen oxide contains that regarding the atmosphere in especially to pay attention, for the convenience monitor, the commonly used hydrochloric acid naphthalene ethylene diamante spectrophotometer method determines in the atmosphere the NO2 content.KEY WORDS:Air, nitrogen dioxide, diazonium reaction, air sampler, Naphthyl ethylenediamine hydrochloride spectrophotometry目录前言 (1)第1章大气中二氧化氮测定的原理 (3)1.1 原理 (3)1.2 仪器 (3)1.3 试剂 (3)1.3.1 N-(1-萘基)乙二胺盐酸盐储备溶液 (4)1.3.2 吸收原液 (4)1.3.3 采样用吸收液 (4)1.3.4 亚硝酸钠标准贮备液 (4)1.3.5 亚硝酸钠标准溶液 (4)第2章校园中二氧化氮的测定 (5)2.1标准曲线的绘制 (5)2.2 采样点的布设 (6)2.3 采样 (7)2.4 样品的测定 (7)2.5 数据处理 (8)第3章操作要点及注意事项 (9)结论 (10)谢辞 (11)参考文献 (12)外文资料翻译 (13)前言氮氧化物(NO X)种类很多,造成大气污染的主要是一氧化氮(NO)和二氧化氮(NO2),因此环境学中的氮氧化物一般是指这二者的总称。
此次主要是通过研究大气中的二氧化氮来确定氮氧化物的含量。
二氧化氮是一种棕红色有刺激性臭味的气体。
具有腐蚀性和较强的氧化性,是污染大气的主要成分之一。
就全球来看,大气中的二氧化氮一部分来源于雷电、含氮有机物的分解、火山爆发、森林火灾等天然源;另一部分来源于燃料燃烧等人为源。
(如机动车、汽车等流动源;工业窑炉等固定源;以及一些化工过程,即各种硝化过程)。
对于学校及周边地区的二氧化氮主要来源于汽车尾气,化石燃料和植物的焚烧,以及农田土壤和动物排泄物中含氮化合物的转化等。
其中有部分的二氧化氮(NO2)是由一氧化氮(NO)氧化而来的。
由于二氧化氮是一种具有危害性的气体,处理不当就会引起一下的现象:(1)酸沉降:汽车中的汽油、柴油燃料在汽缸中燃烧需要空气,空气中有78%的氮气。
由于火花塞点火时使用高压电点火,在高压电的作用下,氮气与氧气生成一氧化氮(NO),一氧化氮不稳定,与氧气进一步反应生成二氧化氮(NO2)。
二氧化氮上升到空中与水蒸气相遇时,就会形成硫酸和硝酸小滴,使雨水酸化,这时落到地面的雨水就成了酸雨。
其中煤和石油的燃烧是造成酸雨的主要祸首。
酸雨会对环境带来广泛的危害,造成巨大的经济损失,如:腐蚀建筑物和工业设备;破坏土壤成分,使农作物减产甚至死亡;饮用酸化物造成的地下水,对人体有害等。
(2)光化学烟雾:氮氧化合物中的二氧化氮与碳氢化合物经紫外线照射发生光化学反应,生成光化学烟雾。
光化学烟雾对人体有很大的刺激性和毒害作用。
(3)破坏臭氧层:二氧化氮和氯氟烃一样具有破坏平流层中的臭氧的能力。
在光合作用下破坏臭氧层,且有二次污染物二氧化氮产生。
(4)引起温室效应:氮氧化物的释放过程中存在着硝化和反硝化作用,此过程中二氧化氮放出,对温室效应有强大的贡献力:1分子二氧化氮的温室效应增温潜力为1分子二氧化碳的300倍。
通过测定二氧化氮来确定氮氧化物的含量是评价人类生存环境质量优劣的重要指标之一。
近几年的观测证明,随着人为活动排放的氮氧化物的增加,不仅使城市污染大气中的臭氧浓度升高,也使干净背景大气中的臭氧浓度明显上升,全球范围对流层臭氧浓度增加还可能影响地~气系统的辐射平衡而引起气候的变化。
因此我们应时刻注意氮氧化物中二氧化氮的变化,并对其进行检测和分析。
盐酸萘乙二胺分光光度法(Saltzman法)是一种常用的测定大气中二氧化氮(NO2)的方法。
该方法灵敏度高,选择性好,操作简便且显色稳定。
本实验是通过空气中的二氧化氮与吸收液中的对氨基苯磺酸进行重氮反应,再与N-(1-萘基)乙二胺盐酸盐作用,生成粉红色的偶氮染料,,与波长540~545nm之间,测定吸光度。
盐酸萘乙二胺分光光度法主要使用于工厂,油库,车库,广场等场合。
第1章大气中二氧化氮测定的原理1.1原理空气中的二氧化氮被吸收液吸收后,生成亚硝酸和硝酸。
其中亚硝酸与对氨基苯磺酸起重氮化反应。
再与盐酸萘乙二胺偶合,呈玫瑰红色,根据颜色深浅,于波长540nm处,用分光光度法测定。
1.2 仪器1.2.1多孔玻板吸收瓶:10mL。
1.2.2空气采样器:流量范围0~1L /min。
1.2.3分光光度计。
1.3试剂分析时均使用符合国家标准的分析纯试剂和无亚硝酸根的蒸馏水或等同纯度的水,必要时可在全玻璃蒸馏器重加少量的高锰酸钾和氢氧化钡重新蒸馏。
1.3.1 N-(1-萘基)乙二胺盐酸盐储备溶液称取 0.50gN-(1-萘基)乙二胺盐酸盐[C10H7NH(CH2)2NH2·2HCI]于50ml容量瓶中,用水溶解稀释至刻度。
此溶液贮于密封的棕色试剂瓶中,在25℃以下暗处存放,可稳定3个月。
1.3.2 吸收原液称取 5.0g对氨基苯磺酸[NH2C6H4SO3H],通过玻璃小漏斗直接加入1000ml容量瓶中,加入50ml冰乙酸和850ml水的混合溶液,盖塞振摇使其溶解,待对氨基苯磺酸完全溶解后,加入50ml N(1-萘基)乙二胺盐酸盐储备溶液,用水稀释至标线。
此为吸收原液,存入棕色瓶中。
1.3.3 采样用吸收液按4分吸收原液和1分水的比例混合。
1.3.4 亚硝酸钠标准贮备液称取0.1500g亚硝酸钠(NaNO2,预先在干燥器内放置24h以上),溶解于水,移入1000ml容量瓶中,用水稀释至标线。
此溶液每毫升含100.0µg亚硝酸根(NO2-),贮于棕色瓶中于暗处存放,可稳定3个月。
1.3.5 亚硝酸钠标准溶液临用前,吸取贮备液2.50ml于100ml容量瓶中,用水稀释至标线。
此溶液每毫升含2.5µg亚硝酸根(NO2-).第2章校园中二氧化氮的测定2.1标准曲线的绘制取6支10ml具塞比色管,按(表2-1)数据配制标准系列。
表2-1 亚硝酸钠标准系列各管摇匀后,避光放置20min,在波长540nm处,用1cm比色皿,以含量水为参比,测定吸光度。
以吸光度为纵坐标,相应的标准溶液中NO2μg为横坐标,绘制标准曲线。
由于比色皿有误差,其结果会影响吸光度的大小,经校正后所得的吸光度见(表2-2):表2-2 经校正后所得的吸光度回归方式的计算:以亚硝酸钠稀释后浓度为x轴,校正后吸光度为y轴做标准曲线(图2-1):图2-1 标准曲线由(图2-1)得出回归方程式为:y=0.9729x+0.00362.2 采样点的布设通过初步调查了解发现,洛阳理工学院东校区校园内大气污染的主要来源于餐厅和锅炉房中的燃料燃烧、汽车尾气、植物及垃圾的焚烧、以及土壤和动物排泄物中含氮有机物的转化等几个方面。
为了更确切的了解校园中大气污染的现状,我们需要对其进行布点采样,以获取具有代表性的大气样品。
通过对校园中污染源分布的了解(污染分布均匀且又有多个污染源),经过分析后,确定采用网格布点法。
其主要分布位置为:( 1 ) 以污染源比较集中的餐厅为中心(2)在汽车流通量多的几个校门口分别布点(东、西、北各设一点)2.3采样采样时取一只内装10.00ml吸收液的多孔玻板吸收管,并使氧化管管)弄湿时,污染后面的吸口稍微向下倾斜,以免当湿空气将氧化剂(CrO3收液。
以0.2~0.3L/min流量,避光采样至吸收液呈微红色为止,记下采样时间,密封好采样管,带回实验室,当日测定。
采样时,若吸收液不变色,采样应不少于6L。
并记下采样现场的温度和大气压。
2.4 样品的测定采样后,放置20min(气温低时应适当延长显色时间。
如室温15℃时,显色40min以上,)直接将样品溶液移入1cm比色皿中,按绘制标准曲线的方法测定试剂空白试液和样品溶液的吸光度。
若样品溶液的吸光度超过标准曲线的测定上限,可用吸收液稀释后再测定吸光度。
计算结果时应乘以稀释倍数。
表2-3 采样的吸光度2.5数据处理大气中二氧化氮的浓度CNO2(mg/m3)的计算:由回归方程式:y=0.9729x+0.0036得出二氧化氮的质量。
式中y——二氧化氮的吸光度;采样体积的计算:Vt= Q×t (公式2-1)式中Q——采样时的流量,L /m3;T——采样时间,min。
由于我国空气质量标准是以标准状态下(0℃,101.325KPa)时的气体体积为对比依据。
为了使计算出的污染物具有可比性,应将监测时的气体采样体积换算成标准状态下的气体体积。
