大气中二氧化氮的测定
大气中二氧化氮的测定

大气中二氧化氮的测定二氧化氮的测定1 主题内容与适用范围 1.1主题内容本标准规定了测定环境空气中二氧化氮的分光光度法。
1.2适用范围当采样体积为4~24L时,本标准适用于测定空气中二氧化氮的浓度范围为0.015~2.0mg/m3。
2 引用标准GB 5275 气体分析标准用混合气体的制备渗透法 3 术语Saltzman 实验系数(f):用渗透法制备的二氧化氮校准用混合气体,在采气过程中被吸收液吸收生成的偶氮燃料相当于亚硝酸根的量与通过采样系统的二氧化氮总量的比值。
该系数为多次重复实验测定的平均值,测定方法见附录B。
4 原理空气中的二氧化氮与吸收液中的对氨基苯磺酸进行重氮化反应,再与N-(1-萘基)乙二胺盐酸盐作用,生成粉红色的偶氮燃料,于波长540~545nm之间处,测定吸光度。
5 试剂除另有说明,分析时均使用符合国家标准的分析纯试剂和无亚硝酸根的蒸馏水或同等纯度的水,必要时可在全玻璃蒸馏器中加少量高锰酸钾和氢氧化钡重新蒸馏。
水纯度的检验方法:按8.1.1条测量,吸收液的吸光度不超过0.005.5.1 N-(1-萘基)乙二胺盐酸盐储备液:称取0.50gN-(1-萘基)乙二胺盐酸盐[C10H7NH(CH2)2NH2・2Cl]于500mL容量瓶中,用水溶解稀释至刻度。
此溶液贮于密封的棕色试剂瓶中,在冰箱中冷藏,可稳定三个月。
5.2 显色液:称取5.0g对氨基苯磺酸[NH2C6H4SO3H],溶于约200mL热水中,将溶液冷却至室温,全部移入1000mL容量瓶中,加入50mL冰乙酸和50.0mL N-(1-萘基)乙二胺盐酸盐储备液(5.1),用水稀释至刻度。
此溶液于密闭的棕色瓶中,在25℃下暗处存放,可稳定三个月。
5.3 吸收液:使用时将显色液(5.2)和水按4+1(V/V)比例混合,即为吸收液。
此溶液于密闭棕色瓶中,25℃以下暗处存放,可稳定三个月。
若呈现淡红色,应弃之重配。
5.4 亚硝酸盐标准工作溶液:2.50mgNO2-/L。
居住区大气中二氧化氮的测定原始记录

;样品状态: 液体 ;
吸光度 A
检测结果 C(mg/m3)
备注
分析:
复核:
日期:
年月日
有限公司
年 月 日颁布
- -J130 居住区大气中二氧化氮的测定原始记录(续表) 第 页 共 页
样品编号
标况体积 吸收液体 稀释倍 V0(L) 积 V1(mL) 数 D
吸光度 A
检测结果 C(mg/m3)
备注
分析:
复核:
日期:
年月日
C=(A-A0)×V1×D/b/K/V0
空白吸光度 A0:
其中:K 为 NO2-NO2-转换系数,0.89;
V1 为吸收液体积,mL;
A 为样品吸光度;
D 为稀释倍数;
V0 为标准状况下的采样体积,L。
可见分光光度计 仪器型号
仪器编号
测定Байду номын сангаас件
波长: 540~550 nm;比色皿厚度: 1 cm;显色时间: 15 min
有限公司
年 月 日颁布
- -J130 居住区大气中二氧化氮的测定原始记录 第 页 共 页
项目编号
温度(℃)
湿度(RH%)
检测依据
居住区大气中二氧化氮检验标准方法—改进的 Saltzman 法 GB 12372-1990 [检出限:短时间采样 0.03mg/m3;长时间采样:0.003mg/m3]
计算公式 仪器名称
标准曲线信息[制备日期:
]Y=bX+a;a=
;b=
;r=
标准溶液名称
亚硝酸盐标准溶液
标准溶液浓度
2.5µg/mL
校准点含量(µg)
回收率合格区间
80-120%
空气中二氧化氮的测定

项目任 务 书GB/T15435—1995————《环 境监 测课 程》策划人:武本奎日期:2009-4-21目录一.项目名称二.项目任务三.测定方法四.项目目标五.项目意义六.检测单位七.操作时间八.项目内容九.准备工作十、操作步骤十一.参考资料十二.自评表一.项目名称:大气中二氧化氮的测定二.项目任务:(1). 配置各种标准溶液(2).绘制标准曲线和校准曲线三.测定方法:GB/T15435—1995大气中二氧化氮检验标准方法Saltzman法(当样品体积为4—24L时,本标准适用于测定空气中二氧化氮的浓度范围为0.015—2.0mg/m3。
)四.项目目标:(1)、掌握溶液吸收富集采样方法对大气中分子态污染物的采集;(2)、掌握盐酸萘乙二胺分光光度法测定氮氧化物的原理和操作技术;(3)、能够正确操作使用大气采样器。
五.项目意义:二氧化氮有毒性,对深呼吸道具有强烈的刺激作用,可引起肺损害甚至造成肺水肿。
二氧化氮使植物枯黄。
测定二氧化氮有助于了解空气质量,对于保护环境、保护人类有重要意义。
六.检测单位:环境0815监测站七.操作时间:2009年4月21日——2009年4月22日八.项目内容:(1)、掌握测定二氧化氮的方法和原理(2)、掌握绘制标准曲线的方法九.准备工作:1、原理:空气中的二氧化氮与吸收液中的对氨基苯磺酸进行重氮化反应,在与N—(1—萘基)乙二胺盐酸盐作用,生成粉红色的偶氮染料,于波长540—545nm之间,测定吸光度。
2、仪器(1)、采样导管:硼硅玻璃、不锈钢、聚四氟乙烯或硅胶管,内径约为6mm,尽可能短一些,任何情况下不得长于2m,配有朝下的空气入口。
(2)、吸收瓶:内装10mL、25Ml或50mL吸收液的多空玻璃吸收瓶,液柱不低于80mm。
检查吸收瓶的玻板阻力,气泡飞散的均匀性及采样效率。
(3)、空气采样瓶:①、便携式空气采样(用于短时间采样):流量范围0—1L /min。
采气流量为0.4L/min,误差小于±5﹪。
实验-二氧化氮的测定

法灵敏度高、选择性好,但需要专业的发光测定仪器。
02 03
分光光度法
通过分光光度计测定二氧化氮与某些显色剂反应生成的有色物质的吸光 度,从而计算出二氧化氮的浓度。该方法操作简便、快速,但需要注意 显色剂的选择和反应条件的控制。
电化学法
利用二氧化氮在电极上发生氧化还原反应的原理进行测定。该方法具有 响应迅速、灵敏度高等优点,但需要定期更换电极并校准仪器。
采样
在采样点设置采样装置,以恒定 的流量抽取空气样品,并通过吸
收液将二氧化氮吸收下来。
样品处理
将采样后的吸收液进行适当处 理,如稀释、过滤等,以便于 后续分析。
测定
使用分析仪器对处理后的样品 进行测定,得到二氧化氮的含 量。
数据处理
根据测定结果和采样体积等信 息,计算出空气中二氧化氮的
浓度。
03 二氧化氮的测定步骤
结果的准确性。
严格遵守实验步骤和操 作规范,避免产生误差。
详细记录实验过程中的数 据,包括试剂用量、反应 时间等,以便后续分析。
安全措施与防护
个人防护
佩戴防护眼镜、防毒面具和实验服, 避免二氧化氮对皮肤和眼睛的刺激。
废气处理
使用废气处理装置,将实验过程中产 生的二氧化氮废气进行无害化处理。
急救措施
熟悉二氧化氮中毒的急救措施,如迅 速脱离现场至空气新鲜处、保持呼吸 道通畅等。
安全标识
在实验区域设置明显的安全标识,提 醒实验人员注意安全事项。
06 总结与展望
实验总结
• 实验目的:本次实验旨在通过测定大气中二氧化氮的含量,了解环境污 染状况,并为环境保护提供科学依据。
• 实验原理:采用盐酸萘乙二胺分光光度法,大气中的二氧化氮在采样吸 收过程中生成的亚硝酸,与对氨基苯磺酸进行重氮化反应,再与N-(1萘基)乙二胺盐酸盐作用,生成紫红色的偶氮染料。根据其颜色的深浅, 用分光光度法测定。
二氧化氮的测定
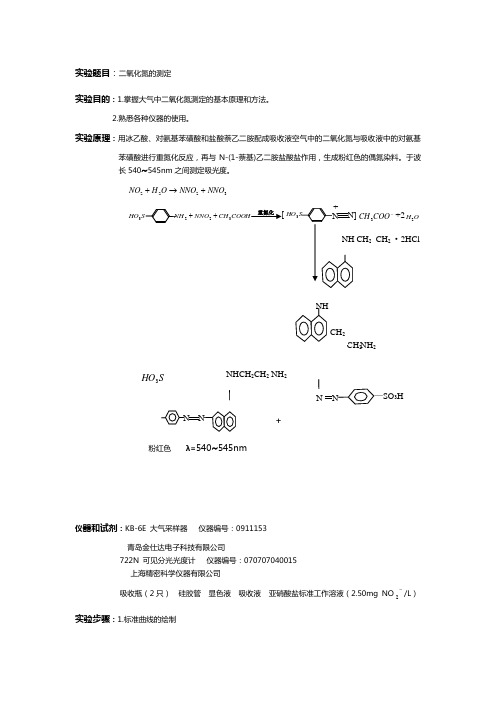
实验题目:二氧化氮的测定实验目的:1.掌握大气中二氧化氮测定的基本原理和方法。
2.熟悉各种仪器的使用。
实验原理:用冰乙酸、对氨基苯磺酸和盐酸萘乙二胺配成吸收液空气中的二氧化氮与吸收液中的对氨基苯磺酸进行重氮化反应,再与N-(1-萘基)乙二胺盐酸盐作用,生成粉红色的偶氮染料。
于波长540~545nm 之间测定吸光度。
3222NNO NNO O H NO +→+COOH CH NNO HO 3223++HO 3仪器和试剂:KB-6E 大气采样器 仪器编号:0911153 青岛金仕达电子科技有限公司722N 可见分光光度计 仪器编号:070707040015S HO 3[ 重氮化SO 3HNHCH 2CH 2 NH 2NH+上海精密科学仪器有限公司吸收瓶(2只)硅胶管显色液吸收液亚硝酸盐标准工作溶液(2.50mg NO 2/L)实验步骤:1.标准曲线的绘制取6支10ml具塞比色管,制备标准色列如下表所示(配制标准色列加入的水为高纯水)标准色列的配制备注:各管混合均匀,于暗处放置20min.用10mm比色皿以水为参比,在波长为542nm处测量吸光度,扣除空白实验的吸光度后对应NO2的浓度(ug/ml)做出标准曲线。
标准曲线2.采样取两支多孔玻璃板吸收瓶,装入10.00ml吸收液。
一支吸收瓶的入口段串接一段15~20cm长的硅胶管,以降低空气中O3对NO2的测定产生的负干扰,另一支吸收瓶的入口端串接一段三氧化铬-砂子氧化管和一段15~20cm长的硅胶管,将NO氧化成NO2后再通人吸收液进行吸收和显色,气样不通过氧化管测定的是NO2含量,通过氧化管测定的是NO2+NO的总量,二者之差为NO的含量。
采样、样品运输及存放过程中应避免阳光照射。
以0.4L/min流量采气。
气态污染物现场采样记录采样地点:沧州医专前三岔道口污染物名称:二氧化氮采样方法:溶液吸收法采样仪器型号:KB-6E 大气采样器采样者:程月张鹏程审核者:李红艳李针。
大气中二氧化氮含量的测定方法阐述

大气中二氧化氮含量的测定方法阐述作者:孙展来源:《环境与发展》2020年第11期摘要:随着我国经济的不断发展,燃煤对我国空气造成了严重的空气污染,尤其是空气中含有的二氧化氮的污染更为严重。
文章对大气中二氧化氮含量的测定方式进行了分析,旨在加强对空气中二氧化氮含量的监测,以进一步提升空气质量。
关键词:大气;二氧化氮;含量;测定方法中图分类号:X831 文献标识码:A 文章编号:2095-672X(2020)11-00-02DOI:10.16647/15-1369/X.2020.11.040Determination of nitrogen dioxide in the atmosphereSun Zhan(Urumqi City Environmental Monitoring Center Station,Urumqi Xinjiang 830000,China)Abstract:With the continuous development of China’s economy, coal combustion has caused serious air pollution in China, especially nitrogen dioxide pollution in the air. This paper mainly analyzes the determination method of nitrogen dioxide content in the atmosphere, aiming at strengthening the monitoring of nitrogen dioxide content in the air and further improving the air quality.Key words:Atmosphere;Nitrogen dioxide;Content;Determination method二氧化氮主要是指大氣中的含氮污染物。
空气中二氧化氮的测定

实验报告课程名称: 土壤与环境分析 指导老师: 廖敏 成绩:__________________ 实验名称: 空气中NO2含量的测定 同组学生姓名: 方丽、林园园一、实验目的和要求1. 掌握盐酸萘乙二胺光度法测定大气中二氧化氮含量的方法和原理;2. 熟悉分光光度计的使用方法;3. 通过NO 2的测定值对空气质量并进行评价。
二、实验内容和原理内容:测定空气中的NO 2含量。
原理:1. 一氧化氮经过氧化后成为二氧化氮,被溶液吸收后生成亚硝酸根离子,与氨基苯磺酸起重氮化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料。
反应溶液颜色有深浅,用吸光度定量测定,整个反应过程可以用如下图示表示。
低价氮氧化物(NO) NO 2 亚硝酸玫瑰红偶氮染料 于540nm 处测定吸光度三、实验材料与试剂:材料:空气试剂:吸收液、蒸馏水、亚硝酸盐标准储备溶液、亚硝酸盐标准工作溶液 吸收液的制备:①N-(1-萘基)乙二胺盐酸盐储备液:称取0.50gN-(1-萘基)乙二胺盐于500mL 容量瓶中, 用水溶解稀释至刻度。
次溶液贮于密封的棕色试剂中,在冰箱中冷藏,可稳定三个月。
②显色液:称取5.0g 对氨基苯磺酸,溶于约200mL 热水中,将溶液冷却至室温,全部移入1000mL 容量瓶中,加入50mL 冰乙酸和50.0mL N-(1-萘基)乙二胺盐酸盐储备液,用水稀释至刻度。
此溶液于密闭的棕色瓶中,在25℃一下暗处存放,可稳定三个月。
③吸收液:使用时将显色液和水按4+1(V/V )比例混合,即为吸收液。
此溶液于密闭棕色瓶中,25℃以下暗处存放,可稳定三个月。
若呈现淡红色,应弃之重配。
四、实验器材与仪器:采样探头、吸收瓶、便携式空气采样器、硅胶管、10ml 比色管、分光光度计、比色皿盐酸萘乙二胺偶合对氨基苯磺酸 重氮化 CrO 3 专业: 农业资源与环境 姓名: 周晓馨学号: 3110100498 日期: 2013.12.09 地点: 农生环B 座227室装订线五、实验方法和步骤:1.标准曲线的绘制:取7支干燥洁净的比色管,按下表中要求加入试剂:编号0 1 2 3 4 5 6 NO2-标准溶液0 0.10 0.20 0.30 0.40 0.50 0.60(5μg/mL)/mL吸收原液/mL 4.00 4.00 4.00 4.00 4.00 4.00 4.00 水/mL 1.00 0.90 0.80 0.70 0.60 0.50 0.40 NO2-含量/μg 0 0.5 1.0 1.5 2.0 2.5 3.0充分摇匀、避开阳光直射,放置15min 用1cm比色皿于540nm下以水为参比测定吸光度。
环境空气二氧化氮的测定

环境空气二氧化氮的测定环境空气中含有许多污染物,其中二氧化氮(NO2)是一种常见的空气污染物。
二氧化氮主要是由燃烧过程中产生的,例如汽车、工厂和发电站等都是二氧化氮的主要来源。
高浓度的二氧化氮对人类健康和大气环境都有很大影响,因此需要对其进行测定和监测。
本文将介绍环境空气二氧化氮的测定方法。
一、原理二氧化氮的测定方法主要是基于其与硫化氢(H2S)在酸性条件下反应生成的硝酸盐(NO3^-),硝酸盐可通过光度法或电导法进行测定。
NO2 + H2S + H2O → NO3^- + 2H+ + 2S二、仪器和试剂1、醋酸镍催化氧化仪或相干光度计2、光电离子化甲烷基氮化物(NOx)分析仪3、硫酸反应器4、硫化氢(H2S)和丙酮5、硼酸缓冲液和硫酸6、环保部标准样品NO27、空气样品收集管和净化器三、实验步骤1、准备工作对于空气样品的收集,应先安装好收集管和净化器,并做好标识。
空气样品需要根据具体条件而定,如大气污染物一般采用24小时集中采样等。
2、收集及净化将空气进入净化器后,将二氧化氮经硝酸及亚硝酸处理后,吸在过滤膜上并送到实验室进行分析。
3、试剂的配制(1) 硼酸缓冲液的制备:分别称取2.26克硼酸和3.7毫升浓氢氧化钠(紫色试剂),溶于500毫升蒸馏水中,调pH值至9.0。
(2) 丙酮和硫酸的配制:将500毫升丙酮逐渐滴加入密闭瓶内的200毫升冷却的浓硫酸中,并搅拌均匀,冷却后即可储存。
(3) NO2/hopcalite接收层制备:将NO2接收层向上,俯卧于NO2吸附层上,即可制成NO2/hopcalite接收层。
4、实验操作(1) 生产硫化氢气体将50毫升30%氢氧化钠溶液放入一玻璃烧杯中,加入5.0克硫代硫酸钠,加热至100℃左右,出现气泡时立即进行反应。
(2) 测定NO2含量将收集到的样品在先的压缩空气中通过NO2/hopcalite接收层吸取,排除热性的异物对NO2浓度的影响,还可简单化解NO2的混合物中其他烷氧化物造氧物的影响,使用眼镜滴球呈瓶、视线观察颜色浓淡即为NO2浓度。
空气中二氧化氮的测定方法

空气中二氧化氮的测定方法空气中的二氧化氮的测定方法主要有改进的Saltzman法和化学发光法等。
C.1改进的Saltzman法C.1.1 相关标准和依本方法主要依据GB12372《居住区大气中二氧化氮检验标准方法改进的Saltzman法》。
C.1.2 原理空气中的二氧化氮,在采样吸收过程中生成的亚硝酸,与对氨基苯磺酰胺进行重氮化反应,再与N-(1-萘基)乙二胺盐酸盐作用,生成紫红色的偶氮染料。
根据其颜色的深浅,比色定量。
C.1.3 测定范围测定范围为10mL样品溶液中含0.15~7.5 gNO 。
采样5L,可测浓度范围为0.03~1.7mg/m3。
C.1.4 试剂和材料所用试剂均为分析纯,但应为优级纯(一级)。
所用水为无NO 的二次蒸馏水。
即一次蒸馏水中加入少量氢氧化钡和高锰酸钾再重蒸馏,制备水的质量以不使吸收液呈淡红色为合格。
C.1.4.1 N-(1-萘基)乙二胺盐酸盐储备液:称取0.45g N-(1-萘基)乙二胺盐酸盐,溶于500mL水中。
C.1.4.2 吸收液:称取4.0g对氨基苯磺酰胺、10g酒石酸和100mg乙二胺四乙酸二钠盐,溶于400mL热的水中。
冷却后,移入1L容量瓶中。
加入100mLN-(1-萘基)乙二胺盐酸盐储备液,混匀后,用水稀释到刻度。
此溶液存放在25℃暗处可稳定3个月,若出现淡红色,表示已被污染,应弃之重配.C.1.4.3 显色液:称取4.0g对氨基苯磺酰胺、10g酒石酸与100mg乙二胺四乙酸二钠盐,溶于400mL热水中。
冷却至室温移入500mL容量瓶中,加入90mgN-(1-萘基)乙二胺盐酸盐,用水稀释至刻度。
显色液保存在暗处25℃以下,可稳定3个月,如出现淡红色,表示已被污染,应弃之重配。
C.1.4.4 亚硝酸钠标准溶液C.1.4.4.1 亚硝酸钠标准储备液;精确称量375.0mg干燥的一级亚硝酸钠和0.2g氢氧化钠,溶于水中移入1L容量瓶中,并用水稀释到刻度。
此标准溶液的浓度为1.00mL含250 gNO ,保存在暗处,可稳定3个月。
实验二被动式采样方法测定大气中的NO2

实验二被动式采样方法测定大气中的NO2一、目的和要求1.了解被动式采样的原理和方法,以及采样滤膜的制作。
2.了解空气中的二氧化氮的分析方法。
二、原理被动式采样方法(passive sampler)是基于气体分子扩散或渗透原理采集空气中气态或蒸汽态污染物的一种采样方法。
环境空气中的污染物分子以扩散方式传质到吸收膜,并采集在吸收膜上。
三、仪器和设备1.被动式采样器的使用条件相对湿度:大于30%2.被动式采样器的主要特点特点:体积小,携带方便,可以放置在需要测量的场所连续采样;操作简便,不需要抽气泵和电源,无需特别的维护,价格便宜;特别适用于大面积调查和监测。
3.被动式采样器结构示意图见图1,外观图见图2。
图1 被动式采样器结构示意图(1. 前盖,2. 钢丝网,3. 吸收膜,4. 压环,5. 托板)四、实验步骤1.采样膜的制作用打孔器将whatman No.40滤纸制成符合采样器的圆形大小,用2% H2O2双氧水溶液浸洗滤膜,在超声波清洗器中洗两次,每次15min,然后用去离子水洗四次,每次10min,尽快低温(60~80℃)烘干。
将洗净、烘干的,用注射器将50μL,25%三乙醇胺TEA的丙酮溶液加到滤纸上,送入真空干燥器中,盖紧干燥器抽滤。
待浸渍液被抽干后,迅速将滤纸装入采样器中,并将采样器其它部件安装好,放于自封袋中、赶尽空气保存。
2.采样方法采样时将整个采样器放于遮雨罩下,固定在采样地点(距离地面 1.5~3m ),视放置地点二氧化氮浓度的高低放置3~15天,城市大气环境下一般放置一周(7天)。
待采样结束后将采样器迅速放入自封袋中,密闭真空保存,带回实验室分析。
图2 被动采样器外观图3.分析方法对空气中的二氧化氮采用盐酸萘乙二胺分光光度法分析。
(1)分析原理空气中的二氧化氮与吸收液中的对氨基苯磺酸进行重氮化反应,再与盐酸萘乙二胺作用,生成粉红色的偶氮染料,于波长540~545nm 之间处,测定吸光度。
实验空气中二氧化氮的测定

(6)氧化管适于在相对湿度为30~70%时 使用。当空气相对湿度大于70%时,应勤 换氧化管;小于30%时,则在使用前,用 经过水面的潮湿空气通过氧化管,平衡1h 。 在使用过程中,应经常注意氧化管是否吸 湿引起板结,或者变为绿色。若板结会使 采样系统阻力增大,影响流量;若变成绿 色,表示氧化管已失效。
2.采样
(1)将一支内装5.00mL吸收液的多孔玻板 吸收管的出气口与空气采样器相连接。
(2)以0.2~0.3 L/min的流量避光采样至 吸收液呈微红色为止,记下采样时间,密 封好采样管,带回实验室,当日测定。
(3)若吸收液不变色,应延长采样时间, 采样量应不少于6L。
(4)在采样的同时,应测定采样现场的温 度和大气压力,并做好记录。
环境监测
亚硝酸与对氨基苯磺酸发生重氮化反应,再与 盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料, 据(故其气在颜 ) 计色转算深变结浅为果,时NO用应2-(分除液光以)光0.7的度6。转法换定系量数。为因0为.7N6O,2 如应果先测 用定三环氧境化空铬气将中一的氧氮化氧氮化氧物化成NO二x浓氧度化,氮则, 再按测定二氧化氮的方法测定。
(2)亚硝酸钠标准贮备液:称取0.1500g 粒状亚硝酸钠(NaNO2,预先在干燥器内放 置24h以上),溶解于水,移入1000mL容 量瓶中,用水稀释至标线。此溶液每毫升 含100.0μgNO2—,贮存于棕色瓶内,冰箱中 保存,可稳定三个月。
(3)亚硝酸钠标准溶液:吸取贮备液5mL 于100mL容量瓶中,用水稀释至标线。此 溶液每毫升含5.0μgNO2—。
(2)吸收液应避光,且不能长时间暴露在 空气中,以防止光照时吸收液显色或吸收 空气中的氮氧化物而使试管空白值增高。
(3)亚硝酸钠(固体)应密封保存,防止 空气及湿气侵入。部分氧化成硝酸钠或呈 粉末状的试剂都不能用直接法配制标准溶 液。若无颗粒状亚硝酸钠试剂,可用高锰 酸钾容量法标定出亚硝酸钠贮备液的准确 浓度后,再稀释为含5.0μg/mL亚硝酸根的 标准溶液。
实验8 二氧化氮测定

实验8 二氧化氮测定实验8二氧化氮测定实验八二氧化氮的测定实验目的1、使学生掌握大气中二氧化氮测定的基本原理和方法;2、熟悉各种仪器的使用。
实验原理见到教材第四章第四节。
仪器和试剂1.吸收瓶内装10ml、25ml或50ml吸收液的多孔玻板吸收瓶。
2.便携式空气采样器流量范围0~1l/min。
采气流量为04l/min时,误差大于±5%。
3.分光光度计。
4.硅胶管内径约6mm。
5.n-(1-萘基)乙二胺盐酸盐贮备液称取0.50n-(1-萘基)乙二胺盐酸盐于500ml 容量瓶中,用水溶解稀释至刻度。
此溶液贮于密封的棕色瓶中,在冰箱中冷藏,可以稳定三个月。
6.呈色液称取5.0g[nh2c6h4so3h]对氨基苯磺酸溶约200ml热水中,将溶液加热至室温,全部迁入1000ml容量瓶,重新加入50ml冰乙酸和50.0mln-(1-萘基)乙二胺盐酸盐鞭叶液,用水吸收至刻度。
此溶液于密封的棕色瓶中,在25℃以下暗处放置,可以平衡三个月。
7.吸收液使用时将显色液和水按4+1(v/v)比例混合,即为吸收液。
此溶液于密闭的棕色瓶中,在25℃以下暗处存放,可稳定三个月。
若呈现淡红色,应弃之重配。
8.亚硝酸盐标准储备溶液250mgno2-/l,精确称取0.3750g亚硝酸钠(nano2-优级氢铵,预先在干燥器内置放24h),迁入1000ml容量瓶中,用水吸收至标线。
此溶液储于密封瓶中于暗处放置,可以平衡三个月。
9.亚硝酸盐标准工作溶液2.50mgno2-/l,用亚硝酸盐标准储备溶液稀释,临用前现配。
操作步骤1.取样取一支多孔玻板吸收瓶,装入10.0ml吸收液,以0.4l/min流量采气6~24l。
采样、样品运输及存放过程应避免阳光照射。
空气中臭氧浓度超过0.25mg/m3时,使吸收液略显红色,对二氧化氮的测定产生负干扰。
采样时在吸收瓶入口端串接一段15~20cm长的硅胶管,可以将臭氧浓度降低到不干扰二氧化氮测定的水平。
土壤农化实验:实验八 大气中二氧化氮的测定

四、实验注意事项
1.吸收液必须无色,如呈微红色可能有亚硝酸根的 污染。日光照射也能引起吸收液显色,所以吸收管 在采样、运送和存放过程中都应采取避光措施。
2.在采样过程中,如吸收液体积缩小较显著,应用 水补充至原来体积(事先做好标线)。
3.氧化管适于在相对湿度30%-70%时使用,当大于 70%时,应勤换氧化管,小于30%时,则使用前, 用经过水潮湿空气通过氧化管,平衡1 h。
4.在交通要道采样时,在将采样点设在十字路口汽 车停车线旁人行道上,距离马路边1.5 10 ml比色管,按下表中要求加好试 剂后,摇匀,避开阳光直射,放置15 min,用1 cm比色皿于 540 nm下以水为参比测定吸光度。
• 3. 样品测定:采样后,将吸收液移入比色皿中,用校准曲 线的绘制方法测定吸光度。
氮氧化物的测定
标准曲线 1. 按下表配制NO2-标准溶液系列,摇匀,避光放置15min
实验八 大气中二氧化氮的测定
一、实验目的
掌握盐酸萘乙二胺光度法测定大气中二氧化氮 的含量并进行评价。
二、实验原理
二氧化氮经吸收,在水中形成亚硝酸盐,亚硝 酸与对氨基苯磺酸起重氮化反应,再与盐酸萘乙 二胺偶合,生成玫瑰红色偶氮染料,根据颜色深 浅,定量测定。
三、实验步骤
1.采样:将一个内装5 ml采样用吸收液的多孔玻璃吸收管的 出气口连接在便携式采样器上,以0.3 L/min的流量采气至吸 收液呈微红色为止,记录采样时间,算出采样体积,并记录 采样时的气温和气压。
编号
0 1 2 3 4 5 6
NO2-标准溶液(5 μg /mL)/mL 吸收原液/mL
0.00
4.00
0.10
4.00
0.20
4.00
二氧化氮的测定(精)

3
V0 K
式中: c——空气中二氧化氮浓度,mg/m3; K——NO2→NO2- 的经验转换系数,0.89; BS——由实验测得的计算因子,μg/(mL· 吸光度); A——样品溶液的吸光度; A0——试剂空白吸光度; V1——采样用的吸收液的体积; D——分析时样品溶液的稀释倍数。
总结:
恒温恒流采样器工作原理 氮氧化物样品的采集 氮氧化物样品的分析
开机,调节流量,开始采样
填写采样记录 采样时间到(或吸收液变粉红色)关机,完成采样记录
拆下吸收管,用橡胶管将吸收管的进口和出口相接
整理采样仪,将吸收管避光保存,送回实验室分析
分光光度计定量步骤
标准色列的配制 测定标准色列的吸光度 绘制工作曲线 样品吸光度的测定 样品中二氧化氮的含量
数据的处理
用最小二乘法计算标准曲线的回归方程,求计
算因子Bs。
采样体积要换算成标准状态下的体积。 计算公式为:
273 Pt V0 Vt 273 t P0
用亚硝酸钠标准溶液制备标准曲线时:
cNO2
A A0 BsV1D (m g / m )
3
V0 K
cNO2
A A0 BsV1D (m g / m )
2.3 二氧化氮的测定 —改进的saltzaman法
原理
空气中的二氧化氮,在采样吸收过程 中生成的亚硝酸,与对氨基苯磺酰胺进行重氮 化反应,再与N-(1-萘基)乙二胺盐酸盐作用, 生成紫红色的偶氮染料。根据其颜色的深浅, 比色定量。
分光光度法 定量
采样
数据处理
采样器的使用
仪器和附件的检查
把吸收液准确的移入吸收管 正确连接采样仪
大气中二氧化氮的测定 实验报告

装
二、实验内容和原理
订 线
1、大气中的氮氧化物
空气中的氮氧化物以一氧化氮、二氧化氮、三氧化二氮、四氧化二氮、五氧化二氮等多种 形态存在,其中一氧化氮和二氧化氮是主要存在形态,为通常所指的氮氧化物(NOx) 。氮氧化 物主要来源于化石燃料高温燃烧和硝酸、化肥等生产工业排放的废气,以及汽车尾气。 NO2 为棕红色具有强烈刺激性气味的气体,毒性比 NO 高 4 倍,是引起支气管炎、肺损伤 等疾病的有害物质。空气中 NO2 常用的测定方法有盐酸萘乙二胺分光光度法、化学发光分析法 及原电池库仑滴定法。
2、盐酸萘乙二胺分光光度法测定大气中的二氧化氮
该方法采样与显色同时进行,操作简便,灵敏度高,是国内外普遍采用的方法。因为测定 NOx 或单独测定 NO 时,需要将 NO 氧化成 NO2,主要采用酸性高锰酸钾溶液氧化法。当吸收液 体积为 10mL,采样 4~24L 时,NOx(以 NO2 计)的最低检出质量浓度为 0.005mg/m3。 用无水乙酸、对氨基苯磺酸和盐酸萘乙二胺配成吸收液采样,空气中的 NO2 被吸收转变成 亚硝酸和硝酸。在无水乙酸存在的条件下,亚硝酸与对氨基苯磺酸发生重氮化反应,然后再与 盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料,其颜色深浅与气样中 NO2 浓度成正比,因此,可 用分光光度法测定。刺吸收及显色反应如下:
1
因为吸收液吸收空气中的 NO2 后,并不是全部生成亚硝酸,还部分生产硝酸,所以计算结 果时需要用 Saltzman 实验系数 f 进行换算。该系数是用 NO2 标准混合气进行多次吸收实验测定 的平均值,表征在采样过程中被吸收液吸收生成偶氮染料的亚硝酸量与通过采样系统的 NO2 总 量的比值。F 值受空气中 NO2 的浓度、采样流量、吸收瓶类型、采样效率等因素影响,故测定 条件应与实际样品保持一致。
大气中二氧化氮的测定

表2-1 亚硝酸钠标准系列
01
2
0 0.40 0.80
0.80 0.80 2.00 1.60
0 0.10
0.80 1.20 0.20
3 1.20
0.80 0.80 0.30
4 1.60
0.80 0.40 0.40
5 2.00
0.80 0
0.50
各管摇匀后,避光放置20min,在波长540nm处,用1cm比色皿,以
以亚硝酸钠稀释后浓度为x轴,校正后吸光度为y轴做标准曲线(图 2-1):
图2-1 标准曲线
由(图2-1)得出回归方程式为: y=0.9729x+0.0036
2.2 采样点的布设
通过初步调查了解发现,洛阳理工学院东校区校园内大气污染的主 要来源于餐厅和锅炉房中的燃料燃烧、汽车尾气、植物及垃圾的焚烧、 以及土壤和动物排泄物中含氮有机物的转化等几个方面。
于50ml容量瓶中,用水溶解稀释至刻度。此溶液贮于密封的棕色试剂瓶 中,在25℃以下暗处存放,可稳定3个月。
1.3.2 吸收原液 称取5.0g对氨基苯磺酸[NH2C6H4SO3H],通过玻璃小漏斗直接加入
1000ml容量瓶中,加入50ml冰乙酸和850ml水的混合溶液,盖塞振摇使其 溶解,待对氨基苯磺酸完全溶解后,加入50ml N(1-萘基)乙二胺盐酸 盐储备溶液,用水稀释至标线。此为吸收原液,存入棕色瓶中。
(2)光化学烟雾:氮氧化合物中的二氧化氮与碳氢化合物经紫外 线照射发生光化学反应,生成光化学烟雾。光化学烟雾对人体有很大的 刺激性和毒害作用。
(3)破坏臭氧层:二氧化氮和氯氟烃一样具有破坏平流层中的臭 氧的能力。在光合作用下破坏臭氧层,且有二次污染物二氧化氮产生。
大气中二氧化氮含量的测定方法

大气中二氧化氮含量的测定方法吴雨彤;吴海;马浩淼;张体强;王振【摘要】综述大气中二氧化氮含量的测定方法.归纳了分光光度法、离子色谱法、化学发光法、荧光猝灭法、激光诱导荧光法、光腔衰荡光谱法、差分吸收光谱法、差分吸收激光雷达法等大气中二氧化氮含量的测定方法,并介绍了其原理、研究现状以及优缺点.为研究人员选择合适的二氧化氮测定方法或进一步的研究提供参考.【期刊名称】《化学分析计量》【年(卷),期】2019(028)005【总页数】5页(P123-127)【关键词】大气污染物;二氧化氮;测定方法【作者】吴雨彤;吴海;马浩淼;张体强;王振【作者单位】中国计量科学研究院,北京 100029;中国计量科学研究院,北京100029;中国计量科学研究院,北京 100029;中国计量科学研究院,北京 100029;中国计量科学研究院,北京 100029【正文语种】中文【中图分类】O657二氧化氮(NO2)是大气中的一种主要含氮污染物,也是我国空气质量监测的关键参数之一。
NO2 的光解是对流层臭氧(O3)的主要来源,其参与了光化学反应以及光化学烟雾的形成[1]。
NO2 通过光化学反应可以产生硝酸型气溶胶,导致大气能见度下降并进一步降低空气质量,是灰霾形成的重要原因之一。
研究表明,NO2 除了直接转化为盐类的机制外,还存在与大气中其它成分的相互影响。
例如,NO2对SO2 形成硫酸盐的过程可以起到一定的加速作用,将加快PM2.5 的增长速度。
此外,硝酸型酸雨的主要成分硝酸和硝酸盐也是由NO2 氧化而来[2–3]。
除环境污染外,NO2 还会危害人体健康。
大量研究表明,NO2 具有腐蚀性、毒性和生理刺激作用,通过呼吸作用进入人体的肺部。
当大气中NO2的含量过高时,可对人体的呼吸系统、心脑血管系统造成损害,诱发一系列的呼吸系统疾病,长期吸入可能会改变肺部构造。
孕妇大量接触NO2,还可能会造成婴幼儿注意力功能受损[4–7]。
大气中NO2 的来源包括自然源和人为源两部分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二氧化氮的测定1 主题内容与适用范围1.1主题内容本标准规定了测定环境空气中二氧化氮的分光光度法。
1.2适用范围当采样体积为4~24L时,本标准适用于测定空气中二氧化氮的浓度范围为0.015~2.0mg/m3。
2 引用标准GB 5275 气体分析标准用混合气体的制备渗透法3 术语Saltzman 实验系数(f):用渗透法制备的二氧化氮校准用混合气体,在采气过程中被吸收液吸收生成的偶氮燃料相当于亚硝酸根的量与通过采样系统的二氧化氮总量的比值。
该系数为多次重复实验测定的平均值,测定方法见附录B。
4 原理空气中的二氧化氮与吸收液中的对氨基苯磺酸进行重氮化反应,再与N-(1-萘基)乙二胺盐酸盐作用,生成粉红色的偶氮燃料,于波长540~545nm之间处,测定吸光度。
5 试剂除另有说明,分析时均使用符合国家标准的分析纯试剂和无亚硝酸根的蒸馏水或同等纯度的水,必要时可在全玻璃蒸馏器中加少量高锰酸钾和氢氧化钡重新蒸馏。
水纯度的检验方法:按8.1.1条测量,吸收液的吸光度不超过0.005.5.1 N-(1-萘基)乙二胺盐酸盐储备液:称取0.50gN-(1-萘基)乙二胺盐酸盐[C10H7NH(CH2)2NH2·2Cl]于500mL容量瓶中,用水溶解稀释至刻度。
此溶液贮于密封的棕色试剂瓶中,在冰箱中冷藏,可稳定三个月。
5.2 显色液:称取5.0g对氨基苯磺酸[NH2C6H4SO3H],溶于约200mL热水中,将溶液冷却至室温,全部移入1000mL容量瓶中,加入50mL冰乙酸和50.0mL N-(1-萘基)乙二胺盐酸盐储备液(5.1),用水稀释至刻度。
此溶液于密闭的棕色瓶中,在25℃下暗处存放,可稳定三个月。
5.3 吸收液:使用时将显色液(5.2)和水按4+1(V/V)比例混合,即为吸收液。
此溶液于密闭棕色瓶中,25℃以下暗处存放,可稳定三个月。
若呈现淡红色,应弃之重配。
5.4 亚硝酸盐标准工作溶液:2.50mgNO2-/L。
准确称取0.3750g亚硝酸钠(NaNO2),优级纯,预先在干燥器内放置24h,移入1000mL容量瓶中,用水稀释至标线。
次溶液贮于暗处存放,可稳定三个月。
5.5 亚硝酸盐标准工作溶液:2.50mgNO2-/L。
用亚硝酸盐标准储备液(5.4)稀释。
临用前现配。
5.6 校准用混合气:使用时,按GB5275规定的渗透法制备零气及能覆盖欲测范围的至少四种浓度的二氧化氮校准用混合气体。
6 仪器6.1 采样探头:硼硅玻璃、不锈钢、聚四氟乙烯或硅胶管,内径约为6mm,尽可能短一些,任何情况下不得长于2m,配有朝下的空气入口。
6.2 吸收瓶:内装10mL、25mL或50mL洗手液的多孔玻板吸收瓶,液柱不低于80mm。
按附录A检查吸收瓶的玻板阻力,气泡分散的均匀性及采样效率。
下图示出了较为适用的二种多孔玻板吸收瓶。
多孔玻板吸收示意图6.3 空气采样器:6.3.1 便携式空气采样器:流量范围0~1L/min。
采气流量为0.4L/min时,误差小于±5%。
6.3.2 恒温自动连续采样器:采气流量为0.2L/min,误差小于±5%。
能将吸收液温度保持在20±4℃。
6.4 分光光度计。
6.5硅胶管:内径约6mm。
7 样品7.1 短时间采样(1h以内):取一支多孔玻板吸收瓶,装入10.0mL吸收液(5.3),标记吸收液液面位置以0.4L/min流量采气6~24L。
7.2 长时间采样(24h以内):用大型多孔玻板吸收瓶,内装25.0mL或50.0mL吸收液,液柱不低于80mm,标记吸收液液面位置,使吸收液温度保持在20±4℃,从9:00到次日9:00,以0.2L/min流量采气288L。
采样、样品运输及存放过程中应避免阳光照射。
气温超过25℃,长时间运输及存放样品应采取降温措施。
7.3干扰及排除空气中臭氧浓度超过0.25mg/m3时,使吸收液略显红色,对二氧化氮的测定产生负干扰。
采样时在吸收瓶入口端串联一段15~20cm长的硅胶管,即可将臭氧浓度降低到不干扰二氧化氮测定的水平。
8分析步骤8.1校准曲线的绘制8.1.1 用亚硝酸盐标准溶液绘制标准曲线取6支10mL具塞比色管,按表1制备标准色列:表1 亚硝酸盐标准色列各管混合,于暗处放置20min(室温低于20℃时,应适当延长显色时间。
如室温为15℃时,显色40min ),用10mm 比色皿,以水为参比,在波长540~545nm 之间处,测量吸光度。
扣除空白试验(零浓度)的吸收度以后,对于NO 2-的浓度(μg/mL ),用最小二乘法计算标准曲线的回归方程。
8.1.2 用二氧化氮标准气体绘制 曲线按GB5275规定的方法,制备零气和能覆盖欲测浓度范围的至少四种浓度的二氧化氮标准混合气体,按采样操作条件(见第7章)采气,采样体积应与预计在现场采集空气样品的体积相近。
按8.1.1条操作测量吸光度。
以通过采样系统的标准混合气体中二氧化氮的含量(μg )与采样瓶中吸收液的体积(mL )之比为横坐标;以各浓度点样品溶液的吸光度(A )与零浓度点样品溶液的吸光度(A 0)之差为纵坐标,绘制工作曲线。
8.2 样品测定采样后放置20min (气温低时,适当延长显色时间。
如15℃时,显色40min ),用水将采样瓶中吸收液的体积补至标线,混匀,按8.1.1条测量样品的吸收度和空白试验样品的吸光度。
采样后应尽快测量样品的吸光度,若不能及时分析,应将样品于低温暗处存放。
样品于30℃暗处存放,可稳定8h ;20℃暗处存放,可稳定24h ;于0~4℃冷藏,至少可稳定三天。
8.3空白试验于采样用吸收液同一批配制的吸收液。
9 结果的表示9.1 用亚硝酸盐标准溶液绘制标准曲线时,空气中二氧化氮的浓度C NO2(mg/m 3)用式(1)计算:0)(2V f b DV a A A C NO ⨯⨯⨯⨯--=(1)式中:A ——样品溶液的吸光度; A0——空白试验溶液的吸光度;b ——按8.1.1条测得的标准曲线的斜率,吸光度(mL/μg ); a ——按8.1.1条测得的标准曲线的截距; V ——采样用吸收液体积,mL ;V 0——换算为标准状态(273K 、101.3kPa )下的采样体积,L ; D ——样品的稀释倍数;f Saltzman 实验系数,0.88(当空气中二氧化氮浓度高于0.720mg/m 3时,f 值为0.77)。
9.2 用二氧化氮标准气体绘制工作曲线时,空气中二氧化氮的浓度C NO2(mg/m 3)用式(2)计算:2V D V C C NO ⨯⨯=(2)式中:C ——由8.1.2条测得的工作曲线上查得的NO 2浓度,μg/mL ; V ——采样用吸收液体积,mL ;V 0——换算到标准状态(273K 、101.3kPa )下的采样体积,L ; D ——样品的稀释倍数。
10 密度和准确度10.1 测定亚硝酸盐标准溶液的精密度和准确度0.715±0.03 0.700 0.0020 0.006 0.0095 0.027 -2.1 0.358±0.01 0.315 0.0015 0.004 0.0056 0.016 -2.0 0.072±0.00 0.070 0.0020 0.002 0.0014 0.004 -2.8本精密度和准确度数据于1993年,由6个实验室对3个浓度水平的试样所做的实验中确定,重复测定次数为6,概率水平为95%。
10.2测定NO2标准气体的精密度和准确度5个实验室测定浓度范围在0.056~0.480mg/m3的NO2标准气体,重复性变异系数小于10%,相对误差小于±8%。
附录A吸收瓶的检查A1 玻板阻力及微孔均匀性检查新的多孔玻板吸收瓶在使用前,应用(1+1)HCl 浸泡24h 以上,用清水洗净,每支吸收瓶在使用前或使用一段时间以后应测定其玻板阻力,检查通过玻板后气泡分散的均匀性。
阻力不符合要求和气泡分散不均匀的吸收瓶不宜使用。
内装10mL 吸收液的多孔玻板吸收瓶,以0.4L/min 流量采样时,玻板阻力位4~5kPa ,通过玻板后的气泡应分散均匀。
内装50mL 吸收液的大型多孔玻板吸收瓶,以0.2L/min 流量采样时,玻板阻力位5~6kPa ,通过玻板后的气泡应分散均匀。
A2采样效率的测定吸收瓶在使用前和使用一段时间以后,应测定其采样效率。
将两支吸收瓶串联,按第7.1条操作,采集环境空气,当第一支吸收瓶中NO 2-浓度约为0.4μg/mL 时,停止采样。
按8.1.1条测量前后两支吸收瓶中样品的吸光度,按式(A1)计算第一支吸收瓶的采样效率(E ):211C C C E +=(A1)式中:C 1、C 2——分别为串联的第一支合第二支吸收瓶中的NO 2的浓度,μg/mL 注:采样效率E 低于0.97的吸收瓶不宜使用。
附录BSaltzman 实验系数的测定按GB5275规定的方法,制备零气和欲测浓度范围的二氧化氮标准混合气体。
按第7.1条采集气样,当吸收液中NO 2-浓度达到0.4μg/mL 左右时,停止采样。
按8.1.1条操作,测量样品的吸光度。
按式B1计算Saltzman 实验系数(f )200)(NO C V b V a A A f ⨯⨯⨯--=(B1)式中:A ——样品溶液的吸光度;A 0——空白试验样品的吸光度;b 、a ——按8.1.1条测得的标准曲线的斜率和截距; V ——采样用吸收液体积,mL ;V 0——换算为标准状态(101.3kPa 、273K )的采样体积,L ;C NO2——通过采样系统的NO 2标准混合气体的浓度,mg/m 3(101.3kPa 、273K )。
f 值的大小手空气中的NO 2的浓度,采样流量,吸收瓶类型,采样效率等因素的影响,故测定f 值时,应尽量使测定条件与实际采样时保持一致。
