第三章碳正离子
《合成化学》第三章

第三章
卤化反应(5学时)
第一节 不饱和烃的卤加成反应(1学时)
-X 等),则不利于该反应的进行。因此,烯烃的反应活性
顺序是:R2C=CR2 > R2C=CHR > R2C=CH2 〉RCH=CH2 > CH2=CH2>
CH2=CHCl 。若烯键碳原子上连接有叔烷基或三芳甲基,则 卤加成反应中常会有重排、消除等副反应伴随发生。
第三章
卤化反应(5学时)
第一节 不饱和烃的卤加成反应(1学时)
多卤乙烯进行自由基加成时,加成方向也取决于取
代基稳定自由基的能力,其次序位:Cl > F > H
F2C
CFCl +
HBr
hν
CF2BrCHFCl 88%
+ : CH2FCF2Br 40
第三章
例如:
H2C CHCN + Cl2
卤化反应(5学时)
第一节 不饱和烃的卤加成反应(1学时)
CCl4 hv , 10oC
ClCH2CHClCN
Br Br2 / CCl4 hv , 0oC , 1小时
H
H Br
第三章
卤化反应(5学时)
第一节 不饱和烃的卤加成反应(1学时)
烯烃与卤素的自由基加成反应历程如下:
a.烯键邻近基团的影响
卤化反应(5学时)
第一节 不饱和烃的卤加成反应(1学时)
与烯键碳原子相连的取代基性质不仅影响着烯键极化方 向,而且直接影响着亲电加成反应的难易程度。烯键碳原子 上接有推电子基团(如HO-、RO-、 C6H5-、 CH3CONH-、R等),则有利于烯烃卤加成反应的进行;反之,若烯键碳原 子上接有拉电子基团(如-NO2、-CN、-CO2H、-CO2R、-SO3H
正碳离子与碳正离子

正碳离子与碳正离子
碳正离子和正碳离子都是指碳原子失去电子而形成的离子。
在
化学中,通常用正离子来描述失去了一个或多个电子的离子,而用
负离子来描述获得了一个或多个电子的离子。
因此,"碳正离子"和"
正碳离子"这两个术语在一般情况下可以认为是同义词,都指代碳原
子失去电子后所形成的离子。
当碳原子失去一个或多个电子时,它会形成不同电荷的离子。
例如,当碳原子失去四个电子时,它会形成C4+离子,也就是碳正
离子或者正碳离子。
这种离子在化学反应中可能会参与共价键的形
成或者与其他离子发生离子键的结合。
在实际应用中,碳正离子在一些化学反应和工业生产中扮演着
重要角色。
例如,在质谱分析中,碳正离子是一种常见的分子离子,可以帮助确定有机化合物的分子结构。
此外,在一些有机合成反应中,也会利用碳正离子来进行特定的反应。
总的来说,无论是"碳正离子"还是"正碳离子",都是指碳原子
失去电子形成的离子,在化学和相关领域中都具有重要的意义和应用。
高等有机化学3
O
R
(CH3CH2CH2)2B + CH3CH2CH3
O O
R
B与手性碳相连时, 重排时构型保持不变.
B(O2CR)3 + CH3CH2CH3 32
烯烃的硼氢化反应
烯烃的硼氢化反应的应用 (1)由烯烃制备醇, 特别是由端基烯烃制备一级醇. (与烯烃直接水合的区域选 择性相反). (2)还原烯烃.
炔烃的硼氢化反应
CH2CH2CH3
O OH (CH3CH2CH2)2B
CH2CH2CH3
(CH3CH2CH2)2B-OCH2CH2CH3
(CH3CH2CH2O)3B
H2O
CH3CH2CH2OH + B(OH)3
(CH3CH2CH2)2B CH2CH2CH3
OH O
R
H3CH2CH2C H3CH2CH2C B
O
CH2CH3 H H H
v
1
2
10.4
14
3.4
烯烃: BrCH=CH2, CH2=CHCO2H, CH2=CHCH2N+Me3Br-, Ph2C=CPh2
v <0.04
<0.03
0
0
空阻大, 共轭
(2)分步反应 CH2=CH2 + Br2
NaCl H2O
CH2Br-CH2Cl + CH2Br-CH2Br
CH2=CH2 + NaCl
O-
Br Br
O
H3C
炔烃的硼氢化-氧化:使用位阻大的含有单氢的硼烷试剂
33
34
炔烃的硼氢化反应
炔烃的硼氢化-还原:使用位阻大的含有单氢的硼烷试剂
35
36
有机化学 第三章讲解

CH 2 =CH 2
+ HO Cl
Cl-CH 2 -CH 2 -OH
-氯乙醇
实际操作时,常用氯和水直接反应。例:
Cl CH 2 =CH 2
Cl 2 -Cl
-
CH 2 Cl
+
CH 2
H 2O -H
+
CH 2
CH 2 (主) OH
Cl -
Cl CH 2
-氯乙醇
CH 2 (副) Cl
33
b a CH 3 -CH=CH
CH 3 CH 3 -C CH-CH 3
30
3 碳正离子
。
H
Cl H
重 排 产 物 (主 )
(d) 过氧化物效应
但有过氧化物存在时:
CH 3 -CH=CH
2
+ HBr
hor
过氧化物
CH 3 CH 2 CH 2 Br (反马)
只能是HBr (HCl、HI都不反马)
31
(丙) 与硫酸加成
烯烃与H2SO4的加成反应也是亲电加成反应,加成方向 遵循马氏规则。例:
2
+ HCl
CH 3 -CH-CH Cl
2-氯丙烷 主要产物
乙酸 80%
3
+ CH 3 CH 2 CH 2 Cl
1-氯丙烷 次要产物
CH 3 CH 2 CH=CH
2
+ HBr
CH 3 CH 2 CH CH Br
HBr
2
H
2-溴丁烷
Br
CH 3 CH 2 CH 2 C CH
HBr
CH 3 CH 2 CH 2 C=CH 2 Br
2
(一) 烯烃和炔烃的结构
《有机化学》(第四版)第三章-不饱和烃(习题答案)

第三章 不饱和烃思考题习题3.1 写出含有六个碳原子的烯烃和炔烃的构造异构体的构造式。
其中含有六个碳原子的烯烃,哪些有顺反异构?写出其顺反异构体的构型式(结构式)。
(P69)解:C 6H 12有13个构造异构体,其中4个有顺反异构体:CH 2=CHCH 2CH 2CH 2CH 3CH 3CH=CHCH 2CH 2CH 3CH 3CH 2CH=CHCH 2CH 3(Z,E)(Z,E)CH 2=CCH 2CH 2CH 3CH 3CH 2=CHCHCH 2CH 3CH 3CH 2=CHCH 2CHCH 3CH 3CH 3C=CHCH 2CH 3CH 3CH 3CH=CCH 2CH 3CH 3CH 3CH=CH 2CHCH 3CH 3(Z,E)(Z,E)CH 2=CHCCH 3CH 3CH 3CH 2=CCHCH 3CH 3CH 3CH 3C=CCH 3CH 3CH 3CH 2=CCH 2CH 3CH 2CH 3C 6H 10有7个构造异构体:CH CCH 2CH 2CH 2CH 3CH 3C CCH 2CH 2CH 3CH 3CH 2C CCH 2CH 3CH CCHCH 2CH 3CH 3CH CCH 2CHCH 3CH 3CH CC(CH 3)3CH 3C CCHCH 3CH 3习题3.2 用衍生物命名法或系统命名法命名以下各化合物:(P74)(1) (CH 3)2CHCH=CHCH(CH 3)2对称二异丙基乙烯 or 2,5-二甲基-3-己烯(2)(CH 3)2CHCH 2CH=CHCHCH 2CH 3CH 3123456782,6-二甲基-4-辛烯(3)CH 3CH 2C CCH 2CH 3123456二乙基乙炔 or 3-己炔(4)CH 3CH 2C(CH 3)2C CH 12345 3,3-二甲基-1-戊炔(5)CH 2=CHCH 2C CH 123451-戊烯-4-炔(6) HCC C=CCH=CH 2CH 2CH 2CH 3CH 2CH 2CH 31234563,4-二丙基-1,3-己二烯-5-炔(7)CH 3CH 32,3-二甲基环己烯(8)CH 3CH 35,6-二甲基-1,3-环己二烯习题3.3 用Z,E-命名法命名以下各化合物:(P74)(1) ↑C=CCH 2CH 3H ClBr↑(Z)-1-氯-1-溴-1-丁烯(2) ↓C=CF CH 3ClCH 3CH 2↑(E)-2-氟-3-氯-2-戊烯 (3) ↑C=CCH 2CH 3CH 2CH 2CH 3HCH 3↓ (E)-3-乙基-2-己烯(4) ↓C=CCH(CH 3)2CH 2CH 2CH 3CH 3H↑ (E)-3-异丙基-2-己烯习题3.4 完成以下反应式:(P83)(1) C 3H 7C CC 3H7C=C H C 3H 7HC 3H 7(2)3C 3H 7C CC 3H 7C=C H C 3H 7C 3H 7H(3)+ Br 2C=C HC 2H 5C 2H 5H25(4)CCHOOC COOH C=CHOOCBr Br COOH+ Br 2习题3.5 以下各组化合物分别与溴进行加成反应,指出每组中哪一个反应较快。
第三章反应机理

CH3 Cl
349
H Cl
431
H=(435+243)-(349+431)= -102KJ/ mol
用反应热来说明反应的难易程度是不完全的, 因为本反应不是一步完成的。
Cl Cl
Cl
CH4
Cl
Cl
H= 243KJ/mol
CH3
HCl H= 4KJ/mol
CH3
Cl2
CH3Cl Cl H= -106KJ/mol
一、基元反应与反应机理
1、化学反应 化学反应包括由反应物向产物的转化,反应主要
以单分子或双分子反应进行。 反应机理是由反应物转变为产物的途径,若为基
元反应,则为一步反应得到产物;若不为基元反应, 则可以分解为多步基元反应过程。反应机理就是将反 应的各步基元反应都详细地表达出来,特别是对中间 体杂化状态、能量变化的描述。
1-氯丙烷产率= 6÷(6+7.6)×100% = 44.1% 2-氯丙烷产率= 7.6÷(6+7.6)×100%= 55.9%
1-溴丙烷生成速率
2-溴丙烷生成速率 =
6×1.0 6
2×82 = 164
1-溴丙烷产率= 6÷(6+164)×100% = 3.5%
2-溴丙烷产率= 164÷(6+164)×100%= 96.5%
5、键的极性与反应形式
亲核
Cδ
δC
Nu
E
亲电
6、过渡态结构 了解过渡态结构对推测反应的发生,反应的过程
非常有用。反应过程大致分为三种类型: ⅠⅡ Ⅲ
(Ⅰ)放热反应,过渡态结构与反应物近。 (Ⅱ)过渡态结构接近于反应物和产物。 (Ⅲ)吸热反应,过渡态结构与产物相近。
第三章 电子效应和空间效应

例: CH3δ+ Clδ键距 μ=qd q: 中心电荷 d:正负电荷中心的距离
分子的偶极距是各键的键距向量和:
H H H
μ=0
Cl H Cl Cl
μ=0
Cl Cl H H
μ=1.94D
C
C
C H
Cl-Cl ( 键距为零)
3.2诱导效应
4.2.1 定义:诱导效应是指在有机化合物中由于电负性不同的取 代基的影响,使整个分子中成键电子云按取代基团的电负性所决定 的方向而偏移的效应。
-I效应:
CH3δδδ+-CH2δδ+-CH2δ+→Clδ-
+I效应:
O CH 3 C H
诱导效应在没有外加电场影响下也存在,它体现的是分子自身的性质。诱
导效应一般用 I 表示,饱和 C-H 键的诱导效应规定为零。
当一个原子或原子团与碳原子成键后,电子云偏离碳 原子,称为-I 效应。 例:
O H3C X H3C H H3C
非极性共价键:相同原子(基团)成键,电 子云分布对称 极性共价键:不同原子(基团)成键,电子 云分布偏向 共价键极性:取决成键原子的相对电负 性.是结构与反应性能关系的基础
极性共价键: 形成共价键的原子,它们之间吸引电子 的能力是不一样的。这就使得两原子间 共价键的电子云不是平均分配在两个原 子核之间,而是偏向电负性较大的原子, 这种键成称为极性共价键。
•
3.4.2 对反应机理的影响
在一些反应中,由于诱导效应等因素可以改变其反 应机理。如溴代烷的水解反应,伯溴代烷如CH3—Br主 要按 SN2历程进行,而叔溴代烷如(CH3)3C—Br则主要 遵从SN1历程进行。
3.4.3 对反应速率的影响
第三章 碳碳键的形成讲解

—CN、>CO。
有机钯催化的形成碳碳键的反应是构筑分子结构的有效方法,具有高的化学选 择性和区域选择性。Heck、Negishi和Suzuki三位化学家因在钯催化交叉偶联方面 做出的杰出贡献而获得2010年诺贝尔化学奖。
有机合成
第3章
碳碳键的形成
有机合成
第3章
碳碳键的形成
有机合成
第3章
碳碳键的形成
羟醛缩合反应
OH 2 CC
OH, 或 H+
O
OH H
CCCC
H2O
H
H
H
注意
(1)反应前后分子结构的变化
(2)反应需要α -氢的参与 (3)至少含有两个α -氢时才会发生脱水 (4)酸也可以催化
O
H
CCCC
H
有机合成
第3章
碳碳键的形成
碱催化机理
OH CC
OH
H
O
OH H
CCCC
H
H
OH
O CC
四氢吡咯
吗啉
六氢吡啶
有机合成
第3章
碳碳键的形成
和醛酮的直接烷基化相比,烯胺的烷基化反应有下列优点:
波谱分析第三章CNMR谱

δc的大小为:δ双键碳>δ三键碳>δ饱和碳
范围:120~240 70~110 -20~100
2.碳原子的电子云密度
碳的化学位移与其核外围电子云密度有关,核 外电子云密度增大,屏蔽效应增强,δc值向 高场位移。
①碳正离子δc值出现在较低场是由于碳正离 子电子短缺,强烈去屏蔽作用所致。如:
② 共轭效应
3.取代烷烃的δc的计算公式 δc(i)=对应烷烃的δc+∑取代基参数 注意取代类型:正取代和异取代的区别
取代基参数请见教材141也表5-4 4.环烷烃及其衍生物
当环烷烃有环张力时,δc位于较高场,五元 环以上的环烷烃,δc都在26ppm左右。
相应的杂环化合物,由于受杂原子电负性的影 响,δc低场位移。
请看下面的例子:
共轭双键化合物,中间碳原子因键级减小, δc值减
小,移向高场。例如,在丁二烯分子中,如果只考虑 取代基的诱导效应,乙烯基应大于乙基,丁二烯的C2 化学位移值应大于140.2ppm,而实际上由于共轭效 应使C2的化学位移向高场移动,为137.2ppm。
③诱导效应
与电负性取代基相连,使碳核外围电子云密 度降低,δc值增大,向低场位移,取代基电 负性愈大,低场位移愈明显。如:
用时,将恢复羰基原来的δc值。例如,苯乙 酮的羰基碳的δc值为195.7ppm,当邻位有甲 基取代时,降低了羰基与苯环的共轭程度,使 羰基碳的δc值向低场移动;当邻二甲基取代 时,由于空间阻碍,羰基与苯环难以继续处于 同一平面,破坏了共轭作用,使羰基恢复到普 通酮的δc值为205.5ppm(如丙酮206.7ppm)。
13C-1H偶合常数 1JCH的大小一般在120到 300Hz范围,决定 1JCH值大小的最重要因素是 C-H键的s电子成分,近似有:
碳负离子半径和碳正离子半径

碳负离子半径和碳正离子半径
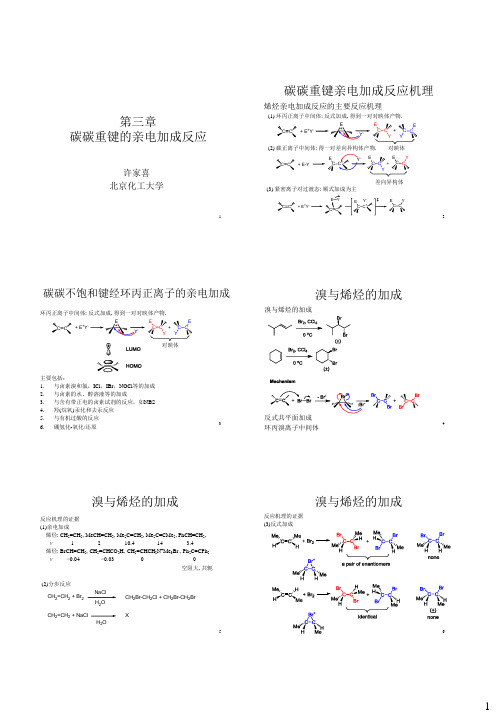
碳正离子是带正电荷的碳原子,以SP2杂化轨道与3个原子或原子团结合,形成3个σ键,与碳原子处于同一个平面,是平面结构,碳正离子是一个活泼的中间体。
碳负离子是带负电荷的具有偶数价电子的物种,其负电荷(未共用电子对)定域在一个碳原子上,一般能迅速发生反转呈现为平衡,这类碳负离子的稳定性顺序(按荷负电原子类型)为伯>仲>叔。
正碳离子和碳负离子的半径大小主要取决于最外层电子数和原子核内质子数,当最外层电子少时,半径较小,当最外层电子多时,半径较大。
离子半径是化学研究中一个重要的概念,对于理解物质的性质和反应机理具有重要意义。
如果你想了解更多关于离子半径的信息,可以查阅相关的化学文献或咨询化学专家。
第三章反应历程

第三章反应历程
例
CH4 + CD4
1:
1
Cl2
hv
CH3Cl + CD3Cl
>> 1
C-H断裂所需的活化能比C-D断裂所需的 活化能小,因此C-H的反应速率比C-D键 反应速率要大。 说明决速步骤与C-H键的断裂有关,否则 kH/kD为1:1
第三章反应历程
3. 有机反应试剂的分类
有机反应是试剂和反应物相互作用而发生的
亲核试剂:具有较大的负电密度,反应中 有 给出电子(Nu:)包括所有的阴离子、具 机 有未共享电子的物质、氨及有机碱类、所 反 有烷基金属、金属还原剂、能供给电子的 应 烯烃或芳烃 试 亲电试剂:具有较高的正电密度,易接受 剂 电子(E+)包括所有的阳离子、可以接受
第三章反应历程
例外:乙炔基正离子是线型结构,空轨道 是Sp杂化轨道;苯基正离子是平面结构, 空轨道是Sp2杂化轨道。 利用X-ray和核磁共振的研究表明,三苯 甲基正离子为螺旋浆结构,三个苯环成 54°角。
+
C
第三章反应历程
碳正离子的产生
•中性底物的异裂产生 RX R+X X可以为卤素、羟基、甚至氢原子。
未共享电子的物质、所有碳正离子、酸类、 二氯卡宾、氧化剂
第三章反应历程
4. 研究反应历程的方法
4.1 产品的分离和鉴定
Ph
Br2
Ph
MeOH
Br Ph
Br Ph
+
Ph Br
Ph OMe
• 说明烯烃和卤素分子的两个部分不是同时加成
第三章 加成反应

CH3 + H2O H+
CH3
CH3
CH3
H CH3
+
HOH
OH
CH3
大约等量的顺、反异构体
南通大学化学化工学院 张湛赋 8
《有机化学选论》讲授提纲——加成反应
B、三分子亲电加成反应机理(AE3)和立体选择性
HX
快
C C + HX
CC
… …
HX CC
慢 反式加成
H CC
HX
速率= k[烯烃][HX]2 X
作为酸起作用。因此,一系列的质子酸以及Lewis酸都具有向烯烃加成的能力。例如:HX、X2、 H2SO4、H3O+、HOX、ICl、BrCl、RCO3H、R+等等。
南通大学化学化工学院 张湛赋 2
《有机化学选论》讲授提纲——加成反应
(1)亲电加成反应机理总述
E CC
E Nuc: C C Nuc
C C + E Nuc
烯烃与HBr的亲电加成反应机理:
(1)
(2)
南通大学化学化工学院 张湛赋 6
《有机化学选论》讲授提纲——加成反应
烯烃与水的亲电加成反应机理:
(1)
(2)
(3)
南通大学化学化工学院 张湛赋 7
《有机化学选论》讲授提纲——加成反应
按照碳正离子中间体进行的双分子亲电加成反应,由于碳正离子为平面构型,因此通常不具 有立体选择性。
+X +H
HX
HX
或 CC
慢 顺式加成
H XHX
快
CC
实验表明, HX 对非共轭的烯烃(空 间阻碍小的烷基取代 烯烃)的加成,是烯 烃与提供质子的 HX 加成的同时,另一分 子 HX 从反面进攻另 一双键碳原子,从而 显示了反式加成的立 体选择性。
碳正离子的杂化类型

碳正离子的杂化类型碳正离子是一种带正电荷的碳离子,具有很高的反应活性和化学惰性。
在化学反应中,碳正离子可以与其他离子或分子发生反应,形成新的化合物。
为了进一步改善碳正离子的性质和应用,研究人员发展了不同的碳正离子的杂化类型。
以下将介绍几种常见的碳正离子的杂化类型。
1. 碳正离子与有机化合物的杂化碳正离子与有机化合物的杂化是最常见的碳正离子杂化类型之一。
在这种杂化中,碳正离子与有机化合物中的碳原子发生反应,形成新的化合物。
这种反应通常是通过碳正离子的亲电性与有机化合物中的亲核性发生的。
杂化后的化合物具有更丰富的化学性质和应用前景。
2. 碳正离子与无机化合物的杂化碳正离子与无机化合物的杂化也是一种常见的杂化类型。
在这种杂化中,碳正离子与无机化合物中的离子或原子发生反应,形成新的化合物。
这种反应可以用于合成新型无机材料或改善材料的性能。
例如,碳正离子与金属离子杂化可以形成金属有机骨架材料,具有良好的催化性能和吸附性能。
3. 碳正离子与生物分子的杂化碳正离子与生物分子的杂化是一种新兴的杂化类型。
在这种杂化中,碳正离子可以与生物分子如蛋白质、核酸等发生反应,形成新的生物功能分子。
这种杂化具有重要的生物学和医学应用。
例如,通过将碳正离子杂化到药物分子上,可以提高药物的生物利用度和疗效。
4. 碳正离子与半导体材料的杂化碳正离子与半导体材料的杂化是一种前沿的杂化类型。
在这种杂化中,碳正离子可以与半导体材料如石墨烯、碳纳米管等发生反应,形成新的杂化材料。
这种杂化材料具有独特的电子性质和应用潜力,可以用于电子器件、能源储存等领域。
总结起来,碳正离子的杂化类型包括与有机化合物、无机化合物、生物分子和半导体材料的杂化。
这些杂化类型可以改善碳正离子的性质和应用,推动碳正离子在化学、生物学和材料科学等领域的研究和应用。
随着杂化技术的不断发展,碳正离子的杂化类型将会更加多样化,为科学研究和工业应用提供更多的可能性。
碳正离子与碳负离子

H 3C
C
H
+
H
C
CH 3
sp2 - sp3 σbond
H 3C
sp2 - s σbond
CH3
+ 的轨道结构
(CH3)3C + 的轨道结构
sp2杂环
平面三角构型
空的P轨道 空的 轨道
正碳离子的稳定性: 正碳离子的稳定性:
HC
C
> CH2 CH
> CH3CH2
2) 诱导效应 3) 共轭效应
(一).负碳离子的生成 ( ) 负碳离子的生成 1. C-H的异裂 (金属有机化合物的生成) 的异裂 金属有机化合物的生成) 2. 负离子对不饱和键的加成 (二).负碳离子的结构 ( ) 二 负碳离子的结构 (三).负碳离子的稳定性剑桥影响因素 负碳离子的稳定性剑桥影响因素 s-性质 性质 取代基效应 芳香性 由相邻杂原子导致的稳定性 非邻位π键的影响 非邻位 键的影响 溶剂效应
C
CH3
溶剂
正碳离子的生成: 正碳离子的生成:
1) 直接离子化
RX
Ph CH Cl Ph
H
R
通过化学键的异裂 X 而产生。 而产生。
Ph2CH
Cl
R OH
ROH2
BF3
R
H2O
CH3COF
C Z H
CH3CO
C ZH
BF4
Z: O,C,S,N
2) 对不饱和键的加成
C C
HCl
H
C C
Cl
C O
NH 2
CH3 H3C C OH CH3
有机化学第三章1

CH3
COOH 高锰酸钾CH 3
CH2CH3 高锰酸钾
COOH
KMnO4 , OH ,
CH3 CH(CH3)2 COOH K 2Cr 2O7 - H 2SO4 COOH CH2 R
烷基被氧化成 羧酸,而且不论烷 COOH 基的碳链长短,一 般都氧化成苯甲酸
COOH
,
C(CH3)3
高锰酸钾
2018/12/6
侧链较长的芳烃光照卤代主要发生在 α碳原子上。
CH2CH3
Cl2, 光 91%
CHCH 3 Cl
+ 9%
CH2CH2 Cl
CH2CH3
Br, 光 100%
CHCH 3 Br
CH2CH2-CH-CH 3 CH3
Br, 光
CHCH 2-CH-CH 3 Br CH3
2018/12/6
4.1.2 硝化反应
2018/12/6
2.2 共振论简介和苯的共振能
定域电子:被限制在两个原子核区域内运动的电子
离域电子:不局限于两个原子核区域内运动的电子。
这种电子的离域作用我们也称之为共轭作用
H2C
C H
C H
CH2
上述非经典结构式较好地表示了电子的离域 ,但是却无法告诉我们该结构中含有多少双键。因 此化学家常用共振结构(共振极限结构)来表示。
烷基苯比苯易磺化
CH3 CH3 CH3 SO3H
+ H2SO4
+
SO3H
反应温度不甲基苯磺酸 43% 32% 13%
对甲基苯磺酸 53% 62% 79%
2018/12/6
磺化反应是可逆的,苯磺酸与稀硫酸共热 时可水解脱下磺酸基。
第三章 消去反应

L
(I)
(II)
L
(I) / (II) 当L=F时,为似E1Cb的E2反应,
F
0.43 因为F具有较大电负性。
Cl
2.0
Br
2.6 当L=Cl,Br,I时,反应为似E1的
I
4.2 E2反应。
CH3CH2
β
CH3
N CH2CH2CH3 OH H2C CH2 + CH3CH CH2
β'
CH3
(98%)
第三章 消去反应
第三章 消去反应
3-1 离子型消去反应历程
气相:成烯消去反应可通过—— (1)环状过渡态 (2)自由基进行反应
溶液:消去反应——离子型反应,分为三类 (1)E1(2)E2(3)E1Cb历程
一、E1历程
第一步 生成碳正离子
第二步 β-碳上失去一个质子而生成烯烃
如:
(CH3)3C Br
遵循 Hofmann
规则
E2反应:
似E1的E2反应,遵循Sayzaf规则;多数情况下,不带电荷的 底物:卤代烃、磺酸酯。 似E1Cb的E2反应,遵循Hofmann规则;底物带电荷:季铵 碱、锍盐。
CH3(CH2)3CHCH3 EtO CH3(CH2)2CH CHCH3 + CH3(CH2)3CH CH2
【解】 2,3-二氯丁烷有两个手性碳原子,故有三个旋光 异构体,即一对对映体和一个内消旋体。
CH3 H Cl Cl H
CH3
一对对映体
H Cl Cl HCH3
CH3
OC(CH3)3 H
CH3 Cl H CH3
Cl
(CH3)3CO H
CH3 C
HC
Cl + Cl
第三章 重排反应

O C
O C H
+使用酚盐(ArOM) ,因为其碱性弱,不足以发生重排
本重排反应物虽以α-芳二酮为主,但脂肪族、脂环族、杂环 族的α-二酮也能反应
O O OH HO COO H3O HO COOH
1,2-环己二酮
KOH/EtOH H3O
2-羟基-1-环己烷甲酸
1. 2.
O
O
HO
OH O Ar C CH Ar CN
OH
Ar C CH Ar CN
OH CH Ar
Benzil重排机理:
O Ar C O Ar C Ar O OH C Ar fast O fast C OH O Ar C O C Ar O Ar C O slow C OH Ar
OH OH O Ar C C O Ar
Benzil重排动力:生成稳定的羧酸盐
若用醇盐(ROM)代替NaOH,则重排产物为相应的酯。
O C O C (CH3)3COK (CH3)3COH C COOC(CH3)3 OH 93% 二苯基羟基乙酸叔丁酯
用醇盐(ROM)时注意:
(1) 醇盐不能有α-H,否则发生氧化还原反应
O C O C
+
H R2C O
(4) 脂肪族伯胺经亚硝酸处理,重氮化失氮
R NH2 HNO2 R N N R + N2
(5) 烯的质子化
R CH CH2 H R CH CH3
亲核重排的两种过程:
分子内的SN1 过程 Z C L C L Z C C C Z C
分子内的SN2 过程(邻基参与过程) Z C C L Z L C C
邻基参与又称邻基促进,迁移基就在离去基附近,有效浓 度高,所以有邻基参与的重排常比没有邻基参与的容易使 离去基离去,重排的速率也大。
碳正离子的杂化类型

碳正离子的杂化类型
碳正离子的杂化类型主要有sp、sp2和sp3三种。
1. sp杂化:碳原子通过sp杂化形成两个sp杂化轨道和两
个未杂化的p轨道。
其中,sp杂化轨道与一个氢原子的1s
轨道重叠形成σ键,另一个sp杂化轨道与另一个碳原子
的sp杂化轨道重叠形成σ键。
这种杂化形式常见于碳正
离子中的烯烃类化合物。
2. sp2杂化:碳原子通过sp2杂化形成三个sp2杂化轨道
和一个未杂化的p轨道。
其中,三个sp2杂化轨道与三个
氢原子的1s轨道重叠形成σ键,未杂化的p轨道与另一
个碳原子的p轨道重叠形成π键。
这种杂化形式常见于碳
正离子中的烯类化合物。
3. sp3杂化:碳原子通过sp3杂化形成四个sp3杂化轨道。
四个sp3杂化轨道与四个氢原子的1s轨道重叠形成σ键。
这种杂化形式常见于碳正离子中的烷类化合物。
需要注意的是,以上杂化类型是理论上的简化模型,实际
情况中可能存在更复杂的杂化形式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7
4
1
+
3
2
OAc
OAc
7
4
5
OAc
6
3
1
2
有旋光
3
4
7
5
外消旋 OAc 1
2
6
OAc
7
4
3
5
1
6
+
2
5
6
+2
1
4
3
7.
2) π电子参与
例:对向-7-取代原菠烯形成非经典碳正离子:
TsO 7
4
5
3
1
7
AcO 7
4
3 HOAc
4
5
1
+
5
3
1
6 同向2-7-取代原6 菠烯2形成经典6 碳正离2 子:
.
China Pharmaceutical University
b) p-π共轭效应
碳正离子中心碳原子p空轨道与π电子共轭,分散正电荷, 稳定碳正离子。
+ Ph C Ph >
Ph
+
Ph C Ph > H
+ PhCH2
+
CH2
CH
CH2
.
China Pharmaceutical University
7
OTs
7
7
7+
3
5
1
44 3
4
4
3
+
5
3
5
1
5
1
+
1
6
2
6Ac
.
China Pharmaceutical University
3) 一种碳鎓离子的形成可通过几种途径 例:原菠基正离子的形成
7
4
5
1
6
3
σ 途径
2
X
SbF5
H
7
4
5
1
3
π 途径
6
+
SbF5 X
2
.
三、亲核取代反应
形成的碳正离子愈稳定,底物的活性就愈大
The SN1 reactivity order for reactants :
CH3 < 10 < Allyl ~ Benzyl ~ 20 < 30
反应速 度
CH3Br 0.58
C2H5Br 1.00
(CH3)2CHBr 261
(CH3)3CBr
8
10
.
R OPNB
2) Mechanism of the SN1 Reaction generally two steps the rate-limiting step is the reactant
give a carbocation intermediate
.
China Pharmaceutical University
.
1922年,Meerwein发现萜类化合物重排与C+有关
1962年,Olah在超酸中检测到C+
G. A. Olah, N. obel 1994
China Pharmaceutical University
产生碳正离子的反应举例:
1) 脂肪族化合物的亲核取代反应
CH3 H3C C Cl
CH3 H3C C+
的水 解
相对 水 解 速 度
R
(80%丙 酮 溶 液 )
CH3-
B
张 力
CH3CH2-
效
(CH3)3C-CH2-
应
增
(CH3)2CH-
大
(CH3)3C-
2.0 15.4 20.0 67.0 4.5*105
底物的空间张力大,形成张力小的产物的倾向强, 反应活性大--B张力效应
.
有张力的底物,倾向于生成张力最小的产物
定义: 亲核试剂提供一对电子与碳原子形成新的共价键,
碳原子与离去基团之间原有的共价键断裂, 离去基带着一对电子离开分子。
通式:R-X + Y :
R- Y + X :
.
四种SN反应类型
(A) neutral substrate + neutral nucleophile
(B) neutral substrate + anionic nucleophile
甲基推电子基通过C-Hσ键与C+的空轨道共轭。
.
σ共轭效应的研究 在超酸催化下进行 超酸:强的质子给予体,强度用哈米特酸度H°表示
超酸特点:1) 给质子能力强,亲核性低; 2) 凝固点低; 3) 粘度小。
.
China Pharmaceutical University
在超酸介质中可得到热力学最稳定的碳正离子
举例: 1.
4n+2=6, n=1
.
4) 不同价键状态
举例: CH3-C+H2 > CH2=C+H
sp2
sp
S特性增加,吸电性增强,不利于C+稳定。
5)溶剂效应 举例:
在气相中,电离活化能为836.8 kJ/mol; 在水溶液中,电离活化能为83.7kJ/mol。
因此,极性溶剂有助于碳正. 离子的形成和稳定
6)空间效应(Steric effect) 对于桥头碳正离子,张力大,稳定性差。
RNu + :X -
Reaction Coordinate (progress)
.
3) Stereochemistry of the SN1 Reaction
Since carbocations are planer and sp2-hybridized, they are achiral.
Thus if we carry out an SN1 reaction on one enantiomer of a chiral reactant, the product ( a racemic mixture) must be optically inactive.
形成碳正离子的相对反应速度:
(CH3)3CBr
Br
K =1
10 -3
Br
10 -6
.
Br
10 -13
二、经典碳正离子与非经典碳正离子 (Carbenium ions and Carbonium ions)
碳正离子(Carbocation)
三价碳正离子(Carbenium ion)
碳鎓离子(Carbonium ion) (五价or更高)
连有诱导吸电子的基团时的稳定性(-I):
.
China Pharmaceutical University
2) 共轭效应(Conjugative effect):
a) p- σ共轭效应 稳定性次序:叔碳正离子> 仲碳正离子> 伯碳正离子
如:
+
+
+
(CH3)3C > CH3CH2CHCH3 > CH3CH2CH2CH2
(C) cationic substrate + neutral nucleophile
(D) cationic substrate + anionic nucleophile
四种反应实例 .
China Pharmaceutical University
.
China Pharmaceutical University
.
China Pharmaceutical University
1、区别
经典碳正离子:中心碳原子价电子层6个电子,形成三根σ键。 此时中心C为3价。
非经典碳正离子:价电子层8个电子,除形成三根σ键外, 余下的一对电子形成一个二电子. 三中心键,中心C是5价
2、形成
1) σ电子参与 在超酸催化下,形成环丙基甲基碳正离子。碳原子 空轨道与σ键共轭形成离域键。
c) p-p 共轭效应
碳正离子中心碳原子p空轨道与邻位杂原子的未共用电 子对的p电子共轭,稳定碳正离子。
如:
+
CH3O CH2
+ CH3O CH2
+
+
CH3O
CH2
CH3O
CH2
.
3)芳香性(Aromaticity)
具有芳香性的平面环状正离子稳定
如:环丙烯基
+
⊕
4n+2=2, n=0
卓正离子
+
⊕
如:
H3C
。
+
>120
CH
H3C
+
C
=
HH
.
China Pharmaceutical University
3、稳定性及研究方法
碳正离子的相对稳定性可由其pKR+来定量表示:
R+ + H2O
ROH + H+
, [ROH][H+ ]
KR+ =
p KR+ = log
[R+]
[R+]
+ p [H+]
[ROH]
OH
H3C
CH3
CH3
2) 烯烃的亲电加成反应
H3C CH CH
H3C
CH2 + HCl
H3C
+
CH CH CH3
H3C
重 排 H3C + C CH2 CH3
- H3C
Cl
H3C
CCl CH2 CH3
