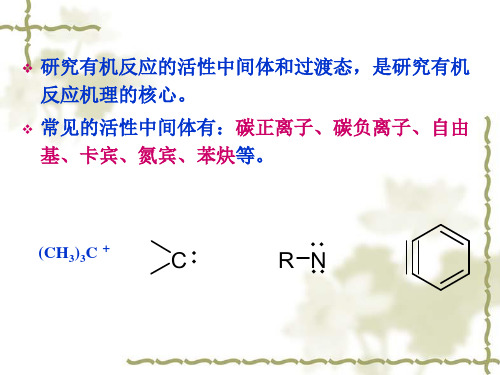
碳正离子
碳正离子

有机活性中间体——碳正离子的研究一、碳正离子的生成在有机化学反应中碳正离子可以通过不同的方法产生,主要有以下三种。
1、直接离子化[1]在化合物的离解过程中,以共价键的异裂方式产生碳正离子。
最常见的为卤代烃的异裂,在离解过程中,与碳原子相连的卤原子带着一对电子离去,产生碳正离子。
R —X →R + +X - 在这个反应中,极性溶剂的溶剂化作用是生成碳正离子的重要条件。
反应是可逆的,反应生成难溶物或用SbF 5作为Lewis 酸生成稳定SbF 6一, 会使反应向右进行,有利于碳正离子的生成。
R —Br+ Ag +→R ++ AgBr ; R —F+SbF5→R ++SbF 6-。
但是醇、醚、酰卤在酸或Lewis 酸的催化下也可以离解为碳正离子。
R 一0H → R +-OH 2→R ++H 20 ; CH 3COF+BF 3-→CH 3CO ++BF 4-利用超强酸可以从非极性化合物如烷烃中,夺取负氢离子而生成碳正离子。
(CH 3)3CH + SbF 5·FSO 3H →(CH 3)3C ++ SbF 5·FSO 3-+H 2 2、间接离子化[2]主要由其它正离子对中性分子加成而产生的碳正离子,最常见的为烯烃的亲电加成反应和芳环上的亲电取代反应。
CCH;+NO223、其它生成的途径由其它较容易获得的碳正离子转换成较稳定的难以获得的碳正离子。
常见的有重氮基正离子脱N 2而生成碳正离子。
RN R +N2 ;N 2+N2二、碳正离子的结构碳正离子带有正电荷,其结构是由其本身所决定的,碳正离子的中心碳原子为三价,价电子层仅有六个电子,根据杂化轨道理论,其构型有两种可能:一种是中心碳原子处于sp 3杂化状态下的角锥构型,另一种是中心碳原子处于sp 2杂化状态下的平面构型(见下图)。
SP3杂化角锥构型 SP2杂化平面构型在这两种构型中,以平面构型比较稳定,这一方面是由于平面构型中与碳原子相连的三个基团相距最远,空间位阻最小;另一方面是sp2杂化的s成份较多,电子更靠近于原子核,也更为稳定;再一方面空的P轨道伸展于平面两侧,便于溶剂化。
第九章碳正离子

同烯丙基碳正离子中间体
2:
比较上图(A)、(B)、 (C) 在140C的乙酸解的速 度,得到的结果是1:13.3:148,中间体是一致的, 中间体在两个碳原子上有部分正电荷,而且被甲基所 稳定化。
3:
进一步证明上述确是一个非经典碳正离子,是从 相对稳定的原冰片二烯正离子的nmr谱得到的。这里, nmr 谱表明2及3质子和4及5 质子是不相当的。那么, 在带正电荷的碳原子和一个双键之间存在着相互作用。
非经典正碳离子是由S. 温斯坦提出来的。H.C.布 朗认为这类正碳离子是一种结构重排的平衡混合物, 而不是非经典正碳离子。G. A. 奥拉等根据低温13C核 磁共振谱的数据,给非经典正碳离子的存在提供了新 的证据。
(1) C=C作为邻位基团 1:
最引人注目的是对甲苯磺酸-7-原冰片烯酯的乙酸 解比对甲苯磺酸-7-原冰片酯的快1011倍,并且保持构 型不变。
溴鎓离子的存在得到了实验的有力的支持,在金 刚烷叉金刚烷(A)的溴化反应中,曾离析出来了相 应的盐(B)。
4: 距离比较远些的溴参与形成正离子的例子,也有 报导,例如,溴和原冰片烯衍生物(A)作用,得到产 品(B)和(C),比例约为7:1。
反应机理
中间体
9.6 碳正离子的检定
测定碳正离子溶液的导电性能和溶液的依数性, 研究其存在与数量。 冷冻捕集碳正离子,后作结构鉴定。 在低温下,用质子和13C NMR、激光Raman光 谱和X-射线测定碳正离子的结构。
4:
有许多现象证明其他双键在同烯丙基位置和在更 远的位置也能有助于反应的进行;但一般速度比例比 较低得多。例如,对溴苯磺酸--(顺-7-原冰片烯基)乙 酯(图A),在25C,乙酸解速度比相应的饱和同系物 (图B)的快140,000倍。
碳正离子

第一节碳正离子含有带有正电荷的三价碳原子的基团,是有机化学反应中常见的活性中间体。
很多离子型的反应是通过生成碳正离子活性中间体进行的,同时碳正离子也是研究得最早、最深入的活性中间体,很多研究反应历程的基本概念和方法都起始于碳正离子的研究,因此,有人认为碳正离子的研究是理论有机化学的基础。
一.碳正离子的生成碳正离子可以通过不同方法产生,主要有下面三种:1.中性化合物异裂,直接离子化化合物在离解过程中,与碳原子连接的基团带着一对电子离去,发生共价键的异裂,而产生碳正离子,这是生成碳正离子的通常途径。
明显的实例如:在这样的过程中,极性溶剂的溶剂化作用是生成碳正碳离子的重要条件。
反应生成难溶解的沉淀也可影响平衡,使反应向右进行,而有利于碳正离子的生成,例如Ag+可以起到催化碳正离子生成的作用。
R-Br + Ag → AgBr↓ + R+SbF5作为Lewis酸,又可生成稳定的SbF6-,也有利于碳正离子的生成。
R-F + SbF5 → R+ + SbF6-在酸或Lewis酸的催化下,醇、醚、酰卤也可以离解为碳正离子,例如:利用酸性特强的超酸甚至可以从非极性化合物如烷烃中,夺取负氢离子,而生成碳正离子。
由于碳正离子在超酸溶液中特殊的稳定性,很多碳正离子结构和性质的研究是在超酸中进行的,利用超酸可以制备许多不同碳正离子的稳定溶液。
2.正离子对中性分子加成,间接离子化质子或带电荷的基团在不饱和键上的加成也可生成碳正离子。
如烯键与卤化氢的加成,第一步生成碳正离子。
羰基酸催化的亲核加成,首先质子化形成碳正离子,更有利于亲核试剂进攻。
芳环上的亲电取代反应,如硝化是由+NO2正离子进攻,形成σ络合物,这是离域化的碳正离子。
3.由其他正离子生成碳正离子可以由其他正离子转变得到,例如重氮基正离子就很容易脱氮而生成芳基正离子。
也可以通过一些较易获得的正离子而制备更稳定但难于获得的碳正离子,例如用三苯甲基正离子可以夺取环庚三烯的负氢离子而获得离子。
碳正离子_精品文档

(3)频哪醇重排
5 碳正离子的应用
利用取代反应可以制备很多物质,而消去脱氢也是制备某些烯烃等的一种重要方法。阳离子聚合可以制备很多有用的高分子材料,但起反应机理有待进一步研究。
5. 重排反应,如Wagner-Meerwein重排,Demyanov 重排,频哪醇重排生成更稳定的碳离子
当醇羟基的b-碳原子是个仲碳原子(二级碳原子)或叔碳原子(三级碳原子)时,在酸催化脱水反应中,常常会发捷姆扬诺夫重排。脂肪族或脂环族伯胺与 亚硝酸作用而导致的重排,也可视为一种瓦格涅尔-米尔外因重排。
3.3 溶剂效应 溶剂化在形成碳正离子的过程中起着重要作用。
3.4 芳构化效应 根据休克尔规则,共面、共轭,p电子数等于4n+2 的环状体系具有芳香性,因此也比较稳定。
4 碳正离子的反应
碳正离子的反应很多,大致可以分为以下几类: 1.单分子亲核取代反应(SN1) 2.芳烃的亲电取代反应;
2.3 由其他正离子生成
如偶氮正离子脱去 N2 生成碳正离子
3 碳正离子稳定性影响因素
3.1电子效应 给电子基团使碳正离子稳定性增加,吸电子集团使碳正离子稳定性降低。
共轭效应可以明显稳定碳正离子
缺电子的p-Π共轭
3.2 空间效应
中心碳原子连接的基团越大,则张力越大,有利于碳正离子的形成。
如:
卤化烃在 Ag+或Lewis 酸中离解,卤原子带着一对电子离去,产生碳正离子;醇,醚,酰卤在酸或Lewis 酸作用下也可生成碳正离子;用超酸甚至可以从非极性化合物如烷烃中夺取H而生成碳正离子。
2.2 质子或其他阳离子与不饱和体系的加成
对于不饱和体系,可通过质子或其它带正电荷的原子团或Lewis 酸的加成来产生碳正离子。
碳正离子

结构
ቤተ መጻሕፍቲ ባይዱ
碳正离子与自由基一样,是一个活泼的中间体。碳正离子有一个正电荷,最外层有6个电子。带正电荷的碳原 子以sp2杂化轨道与3个原子(或原子团)结合,形成3个σ键,与碳原子处于同一个平面。碳原子剩余的P轨道与 这个平面垂直。碳正离子是平面结构。
1963年有报道,直接观察到简单的碳正离子,证明了它的平面结构,为它的存在及其结构提供了实验依据。 根据带正电荷的碳原子的位置,可分为一级碳正离子,二级碳正离子和三级碳正离子。 碳正离子的结构与稳定性直接受到与之相连接的基团的影响。它们稳定性的一般规律如下: (1)苄基型或烯丙型一般较稳定; (2)其它碳正离子是:3°>2°>1°; 而烯丙型,苄基型的碳正离子与二级碳正离子的稳定性比较,尚有争论。 (可以用超共轭解释不同碳正离子的稳定性) 碳正离子越稳定,能量越低,形成越容易。
第一个溶液中稳定的碳正离子的NMR图谱在1958年时由Doering等人所发表.其为七甲基苯离子 (heptamethylbenzenium ion),由六甲基苯加上氯化铝、氯甲烷所制成.Story等人于1960制备出稳定的7norbornadienyl阳离子,借由norbornadienyl chloride与-80℃下溶于液态二氧化硫的四氟硼酸银反应产 生.此NMR图谱显示出一个非传统的中间物(第一个发现的非传统稳定离子) 1962年,Olah借由核磁共振直接发现 三级丁基碳阳离子跟溶于魔酸(magic acid)里的三级丁基氟一样稳定.Norbornyl阳离子的NMR图谱最先由 Schleyer等人发表,而Saunders等人则显示出屏障间质子抢夺的过程.
形成过程
碳正离子的形成过程大概是这样的: C+上原本连有一个电负性较大的或者吸电子的基团(如-Br, -OH等) 那么这个基团就会将它连接的碳上的电子吸引过去使该碳稍微显正电性吸电子基团在适当溶液中还可能带着一对 电子离去(例如Br- ),那么剩下的烃基就形成了碳正离子。
碳正离子参与的有机化学反应

碳正离子参与的有机化学反应碳正离子是有机化学中一类重要的中间体,参与许多重要的化学反应。
以下是一些常见的碳正离子参与的有机化学反应:1.烷基化反应:碳正离子可以作为烷基化的亲电试剂,与底物分子中的亲核原子发生亲核取代反应。
这种反应常用于合成烃类化合物,如烷基苯、醇、酮等。
例如,苯与氯甲烷在三氯化铝催化剂作用下,可以发生烷基化反应生成甲基苯。
2.酰化反应:碳正离子可以与羧酸、酯、酰胺等含氧衍生物发生酰化反应,生成酮、醛等化合物。
这种反应常用于合成酮、醛等化合物,以及制备高分子材料。
例如,苯与乙酰氯在三氯化铝催化剂作用下,可以发生酰化反应生成苯乙酮。
3.缩合反应:碳正离子可以与另一分子中的碳原子或氧原子发生缩合反应,生成新的碳碳键或碳氧键。
这种反应常用于合成环状化合物、高分子材料等。
例如,甲醛与苯酚在氢氧化钠溶液中,可以发生缩合反应生成酚醛树脂。
4.氧化反应:碳正离子可以与氧化剂发生氧化反应,生成酮、羧酸等化合物。
这种反应常用于合成酮、羧酸等化合物,以及降解有机物。
例如,正己烷在氧气作用下,可以发生氧化反应生成己酸。
5.聚合反应:碳正离子可以作为聚合反应的引发剂,引发单体分子聚合生成高分子化合物。
这种反应常用于合成高分子材料。
例如,乙烯在催化剂作用下,可以发生聚合反应生成聚乙烯。
6.环化反应:碳正离子可以与另一分子中的碳原子或氧原子发生环化反应,生成环状化合物。
这种反应常用于合成环状化合物等。
例如,苯与乙烯在催化剂作用下,可以发生环化反应生成苯乙烯。
7.氮化反应:碳正离子可以与氮化物发生氮化反应,生成腈、胺等化合物。
这种反应常用于合成腈、胺等化合物。
例如,乙酸乙酯在氨水作用下,可以发生氮化反应生成乙酸乙酯胺。
8.硫化反应:碳正离子可以与硫化物发生硫化反应,生成砜、硫醚等化合物。
这种反应常用于合成砜、硫醚等化合物。
例如,乙醇与硫化氢在催化剂作用下,可以发生硫化反应生成乙硫醚。
碳正离子参与的有机化学反应种类繁多,这些反应在有机合成、高分子材料制备等领域具有广泛的应用价值。
第七章碳正离子1

4 碳正离子的反应
与亲核试剂作用---具有电子对的物质结合 (Lewis酸碱反应) 脱去氢离子生成烯烃 重排为更稳定的碳正离子
加成反应
Create PDF with GO2PDF for free, if you wish to remove this line, click here to buy Virtual PDF Printer3
H OC2H5
芳香环稠合的邻位作用
H SbF6
Br AgOAc HOAc
H SbF6
H OAc
SbF6
Create PDF with GO2PDF for free, if you wish to remove this line, click here to buy Virtual PDF Printer8
I Cl
构型保持的取代
Br
CH3
C C H HBr
H
H3C
OH
Br HC H3C
CH3 CH
Br
Br
H
H C C CH3 HBr
H3C
OH
Br C
H H3C
H
H
C CH3 H3C C
+
Br
Br
Br CH
CH3
Create PDF with GO2PDF for free, if you wish to remove this line, click here to buy Virtual PDF Printer4
Ts = CH3
SO2
2电子3中心体系
反-7-原冰片烯基对甲苯磺酸酯
实验表明: 在乙酸中的溶剂解的速度比相应的饱 和化合物大 1011倍.产物构型保持.
有机化学 碳正离子稳定性比较

有机化学碳正离子稳定性比较
1、烷基有给电子的诱导作用:因为Sp2杂化轨道电负性强于SP3杂化的烷基碳。
当烷基碳上有氢原子时,还有σ-P超共轭的给电子效应(不懂电子效应的同学可以看一下基础课程中的11讲,电子效应及其应用)。
因此碳正离子稳定性为:三级碳正离子>二级碳正离子>一级碳正离子。
2、碳碳双键和苯环对碳正离子有给电子的p-π共轭效应:双键上的电子会离域到碳正离子的空p轨道上,使碳正离子稳定。
因此碳正离子与双键或苯环相连时,可以增加稳定性。
3、碳正离子的三个SP2杂化轨道应该互成120°,当位于桥头的碳形成碳正离子时,由于桥的刚性,使得与碳相连的三个键无法满足互相成120°,因此具有张力,使碳正离子不稳定。
且刚性越大越不稳定。
桥碳原子数越少,环的刚性越大。
4、与小环烷基相连的碳正离子,由于小环烷烃的香蕉键,会对碳正离子有很强的超共轭效应,因此可以很好地稳定碳正离子,其稳定碳正离子的能力甚至与苯环相当。
扩展资料:
碳正离子可能发生重排反应,从不太稳定的结构,以同样稳定或较稳定的人与速率常数超过10/秒。
这一事实复杂的合成途径许多化合物。
例如,当3-戊醇中加热用HCl水溶液中,最初形成的3-戊基碳正离子重新排列到3-戊基和2-戊基的统计混合物。
这些阳离子与氯离子反应,产生约1/3 3-氯戊烷和2/3 -2-氯戊烷。
三种碳正离子稳定性顺序

三种碳正离子稳定性顺序
碳正离子是指碳原子拥有正电荷的离子,它们在稳定性方面可以分为三种:烯烃碳正离子、烃碳正离子和烷烃碳正离子。
烯烃碳正离子是最不稳定的碳正离子,它们是碳原子拥有了正电荷的离子,但不具有稳定的连接,所以它们是最不稳定的碳正离子。
烃碳正离子是烯烃碳正离子的延伸,它们在烯烃碳正离子的基础上增加了一个稳定的连接,所以它们的稳定性比烯烃碳正离子要高。
最稳定的是烷烃碳正离子,它们比烯烃碳正离子和烃碳正离子都要稳定,因为它们有两个稳定的连接,所以它们是最稳定的碳正离子。
碳正离子的稳定性是由它们拥有的稳定连接有关的,烯烃碳正离子只有一个稳定的连接,烃碳正离子有两个稳定的连接,而烷烃碳正离子有三个稳定的连接,所以它们的稳定性也是线性的,烯烃碳正离子最不稳定,烷烃碳正离子最稳定。
碳正离子的稳定性对某些化学反应非常重要,例如氧化反应,碳正离子的稳定性会影响反应的速度和产物的种类,所以了解碳正离子的稳定性是很重要的。
总之,碳正离子稳定性的顺序为:烯烃碳正离子<烃碳正离子<烷烃碳正离子,它们的稳定性是线性的,烯烃碳正离子最不稳定,烷烃碳正离子最稳定,它们的稳定性对化学反应的影响很大,所以对它们的稳定性有一定的了解是很有必要的。
碳负离子半径和碳正离子半径

碳负离子半径和碳正离子半径
碳正离子是带正电荷的碳原子,以SP2杂化轨道与3个原子或原子团结合,形成3个σ键,与碳原子处于同一个平面,是平面结构,碳正离子是一个活泼的中间体。
碳负离子是带负电荷的具有偶数价电子的物种,其负电荷(未共用电子对)定域在一个碳原子上,一般能迅速发生反转呈现为平衡,这类碳负离子的稳定性顺序(按荷负电原子类型)为伯>仲>叔。
正碳离子和碳负离子的半径大小主要取决于最外层电子数和原子核内质子数,当最外层电子少时,半径较小,当最外层电子多时,半径较大。
离子半径是化学研究中一个重要的概念,对于理解物质的性质和反应机理具有重要意义。
如果你想了解更多关于离子半径的信息,可以查阅相关的化学文献或咨询化学专家。
碳正离子捕获

碳正离子捕获碳正离子捕获(Carbon-14 Dating)是一种测定古物年龄的方法,它是利用碳-14放射性衰变来推算物质年龄。
以下是具体介绍:一、碳-14的产生与特点1.1 碳-14的产生碳-14产生于大气层中的氮气(N2)与宇宙射线碰撞后的核反应。
反应式为:N14 + n0 → C14 + H1其中,N14是氮的原子核,n0是宇宙射线中的中子,C14是碳-14的原子核,H1是氢的原子核(质子)。
1.2 碳-14的特点碳-14具有放射性,半衰期为约5730年,意即约5730年后,其半数核子会衰变成氮-14,同时放出一个β粒子。
这个放射性现象的规律是,若一物质中含有一定比例的碳-14,那么随着时间的推移,碳-14的含量会不断降低。
二、碳正离子捕获的原理2.1 碳正离子的生成甲烷分子(CH4)可以通过电子轰击、热解分解等方式产生碳正离子(C+)。
具体反应式为:CH4 + e- → CH3• + H•(电子轰击)CH4 → C+ + 4H•(热解分解)其中,CH3•是甲基自由基,H•是氢原子自由基。
2.2 碳正离子与CO2的反应碳正离子(C+)与CO2反应生成带正电荷的碳原子(C+•)和氧气分子(O2)。
具体反应式为:C+ + CO2 → C+• + O22.3 碳正离子与有机物的反应碳正离子(C+)与有机物相互作用,将有机物分解成二氧化碳(CO2)和带正电荷的碳原子(C+•)。
具体反应式为:C+ + R → C+• + CO2 + H•(R代表一种有机物)三、碳正离子捕获的应用3.1 碳正离子捕获的步骤碳正离子捕获的步骤包括:取样、样品前处理、质谱分析等。
3.2 碳正离子捕获的局限性碳正离子捕获的局限性主要在于分析的样品必须含有一定比例的有机碳,否则无法进行分析。
同时,由于碳-14的半衰期只有约5730年,因此碳正离子捕获只适用于测定年龄不超过5万年的物质。
3.3 碳正离子捕获的应用领域碳正离子捕获在考古学、地质学等领域有着广泛的应用。
c正离子

三级碳正离子>二级碳正离子>一级碳正离子>甲基碳正离子若有共轭效应存在则更加稳定.反应也是向生成最稳定的化合物方向.因此许多反应生成的物质会发生重排.即碳正离子的迁移.理论上是从诱导效应和共轭效应两方面判断:结论就是如下的规律;Ph-+CH2 > CH2=CH-CH2+> +C(CH3)3 > +CH(CH3)2 > +CH2(CH3) > +CH3从物理学角度来说,电荷越分散,带电体系越稳定Ph-+CH2和CH2=CH-CH2+之所以稳定,是因为正碳离子采取sp2杂化,有一对空的p轨道,可以和苯环或是烯烃的p轨道平行形成p-π共轭,从而使得正电荷分散+C(CH3)3 > +CH(CH3)2 > +CH2(CH3) > +CH3是因为超共轭效应和诱导效应,带正电荷的C院子周围的烷基增多有利于其电荷分散那像CH2=CH-CH2+跟CH2=C+-CH3 哪个更稳定?前者稳定得多,前者的结构是两个p轨道和一个空p轨道两两平行,空p轨道的电荷可以分散到π键上,即p-π共轭,后者则没有这种效果碳正离子肯定是缺电子,你看看附近的基团是什么样的。
如果是吸电子的,就会更不稳定,如果是推电子的,就会稳定。
至于基团吸或者推电子的强弱,就翻书吧。
举例,三级碳正离子稳定性大于二级碳大于一级碳。
带苯环的话。
共轭的话会稳定,破坏共轭的话就不稳定。
比如Ph-CH2 + 就比Ph +稳定。
前者的CH2的C以sp2杂化参与共轭,而后者则破坏了苯环共轭,碳正离子不稳定。
暂时想到这么多。
ph-CH=CH-CH2+较稳定。
笨、碳碳双键和甲基正离子共轭,电子离域,较稳定。
1,比较诱导效应的强弱,就是楼上所说的供电子基团越多越稳定,比如在魔酸溶液中大量存在的叔丁基碳正离子:(CH3)3C+就较稳定。
2,比较共轭效应,p-π共轭比诱导效应甚至更加明显,比如苯环相连的碳正离子,p轨道和苯环共轭,苯环大π键电子离域到正电荷碳原子降低碳原子的正电性从而使整体能量降低,这个比甲基的供电子诱导效应要强一些,形成正离子更加稳定。
碳正离子

(Nucleophilic Substitution and Carbocations)
一、碳正离子的产生、结构和稳定性 1、产生及类型:有机反应中产生的活性中间体的一种。
是Intermediate, 而不是Transition state 碳正离子能在一定条件下存在且被分离出
+ H2SO4
China Pharmaceutical University
2、结构 经典碳正离子(Carbenium ion):
中心碳原子sp2 杂化 与其他三个基团或原子以σ键相连 形成具平面的构型
China Pharmaceutical University
。 一些情形下,键角不是120,或者不是平面结构。
甲基推电子基通过C-Hσ键与C+的空轨道共轭。
σ共轭效应的研究 在超酸催化下进行 超酸:强的质子给予体,强度用哈米特酸度H°表示
超酸特点:1) 给质子能力强,亲核性低; 2) 凝固点低; 3) 粘度小。
China Pharmaceutical University
在超酸介质中可得到热力学最稳定的碳正离子
的水 解
相对 水 解 速 度
R
(80%丙 酮 溶 液 )
CH3-
B
张 力
CH3CH2-
效
(CH3)3C-CH2-
应
增
(CH3)2CH-
大
(CH3)3C-
2.0 15.4 20.0 67.0 4.5*105
底物的空间张力大,形成张力小的产物的倾向强, 反应活性大--B张力效应
有张力的底物,倾向于生成张力最小的产物
1922年,Meerwein发现萜类化合物重排与C+有关
碳正离子的杂化类型

碳正离子的杂化类型
碳正离子的杂化类型主要有sp、sp2和sp3三种。
1. sp杂化:碳原子通过sp杂化形成两个sp杂化轨道和两
个未杂化的p轨道。
其中,sp杂化轨道与一个氢原子的1s
轨道重叠形成σ键,另一个sp杂化轨道与另一个碳原子
的sp杂化轨道重叠形成σ键。
这种杂化形式常见于碳正
离子中的烯烃类化合物。
2. sp2杂化:碳原子通过sp2杂化形成三个sp2杂化轨道
和一个未杂化的p轨道。
其中,三个sp2杂化轨道与三个
氢原子的1s轨道重叠形成σ键,未杂化的p轨道与另一
个碳原子的p轨道重叠形成π键。
这种杂化形式常见于碳
正离子中的烯类化合物。
3. sp3杂化:碳原子通过sp3杂化形成四个sp3杂化轨道。
四个sp3杂化轨道与四个氢原子的1s轨道重叠形成σ键。
这种杂化形式常见于碳正离子中的烷类化合物。
需要注意的是,以上杂化类型是理论上的简化模型,实际
情况中可能存在更复杂的杂化形式。
有机反应中间体
常见的超酸
与100%H2SO4的酸性比较
HSO3F (氟硫酸) HSO3F - SbF5 (魔酸) HF-SbF5
1000倍 1000倍 1016倍
叔丁醇在下列条件下完全转变成叔丁基正离子:
CH3 H3C C OH
CH3
HSO3F - SbF5-SO2 - 60 oC
CH3 H3C C +
CH3
SO3F- + H2O + SbF5 +
❖ 如:反应在CS2中进行时,产物1/2比例为106,而当 溶剂为苯时,则降至49.
CH3 CH3
hv
H3C H
CH3 H
Cl2
CH3 CH3
H3C
CH3 +
H Cl
1
CH3 H3C
H
CH3 CH2Cl
H
2
四、卡宾
❖ 也叫碳烯,是一类缺电子的中性活性中间体,其中 包含一个只有六个价电子的两价碳原子。是1959年 利用光谱研究确定的。
d、乙烯型碳正离子: H2C CH
HC R
C
H
C原子进行sp2杂化, p轨道 用于形成π键,空着的是sp2
+ 杂化轨道,使正电荷集中。 因此不稳定。
苯基正离子:
结构同乙烯型正碳离子,正电荷 集中在sp2杂化轨道上。
此两类碳正离子稳定性极差。
e、溶剂效应:
1) 溶剂的诱导极化作用,利于底物的解离。
SO2
很多正碳离子的结构与稳定性的研究都是在超酸介质中进行的。
4、非经典碳正离子
1) π键参与的非经典碳正离子 实验表明:
反-7-原冰片烯基对甲苯磺酸酯在乙酸中的溶剂解的 速度比相应的饱和化合物大1011倍。
碳负离子和碳正离子对比,碳负离子的稳定性,碳正离子的稳定性,自由基的稳定性

碳正离子与碳负离子的对比一、碳正离子1.碳正离子的产生碳正离子可以认为是通过C-C 单键中一对电子的异裂形成的,式中X 代表卤素。
碳正离子中带正电荷的碳原子是sp 2 杂化,三个杂化轨道呈平面排列与其他原子或基团成键,键角约为120o ,有一个垂直于此平面的空p 轨道,这个空的P 轨道与化学性质密切相关。
B碳正离子很不稳定,需要电子来完成八隅体构型,因此任何给电子的因素都能使正电荷分散而稳定,任何吸电子的因素均能使正电荷集中而更不稳定。
故而R 的共轭效应,给电子的诱导效应和立体效应,以及烷基的超共轭效应都能对碳正离子起稳定作用。
2.碳正离子的稳定性烷基有给电子的诱导效应,故带正电荷的碳上的烷基越多,给电子的诱导效应越大,使正电荷越分散而稳定。
还有超共轭效应,也使得碳正离子更稳定。
P-π共轭也能使正电荷分散而稳定,碳正离子与不饱和的烯或芳基相连时,共轭体系越多,碳正离子越稳定。
(CH 3)3C +>(CH 3)2C +H>CH 3C +H 2>C +H 3 (CH 2=CH)3C +>(CH 2=CH)2C +H>CH 2=CHC +H 2由于碳正离子中带正电荷的碳原子是sp 2 杂化,桥头碳原子由于桥的刚性结构,不形成具有平面三角形的SP 2轨道的碳正离子,即使能形成也很不稳定。
3.碳正离子的反应(1)与与亲核试剂结合:R ++Nu —→R —Nu (2)消除邻位碳上的一个质子而形成烯烃:(3)和烯烃加成形成更大的碳正离子:R 3CXR 3C+XoC +3C +2HC+H 2>>CHC+C CR ++C CC C +R(4)使芳香环烷基化:(5)重排成为更稳定的碳正离子:在有碳正离子的反应中,例如S N 1中,其反应机理如下:R 33C ++X _ R 3C ++N u 3CNu由于碳正离子的平面结构,带正电的碳原子上有一个空的P 轨道,如果该碳原子上连接着三个不同的基团,由于亲核试剂从平面两边进攻的机会相等,因而可以得到“构型保持”和“构型翻转”两种化合物如下:S N 1反应中还包含了碳正离子的另一个重要的反应—重排反应,如上面已给的图中,由一级碳正离子转变为三级碳正离子就是一个重排反应。
碳正离子

碳正离子碳正离子是一种带正电的极不稳定的碳氢化合物。
分析这种物质对发现能廉价制造几十种当代必需的化工产品是至关重要的。
欧拉教授发现了利用超强酸使碳正离子保持稳定的方法,能够配制高浓度的碳正离子和仔细研究它。
他的发现已用于提高炼油的效率、生产无铅汽油和研制新药物。
碳正离子与自由基一样,是一个活泼的中间体。
碳正离子有一个正电荷,最外层有6个电子。
带正电荷的碳原子以SP2杂化轨道与3个原子(或原子团)结合,形成3个σ键,与碳原子处于同一个平面。
碳原子剩余的P轨道与这个平面垂直。
碳正离子是平面结构。
1963年有报道,直接观察到简单的碳正离子,证明了它的平面结构,为它的存在及其结构提供了实验依据。
根据带正电荷的碳原子的位置,可分为一级碳正离子,二级碳正离子和三级碳正离子。
碳正离子的结构与稳定性直接受到与之相连接的基团的影响。
它们稳定性的一般规律如下:(1)苄基型或烯丙型一般较稳定;(2)其它碳正离子是:3°>2°>1°;碳正离子越稳定,能量越低,形成越容易,加成速度也越快,可见碳正离子的稳定性决定烯烃加成的取向。
碳正离子根据结构特点不同可分为:经典碳正离子和非经典碳正离子碳负离子(Carbanion)指的是含有一个连有三个基团,并且带有一对孤对电子的碳的活性中间体。
碳负离子带有一个单位负电荷,通常是四面体构型,其中孤对电子占一个sp3 杂化轨道。
通过比较相应酸的酸性大小,可以大致判断碳负离子的稳定性大小。
一般地,具有能稳定负电荷的基团的碳负离子具有较高的稳定性。
这些基团可以是苯基、电负性较强的杂原子(如O,N,基团如-NO2、-C(=O)-、-CO2R、-SO2-、-CN和-CONR2等)或末端炔烃(也可看作电负性的缘故),例如,三苯甲烷、三氰基甲烷、硝基甲烷和1,3-二羰基化合物具有较强的酸性。
除此之外,不同于缩酮,缩硫酮的α氢也具有较强的酸性。
这可以用硫的3d轨道与C-S键σ*轨道的超共轭效应来解释。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
LOGO
LOGO
共轭效应可以明显稳定碳正离子
缺电子的p-Π共轭 共轭 缺电子的
LOGO
3.2 空间效应 中心碳原子连接的基团越大,则张力越大, 中心碳原子连接的基团越大,则张力越大,有利于碳正 离子的形成。 离子的形成。
LOGO
3.3 溶剂效应 溶剂化在形成碳正离子的过程中起着重要作用。 溶剂化在形成碳正离子的过程中起着重要作用。 3.4 芳构化效应 根据休克尔规则,共面、 根据休克尔规则,共面、 共轭, 电子数等于4n+2 共轭,π电子数等于 的环状体系具有芳香性, 的环状体系具有芳香性, 因此也比较稳定。 因此也比较稳定。
LOGO
4.与烯烃加成生成更大的碳正离子 卤素,氢卤酸, 卤素 氢卤酸,水、硫酸、有机酸、 氢卤酸 硫酸、有机酸、 醇、酚,次卤酸与烯烃加成
LOGO
5. 重排反应,如Wagner-Meerwein重排,Demyanov 重 排,频哪醇重排生成更稳定的碳离子
(1)瓦格涅尔-米尔外因重排反应(Wagner-Meerwein重排) 是醇失水反应中,中间体碳正离子发生1,2-重排反应,并伴随有 氢、烷基或芳基迁移的一类反应 当醇羟基的b-碳原子是个仲碳原子(二级碳原子)或叔碳原子(三级碳原 子)时,在酸催化脱水反应中,常常会发生重排反应,得到重排产物:
R3C:X →R3C++XLOGO
所形成的碳正离子R 一个正电荷,配位数为3, 所形成的碳正离子 3C+,一个正电荷,配位数为 ,中 心原子以三个sp 杂化轨道和三个原子成键, 心原子以三个 2杂化轨道和三个原子成键,三个键轴构 成平面,空着的p轨道垂直于平面 正电荷集中在p轨道上 轨道垂直于平面, 轨道上。 成平面,空着的 轨道垂直于平面,正电荷集中在 轨道上。 取代基R的共轭效应 诱导效应和立体效应, 的共轭效应, 取代基 的共轭效应,诱导效应和立体效应,以及烷基的 超共轭效应都能对碳正离子其稳定作用。 超共轭效应都能对碳正离子其稳
碳正离子化学是有机化学非常重要的组成 部分, 部分,Olah由于发现在超强酸中稳定存在的 由于发现在超强酸中稳定存在的 碳正离子,获得了1994年的诺贝尔化学奖。 年的诺贝尔化学奖。 碳正离子,获得了 年的诺贝尔化学奖 碳正离子是带有正电荷的含碳离子, 碳正离子是带有正电荷的含碳离子,是一 类重要的活性中间体,可用R 表示( 为烷 类重要的活性中间体,可用 3C+表示(R为烷 )。碳正离子及其反应于 世纪20年代由 碳正离子及其反应于20世纪 基)。碳正离子及其反应于20世纪20年代由 C.K.英戈尔德等提出的。碳正离子可以认为 英戈尔德等提出的。 英戈尔德等提出的 是通过共价C-C单键中一对电子的异裂反应而 是通过共价 单键中一对电子的异裂反应而 产生,式中X为卤素 为卤素。 产生,式中 为卤素。
卤化烃在 Ag+或Lewis 酸中离解,卤原子带着一对 电子离去,产生碳正离子;醇,醚,酰卤在酸或 Lewis 酸作用下也可生成碳正离子;用超酸甚至可以 从非极性化合物如烷烃中夺取H而生成碳正离子。 R+ + XR—X X可以是:H, F, Cl, Br, I, OTs, OCOZ(Z为卤素), 可以是: 为卤素) 可以是 为卤素 H2O, ROH, N2+, CO, CO2 如:
LOGO
3.单分子消去反应E1 和SN1反应历程相似,单分子消除反应历程也是分两步进行, 第一步是卤烷分子在溶剂中先离解碳正离子,第二步是在β-碳上 脱去一个质子,同时在α与β-碳原子之间形成一个双键,其过程 是
在起E1反应的同时,生成的碳正离子可以发生重排,形成更稳定的碳正 离子再消去β-氢(E1)或与亲核试剂作用(SN1)
LOGO
LOGO
(2)Demyanov 重排反应捷姆扬诺夫重排。脂肪族或脂环族伯胺与 亚硝酸作用而导致的重排,也可视为一种瓦格涅尔-米尔外因重排。
LOGO
LOGO
(3)频哪醇重排
LOGO
5 碳正离子的应用 利用取代反应可以制备很多物质,而消去脱氢也是制 备某些烯烃等的一种重要方法。阳离子聚合可以制备很多 有用的高分子材料,但起反应机理有待进一步研究。
LOGO
平面碳正离子相对要稳定一些。 平面碳正离子相对要稳定一些。特别是共轭 越多,正电荷越分散,碳正离子越稳定。 越多,正电荷越分散,碳正离子越稳定。
+≈(CH ) C+>C=CArCH2 3 3 CH2+≈(CH3)2CH+> +>CH + CH3CH2 3
LOGO
2 碳正离子的形成
2.1反应物直接解离
+
+
2+
LOGO
4 碳正离子的反应
碳正离子的反应很多,大致可以分为以下几类: 1.单分子亲核取代反应(SN1)
2.芳烃的亲电取代反应;
LOGO
在路易斯酸FeX3作用下,Br-Br键发生极化, 一个卤原子带部分正电荷,另一个卤原子带部 分负电荷。卤正离子向苯环进攻生成σ络合物, 同时生成[FeX4-]与解离出来的质子结合生成HX, 使FeX3催化剂再生。
LOGO
2.2 质子或其他阳离子与不饱和体系的加成
对于不饱和体系,可通过质子或其它带正电荷 的原子团或Lewis 酸的加成来产生碳正离子。
LOGO
2.3 由其他正离子生成
如偶氮正离子脱去 N2 生成碳正离子
LOGO
3 碳正离子稳定性影响因素
3.1电子效应 给电子基团使碳正离子稳定性增加,吸电子集团使碳 正离子稳定性降低。
