氢和稀有气体.ppt
合集下载
氢和稀有气体

他设法从空气中除去氮气和氧气后,发觉还有极少旳气体, 约占总体积旳 1% 。这种剩余气体不同任何物质发生反应,但在 放电管中发生特殊旳辉光,有特征旳波长。于是, Ramsay 宣告 他在空气中发觉了一种新元素,命名为 “氩” ( 拉丁文名旳原意 是 “不活泼” ) 。
这一发觉惊动了科学界,因为当初普遍以为空气已研究得够 清楚了,所以 Ramsay 旳工作具有划时代旳历史意义。
2 氙旳氟化合物旳生成 氙旳氟化物能够由两种单质直接化合生成,反应在一定旳温 度和压强下,在镍制旳容器中进行。为何在镍制容器中进行?
Xe ( g ) + F2 ( g ) ——— XeF2 ( g ) Xe 大过量,防止 XeF4 旳生成 ;
Xe ( g ) + 2 F2 ( g ) ——— XeF4 ( g ) F2 过量,但反应时间应短些,防止 XeF6 旳生成; Xe ( g ) + 3 F2 ( g ) ——— XeF6 ( g ) F2 大过量,反应时间长。 F2 和 Xe 旳混合气体在光照下,也能够直接化合成 XeF2 晶体 。
认识到 “ 惰气 ” 也不是绝对惰性旳。他旳工作为开拓 “ 惰气 ” 元 素化学Ba打rt下let了t 基曾础使。O2 同六氟化铂反应,而生成一种新旳化合物 O2+ [ PtF6 ]- 。他联想到 “惰气” 氙 Xe 旳第一电离能 ( 1171.5 kJ·mol-1 ) 同 O2 分子旳第一电离能 ( 1175.7 kJ·mol-1 ) 相近旳 事实,由此推测到 PtF6 氧化 Xe 旳可能性 。
杂化方式 sp3 不等性
杂化方式 sp3 等性
分子构型 三角锥
分子构型 正四面体
XeOF4 价层电子总数
对数 电子对构型
这一发觉惊动了科学界,因为当初普遍以为空气已研究得够 清楚了,所以 Ramsay 旳工作具有划时代旳历史意义。
2 氙旳氟化合物旳生成 氙旳氟化物能够由两种单质直接化合生成,反应在一定旳温 度和压强下,在镍制旳容器中进行。为何在镍制容器中进行?
Xe ( g ) + F2 ( g ) ——— XeF2 ( g ) Xe 大过量,防止 XeF4 旳生成 ;
Xe ( g ) + 2 F2 ( g ) ——— XeF4 ( g ) F2 过量,但反应时间应短些,防止 XeF6 旳生成; Xe ( g ) + 3 F2 ( g ) ——— XeF6 ( g ) F2 大过量,反应时间长。 F2 和 Xe 旳混合气体在光照下,也能够直接化合成 XeF2 晶体 。
认识到 “ 惰气 ” 也不是绝对惰性旳。他旳工作为开拓 “ 惰气 ” 元 素化学Ba打rt下let了t 基曾础使。O2 同六氟化铂反应,而生成一种新旳化合物 O2+ [ PtF6 ]- 。他联想到 “惰气” 氙 Xe 旳第一电离能 ( 1171.5 kJ·mol-1 ) 同 O2 分子旳第一电离能 ( 1175.7 kJ·mol-1 ) 相近旳 事实,由此推测到 PtF6 氧化 Xe 旳可能性 。
杂化方式 sp3 不等性
杂化方式 sp3 等性
分子构型 三角锥
分子构型 正四面体
XeOF4 价层电子总数
对数 电子对构型
无机化学第13章_氢和稀有气体

⑤野外工作,用硅等两性金属与碱液反应
0.63kg Si可制取1m3H2 :
Si+2NaOH+H2O→Na2SiO3+2H2(g)
或 LiAlH4+4H2O→Al(OH)3+LiOH+4H2(g)
19
Light work with water, NATHAN S. LEWIS Nature 414, 589 - 590 (December 6, 2001) Direct splitting of water under visible light irradiation with an oxide semiconductor photocatalyst, ZHIGANG ZOU, JINHUA YE, KAZUHIRO SAYAMA & HIRONORI ARAKAWA Nature 414, 625 - 627 (December 6, 2001)
11
11/20/2020
性质: a. 溶解性 273K时1体积水仅能溶解0.02体积氢 b. 可燃性 燃料
c. 氢的化学性质:还原剂原料
冶金
加氢反应等
Vegetable oil to fat 植物油 氢化到 脂肪
人造黄油
肥料
12
检验反应:PdCl2(aq) + H2 → Pd(s) + 2HCl(aq)
11/20/2020
第13章 氢和稀有气体
“机遇号”重大发 现
1
11/20/2020
序言
从本章开始学习元素部分。HUMPHREYO说:“真正的化学 是叙述性化学,即元素化学。只有理论没有性质那就不是化 学。”F A COFTON说:“我们确信象其他教科书那样,没有 或几乎没有包含实际内容的无机化学,就好象没有乐器演奏 的一张乐谱。”因此,我们的学习就是要掌握重要元素及其 化合物的重要性质。
氢和稀有气体
CuCl2 + 2 H —— 2 HCl + Cu 原子氢甚至能还原某些含氧酸盐,例 如: BaSO4 + 8 H —— BaS + 4 H2O
2 氢气的制备
(1) 实验室制法 实验室制 H2 常采用稀盐酸与金属锌反 应的方法。
但是由于金属锌中有时含有砷化物、磷
化物等杂质,致使制得的 H2 不纯。
O
N
C
CH
R
N
长链的蛋白质分子自身可以形成螺旋 形构型,这种结构就是靠分子内氢键来稳 定的。 DNA 的双螺旋是两条螺旋形分子通
过氢键结合起来的超分子结构。
18-1-2 氢气的性质与制备
1 氢气的性质
氢有三种同位素:氕 H 、氘 D 和氚 T。
普通的氢和氘有稳定的核,氚是一种不 稳定的放射性同位素,发生 衰变,其半衰 期为 12.26 年:
似之处,但又不完全相同。
氢是唯一值得单独考虑的元素。
稀有气体
稀有气体基态的价电子构型除氦的 ns2 以外,其余均为 ns2 np6 。 在接近地球表面的空气中,1 000 dm3 空 气中约含有 9.3 103 cm3 氩、18 cm3 氖、 5.2 cm3 氦、 1.14 cm3 氪和 0.086 cm3 氙。
主要内容
11
氢 稀有气体
主族元素总结
2 2
33
通常列于碱金属 IA 族顶端
H 氢
稀有气体
He,Ne,Ar,Kr,Xe,Kr 氦、氖、氩、氪、氙 、氡
氢
H
大气中少量的氢气,H2O,及其他无机化
合物和有机化合物中化合态的氢
氢存在于地球、太阳及木星等天体上,是
最丰富的元素
氢
H
2 氢气的制备
(1) 实验室制法 实验室制 H2 常采用稀盐酸与金属锌反 应的方法。
但是由于金属锌中有时含有砷化物、磷
化物等杂质,致使制得的 H2 不纯。
O
N
C
CH
R
N
长链的蛋白质分子自身可以形成螺旋 形构型,这种结构就是靠分子内氢键来稳 定的。 DNA 的双螺旋是两条螺旋形分子通
过氢键结合起来的超分子结构。
18-1-2 氢气的性质与制备
1 氢气的性质
氢有三种同位素:氕 H 、氘 D 和氚 T。
普通的氢和氘有稳定的核,氚是一种不 稳定的放射性同位素,发生 衰变,其半衰 期为 12.26 年:
似之处,但又不完全相同。
氢是唯一值得单独考虑的元素。
稀有气体
稀有气体基态的价电子构型除氦的 ns2 以外,其余均为 ns2 np6 。 在接近地球表面的空气中,1 000 dm3 空 气中约含有 9.3 103 cm3 氩、18 cm3 氖、 5.2 cm3 氦、 1.14 cm3 氪和 0.086 cm3 氙。
主要内容
11
氢 稀有气体
主族元素总结
2 2
33
通常列于碱金属 IA 族顶端
H 氢
稀有气体
He,Ne,Ar,Kr,Xe,Kr 氦、氖、氩、氪、氙 、氡
氢
H
大气中少量的氢气,H2O,及其他无机化
合物和有机化合物中化合态的氢
氢存在于地球、太阳及木星等天体上,是
最丰富的元素
氢
H
氢 稀有气体
用途
燃
料
燃烧值/kJ· -1 kg
氢 气(H2)
戊硼烷(B5H9) 戊 烷(C5H12)
120918
64183 43367
2、氢化物
(1)氢化物的合成
合成二元氢化物的三种常用方法是: 元素直接化合:2E + H2(g) → 2 EH 例如,2Li(l) + H2(g) → 2LiH(s) BrØnsted 碱的加合质子:E- + H2O(ag) → EH + OH例如,Li3N(s) + 3 H2O(l) → 3Li(OH) (aq) + NH3(g) 卤化物或拟卤化物与氢化物之间的复分解: E’H + EX → E’X + EH 例如,LiAlH4 + SiCl4 → LiAlCl4 + SiH4
(kJ•mol–1)
H2O和D2O之间沸点的差异反映了O· · —O 氢 ·H 键不如 O··· D—O氢键强。相同化学环境下键焓高于 键焓的现象在很大程度上是由零点能(指量子在绝对 温度的零点下仍会保持震动的能量 )的差别引起的。 零点能低时键焓相对比较高,零点能高时键焓相对比 较低。氢同位素造成的性质差别大得足以找到某些实 际应用。例如,由于D2O中D–O键的键焓相对比较高 ,电解速率应当低,其结果是在电解水而得到的残液 中得以富集。 利用重水与水的差别,富集重水,再以任一种从 水中制 H2 的方法从 D2O 中获得 D。 慢中子轰击锂产生T:
【思考】潜在储氢材料——化合物 A 是第二周期两种氢化物形成 的路易斯酸碱对,是乙烷的等电子体,相对分子质量30.87,常温 下为白色晶体,稳定而无毒。刚刚融化的 A 缓慢释放氢气,转变 为化合物B(乙烯的等电子体)。B 不稳定,易聚合成聚合物 C (聚乙烯的等电子体)。C 在155oC释放氢气转变为聚乙炔的等电 子体,其中聚合度为3的化合物 D 是苯的等电子体。高于500oC时 D 释放氢气,转变为化合物 E,E 有多种晶型。 (1)写出 A、B、C、D、E 的化学式。
有机化学第24章 氢和稀有气体

第 24 章 氢和稀有气体
主要内容
11
氢
2
稀有气体
2
33
主族元素总结
通常列于碱金属 IA 族顶端 H 氢
稀有气体
He,Ne,Ar,Kr,Xe,Kr 氦、氖、氩、氪、氙 、氡
氢H
大气中少量的氢气,H2O,及其他无机化 合物和有机化合物中化合态的氢
氢存在于地球、太阳及木星等天体上,是 最丰富的元素
Pt 在任何条件下都不能形成氢化物,但 氢可在 Pt 表面上形成化学吸附氢化物,从 而使 Pt 在加氢反应中有广泛的催化作用。
24-2 稀有气体
24-2-1 稀有气体的性质和用途
1 稀有气体的性质
稀有气体是单原子分子,其核外电子层 都有相对饱和的结构,除氦有 2 个电子外, 其余最外层皆有 8 个电子。
它们的蒸发热和在水中的溶解度都 很小,随着原子序数的增加而逐渐升高。
氦是所有气体中最难液化的。
温度在 2.2 K 以下的液氦具有许多反 常的性质,例如超导性、低粘滞性等。氦 不能在常压下固化,这也是一种特性。
所有氡的同位素都有放射性。
2 稀有气体的用途
为反应提供惰性环境。如:在冶炼金 属钛的过程中,要用氩气或氦气作保护气。
(2) 氢桥配位键
在特殊的情况,氢也可以作桥联配体,形 成氢桥配位键,如下图所示的 [Cr2H(CO)10]- 配阴离子中就有桥氢配体。
CO CO
- CO CO
OC Cr
H Cr CO
OC CO
OC CO
(3) 金属型氢化物
氢原子可以填充
3 共用电子对 —— 共价键的形成
在大多数含氢化合物中,H 原子都与其它 元素的原子共用一对电子,或者说形成一个共 价键。
主要内容
11
氢
2
稀有气体
2
33
主族元素总结
通常列于碱金属 IA 族顶端 H 氢
稀有气体
He,Ne,Ar,Kr,Xe,Kr 氦、氖、氩、氪、氙 、氡
氢H
大气中少量的氢气,H2O,及其他无机化 合物和有机化合物中化合态的氢
氢存在于地球、太阳及木星等天体上,是 最丰富的元素
Pt 在任何条件下都不能形成氢化物,但 氢可在 Pt 表面上形成化学吸附氢化物,从 而使 Pt 在加氢反应中有广泛的催化作用。
24-2 稀有气体
24-2-1 稀有气体的性质和用途
1 稀有气体的性质
稀有气体是单原子分子,其核外电子层 都有相对饱和的结构,除氦有 2 个电子外, 其余最外层皆有 8 个电子。
它们的蒸发热和在水中的溶解度都 很小,随着原子序数的增加而逐渐升高。
氦是所有气体中最难液化的。
温度在 2.2 K 以下的液氦具有许多反 常的性质,例如超导性、低粘滞性等。氦 不能在常压下固化,这也是一种特性。
所有氡的同位素都有放射性。
2 稀有气体的用途
为反应提供惰性环境。如:在冶炼金 属钛的过程中,要用氩气或氦气作保护气。
(2) 氢桥配位键
在特殊的情况,氢也可以作桥联配体,形 成氢桥配位键,如下图所示的 [Cr2H(CO)10]- 配阴离子中就有桥氢配体。
CO CO
- CO CO
OC Cr
H Cr CO
OC CO
OC CO
(3) 金属型氢化物
氢原子可以填充
3 共用电子对 —— 共价键的形成
在大多数含氢化合物中,H 原子都与其它 元素的原子共用一对电子,或者说形成一个共 价键。
第10章:卤素

第十章:氢、稀有气体、卤素
第一节 氢
氢的性质 H原子只有一个电子(1s1),是所有元素中最
简单、最小和最轻的。 氢有三种同位素: 氕占99.98%,氘,符号为D ,占0.016%,
氚,符号为T,它的含量甚微。
氢气物理性质 是无色、无臭、无味的气体,易燃。常压下, 当空气中氢气的体积分数在4%~74%之间, 一经点燃,立即爆炸。这个浓度范围叫做氢 的爆炸极限。 氢气的临界温度为-240℃,很难液化。
氯和溴盐:大量 在海水中 NaCl、 NaBr
I:智利硝石
(NaIO3)和 富集于海带、
海藻中
At为放射性元素,其中寿命最长的同位素210At的半 衰期为8.3小时。主要由人工合成。
42He + 20983Bi →21185At + 2 10n
二、成键特征
1.形成-1氧化数的离子或共价化合物:
X(ns2np5) 夺取一个电子
合理摄取人体必需元素
补充必需元素的途径——龋齿与含氟牙膏
合理摄取人体必需元素
补充必需元素的途径——龋齿与含氟牙膏
成人每天需摄入钙约O.7g,需摄入磷约1.4g。钙离子和磷酸根进人人体
后,形成不同形式钙的磷酸盐,其中以羟基磷酸钙[Ca (PO ) OH]最稳定。人 5 43
体内99%以上的钙和85%左右的磷以羟基磷酸钙的形式存在于骨骼和牙齿中。
★形成非极性共价键 如单质 X 2
★形成离子键
与活泼金属化合时,如NaCl, KBr
★形成极性共价键 与非金属化合时,如HCl, HBr
★形成配位键
配合物中作配体[ AgCl2 ] ,[FeF6 ]3
性质变化规律性:
F Cl Br I
单单第水电表 物 颜 熔 沸质质一合负态 色 点 点11(//颜熔电热性-2KK19色沸离(逐8K性卤,逐点势负渐1素0在 原 第 卤渐逐逐值变1的.3质子 一同 素加渐渐)小一kP些a深增变逐半 电一 的F电)性性大小渐子径 离周 特质质变亲期性最能的小合气 淡 58小最中。特34势体 黄 ..氟38殊、大,色36:F性(电卤稀反:素负气 黄 12有常73体 绿 23F有性氯.较气色4 C最四小l体大最除C依l:、液 红 23外63次体 棕 51非溴..B)色88变r。B金r小I由属此性固 紫 3485决体 黑 67最..碘色54定强I 了、
第一节 氢
氢的性质 H原子只有一个电子(1s1),是所有元素中最
简单、最小和最轻的。 氢有三种同位素: 氕占99.98%,氘,符号为D ,占0.016%,
氚,符号为T,它的含量甚微。
氢气物理性质 是无色、无臭、无味的气体,易燃。常压下, 当空气中氢气的体积分数在4%~74%之间, 一经点燃,立即爆炸。这个浓度范围叫做氢 的爆炸极限。 氢气的临界温度为-240℃,很难液化。
氯和溴盐:大量 在海水中 NaCl、 NaBr
I:智利硝石
(NaIO3)和 富集于海带、
海藻中
At为放射性元素,其中寿命最长的同位素210At的半 衰期为8.3小时。主要由人工合成。
42He + 20983Bi →21185At + 2 10n
二、成键特征
1.形成-1氧化数的离子或共价化合物:
X(ns2np5) 夺取一个电子
合理摄取人体必需元素
补充必需元素的途径——龋齿与含氟牙膏
合理摄取人体必需元素
补充必需元素的途径——龋齿与含氟牙膏
成人每天需摄入钙约O.7g,需摄入磷约1.4g。钙离子和磷酸根进人人体
后,形成不同形式钙的磷酸盐,其中以羟基磷酸钙[Ca (PO ) OH]最稳定。人 5 43
体内99%以上的钙和85%左右的磷以羟基磷酸钙的形式存在于骨骼和牙齿中。
★形成非极性共价键 如单质 X 2
★形成离子键
与活泼金属化合时,如NaCl, KBr
★形成极性共价键 与非金属化合时,如HCl, HBr
★形成配位键
配合物中作配体[ AgCl2 ] ,[FeF6 ]3
性质变化规律性:
F Cl Br I
单单第水电表 物 颜 熔 沸质质一合负态 色 点 点11(//颜熔电热性-2KK19色沸离(逐8K性卤,逐点势负渐1素0在 原 第 卤渐逐逐值变1的.3质子 一同 素加渐渐)小一kP些a深增变逐半 电一 的F电)性性大小渐子径 离周 特质质变亲期性最能的小合气 淡 58小最中。特34势体 黄 ..氟38殊、大,色36:F性(电卤稀反:素负气 黄 12有常73体 绿 23F有性氯.较气色4 C最四小l体大最除C依l:、液 红 23外63次体 棕 51非溴..B)色88变r。B金r小I由属此性固 紫 3485决体 黑 67最..碘色54定强I 了、
氢-稀有气体专业知识

D
分之一,主要是核衰变旳产物。
3
二、氢旳物理性质
• 氢是密度最小旳无色无味旳气体 • 扩散速度快,因而具有很高旳导热性 • 微溶于水(一体积水在273K时溶解0.02体积氢) • 沸点低,是20.4K,液态氢能够把除氦以外旳
全部气体冷却为固体 • 易被钯、铂、镍等金属吸收,其中钯旳吸氢能
力最强,室温下一体积旳粉末状钯可吸收900 体积旳氢。所以这些金属是有有关氢反应旳优 良催化剂。
As价电子数:5
AsO43-
其他原子提供旳单键电子数:0(氧原子与 中心原子是以双键结合)
负电荷数:3
所以As旳价电子对数 = (5 + 3)÷2 =4
2、根据价电子对数拟定价电子对电子构型
如出现奇数电子时,将此电子也看成电子对来看待。
AsO43-旳电子对构型是四面体,因为配位原子数 (氧)也是4,所以它旳分子构型也是四面体 15
才开始制得成功,是巴特
列在发觉O2和六氟化铂能 发生反应旳试验事实后受
到启发。
因为O2旳第一电离能(1175.7kJ·mol-1)
和氙旳第一电离能(1171.5kJ·mol-1) 非常接近,于是想到用氙替代氧可能
Xe+PtF6=Xe+[PtF6]-
会发生一样旳反应。成果它成功了。
一、氟化物
氙和氟在密
第九章 氢 希有气体
本章简介氢和希有气体单质 和主要化合物旳性质,制备 和用途。经过希有气体旳构 造简介价层电子对互斥理论。
1
教学要求
1、掌握氢旳物理和化学性质。 2、一般地了解希有气体旳发展简史,
单质旳性质,用途和从空气中分 离它们旳措施。 3、了解希有气体化合物旳性质和构 造特点。 4、掌握价层电子对互斥理论旳基本 内容及其应用。
无机化学教学课件 18章 氢和稀有气体

第18章 氢和稀有气体
Chapter 18 Hydrogen and Rare
Gases
2020/4/24
氢、稀有气体 在周期表中 的位置
2020/4/24
H
氢是周期表中唯一尚未找到确切位
置的元素.· · · · · ·
2020/4/24
本章教学要求
1.了解氢和稀有气体的特点; 2.了解重点元素的存在、分离、性质和用途; 3. 掌握素氢和稀有气体的单质及氢化合物的性质,
H2(g) + CO(g) 就是水煤气,可做工业燃料,使用时不必分离. 但若为了 制氢,必须分离出CO.
可将水煤气连同水蒸气一起通过红热的氧化铁催化剂,CO变成 CO2 ,然
后在 2×106 下用水洗涤 CO2 和 H2 的混合气体,使 CO2溶于水而分离出 H2 .
2020/4/24
CO + H2 + H2O(g)
(1) p
Protium 氕
p+n
Deuterium 氘
p+2n
Tritium 氚
2020/4/24
(2) 存在:丰度:H(99.985%)、D(0.015%)、T(1015%)
原子个数比,H : D = 6800 : 1 H : T = 1010 : 1
(3) 制备:
Tritium是半衰期(half-life)为12.6年的β放射性衰变体。 通常只有核反
18-1-2 氢气的性质与制备 Hydric Properties and Preparation
1. 氢的同位素
1931年底美国哥伦比亚大学的尤里(Urey)教授和他的助手,发现了质 量数为2的重氢,称为氘。后来英、美科学家又发现了质量数为3的氚。氘的 发现是科学界在本世纪三十年代初的一件大事。尤里因该成果,获得1934年 的Nobel化学奖。它们的物理性质见表18—2,主要特征总结如下:
Chapter 18 Hydrogen and Rare
Gases
2020/4/24
氢、稀有气体 在周期表中 的位置
2020/4/24
H
氢是周期表中唯一尚未找到确切位
置的元素.· · · · · ·
2020/4/24
本章教学要求
1.了解氢和稀有气体的特点; 2.了解重点元素的存在、分离、性质和用途; 3. 掌握素氢和稀有气体的单质及氢化合物的性质,
H2(g) + CO(g) 就是水煤气,可做工业燃料,使用时不必分离. 但若为了 制氢,必须分离出CO.
可将水煤气连同水蒸气一起通过红热的氧化铁催化剂,CO变成 CO2 ,然
后在 2×106 下用水洗涤 CO2 和 H2 的混合气体,使 CO2溶于水而分离出 H2 .
2020/4/24
CO + H2 + H2O(g)
(1) p
Protium 氕
p+n
Deuterium 氘
p+2n
Tritium 氚
2020/4/24
(2) 存在:丰度:H(99.985%)、D(0.015%)、T(1015%)
原子个数比,H : D = 6800 : 1 H : T = 1010 : 1
(3) 制备:
Tritium是半衰期(half-life)为12.6年的β放射性衰变体。 通常只有核反
18-1-2 氢气的性质与制备 Hydric Properties and Preparation
1. 氢的同位素
1931年底美国哥伦比亚大学的尤里(Urey)教授和他的助手,发现了质 量数为2的重氢,称为氘。后来英、美科学家又发现了质量数为3的氚。氘的 发现是科学界在本世纪三十年代初的一件大事。尤里因该成果,获得1934年 的Nobel化学奖。它们的物理性质见表18—2,主要特征总结如下:
高中化学奥赛辅导-----无机化学9元素概论 氢、稀有气体

3、导电性和超导性 主族元素单质的导电性差别较大,从左至右,一般 由导体至半导体再到非导体变化。主族金属单质均为导体 ,主族非金属单质一般不导电,位于 P 区对角线上的一些 单质如Si、Ge、 Sb、 Se 、 Te 等单质具有半导体性质,其中 Si 和 Ge 是 最好的半导体材料。 过渡元素单质均为导体。 金属元素中有很多在一定温度下均具有超导性。
应用范围:用以制备以负氧化值存在的非金属单质。
5、电解法 原理:使用外力直流电源将元素还原为单质。 举例: 电解 2NaCl+2H2O 2NaOH+H2↑+Cl2↑
电解
2Al2O3(熔体)
Na3 AlF6 , 96应用范围:制取活泼金属和活泼非金属单质。
二、氢化物 几乎能和除稀有气体外的所有元素结合,形成不同类 型的二元化合物,这就是广义的氢化物定义。严格讲,氢 化物是指H-的化合物,而非金属氧化物则称“某化氢”。 (如HF、HCl、H2S等)。 氢化物按其结构和性质的不同可大至分为三种类型: 离子型、共价型和金属型。某种元素属哪种类型,与元素 的电负性和周期表中位置有关。
基本要求:了解单质的性质和制备方法;氢化物 的类型、结构和特性;氢的化合物的性质。
2、热分解法 原理:某些化合物热稳定性低的特点,制取单质。 300 o C 举例:2Ag2O(s) 4Ag(s)+O2(g) 应用范围:(1)应用于制取活泼性差的金属单质; (2)制取一些高纯单质,如Ni、Zr等。
3、还原法
原理:用还原剂还原化合物(如氧化物等)来制取 单质,一般常用的还原剂是焦炭,CO、H2、活泼金属等。 举例: 高炉炼铁: Fe2O3+3CO 2Fe+3CO2 铝热剂法: Fe2O3+2Al 2Fe+Al2O3 电炉法制黄磷: 2Ca3(PO4)2+10C+6SiO2
无机化学第五章氢和稀有气体

些领域的应用前景值得期待。例如,利用稀有气体化合物进行化学合成、
制备新材料等。
04
氢和稀有气体的关系与比较
原子结构与电子排布
原子结构
氢和稀有气体原子的原子核都只有一个质子,但它们的电子 排布不同。氢原子只有一个电子,而稀有气体原子的电子排 布遵循一定的规律,最外层电子数均为8个。
电子排布
氢原子的电子排布为1s1,而稀有气体原子的电子排布遵循洪特 规则和泡利原理,最外层电子数为8个。
化学键合与分子结构
化学键合
氢原子可以与其他元素形成共价键, 形成氢化物。而稀有气体原子因其最 外层电子数为8个,不易与其他元素 形成化学键,表现出惰性。
分子结构
氢化物分子中,氢原子通常与非金属 元素形成共价键,形成分子。而稀有 气体元素通常以单原子分子形式存在 。
物理和化学性质的比较
物理性质
氢气是一种无色、无味的气体,密度较小,易燃易爆。稀有气体元素通常以单 原子分子形式存在,在常温常压下为气态,不易与其他物质发生反应。
稀有气体在高科技领域的应用
随着科技的发展,稀有气体在电子、光学、医疗等领域的应用将更加广泛,需要深入研究 其特性和应用技术。
跨学科合作与交流
无机化学的发展需要与其他学科进行合作与交流,共同推动氢和稀有气体领域的发展。
THANKS
感谢观看
氢可以与碳结合形成大量的有机化 合物,如烷烃、烯烃、炔烃等。
03
稀有气体的概述
稀有气体的物理性质
稀有气体单质的颜色
稀有气体单质在常温常压下均为气体,且在可见光区不吸收光, 因此呈现为无色。
稀有气体单质的熔沸点
由于稀有气体原子间的作用力很弱,因此它们的熔点和沸点都很低, 常温下常见氧化态为+1,但 在某些条件下也可以表现 出-1的氧化态。
第13章氢和稀有气体

制备方法
• • • • • • • • • 实验室方法 化学法、电解法 工业生产方法 用碳来还原水蒸气制取氢气 用烃类裂解的方法制取氢 水蒸气转换法 烷烃制取烯烃反应的副产物 盐型氢化物与水反应 利用硅与碱反应
3. 氢化物
(1) 离子型(类盐型)氢化物
形成
2M + H2 → 2MH (M代表碱金属)
(a)纯的为白色晶体, 不纯的为浅灰色至黑色 (b)具有离子化合物特征, 如熔、沸点较高, 熔融时能导电 (c)受热时能分解为氢气和游离金属 (d)与水反应产生氢气
MH + H2O → MOH + H2↑
性质
1. 离子型(类盐型)氢化物
(a)纯的为白色晶体, 不纯的为浅灰色至黑色 -能在非水溶剂中与B3+、Al3+、Ga3+等 H (b)具有离子化合物特征, 结合成复合氢化物 如熔、沸点较高, 熔融时能导电
(3)金属型氢化物
(a) 在过渡型氢化物中, 氢以三种形式存在
氢以原子状态存在于金属晶格中 氢的价电子进入氢化物导带, 氢以H+形式存在 氢从氢化物导带中得一个电子, 以H-形式存在
(b) 某些过渡金属和合金具有吸收和释放 氢气的作用 2Pd + H 2PdH 2 某些过渡金属或过渡金属合金可做储氢材料
第13章 氢和稀有气体
13.1
氢Leabharlann 13.1.1 氢的存在和物理性质
13.1.2 氢的化学性质和氢化物
13.1.1 氢的存在和物理性质 • 1766年,英国物理学家和化学家卡文 迪什用六种相似的反应制出了氢气, 这些反应包括锌、铁、锡分别与盐酸 或稀硫酸反应。但由于他是燃素学说 的忠实信徒,而不认为这是一种新的 气体。 • 1787年,杰出的化学家拉瓦锡首次明 确指出水是氢和氧的化合物,氢是一 种元素,并把它命名为Hydrogen。
第2章稀有气体

它能与水强烈作用放出氢气, H-十H2O=H2十OH所以在水溶液中,无水合H-离子存在。
(1)氢
3.独特形式的键合
• 单电子共价键:氢分子离子H2---- [H.H]+;
在缺电子化合物或过渡金属氢化配合物 • 氢桥键:
sp3
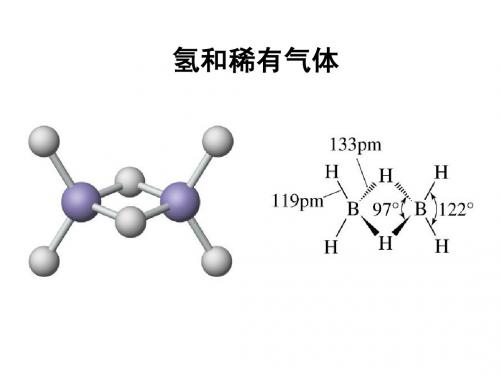
如硼烷
3C-2e
• 电子对键: 通过共用电子对形成 稳定的He原子的ls2构型; • 氢键
氦之外的稀有气体的供应)
二、稀有气体元素的化合物
稀有气体的包合物:
包合物:大分子(主体分子)包容着小分子(客体分子),
靠分子间力结合;
稀有气体的水包合物: —稀有气体分子填充在水的氢键骨架之中; 稀有气体的氢醌包合物: —稀有气体分子填充在氢醌组合形成的骨架中;
复合氟化物: —开创了稀有气体化合物的合成
在有机合成中有很好的应用??。
这种氢化物又称为配合氢化物,形成这类氢化 物的结构基础是BH3和AlH3; • BH3和AlH3接受H-的电子对,形成MH4- 再与碱金属离子形成离子型盐; 代表性物质:LiAlH4、KBH4
• 状态:常温下,H2、F2、C12等又都是气态
(2)氢的反应
1.同非金属反应:
• 表现为比较大的“惰性”: 离解能4.2 kcal/mole; Cl2:57.2 kcal/mole; O2:117 Kcal/mole(双键);
• 与卤素: 光照时剧烈爆炸,自由基反应机理; • 与氧气: 燃烧,可以达到3000 ºC的高温; • 与S和Se: 在较高的温度下反应,
F2 hv 2F F Xe XeF XeF F XeF2 XeF XeF XeF2 +Xe
光化学反应的特点: a.特定的吸收光波长; b.自由基反应机理; c.特定的温度(不能超过195K)。
(1)氢
3.独特形式的键合
• 单电子共价键:氢分子离子H2---- [H.H]+;
在缺电子化合物或过渡金属氢化配合物 • 氢桥键:
sp3
如硼烷
3C-2e
• 电子对键: 通过共用电子对形成 稳定的He原子的ls2构型; • 氢键
氦之外的稀有气体的供应)
二、稀有气体元素的化合物
稀有气体的包合物:
包合物:大分子(主体分子)包容着小分子(客体分子),
靠分子间力结合;
稀有气体的水包合物: —稀有气体分子填充在水的氢键骨架之中; 稀有气体的氢醌包合物: —稀有气体分子填充在氢醌组合形成的骨架中;
复合氟化物: —开创了稀有气体化合物的合成
在有机合成中有很好的应用??。
这种氢化物又称为配合氢化物,形成这类氢化 物的结构基础是BH3和AlH3; • BH3和AlH3接受H-的电子对,形成MH4- 再与碱金属离子形成离子型盐; 代表性物质:LiAlH4、KBH4
• 状态:常温下,H2、F2、C12等又都是气态
(2)氢的反应
1.同非金属反应:
• 表现为比较大的“惰性”: 离解能4.2 kcal/mole; Cl2:57.2 kcal/mole; O2:117 Kcal/mole(双键);
• 与卤素: 光照时剧烈爆炸,自由基反应机理; • 与氧气: 燃烧,可以达到3000 ºC的高温; • 与S和Se: 在较高的温度下反应,
F2 hv 2F F Xe XeF XeF F XeF2 XeF XeF XeF2 +Xe
光化学反应的特点: a.特定的吸收光波长; b.自由基反应机理; c.特定的温度(不能超过195K)。
无机化学课件氢和稀有气体

非整比:LaH2.87、VH0.56等 b.物理性质: 具有金属外观特征,有光泽,能 导电。加热 H 原子逸出可得高纯 H2。 (1) 大部分是用单质直接化合的方法制备
(2) 都有金属的电传导性和显有其他金属性质
(3) 过渡金属吸氢后往往发生晶格膨胀,产物 的密度比母体金属的大
b.物理性质: (4) 成键理论 ➢氢以原子状态存在于金属晶格中 ➢以H+存在于氢化物中,氢将电子供入化合物的导 带中。 ➢氢以H-形式存在,每个氢原子从导带取得1个电 子。
➢ H-存在的重要化学证据:电解其与碱金属的熔 融物,阳极放 H2: 2 H- →H2 + 2e-
➢ 与水反应的实质是: H- + H2O → OH- + H2 此 时 H- 表现出强还原性、不稳定性和强碱性。
b. 化学性质
氢化物
还原性强
E (H2/H ) 2.23V
2 LiH TiO2 Ti 2 LiOH 4 NaH TiCl4 Ti 4 NaCl 2 H2
(2~3) × 105Pa
LaNi5 + 3 H2 微热 LaNi5H6,
含H2量大于同体积液氢
18. 2 稀有气体
稀有气体包括氦、氖、氩、氪、 氙、氡6种元素,
基态的价电子构型除氦的 ns2 以为, 其余均为 ns2np6 。
历史的回顾:1894~1900年间被陆续发现 1.1962年前,确信它们的性质不活泼,叫它们
氢气的制备
CH4 + H2O cat,T,p CO + 3H2 ↑
C3H8 +3 H2O cat,T,p 3CO + 3H2 ↑
(d)甲烷催化分解或水蒸气转化:
CH4 cat,~1273K C + 2H2 ↑
(2) 都有金属的电传导性和显有其他金属性质
(3) 过渡金属吸氢后往往发生晶格膨胀,产物 的密度比母体金属的大
b.物理性质: (4) 成键理论 ➢氢以原子状态存在于金属晶格中 ➢以H+存在于氢化物中,氢将电子供入化合物的导 带中。 ➢氢以H-形式存在,每个氢原子从导带取得1个电 子。
➢ H-存在的重要化学证据:电解其与碱金属的熔 融物,阳极放 H2: 2 H- →H2 + 2e-
➢ 与水反应的实质是: H- + H2O → OH- + H2 此 时 H- 表现出强还原性、不稳定性和强碱性。
b. 化学性质
氢化物
还原性强
E (H2/H ) 2.23V
2 LiH TiO2 Ti 2 LiOH 4 NaH TiCl4 Ti 4 NaCl 2 H2
(2~3) × 105Pa
LaNi5 + 3 H2 微热 LaNi5H6,
含H2量大于同体积液氢
18. 2 稀有气体
稀有气体包括氦、氖、氩、氪、 氙、氡6种元素,
基态的价电子构型除氦的 ns2 以为, 其余均为 ns2np6 。
历史的回顾:1894~1900年间被陆续发现 1.1962年前,确信它们的性质不活泼,叫它们
氢气的制备
CH4 + H2O cat,T,p CO + 3H2 ↑
C3H8 +3 H2O cat,T,p 3CO + 3H2 ↑
(d)甲烷催化分解或水蒸气转化:
CH4 cat,~1273K C + 2H2 ↑
氢和稀有气体

制作氢气 20 升,纯度为 99.9%。
● 生物分解水制氢
生物体分解水不需要电和高温,科学家们试图
修改光合作用旳过程来完毕这一技术。小规模旳试
验已成功。
可
见
● 从海水中制氢 光
Fe(Ⅱ ),Fe(Ⅲ) 电解质溶液
硒镍 化 镉 半 导 体箔
H2(g)
海水
原理:当可见光照射在半导体膜上时,电子被激
发进入导带而留下空穴(低能级旳电子空间)。在导带中 电子移动到金属薄膜与海水之间表面上,水即被还原产 生H2。同步,空穴迁移到半导体与电解质间旳表面,来 自Fe2+旳电子填充空穴。(美国Michigan州立大学H. Ti
RbH(s) SrH2(s) –30.0 –141.0
SnH4(g) +188.3
SbH3(g) +147.8
H2Te (g) >0
HI (g) +1.7
CsH(s) BaH2(s) –32.0 –140.0
量As
SO2 锌还原 H2SO4 产生
H2S + Pb2+ + 2H2O →PbS + 2H3O+ AsH3+3Ag2SO4+3H2O→
6Ag+H3AsO3+3H2SO4
SO2 + 2KOH → K2SO3 + H2O
工业制造措施
industrial preparation methods
水蒸气转化法 CH4(g) + H2O(g) 1 273 K 3 H2(g) + CO(g)
大气层顶 云层顶 液氢 液态金属氢
岩石关键
2. 制备 (每年估计达500×109m3)
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
为了制氢,必须分离出CO。可将水煤气连同水蒸
气一起通过红热的氧化铁催化剂,CO变成 CO2 ,然后 在 2×106 下用水洗涤 CO2 和 H2 的混合气体,使 CO2 溶于水而分离出 H2 。
CO + H2 + H2O(g)
Fe2O3 > 723 K
CO2 + 2 H2
工业制备方法
电解 20% NaOH或 15% KOH水溶液,耗能大,效 率也只有 32%
氢的制备(每年估计达500×109m3 )
N2
H2
NaH
H2
H2
CH4 H2O C
1143 K
1273 K
H2
热解 电 解 光解
H2
H2
H2
实验室制备方法
Zn + H3O+ →Zn2+ + 2H2O + H2 ↑
H2S 锌中含微量 ZnS AsH3 锌和硫酸中含微
量As
SO2 锌还原 H2SO4 产生
氢能源—21世纪的清洁能源
★ 氢燃烧速率快,反应完全。氢能源是清洁能源,没有 环境污染,能保持生态平衡。
★ 目前,已实验成功用氢作动力的汽车,有望不久能投入实 用氢作为航天飞机的燃料已经成为现实,有的航天飞机的液 态氢储罐存有近1800 m3的液态氢。
★ 氢能源研究面临的三大问题:
氢气的发生(降低生产成本)
塞病”,飞船的飞升气体,保护气
Ne 霓红灯,电子工业中的充气介质,低温冷冻剂 Ar 灯泡填充气,保护气
Kr 灯泡填充气,同位素测量 Xe Xe-O2深度麻醉剂,制造高压“人造小太阳” Rn “氡管”用于治疗癌症和中子源
MH H2O MOH H2(g) CaH2 2H2O Ca(OH)2 2H2(g)
氢化钙剧烈水解
• 形成配位氢化物
4LiH AlCl3 无水乙醚Li[AlH4 ] 3LiCl
受潮时强烈水解 +4H2O
LiOH Al(OH) 3 4H2
分子型氢化物
除铝、铋和钋外,第13至第17族元素都形成这类 氢化合物。它们以其分子能够独立存在为特征。
中文名 氕*(音撇) 氘 (音刀) 氚(音川)
英文名称 protium deuterium tritium
表示方法 1H 2H 3H
符号 Байду номын сангаас D T
说明 稳定同位素 稳定同位素 放射性同位素
* 氕这个名称只在个别情况下使用,通常直接叫氢;氘有时又叫“重氢 ”.
氢的存在与制备
存在
氢是宇宙中丰度最高 的元素,在地球上的丰度 排在第15位。 某些矿物( 例 如石油、天然气)和水是氢 的主要资源,大气中 H2 的 含量很低是因为它太轻而 容易脱离地球引力场。
H2S + Pb2+ + 2H2O →PbS + 2H3O+ AsH3+3Ag2SO4+3H2O→
6Ag+H3AsO3+3H2SO4
SO2 + 2KOH → K2SO3 + H2O
工业制备方法
水蒸气转化法 CH4(g) + H2O(g) 1273 K 3 H2(g) + CO(g)
水煤气反应
C (s) + H2O(g) 1273 K H2(g) + CO(g)
(4) 与水反应的实质是: H- +H2O → OH- + H2 此时 H- 表现出强还原性、不稳定性和强碱性.
离子型氢化物的化学性质
• 还原性强 • 钛的冶炼
E (H2/H ) 2.23V
2 LiH TiO2 Ti 2 LiOH
4 NaH TiCl4 Ti 4 NaCl 2 H2 • 剧烈水解
存在形式
● 缺电子氢化物,中心原子
未满8电子构型。
B2H6
● 满电子氢化物,中心原子
价电子全部参与成键。
CH4
● 富电子氢化物,中心原子 成键后有剩余未成键的孤
NH3
电子对.
金属型氢化物
CuH,ZnH2
金属型氢化物
(1) 大部分是用单质直接化合的方法制备。 (2) 都有金属的电传导性和显有其他金属性质如磁性。 (3) 金属 Pt不能形成氢化物,但对加氢反应具有催化作用。
Chapter 11 Hydrogen and Noble Gases
氢和稀有气体
H
氢是周期表中唯一尚未找到 确切位置的元素.· · · · · ·
11.1 氢的同位素
主要同位素有3种,此外还有瞬间即逝的4H 和 5H。
重氢以重水(D2O)的形式存在于天然水中,平均约 占氢原子总数的 0.016%。
4OH- → O2+2H2O + 4e- (阳极) 2H2O +2e- → 2OH- + H2 (阴极) 有文献报道,加热(383~423K)加压(1013~3039 kPa), 效率可提高到 90% 以上。
我国已建成大型制氢设备
equipment
大容量电解槽体
H2
大型制氢站
氢气纯化装置
氢气储罐群
可逆储氢材料
1体积金属Pd 可吸收700 体积 H2,减压或加热可使其分解:
常况
2 Pd + H2
2 PdH
减压,327 K
U + 3/2 H2
523 K 573 K
UH3
LaNi5 + 3 H2
(2~3) × 105Pa
微热
LaNi5H6, 含H2量大于同体积液氢
稀有气体
Noble Gases
存在和用途 化合物
存在和用途
除氦之外, 大气是其他稀有气体元素的唯一资源。有些 地区的天然气中含有高浓度的He(高达8%)。
空气分离中可得 He、Rn外的所有其他稀有气体。He 最难被液化(b. p. 4.2K)。Rn是放射性元素。
稀有气体的主要用途
applications
He 大型反应堆的冷却剂,He-Ne-O2 呼吸气可防 “气
离子型
离子型氢化物
(1) 与s 区金属形成。非挥发性,不导电并具明确结构的 晶形固体。
(2) H-的半径在 126 pm(LiH)与154 pm(CsH) 之间,说明原 子核对核外电子的控制较松弛。
(3) H-存在的重要化学证据:电解其与碱金属的熔融物, 阳极放H2: 2 H- →H2 + 2e-
氢气的储存
氢气的输送(利用)
氢的用途
燃 料 燃烧值/(kJ·kg-1)
氢气
120918
(H2) 戊硼烷
64183
(B5H9) 戊烷
43367
(C5H12)
氢化物
离子型氢化物 分子型氢化物 金属型氢化物
二元氢化物在周期表中的分布
氢的大多数二元化合物可归入下述三大类中的某一 类。但是这种分类的界限也不十分明确,结构类型并非 非此即彼,而是表现出某种连续性。
