新药监测期 期限表
新药保护期、过渡期、行政保护期、专利保护期、监测期、试行期

1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。
这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。
为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。
在如今看,这种光限制自家人的规定,实属汉奸条款。
但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。
还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。
另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。
无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。
2.行政保护期,这是对我国早期专利法的妥协。
中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。
新药监测期期限表
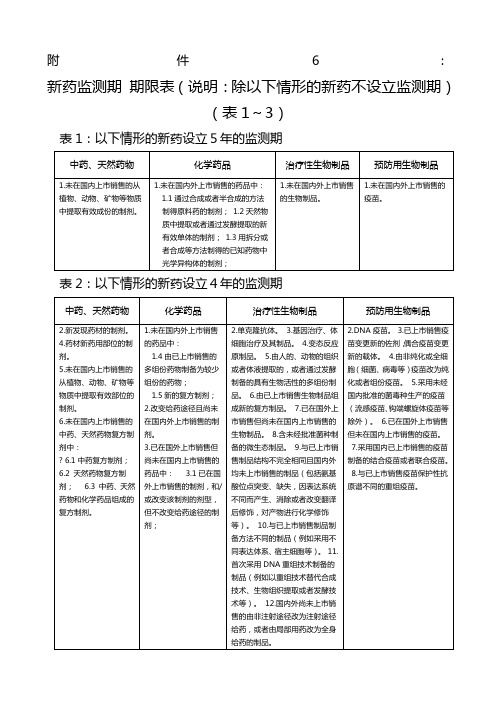
新药监测期期限表(说明:除以下情形的新药不设立监测期)(表1~3)
表1:以下情形的新药设立5年的监测期
中药、天然药物
化学药品
治疗性生物制品
预防用生物制品
1.未在国内上市销售的从植物、动物、矿物等物质中提取有效成份的制剂。
1.未在国内外上市销售的药品中:
1.1通过合成或者半合成的方法制得原料药的制剂;
6.由已上市销售生物制品组成新的复方制品。
7.已在国外上市销售但尚未在国内上市销售的生物制品。
8.含未经批准菌种制备的微生态制品。
9.与已上市销售制品结构不完全相同且国内外均未上市销售的制品(包括氨基酸位点突变、缺失,因表达系统不同而产生、消除或者改变翻译后修饰,对产物进行化学修饰等)。
10.与已上市销售制品制备方法不同的制品(例如采用不同表达体系、宿主细胞等)。
2.改变给药途径且尚未在国内外上市销售的制剂。
3.已在国外上市销售但尚未在国内上市销售的药品中:
3.1已在国外上市销售的制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;
2.单克隆抗体。
3.基因治疗、体细胞治疗及其制品。
4.变态反应原制品。
5.由人的、动物的组织或者体液提取的,或者通过发酵制备的具有生物活性的多组份制品。
11.首次采用DNA重组技术制备的制品(例如以重组技术替代合成技术、生物组织提取或者发酵技术等)。
12.国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的制品。
2.DNA疫苗。
3.已上市销售疫苗变更新的佐剂,偶合疫苗变更新的载体。
4.由非纯化或全细胞(细菌、病毒等)疫苗改为纯化或者组份疫苗。
10.改变灭活剂(方法)或者脱毒剂(方法)的疫苗。
国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(3)

国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(3)文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2003.10.10•【文号】国食药监注[2003]278号•【施行日期】2003.10.10•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文续(2)┎────┬───────┬──┬────────────┬────┬────┬──────┬────┬──────────────┬────┬─────┒┃批准日期│新药名称│注册│保护期、过渡期或监测期│批件编号│药品批准│药品生产企业│新药证书│新药证书持有人│申请日期│受理号┃┃││分类│││文号││编号│││┃┃││││││││││┃┃││├───┬──┬─────┤││││││┃┃│││ 种类│期限│终止期│││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│香菇多糖│ 二│保护期││保护期已过│2003S002│国药准字│金陵药业股份│国药证字│中国科学院上海药物研究所,金│2001-12-│CXS01727┃┃13││││││50│H2003001│有限公司福州│H2003011│陵药业股份有限公司福州梅峰制│10│┃┃│││││││30│梅峰制药厂│9│药厂││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│香菇多糖注射液│ 二│保护期││保护期已过│2003S002│国药准字│金陵药业股份│国药证字│中国科学院上海药物研究所,金│2001-12-│CXS01728┃┃13││││││51│H2003013│有限公司福州│H2003012│陵药业股份有限公司福州梅峰制│10│┃┃│││││││1│梅峰制药厂│0│药厂││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│膦甲酸钠│ 二│保护期││保护期已过│2003S002│国药准字│广东宏远集团│国药证字│南京生命源保健实业有限公司,│2001-12-│CXS01743┃┃13││││││42│H2003012│药业有限公司│H2003012│广东宏远集团药业有限公司│17│┃┃│││││││4││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│膦甲酸钠氯化钠│ 二│保护期││保护期已过│2003S002│国药准字│重庆药友制药│国药证字│南京生命源保健实业有限公司│2001-12-│CXS01744┃┃13│注射液│││││43│H2003012│有限责任公司│H2003011││17│┃┃│││││││5││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│膦甲酸钠氯化钠│ 二│保护期││保护期已过│2003S002│国药准字│重庆药友制药│国药证字│南京生命源保健实业有限公司│2001-12-│CXS01745┃┃13│注射液│││││44│H2003012│有限责任公司│H2003011││17│┃┃│││││││6││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│阿奇霉素葡萄糖│ 四│监测期│不设││2003S002│国药准字│石家庄四药股│国药证字│石家庄四药股份有限公司,成都│2002-1- │CXS2002005┃┃13│注射液│││││26│H2003009│份有限公司│H2003010│欣捷高新技术开发有限公司│28│7┃┃│││││││9││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│阿莫西林克拉维│ 四│保护期│6年│至2007-11-│2003S002│国药准字│哈药集团制药│国药证字│哈药集团制药六厂,哈尔滨恩特│2002-4- │CXS2002030┃┃13│酸钾(7:1)分散││││6│28│H2003010│六厂│H2003010│药业有限责任公司│15│3┃┃│片││││││1││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│阿莫西林克拉维│ 四│过渡期│3年│至2006-2-│2003S002│国药准字│黑龙江乌苏里│国药证字│黑龙江乌苏里江制药有限公司,│2002-4- │CXS2002030┃┃13│酸钾(7:1)颗粒││││12│27│H2003010│江制药有限公│H2003010│哈尔滨恩特药业有限责任公司│15│4┃┃│││││││0│司│5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│咪喹莫特│ 二│过渡期│4年│至2007-2-│2003S002│国药准字│四川明欣药业│国药证字│四川明欣药业有限责任公司│2002-5- │CXS2002040┃┃13│││││12│47│H2003012│有限责任公司│H2003011││16│1┃┃│││││││7││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│咪喹莫特乳膏│ 二│过渡期│4年│至2007-2-│2003S002│国药准字│四川明欣药业│国药证字│四川明欣药业有限责任公司│2002-5- │CXS2002040┃┃13│││││12│48│H2003012│有限责任公司│H2003011││16│2┃┃│││││││8││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│咪喹莫特乳膏│ 二│过渡期│4年│至2007-2-│2003S002│国药准字│四川明欣药业│国药证字│四川明欣药业有限责任公司│2002-5- │CXS2002040┃┃13│││││12│49│H2003012│有限责任公司│H2003011││16│3┃┃│││││││9││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│扎来普隆│ 二│过渡期│4年│至2007-2-│2003S002│国药准字│西南药业股份│国药证字│江苏省药物研究所,西南药业股│2002-7- │CXS2002065┃┃13│││││12│60│H2003013│有限公司│H2003012│份有限公司│18│1┃┃│││││││9││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│扎来普隆胶囊│ 二│过渡期│4年│至2007-2-│2003S002│国药准字│西南药业股份│国药证字│江苏省药物研究所,西南药业股│2002-7- │CXS2002065┃┃13│││││12│61│H2003014│有限公司│H2003012│份有限公司│18│2┃┃│││││││0││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│奥扎格雷钠氯化│ 四│监测期│不设││2003S002│国药准字│长春天诚药业│国药证字│淄博伊奥生物技术开发有限公司│2001-8- │CXS01439┃┃18│钠注射液│││││35│H2003010│有限公司│H2003010││27│┃┃│││││││2││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│尼莫地平注射液│ 四│保护期││保护期已过│2003S002│国药准字│上海信谊金朱│国药证字│上海信谊金朱药业有限公司│2000-8- │CXS00530┃┃19││││││72│H2003015│药业有限公司│H2003013││31│┃┃│││││││1││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│盐酸氨溴索胶囊│ 四│保护期│6年│至2006-4-9│2003S002│国药准字│陕西汉江药业│国药证字│山西省医药研究所,天津市蓝恒│2001-6- │CXS01325┃┃19││││││53│H2003013│股份有限公司│H2003012│医药化工技术研究所,陕西汉江│20│┃┃│││││││3││2│药业股份有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│胞磷胆碱钠氯化│ 四│保护期│6年│至2007-10-│2003S002│国药准字│山东长富洁晶│国药证字│山东长富洁晶药业有限公司│2001-7-5│CXS01344┃┃19│钠注射液││││8│70│H2003014│药业有限公司│H2003013│││┃┃│││││││9││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│醋酸甲地孕酮胶│ 四│保护期││保护期已过│2003S002│----│----│国药证字│北京东方诚成实业有限责任公司│2001-7- │CXS01378┃┃19│囊│││││76│││H2003014││23│┃┃│││││││││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│甲磺酸酚妥拉明│四+ │保护期│6年│至2007-11-│2003S002│国药准字│上海丽珠制药│国药证字│上海市计划生育科学研究所,上│2001-8-6│CXS01398┃┃19│胶囊│五│││6│71│H2003015│有限公司│H2003013│海新顺科技开发有限公司││┃┃│││││││0││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│盐酸班布特罗│ 四│保护期│6年│至2006-12-│2003S002│----│----│国药证字│长沙维神医药科技开发有限公│2001-11-│CXS01621┃┃19│││││14│73│││H2003014│司,湖南维康制药有限公司│12│┃┃│││││││││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│盐酸班布特罗片│ 四│保护期│6年│至2005-6-│2003S002│----│----│国药证字│长沙维神医药科技开发有限公│2001-11-│CXS01622┃┃19│││││21│74│││H2003014│司,西安海欣制药有限公司│12│┃┃│││││││││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│盐酸班布特罗胶│ 四│保护期│6年│至2007-4-9│2003S002│----│----│国药证字│长沙维神医药科技开发有限公│2001-11-│CXS01623┃┃19│囊│││││75│││H2003014│司,湖南维康制药有限公司│12│┃┃│││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│缬沙坦│ 四│保护期│6年│至2006-10-│2003S002│国药准字│南京长澳制药│国药证字│海南正澳制药有限公司│2001-11-│CXS01631┃┃19│││││23│78│H2003015│有限公司│H2003014││14│┃┃│││││││2││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│缬沙坦胶囊│ 四│保护期│6年│至2006-10-│2003S002│国药准字│海南正澳制药│国药证字│海南正澳制药有限公司│2001-11-│CXS01632┃┃19│││││23│79│H2003015│有限公司│H2003014││14│┃┃│││││││3││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│注射用阿奇霉素│ 四│保护期│6年│至2005-6-│2003S002│国药准字│浙江金华康恩│国药证字│浙江康恩贝集团研究开发中心,│2001-11-│CXS01633┃┃19│││││24│39│H2003012│贝生物制药有│H2003011│浙江金华康恩贝生物制药有限公│14│┃┃│││││││1│限公司│1│司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│注射用阿奇霉素│ 四│保护期│6年│至2005-6-│2003S002│国药准字│浙江金华康恩│国药证字│浙江康恩贝集团研究开发中心,│2001-11-│CXS01634┃┃19│││││24│40│H2003012│贝生物制药有│H2003011│浙江金华康恩贝生物制药有限公│14│┃┃│││││││2│限公司│1│司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│盐酸乙哌立松│ 四│保护期│6年│至2007-5-│2003S002│----│----│国药证字│成都市药友科技发展有限公司│2001-11-│CXS01635┃┃19│││││26│45│││H2003011││14│┃┃│││││││││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│盐酸乙哌立松片│ 四│保护期│6年│至2007-5-│2003S002│----│----│国药证字│成都市药友科技发展有限公司│2001-11-│CXS01636┃┃19│││││26│46│││H2003116││14│┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│奥硝唑片│ 四│保护期│6年│至2007-8-6│2003S002│国药准字│四川珍珠制药│国药证字│长沙华美医药研究所,四川珍珠│2002-2-6│CXS2002012┃┃19││││││69│H2003014│有限公司│H2003013│制药有限公司││5┃┃│││││││8││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│那格列奈│ 二│过渡期│4年│至2007-2-│2003S002│国药准字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司│2002-3-6│CXS2002015┃┃19│││││18│62│H2003014│股份有限公司│H2003013│││5┃┃│││││││1││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│那格列奈片│ 二│过渡期│4年│至2007-2-│2003S002│国药准字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司│2002-3-6│CXS2002015┃┃19│││││18│63│H2003014│股份有限公司│H2003013│││6┃┃│││││││2││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│扎来普隆│ 二│过渡期│4年│至2007-2-│2003S002│国药准字│江苏豪森药业│国药证字│江苏豪森药业股份有限公司│2002-3- │CXS2002015┃┃19│││││12│82│H2003015│股份有限公司│H2003014││11│8┃┃│││││││5││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│扎来普隆胶囊│ 二│过渡期│4年│至2007-2-│2003S002│国药准字│江苏豪森药业│国药证字│江苏豪森药业股份有限公司│2002-3- │CXS2002015┃┃19│││││12│83│H2003015│股份有限公司│H2003015││11│9┃┃│││││││6││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│注射用盐酸丁咯│ 四│保护期│6年│至2008-7-│2003S002│国药准字│中国预防医学│国药证字│中国预防医学科学院流行病学微│2002-4- │CXS2002034┃┃19│地尔││││18│81│H2003015│科学院流行病│H2003014│生物学研究所晋城海斯药业有限│27│9┃┃│││││││4│学微生物学研│8│公司,山西省医药研究所││┃┃││││││││究所晋城海斯││││┃┃││││││││药业有限公司││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│加替沙星胶囊│ 一│过渡期│5年│至2008-1-│2003S002│----│----│国药证字│成都恒瑞制药有限公司,连云港│2002-8-7│CXS2002071┃┃19│││││28│80│││H2003014│恒邦医药科技有限公司││5┃┃│││││││││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│青蒿素片│ 四│过渡期│3年│至2006-2-│2003S002│----│----│国药证字│中国中医研究院中药研究所││CXS97302┃┃19│││││18│77│││H2003014│││┃┃│││││││││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│加替沙星│ 一│过渡期│5年│至2008-1-│2003S002│国药试字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司│2002-5- │CXS2002035┃┃20│││││28│36│H2003001│股份有限公司│H2003010││13│9┃┃│││││││4││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│加替沙星氯化钠│ 一│过渡期│5年│至2008-1-│2003S002│国药试字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司│2002-5- │CXS2002036┃┃20│注射液││││28│38│H2003001│股份有限公司│H2003011││13│0┃┃│││││││6││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│加替沙星片│ 一│保护期│12年│至2014-8-6│2003S002│国药试字│江苏豪森药业│国药证字│江苏豪森药业股份有限公司│2002-5- │CXS2002036┃┃20││││││37│H2003001│股份有限公司│H2003010││13│1┃┃│││││││7││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-2-│苦参素氯化钠注│ 四│监测期│不设││2003S002│国药准字│丹东联盛制药│国药证字│丹东联盛制药有限公司│2002-3- │CXS2002023┃┃27│射液│││││98│H2003016│有限公司│H2003015││27│0┃┃│││││││6││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-3-7│氯雷他定分散片│ 四│过渡期│3年│至2006-3-6│2003S003│国药准字│北京双鹭药业│国药证字│北京德众万全药物技术开发有限│2002-1- │CXS2002003┃┃││││││40│H2003020│股份有限公司│H2003018│公司│16│5┃┃│││││││8││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│注射用加替沙星│ 一│过渡期│5年│至2008-1-│2003S002│国药试字│山东罗欣药业│国药证字│山东罗欣药业股份有限公司,安│2003-1-6│X0300012┃┃13│││││28│85│H2003001│股份有限公司│H2003015│徽科宇药物研究所安徽科宇药││┃┃│││││││5││2│物研究所││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│注射用重组人白│ 二│过渡期│4年│至2007-3-│2003S003│国药准字│北京双鹭药业│国药证字│北京双鹭药业股份有限公司│2001-8- │CSS01041┃┃17│介素-11││││16│01│S2003001│股份有限公司│S2003001││27│┃┃│││││││4││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│注射用重组人白│ 二│过渡期│4年│至2007-3-│2003S003│国药准字│北京双鹭药业│国药证字│北京双鹭药业股份有限公司│2001-8- │CSS01042┃┃17│介素-11││││16│02│S2003001│股份有限公司│S2003001││27│┃┃│││││││5││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│匹多莫德│ 四│保护期│6年│至2007-2-4│2003S003│国药准字│天津中津药业│国药证字│天津中津药业股份有限公司│2000-9- │CXS00604┃┃17││││││69│H2003022│股份有限公司│H2003017││25│┃┃│││││││4││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│匹多莫德颗粒│ 四│过渡期│3年│至2006-3-│2003S003│国药准字│天津金世制药│国药证字│天津金世制药有限公司│2000-9- │CXS00605┃┃17│││││16│70│H2003022│有限公司│H2003018││25│┃┃│││││││5││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│烟酸占替诺氯化│ 四│保护期│6年│至2007-6-│2003S003│国药准字│安徽新力药业│国药证字│安徽新力药业股份有限公司│2000-11-│CXS00686┃┃17│钠注射液││││28│64│H2003022│股份有限公司│H2003017││15│┃┃│││││││1│无为分厂│5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│克林霉素磷酸酯│ 四│保护期│6年│至2006-10-│2003S006│国药准字│广西浦北制药│国药证字│沈阳华泰药物研究所│2001-5- │CXS01278┃┃17│氯化钠注射液││││23│64│H2003028│厂│H2003020││31│┃┃│││││││5││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│单硝酸异山梨酯│ 四│保护期│6年│至2007-1-│2003S003│国药准字│济南鲁鹰药业│国药证字│济南百诺医药科技开发有限公│2001-7-5│CXS01348┃┃17│葡萄糖注射液││││21│67│H2003022│有限公司│H2003017│司,济南鲁鹰药业有限公司││┃┃│││││││2││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│美洛昔康│ 四│保护期│6年│至2007-1-│2003S003│----│----│国药证字│江苏恒瑞医药股份有限公司,南│2001-9- │CXS01498┃┃17│││││11│65│││H2003017│京飞马医药科技发展有限责任公│19│┃┃│││││││││6│司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│美洛昔康片│ 四│保护期│6年│至2007-3-│2003S003│----│----│国药证字│江苏恒瑞医药股份有限公司,南│2001-9- │CXS01499┃┃17│││││13│66│││H2003017│京飞马医药科技发展有限责任公│19│┃┃│││││││││7│司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│盐酸莫索尼定│ 二│保护期│8年│至2008-5-│2003S003│----│----│国药证字│上海医药工业研究院,上海雅虎│2002-8- │CXS2002080┃┃17│││││15│17│││H2003015│制药股份有限公司│26│6┃┃│││││││││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│盐酸莫索尼定片│ 二│保护期│8年│至2008-5-│2003S003│----│----│国药证字│上海医药工业研究院,上海雅虎│2002-8- │CXS2002080┃┃17│││││15│18│││H2003015│制药股份有限公司│26│7┃┃│││││││││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│注射用重组人白│ 二│过渡期│4年│至2007-3-│2003S003│国药准字│齐鲁制药厂│国药证字│济南永日制药技术有限公司,山│2002-1- │CSS2002000┃┃18│介素-11││││16│22│S2003001││S2003001│东元隆生物技术有限公司,齐鲁│17│6┃┃│││││││6││1│制药厂││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│注射用重组人白│ 二│过渡期│4年│至2007-3-│2003S003│国药准字│齐鲁制药厂│国药证字│济南永日制药技术有限公司,山│2002-1- │CSS2002000┃┃18│介素-11││││16│23│S2003001││S2003001│东元隆生物技术有限公司,齐鲁│17│7┃┃│││││││7││1│制药厂││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│乳糖酸阿奇霉素│ 四│保护期│6年│至2006-1-│2003S003│国药准字│哈尔滨三联药│国药证字│哈尔滨三联药业有限公司,广州│2002-3- │CXS2002018┃┃18│││││12│20│H2003019│业有限公司│H2003015│白云山医药科技发展有限公司│18│8┃┃│││││││2││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│注射用乳糖酸阿│ 四│保护期│6年│至2006-1-│2003S003│国药准字│哈尔滨三联药│国药证字│哈尔滨三联药业有限公司,广州│2002-3- │CXS2002018┃┃18│奇霉素││││12│21│H2003019│业有限公司│H2003015│白云山医药科技发展有限公司│18│9┃┃│││││││3││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│盐酸伊托必利│ 二│保护期│8年│至2009-3-│2003S003│国药准字│哈药集团制药│国药证字│宁波市天衡制药厂,哈药集团制│2002-5- │CXS2002042┃┃19│││││13│26│H2003019│六厂│H2003015│药六厂│20│1┃┃│││││││4││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│盐酸伊托必利片│ 二│保护期│8年│至2009-3-│2003S003│国药准字│哈药集团制药│国药证字│宁波市天衡制药厂,哈药集团制│2002-5- │CXS2002042┃┃19│││││13│27│H2003019│六厂│H2003015│药六厂│20│2┃┃│││││││5││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│清肝毒胶囊│ 三│过渡期│3年│至2006-3-│2003S003│国药准字│杭州灵丹王药│国药证字│杭州灵丹王药业有限公司│1999-5- │CZS99044┃┃19│││││18│25│Z2003001│业有限公司│Z2003000││19│┃┃│││││││0││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│肌苷氯化钠注射│ 四│保护期│6年│至2008-7-│2003S003│国药准字│丹东联盛制药│国药证字│丹东联盛制药有限公司│2002-1- │CXS2002005┃┃20│液││││23│30│H2003019│有限公司│H2003016││24│4┃┃│││││││6││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│盐酸瑞芬太尼│ 二│过渡期│4年│至2007-3-│2003S003│国药准字│宜昌人福药业│国药证字│宜昌人福药业有限责任公司│2002-7-4│CXS2002057┃┃20│││││19│35│H2003019│有限责任公司│H2003016│││4┃┃│││││││8││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│注射用盐酸瑞芬│ 二│过渡期│4年│至2007-3-│2003S003│国药准字│宜昌人福药业│国药证字│宜昌人福药业有限责任公司│2002-7-4│CXS2002057┃┃20│太尼││││19│34│H2003019│有限责任公司│H2003016│││5┃┃│││││││7││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│注射用盐酸瑞芬│ 二│过渡期│4年│至2007-3-│2003S003│国药准字│宜昌人福药业│国药证字│宜昌人福药业有限责任公司│2002-7-4│CXS2002057┃┃20│太尼││││19│36│H2003019│有限责任公司│H2003016│││6┃┃│││││││9││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│注射用盐酸瑞芬│ 二│过渡期│4年│至2007-3-│2003S003│国药准字│宜昌人福药业│国药证字│宜昌人福药业有限责任公司│2002-7-4│CXS2002057┃┃20│太尼││││19│37│H2003020│有限责任公司│H2003016│││7┃┃│││││││0││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│尿微量白蛋白定││无│││2003S005│----│----│国药证字│卫生部北京老年医学研究所│2000-10-│CSS00084┃┃26│量测定试剂盒( │││││52│││S2003001││11│┃┃│酶联免疫法)││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│人类免疫缺陷病│ 二│无│││2003S005│国药准字│艾康生物技术│国药证字│艾康生物技术(杭州)有限公司│2001-7-5│CSS01028┃┃26│毒(HIV)1/2型抗│││││62│S2003002│(杭州)有限公│S2003001│││┃┃│体诊断试剂(乳││││││5│司│4│││┃┃│胶层析法)│││││││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│重组人红细胞生│ 五│过渡期│3年│至2006-1-│2003S005│国药准字│山东阿华生物│国药证字│山东阿华生物药业有限公司│2002-1- │CSS2002000┃┃26│成素注射液││││29│58│S2003002│药业有限公司│S2003001││16│2┃┃│││││││1││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│重组人红细胞生│ 五│过渡期│3年│至2006-1-│2003S005│国药准字│山东阿华生物│国药证字│山东阿华生物药业有限公司│2002-1- │CSS2002000┃┃26│成素注射液││││29│59│S2003002│药业有限公司│S2003001││16│3┃┃│││││││2││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│重组人红细胞生│ 五│过渡期│3年│至2006-1-│2003S005│国药准字│山东阿华生物│国药证字│山东阿华生物药业有限公司│2002-1- │CSS2002000┃┃26│成素注射液││││29│60│S2003002│药业有限公司│S2003001││16│4┃┃│││││││3││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│重组人红细胞生│ 五│过渡期│3年│至2006-1-│2003S005│国药准字│山东阿华生物│国药证字│山东阿华生物药业有限公司│2002-1- │CSS2002000┃┃26│成素注射液││││29│61│S2003002│药业有限公司│S2003001││16│5┃┃│││││││4││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│苦参碱葡萄糖注│ 四│监测期│不设││2003S005│国药准字│汕头市亚联药│国药证字│汕头市亚联药业有限公司│2000-10-│CXS00666┃┃26│射液│││││23│H2003025│业有限公司│H2003019││25│┃┃│││││││6││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│苦参碱葡萄糖注│ 四│监测期│不设││2003S005│国药准字│汕头市亚联药│国药证字│汕头市亚联药业有限公司│2000-10-│CXS00667┃┃26│射液│││││24│H2003025│业有限公司│H2003019││25│┃┃│││││││7││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│苦参碱葡萄糖注│ 四│监测期│不设││2003S003│国药准字│江苏正大天晴│国药证字│连云港正大天晴制药有限公司│2000-11-│CXS00687┃┃26│射液│││││44│H2003021│药业股份有限│H2003016││20│┃┃│││││││0│公司│4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│肌苷氯化钠注射│ 四│保护期│6年│至2008-7-│2003S006│国药准字│上海长征富民│国药证字│安徽科宇药物研究所,上海长征│2001-11-│CXS01607┃┃26│液││││23│63│H2003028│药业有限公司│H2003020│富民药业有限公司│7│┃┃│││││││4││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-3-│硫酸西索米星氯│ 四│保护期│6年│至2008-7-│2003S005│国药准字│安徽双鹤药业│国药证字│南京曌元医药制品有限公司,安│2001-11-│CXS01619┃。
关于发布新药监测期期限的通知关于发布新药监测期期限的通知
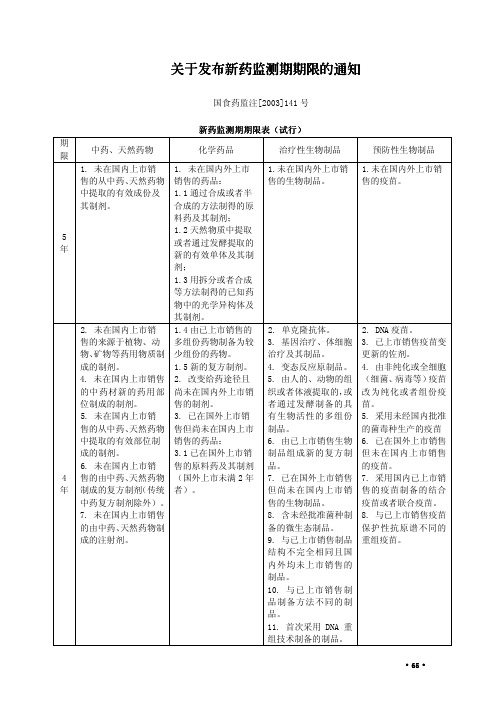
6. 未在国内上市销售 售但尚未在国内上市 制品的剂型但不改变 销售疫苗的剂型,但不
的由中药、天然药物制 销售的原料药(其制剂 给药途径的生物制品。 改变给药途径的疫苗。
成的复方制剂(传统中 已在国内上市销售)。
13. 改变免疫剂量或
不 设
药复方制剂)。
5. 改变国内已上市销
9. 改变国内已上市销 售药品的剂型,但不改
制剂。
(国外上市超过 2 年
细胞基质生产的疫苗。
9. 改变国内已上市 者)。
10. 改变灭活剂(方
销售药品剂型的制剂 3.2 已在国外上市销
法)或者脱毒剂(方法)
(工艺有质的改变者)。 售的复方制剂。
的疫苗。
10. 改变国内已上市 3.3 改变给药途径并
11. 改变给药途径的
销售药品工艺的制剂 已在国外上市销售的
位制成的制剂。
售的制剂。
者通过发酵制备的具 苗。
5. 未在国内上市销 3. 已在国外上市销 有生物活性的多组份 5. 采用未经国内批准
售的从中药、天然药物 售但尚未在国内上市 制品。
的菌毒种生产的疫苗
中提取的有效部位制 销售的药品:
6. 由已上市销售生物 6. 已在国外上市销售
成的制剂。 6. 未在国内上市销
65656565关于发布新药监测期期限的通知关于发布新药监测期期限的通知关于发布新药监测期期限的通知关于发布新药监测期期限的通知国食药监注2003141号新药监测期期限表新药监测期期限表新药监测期期限表新药监测期期限表试行试行试行试行期限中药天然药物化学药品治疗性生物制品预防性生物制品5年1
关于发布新药监测期期限的通知
物、矿物等药用物质制 少组份的药物。
治疗及其制品。
国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(2)

国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(2)文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2003.10.10•【文号】国食药监注[2003]278号•【施行日期】2003.10.10•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文续(1)┎────┬───────┬──┬────────────┬────┬────┬──────┬────┬──────────────┬────┬─────┒┃批准日期│新药名称│注册│保护期、过渡期或监测期│批件编号│药品批准│药品生产企业│新药证书│新药证书持有人│申请日期│受理号┃┃││分类│││文号││编号│││┃┃││││││││││┃┃││├───┬──┬─────┤││││││┃┃│││ 种类│期限│终止期│││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│卡维地洛│ 二│保护期│8年│至2005-4-2│2002H068│----│----│国药证字│湖南医药工业研究所,湖南维康│2001-3- │CXS01139┃┃23││││││5│││H2002047│制药有限公司│21│┃┃│││││││││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│卡维地洛片│ 二│保护期│8年│至2005-4-2│2002H068│国药准字│广州南新制药│国药证字│湖南医药工业研究所│2001-3- │CXS01140┃┃23││││││6│H2002070│有限公司│H2002047││21│┃┃│││││││7││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│清淋胶囊│ 四│过渡期│3年│至2005-12-│2002Z012│国药准字│吉泰安(四川│国药证字│吉泰安(四川)药业有限公司│2000-9- │CZS00079┃┃23│││││22│3│Z2002014│)药业有限公│Z2002009││27│┃┃│││││││5│司│1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│复方马其通胶囊│ 三│过渡期│3年│至2005-12-│2002Z012│国药准字│武汉联合药业│国药证字│中国人民解放军264医院,武汉│2000-10-│CZS00084┃┃23│││││22│6│Z2002014│有限责任公司│Z2002009│滋盛医药科技开发有限责任公│18│┃┃│││││││8││4│司,武汉联合药业有限责任公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│龟龙中风丸│ 三│过渡期│3年│至2005-12-│2002Z012│国药准字│沈阳中药制药│国药证字│沈阳中药制药有限公司│2000-11-│CZS00093┃┃23│││││22│5│Z2002014│有限公司│Z2002009││20│┃┃│││││││7││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│复方益母片│ 四│过渡期│3年│至2005-12-│2002Z012│国药准字│营口奥达制药│国药证字│山东省生物药物研究院,营口奥│2001-9- │CZS01040┃┃23│││││22│2│Z2002014│有限公司│Z2002009│达制药有限公司│19│┃┃│││││││4││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│天芪降糖胶囊│ 三│过渡期│3年│至2005-12-│2002Z012│国药准字│西安高科陕西│国药证字│长春市白山中药研究所│2001-10-│CZS01049┃┃23│││││22│1│Z2002014│金方药业公司│Z2002008││17│┃┃│││││││3││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│加味藿香正气软│ 四│过渡期│3年│至2005-12-│2002Z012│国药准字│江苏康缘药业│国药证字│江苏康缘药业股份有限公司│2002-4- │CZS2002002┃┃23│胶囊││││22│0│Z2002014│股份有限公司│Z2002008││15│4┃┃│││││││2││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│太子保心口服液│ 三│过渡期│3年│至2005-12-│2002Z011│国药准字│北京同仁堂科│国药证字│北京同仁堂科技发展股份有限公│2002-4- │CZS2002002┃┃23│││││22│5│Z2002013│技发展股份有│Z2002008│司制药厂│24│6┃┃│││││││5│限公司制药厂│3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│四季三黄胶囊│ 四│保护期│6年│至2007-6-│2002Z012│国药准字│宿州科苑药业│国药证字│宿州科苑药业有限公司│1997-8- │CZS98002┃┃23│││││28│4│Z2002014│有限公司│Z2002009││12│┃┃│││││││6││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-12-│盐酸格拉司琼葡│ 四│保护期│6年│至2008-9-4│2002H068│国药准字│江苏扬子江药│国药证字│南昌弘益医药研究所│2001-5- │CXS01260┃┃28│萄糖注射液│││││7│H2002071│业集团有限公│H2002047││23│┃┃│││││││8│司│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-2│马来酸氨氯地平│ 四│保护期│6年│至2005-12-│2003S000│国药准字│扬州奥赛康药│国药证字│南京海光应用化学研究所│2001-1- │CXS01013┃┃│││││29│05│H2003000│业有限公司│H2003000││10│┃┃│││││││5││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-2│马来酸氨氯地平│ 四│保护期│6年│至2005-12-│2003S000│国药准字│江苏联环药业│国药证字│南京海光应用化学研究所│2001-1- │CXS01014┃┃│片││││29│06│H2003000│股份有限公司│H2003000││10│┃┃│││││││6││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-2│氯雷他定│ 四│保护期│6年│ 至2008-5-│2003S000│国药准字│常州四药制药│国药证字│常州四药制药有限公司,上海医│2002-1- │CXS2002007┃┃│││││29│03│H2003000│有限公司│H2003000│药工业研究院│30│9┃┃│││││││3││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-2│氯雷他定片│ 四│保护期│6年│至2008-5-│2003S000│国药准字│常州四药制药│国药证字│常州四药制药有限公司,上海医│2002-1- │CXS2002008┃┃│││││29│04│H2003000│有限公司│H2003000│药工业研究院│30│0┃┃│││││││4││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-2│注射用还原型谷│ 四│保护期│6年│至2007-6-│2003S000│国药准字│山东绿叶制药│国药证字│北京红惠生物制药股份有限公司│2002-5- │CXS2002046┃┃│胱甘肽││││10│01│H2003000│股份有限公司│H2003000││28│2┃┃│││││││1││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-2│注射用还原型谷│ 四│保护期│6年│至2007-6-│2003S000│国药准字│山东绿叶制药│国药证字│北京红惠生物制药股份有限公司│2002-5- │CXS2002046┃┃│胱甘肽││││10│02│H2003000│股份有限公司│H2003000││28│3┃┃│││││││2││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-7│复方乳酸软膏│ 三│过渡期│3年│至2006-1-6│2003S000│国药准字│福建太平洋制│国药证字│福建太平洋制药有限公司│2002-8- │CXS2002072┃┃││││││07│H2003000│药有限公司│H2003000││12│6┃┃│││││││7││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2003-1-7│复方乳酸软膏│ 三│过渡期│3年│至2006-1-6│2003S000│国药准字│福建太平洋制│国药证字│福建太平洋制药有限公司│2002-8- │CXS2002072┃┃││││││08│H2003000│药有限公司│H2003000││12│7┃┃│││││││8││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│门冬氨酸鸟氨酸│ 四│保护期│6年│至2009-1-│2003S000│----│----│国药证字│武汉启瑞科技发展有限公司│2000-10-│CXS00628┃┃17│││││16│17│││H2003001││11│┃┃│││││││││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│注射用门冬氨酸│ 四│过渡期│3年│至2006-1-│2003S000│----│----│国药证字│武汉启瑞科技发展有限公司│2000-10-│CXS00629┃┃17│鸟氨酸││││16│13│││H2003000││11│┃┃│││││││││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│注射用门冬氨酸│ 四│过渡期│3年│至2006-1-│2003S000│----│----│国药证字│武汉启瑞科技发展有限公司│2000-10-│CXS00630┃┃17│鸟氨酸││││16│18│││H2003000││11│┃┃│││││││││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│门冬氨酸鸟氨酸│ 四│保护期│6年│至2009-1-│2003S000│----│----│国药证字│武汉启瑞科技发展有限公司│2000-10-│CXS00631┃┃17│颗粒剂││││16│19│││H2003001││11│┃┃│││││││││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│门冬氨酸鸟氨酸│ 四│保护期│6年│至2009-1-│2003S000│----│----│国药证字│武汉启瑞科技发展有限公司│2000-10-│CXS00632┃┃17│颗粒剂││││16│20│││H2003001││11│┃┃│││││││││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│多糖铁│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│青岛国风高科│国药证字│青岛国风高科药业有限责任公│2002-4- │CXS2002032┃┃17│││││16│14│H2003003│药业有限责任│H2003001│司,青岛化工学院│18│3┃┃│││││││2│公司│0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│多糖铁胶囊│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│青岛国风高科│国药证字│青岛国风高科药业有限责任公│2002-4- │CXS2002032┃┃17│││││16│15│H2003003│药业有限责任│H2003001│司,青岛化工学院│18│4┃┃│││││││3│公司│1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│雷贝拉唑钠│ 二│保护期│8年│至2010-7-│2003S000│国药准字│峨眉山健康制│国药证字│峨眉山健康制药有限责任公司│2002-6-6│CXS2002047┃┃17│││││24│10│H2003000│药有限责任公│H2003000│││1┃┃│││││││9│司│7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│雷贝拉唑钠肠溶│ 二│保护期│8年│至2010-7-│2003S000│国药准字│峨眉山健康制│国药证字│峨眉山健康制药有限责任公司│2002-6-6│CXS2002047┃┃17│片││││24│11│H2003001│药有限责任公│H2003000│││2┃┃│││││││0│司│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│双氢青蒿素哌喹│ 三│过渡期│3年│至2006-1-│2003S000│----│----│国药证字│广州华立健医药研究所,广州市│2002-7-3│CXS2002056┃┃17│片││││16│16│││H2003001│华立健药业有限公司││8┃┃│││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│缬沙坦│ 四│保护期│6年│至2006-10-│2003S000│国药准字│哈药集团三精│国药证字│哈药集团三精制药有限公司,长│2001-1- │CXS01027┃┃24│││││23│23│H2003003│制药有限公司│H2003001│沙泓扬医药科技开发有限公司,│15│┃┃│││││││4││8│哈尔滨市宁宇药物研究所││┃┃││││││││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│缬沙坦胶囊│ 四│保护期│6年│至2006-10-│2003S000│国药准字│永信药品工业│国药证字│永信药品工业(昆山)有限公司,│2001-1- │CXS01028┃┃24│││││23│24│H2003003│(昆山)有限公│H2003001│哈药集团三精制药有限公司,长│15│┃┃│││││││5│司│9│沙泓扬医药科技开发有限公司,││┃┃││││││││││哈尔滨市宁宇药物研究所││┃┃││││││││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│辣椒碱│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│长春三九生物│国药证字│石家庄正光生物工程有限公司│2002-7-1│CXS2002055┃┃24│││││23│21│H2003003│制药股份有限│H2003001│││4┃┃│││││││0│公司│6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│辣椒碱软膏│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│长春三九生物│国药证字│石家庄正光生物工程有限公司│2002-7-1│CXS2002055┃┃24│││││23│22│H2003003│制药股份有限│H2003001│││5┃┃│││││││1│公司│7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│人类免疫缺陷病│ 二│无│││2003S002│国药准字│北京万泰生物│国药证字│北京万泰生物药业有限公司,厦│2001-6-5│CSS01022┃┃29│毒(HIV1+2型)抗│││││13│S2003000│药业有限公司│S2003000│门大学││┃┃│体诊断试剂盒││││││1││1│││┃┃│(金标法)│││││││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│羟苯磺酸钙│ 四│保护期│6年│至2006-12-│2003S001│国药准字│上海复星朝晖│国药证字│合肥医工医药研究所,南京长澳│2001-1- │CXS01025┃┃29│││││14│94│H2003008│药业有限公司│H2003009│制药有限公司,上海复星朝晖药│15│┃┃│││││││9││3│业有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│羟苯磺酸钙胶囊│ 四│保护期│6年│至2006-12-│2003S001│国药准字│上海复星朝晖│国药证字│合肥医工医药研究所,南京长澳│2001-1- │CXS01026┃┃29│││││14│93│H2003008│药业有限公司│H2003009│制药有限公司,上海复星朝晖药│15│┃┃│││││││8││2│业有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│羟苯磺酸钙片│ 四│过渡期│3年│至2006-1-│2003S001│国药准字│南京长澳制药│国药证字│合肥医工医药研究所,南京长澳│2001-3- │CXS01128┃┃29│││││28│92│H2003008│有限公司│H2003009│制药有限公司│19│┃┃│││││││7││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│肌苷葡萄糖注射│ 四│保护期│6年│至2008-3-5│2003S001│国药准字│石家庄四药股│国药证字│南昌弘益医药研究所│2001-5- │CXS01261┃┃29│液│││││98│H2003009│份有限公司│H2003009││23│┃┃│││││││2││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│甲磺酸多沙唑嗪│ 二│保护期│8年│至2008-7-│2003S000│----│----│国药证字│上海今科明光药业有限公司│2001-6- │CXS01317┃┃29│││││13│38│││H2003002││20│┃┃│││││││││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│甲磺酸多沙唑嗪│ 二│保护期│8年│至2008-7-│2003S000│----│上海今科明光│国药证字│上海今科明光药业有限公司│2001-6- │CXS01318┃┃29│片││││13│39││药业有限公司│H2003003││20│┃┃│││││││││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│氟康唑葡萄糖注│ 四│保护期│6年│至2008-7-│2003S001│国药准字│鲁南制药股份│国药证字│济南新力特科技有限公司,鲁南│2001-8-8│CXS01405┃┃29│射液││││18│85│H2003008│有限公司│H2003008│制药股份有限公司││┃┃│││││││3││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│氟尿嘧啶葡萄糖│ 四│监测期│不设││2003S001│国药准字│浙江一新制药│国药证字│浙江一新制药股份有限公司│2001-8- │CXS01452┃┃29│注射液│││││38│H2003005│股份有限公司│H2003004││30│┃┃│││││││5││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│法莫替丁氯化钠│ 四│保护期│6年│至2007-8-│2003S001│国药准字│重庆迪康长江│国药证字│南昌弘益医药研究所,重庆迪康│2001-9- │CXS01482┃┃29│注射液││││21│84│H2003008│制药有限公司│H2003008│长江制药有限公司│12│┃┃│││││││2││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│普仑司特│ 二│过渡期│4年│至2007-1-│2003S002│国药准字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司,上│2001-9- │CXS01484┃┃29│││││28│03│H2003009│股份有限公司│H2003010│海医药工业研究院│17│┃┃│││││││6││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│普仑司特胶囊│ 二│过渡期│4年│至2007-1-│2003S002│国药准字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司,上│2001-9- │CXS01485┃┃29│││││28│04│H2003009│股份有限公司│H2003010│海医药工业研究院│17│┃┃│││││││7││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│地红霉素│ 二│过渡期│4年│至2007-1-│2003S001│国药准字│广东万基药业│国药证字│山东省医药工业研究所,广东万│2001-9- │CXS01527┃┃29│││││28│82│H2003008│有限公司│H2003008│基药业有限公司│26│┃┃│││││││0││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│地红霉素肠溶片│ 二│过渡期│4年│至2007-1-│2003S001│国药准字│广东万基药业│国药证字│山东省医药工业研究所,广东万│2001-9- │CXS01528┃┃29│││││28│83│H2003008│有限公司│H2003008│基药业有限公司│26│┃┃│││││││1││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│硫酸庆大霉素氯│ 四│监测期│不设││2003S001│国药准字│沈阳志鹰制药│国药证字│沈阳市山日药物研究所,沈阳志│2001-10-│CXS01587┃┃29│化钠注射液│││││99│H2003009│厂│H2003009│鹰制药厂│30│┃┃│││││││3││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│头孢克肟│ 四│过渡期│3年│至2005-10-│2002S000│国药准字│广州白云山制│国药证字│广州白云山制药股份有限公司广│2001-11-│CXS01649┃┃29│││││28│41│H2003004│药股份有限公│H2003003│州白云山化学制药厂│15│┃┃│││││││3│司广州白云山│2│││┃┃││││││││化学制药厂││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│头孢克肟胶囊│ 四│保护期│6年│至2008-9-│2003S000│国药准字│广州白云山制│国药证字│广州白云山制药股份有限公司广│2001-11-│CXS01650┃┃29│││││11│42│H2003004│药股份有限公│H2003003│州白云山制药总厂│15│┃┃│││││││4│司广州白云山│3│││┃┃││││││││制药总厂││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│头孢克肟颗粒│ 四│保护期│6年│至2008-9-│2003S000│国药准字│广州白云山制│国药证字│广州白云山制药股份有限公司广│2001-11-│CXS01651┃┃29│││││11│43│H2003004│药股份有限公│H2003003│州白云山制药总厂│15│┃┃│││││││5│司广州白云山│4│││┃┃││││││││制药总厂││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│盐酸西布曲明片│ 二│保护期│8年│至2008-11-│2003S001│国药准字│盐城制药有限│国药证字│江苏省药物研究所,盐城制药有│2001-11-│CXS01668┃┃29│││││1│97│H2003009│公司│H2003009│限公司│19│┃┃│││││││1││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│注射用盐酸克林│ 四│监测期│不设││2003S001│国药准字│重庆药友制药│国药证字│重庆市莱美药物技术有限公司│2001-11-│CXS01687┃┃29│霉素│││││86│H2003008│有限责任公司│H2003008││28│┃┃│││││││4││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│醋酸甲地孕酮分│ 四│保护期│6年│至2007-1-│2003S002│----│----│国药证字│西安太明医药研究所│2001-11-│CXS01698┃┃29│散片││││21│02│││H2003010││28│┃┃│││││││││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│头孢克肟片│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│广州白云山制│国药证字│广州白云山制药股份有限公司广│2001-12-│CXS01782┃┃29│││││28│44│H2003004│药股份有限公│H2003003│州白云山制药总厂│27│┃┃│││││││6│司广州白云山│5│││┃┃││││││││制药总厂││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│头孢克肟分散片│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│广州白云山制│国药证字│广州白云山制药股份有限公司广│2001-12-│CXS01783┃┃29│││││28│46│H2003004│药股份有限公│H2003003│州白云山制药总厂│27│┃┃│││││││8│司广州白云山│7│││┃┃││││││││制药总厂││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│头孢克肟分散片│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│广州白云山制│国药证字│广州白云山制药股份有限公司广│2001-12-│CXS01784┃┃29│││││28│45│H2003004│药股份有限公│H2003003│州白云山制药总厂│27│┃┃│││││││7│司广州白云山│6│││┃┃││││││││制药总厂││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│肌苷氯化钠注射│ 四│保护期│6年│至2008-7-│2003S000│国药准字│江西东亚药业│国药证字│江西东亚药业有限责任公司│2002-2-4│CXS2002010┃┃29│液││││23│40│H2003004│有限责任公司│H2003003│││0┃┃│││││││0││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│环酯红霉素│ 二│过渡期│4年│至2007-1-│2003S001│国药准字│昆山双鹤药业│国药证字│中国医学科学院医药生物技术研│2002-3- │CXS2002019┃┃29│││││28│39│H2003005│有限责任公司│H2003004│究所,北京双鹤药业股份有限公│19│4┃┃│││││││6││3│司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│环酯红霉素片│ 二│过渡期│4年│至2007-1-│2002S001│国药准字│北京双鹤药业│国药证字│北京双鹤药业股份有限公司│2002-3- │CXS2002019┃┃29│││││28│40│H2003005│股份有限公司│H2003004││19│5┃┃│││││││7││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│环酯红霉素片│ 二│过渡期│4年│至2007-1-│2003S001│国药准字│北京双鹤药业│国药证字│北京双鹤药业股份有限公司│2002-3- │CXS2002019┃┃29│││││28│41│H2003005│股份有限公司│H2003004││19│6┃┃│││││││8││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│复方薄荷脑鼻用│ 四│过渡期│3年│至2006-1-│2003S018│国药准字│曼秀雷敦(中│国药证字│曼秀雷敦(中山)药业有限公司│2002-4- │CXS2002029┃┃29│吸入剂││││28│1│H2003007│山)药业有限│H2003008││11│8┃┃│││││││7│公司│1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│注射用盐酸克林│ 四│监测期│不设││2003S001│国药准字│海南斯达制药│国药证字│海南欧化医药科技有限公司│2002-4- │CXS2002032┃┃29│霉素│││││42│H2003005│有限公司│H2003004││22│6┃┃│││││││9││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│肠内营养混悬液│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│纽迪希亚制药│国药证字│纽迪希亚制药(无锡)有限公司│2002-5- │CXS2002037┃┃29│(TPSPA)││││28│36│H2003003│(无锡)有限公│H2003002││14│3┃┃│││││││8│司│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│肠内营养混悬液│ 四│过渡期│3年│至2006-1-│2003S000│国药准字│纽迪希亚制药│国药证字│纽迪希亚制药(无锡)有限公司│2002-5- │CXS2002037┃┃29│(TPSPA)││││28│37│H2003003│(无锡)有限公│H2003002││14│4┃┃│││││││9│司│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│齐多夫定│ 四│保护期│6年│至2008-8-5│2003S001│国药准字│河南天方药业│国药证字│河南师范大学,河南天方药业股│2002-6-3│CXS2002046┃┃29││││││56│H2003006│股份有限公司│H2003006│份有限公司││0┃┃│││││││1││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│齐多夫定胶囊│ 四│保护期│6年│至2008-8-5│2003S001│国药准字│河南天方药业│国药证字│河南天方药业股份有限公司│2002-6-3│CXS2002046┃┃29││││││57│H2003006│股份有限公司│H2003006│││1┃┃│││││││2││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│奈达铂│ 二│过渡期│4年│至2007-1-│2003S001│----│----│国药证字│中国医学科学院药物研究所,南│2002-7-4│CXS2002058┃┃29│││││28│49│││H2003005│京生物工程与医药科技发展有限││1┃┃│││││││││3│公司,南京东捷医药科技有限责││┃┃││││││││││任公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│注射用奈达铂│ 二│过渡期│4年│至2007-1-│2003S001│----│----│国药证字│中国医学科学院药物研究所,南│2002-7-4│CXS2002058┃┃29│││││28│48│││H2003005│京生物工程与医药科技发展有限││2┃┃│││││││││2│公司,南京东捷医药科技有限责││┃┃││││││││││任公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│加替沙星│ 一│过渡期│5年│至2008-1-│2003S000│国药试字│江苏扬子江药│国药证字│南京圣和药业有限公司│2002-7- │CXS2002068┃┃29│││││28│31│H2003000│业集团有限公│H2003002││30│8┃┃│││││││4│司│3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│加替沙星片│ 一│保护期│12年│至2014-8-6│2003S000│国药试字│南京圣和药业│国药证字│南京圣和药业有限公司│2002-7- │CXS2002068┃┃29││││││33│H2003000│有限公司│H2003002││30│9┃┃│││││││6││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│加替沙星胶囊│ 一│过渡期│5年│至2008-1-│2003S000│国药试字│上海海尼药业│国药证字│南京圣和药业有限公司│2002-7- │CXS2002069┃┃29│││││28│32│H2003000│有限公司│H2003002││30│0┃┃│││││││5││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2003-1-│加替沙星注射液│ 一│过渡期│5年│至2008-1-│2003S000│----│----│国药证字│南京圣和药业有限公司,上海海│2002-7- │CXS2002069┃┃29│││││28│34│││H2003002│尼药业有限公司│30│1┃┃│││││││││6│││┃。
新药保护期、过渡期、监测期

新药保护期、过渡期、监测期…一次说清楚1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。
这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。
为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。
在如今看,这种光限制自家人的规定,实属汉奸条款。
但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。
还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。
另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。
无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。
2.行政保护期,这是对我国早期专利法的妥协。
中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。
新药监测期 期限表

12.国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的制品。
2.DNA疫苗。
3.已上市销售疫苗变更新的佐剂,偶合疫苗变更新的载体。
4.由非纯化或全细胞(细菌、病毒等)疫苗改为纯化或者组份疫苗。
5.未在国内上市销售的从植物、动物、矿物等物质中提取有效部位的制剂。
6.未在国内上市销售的中药、天然药物复方制剂中:
6.1中药复方制剂;
6.2 天然药物复方制剂;
6.3 中药、天然药物和化学药品组成的复方制剂。
1.未在国内外上市销售的药品中:
1.4由已上市销售的多组份药物制备为较少组份的药物;
1.5新的复方制剂;
10.改变灭活剂(方法)或者脱毒剂(方法)的疫苗。
11.改变给药途径的疫苗。
4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药的制剂。
5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂中采用特殊制剂技术者,如靶向制剂、缓释制剂、控释制剂。
14.改变给药途径的生物制品(不包括12)。
9.更换其他已批准表达体系或者已批准细胞基质生产的疫苗;采用新工艺制备并且实验室研究资料证明产品安全性和有效性明显提高的疫苗。
7.改变国内已上市销售中药、天然药物给药途径的制剂。
8.改变国内已上市销售中药、天然药物剂型的制剂中采用特殊制剂技术者,如靶向制剂、缓释制剂、控释制剂。
3.已在国外上市销售但尚未在国内上市销售的药品中:
3.2已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;
3.3改变给药途径并已在国外上市销售的制剂;
新兽药监测期期限表

新兽药分类第一类我国创制的原料药品及其制剂(包括天然药物中提取的及合成的新发现的有效单体及其制剂);我国研制的国外未批准生产。
仅有文献报道的原料药品及其制剂;新发现的中药材;中药材新的药用部位。
第二类我国研制的国外己批准生产,但未列入国家药典、兽药典或国家法定药品标准的原料药品及其制剂。
天然药物中提取的有效部分及其制剂。
第三类我国研制的国外已批准生产,并已列入国家药典、兽药典或国家法定药品标准的原料药品及其制剂;天然药物中已知有效单体用合成或半合成方法制取的原料药品及其制剂;西兽药复方制剂;中西兽药复方制剂。
第四类改变剂型或改变给药途径的药品。
新的中药制剂(包括古方、秘方、验方、改变传统处方的);改变剂型但不改变给药途径的中成药。
第五类增加适应症的西兽药制剂、中兽药制剂(中成药)。
新兽药监测期期限表类别监测期期限预防用兽用生物制品5年1.未在国内外上市销售的制品。
4年2.已在国外上市销售但未在国内上市销售的制品。
3年3.对已在国内上市销售的制品使用的菌(毒、虫)株、抗原、主要原材料或生产工艺等有根本改变的制品。
3.1.已在国内上市销售但采用新的菌(毒、虫)株生产的制品;3.2.已在国内上市销售但保护性抗原谱、DNA、多肽序列等不同的制品;3.3.已在国内上市销售但表达体系或细胞基质不同的制品;3.4.由已在国内上市销售的非纯化或全细胞(细菌、病毒等)疫苗改为纯化或组份疫苗;3.5.采用国内已上市销售的疫苗制备的联苗;3.6.已在国内上市销售但改变靶动物、给药途径的疫苗;3.7.已在国内上市销售但改变佐剂、保护剂或其他重要生产工艺的疫苗。
不设4.已在国内上市销售但改变剂型、免疫剂量的疫苗。
类别监测期期限治疗用兽用生物制品5年 1.未在国内外上市销售的制品。
4年 2.已在国外上市销售但未在国内上市销售的制品。
3年3 对已在国内上市销售的制品使用的菌(毒、虫)株、抗原、主要原材料或生产工艺等有根本改变的制品。
国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(1)

国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(1)文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2003.10.10•【文号】国食药监注[2003]278号•【施行日期】2003.10.10•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(国食药监注[2003]278号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),解放军总后卫生部:根据国家药品监督管理局《关于<中华人民共和国药品管理法实施条例>实施前已批准生产和临床研究的新药的保护期的通知》(国药监注[2003]59号)、我局《关于发布新药监测期期限的通知》(国食药监注[2003]141号)的有关规定,现就2002年9月15日以后批准新药的保护期、过渡期或监测期事宜通知如下:一、对2002年9月15日以来批准的新药,尚未确定保护期、过渡期或监测期的,按其申报与审批情况分别予以确定,并自该新药证书或生产批准之日起生效。
具体品种见附件。
二、对处于过渡期内的新药,我局不受理其他申请人同品种的新药或已有国家标准药品申请,省、自治区、直辖市食品药品监督管理局(药品监督管理局)应当将已经收到的申请退回申请人。
三、对没有保护期、过渡期或未设监测期的新药,自其获得药品批准文号之日起,我局不再受理其他申请人同品种的新药申请,省、自治区、直辖市食品药品监督管理局(药品监督管理局)应当将已经收到的申请退回申请人。
四、过渡期内新药技术转让的申报与审批,按照原国家药品监督管理局对新药保护期的相关规定办理。
特此通知附件:2002年9月15日以来尚未确定的新药保护期、过渡期或监测期确定表国家食品药品监督管理局二00三年十月十日附件:2002年9月15日以来尚未确定的新药保护期、过渡期或监测期确定┎────┬───────┬──┬────────────┬────┬────┬──────┬────┬──────────────┬────┬─────┒┃批准日期│新药名称│注册│保护期、过渡期或监测期│批件编号│药品批准│药品生产企业│新药证书│新药证书持有人│申请日期│受理号┃┃││分类│││文号││编号│││┃┃││││││││││┃┃││├───┬──┬─────┤││││││┃┃│││ 种类│期限│终止期│││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│克拉霉素胶囊│ 四│保护期││保护期已过│2002H052│国药准字│珠海润都制药│国药证字│珠海润都制药有限公司│2000-9- │CXS00570┃┃17││││││0│H2002048│有限公司│H2002034││18│┃┃│││││││8││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│克拉霉素胶囊│ 四│保护期││保护期已过│2002H052│国药准字│珠海润都制药│国药证字│珠海润都制药有限公司│2000-9- │CXS00571┃┃17││││││1│H2002048│有限公司│H2002034││18│┃┃│││││││9││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用己酮可可│ 四│监测期│不设││2002H052│国药准字│吉林省辉南长│国药证字│东北制药集团公司沈阳第一制药│2002-1-7│CXS2002000┃┃17│碱│││││2│H2002049│龙生化药业股│H2002035│厂,吉林省辉南长龙生化药业股││1┃┃│││││││0│份有限公司│0│份有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用烟酸占替│ 四│监测期│不设││2002H052│国药准字│吉林省辉南长│国药证字│东北制药集团公司沈阳第一制药│2002-1-7│CXS2002000┃┃17│诺│││││3│H2002049│龙生化药业股│H2002035│厂,吉林省辉南长龙生化药业股││2┃┃│││││││1│份有限公司│1│份有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用烟酸占替│ 四│监测期│不设││2002H053│国药准字│国药集团国瑞│国药证字│合肥恒星药物研究所│2001-4- │CXS01216┃┃22│诺│││││0│H2002050│药业有限公司│H2002035││23│┃┃│││││││7││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│复方苯佐卡因凝│ 三│过渡期│3年│至2005-9-│2002H053│国药准字│广西半宙制药│国药证字│广西半宙制药股份有限公司,南│2001-9-3│CXS01455┃┃22│胶││││21│1│H2002050│股份有限公司│H2002035│宁市安科新技术研究所││┃┃│││││││8││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│复方苯佐卡因凝│ 三│过渡期│3年│至2005-9-│2002H054│国药准字│广西半宙制药│国药证字│广西半宙制药股份有限公司,南│2001-9-3│CXS01456┃┃22│胶││││21│0│H2002051│股份有限公司│H2002035│宁市安科新技术研究所││┃┃│││││││7││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│胞磷胆碱钠氯化│ 四│保护期│6年│至2007-10-│2002H053│国药准字│武汉久安药业│国药证字│北京德生堂医药卫生研究所│2001-12-│CXS01753┃┃24│钠注射液││││8│9│H2002051│有限公司│H2002036││18│┃┃│││││││6││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│过渡期│3年│至2005-9-│2002H055│国药准字│齐鲁制药厂│国药证字│山东省医药工业研究所,齐鲁制│2000-6-2│CXS00340┃┃26│磷酸二氢钠││││25│0│H2002054││H2002037│药厂││┃┃│││││││0││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│阿奇霉素枸橼酸│ 四│过渡期│3年│至2005-9-│2002H054│国药准字│浙江康裕制药│国药证字│合肥医工医药研究所,浙江康裕│2001-11-│CXS01691┃┃26│二氢钠││││25│1│H2002033│有限公司│H2002036│制药有限公司│28│┃┃│││││││7││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│过渡期│3年│至2005-9-│2002H054│国药准字│浙江康裕制药│国药证字│合肥医工医药研究所,浙江康裕│2001-11-│CXS01692┃┃26│枸橼酸二氢钠││││25│3│H2002033│有限公司│H2002036│制药有限公司│28│┃┃│││││││8││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│过渡期│3年│至2005-9-│2002H054│国药准字│浙江康裕制药│国药证字│合肥医工医药研究所,浙江康裕│2001-11-│CXS01693┃┃26│枸橼酸二氢钠││││25│2│H2002033│有限公司│H2002036│制药有限公司│28│┃┃│││││││9││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│结核分支杆菌核│ 四│保护期│8年│至2008-9-│2002S006│国药准字│华美生物工程│国药证字│华美生物工程公司│2001-1-3│CSS01001┃┃30│酸扩增(PCR)荧││││22│1│S2002009│公司│S2002003│││┃┃│光检测试剂盒││││││5││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│阿奇霉素磷酸二│ 四│过渡期│3年│至2005-9-│2002H054│国药准字│齐鲁制药厂│国药证字│山东省医药工业研究所、齐鲁制│2000-6-2│CXS00339┃┃30│氢钠││││29│9│H2002053││H2002037│药厂││┃┃│││││││9││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│保护期│6年│至2005-6-│2002H056│国药准字│辽宁天龙药业│国药证字│包头市千年健科技开发有限责任│2000-9- │CXS00559┃┃30│││││24│2│H2002055│有限公司│H2002038│公司,辽宁天龙药业有限公司│13│┃┃│││││││0││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│克林霉素磷酸酯│ 四│过渡期│3年│至2005-9-│2002H056│国药准字│华北制药集团│国药证字│华北制药集团制剂有限公司│2000-9- │CXS00565┃┃30│外用溶液剂││││29│3│H2002055│制剂有限公司│H2002038││18│┃┃│││││││1││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用高三尖杉│ 四│监测期│不设││2002H056│----│西安大唐制药│国药证字│西安新通药物研究有限公司│2001-4- │CXS01203┃┃30│酯碱│││││1││有限公司│H2002038││17│┃┃│││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用高三尖杉│ 四│监测期│不设││2002H056│----│西安大唐制药│国药证字│西安新通药物研究有限公司│2001-4- │CXS01204┃┃30│酯碱│││││0`││有限公司│H2002038││17│┃┃│││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│保护期│6年│至2005-6-│2002H054│国药准字│河南辅仁怀庆│国药证字│开封康诺生化制药厂│2001-4- │CXS01208┃┃30│││││24│8│H2002053│堂制药有限公│H2002037││18│┃┃│││││││0│司│1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│己酮可可碱葡萄│ 四│保护期│6年│至2007-10-│2002H056│国药准字│大连德泽制药│国药证字│大连天宇制药有限公司│2001-6- │CXS01302┃┃30│糖注射液││││24│4│H2002055│有限公司│H2002038││14│┃┃│││││││2││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│胞磷胆碱钠氯化│ 四│保护期│6年│至2007-10-│2002H056│----│----│国药证字│安徽科苑药业有限公司│2001-11-│CXS01676┃┃30│钠注射液││││8│6│││H2002038││21│┃┃│││││││││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│烟酸占替诺氯化│ 四│保护期│6年│至2007-6-│2002H056│国药准字│大连德泽制药│国药证字│中国人民解放军第九八九二工│2001-11-│CXS01677┃┃30│钠注射液││││28│5│H2002055│有限公司│H2002038│厂,丹东市鸭绿江医药研究开发│23│┃┃│││││││3││6│中心││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│口服补液盐溶液│ 四│过渡期│3年│至2005-9-│2002H056│国药准字│上海强生制药│国药证字│上海强生制药有限公司│2002-2-5│CXS2002010┃┃30│││││29│7│H2002055│有限公司│H2002038│││9┃┃│││││││4││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│多西他赛│ 四│过渡期│3年│至2005-9-│2002H055│国药准字│江苏恒瑞医药│国药证字│中国医学科学院药物研究所,江│2002-4-8│CXS2002027┃┃30│││││29│3│H2002054│股份有限公司│H2002037│苏恒瑞医药股份有限公司││3┃┃│││││││2││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用多西他赛│ 四│过渡期│3年│至2005-9-│2002H055│国药准字│江苏恒瑞医药│国药证字│中国医学科学院药物研究所,江│2002-4-8│CXS2002027┃┃30│││││29│4│H2002054│股份有限公司│H2002037│苏恒瑞医药股份有限公司││4┃┃│││││││3││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│丁苯酞│ 一│过渡期│5年│至2007-9-│2002H055│国药试字│石家庄制药集│国药证字│中国医学科学院药物研究所│2002-5- │CXS2002045┃┃30│││││29│1│H2002000│团欧意药业有│H2002037││29│2┃┃│││││││8│限公司│4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│丁苯酞软胶囊│ 一│过渡期│5年│至2007-9-│2002H055│国药试字│石家庄制药集│国药证字│中国医学科学院药物研究所│2002-5- │CXS2002045┃┃30│││││29│2│H2002000│团欧意药业有│H2002037││29│3┃┃│││││││9│限公司│5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│司他夫定│ 四│保护期│6年│至2008-9-│2002H055│国药准字│东北制药总厂│国药证字│东北制药总厂│2002-9- │CXS2002098┃┃30│││││12│7│H2002054││H2002038││28│2┃┃│││││││7││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│司他夫定胶囊│ 四│保护期│6年│至2008-9-│2002H055│国药准字│东北制药总厂│国药证字│东北制药总厂│2002-9- │CXS2002098┃┃30│││││12│8│H2002054││H2002038││28│3┃┃│││││││8││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│司他夫定胶囊│ 四│保护期│6年│至2008-9-│2002H055│国药准字│东北制药总厂│国药证字│东北制药总厂│2002-9- │CXS2002098┃┃30│││││12│9│H2002054││H2002038││28│4┃┃│││││││9││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│小儿豉翘清热颗│ 三│过渡期│3年│至2005-9-│2002Z010│国药准字│江苏帝益药业│国药证字│天津药物研究院,江苏帝益药业│2001-9- │CZS01045┃┃30│粒││││29│5│Z2002009│有限公司│Z2002007│有限公司│26│┃┃│││││││6││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│小儿豉翘清热颗│ 三│过渡期│3年│至2005-9-│2002Z010│国药准字│江苏帝益药业│国药证字│天津药物研究院,江苏帝益药业│2001-9- │CZS01046┃┃30│粒││││29│6│Z2002009│有限公司│Z2002007│有限公司│26│┃┃│││││││7││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│丙型肝炎病毒分│ 一│无│││2002S006│----│----│国药证字│中国人民解放军军事医学科学院│2001-11-│CSS01064┃┃16│片段抗体检测试│││││0│││S2002003│放射医学研究所,深圳益生堂生│21│┃┃│剂盒(蛋白芯片)││││││││4│物企业有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│头孢呋辛酯│ 四│保护期│6年│至2006-5-│2002H057│----│----│国药证字│南京海光应用化学研究所│2000-12-│CXS00733┃┃16│││││26│1│││H2002039││18│┃┃│││││││││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│头孢呋辛酯片│ 四│保护期│6年│至2002-9-6│2002H057│----│----│国药证字│南京海光应用化学研究所│2000-12-│CXS00734┃┃16││││││2│││H2002039││18│┃┃│││││││││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│胸腺肽&A1│ 四│过渡期│3年│至2005-10-│2002H055│国药准字│四川源基制药│国药证字│四川源基制药有限公司,成都地│2001-3- │CXS01123┃┃16│││││15│5│H2002054│有限公司│H2002037│奥九泓制药厂│15│┃┃│││││││4││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用胸腺肽& │ 四│过渡期│3年│至2005-10-│2002H055│国药准字│成都地奥九泓│国药证字│成都地奥九泓制药厂│2001-3- │CXS01124┃┃16│A1││││15│6│H2002054│制药厂│H2002037││15│┃┃│││││││5││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│甲磺酸托烷司琼│ 二│过渡期│4年│至2006-10-│2002H057│国药准字│北京四环医药│国药证字│中国人民解放军军事医学科学院│2001-3- │CXS01129┃┃16│││││15│7│H2002056│科技股份有限│H2002039│毒物药物研究所│19│┃┃│││││││2│公司│6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│甲磺酸托烷司琼│ 二│过渡期│4年│至2006-10-│2002H057│国药准字│北京四环医药│国药证字│中国人民解放军军事医学科学院│2001-3- │CXS01130┃┃16│片││││15│8│H2002056│科技股份有限│H2002039│毒物药物研究所│19│┃┃│││││││3│公司│7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│甲磺酸托烷司琼│ 二│过渡期│4年│至2006-10-│2002H057│国药准字│北京四环医药│国药证字│中国人民解放军军事医学科学院│2001-3- │CXS01131┃┃16│注射液││││15│9│H2002056│科技股份有限│H2002039│毒物药物研究所│19│┃┃│││││││4│公司│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氟康唑葡萄糖注│ 四│保护期│6年│至2008-7-│2002H058│国药准字│河南天方药业│国药证字│河南天方药业股份有限公司│2001-9- │CXS01474┃┃16│射液││││18│0│H2002056│股份有限公司│H2002039││10│┃┃│││││││5││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│托吡酯片│ 四│过渡期│3年│至2005-10-│2002H056│国药准字│西安杨森制药│国药证字│西安杨森制药有限公司│2001-11-│CXS01701┃┃16│││││15│8│H2002055│有限公司│H2002038││28│┃┃│││││││5││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│托吡酯片│ 四│过渡期│3年│至2005-10-│2002H056│国药准字│西安杨森制药│国药证字│西安杨森制药有限公司│2001-11-│CXS01702┃┃16│││││15│9│H2002055│有限公司│H2002038││28│┃┃│││││││6││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│托吡酯片│ 四│过渡期│3年│至2005-10-│2002H057│国药准字│西安杨森制药│国药证字│西安杨森制药有限公司│2001-11-│CXS01703┃┃16│││││15│0│H2002055│有限公司│H2002038││28│┃┃│││││││7││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│胞磷胆碱钠氯化│ 四│保护期│6年│至2007-10-│2002H058│国药准字│济南三九益民│国药证字│山东九新医药科技开发有限责任│2001-12-│CXS01789┃┃16│钠注射液││││8│3│H2002056│制药有限责任│H2002040│公司,济南三九益民制药有限责│29│┃┃│││││││8│公司│2│任公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氯雷他定│ 四│保护期│6年│ 至2008-5-│2002H057│国药准字│深圳海王药业│国药证字│南京臣功制药有限公司,深圳海│2002-1-7│CXS2002000┃┃16│││││29│3│H2002055│有限公司│H2002039│王药业有限公司││3┃┃│││││││8││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氯雷他定颗粒剂│ 四│过渡期│3年│至2005-10-│2002H057│国药准字│南京三锐药业│国药证字│南京臣功制药有限公司│2002-1-7│CXS2002000┃┃16│││││15│5│H2002056│有限公司│H2002039│││4┃┃│││││││0││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氯雷他定咀嚼片│ 四│过渡期│3年│至2005-10-│2002H057│国药准字│深圳海王药业│国药证字│南京臣功制药有限公司,深圳海│2002-1-7│CXS2002000┃┃16│││││15│6│H2002056│有限公司│H2002039│王药业有限公司││5┃┃│││││││1││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氯雷他定胶囊│ 四│过渡期│3年│至2005-10-│2002H057│国药准字│深圳海王药业│国药证字│南京臣功制药有限公司,深圳海│2002-1-7│CXS2002000┃┃16│││││15│4│H2002055│有限公司│H2002039│王药业有限公司││8┃┃│││││││9││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│盐酸左布比卡因│ 四│过渡期│3年│至2005-10-│2002H058│国药准字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司│2002-1-7│CXS2002000┃┃16│││││15│4│H2002056│股份有限公司│H2002040│││9┃┃│││││││9││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│盐酸左布比卡因│ 四│过渡期│3年│至2005-10-│2002H058│国药准字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司│2002-1-7│CXS2002001┃┃16│注射液││││15│5│H2002057│股份有限公司│H2002040│││0┃┃│││││││0││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│胞磷胆碱钠氯化│ 四│保护期│6年│至2007-10-│2002H058│国药准字│武汉滨湖双鹤│国药证字│武汉滨湖双鹤药业有限责任公司│2002-1-9│CXS2002002┃┃16│钠注射液││││8│1│H2002056│药业有限责任│H2002040│││0┃┃│││││││6│公司│0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用己酮可可│ 四│监测期│不设││2002H058│国药准字│武汉海特生物│国药证字│湖北中远医药有限公司│2002-1- │CXS2002002┃┃16│碱│││││2│H2002056│制药股份有限│H2002040││14│5┃┃│││││││7│公司│1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│头孢克洛缓释片│ 四│保护期│6年│至2005-12-│2002H058│国药准字│礼来苏州制药│国药证字│礼来苏州制药有限公司│2002-2-6│CXS2002012┃┃16│││││29│6│H2002057│有限公司│H2002040│││4┃┃│││││││1││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│西尼地平│ 二│过渡期│4年│至2006-10-│2002H058│国药准字│安徽新力药业│国药证字│天津药物研究院,安徽新力药业│2002-8- │CXS2002072┃┃22│││││21│9│H2002057│股份有限公司│H2002040│股份有限公司蚌埠涂山分厂│12│8┃┃│││││││8│蚌埠涂山分厂│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│西尼地平片│ 二│过渡期│4年│至2006-10-│2002H058│国药准字│安徽新力药业│国药证字│天津药物研究院,安徽新力药业│2002-8- │CXS2002072┃┃22│││││21│8│H2002057│股份有限公司│H2002040│股份有限公司蚌埠涂山分厂│12│9┃┃│││││││7│蚌埠涂山分厂│7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│阿司待因片│ 三│过渡期│3年│至2005-10-│2002H058│国药准字│山东新华制药│国药证字│山东新华制药股份有限公司│2001-11-│CXS01662┃┃23│││││22│7│H2002057│股份有限公司│H2002040││16│┃┃│││││││6││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│头孢呋辛钠│ 四│保护期│6年│至2005-5-│2002H059│国药准字│浙江永宁制药│国药证字│四川抗菌素工业研究所│2002-1- │CXS2002002┃┃23│││││13│2│H2002058│厂│H2002041││10│2┃┃│││││││1││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用头孢呋辛│ 四│保护期│6年│至2005-5-│2002H059│国药准字│浙江永宁制药│国药证字│四川抗菌素工业研究所│2002-1- │CXS2002002┃┃23│钠││││13│3│H2002058│厂│H2002041││10│3┃┃│││││││2││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用头孢呋辛│ 四│保护期│6年│至2005-5-│2002H059│国药准字│浙江永宁制药│国药证字│四川抗菌素工业研究所│2002-1- │CXS2002002┃┃23│钠││││13│4│H2002058│厂│H2002041││10│4┃┃│││││││3││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│奈韦拉平│ 四│监测期│不设││2002H059│国药准字│上海迪赛诺化│国药证字│上海迪赛诺生物医药有限公司│2002-10-│CXS2002104┃┃23││││││0│H2002057│学制药有限公│H2002040││18│8┃┃│││││││9│司│9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│奈韦拉平片│ 四│监测期│不设││2002H059│国药准字│上海迪赛诺生│国药证字│上海迪赛诺生物医药有限公司│2002-10-│CXS2002104┃┃23││││││1│H2002058│物医药有限公│H2002041││18│9┃┃│││││││0│司│0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│西尼地平│ 二│过渡期│4年│至2006-10-│2002H059│国药准字│山西泰盛制药│国药证字│山西泰盛制药有限公司,北京克│2002-10-│CXS2002099┃┃24│││││21│5│H2002058│有限公司│H2002041│莱瑞科贸有限公司呼和浩特分公│16│7┃┃│││││││4││3│司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│西尼地平片│ 二│过渡期│4年│至2006-10-│2002H059│国药准字│山西泰盛制药│国药证字│山西泰盛制药有限公司,北京克│2002-10-│CXS2002099┃┃24│││││21│6│H2002058│有限公司│H2002041│莱瑞科贸有限公司呼和浩特分公│16│8┃┃│││││││5││4│司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│复方平贝口服液│ 三│过渡期│3年│至2005-10-│2002Z010│国药准字│大连金泉生物│国药证字│大连金泉生物工程制药有限公司│2001-1- │CZS01003┃┃24│││││23│8│Z2002010│工程制药有限│Z2002007││10│┃┃│││││││0│公司│6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│琥乙红霉素分散│ 四│保护期│6年│至2005-7-│2002H060│国药准字│三九企业集团│国药证字│合肥新思达医药技术有限公司│2001-3- │CXS01159┃┃29│片││││28│9│H2002059│永安制药厂│H2002042││28│┃┃│││││││9││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│己酮可可碱葡萄│ 四│保护期│6年│至2007-10-│2002H061│国药准字│安庆制药有限│国药证字│安徽省安泰医药生物技术有限责│2001-4-2│CXS01172┃┃29│糖注射液││││24│6│H2002061│公司│H2002042│任公司││┃┃│││││││6││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│硫酸钡混悬液│ 四│过渡期│3年│至2005-10-│2002H061│国药准字│汕头金石制药│国药证字│汕头金石制药总厂│2001-5- │CXS01265┃┃29│││││28│7│H2002061│总厂│H2002043││29│┃┃│││││││7││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│硫酸钡混悬液│ 四│过渡期│3年│至2005-10-│2002H061│国药准字│汕头金石制药│国药证字│汕头金石制药总厂│2001-5- │CXS01266┃┃29│││││28│9│H2002061│总厂│H2002043││29│┃┃│││││││9││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│硫酸钡混悬液│ 四│过渡期│3年│至2005-10-│2002H061│国药准字│汕头金石制药│国药证字│汕头金石制药总厂│2001-5- │CXS01267┃┃29│││││28│8│H2002061│总厂│H2002043││29│┃┃│││││││8││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│硫酸钡混悬液│ 四│过渡期│3年│至2005-10-│2002H062│国药准字│汕头金石制药│国药证字│汕头金石制药总厂│2001-5- │CXS01268┃┃29│││││28│0│H2002062│总厂│H2002043││29│┃┃│││││││0││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│高三尖杉酯碱氯│ 四│保护期│6年│至2008-7-│2002H063│国药准字│陕西金裕制药│国药证字│陕西金裕制药股份有限公司│2001-6-4│CXS01286┃┃29│化钠注射液││││24│9│H2002063│股份有限公司│H2002044│││┃┃│││││││1││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氟康唑葡萄糖注│ 四│保护期│6年│至2008-7-│2002H062│----│----│国药证字│山东省医药工业研究所│2001-7- │CXS01367┃┃29│射液││││18│4│││H2002043││18│┃┃│││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氟康唑葡萄糖注│ 四│保护期│6年│至2008-7-│2002H063│国药准字│山东天福制药│国药证字│山东省医疗器械研究所│2001-8-8│CXS01403┃┃29│射液││││18│1│H2002062│厂│H2002043│││┃┃│││││││4││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用硫酸奈替│ 四│保护期│6年│至2007-11-│2002H064│----│----│国药证字│北京华睿鼎信科技有限公司,湖│2001-9-3│CXS01462┃┃29│米星││││6│0│││H2002044│北午时药业股份有限公司││┃。
关于保护期、监测期、过渡期等几个新手困惑的问题

关于保护期、监测期、过渡期等几个新手困惑的问题自1998年国家药品监督管理局成立以来,对于注册法规修订较大,1999年4月22日颁布《新药审批办法》、《新生物制品审批办法》、《新药保护和技术转让的规定》、《仿制药品审批办法》和《进口药品管理办法》,启动了对药品注册审评模式的改革,逐步与国际接轨。
随着我国2001年加入WTO和新修订的《药品管理法》及其《实施条例》的颁布实施,原国家药品监督管理局对上述办法进行了修订,于2002年12月1日颁布实施《药品注册管理办法》(试行),以适应WTO关于知识产权的相关原则,适应《药品管理法实施条例》后对“新药”定义修改的新形势。
由于近几年注册规章的频繁修订,对于药品注册相关规章的理解发生偏差,使在药品注册申请过程中出现了许多问题,如新药类别、新药保护期、过渡期、监测期的理解等。
而实际上,当我们把目光不单单局限在《药品注册管理办法》上,回头看看老的注册法规、看看药品监管的“基本法”《药品管理法》,许多问题实际上并不难理解。
《药品管理法》作为药品监管行政执法的法律依据,对药品监管中许多问题都做出了原则性规定。
例如在第一章总则中对药品监管的目的、适用范围、执法部门等均做出了原则性规定,尤其是第一条“为加强药品监督管理,保证药品质量,保障人体用药安全,维护人民身体健康和用药的合法权益,特制定本法”,更是整个药品监管的核心——确保人民用药安全有效。
在第四章第25条规定了配制医疗机构制剂“应当是本单位临床需要而市场上没有供应的品种,并须经所在地省、自治区、直辖市人民政府药品监督管理部门批准后方可配制。
配制的制剂必须按照规定进行质量检验;合格的,凭医师处方在本医疗机构使用。
特殊情况下,经国务院或者省、自治区、直辖市人民政府的药品监督管理部门批准,医疗机构配制的制剂可以在指定的医疗机构之间调剂使用”,从这一条我们可以知道如果要申请医疗机构制剂,需要得到省级药品监督管理局的批准方可以配制。
新药保护期过渡期监测期的区别

新药保护期、过渡期、监测期的区别
2008-11-27 15:21:42
1、新药保护期(1985~2002.9.15)
1985~1999/5/1 ,新药保护期如下:
1999/5/1~2002/9/15 ,新药保护期如下:
2、过渡期(适用于2002.9.15前批临床但未批生产的)
对于2002年9月15日以前我局已经批准临床研究但未批准生产的新药,仍按照原药品注册管理的有关规定审批。
批准生产后,按照原《新药审批办法》属于一类新药的,给予5年的过渡期;属于二类新药的,给予4年的过渡期;属于三类至五类新药的,给予3年的过渡期。
在过渡期内,其他药品生产企业不得生产相同品种的药品。
3、监测期
对于2002年9月15日以前我局已经受理但未批准临床研究的新药,
以及2002年9月15日以后我局受理的新药,按照修订的《药品管理法》及《实施条例》的有关规定审批。
即:对未曾在中国境内上市销售的品种,按照新药审批,并且对批准药品生产企业生产的新药,设立不超过5年的监测期;对已经在中国境内上市销售的品种,按照已有国家标准药品审批。
具体监测期限见下表
新药监测期期限表(试行).。
药品保护期、过渡期、检测期情况表

一类:12年(含试产期两年)
二、三类:8年
四、五类:6年
监测期:
1.1、1.2、1.3类:5年
1.4、1.5、2、3.1(<2年)类:4年
3.1(>2年)、3.2、3.3、4、5(特殊制剂*):3年
3(原料)、5(普通制剂*)类:不设
监测期:
1.1、1.2、1.3类:5年
1.4、1.5、2、3.1(<2年)类:4年
2002.9.15以后,
1.受理新药,按上述第3条审批。
2.批准新药,详细见表:《2002.9.15以来尚未确定保护期、过渡期或监测期确定表》
注*:普通制剂:包括片剂、胶囊、注射剂等
特殊制剂:靶向制剂、缓释制剂、控释制剂等
药品保护期、过渡期、监测期具体情况表(2005.10.20)
药品
法规
1985.11.1
《新药审批办法》
1999.5.1
《新药审批办法》
2002.12.1
《药品注册管理办法(试行)》
2005.5.1
《药品注册管理办法》
具体
内容
保护期:
一类:8年(含试产期2年)
二类:6年(含试产期2年)
三类:4年
四类:3年
3.1(>2年)、3.2、3.3、4、5(特殊制剂*):3年
1.6、3.4、5(普通制剂*)、化学原料药:不设
备注
2002.9.15以前,
1.已获新药保护:保护期不变
2.仅批临床的新药:按99年法规执行,批生产后,按99年法规设立过渡期
一类:5年过渡期
二类:4年过渡期
三、四、五类:3年过渡期
3.受理但未审批新药:按2001版《药品管理法》审批。未在境内上市药品按新药审批,对批准生产的新药设立
新药保护期

新药保护期、过渡期、监测期…一次说清楚1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。
这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。
为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。
在如今看,这种光限制自家人的规定,实属汉奸条款。
但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。
还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。
另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。
无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。
2.行政保护期,这是对我国早期专利法的妥协。
中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。
国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有

国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(1)【法规类别】药品管理【发文字号】国食药监注[2003]278号【发布部门】国家食品药品监督管理局(原国家药品监督管理局)(已撤销)【发布日期】2003.10.10【实施日期】2003.10.10【时效性】现行有效【效力级别】部门规范性文件国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(国食药监注[2003]278号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),解放军总后卫生部:根据国家药品监督管理局《关于<中华人民共和国药品管理法实施条例>实施前已批准生产和临床研究的新药的保护期的通知》(国药监注[2003]59号)、我局《关于发布新药监测期期限的通知》(国食药监注[2003]141号)的有关规定,现就2002年9月15日以后批准新药的保护期、过渡期或监测期事宜通知如下:一、对2002年9月15日以来批准的新药,尚未确定保护期、过渡期或监测期的,按其申报与审批情况分别予以确定,并自该新药证书或生产批准之日起生效。
具体品种见附件。
二、对处于过渡期内的新药,我局不受理其他申请人同品种的新药或已有国家标准药品申请,省、自治区、直辖市食品药品监督管理局(药品监督管理局)应当将已经收到的申请退回申请人。
三、对没有保护期、过渡期或未设监测期的新药,自其获得药品批准文号之日起,我局不再受理其他申请人同品种的新药申请,省、自治区、直辖市食品药品监督管理局(药品监督管理局)应当将已经收到的申请退回申请人。
四、过渡期内新药技术转让的申报与审批,按照原国家药品监督管理局对新药保护期的相关规定办理。
特此通知附件:2002年9月15日以来尚未确定的新药保护期、过渡期或监测期确定表国家食品药品监督管理局二00三年十月十日保护期、过渡期或监测期确定。
新药保护期、过渡期、行政保护期、专利保护期、监测期、试行期-一次说清楚

新药保护期、过渡期、行政保护期、专利保护期、监测期、试行期,一次说清楚这个问题看来一直困扰着大家,我试着回答一下,希望这个回答能从根本上讲清楚,并且终结此话题的讨论。
1分限制,纯属激励新手。
1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。
这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。
为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。
在如今看,这种光限制自家人的规定,实属汉奸条款。
但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。
还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。
另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。
2.行政保护期,这是对我国早期专利法的妥协。
中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。
新药保护期

新药保护期、过渡期、监测期…一次说清楚1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。
这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。
为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。
在如今看,这种光限制自家人的规定,实属汉奸条款。
但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。
还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。
另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。
无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。
2.行政保护期,这是对我国早期专利法的妥协。
中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。
新兽药监测期期限表

1.国内外未上市销售的原料及 1.未在国内上市销售的原药及其 1.未在国内外上市销售的兽用
其制剂。
制剂。
消毒剂。
1.1.通过合成或者半合成的方 1.1.从中药、天然药物中提取的 1.1.通过合成或者半合成的方
法制得的原料及其制剂;
有效成份及其制剂;
法制得的原料药及其制剂;
1.2.天然物质中提取或者通过 1.2.来源于植物、动物、矿物等 1.2.天然物质中提取的新的有
4.改变已在国内外上市销 售的消毒剂的剂型。
3.改变已在国内外上市销 售的消毒剂的处方的。
3.改变国内外已上市销售的 3.1.传统中兽药复方制剂; 原料及其制剂。
3.1.改变药物的酸根、碱基 3.2.现代中兽药复方制剂,
(或者金属元素);
包括以中药为主的中西兽药
复方制剂;
3.2.改变药物的成盐、成 3.3.兽用天然药物复方制
酯;
剂;
3.3.人用药物转为兽药。 3.4.由中药、天然药物制成 的注射剂。
的制品。
断制品。
3.对已在国内上市销 3 对已在国内上市销售的 售的制品使用的菌 制品使用的菌(毒、虫) (毒、虫)株、抗原 株、抗原、主要原材料或 、主要原材料或生产 生产工艺等有根本改变的 工艺等有根本改变的 制品。 制品。
3.与我国已批准上市销 售的同类诊断制品相 比,在敏感性、特异性 等方面有根本改进的诊 断制品。
发酵提取的新的有效单体及其 药用物质及其制剂;
效单体及其制剂;
制剂; 1.3.用拆分或者合成等方法制
1.3.中药材代用品。
1.3.新的复方消毒剂。
得的已知药物中的光学异构体
及其制剂;
1.4.由已上市销售的多组份 2.未在国内上市销售的部位 2.已在国外上市销售但尚
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8.改变国内已上市销售中药、天然药物剂型的制剂中采用特殊制剂技术者,如靶向制剂、缓释制剂、控释制剂。
3.已在国外上市销售但尚未在国内上市销售的药品中:
3.2已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;
3.3改变给药途径并已在国外上市销售的制剂;
2.改变给药途径且尚未在国内外上市销售的制剂。
3.已在国外上市销售但尚未在国内上市销售的药品中:
3.1已在国外上市销售的制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂;
2.单克隆抗体。
3.基因治疗、体细胞治疗及其制品。
4.变态反应原制品。
5.由人的、动物的组织或者体液提取的,或者通过发酵制备的具有生物活性的多组份制品。
11.首次采用DNA重组技术制备的制品(例如以重组技术替代合成技术、生物组织提取或者发酵技术等)。
12.国内外尚未上市销售的由非注射途径改为注射途径给药,或者由局部用药改为全身给药的制品。
2.DNA疫苗。
3.已上市销售疫苗变更新的佐剂,偶合疫苗变更新的载体。
4.由非纯化或全细胞(细菌、病毒等)疫苗改为纯化或者组份疫苗。
附件6:
新药监测期 期限表(说明:除以下情形的新药不设立监测期)(表1~3)
表1:以下情形的新药设立5年的监测期
中药、天然药物
化学药品
治疗性生物制品
预防用生物制品
1.未在国内上市销售的从植物、动物、矿物等物质中提取有效成份的制剂。
1.未在国内外上市销售的药品中:
1.1通过合成或者半合成的方法制得原料药的制剂;
4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药的制剂。
5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂中采用特殊制剂技术者,如靶向制剂、缓释制剂、控释制剂。
14.改变给药途径的生物制品(不包括12)。
9.更换其他已批准表达体系或者已批准细胞基质生产的疫苗;采用新工艺制备并且实验室研究资料证明产品安全性和有效性明显提高的疫苗。
10.改变灭活剂(方法)或者脱毒剂(方法)的疫苗。
11.改变给药途径的疫苗。
5.采用未经国内批准的菌毒种生未在国内上市销售的疫苗。
7.采用国内已上市销售的疫苗制备的结合疫苗或者联合疫苗。
8.与已上市销售疫苗保护性抗原谱不同的重组疫苗。
表3:以下情形的新药设立3年的监测期
中药、天然药物
化学药品
治疗性生物制品
预防用生物制品
6.由已上市销售生物制品组成新的复方制品。
7.已在国外上市销售但尚未在国内上市销售的生物制品。
8.含未经批准菌种制备的微生态制品。
9.与已上市销售制品结构不完全相同且国内外均未上市销售的制品(包括氨基酸位点突变、缺失,因表达系统不同而产生、消除或者改变翻译后修饰,对产物进行化学修饰等)。
10.与已上市销售制品制备方法不同的制品(例如采用不同表达体系、宿主细胞等)。
5.未在国内上市销售的从植物、动物、矿物等物质中提取有效部位的制剂。
6.未在国内上市销售的中药、天然药物复方制剂中:
6.1中药复方制剂;
6.2 天然药物复方制剂;
6.3 中药、天然药物和化学药品组成的复方制剂。
1.未在国内外上市销售的药品中:
1.4由已上市销售的多组份药物制备为较少组份的药物;
1.5新的复方制剂;
1.2天然物质中提取或者通过发酵提取的新有效单体的制剂;
1.3用拆分或者合成等方法制得的已知药物中光学异构体的制剂;
1.未在国内外上市销售的生物制品。
1.未在国内外上市销售的疫苗。
表2:以下情形的新药设立4年的监测期
中药、天然药物
化学药品
治疗性生物制品
预防用生物制品
2.新发现药材的制剂。
4.药材新药用部位的制剂。
